一株产植物激素的菌根真菌及其在促进植物生长中的应用的制作方法
本发明属于农业微生物领域,具体地涉及一株产植物激素的菌根真菌及其在促进植物生长中的应用。
背景技术:
菌根是土壤中的菌根真菌与高等植物营养根系形成的一种互惠共生联合体。在这一共生体系中,植物根系为菌根菌提供定居场所,合成光合产物,而菌根菌则能活化土壤养分,供给植物;有些菌根菌可产生植物激素,如生长素、细胞分裂素和赤霉素等促进植物生长发育;也可产生抗生素抑制植物根部致病菌的生长。总之,菌根形成对寄主植物的有益作用是多方面的。其中,菌根所具有的合成植物激素的能力在其多种有益作用中发挥主导作用,是生产实践中筛选优良菌种的一个重要指标。因此,从植物根部筛选高效合成植物激素的菌根真菌,并将其开发成“菌根制剂”,应用于培育种苗、林业育苗和荒山造林中,简单实用,绿色环保,成为当前农业微生物领域一个研究热点。
技术实现要素:
本发明要解决的技术问题在于提供一株产植物激素的菌根真菌及其在促进植物生长中的应用。本发明菌株可以有效促进蓝莓苗和杨树苗的生长。
本发明是通过如下技术方案来实现的:
一株产植物激素的菌根真菌r49,其分类命名为lophiostomasp.,所述菌根真菌r49保藏号为cgmccno.13883。
本发明还提供一种菌根真菌r49接种剂的制备方法,将所述菌根真菌r49接种到pda平板,28℃倒置培养10天;用打孔器打取菌块,接种到分装后的pda培养液中,28℃震荡培养15-20天,转速为180rpm;所述分装后的pda培养液制备:将pda培养液分装到容器中,并放入玻璃球,高压灭菌。
本发明还提供一种含有所述菌根真菌r49发酵液的苗木促生长制剂。
本发明还提供一种所述菌根真菌r49在苗木促生长制剂上的应用。
本发明与现有技术相比的有益效果:
在本发明菌株的培养液和菌丝体中均检测到玉米素、赤霉素、脱落酸和生长素,并且培养液中的含量远远高于菌丝体,说明该菌株通过分泌各种激素,促进宿主植物生长。
使用本发明菌株促生效果明显,且该菌株宿主专一性不大,可广泛应用于苗木的快繁和速生培养,简单实用,绿色环保。
附图说明
图1菌根真菌r49对蓝莓组培苗的接种效应;a对照组,b接种菌根真菌r49组;
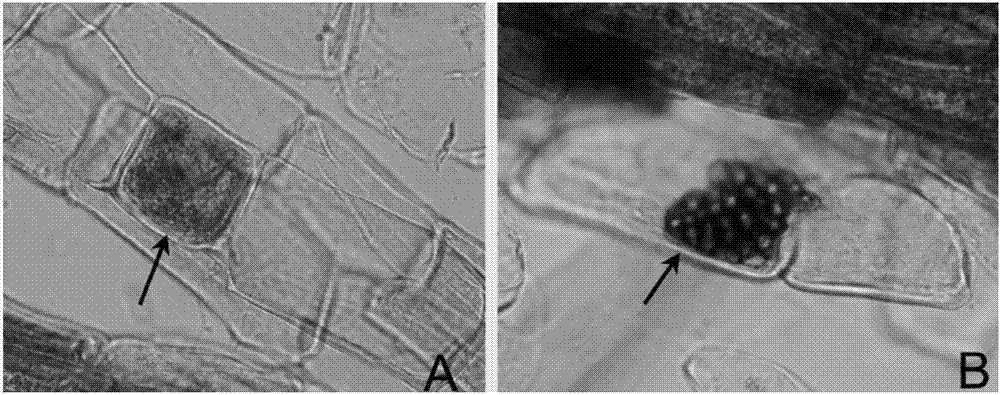
图2菌根真菌r49在蓝莓根内的定植:a,箭头所指为细胞内的r49菌丝;b,箭头所指为细胞内的r49微菌核;图3菌根真菌r49菌落的形态特征;
图4菌根真菌r49的菌丝特征;
图5接种菌根真菌r49对杨树株高的影响;
图6接种菌根真菌r49对杨树地径、叶绿素含量及干重的影响。
菌株保藏信息:菌株为r49,其分类命名为lophiostomasp.;该菌株保藏于2017年4月11日中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),保藏地址:北京市朝阳区北辰西路1号院3号保藏编号为:cgmccno.13883。
具体实施方式
下面通过实施例来对本发明的技术方案作进一步解释,但本发明的保护范围不受实施例任何形式上的限制。
实施例1
蓝莓根部内生真菌的分离、纯化,步骤如下:
1、从烟台乳山蓝莓种植园中采集带土样的栽培蓝莓根系。用清水洗净蓝莓根段,然后将其转移至超净工作台中进行如下操作:将根段浸泡在10%(质量比)双氧水中8min,期间用无菌镊子轻轻翻动几次,以保证消毒彻底;无菌水漂洗2-3次后,将其转入6%(质量比)次氯酸钠,浸泡15分钟,无菌水漂洗2次;滤纸吸干根段表面残留的液体。将消毒后的根段用无菌的剪刀剪成0.5cm长的根段,接入制备好的pda平板,于25℃恒温培养箱中黑暗倒置培养。pda平板的配方:0.6%马铃薯浸粉,2%葡萄糖,2%琼脂,ph5.6。115℃灭菌20分钟,冷却至60℃时,加入无菌的氨苄青霉素(50ug/ml)和硫酸链霉素(100ug/ml),上述各成份浓度均为pda培养基中的终浓度。
2、当发现组织切口处有真菌长出来的时候,尽快用接种针将其挑入不加青霉素和链霉素的pda平板中,25℃恒温培养箱中黑暗倒置进行纯化培养,转移3-5次后得到纯菌落。
实施例2
促生有益菌根真菌的筛选,具体步骤如下:
1、蓝莓苗的培养
(1)蓝莓芽分化
选取生长状态良好,株高4-5cm的蓝莓组培苗进行快速繁殖。在超净工作台中用无菌的剪刀将组培瓶中的蓝莓植株从基部剪断,剪成2-3cm的茎段,然后用无菌的镊子将其接到含有分化培养基的组培瓶中,每瓶中接入3-4个茎段,均匀分散放置。所用的培养基是以wpm培养基为基本培养基,在每升wpm培养基中均添加蔗糖20g、琼脂5-10g,添加的植物激素为玉米素1.0-3.0mg,培养基ph5.0-5.5,培养容器装量10-30%,121℃高压灭菌20min。培养条件设置为23-25℃,2000-3000lx的光强,光照时间8-16h/天,培养时间40-60天。
(2)蓝莓生根培养
在超净工作台中,选取高5-6cm生长状态良好的蓝莓组培苗进行生根培养。用无菌的剪刀从蓝莓组培苗的基部剪断,然后用无菌的镊子将剪断的植株插入带有滤纸球的生根培养基中,植株插的深度以植株底部刚浸入培养基为宜,每瓶液体培养基中接入6-10株蓝莓苗。所用培养基为1/2wpm培养基为基本培养基,然后加入蔗糖20g,吲哚丁酸1-2.5mg,定容到1升,调培养基的ph为5.0-5.5将配好的液体培养基倒入装有滤纸球的组培瓶中,培养容器装量10-30%(体积比),121℃高压灭菌20min。滤纸球以铺满组培瓶的底部以便于固定蓝莓幼苗。培养条件设置为23-25℃,2000-3000lx的光强,光照时间8-16h/天,培养时间40-60天。
2、接种剂的制备
选取15株上述实例1纯化的内生真菌,分别接种到pda平板,28℃倒置培养10天。每种菌打取3块直径为5mm菌块,分别接种到分装后的pda培养液中,28℃震荡培养15-20天,转速为180rpm。所述分装后的pda培养液制备:pda培养液分装到500ml三角瓶中,每瓶分装100-200ml,并放入10-20个玻璃球,121℃高压灭菌20min。
3、回接蓝莓组培苗,筛选促生菌根真菌
(1)共培养基质的准备
先将干苔藓剪短,用清水洗净,在蒸馏水中浸泡过夜,让其充分吸水,再分装到组培瓶中,容器装量为15%-25%(体积比),121℃高压灭菌30min,备用。
(2)菌株与蓝莓组培苗共培养
将生根蓝莓苗用无菌的镊子接入上述制备共培养基质中,再用移液枪分别加入4-6ml上述制备的各菌种接种剂。吸取前,需要将接种剂晃动混匀。移液枪头前端需剪掉2-3mm,并灭菌后才能使用。接种后,放至25℃,2000-3000lx的光强,光照时间8-16hr/天条件下进行共培养80天后,观察接种菌株对蓝莓苗生长的影响。每种菌设3次重复,每重复5瓶蓝莓组培苗。
结果显示,筛选到一株真菌r49。与未接种对照相比,接种该菌株的蓝莓苗明显健壮,分蘖数多,叶片大而浓绿,且根系发达。(图1)。取部分根段,检测真菌r49在蓝莓组培苗根部的定植情况。将根段放入提前配制好的faa固定液中固定12小时,冲洗后脱色。所述的脱色方法为经过10%(g/ml)koh透明、10%(质量比)h2o2漂白、1%(质量比)hcl酸化、0.05%(g/ml)台盼蓝染色和50%(体积比)甘油脱色。随机选取蓝莓根段,在显微镜下镜检观察。如图2所示,在蓝莓根的皮层细胞中可看到菌丝和微菌核,表明r49可侵入宿主植物根内。此外,取接种的蓝莓苗的根样,从中只分离得到与接种剂相同的菌株,进一步证明上述接菌的蓝莓苗所表现出的生长优势是真菌r49蓝莓根部定植引起的。
实施例3
菌株r49的形态和分子生物学鉴定,步骤如下:
1、挑取上述保存的纯化菌种,接种到pda平板中,于28℃恒温培养箱中培养活化1-2周。用直径为0.5cm的无菌打孔器从菌落的最外层打取菌饼,接种到新的pda平板上,于28℃恒温培养箱中培养1周,观察菌落的形态。图3示菌落为表面为灰白色,背面棕黄色,椭圆形,菌丝致密,中间凸起,边缘有皱褶,菌落被面的中心处有深色裂痕。
2、用接种针挑取少量纯化后的单菌落菌丝,将其放入滴有一滴生理盐水的载玻片上制成临时装片,并在显微镜下观察内生真菌的菌丝结构。图4示,菌丝曲直不一,有隔,树枝状分枝,能产生孢子。
3、对菌种进行分子生物学鉴定。采用全式金的
测序结果:
cgggaggccctgtctgaaccctatgtcattgtcgcacctcgcgtttcctcggcgggctcgcccgccaacgaggaccccataccaaacccattgcagtattgcagtacacgtcttacaaacaatcaatcaaaactttcaacaacggatctcttggttagggcatcgatgaagaacgcatcgaaatgcgataatcagtgtgaattgcagaatttagtgaatcatcgaatctttgaacgcacattgcgccctttggtatcccttagggcatgcctgttcgagcgtcatgtaaatcctcaggcaccgcttgaagttaggcgcctgttccgccgcgcgcgcggactcgcctcgaagagattggcggactgtgtgttggccacgagcgcagcagaccacgcggctcgtgccctcccgcgcaggcgctccaggaagcgacccccccaattttgacctcggatcaggtagggatacccgctgaacttaagcatatcaa。
实施例4
菌株r49发酵液中的植物激素含量测定,具体步骤如下:
1、植物激素的提取。从r49的pda平板上打取3块5mm菌块,接种到装有50mlpda培养液的250ml三角瓶中,28℃震荡培养10天,转速为180rpm,制备种子液。按10%(v/v)的比例接入装有100ml新鲜的pda培养液的500ml三角瓶中。设置6瓶重复,其中3瓶用于测定菌丝体和发酵液中的激素含量,另外3瓶菌丝体经烘干后,记录菌丝体干重。将上述培养液中的菌丝体经真空抽滤后,用无菌水冲洗3次,滤纸吸干,在小研钵中加入5ml80%(v/v)冰甲醇,研磨10min,转至100ml锥形瓶中,加入20ml80%的冰甲醇,摇匀后放置0℃40hr,期间不时摇动。过滤后,滤液减压浓缩至10ml,经0.45μm滤膜过滤,将3瓶所得的过滤清液混合,用于上机测定菌丝体中的植物激素含量。过滤所得菌丝体培养液,连同冲洗菌丝体的流出液混合,压缩到10ml,经0.45μm滤膜过滤,3瓶混合后所得清液用于上机测定发酵液中的植物激素含量。
3、植物激素的测定。采用高效液相色谱仪(hplc,agilent1200,美国产)测定样品中的吲哚乙酸(iaa)、赤霉素(ga3)、玉米素(z)和脱落酸(aba)含量。层析柱为zorbaxsb-c18,analytical4.6×150mm;流动相:20%ch3cn,20%ch3oh,60%h2o,h3po4调ph为3.0;流速:0.7ml/min;检测器:uv254nm×0.1aufg。将所得到的待测样品的分离色谱,以保留时间定性,峰高值定量,通过spss软件,结合标准曲线方程,计算出各样品中的激素含量(表1)。结果显示,菌株r49可以分泌玉米素、赤霉素、脱落酸和生长素等多种激素,尤其是玉米素和赤霉素含量显著,并且培养液中的分泌量均明显高于其在菌丝体中的含量,差异显著,说明该真菌所产生的植物激素可释放到细胞外,通过菌根共生体系,这些激素可进入植物组织中发挥作用。
表1菌株r49的菌丝体和培养液中的植物激素含量
实施例5r49对杨树苗的接种效应,具体步骤如下:
1、杨树苗的培养
在超净工作台中,用无菌剪刀从杨树组培苗上截取4-5cm的茎段,插到生根培养基中,进行生根培养。所用杨树生根培养基为ms固体培养基添加萘乙酸(naa)0.1mg/l,ph5.8-6.0,经121℃高压灭菌20min后,在超净工作台上分装到组培瓶中,装量是培养瓶的10-30%(v/v)。培养条件设置为23-26℃,2000-3000lx的光强,光照时间8-16h/天,培养时间30天。选取高度10cm,叶片数为8~10的杨树生根苗,进行驯化移栽。培养基质为蛭石与营养土,按体积比例1:1混匀,高压蒸汽灭菌锅121℃,灭菌3hr,分装到经75%酒精消毒的塑料营养钵中,营养钵直径为12cm,高为20cm。将移栽成活的杨树幼苗放置于温度18-25℃,自然光照的温室条件下生长。
2、菌株r49促进杨树苗生长
选取长势一致杨树幼苗进行接种效应分析。设定接菌实例组和对照组,每组15盆(3个重复,5盆/重复)。接菌实例组:每盆倒入10mlr49菌液,接种剂的制备同实施例2的步骤2。对照组:未加菌液。杨树苗放置在玻璃温室中培养,条件均为自然光照,环境湿度为60%-80%,常规管理。每隔20天记录两组的株高,80天后测定地上生物量干重和顶部成熟健康叶片的叶绿素含量。图5示接种40天时,与对照组相比,接菌实例组的杨树苗的株高开始表现出优势,60天和80天时,优势愈加显著。80天后接菌实例组的杨树苗株的地上部分干重、根的干重及叶片的叶绿素含量也明显高于比对照组(图6)。以上结果说明r49对宿主专一性不大,也可显著提高杨树叶片的光合能力,促进杨树苗的生长。该菌株可广泛应用于苗木的快繁和速生培养,简单实用,绿色环保。
sequencelisting
<110>鲁东大学
<120>一株产植物激素的菌根真菌及其在促进植物生长中的应用
<130>无
<160>1
<170>patentinversion3.3
<210>1
<211>490
<212>dna
<213>lophiostomasp.
<400>1
cgggaggccctgtctgaaccctatgtcattgtcgcacctcgcgtttcctcggcgggctcg60
cccgccaacgaggaccccataccaaacccattgcagtattgcagtacacgtcttacaaac120
aatcaatcaaaactttcaacaacggatctcttggttagggcatcgatgaagaacgcatcg180
aaatgcgataatcagtgtgaattgcagaatttagtgaatcatcgaatctttgaacgcaca240
ttgcgccctttggtatcccttagggcatgcctgttcgagcgtcatgtaaatcctcaggca300
ccgcttgaagttaggcgcctgttccgccgcgcgcgcggactcgcctcgaagagattggcg360
gactgtgtgttggccacgagcgcagcagaccacgcggctcgtgccctcccgcgcaggcgc420
tccaggaagcgacccccccaattttgacctcggatcaggtagggatacccgctgaactta480
agcatatcaa490
- 还没有人留言评论。精彩留言会获得点赞!