一种吡咯并吡咯二酮聚合物及其制备方法和应用与流程
本发明属于有机太阳能电池材料领域,涉及一种吡咯并吡咯二酮聚合物及其制备方法和应用。
背景技术:
有机太阳能电池因为其可以在诸多复杂环境中为人类提供清洁而且廉价的能源,实现了多功能性的使用方式和用途,一直得到了科研人员的广泛关注和深入研究。在目前的工作中,由共轭聚合物或小分子/富勒烯衍生物小分子作为给体和受体的本体异质结(bhj)的聚合物太阳能电池的能量转换效率(pce)已经达到了11%以上。然而,富勒烯衍生物有着极有挑战性的难以克服的缺点,如制备方法复杂,成本高昂,活性层的相稳定性差以及其光谱吸收较差不易产生良好的吸光互补。在富勒烯体系中,给体分子的设计原则通常用实现低homo来迎合富勒烯的能带,这使得器件的可调节性下降,局限了给体分子的选材范围。当给体的homo能级降低到与富勒烯受体相匹配时,给体的lumo能级将与富勒烯材料的lumo能级接近从而无法产生良好的激子分离,这是一个较为矛盾的现象。非富勒烯分子受体的开发向大家展示了非富勒烯体系在有机太阳能电池中的巨大的应用潜力。由共轭聚合物作为给体和itic衍生物作为受体的本体异质结(bhj)的聚合物太阳能电池的能量转换效率(pce)据报道已经达到12%以上。新的非富勒烯聚合物受体的设计合成是另一种方式来实现更高的功率转换效率(pce)的方法,其重要意义在于实现全聚合物太阳能电池,其器件的加工性能和相热稳定性应该具有较大的竞争力。
吡咯并吡咯二酮(dpp)基聚合物由于其优异的光电性能和卓越的激子迁移率,已引起人们的广泛关注,被广泛应用于有机场效应晶体管和有机太阳能电池的研究和应用中。dpp基聚合物有着较宽的吸收范围,可以实现在红外区的有效吸收,这在有机太阳能电池中具有重要意义。
因此,在本领域中,期望开发一种能够使得有机太阳能电池器件具有良好性能的吡咯并吡咯二酮聚合物电池材料。
技术实现要素:
针对现有技术的不足,本发明的目的在于提供一种吡咯并吡咯二酮聚合物及其制备方法和应用。
为达到此发明目的,本发明采用以下技术方案:
第一方面,本发明提供一种吡咯并吡咯二酮聚合物,所述吡咯并吡咯二酮聚合物具有如式i所示的结构:
其中,ar1和ar2不同,分别独立地选自
在本发明中,所述吡咯并吡咯二酮聚合物中吡咯并吡咯二酮基两侧具有噻吩和苯并噻吩基团,得到不对称的dpp共聚物,通过分子中这种不对称的共轭单元的相互配合,协同作用,可以改变吡咯并吡咯二酮聚合物的吸收带边和能级,使得具有较窄的能量带隙和更宽的吸收带边,和较高的双极性激子迁移率,从而可用于构筑良好的场效应晶体管器件和高效能量转化效率的有机太阳能电池器件。
在本发明所述的式i-iii所示的结构的聚合物中ar1和ar2不同,分别独立地选自
在本发明中,r为碳原子数为10-25的直链烷基或支链烷基,例如碳原子数为10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25的直链烷基或支链烷基,优选碳原子数为12-20的直链烷基或支链烷基。
优选地,所述吡咯并吡咯二酮聚合物为具有如式a-c所示的结构的聚合物中的任意一种或至少两种的组合:
其中,ar1和ar2不同,分别独立地选自
第二方面,本发明提供一种如上所述的吡咯并吡咯二酮聚合物的制备方法,所述制备方法包括以下步骤:
(1)5-氧-2-(噻吩)-4,5-二羟基-1h-吡咯-3-羧酸甲酯与6-溴代苯并-2-噻吩-2-腈反应得到3-(6-溴代苯并-2-噻吩)-6-(噻吩)吡咯[3,4-c]并吡咯-1,4(2h,5h)-二酮,反应式如下:
(2)步骤(1)得到的3-(6-溴代苯并-2-噻吩)-6-(噻吩)吡咯[3,4-c]并吡咯-1,4(2h,5h)-二酮与卤代烷烃r-x进行反应,得到式ii所示化合物,反应式如下:
(3)步骤(2)得到的式ii所示化合物与溴化试剂进行反应,得到式iii所示化合物,反应式如下:
(4)步骤(3)制备得到的式iii所示化合物与式iv所示的双(三甲基)锡化合物发生聚合反应,得到式i所示的吡咯并吡咯二酮聚合物,反应式如下:
其中,ar1和ar2不同,分别独立地选自
优选地,步骤(1)所述5-氧-2-(噻吩)-4,5-二羟基-1h-吡咯-3-羧酸甲酯与6-溴代苯并-2-噻吩-2-腈反应得到3-(6-溴代苯并-2-噻吩)-6-(噻吩)吡咯[3,4-c]并吡咯-1,4(2h,5h)-二酮的摩尔比为1:(1-1.5),例如1:1、1:1.1、1:1.2、1:1.3、1:1.4或1:1.5。
优选地,步骤(1)所述反应在金属钠存在下进行。
优选地,所述金属钠与5-氧-2-(噻吩)-4,5-二羟基-1h-吡咯-3-羧酸甲酯的摩尔比为(2-4):1,例如2:1、2.3:1、2.5:1、2.8:1、3:1、3.2:1、3.5:1、3.8:1或4:1。
优选地,步骤(1)所述反应在催化剂存在下进行。
优选地,所述催化剂为氯化亚铁。
优选地,所述催化剂为5-氧-2-(噻吩)-4,5-二羟基-1h-吡咯-3-羧酸甲酯质量的0.1-0.5%,例如0.1%、0.15%、0.2%、0.25%、0.3%、0.35%、0.4%、0.45%或0.5%。
优选地,步骤(1)所述反应的温度为80-150℃,例如80℃、85℃、90℃、95℃、100℃、110℃、120℃、130℃、140℃或150℃,优选100-120℃。
优选地,步骤(1)所述反应的时间为1-8小时,例如1小时、1.5小时、2小时、3小时、4小时、5小时、6小时、7小时或8小时。
优选地,步骤(1)所述反应在醇类溶剂中进行,所述醇类溶剂优选2-甲基-2-丁醇。
优选地,步骤(2)所述3-(6-溴代苯并-2-噻吩)-6-(噻吩)吡咯[3,4-c]并吡咯-1,4(2h,5h)-二酮与卤代烷烃r-x的摩尔比为1:(2-6),例如1:2、1:2.3、1:2.5、1:2.8、1:3、1:3.3、1:3.5、1:3.8、1:4、1:4.3、1:4.5、1:4.8、1:5、1:5.2、1:5.5、1:5.8或1:6,优选1:4。
优选地,所述卤代烷烃r-x为2-溴代辛基十二烷。
优选地,步骤(2)所述反应的温度为100-150℃,例如100℃、110℃、120℃、130℃、140℃或150℃。.
优选地,步骤(2)所述反应的时间为5-24小时,例如5小时、7小时、9小时、10小时、12小时、14小时、16小时、18小时、20小时、22小时或24小时。
优选地,步骤(3)所述式ii所示化合物与溴化试剂的摩尔比为1:(2-2.5),例如1:2、1:2.1、1:2.2、1:2.3、1:2.4或1:2.5。
优选地,所述溴化试剂为n-溴代琥珀酰亚胺。
优选地,步骤(3)所述反应的温度为0-60℃,例如10℃、13℃、15℃、18℃、20℃、22℃、25℃、28℃、30℃、33℃或35℃。
优选地,步骤(3)所述反应的时间为5-24小时,例如5小时、7小时、9小时、10小时、12小时、14小时、16小时、18小时、20小时、22小时或24小时。
优选地,步骤(4)所述式iii所示化合物与式iv所示的双(三甲基)锡化合物的摩尔比为1:(1-1.5),例如1:1、1:1.1、1:1.2、1:1.3、1:1.4或1:1.5。
优选地,步骤(4)所述聚合反应在靶类催化剂存在下进行。
优选地,所述靶类催化剂为三(二亚苄基丙酮)二钯和三(邻甲基苯基)磷的组合。
优选地,所述三(二亚苄基丙酮)二钯和三(邻甲基苯基)磷的摩尔比为1:(3-6),例如1:3、1:3.3、1:3.5、1:3.8、1:4、1:4.3、1:4.5、1:4.8、1:5、1:5.2、1:5.5、1:5.8或1:6,优选1:4。
优选地,步骤(4)在保护性气体保护下进行,所述保护性气体优选氮气或氩气。
优选地,步骤(4)所述聚合反应的溶剂为甲苯和n,n-二甲基甲酰胺的混合物。
优选地,所述甲苯和n,n-二甲基甲酰胺的混合物中甲苯与n,n-二甲基甲酰胺的体积比为(8-15):1,例如8:1、8.5:1、9:1、9.5:1、10:1、10.5:1、11:1、12:1、13:1、14:1或15:1。
优选地,步骤(4)所述聚合反应的温度为80-150℃,例如80℃、85℃、90℃、95℃、100℃、110℃、120℃、130℃、140℃或150℃,优选100-120℃。
优选地,步骤(4)所述聚合反应的时间为1-5小时,例如1小时、1.5小时、2小时、2.5小时、3小时、3.5小时、4小时、4.5小时或5小时。
第三方面,本发明提供一种半导体共混物,所述半导体共混物包括给体材料和受体材料,所述给体材料为如上所述的吡咯并吡咯二酮聚合物。
优选地,所述受体材料为富勒烯衍生物,优选[6,6]-苯基c61丁酸甲酯(pc61bm)、[6,6]-苯基c71丁酸甲酯(pc71bm)或1',1”,4',4”-四氢二[1,4]甲桥萘并[1,2:2',3';56,60:2”,3”][5,6]富勒烯-c60-ih,进一步优选[6,6]-苯基c71丁酸甲酯(pc71bm)。
优选地,所述半导体共混物中给体材料与受体材料的质量比为1:(1-3),例如1:1、1:1.5、1:2、1:2.5或1:3,优选1:2。
第四方面,本发明提供一种半导体共混物,所述半导体共混物包括给体材料和受体材料,所述受体材料为如上所述的吡咯并吡咯二酮聚合物。
优选地,所述给体材料为聚噻吩类聚合物及其衍生物,优选聚3-己基噻酚(p3ht)。
优选地,所述半导体共混物中给体材料与受体材料的质量比为1:(1-3),例如1:1、1:1.5、1:2、1:2.5或1:3,优选1:2。
另一方面,本发明提供一种有机太阳能电池器件,所述有机太阳能电池器件包括活性材料层,所述活性材料层包括如上第三方面或第四方面所述的半导体共混物。
在本发明中,所述的吡咯并吡咯二酮聚合物既可以作为给体材料又可以作为受体材料应用于有机太阳能电池器件,因此,本发明所述的吡咯并吡咯二酮聚合物具有双极性半导体材料。
相对于现有技术,本发明具有以下有益效果:
(1)本发明的吡咯并吡咯二酮聚合物中吡咯并吡咯二酮基两侧具有噻吩和苯并噻吩基团,通过分子中这种不对称的共轭单元的相互配合,协同作用,可以改变吡咯并吡咯二酮聚合物的吸收带边和能级,使得具有较窄的能量带隙和更宽的吸收带边,和较高的双极性激子迁移率,使得其空穴迁移率在1.20cm2·v-1·s-1以上,电子迁移率为0.14-0.40cm2·v-1·s-1。
(2)将本发明的吡咯并吡咯二酮聚合物用于有机太阳能电池中,将其作为给体材料时,太阳能电池能量转化效率在5.59%以上,将其作为受体材料时,太阳能电池能量效率为0.28-0.44%,因此,吡咯并吡咯二酮聚合物可作为双极性半导体材料,其在效应晶体管器件和有机太阳能电池器件都有着相当的研究价值和应用前景。
附图说明
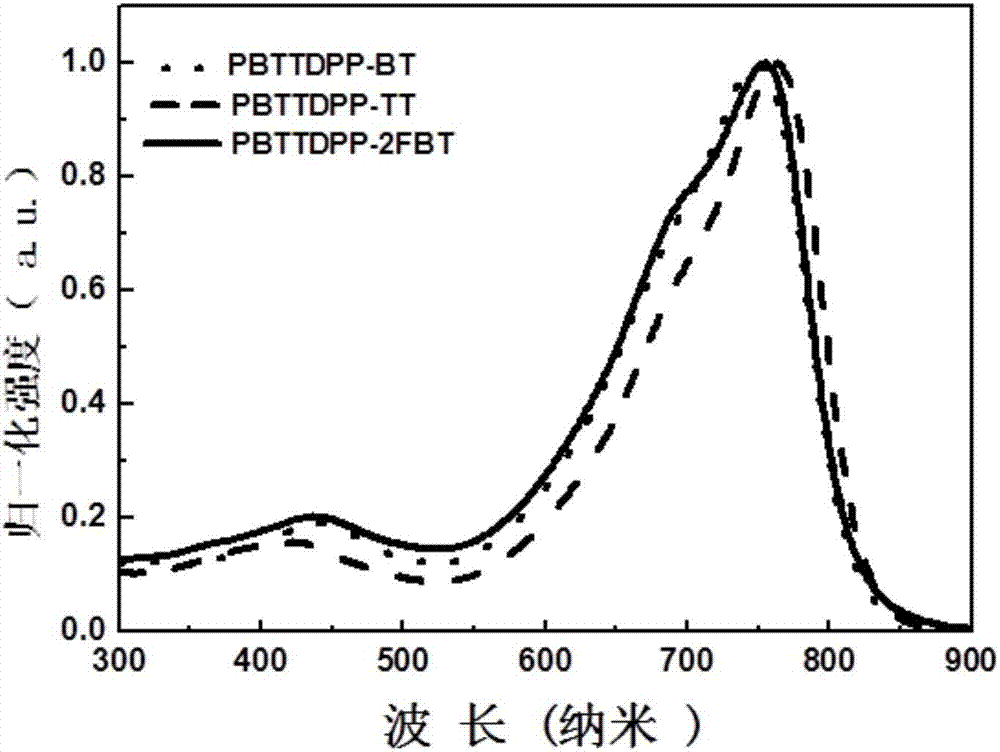
图1为实施例1-3制备得到的吡咯并吡咯二酮聚合物pbttdpp-bt,pbttdpp-tt和pbttdpp-2fbt薄膜紫外可见吸收光谱图;
图2为实施例1-3制备得到的吡咯并吡咯二酮聚合物pbttdpp-bt,pbttdpp-tt和pbttdpp-2fbt的溶液紫外可见吸收光谱图;
图3为实施例1-3制备得到的吡咯并吡咯二酮聚合物pbttdpp-bt,pbttdpp-tt和pbttdpp-2fbt的作为给体材料应用于电池器件时的电流密度-电压曲线图;
图4为实施例1-3制备得到的吡咯并吡咯二酮聚合物pbttdpp-bt,pbttdpp-tt和pbttdpp-2fbt作为给体材料应用于电池器件时的外量子效率曲线图;
图5为实施例1-3制备得到的吡咯并吡咯二酮聚合物pbttdpp-bt,pbttdpp-tt和pbttdpp-2fbt作为给体材料时制备得到的电池器件活性层的原子力显微镜高度图;其中从左至右(a)图为pbttdpp-bt作为给体材料时的电池器件活性层的原子力显微镜高度图,(b)图为pbttdpp-tt作为给体材料时的电池器件活性层的原子力显微镜高度图,(c)图为pbttdpp-2fbt作为给体材料时的电池器件活性层的原子力显微镜高度图;(a)、(b)和(c)图的标尺均为500nm;
图6为实施例1-3制备得到的吡咯并吡咯二酮聚合物pbttdpp-bt,pbttdpp-tt和pbttdpp-2fbt作为给体材料时制备得到的电池器件活性层的透射电子显微镜图;其中从左至右(d)图为pbttdpp-bt作为给体材料时的电池器件活性层的透射电子显微镜图,(e)图为pbttdpp-tt作为给体材料时的电池器件活性层的透射电子显微镜图,(f)图为pbttdpp-2fbt作为给体材料时的电池器件活性层的透射电子显微镜图;(d)、(e)和(f)图的标尺均为0.2μm;
图7为实施例1-3制备得到的吡咯并吡咯二酮聚合物pbttdpp-bt,pbttdpp-tt和pbttdpp-2fbt作为受体材料时制备得到的电池器件活性层的原子力显微镜高度图;其中从左至右(a)图为pbttdpp-bt作为受体材料时的电池器件活性层的原子力显微镜高度图,(b)图为pbttdpp-tt作为受体材料时的电池器件活性层的原子力显微镜高度图,(c)图为pbttdpp-2fbt作为受体材料时的电池器件活性层的原子力显微镜高度图;(a)、(b)和(c)图的标尺均为500nm;
图8为实施例1-3制备得到的吡咯并吡咯二酮聚合物pbttdpp-bt,pbttdpp-tt和pbttdpp-2fbt作为受体材料时制备得到的电池器件活性层的透射电子显微镜图;其中从左至右(d)图为pbttdpp-bt作为受体材料时的电池器件活性层的透射电子显微镜图,(e)图为pbttdpp-tt作为受体材料时的电池器件活性层的透射电子显微镜图,(f)图为pbttdpp-2fbt作为受体材料时的电池器件活性层的透射电子显微镜图;(d)、(e)和(f)图的标尺均为0.2μm。
具体实施方式
下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
实施例1
在本实施例中,通过以下制备方法制备式a所示的吡咯并吡咯二酮聚合物:
反应流程如下:
其中,ar1和ar2不同,分别独立地选自
制备方法包括以下步骤:
(1)3-(6-溴代苯并-2-噻吩)-6-(噻吩)吡咯[3,4-c]并吡咯-1,4(2h,5h)-二酮的制备:
钠(0.68g,29.6mmol)添加到溶有氯化亚铁(3mg)的2-甲基-2-丁醇(30ml)溶液中,搅拌加热回流至钠完全消耗。将溶液冷却至80℃后逐滴加入6-溴代苯并-2-噻吩-2-腈(2.4g,10.1mmol)。加入5-氧-2-(噻吩)-4,5-二羟基-1h-吡咯-3-羧酸甲酯(1.88g,8.4mmol),得到的混合物在120℃搅拌2小时。通过加入溶有冰醋酸(5毫升)的甲醇(20毫升)溶液和的混合物在90℃搅拌10分钟。过滤沉淀,用水和甲醇洗涤,真空干燥。产物为3-(6-溴代苯并-2-噻吩)-6-(噻吩)吡咯[3,4-c]并吡咯-1,4(2h,5h)-二酮,产率为46%,可直接使用无需纯化。
(2)3-(6-溴代苯并-2-噻吩),5-偏(2-辛基十二烷醇)-6-(噻吩)吡咯[3,4-c]并吡咯-1,4(2h,5h)-二酮的制备:
向溶有3-(6-溴代苯并-2-噻吩)-6-(噻吩)吡咯[3,4-c]并吡咯-1,4(2h,5h)-二酮(2.6g,6.1mmol)和18-冠醚-6(5mg)的dmf(50ml)溶液中加入k2co3(8.8g,24.4mmol)加入到120℃反应1小时,然后逐滴加入2-溴代辛基十二烷(3.4g,24.4mmol)。混合均匀后在120℃反应12个小时,将反应后的混合物倒入水中用氯仿萃取。合并有机层,用水洗,na2so4干燥和真空浓缩。用硅胶柱层析,用石油醚和二氯甲烷作为洗脱剂,用硅胶柱层析法对残渣进行纯化。最终产物经乙醇重结晶。产率为21%,紫色固体。tlc(pe:dcm,4:1v/v):rf=0.20。
产物结构表征数据如下:
1hnmr(300mhz,cdcl3):δ9.01(s,1h),8.96(dd,j=1.0,3.9hz,1h),8.01-7.99(m,1h),7.81(d,j=8.6hz,1h),7.66(dd,j=1.0,5.0hz,1h),7.53(dd,j=1.7,8.6hz,1h),7.29(dd,j=4.0,5.0hz,1h),4.04(dd,j=3.9,7.6hz,4h),1.91,(brs,2h),1.44-1.08(m,64h),0.94-0.78(m,12h);13cnmr(75mhz,cdcl3):δ161.81,161.51,142.41,141.53,139.62,137.61,135.93,131.19,131.14,129.71,129.65,128.81,128.52,126.21,124.50,120.70,109.74,108.01,46.33,37.92,37.72,31.90,31.86,31.20,31.12,29.98,29.62,29.55,29.49,29.34,29.28,26.21,26.15,22.66,14.10;hrms(maldi-tof-ms)c58h89brn2o2s2na+([m+na]+)计算值:1011.5441,测定值1011.5448。
(3)3-(6-溴代苯并-2-噻吩)-6-(5-溴代-2-噻吩)-2,5-偏(2-辛基十二烷醇)吡咯[3,4-c]并吡咯-1,4(2h,5h)-二酮的制备:
3-(6-溴代苯并-2-噻吩)-6-(5-溴代-2-噻吩)-2,5-偏(2-辛基十二烷醇)吡咯[3,4-c]并吡咯-1,4(2h,5h)-二酮(0.99g,1.0mmol)溶于15ml氯仿。溶液通5min氩气除净氧气后加入n-溴代琥珀酰亚胺(0.392g,2.2mmol)。室温搅拌过夜,混合物倒入100毫升甲醇和过滤。随后的残留物从乙醇重结晶。产率为80%,黑色固体;tlc(pe:dcm,5:1v/v):rf=0.30。
产物的结构表征数据如下:
1hnmr(300mhz,cdcl3):δ9.02(s,1h),8.70(dd,j=1.0,4.2hz,1h),8.01(s,1h),7.81(d,j=8.6hz,1h),7.53(dd,j=1.6,8.6hz,1h),7.23(d,j=4.2hz,1h),4.04(d,j=7.7hz,2h),3.95(d,j=7.7hz,2h),1.89,(brs,2h),1.42-1.07(m,64h),0.93-0.76(m,12h);13cnmr(75mhz,cdcl3):δ161.48,161.35,142.47,140.05,139.98,137.53,135.74,131.45,131.04,129.58,128.85,126.22,124.48,120.56,119.41,109.53,108.16,46.36,37.90,37.73,31.90,31.87,31.20,31.11,29.98,29.63,29.55,29.49,29.35,29.28,26.20,26.14,22.66,14.10;hrms(maldi-tof-ms)c58h88br2n2o2ss2+([m]+)计算值:1066.4648,测定值1066.4644。
(4)式a所示的吡咯并吡咯二酮聚合物(pbttdpp-bt)的制备:
在氩气气氛中,在schlenk管将3-(6-溴代苯并-2-噻吩)-6-(5-溴代-2-噻吩)-2,5-偏(2-辛基十二烷醇)吡咯[3,4-c]并吡咯-1,4(2h,5h)-二酮(0.10mmol,107mg),5,5'-双(三甲基甲锡烷基)-2,2'-联噻吩(0.10mmol,49.2mg),pd2(dba)3(1.4mg,0.0015mmol,1.5mol%)和(o-tol)3p(1.8mg,0.006mmol,6mol%)混合溶解在甲苯溶液(5ml)、dmf(0.5ml)。反应控制在110℃,维持2h,然后添加2-溴噻吩(0.5ml)与三甲基甲锡烷基进行端基反应。混合物在100℃下进一步搅拌1h。冷却到室温后,将混合物转移到冷冻甲醇(20毫升)沉淀。初步得到的聚合物产物通过过滤收集并用丙酮,正己烷索氏提取净化,剩余产品与邻二氯苯溶解回流。在邻二氯苯溶液通过蒸发浓缩和转移到甲醇中沉淀,并真空干燥。最后,得到所需的聚合物产率为96%;gpc(1,2-二氯苯,120℃):mn=66.2kda,mw=153.2kda,pdi=2.31。
实施例2
在本实施例中,通过以下制备方法制备式b所示的吡咯并吡咯二酮聚合物:
经过与实施例1相同的步骤(1)-(3)制备得到3-(6-溴代苯并-2-噻吩)-6-(5-溴代-2-噻吩)-2,5-偏(2-辛基十二烷醇)吡咯[3,4-c]并吡咯-1,4(2h,5h)-二酮。
而后经过如下步骤(4)制备式b所示的吡咯并吡咯二酮聚合物(pbttdpp-tt),制备流程如下:
在氩气气氛中,在schlenk管将3-(6-溴代苯并-2-噻吩)-6-(5-溴代-2-噻吩)-2,5-偏(2-辛基十二烷醇)吡咯[3,4-c]并吡咯-1,4(2h,5h)-二酮(0.10mmol,107mg),2,5-双(三甲基甲锡烷基)噻吩[3,2-b]并噻吩(0.10mmol,46.6mg),pd2(dba)3(1.4mg,0.0015mmol,1.5mol%)和(o-tol)3p(1.8mg,0.006mmol,6mol%)的混合物溶解于schlenk管中,甲苯(5ml)和dmf(0.5ml)的混合溶剂里。反应在110℃搅拌两小时,随后加入2-bromothiophene(0.5ml)与三甲基甲锡烷基端基反应。混合物在100℃反应1小时。随后冷却到室温,混合物加入到到冷冻甲醇(20毫升)生成沉淀。初步得到的聚合物通过过滤收集并用丙酮索氏提取净化,正己烷和剩余产品与回流邻二氯苯溶解。在邻二氯苯溶液通过蒸发浓缩和沉淀转化为甲醇,在真空干燥。最后,得到所需的聚合物。产率96%。
实施例3
在本实施例中,通过以下制备方法制备式c所示的吡咯并吡咯二酮聚合物:
经过与实施例1相同的步骤(1)-(3)制备得到3-(6-溴代苯并-2-噻吩)-6-(5-溴代-2-噻吩)-2,5-偏(2-辛基十二烷醇)吡咯[3,4-c]并吡咯-1,4(2h,5h)-二酮。
而后经过如下步骤(4)制备式c所示的吡咯并吡咯二酮聚合物(pbttdpp-2fbt),制备流程如下:
在氩气气氛中,在schlenk管将3-(6-溴代苯并-2-噻吩)-6-(5-溴代-2-噻吩)-2,5-偏(2-辛基十二烷醇)吡咯[3,4-c]并吡咯-1,4(2h,5h)-二酮(0.10mmol,107mg),(3,3'-二氟-2,2'--5,5'-联噻吩)双(三甲基甲锡烷)(0.10mmol,52.8mg),pd2(dba)3(1.4mg,0.0015mmol,1.5mol%)和(o-tol)3p(1.8mg,0.006mmol,6mol%)的混合物溶解于schlenk管中,甲苯(5ml)和dmf(0.5ml)的混合溶剂里。反应在110℃搅拌两小时,随后加入2-bromothiophene(0.5ml)与三甲基甲锡烷基端基反应。混合物在100℃反应1小时。随后冷却到室温,混合物加入到到冷冻甲醇(20毫升)生成沉淀。初步得到的聚合物通过过滤收集并用丙酮索氏提取净化,正己烷和剩余产品与回流邻二氯苯溶解。在邻二氯苯溶液通过蒸发浓缩和沉淀转化为甲醇,在真空干燥。最后,得到所需的聚合物。产率96%,gpc(1,2-二氯苯,120℃):mn=66.2kda,mw=153.2kda,pdi=2.31;anal.c60h88n2o2s3se计算值:c,68.99;h,8.49;n,2.68,测定值:c,68.31;h,8.31;n,2.78。
产率94%,gpc(1,2-二氯苯,120℃):mn=74.7kda,mw=174.1kda,pdi=2.33;anal.c60h88n2o2s3se计算值:c,68.99;h,8.49;n,2.68,测定值:c,68.31;h,8.31;n,2.78。
实施例4
将实施例1-3制备得到的吡咯并吡咯二酮聚合物pbttdpp-bt,pbttdpp-tt和pbttdpp-2fbt分别制备成薄膜和溶液,进行薄膜紫外可见吸收光谱和溶液紫外可见吸收光谱的表征;
如图1所示,为实施例1-3制备得到的吡咯并吡咯二酮聚合物pbttdpp-bt,pbttdpp-tt和pbttdpp-2fbt薄膜紫外可见吸收光谱图,图2为实施例1-3制备得到的吡咯并吡咯二酮聚合物pbttdpp-bt,pbttdpp-tt和pbttdpp-2fbt的溶液紫外可见吸收光谱图;由图1和图2可以看出,pbttdpp-bt、pbttdpp-tt和pbttdpp-2fbt具有由于类似的分子骨架,所以其吸收带边类似,在pbttdpp-tt和pbttdpp-2fbt中,因为其共轭性的增强,所以比较pbttdpp-bt的光谱其最大吸收峰有了轻微的红移。在pbttdpp-bt、pbttdpp-tt和pbttdpp-2fbt的薄膜中,存在稍宽的吸收峰,其最大吸收峰(λ最大)相比它们的溶液光谱的蓝移约10nm,这说明在其溶液中存在着较为严重的分子聚集。此外,相比于ppytdpp-bt的(500-811nm)光谱,pbttdpp-bt、pbttdpp-tt和pbttdpp-2fbt有较宽的吸收带(500-850nm),这可能是源于其共轭面的增大。从pbttdpp-bt、pbttdpp-tt和pbttdpp-2fbt的吸收带边计算的光学带隙,其光学带隙分别为1.49ev,1.46ev和1.46ev,这比两侧端基的噻吩吡啶dpp的聚合物大约要低0.1ev。
实施例5
对实施例1-3制备得到的吡咯并吡咯二酮聚合物pbttdpp-bt、pbttdpp-tt和pbttdpp-2fbt用作电池材料给体材料和受体材料时得到的电池器件的性能进行测定;
从pbttdpp-bt、pbttdpp-tt和pbttdpp-2fbt的lumo、homo能级判断,作为双极性共聚物具有较高的电子和空穴的电荷迁移率,使它们在有机太阳能电池中具有作为受体和给体的潜力。pbttdpp-bt、pbttdpp-tt和pbttdpp-2fbt的作为给体的电池器件结构被设计为ito/zno/pbttdpp-bt:pc71bm/moox/ag(pbttdpp-bt作为给体材料),ito/zno/pbttdpp-tt:pc71bm/moox/ag(pbttdpp-tt作为给体材料)和ito/zno/pbttdpp-2fbt:pc71bm/moox/ag(pbttdpp-2fbt作为给体材料)。pbttdpp-tt和pbttdpp-2fbt的作为受体的电池器件结构被设计为ito/pedot:pss/pbttdpp-tt:p3ht/ca/al(pbttdpp-bt作为受体材料)和ito/pedot:pss/pbttdpp-2fbt:p3ht/ca/al(pbttdpp-2fbt作为受体材料)。在am1.5g,100mw/cm2的模拟太阳光(newportoriel)下测试有机太阳能电池的光伏性能(即电流密度-电压曲线j-v)。
pbttdpp-bt、pbttdpp-tt和pbttdpp-2fbt用作电池材料给体材料的电流密度-电压曲线如图3所示,外量子效率曲线图如图4所示,由图3和图4可以看出,pbttdpp-bt:pc71bm,pbttdpp-tt:pc71bm和pbttdpp-2fbt:pc71bm的混合膜中给受体的质量比为1:2时,器件性能表现出最佳的能量转化效率。pbttdpp-bt:pc71bm的薄膜太阳能电池中能量转化效率为5.59%,voc为0.661v,jsc为13.47macm-2,ff为62.8%;pbttdpp-tt:pc71bm的薄膜太阳能电池中能量转化效率为6.96%,voc为0.694v,jsc为16.20macm-2,ff为61.9%,pbttdpp-tt:p3ht的薄膜太阳能电池中能量转化效率为0.28%;pbttdpp-2fbt:pc71bm的薄膜太阳能电池中能量转化效率为5.62%,voc为0.794v,jsc为10.38macm-2,ff为68.2%。
pbttdpp-bt、pbttdpp-tt和pbttdpp-2fbt用作受体材料时,pbttdpp-tt:p3ht和pbttdpp-2fbt:p3ht的混合膜中受给体的质量比为1:2时,器件性能表现出最佳的能量转化效率。pbttdpp-2fbt:p3ht的薄膜太阳能电池中能量转化效率为0.44%。这种可以体现出给受体双重性质的聚合物可能主要源于其lumo/homo在不同体系中可以较好地匹配形成有效的激子传输。pbttdpp-tt/p3ht和pbttdpp-2fbt/p3ht作为活性层的全聚合物太阳能电池中,其相分离尺度难以调节;并且为了使p3ht达到良好的结晶状态需在150℃退火30min,这可能不利于pbttdpp-tt/p3ht和pbttdpp-2fbt/p3ht共混层中给受体两者形成较好地激子传输。
实施例6
在本实施例中,对实施例1-3制备得到的吡咯并吡咯二酮聚合物pbttdpp-bt、pbttdpp-tt和pbttdpp-2fbt作为给体材料和受体材料的电池器件的活性层进行原子力显微镜高度和透射电子显微镜表征。
为了比较pbttdpp-bt、pbttdpp-tt和pbttdpp-2fbt与pc71bm共混活性层的形貌差异,采用原子力显微镜(afm)和透射电子显微镜(tem)等表征手段。
从图5的原子力显微镜图中(a)、(b)和(c)图可以看出,基于pbttdpp-tt的共混膜中微观形貌图像分析可得其表面平均粗糙度约在1.37nm左右,对比pbttdpp-bt和pbttdpp-2fbt的共混膜,两者的膜中有着较为明显的大小约为几百纳米的纳米粒子结构,两者表面平均粗糙度分别约在2.23nm和2.32nm。从透射电子显微镜图像即图6中(d)、(e)和(f)图可知,在pbttdpp-tt的共混膜中,两组分之间并没有形成纳米纤维结构,然而在pbttdpp-bt和pbttdpp-2fbt的共混膜中存在着较为明显的纳米纤维结构。这种差异可以解释在pbttdpp-tt的器件中,因为其良好的相分离从而形成了较大的给受体界面用于激子分离,这也是其短路电流值最高的原因。
为了比较pbttdpp-bt、pbttdpp-tt和pbttdpp-2fbt与p3ht共混活性层的形貌差异,也采用了原子力显微镜(afm)和透射电子显微镜(tem)表征手段。
从图7的原子力显微镜图中(a)、(b)和(c)与图8透射电子显微镜(tem)中(d)、(e)和(f)图相比可以看出,pbttdpp-bt、pbttdpp-tt和pbttdpp-2fbt与p3ht共混活性层的表面粗糙度要远大于pbttdpp-bt,pbttdpp-tt和pbttdpp-2fbt与pc71bm共混活性层的粗糙度,这说明了全聚合物太阳能电池的能量转化效率低主要可能因为其相行为不匹配导致的。通过透射电子显微镜(tem)可以发现,其相分离尺度与理想的10nm左右的相分离尺度相差甚远,这种结果不利于形成有效的激子分离和有效的激子迁移效果,这导致了jsc和ff数值较低,也说明只要再进一步优化全聚合物太阳能电池中的相分离情况,实现更好的激子分离和传输效率从能提高器件的能量转化效率。
申请人声明,本发明通过上述实施例来说明本发明的吡咯并吡咯二酮聚合物及其制备方法和应用,但本发明并不局限于上述实施例,即不意味着本发明必须依赖上述实施例才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明所选用原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
- 还没有人留言评论。精彩留言会获得点赞!