芴系化合物、含有该芴系化合物的光聚合引发剂、以及含有该光聚合引发剂的光敏性组合物的制作方法
本申请是2013年9月20日提出的申请号为201380050762.6的同名专利申请的分案申请。
本发明涉及芴系化合物、含有该芴系化合物的光聚合引发剂、以及含有该光聚合引发剂的光敏性组合物。
背景技术:
一般而言,含有具有乙烯性不饱和键的化合物和光聚合引发剂的光敏性组合物可以通过照射活性能量射线而固化。因此,光敏性组合物可用于光固化性粘接剂、光固化性油墨、光敏性印刷版、各种光致抗蚀剂等多种用途。
作为光聚合引发剂,例如已知含有咔唑骨架的肟酯化合物(例如专利文献1~3)。由于这些化合物对活性能量射线具有优异的灵敏度,故而适合使用。然而,期待开发出一种与这些化合物相比,对活性能量射线的灵敏度更优异的光聚合引发剂。并且,这些化合物在溶解性方面也有改善的余地。进而,由于光聚合引发剂被应用于各种用途,故而期待其除了具有对活性能量射线的高灵敏度之外,对于各用途所要求的特性也具有优异的性能。
此外,专利文献4和5中公开了具有芴骨架的肟酯化合物。然而,并未公开该化合物的合成方法等的具体情况,也尚不清楚该化合物是否可用作光聚合引发剂。
现有技术文献
专利文献
专利文献1:日本特开2006-36750号公报
专利文献2:国际公开第2002/100903号小册子
专利文献3:国际公开第2011/152066号小册子
专利文献4:日本特开2008-100955号公报
专利文献5:日本特开2010-15025号公报
技术实现要素:
发明要解决的问题
本发明的目的在于解决上述现有化合物所存在的问题,提供一种新的具有芴骨架的化合物、含有该化合物的光聚合引发剂以及含有该光聚合引发剂的对活性能量射线的灵敏度优异的光敏性组合物。
解决问题的技术手段
本发明的发明人进行了深入研究,结果发现,通过使用新的具有2位和7位被取代的芴骨架的化合物,能够实现上述目的,从而完成了本发明。
本发明的芴系化合物由通式(1)表示,
通式(1)中,在m为0且n为0的情况下,r1表示氢原子、卤原子、硝基、被可以取代有卤原子的碳原子数1~8的烷基所取代的磺酰氧基、可以被取代的苯基磺酰氧基、被可以取代有卤原子的碳原子数1~8的烷基所取代的磺酰基、可以被取代的苯基磺酰基、可以被取代的杂环式磺酰基或者可以被取代的稠环式磺酰基,
在m为0且n为1的情况下,r1表示可以被取代的苯基、可以被取代的杂环基、或者可以被取代的稠环基,
在m为1且n为1的情况下,r1表示被可以取代有卤原子的碳原子数1~8的烷基所取代的磺酰氧基、或者可以被取代的苯基磺酰氧基;
r2和r3分别独立,表示氢原子、碳原子数1~22的直链状、支链状或环状的烷基、碳原子数1~10的直链状或支链状的卤代烷基、被1个以上的醚键或硫醚键中断的碳原子数2~15的直链状或支链状的烷基、可以被取代的苯基、或者碳原子数7~11的苯基烷基,r2和r3也可以一起形成环;
r4是式(2)或式(3)所示的基团,
式(2)和(3)中,r5和r5'表示碳原子数1~17的直链状、支链状或环状的烷基、碳原子数2~5的直链状或支链状的卤代烷基、被1个以上的醚键或硫醚键中断的碳原子数2~7的直链状或支链状的烷基、可以被取代的苯基、可以被取代的碳原子数7~11的苯基烷基、可以被取代的碳原子数7~10的苯氧基烷基、可以被取代的杂环基、或者可以被取代的稠环基;
式(2)中,r6表示碳原子数1~17的直链状、支链状或环状的烷基、碳原子数1~7的直链状或支链状的卤代烷基、被1个以上的醚键或硫醚键中断的碳原子数2~7的直链状或支链状的烷基、可以被取代的碳原子数2~4的直链状或支链状的氨基烷基、可以被取代的苯基、可以被取代的碳原子数7~11的苯基烷基、被1个以上的醚键或硫醚键中断的可以被取代的碳原子数7~10的苯基烷基、可以被取代的稠环基、或者可以被取代的杂环基;
式(3)中,r7表示碳原子数1~16的直链状、支链状或环状的烷基、碳原子数1~6的直链状或支链状的卤代烷基、可以被取代的苯基、可以被取代的碳原子数7~10的苯基烷基、被1个以上的醚键或硫醚键中断的可以被取代的碳原子数7~9的苯基烷基、可以被取代的稠环基、或者可以被取代的杂环基;
m和n表示0或1,在m为1的情况下,n为1。
在优选的实施方式中,上述r5或r5'为甲基。
在优选的实施方式中,r4为式(2)所示的基团,r6为碳原子数1~7的直链状、支链状或环状的烷基、碳原子数1~5的直链状或支链状的卤代烷基、可以被取代的碳原子数2~4的直链状或支链状的氨基烷基、可以被取代的苯基、可以被取代的碳原子数7~11的苯基烷基、被1个以上的醚键或硫醚键中断的可以被取代的碳原子数7~10的苯基烷基、可以被取代的稠环基、或者可以被取代的杂环基。
在优选的实施方式中,r4为式(3)所表示的基团,r7为碳原子数1~6的直链状、支链状或环状的烷基、碳原子数1~4的直链状或支链状的卤代烷基、可以被取代的苯基、可以被取代的碳原子数7~10的苯基烷基、被1个以上的醚键或硫醚键中断的可以被取代的碳原子数7~9的苯基烷基、可以被取代的稠环基、或者可以被取代的杂环基。
在优选的实施方式中,m和n为0,r1为卤原子或硝基;或者m为0、n为1,r1为可以被取代的苯基、可以被取代的稠环基或可以被取代的杂环基。
本发明的另一方面提供一种光聚合引发剂。该光聚合引发剂含有至少1种上述的芴系化合物。
本发明的又一方面提供一种光敏性组合物。该光敏性组合物含有至少具有1个乙烯性不饱和键的化合物和上述光聚合引发剂。
发明效果
本发明的新的芴系化合物对活性能量射线具有高灵敏度。并且,本发明的芴系化合物通过适当选择芴骨架上所键合的官能团,能够提供具有更优异的特性(例如对活性能量射线的进一步提高的灵敏度、高溶解性以及更优异的透明性等)的光聚合引发剂。因此,本发明的芴系化合物可作为光聚合引发剂而适合用于各种用途。
附图说明
图1(a)是表示对合成例4中获得的芴系化合物测定曝光前后的着色程度(吸收光谱)的结果的曲线图,图1(b)是表示对参考例1的化合物测定曝光前后的着色程度的结果的曲线图。
图2是由含有合成例1中获得的芴系化合物的光敏性组合物所获得的透明固化膜(实施例1)和黑色固化膜(实施例10)的激光显微镜照片。
图3是由含有合成例2中获得的芴系化合物的光敏性组合物所获得的透明固化膜(实施例2)和黑色固化膜(实施例11)的激光显微镜照片。
图4是由含有合成例8中获得的芴系化合物的光敏性组合物所获得的透明固化膜(实施例5)的激光显微镜照片。
图5是由含有合成例11中获得的芴系化合物的光敏性组合物所获得的透明固化膜(实施例7)的激光显微镜照片。
图6是由含有现有的光聚合引发剂的光敏性组合物所获得的透明固化膜(比较例1)和黑色固化膜(比较例3)的激光显微镜照片。
图7是由含有合成例d-1中获得的芴系化合物的光敏性组合物所获得的透明固化膜(实施例2-1)和黑色固化膜(实施例2-11)的激光显微镜照片。
图8是由含有合成例d-3中获得的芴系化合物的光敏性组合物所获得的透明固化膜(实施例2-2)和黑色固化膜(实施例2-13)的激光显微镜照片。
图9是由含有合成例d-4中获得的芴系化合物的光敏性组合物所获得的透明固化膜(实施例2-3)和黑色固化膜(实施例2-14)的激光显微镜照片。
图10是由含有合成例d-12中获得的芴系化合物的光敏性组合物所获得的透明固化膜(实施例2-7)和黑色固化膜(实施例2-17)的激光显微镜照片。
图11是由含有合成例d-14中获得的芴系化合物的光敏性组合物所获得的透明固化膜(实施例2-8)和黑色固化膜(实施例2-18)的激光显微镜照片。
具体实施方式
[a.芴系化合物]
[a-1.本发明的芴系化合物]
本发明的芴系化合物由通式(1)表示。
上述通式(1)中,在m为0且n为0的情况下、即r1与芴骨架直接键合的情况下,r1表示氢原子、卤原子、硝基、被可以取代有卤原子的碳原子数1~8的烷基所取代的磺酰氧基、可以被取代的苯基磺酰氧基、被可以取代有卤原子的碳原子数1~8的烷基所取代的磺酰基、可以被取代的苯基磺酰基、可以被取代的杂环式磺酰基、或者可以被取代的稠环式磺酰基。在上述通式(1)中,在m为0且n为0的情况下,优选r1为卤原子或硝基。
具体而言,在m为0且n为0的情况下,r1为氢原子、卤原子、硝基、下述式所示的烷基磺酰氧基:
(式中,r8表示碳原子数1~8的直链状、支链状或环状的烷基、或者碳原子数1~4的直链状的卤代烷基)、
下述式所示的可以被取代的苯基磺酰氧基:
(式中,r9表示氢原子、碳原子数1~4的直链状或支链状的烷基、碳原子数1~4的直链状或支链状的烷氧基、卤原子、氰基、芳基或者硝基)、
下述式所示的烷基磺酰基:
(式中,r10表示碳原子数1~8的直链状、支链状或环状的烷基、或者碳原子数1~4的直链状的卤代烷基)、
下述式所示的可以被取代的苯基磺酰基:
(式中,r11表示氢原子、碳原子数1~4的直链状或支链状的烷基、碳原子数1~4的直链状或支链状的烷氧基、卤原子、氰基、芳基或者硝基)、
下述式所示的可以被取代的杂环式磺酰基:
(式中,r12表示氢原子或卤原子,r13表示氢原子、羟基、或者碳原子数1~4的直链状或支链状的烷氧基,r14表示氢原子、羟基、或者碳原子数1~4的直链状或支链状的烷氧基)、
下述式所示的可以被取代的稠环式磺酰基:
(式中,r15表示氢原子、碳原子数1~4的直链状或支链状的烷氧基、羟基、被碳原子数1~4的直链状或支链状的烷基取代的氨基、卤原子、或者硝基,r16表示氢原子、碳原子数1~4的直链状或支链状的烷氧基、羟基、卤原子、或者硝基)。
上述r8优选为碳原子数1~4的直链状或支链状的烷基,更优选为甲基。上述r9优选为氢原子、碳原子数1~4的直链状或支链状的烷基、碳原子数1~4的直链状或支链状的烷氧基、卤原子、氰基、或者硝基,更优选为甲基。作为上述卤原子,例如可举出:氟、氯、溴、碘。
上述r10优选为碳原子数1~4的直链状或支链状的烷基,更优选为甲基。上述r11优选为氢原子、碳原子数1~4的直链状或支链状的烷基、碳原子数1~4的直链状或支链状的烷氧基、卤原子、氰基、或者硝基,更优选为甲基。作为上述卤原子,例如可举出:氟、氯、溴、碘。
上述r12优选为氢原子或卤原子。上述r13优选为氢原子、甲氧基、乙氧基或羟基。上述r14优选为氢原子、甲氧基、乙氧基或羟基。
上述r15优选为氢原子。上述r16优选为氢原子。即,在r1为稠环式磺酰基的情况下,优选该稠环式磺酰基未被取代。
上述通式(1)中,在m为0且n为1的情况下、即r1经由羰基与芴骨架键合的情况下,r1表示可以被取代的苯基、可以被取代的杂环基、或者可以被取代的稠环基。在通式(1)中,在m为0且n为1的情况下,优选r1为可以被取代的苯基。
具体而言,在m为0且n为1的情况下,包含r1的与芴骨架键合的部分为下述式所示的包含被取代的苯基的结构:
(式中,r17~r21分别独立,表示氢原子、硝基、芳基、卤原子、氰基、碳原子数1~7的直链状、支链状或环状的烷基、碳原子数1~4的直链状或支链状的卤代烷基、碳原子数1~4的直链状或支链状的烷氧基、或者碳原子数1~4的直链状或支链状的卤代烷氧基)、
下述式所示的包含可以被取代的杂环的结构:
下述式所示的包含可以被取代的稠环的结构:
(式中,r22表示氢原子、硝基、羟基、碳原子数1~4的直链状或支链状的烷基、或者碳原子数1~4的直链状或支链状的烷氧基,r23表示氢原子、羟基、卤原子、硝基、氰基、碳原子数1~4的直链状或支链状的烷基、或者碳原子数1~4的直链状或支链状的烷氧基)。
上述r17~r21分别独立,优选为氢原子、硝基、卤原子、氰基、碳原子数1~4的直链状或支链状的烷基、碳原子数1~4的直链状或支链状的烷氧基、或者碳原子数1~4的直链状或支链状的卤代烷基。在上述碳原子数1~4的直链状或支链状的卤代烷基中,作为取代烷基的氢原子的卤原子,可举出上述卤原子。作为取代有卤原子的碳原子数1~4的直链状或支链状的烷基,具体可举出:三氟甲基、五氟乙基、九氟丁基等。
此外,在上述r17~r21中的至少1个基团为硝基的情况下,其他基团优选分别独立地为氢原子、卤原子、硝基、或者碳原子数1~4的直链状或支链状的烷基。
上述r22优选为氢原子、甲基、乙基、甲氧基、乙氧基或羟基。上述r23优选为氢原子、甲基、乙基、甲氧基、乙氧基、羟基、卤原子或氰基。
上述通式(1)中,在m为1且n为1的情况下、即r1经由羰基和亚苯基与芴骨架键合的情况下,r1表示被可以取代有卤原子的碳原子数1~8的烷基所取代的磺酰氧基(具体而言,被碳原子数1~8的直链状、支链状或环状的烷基取代的磺酰氧基、或者被碳原子数1~4的直链状的卤代烷基取代的磺酰氧基)、或者可以被取代的苯基磺酰氧基。
具体而言,在m为1且n为1的情况下,包含r1的与芴骨架键合的部分为下述式所示的磺酰氧基:
(式中,r24表示碳原子数1~8的直链状、支链状或环状的烷基、或者碳原子数1~4的直链状的卤代烷基)、
下述式所示的可以被取代的苯基磺酰氧基:
(式中,r25表示氢原子、碳原子数1~4的直链状或支链状的烷基、碳原子数1~4的直链状或支链状的烷氧基、卤原子、氰基、或者硝基)。
上述r24优选为甲基。上述r25优选为甲基。
上述通式(1)中,r2和r3分别独立,表示碳原子数1~22的直链状、支链状或环状的烷基、碳原子数1~10的直链状或支链状的卤代烷基、被1个以上的醚键或硫醚键中断的碳原子数2~15的直链状或支链状的烷基、可以被取代的苯基、可以被取代的碳原子数7~11的苯基烷基。上述r2和r3也可以一起形成环。作为碳原子数1~10的直链状或支链状的卤代烷基所含的卤原子,可举出上述所例示的卤原子。
上述r2和r3优选分别独立地为氢原子、或者碳原子数2~8的直链状或支链状的烷基。
上述通式(1)中,r4为式(2)或式(3)所示的基团。上述通式(1)中,r4优选为式(2)所示的基团。
式(2)和(3)中,r5和r5'表示碳原子数1~17的直链状、支链状或环状的烷基、碳原子数2~5的直链状或支链状的卤代烷基、被1个以上的醚键或硫醚键中断的碳原子数2~7的直链状或支链状的烷基、可以被取代的苯基、可以被取代的碳原子数7~11的苯基烷基、可以被取代的碳原子数7~10的苯氧基烷基、可以被取代的杂环基、或者可以被取代的稠环基。上述r5和r5'优选为甲基。
作为上述被1个以上的醚键或硫醚键中断的碳原子数2~7的直链状或支链状的烷基,例如可举出:甲氧基甲基、乙氧基甲基、2-乙氧基乙基、丁氧基甲基、(2-丁氧基乙氧基)甲基、2-甲基硫乙基等。
作为上述可以被取代的苯基的取代基,例如可举出:碳原子数1~4的直链状或支链状的烷基、碳原子数1~4的直链状或支链状的烷氧基、卤原子、氰基、芳基、或者硝基。
作为上述可以被取代的碳原子数7~11的苯基烷基,例如可举出:苯基甲基、1-苯基乙基、2-苯基乙基、3-苯基丙基、4-苯基丁基、5-苯基戊基、氯苯基甲基、硝基苯基甲基等。
作为上述可以被取代的碳原子数7~10的苯氧基烷基,例如可举出:苯氧基甲基、1-苯氧基乙基、2-苯氧基乙基、3-苯氧基丙基、4-苯氧基丁基、氯苯氧基甲基、硝基苯氧基甲基等。
作为上述可以被取代的杂环基和可以被取代的稠环基,可举出:上述r1的项目中所例示的可以被取代的杂环基和可以被取代的稠环基。
上述式(2)中,r6表示碳原子数1~17的直链状、支链状或环状的烷基、碳原子数1~7的直链状或支链状的卤代烷基、被1个以上的醚键或硫醚键中断的碳原子数2~7的直链状或支链状的烷基、可以被取代的碳原子数2~4的直链状或支链状的氨基烷基、可以被取代的苯基、可以被取代的碳原子数7~11的苯基烷基、被1个以上的醚键或硫醚键中断的可以被取代的碳原子数7~10的苯基烷基、可以被取代的稠环基、或者可以被取代的杂环基。上述r6优选为碳原子数1~17的直链状或支链状的烷基、碳原子数3~10的环状烷基、碳原子数1~7的直链状或支链状的卤代烷基、被1个以上的醚键或硫醚键中断的碳原子数2~7的直链状或支链状的烷基、可以被取代的碳原子数2~4的直链状或支链状的氨基烷基、可以被取代的苯基、可以被取代的碳原子数7~11的苯基烷基、被1个以上的醚键或硫醚键中断的可以被取代的碳原子数7~10的苯基烷基、可以被取代的稠环基、或者可以被取代的杂环基,更优选为碳原子数1~7的直链状或支链状的烷基、碳原子数1~3的直链状或支链状的卤代烷基、碳原子数3~6的环状的烷基、可以被取代的碳原子数2~4的直链状或支链状的氨基烷基、被任意适当的基团取代的苯基、可以被取代的稠环基、或者可以被取代的杂环基。
上述式(2)具体为下述式所示的含有烷基的结构:
(式中,r26表示碳原子数1~17的直链状或支链状的烷基);
下述式所示的含有1个以上的醚键或硫醚键的结构:
(式中,r27表示被1个以上的醚键或硫醚键中断的碳原子数1~6的直链状或支链状的烷基、可以被1个以上的醚键或硫醚键中断的碳原子数1~6的直链状或支链状的烷氧基(烷氧基的氧原子与式中的碳原子键合)、或者可以被1个以上的醚键或硫醚键中断的碳原子数1~6的直链状或支链状的烷硫基(烷硫基的硫原子与式中的碳原子键合));
优选为下述式所示的含有1个以上的醚键或硫醚键的结构:
(式中,r28表示碳原子数1~4的直链状或支链状的烷基);
下述式所示的含有可以被取代的苯基的结构:
(式中,r29表示单键、碳原子数1~4的直链状或支链状的亚烷基、被1个以上的醚键或硫醚键中断的碳原子数1~4的直链状或支链状的亚烷基、可以被1个以上的醚键或硫醚键中断的碳原子数1~4的直链状或支链状的亚烷氧基(亚烷氧基的氧原子与式中的芳香环键合)、或者可以被1个以上的醚键或硫醚键中断的碳原子数1~4的直链状或支链状的亚烷硫基(亚烷硫基的硫原子与式中的芳香环键合),r30~r34分别独立,表示氢原子、碳原子数1~7的直链状或支链状的烷基、碳原子数1~4的直链状或支链状的卤代烷基、卤原子、硝基、氰基、可以被1个以上的醚键或硫醚键中断的碳原子数1~6的直链状或支链状的烷氧基(烷氧基的氧原子与式中的芳香环键合)、或者可以被1个以上的醚键或硫醚键中断的碳原子数1~4的直链状或支链状的烷硫基(烷硫基的硫原子与式中的芳香环键合));
下述式所示的含有可以被取代的碳原子数2~4的直链状或支链状的氨基烷基的结构:
(式中,r52表示碳原子数2~4的直链状或支链状的亚烷基,r53、r54分别独立,表示碳原子数1~4的直链状或支链状的烷基、r59co或者r60coo,r59和r60分别独立,表示与上述r5所例示的基团相同的基团);
优选为下述式所示的含有可以被取代的碳原子数2~4的直链状或支链状的氨基烷基的结构:
(式中,r39和r40分别独立,表示氢原子或甲基,r41和r42表示与上述r5所例示的基团相同的基团);
下述式所示的含有可以被取代的稠环的结构:
(式中,r43表示氢原子、碳原子数1~4的直链状或支链状的烷基、碳原子数1~4的直链状或支链状的烷氧基、或者羟基,r44表示氢原子、碳原子数1~4的直链状或支链状的烷基、碳原子数1~4的直链状或支链状的烷氧基、羟基、卤原子、或者氰基);
下述式所示的含有可以被取代的杂环的结构:
r26优选表示碳原子数1~7的直链状或支链状的烷基,更优选为碳原子数1~3的直链状的烷基。并且,碳原子数3~10的环状的烷基优选为环丙基、环丁基、环戊基、环己基、或金刚烷基,更优选为环己基。
r27优选表示被1个醚键或硫醚键中断的碳原子数1~6的直链状或支链状的烷基、可以被1个醚键或硫醚键中断的碳原子数1~6的直链状或支链状的烷氧基(烷氧基的氧原子与式中的碳原子键合)、或者可以被1个醚键或硫醚键中断的碳原子数1~6的直链状或支链状的烷硫基(烷硫基的硫原子与式中的碳原子键合)。
r28优选为甲基。
r30~r34分别独立,优选为氢原子、碳原子数1~4的直链状或支链状的烷基、碳原子数1~4的直链状或支链状的烷氧基、硝基、卤原子、碳原子数1~4的直链状或支链状的卤代烷基、och(r36)ch2or37所示的直链状或支链状的烷氧基(烷氧基的氧原子与式中的芳香环键合,r36和r37分别独立地表示氢原子、甲基或乙基,优选表示氢原子或甲基)、sr38所示的直链状或支链状的烷硫基(烷硫基的硫原子与式中的芳香环键合,r38表示碳原子数1~4的直链状或支链状的烷基,优选表示甲基),更优选分别独立地为氢原子、甲基或甲氧基。
r53、r54分别独立,优选表示r59co或r60coo(如上所述,r59和r60分别独立地表示与上述r5所例示的基团相同的基团)。
r39和r40分别独立,优选为氢原子或甲基。r41和r42优选为甲基。
r43优选为氢原子、甲基、乙基、甲氧基、乙氧基或羟基。r44优选为氢原子、甲基、氰基或卤原子。
上述式(3)中,r7表示碳原子数1~16的直链状、支链状或环状的烷基、碳原子数1~6的直链状或支链状的卤代烷基、可以被取代的苯基、可以被取代的碳原子数7~10的苯基烷基、被1个以上的醚键或硫醚键中断的可以被取代的碳原子数7~9的苯基烷基、可以被取代的稠环基、或者可以被取代的杂环基。上述r7优选为碳原子数1~6的直链状、支链状或环状的烷基、碳原子数1~4的直链状或支链状的卤代烷基、可以被取代的苯基、可以被取代的碳原子数7~10的苯基烷基、被1个以上的醚键或硫醚键中断的可以被取代的碳原子数7~9的苯基烷基、可以被取代的稠环基、或者可以被取代的杂环基。
上述式(3)具体而言为下述式所示的含有烷基的结构:
(式中,r45表示碳原子数1~16的直链状、支链状或环状的烷基、或者碳原子数1~6的直链状或支链状的卤代烷基)、
下述式所示的含有可以被取代的苯基的结构:
(式中,r35表示单键、碳原子数1~4的直链状或支链状的亚烷基、被1个以上的醚键或硫醚键中断的碳原子数1~4的直链状或支链状的亚烷基、可以被1个以上的醚键或硫醚键中断的碳原子数1~4的直链状或支链状的亚烷氧基(亚烷氧基的氧原子与式中的芳香环键合)、或者可以被1个以上的醚键或硫醚键中断的碳原子数1~4的直链状或支链状的亚烷硫基(亚烷硫基的硫原子与式中的芳香环键合),r46~r50分别独立,表示氢原子、碳原子数1~4的直链状或支链状的烷基、碳原子数1~4的直链状或支链状的烷氧基、碳原子数1~4的直链状或支链状的烷硫基、碳原子数1~4的直链状或支链状的卤代烷基、卤原子、硝基、芳基、苄基、或者苄氧基)、
下述式所示的含有可以被取代的稠环基的结构:
(式中,r51表示氢原子、碳原子数1~4的直链状或支链状的烷基、碳原子数1~4的直链状或支链状的烷氧基或者羟基)、
下述式所示的含有可以被取代的杂环基的结构:
r45优选为碳原子数1~6的直链状、支链状或环状的烷基、或者碳原子数1~4的直链状或支链状的卤代烷基,更优选为碳原子数1~3的直链状的烷基、或者碳原子数1~2的直链状的卤代烷基。
r46~r50分别独立,优选为氢原子、甲基或甲氧基。
r51优选为氢原子、甲基、乙基、甲氧基、乙氧基或羟基。
通式(1)中,m表示亚苯基的个数。上述m为0或1。此外,通式(1)中,n表示羰基的个数。上述n为0或1。通式(1)中,优选m和n为0、或m为0且n为1。
作为上述通式(1)所示的芴系化合物,具体可举出下列化合物。
[a-2.芴系化合物的合成]
本发明的芴系化合物例如可以通过下述反应流程合成。
首先,具有所希望的r2和r3的芴系化合物,例如可以通过使芴与含有r2或r3的卤化物(x1-r2以及x2-r3、x1和x2分别独立,表示溴、氯、碘,r2和r3如上所述)及任意适当的碱进行反应而获得(反应i)。
[反应i]
上述x1或x2所示的卤原子优选为溴或碘。
作为上述碱,可以使用任意适当的碱,例如可举出无机碱或有机碱。具体而言,可举出:氢氧化锂、氢氧化钠、氢氧化钙、氢氧化钾、氢氧化镁、碳酸氢钠、碳酸氢钾、碳酸钠、碳酸钾、三乙胺、吡啶、哌啶、二氮杂双环十一碳烯、丁基锂、叔丁醇钾、叔丁醇钠、甲醇钠和乙醇钠等。上述碱优选为丁基锂、叔丁醇钾、叔丁醇钠、甲醇钠和乙醇钠。
作为上述x1-r2和x2-r3,可使用任意适当的卤化物。作为上述卤化物,例如可举出:具有碳原子数1~22的直链状、支链状或环状的烷基的烷基卤化物、具有被卤原子取代的碳原子数1~10的直链状或支链状的卤代烷基的卤化物、具有被1个以上的醚键或硫醚键中断的碳原子数2~15的直链状或支链状的烷基的卤化物、被碳原子数1~11的烷基取代的苯卤化物、具有被1个以上的醚键或硫醚键中断的碳原子数1~5的烷基的苯卤化物、被卤原子取代的苯卤化物、被氨基取代的苯卤化物、碳原子数7~11的苯基烷基卤化物和具有碳原子数2~12的直链状或支链状的烷基的烷基二卤化物等。
进一步具体而言,例如作为导入碳原子数1~22的直链状、支链状或环状的烷基作为r2和r3时所使用的卤化物,可举出:碘甲烷、溴乙烷、溴丙烷、溴代环丙烷、溴丁烷、溴代-2-甲基丙烷、溴代叔丁烷、溴代环丁烷、溴戊烷、溴代-1-甲基丁烷、溴代-2-甲基丁烷、溴代-3-甲基丁烷、溴代环丁基甲烷、溴代环戊烷、溴己烷、溴代环己烷、溴代-4-甲基戊烷、溴代-1-乙基丁烷、溴代-2-乙基丁烷、溴庚烷、溴代环庚烷、溴代-1-乙基戊烷、溴代环己基甲烷、溴辛烷、溴代-1-甲基庚烷、溴代-2-乙基己烷、溴壬烷、溴癸烷、溴代十一烷、溴代十二烷、溴代十三烷、溴代十四烷、溴代十五烷、溴代十六烷、溴代十七烷、溴代十八烷、溴代二十烷、溴代二十二烷等。
此外,例如作为导入碳原子数1~10的直链状或支链状的卤代烷基作为r2和r3时所使用的卤化物,可举出:2-氯乙基溴、3-氯-2-甲基丙基溴、3-氯丙基溴、4-氯丁基溴、5-氯戊基溴、6-氯己基溴、7-氯戊基溴、3,4-二氯丁基溴、2,2,2-三氟乙基溴、3,3,3-三氟丙基溴、4,4,4-三氟丁基溴、七氟丙基溴、九氟丁基溴、十三氟己基溴、十五氟庚基溴、十七氟辛基溴、十九氟壬基溴、全氟癸基溴、2-氯乙基碘、3-氯丙基碘、4-氯丁基碘、5-氯戊基碘、6-氯己基碘、2,2,2-三氟乙基碘、3,3,3-三氟丙基碘、4,4,4-三氟丁基碘、七氟丙基碘、九氟丁基碘、十三氟己基碘、十七氟辛基碘、全氟癸基碘等。
另外,例如作为导入被1个以上的醚键或硫醚键中断的碳原子数2~15的直链状或支链状的烷基作为r2和r3时所使用的卤化物,可举出:溴乙基甲基醚、溴乙基乙基醚、溴甲氧基丙烷、溴代-3-(2-甲氧基乙氧基)丙烷、溴代-2-[2-(2-甲氧基乙氧基)乙氧基]乙烷、溴代-2-[2-[2-(2-甲氧基乙氧基)乙氧基]乙氧基]乙烷、2-氯乙基甲基硫醚、2-氯乙基乙基硫醚、3-氯丙基十二烷基硫醚等。
另外,例如作为导入可以被取代的苯基作为r2和r3时所使用的卤化物,可举出:溴苯、碘代甲苯、溴氟苯、溴代苯甲硫醚、溴代苯甲醚、溴代苯甲腈、溴乙基苯、溴代叔丁基苯、溴代异丙苯、溴代-n,n-二甲基苯胺、溴代三甲基甲硅烷基苯、溴代乙炔基苯、溴苯乙腈、溴代硝基苯、溴代苯基哌啶、溴代联苯、溴代甲磺酰基苯、苄氧基溴苯、(三氟甲基)碘苯等。
另外,例如作为导入碳原子数7~11的苯基烷基作为r2和r3时所使用的卤化物,可举出:苄基溴、(溴乙基)苯、苯基丙基溴、苯基丁基溴、苯基戊基溴、(三氟甲基)苄基溴、(三氟甲氧基)苄基溴等。
另外,例如作为r2和r3一起形成环时所使用的卤化物,可举出二溴乙烷、二溴戊烷、二溴己烷、二溴十二烷等。
在r2和r3为被1个以上的醚键中断的碳原子数2~15的直链状或支链状的烷基的情况下,具有所希望的r2和r3的芴系化合物,例如也可通过导入酯基的反应、接着将所导入的酯基还原而获得羟基的反应、接着对羟基进行烷基化的反应而获得。上述反应可以由下述反应流程表示(反应i')。
[反应i']
上述酯基导入反应例如可以通过使芴与卤代烷基羧酸烷基酯进行反应而获得(反应i'(a))。该反应可在存在任意适当的碱的条件下实施。
作为上述卤代烷基羧酸烷基酯,可使用任意适当的化合物。在r2为r62-ch2-o-r64所示的基团(r62是与芴环键合的基团,表示可以被1个以上的醚键中断的碳原子数1~7(优选为1~4)的直链状或支链状的烷基,r64表示可以被1个以上的醚键中断的碳原子数1~13(优选为1~4)的直链状或支链状的烷基)、且r3为r63-ch2-o-r65所示的基团(r63是与芴环键合的基团,表示可以被1个以上的醚键中断的碳原子数1~7(优选为1~4)的直链状或支链状的烷基,r65表示可以被1个以上的醚键中断的碳原子数1~13(优选为1~4)的直链状或支链状的烷基)的情况下,上述卤代烷基羧酸烷基酯优选含有r62或r63。作为含有r62或r63的卤代烷基羧酸烷基酯,例如可举出由x8-r62-coor66或x9-r63-coor67(x8和x9分别独立地表示卤原子,优选溴、氯、碘,r66和r67分别独立,表示碳原子数1~7的直链状或支链状的烷基,r62和r63如上所述)所示的卤代烷基羧酸烷基酯。
作为上述碱,例如可举出无机碱或有机碱。作为上述碱,具体可举出反应i所使用的碱。上述碱优选为丁基锂、叔丁醇钾、叔丁醇钠、甲醇钠和乙醇钠。
上述将所导入的酯基还原而获得羟基的反应,例如可以通过使由反应i'(a)所获得的化合物与还原剂反应而实施(反应i'(b))。
作为上述还原剂,可使用任意适当的还原剂。作为上述还原剂,例如可举出:氢化铝锂、硼氢化钠、硼烷等。
上述对羟基进行烷基化的反应,例如可以通过使由反应i'(b)所获得的化合物与烷基化剂作用而实施(反应i'(c))。该反应可在存在任意适当的碱的条件下实施。
作为上述烷基化剂,可以使用任意适当的烷基化剂。在r2为r62-ch2-o-r64所示的基团、且r3为r63-ch2-o-r65所示的基团的情况下,作为上述烷基化剂,例如可举出由x10-r64或x11-r65(x10和x11分别独立地表示卤原子,优选表示溴、氯、碘,r64和r65如上所述)所示的烷基卤化物。
作为上述碱,例如可举出无机碱或有机碱。作为上述碱,具体可举出:氢化钠、烷基溴化镁等格林亚试剂等、以及反应i所使用的碱。上述碱优选为氢化钠。
另外,在r2和r3为氢原子的情况下,反应i和i'省略。
接着,使具有所希望的r2和r3的芴化合物与上述r4为式(2)所示的基团时含有上述r6的羧酸卤化物、使该芴化合物与上述r4为式(3)所示的基团时含有上述r7的羧酸卤化物在任意适当的路易斯酸的存在下进行反应(反应ii)。
[反应ii]
上述的含有r6的羧酸卤化物以及含有r7的羧酸卤化物所含的卤原子(x3和x3')优选为氯、溴或碘。
作为上述路易斯酸,可使用任意适当的路易斯酸。作为该路易斯酸,例如可举出:氯化铝、氯化铁、四氯化钛等。上述路易斯酸优选为氯化铝。
作为上述的含有r6的羧酸卤化物,可使用任意适当的羧酸卤化物。例如可举出:碳原子数1~17的直链状、支链状或环状的烷基羧酸卤化物、碳原子数1~7的直链状或支链状的卤代烷基羧酸卤化物、被1个以上的醚键或硫醚键中断的碳原子数2~7的直链状或支链状的烷基羧酸卤化物、可以被取代的苯基羧酸卤化物、可以被取代的碳原子数7~11的苯基烷基羧酸卤化物、可以被取代的碳原子数7~10的苯氧基烷基羧酸卤化物、可以被取代的稠环式羧酸卤化物、或者可以被取代的杂环式羧酸卤化物等。
其中,在r6为可以被取代的碳原子数2~4的氨基烷基的情况下,通过使具有所希望的r2和r3的芴化合物与碳原子数2~4的具有不饱和键的烷基羧酸卤化物进行反应,接着进行肟化反应、酰化反应而衍生。或者通过使具有所希望的r2和r3的芴化合物与碳原子数2~4的卤代烷基羧酸卤化物进行反应,接着进行氨基化反应而衍生。作为卤代烷基羧酸卤化物,例如可举出4-氯丁酰氯等。
作为上述的含有r7的羧酸卤化物,可使用任意适当的羧酸卤化物。例如可举出碳原子数2~17的直链状、支链状或环状的烷基羧酸卤化物、碳原子数2~7的直链状或支链状的卤代烷基羧酸卤化物、可以被取代的碳原子数7~11的苯基烷基羧酸卤化物、可以被取代的碳原子数7~10的苯氧基烷基羧酸卤化物、可以被取代的稠环式乙酰卤化物、或者可以被取代的杂环式乙酰卤化物等。
在上述r4为式(2)所示的基团、且上述r6为被1个以上的醚键或硫醚键中断的可以被取代的碳原子数7~10的苯基烷基的情况下、或者在上述r4为式(3)所示的基团、且上述r7为被1个以上的醚键或硫醚键中断的可以被取代的碳原子数7~9的苯基烷基的情况下,也可以对通过反应ii获得的下述化合物进一步实施下述反应ii'。
[反应ii']
上述反应ii'中,r56表示直链状或支链状的亚烷基、或者被1个以上的醚键或硫醚键中断的亚烷基,r57表示可以被取代的苯基或可以被取代的苯基烷基,-r56-o-r57和-r56-s-r57与-r6或-ch2-r7对应,x7表示卤原子。
卤原子(x7)优选为氯、溴或碘。
反应ii'可以在卤素交换剂的存在下进行。作为卤素交换剂,可以使用任意适当的卤素交换剂。作为卤素交换剂,例如可举出:碱金属卤化物(例如碘化钠、碘化钾、溴化钠和溴化钾)、季铵盐(例如四丁基溴化铵和四丁基碘化铵等)。
反应ii'也可在碱的存在下进行。作为碱,可使用任意适当的碱。作为碱,例如可举出无机碱和有机碱。作为碱,例如可举出:碱金属氢氧化物(例如氢氧化钠和氢氧化钾)、碳酸钠、碳酸钾、叔丁醇钾、氢化钠和二氮杂双环十一碳烯等。
接着,通过使反应ii和/或反应ii'中获得的芴系化合物与可赋予所希望的r1的化合物进行反应,获得具有所希望的r1的芴系化合物(反应iii)。
在合成上述m为0且n为0的情况、即上述r1与芴骨架直接键合的化合物的情况下,并且r1为被可以取代有卤原子的碳原子数1~8的烷基所取代的磺酰基、可以被取代的苯基磺酰基以外的基团的情况下,例如通过使反应ii和/或反应ii'中获得的芴系化合物与可赋予所希望的r1的化合物进行反应,能够获得具有所希望的r1的芴化合物(反应iii-i)。
[反应iii-i]
例如在合成具有硝基作为r1的芴系化合物的情况下,通过常规方法将上述具有所希望的r2、r3和r4的芴系化合物硝基化,获得具有硝基作为r1的芴系化合物。
另外,例如在合成具有卤原子作为r1的芴系化合物的情况下,通过常规方法将上述反应ii和/或反应ii'中获得的芴系化合物硝基化,接着经过还原、桑德米耶反应,由此获得具有卤原子作为r1的芴系化合物。
另外,例如在合成具有烷基磺酰氧基、或者可以被取代的苯基磺酰氧基作为r1的芴系化合物的情况下,通过常规方法将上述反应ii和/或反应ii'中获得的芴系化合物硝基化,接着利用还原、桑德米耶反应导入羟基,其后,与任意适当的化合物进行反应,由此获得具有烷基磺酰氧基、或者可以被取代的苯基磺酰氧基的芴系化合物。作为与该导入羟基后的芴系化合物进行反应的化合物,例如可举出:甲磺酰氯、乙磺酰氯、苯磺酰氯、对甲苯磺酰氯、三氟甲磺酰氯等。
在上述m为0且n为0、并且r1为被可以取代有卤原子的碳原子数1~8的烷基所取代的磺酰基、可以被取代的苯基磺酰基、可以被取代的稠环式磺酰基、可以被取代的杂环式磺酰基的情况下,例如通过使反应ii和/或反应ii'中获得的芴系化合物与可赋予所希望的r1的磺酸卤化物进行反应,获得具有所希望的r1的芴系化合物(反应iii-ii)。作为可赋予所希望的r1的磺酸卤化物中的卤素x4,适合使用与上述x3和x3'相同的卤原子。
[反应iii-ii]
作为可赋予上述所希望的r1的磺酸卤化物,可使用任意适当的磺酸卤化物。例如作为该磺酸卤化物,可举出:甲磺酰氯、苯磺酰氯、噻吩磺酰氯、吡啶磺酰氯、三氟甲磺酰氯等。
另外,在上述m为0且n为1的情况下(反应iii-iii)、上述m为1且n为1的情况下(反应iii-iv),使上述反应ii和/或反应ii'中获得的芴系化合物与含有所希望的r1的羧酸卤化物进行反应即可。作为该含有所希望的r1的羧酸卤化物中的卤素x5和x6,适合使用与上述x3和x3'相同的卤原子。
[反应iii-iii]
[反应iii-iv]
作为上述含有r1的羧酸卤化物,可使用任意适当的羧酸卤化物。例如作为反应iii-iii所使用的羧酸卤化物,可举出:苯甲酰氯、甲苯酰氯、甲氧基苯甲酰氯、噻吩甲酰氯、萘甲酰氯等。
另外,在合成具有可以被卤原子取代的烷基磺酰氧基或可以被取代的苯基磺酰氧基作为r1的芴系化合物的情况下,在上述反应iii-iv中,优选使用对位具有被任意适当的保护基保护的羟基的羧酸卤化物。作为该保护基,例如可举出乙酰基、叔戊酰基等。
另外,在使用上述具有被保护的羟基的羧酸卤化物的情况下,可使用氢氧化钠、碳酸钾、三乙胺等碱进行去保护,使其与所希望的磺酸卤化物进行反应,从而获得具有烷基磺酰氧基、苯基磺酰氧基的芴化合物。作为用于导入该烷基磺酰氧基的磺酸卤化物,可举出:甲磺酰氯、异丙基磺酰氯、1-辛磺酰氯、2-氯乙磺酰氯等。另外,作为用于导入该苯基磺酰氧基的磺酸卤化物,可举出:苯磺酰氯、对甲苯磺酰氯、4-甲氧基苯磺酰氯、4-异丙氧基苯基磺酰氯、2,4-二氯苯磺酰氯、4-氰基苯磺酰氯、4-硝基苯磺酰氯等。
接着,使取代了所希望的r1的芴系化合物与羟胺盐酸盐、亚硝酸酯、亚硝酰氯等进行反应,由此,将与r6邻接的羰基转化为肟基、或者在与r7邻接的碳上导入肟基(反应iv)。
[反应iv]
接着,使上述反应iv中获得的芴系化合物与可赋予所希望的r5、r5'基的化合物进行反应,由此能够将肟基的末端的羟基取代为所希望的r5、r5'基(反应v)。
[反应v]
作为上述的可赋予所希望的r5或r5'的化合物,可使用任意适当的化合物。例如作为可赋予碳原子数1~17的直链状、支链状或环状的烷基的化合物,可举出:乙酸酐、丙酸酐、癸酸酐、硬脂酸酐、异丁酸酐、叔戊酸酐等酸酐;以及环己甲酰氯、2-丙基戊酰氯、3,5,5-三甲基己酰氯等酰卤化物等。另外,作为可赋予碳原子数2~5的直链状或支链状的卤代烷基的化合物,例如可举出:3-氯丙酰氯、5-氯戊酰氯、3-氯叔戊酰氯、6-溴己酰氯等酰卤化物等。另外,作为可赋予被1个以上的醚键或硫醚键中断的碳原子数2~7的直链状或支链状的烷基的化合物,例如可举出:甲氧基乙酰氯、乙氧基乙酰氯、丁氧基乙酰氯、3-(甲硫基)丙酰氯、(2-丁氧基乙氧基)乙酰氯等酰卤化物等。另外,作为可赋予可以被取代的苯基的化合物,例如可举出:4-甲氧基苯基乙酸酐等酸酐;以及苯甲酰氯、甲苯酰氯、3,5-二甲基苯甲酰氯、4-甲氧基苯甲酰氯、4-氰基苯甲酰氯、4-硝基苯甲酰氯、4-苯基苯甲酰氯、氯苯甲酰氯等酰卤化物等。另外,作为可赋予可以被取代的碳原子数7~11的苯基烷基的化合物,例如可举出:苯基乙酰氯、苯基丙酰氯、氯苯基乙酰氯、4-苯基丁酰氯、6-苯基己酰氯、硝基苯基乙酰氯等酰卤化物等。另外,作为可赋予可以被取代的碳原子数7~10的苯氧基烷基的化合物,例如可举出:苯氧基乙酰氯、苯氧基丙酰氯、氯苯氧基乙酰氯、硝基苯氧基乙酰氯等。另外,作为可赋予可以被取代的杂环基的化合物,例如可举出:2-噻吩甲酰氯、噻吩-2-乙酰氯、氯烟酰氯、2-呋喃甲酰氯、喹啉甲酰氯等酰卤化物等。另外,作为可赋予可以被取代的稠环基的化合物,例如可举出:萘甲酰氯、2-乙氧基-1-萘甲酰氯、蒽甲酰氯等酰卤化物等。
并且,上述反应i~iii无需按照该顺序进行,也可适当变更反应工序的顺序进行。
作为上述各反应所使用的溶剂,可根据反应所使用的化合物等而使用任意适当的溶剂。另外,在上述各反应中,可以根据需要在任意适当的催化剂的存在下进行反应。
[b.光聚合引发剂]
本发明的光聚合引发剂含有至少1种上述芴系化合物。本发明的光聚合引发剂,由于含有上述芴系化合物,与现有的光聚合引发剂(例如含有咔唑骨架的化合物)相比,具有对活性能量射线更高的灵敏度。并且,能够提供一种还具有比现有的光聚合引发剂更优异的特性(例如溶解性或透明性)的光聚合引发剂。
另外,本发明的光聚合引发剂,通过适当选择芴骨架上所键合的官能团,能够提供一种具有比现有的光聚合引发剂更优异的特性的光聚合引发剂。例如含有至少1种上述化合物1、4、8、d-4、d-8和d-12的光聚合引发剂能够具有更优异的溶解性。另外,含有至少1种上述化合物1、2、8、11、d-1、d-2、d-3、d-4、d-12和d-14的光聚合引发剂,对于活性能量射线具有更高的灵敏度。并且,例如含有至少1种上述化合物4、6、8、9、11和d-8的光聚合引发剂能够提供一种具有更优异的透明性的光敏性组合物以及成形体。
本发明的光聚合引发剂可以根据所需的特性或灵敏度等,含有2种以上的上述芴系化合物。并且,也可以与上述芴系化合物以外的任意适当的其他的光聚合引发剂组合使用。
[c.光敏性组合物]
本发明的光敏性组合物含有:至少具有1个乙烯性不饱和键的化合物、以及上述光聚合引发剂。如上所述,本发明的光聚合引发剂具有对活性能量射线的高灵敏度。因此,能够以更低的成本提供一种具有对活性能量射线的高反应性的光敏性组合物。
作为上述至少具有1个乙烯性不饱和键的化合物,可以使用能够应用于光敏性组合物的任意适当的化合物。例如可举出:乙烯、丙烯等不饱和脂肪族烃;(甲基)丙烯酸、丁烯酸等不饱和一元酸;具有1个羧基和2个以上(甲基)丙烯酰基的多官能(甲基)丙烯酸酯等不饱和多元酸;(甲基)丙烯酸-2-羟基乙酯、(甲基)丙烯酸缩水甘油酯、(甲基)丙烯酸甲酯、乙二醇二(甲基)丙烯酸酯等不饱和一元酸与醇、多元醇或多元酚的酯;马来酸酐等不饱和多元酸的酸酐;(甲基)丙烯酰胺等不饱和一元酸与多元胺的酰胺;丙烯醛等不饱和醛;(甲基)丙烯腈等不饱和腈;苯乙烯、乙烯基苄基缩水甘油醚等不饱和芳香族化合物;甲基乙烯基酮等不饱和酮;乙烯胺、烯丙胺等不饱和胺化合物;烯丙醇等乙烯醇;乙烯基甲基醚、烯丙基缩水甘油醚等乙烯醚;马来酰亚胺、n-苯基马来酰亚胺等不饱和酰亚胺类;茚类;1,3-丁二烯等脂肪族共轭二烯类;聚苯乙烯、聚硅氧烷等聚合物分子链的末端具有单(甲基)丙烯酰基的大分子单体类;氯乙烯、含羟基的乙烯系单体与聚异氰酸酯化合物的乙烯基氨基甲酸酯化合物、含羟基的乙烯系单体与聚环氧化合物的乙烯基环氧化合物、cardo树脂等。这些可以仅使用1种也可以组合2种以上使用。并且,在使用2种以上化合物的情况下,也可以预先将它们共聚而以共聚物的形式使用。
此外,通过使用具有乙烯性不饱和键的碱显影性化合物作为上述至少具有1个乙烯性不饱和键的聚合性化合物,可以将本发明的光敏性组合物制成碱显影性光敏性树脂组合物。作为该具有乙烯性不饱和键的碱显影性化合物,可使用丙烯酸酯的共聚物、酚及/或甲酚酚醛清漆环氧树脂、具有多官能环氧基的聚苯基甲烷型环氧树脂、使环氧化合物与不饱和一元酸作用并与多元酸酐作用所获得的树脂。
作为上述不饱和一元酸,可举出:丙烯酸、甲基丙烯酸、丁烯酸、桂皮酸、山梨酸等。另外,作为上述多元酸酐,可举出:联苯四羧酸酐、琥珀酸酐、马来酸酐、偏苯三酸酐、均苯四酸酐等。
上述光敏性组合物中的光聚合引发剂的含量可根据用途和所使用的芴系化合物的特性而设定为任意适当的值。上述光敏性组合物中的光聚合引发剂的含量,相对于至少含有1个乙烯性不饱和基团的化合物100重量份,例如为0.1重量份~30重量份,优选为1重量份~20重量份。
本发明的光敏性组合物除了含有上述至少具有1个乙烯性不饱和键的化合物和光聚合引发剂之外,还可以含有任意适当的其他添加剂。作为该其他添加剂,例如可举出:表面活性剂、增塑剂、填充剂、流平剂、抗氧化剂、紫外线吸收剂、催化剂、分散助剂、敏化剂、交联剂、颜料、染料、无机化合物、有色材料、溶剂、聚合抑制剂等。
作为上述溶剂,例如可举出:丙酮、甲乙酮、环己酮等酮类;乙醚、二噁烷、四氢呋喃、1,2-二甲氧基乙烷、丙二醇单甲醚(pgme)、二丙二醇二甲醚、二乙二醇二丁醚等醚系溶剂;乙酸甲酯、乙酸乙酯、乙酸丁酯、乳酸乙酯等酯系溶剂;乙二醇单甲醚、乙酸-3-甲氧基丁酯、丙二醇单甲醚乙酸酯(pgmea)等溶纤剂系溶剂;甲醇、乙醇、丙醇、戊醇等醇系溶剂;乙二醇单甲基乙酸酯、丙二醇甲基乙酸酯等醚酯系溶剂;苯、甲苯、二甲苯等芳香族烃系溶剂;己烷、庚烷、环己烷等脂肪族烃系溶剂;二氯甲烷、氯仿、四氯化碳、1,2-二氯乙烷等卤代脂肪族烃系溶剂;氯苯等卤代芳香族烃系溶剂;苯胺、三乙胺、吡啶、乙酸、乙腈、n,n-二甲基甲酰胺、n-甲基吡咯烷酮、二甲亚砜、水等。该溶剂可以仅使用1种也可以使用2种以上溶剂的混合溶剂。上述溶剂优选为酮类、溶纤剂系溶剂、或者醚酯系溶剂。通过使用这些溶剂,能够获得优异的相溶性。
本发明的光敏性组合物可应用于任意适当的用途。如上所述,本发明的光聚合引发剂,通过适当选择芴系化合物上取代的官能团,能够具有优异的特性。因此,在可应用光敏性组合物的用途中,能够提供可发挥更优异的效果的光敏性组合物。
作为上述光敏性组合物的用途,没有特别限制,可用于任意适当的用途。例如可用于光固化性涂料;光固化性油墨;光固化性粘接剂;印刷版;印刷油墨;牙科用组合物;全息照相记录用材料;图像记录材料等记录材料;印刷配线基板;彩色电视、pc监视器、便携式信息终端、数字相机等彩色显示的液晶显示元件中的彩色滤光片;镀敷用掩模;阻焊剂;磁记录材料;光开关;电子电路;各种光致抗蚀剂材料或保护膜等的各种用途。
实施例
以下,利用实施例具体说明本发明,但本发明不受这些实施例的任何限定。其中,份意指重量份。
[合成例1]化合物1的合成
通过以下的合成方法,合成芴系化合物(化合物1)。
向反应容器中添加四氢呋喃(thf)250.0重量份和叔丁醇钾(ktb)42.2重量份,并添加芴25.0重量份。接着,向反应容器中滴加溴丙烷40.7重量份。将该溶液加热至40℃,并搅拌3小时。接着,将该溶液冷却至室温,注入乙酸乙酯和水,分离油层,并反复水洗2次。接着,利用无水硫酸镁干燥油层后,过滤分离无水硫酸镁,并将该过滤液浓缩,获得9,9-二丙基芴37.7重量份(产率100%,hplc纯度92%)。
将所获得的9,9-二丙基芴37.0重量份、二氯甲烷370.0重量份和氯化铝29.6重量份添加至反应容器中并进行搅拌。将该液体冷却至10℃,滴加邻甲苯酰氯22.8重量份,进一步搅拌4小时。在冷却至10℃以下的370.0重量份的水中注入该反应液,分离油层,并利用碳酸钾水溶液进行清洗。接着,利用无水硫酸镁干燥油层后,过滤分离无水硫酸镁,并将过滤液浓缩,由此,获得化合物1-a51.2重量份(产率94%,hplc纯度85%)。
将所获得的化合物1-a50.0重量份和乙酸500.0重量份添加至反应容器中,并滴加发烟硝酸10.8重量份,将该溶液加热至80℃。向该反应液中滴加浓硫酸13.3重量份,于80℃搅拌3小时。搅拌后冷却至室温,注入水、乙酸乙酯,分离油层,并利用水、碳酸钾水溶液反复进行清洗。接着,利用无水硫酸镁干燥油层后,过滤分离无水硫酸镁,并将过滤液浓缩。利用硅胶柱层析法对所获得的油状物进行离析精制,获得化合物1-b33.7重量份(产率60%,hplc纯度99%)。
将所获得的化合物1-b30.0重量份、丙二醇单甲醚(pgme)90.0重量份和吡啶34.4重量份添加至反应容器中并进行搅拌。接着,添加羟胺盐酸盐30.3重量份,加热至140℃并搅拌4小时。将该反应液冷却至室温,注入水、乙酸乙酯,分离油层,再次利用水、稀盐酸、氯化钠水溶液进行清洗。接着,利用无水硫酸镁干燥油层后,过滤分离无水硫酸镁,并将过滤液浓缩,由此,获得化合物1-c28.0重量份(产率90%,hplc纯度96%)。
将所获得的化合物1-c25.0重量份、乙酸乙酯125.0重量份添加至反应容器中,滴加乙酸酐13.8重量份,于室温搅拌5小时。在该反应液中注入水、乙酸乙酯,分离油层,并利用碳酸钾水溶液、氯化钠水溶液进行清洗。接着,利用无水硫酸镁干燥油层,过滤分离无水硫酸镁,并将过滤液浓缩。将所获得的产物利用乙酸乙酯/己烷进行重结晶,获得17.3重量份的化合物1(产率63%,hplc纯度99%)。所获得的化合物1的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:8.20-8.27(m:2h)、7.77-7.82(m:2h)、7.70-7.73(d:1h)、7.28-7.45(m:4h)、7.12(dd:1h)、2.17(s:3h)、2.06(s:3h)、2.00(t:4h)、0.52-0.72(m:10h)
[合成例2]化合物2的合成
将溴丙烷变更为溴己烷,除此以外,利用与合成例1相同的方式合成化合物2。所获得的化合物2的产率为40%,hplc纯度为99%。所获得的化合物的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:8.27(dd:1h)、8.20(d:1h)、7.81(d:1h)、7.73(d:1h)、7.67(d:1h)、7.54(dd:1h)、7.40(dt:1h)、7.28-7.36(m:2h)、7.13(d:1h)、2.15(s:3h)、2.08(s:3h)、2.00(t:4h)、0.97-1.12(m:12h)、0.78(t:6h)、0.50-0.60(m:4h)
[合成例3]化合物3的合成
将邻甲苯酰氯变更为环己甲酰氯,除此以外,利用与合成例1相同的方式合成化合物3。所获得的化合物3的产率为17%,hplc纯度为97%。所获得的化合物的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:8.20-8.30(m:2h)、7.76-7.85(m:2h)、7.40-7.45(m:1h)、7.18-7.22(m:1h)、3.24-3.34(m:0.5h,异构体)、2.68-2.78(m:0.5h,异构体)、1.12-2.20(m:17h)、0.58-0.74(m:10h)
[合成例4]化合物4的合成
通过以下的合成方法,合成芴系化合物(化合物4)。
与合成例1同样操作,将所获得的9,9-二丙基芴37.0重量份、二氯甲烷370.0重量份和氯化铝29.6重量份添加至反应容器中并进行搅拌。将该溶液冷却至10℃,滴加邻甲苯酰氯22.8重量份。滴加结束后搅拌1小时。接着,向该反应液中添加氯化铝29.6重量份、乙酰氯12.8重量份,加热至室温并搅拌3小时。将该反应液注入至冷水中,分离油层,利用碳酸钾水溶液、氯化钠水溶液进行清洗。接着,利用无水硫酸镁干燥油层后,过滤分离无水硫酸镁,并将过滤液浓缩。通过硅胶柱层析法对所获得的油状物进行离析精制,获得化合物4-a43.7重量份(产率72%,hplc纯度99%)。
将化合物4-a30.0重量份、乙醇300.0重量份和三乙胺(tea)8.1重量份添加至反应容器中并进行搅拌。接着,添加羟胺盐酸盐7.6重量份并搅拌3小时。在该反应液中注入水、乙酸乙酯,分离油层,利用水、稀盐酸、氯化钠水溶液进行清洗。接着,利用无水硫酸镁干燥油层后,过滤分离无水硫酸镁,并将过滤液浓缩,由此,获得化合物4-b28.2重量份(产率90%,hplc纯度99%)。
将所获得的化合物4-b25.0重量份和乙酸乙酯125.0重量份添加至反应容器中,并滴加乙酸酐13.9重量份,于室温搅拌3小时。在该反应液中注入水、乙酸乙酯,分离油层,利用碳酸钾水溶液、氯化钠水溶液进行清洗。接着,利用无水硫酸镁干燥油层后,过滤分离无水硫酸镁,并将过滤液浓缩。将所获得的产物利用甲醇进行重结晶,获得19.2重量份的化合物4(产率70%,hplc纯度98%)。所获得的化合物4的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:7.91(s:1h)、7.76(dd:3h)、7.70(d:1h)、7.42(dd:1h)、7.26-7.37(m:4h)、2.46(s:3h)、2.36(s:3h)、2.30(s:3h)、2.00(t:4h)、0.62-0.72(m:10h)
[合成例5]化合物5的合成
将邻甲苯酰氯变更为1-萘甲酰氯,除此以外,利用与合成例4相同的方式合成化合物5。所获得的化合物5的产率为25%,hplc纯度为97%。所获得的化合物的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:8.52(s:1h)、7.26-7.91(m:12h)、2.36(s:3h)、2.30(s:3h)、2.00(t:4h)、0.62-0.72(m:10h)
[合成例6]化合物6的合成
将溴丙烷变更为溴己烷,除此以外,利用与合成例4相同的方式合成化合物6。所获得的化合物6的产率为30%,hplc纯度为99%。所获得的化合物的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:7.87(s:1h)、7.79(d:2h)、7.72-7.60(m:3h)、7.25-7.47(m:4h)、2.47(s:3h)、2.36(s:3h)、2.31(s:3h)、1.97-2.05(m:4h)、0.96-1.18(m:12h)、0.77(t:6h)、0.53-0.65(m:4h)
[合成例7]化合物7的合成
将邻甲苯酰氯变更为苯甲酰氯,除此以外,利用与合成例4相同的方式合成化合物7。所获得的化合物7的产率为30%,hplc纯度为99%。所获得的化合物的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:7.78-7.87(m:7h)、7.75(brs:1h)、7.58-7.63(m:1h)、7.48-7.66(m:2h)、2.48(s:3h)、2.31(s:3h)、2.00(t:4h)、0.62-0.72(m:10h)
[合成例8]化合物8的合成
将溴丙烷变更为溴己烷、将邻甲苯酰氯变更为苯甲酰氯,除此以外,利用与合成例4相同的方式合成化合物8。所获得的化合物8的产率为32%,hplc纯度为99%。所获得的化合物的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:7.79-7.86(m:7h)、7.75(s:1h)、7.59-7.66(m:1h)、7.48-7.55(m:2h)、2.47(s:3h)、2.31(s:3h)、1.98-2.07(m:4h)、0.98-1.18(m:12h)、0.77(t:6h)、0.55-0.68(m:4h)
[合成例9]化合物9的合成
通过以下的合成方法,合成芴系化合物(化合物9)。
使用溴己烷代替溴丙烷,除此以外,利用与合成例1相同的方式获得9,9-二己基芴,将所获得的9,9-二己基芴50.0重量份、二氯甲烷500.0重量份和氯化铝29.9重量份添加至反应容器中并进行搅拌。将该溶液冷却至10℃,滴加对氟苯甲酰氯26.1重量份。滴加结束后将反应液加温至室温,并搅拌3小时。接着,向该反应液中添加氯化铝29.9重量份、巴豆酰氯15.6重量份,搅拌20小时。将该反应液注入至冷水中,分离油层,并利用碳酸钾水溶液、氯化钠水溶液进行清洗。接着,利用无水硫酸镁干燥油层后,过滤分离无水硫酸镁,并将过滤液浓缩。通过硅胶柱层析法对所获得的油状物进行离析精制,获得化合物9-a21.1重量份(产率35%,hplc纯度99%)。
将化合物9-a20.0重量份、乙醇200.0重量份和三乙胺7.7重量份添加至反应容器中并进行搅拌。接着,添加羟胺盐酸盐6.0重量份,加温至80℃并搅拌3小时。冷却至室温后,在该反应液中注入水、乙酸乙酯,分离油层,利用水、稀盐酸、氯化钠水溶液进行清洗。接着,利用无水硫酸镁干燥油层后,过滤分离无水硫酸镁,并将过滤液浓缩,由此,获得化合物9-b21.8重量份(产率100%,hplc纯度80%)。
将所获得的化合物9-b20.0重量份和乙酸乙酯100.0重量份添加至反应容器中,并滴加乙酸酐13.8重量份,于室温搅拌20小时。在该反应液中注入水、乙酸乙酯,分离油层,利用碳酸钾水溶液、氯化钠水溶液进行清洗。接着,利用无水硫酸镁干燥油层后,过滤分离无水硫酸镁,并将过滤液浓缩。通过硅胶柱层析法对所获得的油状产物进行离析精制,获得7.5重量份的化合物9(产率30%,hplc纯度97%)。所获得的化合物的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:7.86(q:2h)、7.75-7.83(m:6h)、7.18(t:2h)、4.84(brs:1h)、3.14-3.36(m:2h)、2.33(s:3h)、2.25(s:3h)、2.00-2.10(m:4h)、1.92(s:3h)、0.98-1.20(m:15h)、0.76(t:6h)、0.58-0.67(m:4h)
[合成例10]化合物10的合成
将对氟苯甲酰氯变更为对三氟甲基苯甲酰氯,除此以外,利用与合成例9相同的方式合成化合物10。所获得的化合物10的产率为22%,hplc纯度为97%。所获得的化合物的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:7.70-7.88(m:10h)、4.84(brs:1h)、3.14-3.36(m:2h)、2.33(s:3h)、2.25(s:3h)、2.00-2.10(m:4h)、1.92(s:3h)、0.98-1.20(m:15h)、0.76(t:6h)、0.58-0.67(m:4h)
[合成例11]化合物11的合成
将对氟苯甲酰氯变更为2-噻吩甲酰氯,除此以外,利用与合成例9相同的方式合成化合物11。所获得的化合物11的产率为28%,hplc纯度为96%。所获得的化合物的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:7.73-7.93(m:7h)、7.67(dd:1h)、7.20(q:1h)、4.74-4.96(brs:1h)、3.14-3.36(m:2h)、2.34(s:3h)、2.24(s:3h)、2.02-2.10(m:4h)、1.91(s:3h)、0.94-1.20(m:15h)、0.76(t:6h)、0.56-0.68(m:4h)
[合成例12]化合物12的合成
将对氟苯甲酰氯变更为对硝基苯甲酰氯,除此以外,利用与合成例9相同的方式合成化合物12。所获得的化合物12的产率为19%,hplc纯度为97%。所获得的化合物的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:8.37(m:2h)、7.97(d:1h)、7.50-7.88(m:6h)、7.25-7.50(m:1h)、4.84(brs:1h)、3.10-3.36(m:2h)、2.23-2.40(m:4h)、1.90-2.16(m:9h)、0.98-1.20(m:15h)、0.76(t:6h)、0.50-0.67(m:4h)
[合成例13]化合物13的合成
通过以下的合成方法,合成芴系化合物(化合物13)。
使用溴己烷代替溴丙烷,除此以外,利用与合成例1相同的方式获得9,9-二己基芴,将所获得的9,9-二己基芴50.0重量份、二氯甲烷500.0重量份和氯化铝29.9重量份添加至反应容器中并进行搅拌。将该溶液冷却至10℃,滴加2,5-二甲基苯基乙酰氯30.0重量份。滴加结束后将反应液加温至室温,并搅拌3小时。将该反应液注入至冷水中,分离油层,利用碳酸钾水溶液、氯化钠水溶液进行清洗。接着,利用无水硫酸镁干燥油层后,过滤分离无水硫酸镁,并将过滤液浓缩。在所获得的固态物中加入甲醇120重量份,加温至60℃并搅拌1小时。将溶液冷却后,加入水25重量份并进行过滤,获得化合物13-a50.2重量份(产率70%,hplc纯度90%)。
将化合物13-a50.0重量份、二氯甲烷500.0重量份和氯化铝34.7重量份添加至反应容器中并进行搅拌。将该溶液冷却至10℃,滴加对硝基苯甲酰氯19.3重量份。滴加结束后,将反应液加温至40℃并搅拌5小时。将该反应液注入至冷水中,分离油层,利用碳酸钾水溶液、氯化钠水溶液进行清洗。接着,利用无水硫酸镁干燥油层后,过滤分离无水硫酸镁,将过滤液浓缩,获得化合物13-b63.5重量份(产率97%,hplc纯度80%)。
将化合物13-b60.0重量份和四氢呋喃300.0重量份添加至反应容器中并进行搅拌。在该溶液中加入亚硝酸异戊酯(isopentylnitrite)12.3重量份,添加28%的甲醇钠的甲醇溶液18.4重量份,于室温搅拌1小时。在该溶液中加入乙酸乙酯和水,分离油层,用水清洗2次。接着,利用无水硫酸镁干燥油层后,过滤分离无水硫酸镁,将过滤液浓缩,通过硅胶柱层析法对所获得的油状物进行离析精制,获得化合物13-c22.0重量份(产率35%,hplc纯度95%)。
将化合物13-c20.0重量份和冰醋酸60.0重量份添加至反应容器中并进行搅拌。在该溶液中加入乙酸酐6.2重量份,加温至40℃并搅拌5小时。向水800.0重量份和甲醇80.0重量份的混合液中注入冷却至室温的反应液,过滤所析出的晶体,获得15.1重量份的化合物13(产率71%,hplc纯度98%)。所获得的化合物的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:8.29-8.38(m:4h)、8.24(d:1h)、7.87-8.03(m:2h)、7.78-7.90(m:2h)、7.37-7.46(m:3h)、7.25(s:1h)、2.35(s:6h)、2.22(s:3h)、1.97-2.10(m:4h)、0.98-1.20(m:12h)、0.76(t:6h)、0.57-0.70(m:4h)
[合成例14]化合物14的合成
将对硝基苯甲酰氯变更为对氟苯甲酰氯,除此以外,利用与合成例13相同的方式合成化合物14。所获得的化合物14的产率为14%,hplc纯度为95%。所获得的化合物的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:8.15(d:1h)、7.85-8.00(m:2h)、7.78-7.90(m:4h)、7.37-7.46(m:3h)、7.25(s:1h)、7.01-7.10(m:2h)、2.35(s:6h)、2.22(s:3h)、1.97-2.10(m:4h)、0.98-1.20(m:12h)、0.76(t:6h)、0.57-0.70(m:4h)
[合成例15]化合物15的合成
通过以下的合成方法,合成芴系化合物(化合物15)。
将利用与合成例1相同的方式所获得的9,9-二丙基芴50.0重量份、二氯甲烷500.0重量份和氯化铝29.9重量份添加至反应容器中并进行搅拌。将该溶液冷却至10℃,滴加乙酰氯15.7重量份。滴加结束后将反应液加温至室温并搅拌3小时。将该反应液注入至冷水中,分离油层,利用碳酸钾水溶液、氯化钠水溶液进行清洗。接着,利用无水硫酸镁干燥油层后,过滤分离无水硫酸镁,并将过滤液浓缩。通过硅胶柱层析法对所获得的油状物进行离析精制,获得化合物15-a26.3重量份(产率45%,hplc纯度100%)。
将化合物15-a25.0重量份和甲醇125.0重量份添加至反应容器中并进行搅拌。在该溶液中加入三乙胺17.3重量份和羟胺盐酸盐17.8重量份,于室温搅拌3小时。在该溶液中加入水125.0重量份,过滤所析出的晶体,获得化合物15-b18.4重量份(产率70%,hplc纯度99%)。
将化合物15-b15.0重量份和四氢呋喃75.0重量份添加至反应容器中,并缓慢加入乙酸酐10.0重量份,于室温搅拌3小时。将反应液注入至水80.0重量份和甲醇20.0重量份的混合液中,过滤所析出的晶体,获得11.9重量份的化合物15(产率70%,hplc纯度100%)。所获得的化合物的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:7.78(s:1h)、7.72(s:3h)、7.30-7.40(m:3h)、2.35(s:3h)、2.28(s:3h)、1.92-2.02(m:4h)、0.55-0.70(m:10h)[合成例16]化合物16的合成
除了省略二丙基化的步骤以外,利用与合成例15相同的方式合成化合物16。所获得的化合物16的产率为33%,hplc纯度为98%。所获得的化合物的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:8.00(s:1h)、7.72-7.85(m:3h)、7.58(d:1h)、7.30-7.43(m:2h)、3.95(s:2h)、2.46(s:3h)、2.26(s:3h)[合成例d-1]化合物d-1的合成
将邻甲苯酰氯变更为苯甲酰氯,除此以外,利用与合成例1相同的方式合成化合物d-1。所获得的化合物d-1的产率为15%,hplc纯度为99%。所获得的化合物的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:8.20-8.32(m:2h)、7.32-7.88(m:9h)、1.95-2.15(m:7h)、0.55-0.75(m:10h)
[合成例d-2]化合物d-2的合成
将邻甲苯酰氯变更为4-叔丁基苯甲酰氯,除此以外,利用与合成例1相同的方式合成化合物d-2。所获得的化合物d-2的产率为12%,hplc纯度为93%。所获得的化合物的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:8.20-8.32(m:2h)、7.67-7.87(m:3h)、7.28-7.56(m:5h)、1.97-2.08(m:7h)、1.36(d:9h)、0.58-0.72(m:10h)
[合成例d-3]化合物d-3的合成
通过以下的合成方法,合成芴系化合物(化合物d-3)。
在利用与合成例1相同的方式所获得的9,9-二丙基芴50.0重量份中加入乙酸250重量份使其溶解后,加入浓硫酸29.4重量份,加温至40℃。加入浓硝酸29.0重量份并搅拌1小时后,将反应液注入至水中。过滤所析出的晶体,获得2-硝基-9,9-二丙基芴54.3重量份(产率92%,hplc纯度100%)。
在2-硝基-9,9-二丙基芴50.0重量份中加入二氯甲烷500重量份和无水氯化铝45.1重量份后,加入乙酰氯26.6重量份,加温至40℃并搅拌4小时。将反应液冷却后,将反应液注入至冰水中而分液。利用5%碳酸氢钠水溶液、水清洗油层后进行浓缩,获得化合物d-3a25.1重量份(产率44%,hplc纯度99%)。
在化合物d-3a20重量份中加入乙醇200重量份、羟胺盐酸盐16.5重量份和无水乙酸钠19.4重量份,加温至40℃并搅拌2小时。将反应液冰浴冷却,过滤所析出的晶体,获得化合物d-3b20.9重量份(产率100%,hplc纯度94%)。
在化合物d-3b20重量份中加入乙酸乙酯200重量份使其溶解后,加入乙酸酐17.4重量份,于室温搅拌5小时。加入水而分液,利用5%碳酸氢钠水溶液、水进行清洗。将油层浓缩,利用甲醇进行重结晶,由此,获得化合物d-316.9重量份(产率75%,hplc纯度99%)。所获得的化合物d-3的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:8.27(dd:1h)、8.23(d:1h)、7.78-7.85(m:4h)、2.47(s:3h)、2.30(s:3h)、2.05(t:4h)、0.55-0.72(m:10h)
[合成例d-4]化合物d-4的合成
将溴丙烷变更为溴代-3-甲基丁烷,获得9,9-二(3-甲基丁基)芴,除此以外,利用与合成例d-3相同的方式合成化合物d-4。所获得的化合物d-4的产率为30%,hplc纯度为98%。所获得的化合物的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:8.28(dd:1h)、8.20(d:1h)、7.82(t:3h)、7.70(s:1h)、2.46(s:3h)、2.30(s:3h)、2.02-2.13(m:4h)、1.28(sep:2h)、0.62(d:12h)、0.34-0.50(m:4h)
[合成例d-5]化合物d-5的合成
将溴丙烷变更为溴代环己烷,获得9-环己基芴,除此以外,利用与合成例d-3相同的方式合成化合物d-5。所获得的化合物d-5的产率为20%,hplc纯度为97%。所获得的化合物的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:8.40(s:1h)、8.30(d:1h)、8.00(s:1h)、7.75-7.90(m:3h)、4.03(s:1h)、2.45(s:3h)、2.26(s:3h)、0.8-1.8(m:11h)
[合成例d-6]化合物d-6的合成
将溴丙烷变更为1,5-二溴戊烷,获得螺[环己烷-1,9'-芴],除此以外,利用与合成例d-3相同的方式合成化合物d-6。所获得的化合物d-6的产率为5%,hplc纯度为99%。所获得的化合物的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:8.56(d:1h)、8.30(dd:1h)、8.03(d:1h)、7.78-7.88(m:3h)、2.47(s:3h)、2.30(s:3h)、1.62-2.00(m:10h)
[合成例d-7]化合物d-7的合成
通过以下的合成方法,合成芴系化合物(化合物d-7)。
在利用与合成例1相同的方式所获得的9,9-二丙基芴50.0重量份中加入二氯甲烷500重量份而溶解后,进行冰浴冷却,加入氯化铝39.9重量份后,滴加乙酰氯16.0重量份并搅拌2小时。加入氯化铝79.9重量份、4-硝基苯甲酰氯55.6重量份,加温至40℃并搅拌5小时。将反应液冷却后,将其注入至冰水中而分液后,水洗2次,并将油层浓缩。利用甲醇使所获得的固体悬浮并进行过滤,获得化合物d-7a61.0重量份(产率69%,hplc纯度89%)。
在化合物d-7a50重量份中加入乙醇500重量份、羟胺盐酸盐31.5重量份和无水乙酸钠37.2重量份,加温至40℃并搅拌2小时。将反应液冰浴冷却,过滤所析出的晶体,获得化合物d-7b51.7重量份(产率100%,hplc纯度80%)。
在化合物d-7b50重量份中加入乙酸乙酯500重量份而溶解后,加入乙酸酐33.5重量份,于室温搅拌5小时。加入水而分液,利用5%碳酸氢钠水溶液、水进行清洗。将油层浓缩,利用甲醇进行重结晶,由此,获得化合物d-712.2重量份(产率22%,hplc纯度98%)。所获得的化合物d-7的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:8.37(d:2h)、7.96(d:2h)、7.89(s:1h)、7.73-7.84(m:5h)、2.47(s:3h)、2.30(s:3h)、2.00-2.07(m:4h)、0.60-0.72(m:10h)
[合成例d-8]化合物d-8的合成
将乙酰氯变更为2-甲基丙酰氯,除此以外,利用与合成例d-7相同的方式合成化合物d-8。所获得的化合物d-8的产率为33%,hplc纯度为98%。所获得的化合物的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:8.35-8.42(m:2h)、7.70-8.00(m:6h)、7.43-7.50(m:1h)、7.18-7.23(m:1h)、3.60(sep:0.5h,异构体)、3.08(sep:0.5h,异构体)、2.28(s:1.5h,异构体)、1.97-2.10(m:4h)、1.94(s:1.5h,异构体)、1.20-1.30(m:6h)、0.60-0.75(m:10h)
[合成例d-9]化合物d-9的合成
通过以下的合成方法,合成芴系化合物(化合物d-9)。
在利用与合成例1相同的方式所获得的9,9-二丙基芴20.0重量份中加入二氯甲烷200重量份和无水氯化铝16.0重量份后,加入丙酰氯7.5重量份,于室温搅拌2小时。加入氯化铝32.0重量份、4-硝基苯甲酰氯22.2重量份,加温至40℃并搅拌5小时。将反应液冷却后,将其注入至冰水中而分液后,水洗2次,并将油层浓缩。利用甲醇使所获得的固体悬浮并进行过滤,获得化合物d-9a29.1重量份(产率80%,hplc纯度95%)。
在化合物d-9a25重量份中加入四氢呋喃250重量份、浓盐酸85.8重量份和亚硝酸异戊酯19.3重量份,于室温搅拌12小时。将反应液注入至水中,加入乙酸乙酯而分液。用水清洗2次后,将油层浓缩,获得黄色油状物。通过硅胶柱层析法对该油状物进行离析精制,获得化合物d-9b16.0重量份(产率60%,hplc纯度95%)。
在化合物d-9b15重量份中加入乙酸乙酯150重量份而溶解后,加入乙酸酐9.5重量份,于室温搅拌24小时。加入水而分液,利用5%碳酸氢钠水溶液、水进行清洗。将油层浓缩,获得14.7重量份的化合物d-9(产率90%,hplc纯度98%)。所获得的化合物d-9的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:8.37(d:2h)、8.25-8.20(m:2h)、7.97(d:2h)、7.88(t:3h)、7.77(dd:1h)、2.35(s:3h)、2.30(s:3h)、1.98-2.22(m:4h)、0.62-0.74(m:10h)
[合成例d-10]化合物d-10的合成
通过以下的合成方法,合成芴系化合物(化合物d-10)。
在利用与合成例1相同的方式所获得的9,9-二丙基芴50.0重量份中加入二氯甲烷500重量份和无水氯化铝39.9重量份后,加入巴豆酰氯21.3重量份,于室温搅拌2小时。加入无水氯化铝39.9重量份、2-噻吩磺酰氯54.7重量份,并于室温搅拌24小时。将反应液注入至冰水中而分液后,水洗2次,并将油层浓缩。利用甲醇使所获得的固体悬浮并进行过滤,获得化合物d-10a15.8重量份(产率17%,hplc纯度90%)。
在化合物d-10a15重量份中加入乙醇150重量份、羟胺盐酸盐5.6重量份和三乙胺6.6重量份,升温至78℃并搅拌5小时。将反应液冷却至室温后滴加至水中,过滤所析出的晶体,获得化合物d-10b16.2重量份(产率98%,hplc纯度96%)。
在化合物d-10b15重量份中加入乙酸乙酯150重量份而溶解后,加入乙酸酐20.9重量份,加温至35℃并搅拌5小时。加入水而分液,利用5%碳酸氢钠水溶液、水进行清洗。将油层浓缩,利用甲醇进行重结晶,由此,获得15.5重量份的化合物d-10(产率83%,hplc纯度97%)。所获得的化合物d-10的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:8.02(d:1h)、7.93-7.98(m:1h)、7.84-7.77(m:4h)、7.72(dd:1h)、7.64(dd:1h)、7.08-7.11(m:1h)、4.84(brs:1h)、3.15-3.30(m:2h)、2.33(s:3h)、2.24(s:3h)、1.95-2.10(m:4h)、1.80(s:3h)、1.13-1.24(m:3h)、0.50-0.72(m:10h)
[合成例d-11]化合物d-11的合成
通过以下的合成方法,合成芴系化合物(化合物d-11)。
向反应容器中添加四氢呋喃500.0重量份和叔丁醇钾68.7重量份,并添加2-溴芴50.0重量份。接着,向反应容器中滴加溴丙烷56.1重量份。将该溶液加热至40℃并搅拌3小时。将该反应液冷却至室温后注入乙酸乙酯、水而分液,将油层水洗2次。将油层浓缩,获得2-溴-9,9-二丙基芴67.2重量份(产率100%,hplc纯度92%)。
将所获得的2-溴-9,9-二丙基芴50.0重量份、二氯甲烷500.0重量份和无水氯化铝30.4重量份添加至反应容器中,冷却至0℃。滴加巴豆酰氯20.6重量份,加温至室温并搅拌4小时。将反应液注入至冰水中而分液,利用5%碳酸氢钠水溶液、水进行清洗。将油层浓缩,通过硅胶柱层析法进行离析精制,获得化合物d-11a15.1重量份(产率25%,hplc纯度80%)。
在所获得的化合物d-11a15.0重量份中添加乙醇150.0重量份、羟胺盐酸盐10.5重量份和无水乙酸钠12.4重量份,加热至40℃并搅拌5小时。将该反应液冷却至室温,注入水、乙酸乙酯而分液,利用水、稀盐酸对油层进行清洗。将油层浓缩,获得化合物d-11b10.9重量份(产率65%,hplc纯度83%)。
在所获得的化合物d-11b10.0重量份中加入乙酸乙酯100.0重量份和乙酸酐18.3重量份,加温至40℃并搅拌5小时。将反应液冷却至室温后,加入水而分液,利用水、5%碳酸氢钠水溶液清洗油层后进行浓缩。通过硅胶柱层析法对所获得的固体进行离析精制,获得7.1重量份的化合物d-11(产率55%,hplc纯度96%)。所获得的化合物d-11的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:7.67-7.78(m:3h)、7.58(d:1h)、7.45-7.50(m:2h)、4.82(brs:1h)、3.14-3.32(m:2h)、2.32(s:3h)、2.24(s:3h)、1.92-2.30(m:4h)、1.89(s:3h)、1.2(d:3h)、0.55-0.72(m:10h)
[合成例d-12]化合物d-12的合成
通过以下的合成方法,合成芴系化合物(化合物d-12)。
在利用与合成例d-3相同的方式所获得的2-硝基-9,9-二丙基芴50.0重量份中加入二氯甲烷500重量份和无水氯化铝45.1重量份后,加入4-氯丁酰氯47.7重量份,于室温搅拌2小时。将反应液注入至冰水中而分液后,将油层水洗2次,并进行浓缩。利用甲醇使所获得的固体悬浮并进行过滤,获得化合物d-12a50.8重量份(产率100%,hplc纯度98%)。
在化合物d-12a20.0重量份中加入乙醇200重量份、羟胺盐酸盐8.7重量份和三乙胺10.3重量份,于60℃搅拌3小时。将反应液注入至水中,加入乙酸乙酯而分液,用水清洗2次后,将油层浓缩干燥固化。利用甲醇将所获得的固体重结晶,获得化合物d-12b25.6重量份(产率100%,hplc纯度92%)。
在化合物d-12b25重量份中加入乙酸乙酯250重量份而溶解后,加入乙酸酐18.5重量份,于室温搅拌5小时。加入水而分液,利用5%碳酸氢钠水溶液、水进行清洗。将油层浓缩,通过硅胶柱层析法对所获得的固体进行离析精制,获得17.9重量份的化合物d-12(产率65%,hplc纯度98%)。所获得的化合物d-12的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:8.28(dd:1h)、8.23(d:1h)、7.79-7.86(m:4h)、3.62(t:2h)、3.12(t:2h)、2.31(s:3h)、2.01-2.14(m:6h)、0.56-0.72(m:10h)
[合成例d-13]化合物d-13的合成
通过以下的合成方法,合成芴系化合物(化合物d-13)。
在合成例d-12中获得的化合物d-12a20重量份中加入四氢呋喃200重量份、浓盐酸78.1重量份和亚硝酸异戊酯8.8重量份,于室温搅拌5小时。将反应液注入至水中,加入乙酸乙酯而分液。用水清洗2次后,将油层浓缩,获得化合物d-13b20.8重量份(产率97%,hplc纯度88%)。
在化合物d-13b20重量份中加入乙酸乙酯200重量份而溶解后,加入乙酸酐14.8重量份,于室温搅拌16小时。加入水而分液,利用5%碳酸氢钠水溶液、水进行清洗。将油层浓缩,通过硅胶柱层析法对所获得的油状物进行离析精制,获得14.1重量份的化合物d-13(产率62%,hplc纯度98%)。所获得的化合物d-13的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:8.29(dd:1h)、8.25(d:1h)、8.17-8.21(m:2h)、7.88(dd:2h)、3.83(t:2h)、3.36-3.41(m:2h)、2.31(s:3h)、2.00-2.12(m:4h)、0.58-0.72(m:10h)
[合成例d-14]化合物d-14的合成
通过以下的合成方法,合成芴系化合物(化合物d-14)。
在由合成例d-2所获得的化合物d-12a20重量份中加入四氢呋喃200重量份、碘化钾2.1重量份和4-氯苯硫醇7.6重量份,于室温一面搅拌一面加入氢氧化钠2.1重量份。将混合液加温至50℃并搅拌2小时后,冷却至室温,加入水、乙酸乙酯而分液。利用水、稀盐酸进行清洗后,将油层浓缩,通过硅胶柱层析法对所获得的产物进行离析精制,获得化合物d-14a16.0重量份(产率63%,hplc纯度93.8%)。
在化合物d-14a15重量份中加入乙醇150重量份、羟胺盐酸盐5.1重量份和三乙胺6.1重量份,加温至60℃并搅拌10小时后,冷却至室温。向反应液中加入水、乙酸乙酯而分液。用水清洗2次后,将油层浓缩,获得化合物d-14b15.4重量份(产率100%,hplc纯度87%)。
在化合物d-14b15重量份中加入乙酸乙酯150重量份和乙酸酐8.8重量份,于室温搅拌5小时。加入水而分液,利用5%碳酸氢钠水溶液、水进行清洗后将油层浓缩。通过硅胶柱层析法对所获得的固体进行离析精制,获得10.5重量份的化合物d-14(产率65%,hplc纯度98%)。所获得的化合物d-14的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:8.29(dd:1h)、8.22(d:1h)、7.71-7.85(m:4h)、7.20-7.27(m:4h)、3.07(t:2h)、2.98(t:2h)、2.27(s:3h)、1.85-2.08(m:6h)、0.55-0.72(m:10h)
[合成例d-15]化合物d-15的合成
通过以下的合成方法,合成芴系化合物(化合物d-15)。
在由合成例d-14所获得的化合物d-14a20重量份中加入四氢呋喃200重量份、28%甲醇钠的甲醇溶液9.5重量份和亚硝酸异戊酯5.8重量份,于室温搅拌2小时。将反应液注入至水中,加入乙酸乙酯而分液。用水清洗2次后,将油层浓缩,获得化合物d-15b17.3重量份(产率82%,hplc纯度65%)。
在化合物d-15b15重量份中加入乙酸乙酯150重量份而溶解后,加入乙酸酐8.6重量份,于室温搅拌4小时。加入水而分液,利用5%碳酸氢钠水溶液、水进行清洗。将油层浓缩,通过硅胶柱层析法对所获得的油状物进行离析精制,获得5.7重量份的化合物d-15(产率36%,hplc纯度100%)。所获得的化合物d-15的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:8.29(dd:1h)、8.25(d:1h)、8.16-8.21(m:2h)、7.88(dd:2h)、7.30(d:4h)、3.25(m:4h)、2.21(s:3h)、2.00-2.12(m:4h)、0.58-0.72(m:10h)
[合成例d-16]化合物d-16的合成
将溴丙烷变更为苄基溴,除此以外,利用与合成例4相同的方式合成化合物d-16。所获得的化合物d-16的产率为10%,hplc纯度为98%。所获得的化合物的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:7.93(s:1h)、7.75(d:1h)、7.70(s:1h)、7.60(d:1h)、7.40-7.50(m:3h)、7.28-7.35(m:3h)、6.85-7.00(m:6h)、6.40(d:4h)、3.40(q:4h)、2.42(s:3h)、2.34(s:3h)、2.31(s:3h)
[合成例d-17]化合物d-17的合成
通过以下的合成方法,合成芴系化合物(化合物d-17)。
在利用与合成例1相同的方式所获得的9,9-二丙基芴20.0重量份中加入二氯甲烷200重量份和无水氯化铝12.8重量份后,加入1-萘甲酰氯18.3重量份,于室温搅拌2小时。将反应液注入至冰水中而分液后,水洗2次,并将油层浓缩。利用甲醇使所获得的固体悬浮并进行过滤,获得化合物d-17a35.9重量份(产率100%,hplc纯度98%)。
在化合物d-17a30.0重量份中加入乙醇300重量份、羟胺盐酸盐37.1重量份和无水乙酸钠43.8重量份,于78℃搅拌24小时。将反应液冷却后注入至水中,加入乙酸乙酯而分液。用水清洗2次后,将油层浓缩。利用甲醇将所获得的固体重结晶,获得化合物d-17b25.0重量份(产率81%,hplc纯度98%)。
在化合物d-17b20重量份中加入乙酸乙酯200重量份而溶解后,加入乙酸酐13.2重量份,于室温搅拌6小时。加入水而分液,利用5%碳酸氢钠水溶液、水进行清洗。将油层浓缩,利用甲醇将所获得的固体重结晶,获得17.6重量份的化合物d-17(产率81%,hplc纯度97%)。所获得的化合物d-17的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:7.96(q:2h)、7.81(s:1h)、7.28-7.70(m:11h)、1.85-2.00(m:7h)、0.62(d:10h)
[合成例d-18]化合物d-18的合成
通过以下的合成方法,合成芴系化合物(化合物d-18)。
向反应容器中加入芴25.0重量份和经脱水的四氢呋喃300.0重量份,利用氮气进行置换后冷却至-20℃。加入正丁基锂(1.6m己烷溶液)59.7重量份并缓慢加温至室温,其后搅拌1小时。将反应液冷却至-78℃,加入1,1,1-三氟-3-碘丙烷31.0重量份,缓慢加温至室温后搅拌1小时。再次冷却至-78℃并加入正丁基锂(1.6m己烷溶液)59.7重量份,加温至室温,其后搅拌1小时。再冷却至-78℃,加入1,1,1-三氟-3-碘丙烷31.0重量份,加温至室温,并搅拌1小时。在反应液中加入90%乙酸后,加入饱和食盐水和己烷而分液。对油层进行水洗并浓缩。通过硅胶柱层析法对所获得的固体进行离析精制,获得9,9-双(3,3,3-三氟丙基)-9h-芴28.5重量份(产率66%,hplc纯度98%)。
在无水氯化铝14.0重量份中加入二氯甲烷250重量份,一面进行搅拌一面加入乙酰氯6.6重量份,进行冰浴冷却。在该混合液中添加将9,9-双(3,3,3-三氟丙基)-9h-芴25.0重量份溶解于二氯甲烷25.0重量份中而获得的混合液,加温至室温并搅拌1小时。将反应液注入至冰水中而分液后,水洗2次,并将油层浓缩。利用甲醇将所获得的固体重结晶,获得化合物d-18a25.9重量份(产率93%,hplc纯度98%)。
在化合物d-18a25.0重量份中加入乙醇250重量份、羟胺盐酸盐17.4重量份和无水乙酸钠20.5重量份,加温至40℃并搅拌6小时。向反应液中注入水后过滤所析出的晶体,获得化合物d-18b25.2重量份(产率97%,hplc纯度99%)。
在化合物d-18b20.0重量份中加入乙酸乙酯200重量份和乙酸酐14.7重量份,于室温搅拌24小时。加入水而分液,利用水进行清洗后,将油层浓缩。利用甲醇将所获得的固体重结晶,获得21.6重量份的化合物d-18(产率98%,hplc纯度99%)。所获得的化合物d-18的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:7.72-7.86(m:4h)、7.36-7.47(m:3h)、2.46(s:3h)、2.22-2.39(m:7h)、1.16-1.40(m:4h)
[合成例d-19]化合物d-19的合成
通过以下的合成方法,合成芴系化合物(化合物d-19)。
向反应容器中加入叔丁醇钾60.8重量份和四氢呋喃300重量份,冷却至0℃。将芴30重量份溶解于四氢呋喃90重量份中,并滴加至叔丁醇钾溶液中。于0℃搅拌10分钟后,滴加溴乙酸叔丁酯105.6重量份,于0℃搅拌1小时后加温至室温,再搅拌1小时。加入乙酸乙酯、水而分液后,将油层浓缩,获得化合物d-19a71.2重量份(产率100%,hplc纯度93%)。
向四氢呋喃500重量份中加入氢化铝锂13.0重量份,冷却至0℃,并滴加溶解于四氢呋喃100重量份中的化合物d-19a70重量份。加温至室温并搅拌1小时后,加温至40℃,再搅拌1小时。将反应液冷却至室温后,加入饱和罗谢耳盐(rochellesalt)水溶液进行骤冷而分液后,利用稀盐酸清洗油层后进行浓缩,获得化合物d-19b29.8重量份(产率60%,hplc纯度98%)。
将化合物d-19b25.0重量份溶解于四氢呋喃200重量份中,冷却至0℃后,加入氢化钠(60%油分散液)9.8重量份,并搅拌10分钟。加入碘甲烷30.7重量份,加温至室温并搅拌1小时。加入90%乙酸后,加入乙酸乙酯、水而分液,利用饱和食盐水清洗油层后进行浓缩。利用甲醇将所获得的固体重结晶,获得化合物d-19c27.8重量份(产率100%,hplc纯度100%)。
在无水氯化铝17.7重量份中加入二氯甲烷250重量份,加入乙酰氯8.3重量份,进行冰浴冷却。在该混合液中添加将化合物d-19c25.0重量份溶解于二氯甲烷25.0重量份中而获得的混合液,加温至室温并搅拌1小时。将反应液注入至冰水中而分液,将油层水洗2次并进行浓缩。利用甲醇将所获得的固体重结晶,获得化合物d-19d22.4重量份(产率78%,hplc纯度98%)。
在化合物d-19d20.0重量份中加入乙醇200重量份、羟胺盐酸盐17.1重量份和无水乙酸钠20.2重量份,加温至40℃并搅拌24小时。向反应液中注入水后过滤所析出的晶体,获得化合物d-19e19.4重量份(产率93%,hplc纯度99%)。
在化合物d-19e15.0重量份中加入乙酸乙酯150重量份和乙酸酐13.5重量份,于室温搅拌3小时。加入水而分液,利用水进行清洗后将油层浓缩。利用甲醇将所获得的固体重结晶,获得12.4重量份的化合物d-19(产率74%,hplc纯度100%)。所获得的化合物d-19的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:7.68-7.85(m:4h)、7.33-7.50(m:3h)、3.00(s:6h)、2.66(q:4h)、2.45(s:3h)、2.38(q:4h)、2.28(s:3h)
[合成例d-20]化合物d-20的合成
将乙酸酐变更为苯甲酰氯,除此以外,利用与合成例1相同的方式合成化合物d-20。所获得的化合物d-20的产率为30%,hplc纯度为98%。所获得的化合物的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:8.25(d:2h)、7.99(d:1h)、7.82(d:1h)、7.74(d:1h)、7.69(dd:2h)、7.33-7.55(m:7h)、7.23(d:1h)、2.21(s:3h)、2.00-2.12(m:4h)、0.54-0.74(m:10h)
[合成例d-21]化合物d-21的合成
将乙酸酐变更为3-(甲硫基)丙酰氯,除此以外,利用与合成例1相同的方式合成化合物d-21。所获得的化合物d-21的产率为25%,hplc纯度为98%。所获得的化合物的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:8.21-8.28(m:2h)、7.86(s:1h)、7.81(d:1h)、7.73(d:1h)、7.29-7.45(m:4h)、7.14(d:1h)、2.58-2.69(m:4h)、2.17(s:3h)、1.98-2.07(m:7h)、0.55-0.71(m:10h)
[合成例d-22]化合物d-22的合成
将乙酸酐变更为噻吩-2-乙酰氯,除此以外,利用与合成例1相同的方式合成化合物d-22。所获得的化合物d-22的产率为30%,hplc纯度为99%。所获得的化合物的结构通过1h-nmr谱(cdcl3)进行确认。以下表示1h-nmr谱。
δ[ppm]:8.25(dd:1h)、8.21(d:1h)、7.85(d:1h)、7.79(d:1h)、7.70(d:1h)、7.36-7.43(m:2h)、7.30(d:2h)、7.16(dd:1h)、7.08(d:1h)、6.88(q:1h)、6.73(d:1h)、3.82(s:2h)、2.07(s:3h)、2.01(t:4h)、0.52-0.70(m:10h)
[合成例d-23]化合物d-23的合成
将乙酸酐变更为环己甲酰氯,除此以外,利用与合成例1相同的方式合成化合物d-23。所获得的化合物d-23的产率为30%,hplc纯度为97%。
[合成例d-24]化合物d-24的合成
将乙酸酐变更为3-氯丙酰氯,除此以外,利用与合成例1相同的方式合成化合物d-24。所获得的化合物d-24的产率为30%,hplc纯度为98%。
[合成例d-25]化合物d-25的合成
将乙酸酐变更为甲氧基乙酰氯,除此以外,利用与合成例1相同的方式合成化合物d-25。所获得的化合物d-25的产率为30%,hplc纯度为98%。
[合成例d-26]化合物d-26的合成
将乙酸酐变更为苯基乙酰氯,除此以外,利用与合成例1相同的方式合成化合物d-26。所获得的化合物d-26的产率为30%,hplc纯度为99%。
[物性评价]
对上述合成例中获得的芴系化合物进行以下的物性评价。并且,为了进行比较,对以下的参考例1和参考例2的光聚合引发剂也同样地进行物性评价。将结果示于表1。
(参考例1)
作为光聚合引发剂,使用下述式所示的化合物c-1。
(参考例2)
作为光聚合引发剂,使用下述式所示的化合物c-2。
(吸光系数)
制备化合物1、2、4、6、8、9、11、12、13、15、16、d-1、d-3、d-4、d-7、d-8、d-9、d-12、d-14、d-15、d-20、c-1和c-2的0.001%(wt/vol)四氢呋喃溶液,利用分光光谱仪(hitachihigh-technologies公司制造,商品名“u-3900h”)测定吸光度。根据由分光光谱仪所获得的吸收光谱,读取出波长280nm~400nm时的最大吸收波长(λmax)。(熔点、分解点)
使用5.0mg的化合物1、2、4、6、8、9、11、12、13、15、16、d-1、d-3、d-4、d-7、d-8、d-9、d-12、d-14、d-15、d-20、c-1和c-2,通过热分析装置(tg-dta)(rigaku公司制造,商品名“thermoplusevotg8120”)进行测定。
(溶解度)
在室温下将化合物1、4、8、15、16、d-1、d-3、d-4、d-7、d-8、d-9、d-12、d-20、c-1和c-2分别溶解于丙二醇单甲醚(pgme)、丙二醇单甲醚乙酸酯(pgmea)、乳酸乙酯100重量份中,测定光聚合引发剂相对于各溶剂的溶解量。针对溶解量,依据下述评价基准评价溶解性。其中,关于化合物2、9、11、12、13、d-14和d-15,由于所获得的化合物为液体,故而未测定溶解度。
a:溶解10重量份以上
b:溶解在5重量份以上且低于10重量份的范围
c:溶解在2重量份以上且低于5重量份的范围
d:溶解低于2重量份
[表1]
(透明性)
由于光聚合引发剂需求透明性,故而对曝光后因光聚合引发剂引起的着色的影响进行确认。具体而言,如下所述,通过测定吸光度来评价光聚合引发剂本身在曝光前后的着色(变色)程度。制备合成例4的化合物4的40g/l四氢呋喃溶液,将该溶液装入光程长度1cm的带盖的石英制uv比色皿(12.5×12.5×58mm)中。使用分光光谱仪(hitachihigh-technologies公司制造,商品名“u-3900h”),测定曝光前该溶液的吸收光谱。其后,使用曝光装置(ushio电机株式会社制造,商品名“multilight”(ml-251a/b)、光学单元(pm25c-100)),对uv比色皿的石英面垂直地照射365nm的紫外线850mj/cm2,再次测定该溶液的吸收光谱。反复进行该操作,测定因紫外线的照射所引起的该溶液的吸光度变化。并且,使用参考例1的化合物c-1代替合成例4的化合物4,实施同样的实验。图1(a)是表示对化合物4的测定结果的曲线图,图1(b)是表示对化合物c-1的测定结果的曲线图。
图1(a)的曲线图的横轴表示吸收光谱的测定波长(nm),纵轴表示该波长下的吸光度(abs.)。以实线表示紫外线照射前的测定结果,以点线表示照射总量850mj/cm2的紫外线后的测定结果,以虚线表示照射总量1700mj/cm2的紫外线后的测定结果,以圆点实线表示照射总量2550mj/cm2的紫外线后的测定结果。针对图1(b)的曲线图也相同。若将图1(a)所示的测定结果与图1(b)所示的测定结果进行比较,则明显可知化合物4在曝光前后吸光度的上升程度低于化合物c-1在曝光前后吸光度的上升程度。因此,显示出化合物4因曝光所产生的着色的影响较小。
透明光敏性组合物的评价
[实施例1]
在室温下将合成例1中获得的芴系化合物(化合物1)0.192重量份(0.4mmol)、含酸基的丙烯酸酯(daicel-allnex株式会社制造的商品名“cyclomerp(aca)200m”、使用pgmea将固态成分含量调节为20重量%)13.2重量份、二季戊四醇六丙烯酸酯(日本化药株式会社制造,商品名“kayaraddpha”)0.40重量份和pgmea6.0重量份进行搅拌、混合30分钟后,利用5μm的薄膜过滤器进行过滤,获得光敏性组合物。
[实施例2~10和实施例2-1~2-10]
除了将所使用的芴系化合物及其使用量设为表2所记载的那样以外,利用与实施例1相同的方式获得光敏性组合物。其中,作为光聚合引发剂的芴系化合物的使用量,在各实施例和比较例中使用成为相同摩尔量的量。
(比较例1和2)
除了将光聚合引发剂及其使用量设为表2所记载的那样以外,利用与实施例1相同的方式获得光敏性组合物。
[表2]
[评价1]
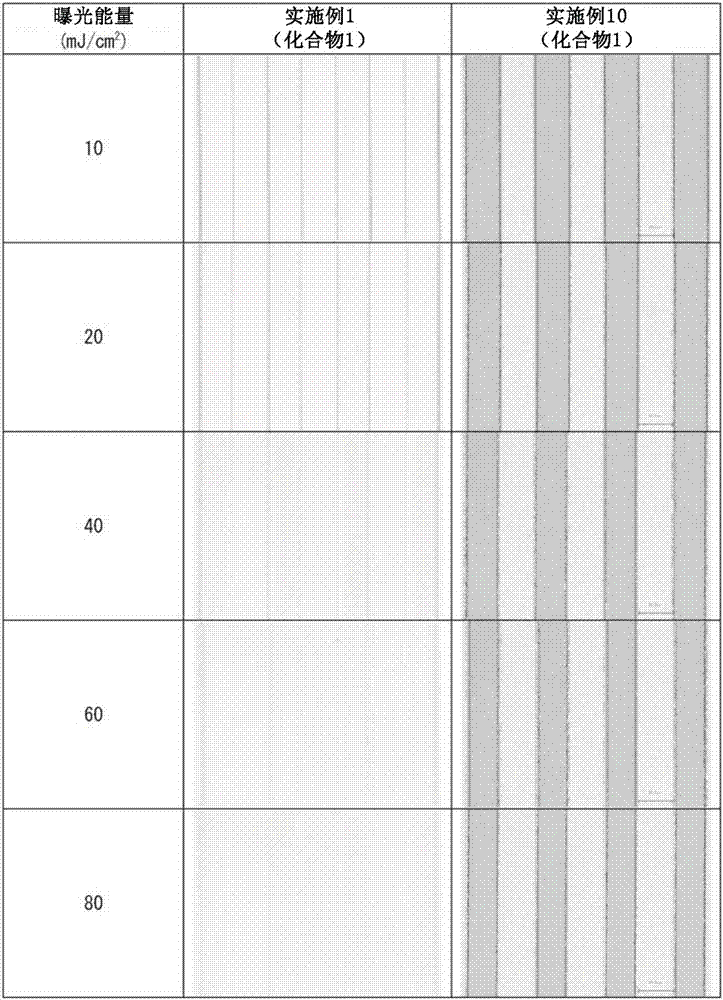
使用旋涂机(株式会社共和理研制造,商品名“k-359sd1”),将实施例1~9、实施例2-1~2-10和比较例1中获得的光敏性组合物涂布于玻璃基板上,使得干燥膜厚为1.0μm。使用送风干燥机,对涂布后的玻璃基板于90℃干燥10分钟,形成涂膜(光敏层)。接着,经由负像掩模(掩模宽度:20μm),使用高压水银灯(karlsuss公司制造,商品名“maskaligner”),以5mj/cm2、10mj/cm2、20mj/cm2、40mj/cm2、60mj/cm2、80mj/cm2对该膜进行曝光。接着,将其浸渍于0.1重量%四甲基氢氧化铵(tmah)水溶液中,其后利用纯水进行冲洗,对残存的固化膜进行下述评价。将结果示于表3。其中,比较例1的组合物,在曝光能量为10mj/cm2时未能形成固化膜。将使用实施例1、2、5、7、比较例1、实施例2-1、2-2、2-3、2-7和2-8的光敏性组合物所获得的透明固化膜的显微镜照片示于图2~11。
(20μm图案线宽)
使用彩色3d激光显微镜(株式会社keyence制造,商品名“vk-x110”),对各曝光能量下的图案影像进行放大观察(×2000),测定图案的宽度。线宽的值越大表示灵敏度越高。
[表3]
含有本发明的芴系化合物的光敏性组合物即便曝光能量为10mj/cm2也能形成图案。而使用现有的光聚合引发剂的光敏性组合物即比较例1,在曝光能量为10mj/cm2的情况下未能形成图案。进而,在曝光能量为80mj/cm2的情况下,实施例1~7、以及实施例2-1、2-2、2-3、2-7和2-8的光敏性组合物均具有比比较例1的光敏性组合物优异的灵敏度。其中,实施例1和2、以及实施例2-2的光敏性组合物具有特别优异的灵敏度。
[评价2]
(组合物的平均透射率)
针对实施例1~9、实施例2-1~2-10和比较例1~2中获得的光敏性树脂组合物,分别使用分光光谱仪(hitachihigh-technologies公司制造,商品名“u-3900h”,石英比色皿,光程长度:1cm)测定400nm~700nm时的平均透射率(%)。将结果示于表4。
(透明固化膜的透射率)
使用实施例1~9、实施例2-1~2-10、以及比较例1和2中获得的光敏性组合物,将曝光能量设为80mj/cm2,除此以外,利用与评价1相同的方式形成透明固化膜。针对所获得的透明固化膜,使用分光光谱仪(hitachihigh-technologies公司制造,商品名“u-3900h”,石英比色皿,光程长度:1cm)测定400nm时的透射率(%)、以及400~700nm时的平均透射率(%)。400nm时的透射率越高,表示黄色的着色越少。并且,涂膜的透射率越高,表示所形成的图案的透射性越高。将结果示于表4。
[表4]
利用使用了本发明的芴系化合物的实施例1~9和实施例2-1~2-10的透明固化膜中,获得了具有实用上充分的透明性的涂膜。尤其是在使用实施例3、5、6、7、8和2-5的光敏性组合物时,获得了具有高透明性的透明固化膜。
黑色光敏性组合物的评价
[实施例10]
在室温下将合成例1中获得的芴系化合物(化合物1)0.196重量份(0.4mmol)、cardo树脂(使用pgmea将固态成分含量调节为20重量%)5.9重量份、二季戊四醇六丙烯酸酯(日本化药株式会社制造,商品名“kayaraddpha”)0.4重量份、碳黑的pgmea分散液(固态成分浓度:20重量%)10重量份和pgmea3.5重量份混合,并搅拌30分钟,利用5μm薄膜过滤器进行过滤,获得光敏性组合物。
[实施例11~15和实施例2-11~2-20]
除了将所使用的芴系化合物及其使用量设为表5所记载的那样以外,利用与实施例10相同的方式获得光敏性组合物。
(比较例3)
除了将光聚合引发剂及其使用量设为表5所记载的那样以外,利用与实施例10相同的方式获得光敏性组合物。
[表5]
[评价3]
使用旋涂机(株式会社共和理研制造,商品名“k-359sd1”),将实施例10~15、实施例2-11~2-20和比较例3中获得的光敏性组合物涂布于玻璃基板上,使得干燥膜厚为1.0μm。使用送风干燥机,将涂布后的玻璃基板于90℃干燥10分钟,形成涂膜(光敏层)。接着,经由负像掩模(掩模宽度:20μm),使用高压水银灯(karlsuss公司制造,商品名“maskaligner”),以10mj/cm2、20mj/cm2、40mj/cm2、60mj/cm2、80mj/cm2对该膜进行曝光。接着,将其浸渍于0.1重量%四甲基氢氧化铵(tmah)水溶液中,其后利用纯水进行冲洗,对残存的固化膜进行下述评价。将结果示于表6~8。另外,将使用实施例10、11和比较例3的光敏性组合物所获得的黑色固化膜的显微镜照片示于图2、3和6,并将使用实施例2-11、2-13、2-14、2-17和2-18的光敏性组合物所获得的黑色固化膜的显微镜照片示于图7~11。
(20μm图案线宽)
使用彩色3d激光显微镜(株式会社keyence制造,商品名“vk-x110”),对各曝光能量下的图案影像进行放大观察(×2000),测定图案的宽度。线宽的值越大,表示灵敏度越高。
(图案的直线性)
通过目测评价各曝光能量下的图案影像的外观。将形成了良好的直线形图案的评价为良好,将图案影像变形或端部观察到凹凸的评价为不良。
(图案的剥离)
通过目测观察在0.1%tmah水溶液中浸渍显影后的固化膜的外观。将无外观变化且也无固化膜的剥离的评价为良好。
(残渣)
通过目测评价在0.1%tmah水溶液中浸渍显影后在未曝光部分有无涂膜的残存。将没有未曝光部分的涂膜的残存的评价为无。
[表6]
[表7]
[表8]
在20μm图案线宽的评价中,实施例10~15以及实施例2-11~2-20的光敏性组合物在任一曝光能量下均可形成图案。其中,实施例10、11、以及实施例2-11~2-14和2-17~2-20,在全部曝光能量下均显示出比使用现有的光聚合引发剂的比较例3更高的灵敏度。同样地,在图案的直线性、图案的剥离、残渣的评价中,实施例10、11、以及实施例2-11~2-14和2-17~2-20也显示出比使用现有的光聚合引发剂的比较例3更好的结果。
产业上的可利用性
本发明的芴系化合物适合用作光聚合引发剂。由于本发明的芴系化合物具有高灵敏度,故而适合用于各种用途。含有本发明的芴系化合物的光聚合引发剂发挥出在现有的光聚合引发剂同等以上的性能。并且,通过使用灵敏度更高的作为光聚合性引发剂的芴系化合物,即便减少光聚合引发剂的使用量,也能够维持与现有的光聚合引发剂同等的性能,能够降低光敏性组合物制造中的成本。进而,通过使用灵敏度更高的芴系化合物,能够降低反应时的曝光能量,也能够降低能量消耗量。
- 还没有人留言评论。精彩留言会获得点赞!
- 芴系化合物、含有该芴系化合物的光聚合引发剂、以及含有该光聚合引发剂的光敏性组合物的制作方法
- 阳离子光引发剂4-异丁基苯基-4′-甲基苯基碘鎓六氟磷酸盐的制备方法
- 阳离子聚合引发剂体系及其应用和阳离子聚合方法
- 阳离子聚合引发剂体系及其应用和阳离子聚合方法
- 光聚合方法、油墨组、图像形成方法、油墨组合物以及它们中使用的光聚合引发剂及水溶 ...的制作方法
- 热阳离子聚合性组合物、各向异性导电粘接膜、连接结构体及其制造方法
- 一种聚异丁烯中游离氯离子的检测方法
- 通过使用特殊引发剂体系增加聚合反应器产量的制作方法
- 能够使含能量辐射屏蔽物的树脂能量辐射固化的新树脂固化方法、组合物、模塑制品以及 ...的制作方法
- 稳定的有机硼烷聚合反应引发剂和可聚合的组合物的制作方法