一种酶催化与高温水解相结合的制备羟基酪醇的方法与流程
本发明涉及生物化学和医药保健品领域,涉及从天然产物油橄榄叶提取物中制备羟基酪醇的方法,具体为一种酶催化与高温水解相结合的制备羟基酪醇的方法。
背景技术:
油橄榄(oleaeuropaeal.)又名齐墩果,属木犀科木犀榄属常绿乔木,地中海国家,如西班牙、希腊、意大利、突尼斯等为其集中产地,种植面积约占全球种植面积的95%。我国于20世纪60年代开始大面积引种油橄榄树,主要分布在中西部如甘肃、四川等地,面积45万多亩,共有500多万株。每摘取100kg的油橄榄果大约可以得到3-5kg的油橄榄叶。目前油橄榄叶一般会被燃烧或作为有机肥。我国每年因对油橄榄树进行维护剪枝产生的叶子多达60万吨。油橄榄叶被丢弃或焚烧,造成资源的浪费及生态环境的破坏。而油橄榄叶中含有丰富多样的酚类化合物,已知的主要功能性成分有简单酚类化合物、裂环烯醚萜(橄榄苦苷)和木酚素类三类抗氧化剂。其中油橄榄叶中橄榄苦苷的含量可以达到10-17%。
羟基酪醇化学名为3,4-二羟基苯乙醇,分子式c8h10o3,分子量154。它是一种来自橄榄的酚类化合物之一,被认为是天然的最强的抗氧化剂之一。羟基酪醇有很强的清除自由基的能力,展现出许多生物学活性,其中包括抗癌活性、抗炎活性、抗菌活性、抗基因毒性、抗细胞毒素、预防高胆固醇、预防代谢疾病、预防氧化应激、预防消化紊乱等。
游离的羟基酪醇很少存在于自然界中,以酯化物存在于橄榄各个部位的橄榄苦苷水解后可以得到羟基酪醇。由于其制备工艺较为复杂,商品的羟基酪醇的价格一般较为昂贵。利用酸、碱制备羟基酪醇时,因为酸、碱水解对设备的要求高,腐蚀性大,中和麻烦,中和后生成的小分子氯化钠或硫酸钙容易吸附小分子的羟基酪醇,使得后续的分离、纯化较为困难。用化学的方法合成羟基酪醇虽有少量的报道,但合成的成本较高,而且得率较低。因此,通过温和的酶催化反应制备羟基酪醇具有广泛的前景。cn104926615a中报道了利用半纤维素酶制备羟基酪醇的方法,橄榄苦苷(含量38.6%)的降解率为85.28%,羟基酪醇的含量为6.07%(羟基酪醇的得率相当于55.18%)。hamza等利用黑曲霉纤维素酶酶解橄榄叶提取物,羟基酪醇的得率为23.25%。原姣姣等研究了橄榄苦苷(含量81.04%)半纤维素酶解制备羟基酪醇,得到橄榄苦苷的降解率为98.54%,羟基酪醇含量为11.31%(羟基酪醇的得率相当于40.31%)。卜文文等采用β-葡萄糖苷酶水解橄榄叶提取物制备羟基酪醇,ht的得率为54.88%。因此,利用生物酶催化技术,提高羟基酪醇的得率方面有很大的提升空间。
技术实现要素:
发明目的:针对利用生物酶催化技术制备羟基酪醇的过程中,存在得率较低的缺点,本发明提供了一种酶催化与高温水解相结合的制备羟基酪醇的方法,以期获得较高的橄榄苦苷降解率和较高的羟基酪醇得率。
技术方案:为实现上述发明目的,本发明采用的技术方案如下:
一种酶催化与高温水解相结合的制备羟基酪醇的方法,先以富含β-葡萄糖苷酶(bg)的纤维素酶的用量为10-60fpu/g橄榄苦苷对橄榄苦苷进行酶解反应,然后不经处理直接控温80-100℃继续水解24h以上,获得橄榄苦苷的降解率95%以上,羟基酪醇的得率80%以上的羟基酪醇溶液。
所述的酶催化与高温水解相结合的制备羟基酪醇的方法,橄榄苦苷的浓度28-50g/l。
所述的酶催化与高温水解相结合的制备羟基酪醇的方法,富含β-葡萄糖苷酶的纤维素酶在50℃,ph值4.8,150rpm的条件下水解1-12h。
所述的酶催化与高温水解相结合的制备羟基酪醇的方法,所述的富含β-葡萄糖苷酶的纤维素酶中,β-葡萄糖苷酶酶活(采用pnpg法)与滤纸酶活(按照国际标准iupac法测定)之比不小于25。
所述的酶催化与高温水解相结合的制备羟基酪醇的方法,继续水解时间在36-48h。
有益效果:与现有技术相比,本发明采用酶催化和高温水解相结合的方法,从油橄榄叶提取物中制备羟基酪醇,以温和的酶催化进行反应,酶的用量较少,节约成本,得到了较高的橄榄苦苷降解率为95%以上,和羟基酪醇得率为80-90%,特别是羟基酪醇的得率获得显著提高,为工业化生产打下基础。
附图说明
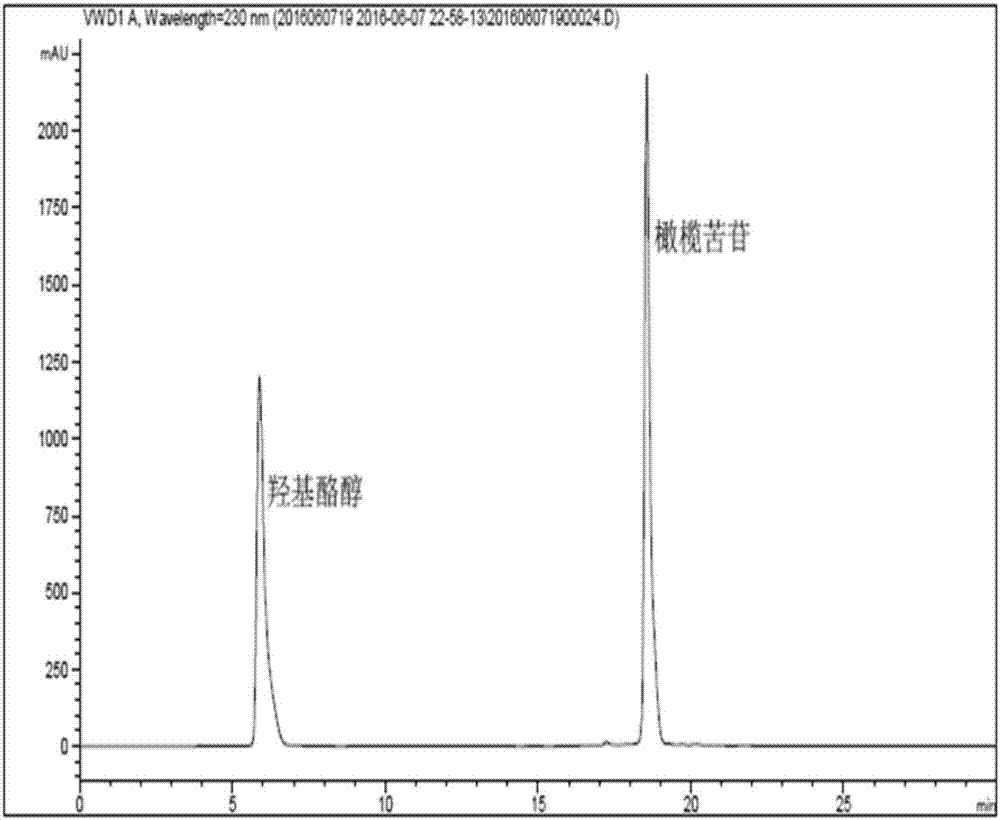
图1是橄榄苦苷和羟基酪醇标准品的hplc色谱图;
图2是50℃不同酶解时间下的橄榄苦苷降解率的变化图;
图3是50℃不同酶解时间下的羟基酪醇得率的变化图;
图4是不同温度条件下的工艺结果图;
图5是不同酶用量的工艺结果图
图6是酶解前的色谱图;
图7是酶解中的色谱图;
图8是酶解后的色谱图;
图9是纤维素酶和嗜热bg酶在不同条件下的橄榄苦苷降解率的变化图;
图10是纤维素酶和嗜热bg酶在不同条件下的羟基酪醇得率的变化图。
具体实施方式
下面结合实施例对本发明做进一步的说明。根据下述实施例,可以更好地理解本发明。实施例中的内容仅仅用于说明本发明,但本发明不局限于这些实施例。
以下实施例中,橄榄苦苷和羟基酪醇的含量采用hplc测定。色谱条件如下:色谱仪:安捷伦高效液相色谱仪1260;色谱柱:zorbaxeclipse,xdb-c18(250×4.6mm,5μm);检测器:紫外检测,波长230nm;流动相:100%甲醇和0.2%磷酸水溶液,采用三段等度洗脱:0-10min,甲醇35%,磷酸水溶液65%,10.1-25min,甲醇55%,磷酸水溶液45%,25.1-30min,甲醇35%,磷酸水溶液65%。流速:0.6ml/min;时间:30min;柱温:30℃;进样体积:10μl。采用从sigma购买的橄榄苦苷和羟基酪醇的标准品配制成混合溶液,以峰面积为纵坐标,橄榄苦苷和羟基酪醇的浓度为横坐标,得到橄榄苦苷的标准曲线:峰面积=26691.75*amt-45.38,r2=0.9999(其中amt指橄榄苦苷的浓度),羟基酪醇的hplc标准曲线:峰面积=23320.01*amt+165.40,r2=0.9998(其中amt指羟基酪醇的浓度)。橄榄苦苷和羟基酪醇标准品的hplc色谱图如图1所示。
以下实施例中,橄榄苦苷的降解率和羟基酪醇的得率计算如下:oe的降解率%=(1-水解后橄榄苦苷的质量/水解前橄榄苦苷的质量)*100,羟基酪醇的得率%=水解后羟基酪醇的质量/(水解前橄榄苦苷的质量*0.285)*100,(其中0.285为羟基酪醇转换为橄榄苦苷的理论转化系数,因为完全降解1mol的橄榄苦苷(540g)可以生成1mol的羟基酪醇(154g),1g的橄榄苦苷得到羟基酪醇的化学计算值为154/540=0.285g。)
β-葡萄糖苷酶的活力采用pnpg(对硝基苯酚-β-d-葡萄糖苷)试剂测定,0.1ml适当稀释的酶液与0.9ml5mmol/lpnpg溶液(分别预热5分钟)混合后,于50℃下保温10min。10min后立即加入2ml1mol/lna2co3溶液终止反应后,再加入10ml的蒸馏水,摇匀。在400nm下测定吸光度。以0.1ml蒸馏水代替酶液作空白对照。(要做2~3个平行样,取平均值)。一个β-葡萄糖苷酶酶活力单位定义为,在标准反应条件下,每分钟水解生成1μmol对硝基苯酚所需要的酶量。
滤纸酶活采用国际理论和应用化学协会(iupac)推荐的标准方法测定,一个滤纸酶活力的国际单位(fpu)等于在标准反应条件下每分钟生成1μmol葡萄糖所需的酶量。
实施例1
取浓度为10.0g/l的橄榄苦苷溶液50ml置于125ml的锥形瓶中,加入10fpu/g橄榄苦苷的富含高活力β-葡萄糖苷酶的纤维素酶(novozyme,β-葡萄糖苷酶酶活与滤纸酶活之比不小于25),50℃酶解12h,然后升高温度到90℃,继续水解36h。酶解结束后,酶解液在8000r/min离心10min。离心后滤液过0.22μm的滤膜,稀释后hplc检测分析,得到橄榄苦苷的降解率为100%,羟基酪醇的得率为88.90%(含量相当于2.53g/l)。
实施例2
量取浓度为12.5g/l的橄榄苦苷溶液50ml置于125ml的锥形瓶中,加入60fpu/g橄榄苦苷的富含高活力β-葡萄糖苷酶的纤维素酶(novozyme,β-葡萄糖苷酶酶活与滤纸酶活之比不小于25),50℃酶解12h,然后升高温度到90℃,继续水解36h。酶解结束后,酶解液在8000r/min离心10min。离心后滤液过0.22μm的滤膜,稀释后hplc检测分析,得到橄榄苦苷的降解率为100%,羟基酪醇的得率为83.89%(含量相当于2.99g/l)。
实施例3
量取浓度为10.0g/l的橄榄苦苷溶液50ml置于125ml的锥形瓶中,加入50fpu/g橄榄苦苷的富含高活力β-葡萄糖苷酶的纤维素酶(novozyme,β-葡萄糖苷酶酶活与滤纸酶活之比不小于25),50℃酶解1h,然后升高温度到90℃,继续水解47h。酶解结束后,酶解液在8000r/min离心10min。离心后滤液过0.22μm的滤膜,稀释后hplc检测分析,得到橄榄苦苷的降解率为100%,羟基酪醇的得率为82.38%(含量相当于2.35g/l)。
实施例4
量取浓度为10.0g/l的橄榄苦苷溶液50ml置于125ml的锥形瓶中,加入40fpu/g橄榄苦苷的富含高活力β-葡萄糖苷酶的纤维素酶(novozyme,β-葡萄糖苷酶酶活与滤纸酶活之比不小于25),50℃酶解12h,然后升高温度到80℃,继续水解36h。酶解结束后,酶解液在8000r/min离心10min。离心后滤液过0.22μm的滤膜,稀释后hplc检测分析,得到橄榄苦苷的降解率为100%,羟基酪醇的得率为83.32%(含量相当于2.37g/l)。
实施例5
量取浓度为5.0g/l的橄榄苦苷溶液50ml置于125ml的锥形瓶中,加入40fpu/g橄榄苦苷的富含高活力β-葡萄糖苷酶的纤维素酶(novozyme,β-葡萄糖苷酶酶活与滤纸酶活之比不小于25),50℃酶解12h,然后升高温度到90℃,继续水解24h。酶解结束后,酶解液在8000r/min离心10min。离心后滤液过0.22μm的滤膜,稀释后hplc检测分析,得到橄榄苦苷的降解率为100%,羟基酪醇的得率为84.54%(含量相当于1.20g/l)。
实施例6
量取浓度为7.0-12.5g/l的橄榄苦苷溶液50ml置于125ml的锥形瓶中,加入10-60fpu/g橄榄苦苷的富含高活力β-葡萄糖苷酶的纤维素酶(novozyme,β-葡萄糖苷酶酶活与滤纸酶活之比不小于25),50℃酶解1-12h,然后升高温度到80-100℃,继续水解24h以上。酶解结束后,酶解液在8000r/min离心10min。然后过0.22μm的滤膜,稀释后,进行hplc检测橄榄苦苷和羟基酪醇的含量。以橄榄苦苷的降解率和羟基酪醇的得率为指标,获得50℃不同的酶解时间、不同的温度、不同的酶用量对橄榄苦苷溶液酶催化和高温水解结合制备羟基酪醇的结果,每次试验进行2次,并取其平均值。
结果如图1-8所示。由图2可知,50℃酶解0.5h、1h、2h、6h、12h后,然后升高温度继续水解,24h时,橄榄苦苷的降解率几乎一样。由图3可知,50℃酶解0.5h、1h、2h、6h、12h后,然后升高温度继续水解,36h后羟基酪醇的得率也基本一致。说明50℃酶解0.5-12h,升高温度继续水解,24h后橄榄苦苷的降解率和36h后羟基酪醇的得率基本一致。由图4可知,随着温度的升高,橄榄苦苷的降解率基本一样,但是羟基酪醇的得率随着温度的升高而增大。由此可知,高温对于羟基酪醇的形成有利。由图5可知,当纤维素酶用量为2fpu/g橄榄苦苷和4fpu/g橄榄苦苷时,橄榄苦苷降解率和羟基酪醇得率明显较低。随着纤维素酶用量的增加,由10fpu/g橄榄苦苷到60fpu/g橄榄苦苷时,橄榄苦苷降解率和羟基酪醇得率基本相同。
图6-8是纤维素酶酶解橄榄苦苷前后的hplc图谱。由图6可以看出,橄榄苦苷溶液富含橄榄橄榄苦苷,其它酚类物质含量很少,几乎不含有羟基酪醇。由图7可知,酶解过程中,橄榄苦苷显著降低,生成许多其它的中间产物,此时,羟基酪醇并不是太多。由图8可知,橄榄苦苷消失,羟基酪醇显著增加。由此可知,酶解前后物质有明显的变化。
对比例1
量取浓度为7.0-12.5g/l的橄榄苦苷溶液50ml置于125ml的锥形瓶中,分别加入80-120unit/g橄榄苦苷的13种酶(表1),在其最适的温度下和ph值下,酶解18-30h。酶解结束后,90℃灭酶5min,酶解液在8000r/min离心10min。然后过0.22μm的滤膜,稀释后,进行高效液相色谱(hplc)检测橄榄苦苷和羟基酪醇的含量。每次试验进行2次,并取其平均值,结果如表1和图9-10所示。
表1酶的种类和来源对油橄榄叶橄榄苦苷酶解效率的影响
由表1可知,13种不同来源的酶在其最适温度和ph值下,进行酶解橄榄苦苷,novozyme纤维素酶酶解时,橄榄苦苷的降解率最高,南京林业大学嗜热β-葡萄糖苷酶酶(bg)解时,羟基酪醇的得率最高。
由图9可知,novozyme纤维素酶在50℃酶解12h,90℃酶解60h和novozyme在50℃酶解12h,添加南京林业大学的嗜热β-葡萄糖苷酶90℃酶解60h的结果基本相同,在24h时橄榄苦苷的降解率均能达到100%。50℃单独添加novozyme纤维素酶和90℃单独添加嗜热β-葡萄糖苷酶的橄榄苦苷降解率均不好。
由图10可知,50℃单独添加novozyme纤维素酶和90℃单独添加嗜热β-葡萄糖苷酶的羟基酪醇的得率都不高,在50%以内。novozyme纤维素酶在50℃酶解12h,90℃酶解60h和novozyme在50℃酶解12h,添加南京林业大学的嗜热β-葡萄糖苷酶90℃酶解60h时羟基酪醇的得率基本相同。所以由图9-10可知,只需要单独使用novozyme纤维素酶一种酶,在50℃酶解12h,升高温度到90℃继续水解,效果最好。
- 还没有人留言评论。精彩留言会获得点赞!