一种饲养层细胞、培养方法及应用与流程
本发明涉及生物工程技术领域,特别涉及一种饲养层细胞、培养方法及应用。
背景技术:
原始生殖细胞(primordialgermcells,pgcs)具备发育全能性,因数量较多,可作为组织工程的新来源。它也是研究基因组印迹与胚胎早期发育关系的最佳材料,还是研究生殖细胞发育分化的体外模型、生产治疗用重组蛋白的理想来源和研究转基因动物遗传操作的有效载体。鸡胚原始生殖细胞(chickenprimordialgermcells,cpgcs)应用研究广泛,相比较桑椹胚和囊胚体外培养获取干细胞优势明显;为基础研究提供了最原始的发育生物学模型;生产克隆动物,降低禽类的保种成本;生产药物蛋白,是生产治疗用重组蛋白极为理想的来源。目前cpgc无饲养层细胞的培养体系尚不完善,饲养层仍然是cpgc体外培养和大量扩增必不可少的因素,因此寻找能有效维持鸡原始生殖细胞未分化生长状态的饲养层细胞成为一个重要课题。
在cpgcs的体外培养中所采用的饲养层主要有sto细胞株、鸡胚胎原代成纤维细胞(pcef)、性腺基质细胞(scs)、小鼠胚胎原代成纤维细胞(pmef)等。成纤维细胞在体外培养条件下存活时间较为有限,一般传至5、6代时便开始衰老,这就决定了必须频繁的进行成纤维细胞的制备,而不同批次制备的饲养层细胞增加了cpgcs培养过程中的不确定性和不稳定性,不利于维持cpgcs的未分化状态。以鼠源细胞作为饲养层时,异源性成分存在未知病原体感染的风险。
技术实现要素:
为了克服现有的饲养层细胞不确定性及不稳定性高,或可能存在未知病原体感染风险的问题,可使用与cpgcs相同来源的鸡骨髓间充质干细胞(chickenbonemarrow-mesenchymalstemcells,cbm-msc)作为cpgcs的饲养层细胞。因为间充质干细胞(mesenchymalstemcells,msc)通过对ⅱ型组织相容性复合基因mhc-ii和其他共刺激分子的低表达,以主要组织相容性复合体(majorhistocompatibilitycomplex,mhc)身份在供体和受体之间抑制t细胞的活动。通过这种机制,免疫排斥问题在使用同种异体msc时显得并不特别重要。
本发明是通过以下技术方案实现的:
一种饲养层细胞的培养方法,包括以下步骤:
1)鸡骨髓间充质干细胞的获取:取1至10天龄的鸡的股骨和胫骨,以ko-dmem培养基冲洗出骨内的骨髓细胞,过筛网制成单细胞悬液,将单细胞悬液放入离心管进行离心,随后弃去上层脂肪等杂质后添加cbm-msc完全培养基进行培养;
2)饲养层的制备:将鸡骨髓间充质干细胞用含有0.02%edta的0.25%浓度的胰蛋白酶进行消化,调整细胞密度为5×105个/ml,注入24孔板制成饲养层,待长成80%-90%汇合时,用丝裂霉素-c消化处理后进行离心,离心后再次调整细胞密度为5×105个/ml,随后接种于培养板中,置于培养箱中以37℃,5%co2的环境条件培养至少24h。
其中,所述cbm-msc培养基成分包括:ko-dmem,胎牛血清,谷氨酰胺,谷丙氨酸二肽,表皮生长因子bfgf和双抗溶液。
由上述培养方法所获得的饲养层细胞可作为鸡原始生殖细胞的饲养层细胞的体外培养,其包括步骤:从鸡的14-16hh阶段胚胎的脉管系统中分离包含鸡胚原始生殖细胞的血液组织,并加入具有如权利要求3所述饲养层细胞的24孔板中,添加cpgcs完全培养基进行培养。所述cpgcs完全培养基成分包括:ko-dmem、胎牛血清、鸡血清、谷丙氨酸二肽补充剂,1×的核苷,1×的非必需氨基酸,100×的β-巯基乙醇,以及人lif生长因子、人scf生长因子和人bfgf生长因子。
与现有技术相比,本发明的有益效果是:
(1)本发明打破了传统的以成纤维细胞作为饲养层的传统方法,避免了多次制备不同代次的成纤维细胞造成的不确定性与不稳定性;
(2)本发明避免了异源细胞作为饲养层后产生的不利影响;
(3)本发明中使用的细胞仍保持在早期胚胎期其扩增能力强和生存周期长;
(4)本发明简化了实验操作步骤,节省了时间,降低实验成本。
附图说明
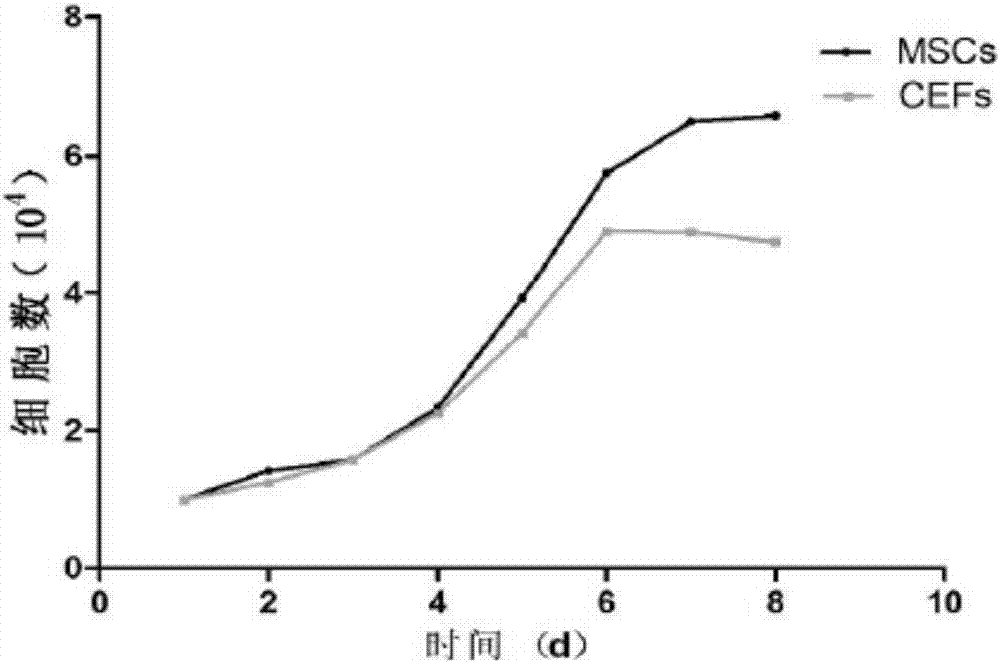
图1是cbm-msc和cefs的生长曲线对比图;
图2为cbm-msc的免疫荧光鉴定结果图;
图3为cbm-msc的成脂成骨分化结果图;
图4为cpgcs的rt-pcr电泳鉴定图;
图5是cpgcs表面标志物的免疫荧光鉴定结果图;
图6是分别以cbm-msc和cefs为饲养层饲养的cpgcs增值情况对比文图。
具体实施方式
下面通过具体实施方式结合附图对本发明作进一步详细说明。但本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
实施例1:cbm-msc的分离培养
(1)鸡骨髓的获取:
1-7日龄鸡脱臼处死,分离鸡大腿和鸡小腿,分离后在75%乙醇中浸泡15min;无菌条件下剥离肌肉和结缔组织,完整的分离股骨、胫骨,将干骸端切除,并将骨髓腔暴露;用注射器吸取无血清的ko-dmem培养基并冲洗骨髓腔,并用加有抗凝剂的离心管收集。
(2)cbm-mscs的原代培养
将冲出的骨髓细胞过筛网制成单细胞悬液,1000rpm/min离心5min,弃去上层脂肪等杂质;收集底部细胞并用pbs洗涤3次,随后重悬并接种到含有cbm-msc培养基中,所述cbm-msc培养基包含ko-dmem培养基,7.5%胎牛血清,2mml谷氨酰胺,2mm谷丙氨酸二肽,10ng/ml表皮生长因子bfgf和104iu/ml双抗溶液。将细胞在保持在37℃的co2培养箱中,在相对湿度为60%-70%、co2占5%的空气气氛中培养。24小时后更换培养基,然后每3天更换一次。
(3)cbm-mscs的传代培养
当原代培养的鸡骨髓细胞达到80%汇合时,弃去细胞培养液;用pbs洗涤三次;用含有0.02%edta的0.25%胰蛋白酶覆盖细胞使细胞得到解离;待细胞回缩变圆并从培养皿上开始脱落时用含有10%胎牛血清的完全培养基终止消化;将混合液反复吹打直至贴壁细胞从培养皿上脱落形成细胞悬液1200rpm下离心5分钟;弃去液体后加入培养基轻柔吹匀使细胞散开,从而对培养的cbm-mscs进行传代培养。
所述ko-dmem培养基、双抗溶液购于gibco公司;所述胎牛血清(fbs)购于hyclone公司;所述谷氨酰胺、谷丙氨酸二肽(glutamax-i)购于invitrogen公司;表皮生长因子bfgf购于peprotech公司。
实施例2:cbm-msc和cefs生长曲线的绘制
分别取第3代的cbm-msc和cefs进行计数根据所得数据绘制生长曲线,以1×104接种至24孔板内,每间隔24小时取三个孔,并记下平均数。得图1所示的生长曲线对比图。
实施例3:cbm-msc的免疫荧光鉴定
(1)取第三代的cbm-mscs,接种在明胶包被的24孔板上,待达到70%融合时,弃去培养液,用pbs洗涤2遍;
(2)在24孔板内加入3.7%多聚甲醛溶液固定30分钟,并用含有5%fbs的pbs洗涤细胞三次(每次洗涤10分钟);
(3)在24孔板内加入透化剂(0.1%tritonx-100,pbs),室温孵育15min后弃去,用pbs洗三遍,每次5min;
(4)在24孔板内加入封闭液(10%fbs:pbs)37℃封闭1h后弃去,pbs洗三遍,每次5min;
(5)在4℃下与针对cd29和cd44(1:200,santacruz,ca)的一抗孵育过夜,除去一抗后,用含有5%fbs的pbs洗涤细胞三次(每次洗涤10分钟);
(6)室温下在黑暗中,加入用fitc标记的二抗(1:500,santacruz,ca)1小时,用pbs洗三遍,每次5min;
(7)最后将样品在避光条件下用dapi孵育5分钟,用pbs洗三遍,每次5min;
加入抗荧光淬灭剂后在荧光显微镜下分析得图2所示的免疫荧光鉴定结果图。
所述dapi购于invitrogen公司。
实施例4:cbm-msc的多向分化
在第三次传代时以相同密度接种至六孔板的其中三个孔内,标记1、2、3,其中1、2两孔为实验组,3孔为对照,当细胞生长至80%的汇合时,去除培养基,然后用pbs洗涤细胞3次。
(1)将脂肪形成分化诱导培养基加入1孔中;
(2)将成骨分化诱导培养基加入2孔中;
(3)将完全培养基中加入3孔对照组细胞中。
培养基每3-4天完全更换。在诱导7天后,观察到1孔出现明显的大量钙结节时通过油红o染色评价脂肪生成能力,在诱导14天后观察到2孔中产生大量油脂时通过茜素红染色测定成骨能力。使用rt-pcr进一步检测成脂和成骨细胞特异性基因。基因序列如下:
在光学显微镜下观察并拍照,得到如图3所示的分化结果图。
所述脂肪形成分化诱导培养基(adm)和成骨分化诱导培养基(odm)购于biowit公司。
实施例5:饲养层的制备
(1)将cbm-mscs用含有0.02%edta的0.25%胰蛋白酶覆盖细胞使细胞得到解离;待细胞回缩变圆并从培养皿上开始脱落时用含有10%胎牛血清的完全培养基终止消化;
(2)1000rpm/min离心5min,弃上清,用含10%血清的新鲜配制的培养基重悬细胞,转移至细胞培养皿中,37℃,5%co2,饱和湿度下培养;
(3)当细胞达到80%-90%汇合时,去掉培养基,用pbs洗涤后加入含10μg/ml丝裂霉素-c的细胞培养基,37℃孵育2h;
(4)去掉培养基,用pbs洗涤cbm-mscs4-6次,以确保完全去除丝裂霉素-c;
(5)用含有0.02%edta的0.25%胰酶消化,制备单细胞悬液,调整细胞密度为5×105个/ml,接种于培养板中,置37℃,5%co2,培养箱中培养24h后可使用;
(6)若实验中发现细胞量过少则补加经丝裂霉素-c处理过的细胞,确保细胞能连成一片,铺成单层且无间隙;
(7)将制备好的饲养层放置在培养箱中备用,使用前去除培养液且用pbs洗5次,换为干细胞培养液。
实施例6:以cbm-mscs作为cpgcs的饲养层细胞的体外培养
从麻黄鸡14-16hh阶段胚胎的脉管系统中分离包括cpgcs(来自循环血的原始生殖细胞)的血细胞,并用加入预处理过含有cbm-mscs饲养细胞的培养皿上培养,完全培养基包括7.5%胎牛血清fbs,2.5%鸡血清cs,2mmglutamax-i补充剂,1×核苷,1×非必需氨基酸,100×β-巯基乙醇,以及以下生长因子的组合:5ng/ml人lif,5ng/ml人scf和10ng/ml人bfgf,余量由ko-dmem培养基补全。
实施例7:cpgcs特异性基因表达
取第2cpgcs培养5天后,收集培养液,离心后弃去上清,得到纯化的cpgcs克隆。采用常规rt-pcr检测干细胞多能性关键基因(nanog、pouv、sox2)和生殖细胞特异性基因(cvh和天azl)的表达。进行rt-pcr分析以确定包括nanog,pouv,sox2,cvh和daz1的pgc特异性基因的表达水平,得到如图4所示的电泳鉴定图。引物序列总结在下表中。
实施例8:cpgcs表面标志物的免疫荧光鉴定
将cpgcs接种到两个孔中,使用抗ssea-1(1:200,santacruz,ca)和抗dazl(1:200,santacruz,ca)抗体检测cpgcs表面标志物ssea-1和dazl。具体步骤参考实施例3,得到cpgcs表面标志物的免疫荧光鉴定结果图。
实施例9:饲养层细胞对cpgcs增殖的影响
(1)纯化后的cpgcs接种于铺有cbm-mscs和ccefs细胞饲养层的培养板上,并以cpgcs完全培养液,置于37.5℃、含5%co2的培养箱中进行培养;
(2)待cpgcs培养5-7天后会形成pgcs克隆,克隆形成即可进行细胞传代;
(3)取第3代的cpgcs按2×105/孔的细胞密度分别接种到含有cbm-mscs细胞饲养层和有ccefs细胞饲养层的两种12孔板中,置于37℃,5%co2培养箱中培养2天;
(4)将12孔板的pgcs克隆消化成单细胞后,转移到96孔板中12孔板每个孔的细胞混匀后接种到96孔板的6个孔中,每孔100μl;
(5)参照cck-8试剂盒说明书,每孔加入10μlcck-8溶液,细胞培养箱内孵育2h;
(6)最后用酶标仪在450nm测定吸光值,得到如图6所示的增值情况对比图。
结果表明,使用以cbm-mscs为饲养层的cpgcs对cpgc标记ssea-1和dazl是阳性的,为了检查pgc特异性基因表达,进行rt-pcr分析检测nanog,pouv和sox2发现均有表达,且生殖细胞特异性基因cvh和dazl也在培养的cpgcs中表达,经鉴定这些cpgcs表达pgc特异表面标志和特异基因,可以证实cbm-msc饲养层组的cpgcs具有良好的未分化状态。且通过cbm-msc和ccefs的生长曲线可明显观测到两种细胞的生长状态呈现出了“s”形,在培养大约3天后,细胞均进入对数生长期,但6天以后,ccefs的数量开始下降,与此同时cbm-msc处于对数增长期,表明在外培养过程中,cbm-msc有着比ccefs更好自我更新和增殖能力。分别以cbm-msc和ccefs作为饲养层细胞饲养cpgcs,可以看出cbm-msc作为饲养层细胞明显数量较多。
sequencelisting
<110>佛山科学技术学院
<120>一种饲养层细胞、培养方法及应用
<130>2017
<160>22
<170>patentinversion3.5
<210>1
<211>18
<212>dna
<213>未知
<400>1
ctgtctgcgatggatgat18
<210>2
<211>18
<212>dna
<213>未知
<400>2
aatagggaggagaaggag18
<210>3
<211>23
<212>dna
<213>未知
<400>3
gacccaccacgtccctgacattg23
<210>4
<211>23
<212>dna
<213>未知
<400>4
ggtttcgtaggctcctcccatcc23
<210>5
<211>18
<212>dna
<213>未知
<400>5
cttgctcgccttcaccac18
<210>6
<211>18
<212>dna
<213>未知
<400>6
ctgtctgcgatggatgat18
<210>7
<211>22
<212>dna
<213>未知
<400>7
cgcttacgctgtttgtgtttcg22
<210>8
<211>21
<212>dna
<213>未知
<400>8
ggtggaggtggttcacttgga21
<210>9
<211>21
<212>dna
<213>未知
<400>9
attgtccaccgcaaatgcttc21
<210>10
<211>24
<212>dna
<213>未知
<400>10
aaataaagccatgccaatctcgtc24
<210>11
<211>24
<212>dna
<213>未知
<400>11
tggtttcagaaccaacgaatgaag24
<210>12
<211>21
<212>dna
<213>未知
<400>12
tgcactggtcacagcctgaag21
<210>13
<211>19
<212>dna
<213>未知
<400>13
gttgtccgggtctggttct19
<210>14
<211>21
<212>dna
<213>未知
<400>14
gtggaaaggtggcatgtagac21
<210>15
<211>24
<212>dna
<213>未知
<400>15
gaagatgcacaactcggagatcag24
<210>16
<211>19
<212>dna
<213>未知
<400>16
gagccgtttggcttcgtca19
<210>17
<211>24
<212>dna
<213>未知
<400>17
gtctgcctgtgcagcatgacattg24
<210>18
<211>25
<212>dna
<213>未知
<400>18
ctttgcccaaagatgccaggaactc25
<210>19
<211>20
<212>dna
<213>未知
<400>19
cgtcaacaacctgccaagga20
<210>20
<211>20
<212>dna
<213>未知
<400>20
ttctttgctccccaggaacc20
<210>21
<211>21
<212>dna
<213>未知
<400>21
attgtccaccgcaaatgcttc21
<210>22
<211>24
<212>dna
<213>未知
<400>22
aaataaagccatgccaatctcgtc24
- 还没有人留言评论。精彩留言会获得点赞!