一种γδT细胞培养方法与流程
本发明涉及生物
技术领域:
,具体涉及一种γδt细胞培养方法。
背景技术:
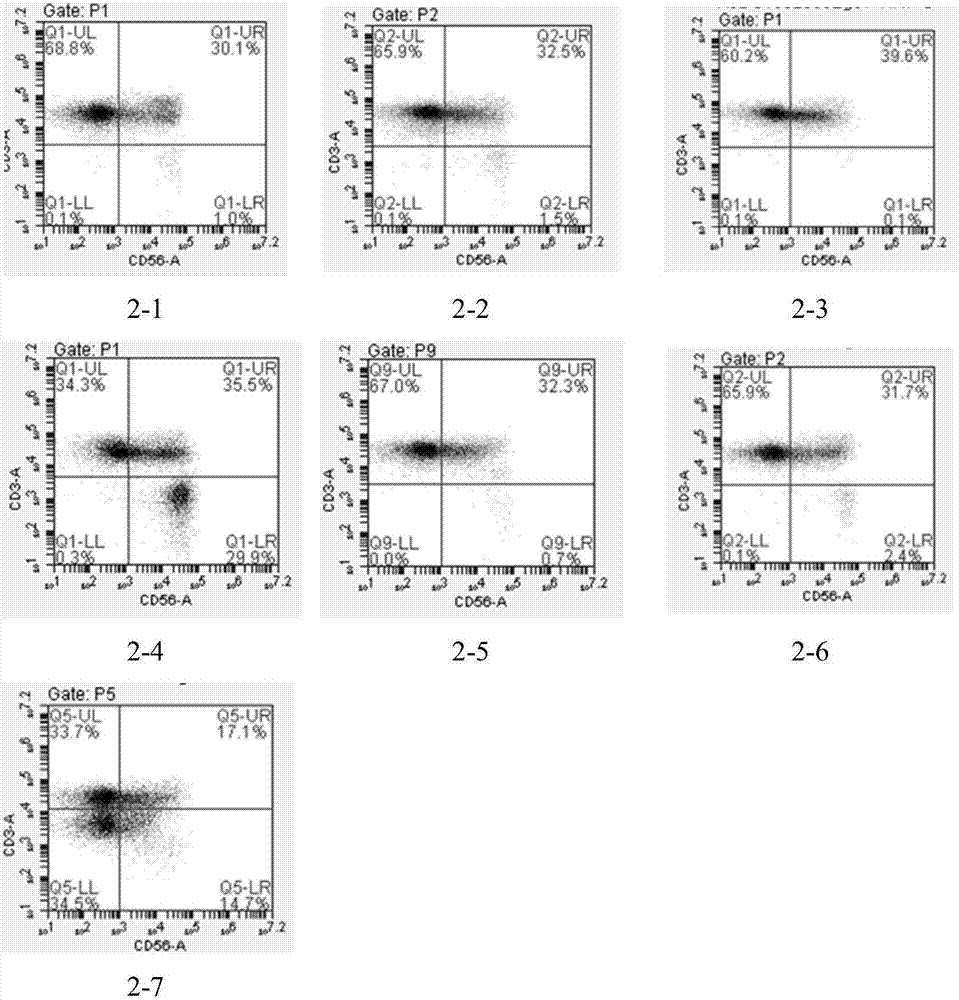
:γδt细胞是一类分布于外周血及粘膜组织的非mhc限制性固有t淋巴细胞,γδt细胞被认为是介于获得性与天然免疫之间的特殊免疫细胞类型,占cd3+t细胞的1%~5%,大部分γδt细胞不表达cd4、cd8分子,有特异性识别抗原功能而无mhc限制,并在机体抗感染和自身免疫疾病及抗肿瘤等过程中起重要作用。在人体的外周血中均能分离得到γδt细胞。在大肠癌、肺癌、乳腺癌、肾癌、前列腺癌等多种肿瘤组织中亦分离得到γδt细胞。γδt细胞不仅能杀伤自体肿瘤细胞,还能杀伤异体肿瘤细胞,但对正常细胞无毒性。现有γδt细胞培养技术是直接分离外周血中的单个核细胞(pbmc),然后将pbmc细胞在含有一定浓度的il-2的培养基中与肿瘤细胞混合培养2周,得到109的细胞,并将其作为细胞制剂,运用于机体保健或临床。现有技术主要采用il-2和肿瘤细胞共同刺激单个核细胞,使细胞进行扩增。其缺点主要是细胞扩增倍数相对较低,纯度相对较低,且存在肿瘤细胞无法完全与γδt细胞分开等风险。技术实现要素:有鉴于此,本发明公开了一种γδt细胞培养方法,本发明将将高密度细胞培养瓶进行改造,然后将分离得到的单个核细胞采用il-2进行诱导,培养γδt细胞,并且采用肿瘤细胞裂解后的内容物来致敏γδt细胞,使γδt细胞的扩增效果得到增强,且其杀伤活性也大大增强。本发明公开的γδt细胞培养方法包括以下步骤:1)收集外周血,离心分离得到外周血单个核细胞;2)对步骤1)分离得到的外周血单个核细胞进行诱导培养;3)制备肿瘤细胞裂解内容物,将所述肿瘤细胞裂解内容物与步骤2)的产物进行共培养;4)对步骤3)的产物进行检测。优选地,步骤2)所述的诱导培养为:将步骤1)分离得到的细胞以一定密度加入到xvivo-15培养基,并往培养基中加入浓度为50-500μg/ml的okt-3和浓度为100-1000u/ml的il-2。在本发明提供的实施例中,xvivo-15培养基购至瑞士lonza公司。作为优选,诱导培养的条件为37℃,二氧化碳含量为5%的二氧化碳培养箱。作为优选,诱导培养采用高密度细胞培养瓶进行培养。在本发明提供的实施例中,高密度细胞培养瓶购至美国cellline公司。在本发明中,高密度细胞培养瓶为一种双室细胞培养瓶,主要模拟生物反应器进行细胞培养。在本发明中,肿瘤细胞裂解内容物为k562细胞经过反复冻融离心后的上清液。优选地,肿瘤细胞裂解内容物的制备方法为:将肿瘤细胞k562从培养箱中拿出来,迅速放入-196℃的液氮中30分钟。从液氮中拿出来使劲摇晃,直到完成融解。再放入-196℃的液氮中。如此反复3-5次,直到肿瘤细胞完全破裂,细胞内容物完全释放出来。然后将细胞内容物进行离心,5000rpm10分钟,收集上清液即为肿瘤细胞裂解内容物。用bca法检测内容物的蛋白浓度,得蛋白浓度为62.4μg/ml。相比于现有技术,本发明公开的γδt细胞培养方法具有以下优点:1、本发明专利主要采用改造后的高密度细胞培养瓶,在添加il-2的情况下诱导培养γδt细胞,使γδt细胞的扩增效果得到增强,且所用培养基减少,继而降低了生产成本;2、本发明专利采用肿瘤细胞裂解后的内容物刺激γδt细胞,使其杀伤活性大大增强,且规避了γδt细胞终仍混有辐照后的肿瘤细胞的风险。附图说明图1示培养2周后γδt细胞的形态(100倍),其中1-1为对比例1培养的γδt细胞,1-2为实施例1培养的γδt细胞;图2示培养2周后γδt细胞的流式检测结果;其中2-1~2-7分别为实施例1-6、对比例1培养的γδt细胞流式检测结果。具体实施方式本发明公开了一种γδt细胞培养方法。下面将结合本发明具体实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例只是本发明一部分实施例,而不是全部的实施例。本领域技术人员应当理解,对本发明的具体实施例进行修改或者对部分技术特征进行同等替换,而不脱离本发明技术方案的精神,均应涵盖在本发明保护的范围中。实施例中使用的试剂和组分均为市售或自制来源。在本发明中,高密度细胞培养瓶为一种双室细胞培养瓶,主要模拟生物反应器进行细胞培养。该高密度细胞培养瓶购至cellline公司。肿瘤细胞裂解内容物为k562细胞经过反复冻融离心后的上清液。k562细胞为人慢性髓系白血病细胞株,由暨南大学生物医药研究基地惠赠。实施例1:(1)采集志愿者20ml血液;(2)离心后收集血浆;(3)将下层血细胞用生理盐水进行稀释,再将稀释液加入已有ficoll分离液(购至stemcell公司)的sepmate离心管(购至stemcell公司)中,离心10-20min;(4)离心后将上层液体从离心管中倒出,再加入一定量的生理盐水重悬细胞,离心;(5)按照1-2×106的细胞密度加入xvivo-15培养基进行培养,并在培养基中加入50μg/ml的okt-3和100u/ml的il-2。每日观察γδt细胞的形态(图1-2)。(6)以后每隔两天补加一定的细胞培养液和细胞因子。(7)第6天,加入50ng/ml肿瘤细胞裂解后的内容物,对γδt细胞进行刺激。(8)以后每隔两天补加一定的细胞培养液和细胞因子。(9)14天后,抽取1×106的细胞进行γδt细胞进行流式检测,抽取8×106的细胞对k562细胞进行杀伤活性检测,抽取部分消培养液检测il-4和ifn-γ的表达量。实施例2:(1)采集志愿者20ml血液;(2)离心后收集血浆;(3)将下层血细胞用生理盐水进行稀释,再将稀释液加入已有ficoll分离液(购至stemcell公司)的sepmate离心管(购至stemcell公司)中,离心10-20min;(4)离心后将上层液体从离心管中倒出,再加入一定量的生理盐水重悬细胞,离心;(5)按照1-2×106的细胞密度加入xvivo-15培养基进行培养,并在培养基中加入500μg/ml的okt-3和100u/ml的il-2。每日观察γδt细胞的形态(与图1-2相似)。(6)以后每隔两天补加一定的细胞培养液和细胞因子。(7)第6天,加入50ng/ml肿瘤细胞裂解后的内容物,对γδt细胞进行刺激。(8)以后每隔两天补加一定的细胞培养液和细胞因子。(9)14天后,抽取1×106的细胞进行γδt细胞进行流式检测,抽取8×106的细胞对k562细胞进行杀伤活性检测,抽取部分消培养液检测il-4和ifn-γ的表达量。实施例3:(1)采集志愿者20ml血液;(2)离心后收集血浆;(3)将下层血细胞用生理盐水进行稀释,再将稀释液加入已有ficoll分离液(购至stemcell公司)的sepmate离心管(购至stemcell公司)中,离心10-20min;(4)离心后将上层液体从离心管中倒出,再加入一定量的生理盐水重悬细胞,离心;(5)按照1-2×106的细胞密度加入xvivo-15培养基进行培养,并在培养基中加入100μg/ml的okt-3和100u/ml的il-2。每日观察γδt细胞的形态(与图1-2相似)。(6)以后每隔两天补加一定的细胞培养液和细胞因子。(7)第6天,加入50ng/ml肿瘤细胞裂解后的内容物,对γδt细胞进行刺激。(8)以后每隔两天补加一定的细胞培养液和细胞因子。(9)14天后,抽取1×106的细胞进行γδt细胞进行流式检测,抽取8×106的细胞对k562细胞进行杀伤活性检测,抽取部分消培养液检测il-4和ifn-γ的表达量。实施例4:(1)采集志愿者20ml血液;(2)离心后收集血浆;(3)将下层血细胞用生理盐水进行稀释,再将稀释液加入已有ficoll分离液(购至stemcell公司)的sepmate离心管(购至stemcell公司)中,离心10-20min;(4)离心后将上层液体从离心管中倒出,再加入一定量的生理盐水重悬细胞,离心;(5)按照1-2×106的细胞密度加入xvivo-15培养基进行培养,并在培养基中加入50μg/ml的okt-3和1000u/ml的il-2。每日观察γδt细胞的形态(与图1-2相似)。(6)以后每隔两天补加一定的细胞培养液和细胞因子。(7)第6天,加入50ng/ml肿瘤细胞裂解后的内容物,对γδt细胞进行刺激。(8)以后每隔两天补加一定的细胞培养液和细胞因子。(9)14天后,抽取1×106的细胞进行γδt细胞进行流式检测,抽取8×106的细胞对k562细胞进行杀伤活性检测,抽取部分消培养液检测il-4和ifn-γ的表达量。实施例5:(1)采集志愿者20ml血液;(2)离心后收集血浆;(3)将下层血细胞用生理盐水进行稀释,再将稀释液加入已有ficoll分离液(购至stemcell公司)的sepmate离心管(购至stemcell公司)中,离心10-20min;(4)离心后将上层液体从离心管中倒出,再加入一定量的生理盐水重悬细胞,离心;(5)按照1-2×106的细胞密度加入xvivo-15培养基进行培养,并在培养基中加入50μg/ml的okt-3和500u/ml的il-2。每日观察γδt细胞的形态(与图1-2相似)。(6)以后每隔两天补加一定的细胞培养液和细胞因子。(7)第6天,加入50ng/ml肿瘤细胞裂解后的内容物,对γδt细胞进行刺激。(8)以后每隔两天补加一定的细胞培养液和细胞因子。(9)14天后,抽取1×106的细胞进行γδt细胞进行流式检测,抽取8×106的细胞对k562细胞进行杀伤活性检测,抽取部分消培养液检测il-4和ifn-γ的表达量。实施例6:(1)采集志愿者20ml血液;(2)离心后收集血浆;(3)将下层血细胞用生理盐水进行稀释,再将稀释液加入已有ficoll分离液(购至stemcell公司)的sepmate离心管(购至stemcell公司)中,离心10-20min;(4)离心后将上层液体从离心管中倒出,再加入一定量的生理盐水重悬细胞,离心;(5)按照1-2×106的细胞密度加入xvivo-15培养基进行培养,并在培养基中加入50μg/ml的okt-3和100u/ml的il-2。每日观察γδt细胞的形态(与图1-2相似)。(6)以后每隔两天补加一定的细胞培养液和细胞因子。(7)第6天,加入50ng/ml肿瘤细胞裂解后的内容物,对γδt细胞进行刺激。(8)以后每隔两天补加一定的细胞培养液和细胞因子。(9)14天后,抽取1×106的细胞进行γδt细胞进行流式检测,抽取8×106的细胞对k562细胞进行杀伤活性检测,抽取部分消培养液检测il-4和ifn-γ的表达量。对比例1(1)采集志愿者20ml血液;(2)离心后收集血浆;(3)将下层血细胞用生理盐水进行稀释,再将稀释液加入已有ficoll分离液(购至stemcell公司)的sepmate离心管(购至stemcell公司)中,离心10-20min;(4)离心后将上层液体从离心管中倒出,再加入一定量的生理盐水重悬细胞,离心;(5)按照1-2×106的细胞密度加入xvivo-15培养基进行培养,并在培养基中加入50μg/ml的okt-3和100u/ml的il-2。每日观察γδt细胞的形态(图1-1)。(6)以后每隔两天补加一定的细胞培养液和细胞因子。(7)第6天,收集所有的γδt细胞与在8kgry的条件下辐照4小时后的k562细胞共培养,γδt细胞与k562细胞的比例为10:1。(8)14天后,抽取1×106的细胞进行γδt细胞进行流式检测,抽取8×106的细胞k562细胞进行杀伤活性检测,抽取部分消培养液检测il-4和ifn-γ的表达量。试验例1流式细胞仪检测γδt细胞表面标志物取实施例1、对比例1分选后及共同培养后的γδt细胞进行cd56和cd3的流式检测。流式检测方法如下:取1×106个γδt细胞;250g离心5min去上清;用含10%fbs的pbs溶液清洗2次;避光加入cd56和cd3抗体2.5μl室温孵育30min;用含10%fbs的pbs溶液清洗2次;用500mlrpmi1640培养基重悬细胞并过滤,上流式细胞仪进行检测(图2)。结果显示,对比例中cd56+和cd3+双阳性表达率比所有实施例组都低,且差异具有统计学意义。试验例2检测γδt细胞的杀伤活性对上述实施例1-6和对比例1收集的γδt细胞的共培养物进行杀伤活性检测。铺板时各实验孔和对照设置如下:实验孔:按效靶比40:1、20:1和10:1进行靶细胞(k562)和效应细胞(实施例1-3得到的共培养物)的铺板。其中,效应细胞的浓度分别为4×106个/ml,2×106个/ml,1×106个/ml,每孔100μl,每组3个复孔;k562浓度为1×105个/ml,每孔100μl,每组3个复孔。效应细胞自然释放孔:4×106个/ml,2×106个/ml,1×106个/ml,每孔100μl,每组3个复孔,每孔加入100μl培养基。靶细胞最大释放孔:1×105个/ml的靶细胞,每孔100μl,每组3个复孔,每孔加入100μl培养基,于37℃、5%二氧化碳培养箱孵育前45min每孔加入20μl细胞裂解液。靶细胞自然释放孔:1×105个/ml的靶细胞,每孔100μl,每组3个复孔,每孔加入100μl培养基。培养液空白对照:每孔200μl培养液,每组3个复孔。体积纠正对照:每孔200μl培养液,每组3个复孔,于37℃、5%二氧化碳培养箱孵育前45min每孔加入20μl细胞裂解液。铺板后将培养板250g离心4min,置于37℃、5%二氧化碳培养箱孵育4h。在培养结束前45min,取出培养板,在靶细胞最大释放组和体积纠正组每孔加入20μl细胞裂解液,250g离心4min,继续培养45min后取出。进行ldh(乳酸脱氢酶)测定,具体步骤如下:250g离心4min,每孔吸出50μl上清转移到另一新的96孔板中,每孔加底物溶液50μl,室温避光孵育30min。每孔加入50μl终止液,用振荡器将色素颗粒打散,测定490波长处的吸光度值。试验组、靶细胞ldh自然释放组和效应细胞ldh自然释放组的吸光度均值减去培养液空白对比例吸光度值均值,获得校正值。靶细胞ldh最大释放组的吸光度均值减去体积纠正组吸光度值均值,获得校正值。杀伤活性按如下公式计算:活性=(a-e-t)/(tmax-t)×100%………………(1)a:试验组吸光度值校正值,e:效应细胞自然释放孔吸光度值校正值,t:靶细胞自然释放孔吸光度值校正值,tmax:靶细胞最大释放组吸光度值校正值。检测结果见表1。表1γδt细胞对k562细胞的杀伤活性检测结果效靶比40:120:110:1实施例146.96%35.20%12.50%实施例252.30%42.10%15.30%实施例358.21%43.12%19.24%实施例449.52%35.90%14.23%实施例554.20%40.27%16.2%实施例651.23%34.20%17.65%对比例125.60%15.90%6.50%试验例3检测γδt细胞的il-4和ifn-γ的表达量(1)将巨噬细胞培养后的细胞培养液收集起来进行浓缩,为实验品;分别将ifn-γ和il-4标准品溶解,分别设置了5个浓度,分别是10μg/ml,20μg/ml,30μg/ml、40μg/ml及50μg/ml;从已恢复到室温的密封袋中取出实验所需板条;(2)留空白孔,提前30min制备生物素化抗体工作液,于10℃~35℃下避光放置;(3)分别将实验品或不同浓度的标准品(0μg/ml孔加试剂稀释液)加入相应孔中,100μl/孔,用封板胶纸封住反应孔,37℃孵箱孵育90min;(4)洗板4次:(5)除空白孔外,加入酶结合物工作液,100μl/孔。用胶纸封住反应孔,于37℃孵箱避光孵育60min;(6)洗板4次;(7)除空白孔外,加入酶结合物工作液,100μl/孔。用胶纸封住反应孔,于37℃孵箱避光孵育30min;(8)洗板4次;(9)加入显色底物,100μl/孔,于37℃孵箱避光孵育15min:(10)加入终止液,100μl/孔,混匀后检测其吸光度值(od450值)。检测结果见表2。表2ifn-γ和il-4含量以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1