检测山羊支原体山羊肺炎亚种的荧光定量PCR试剂盒的制作方法
技术领域:
本发明涉及分子生物学检测技术领域,属于检测山羊支原体山羊肺炎亚种的荧光定量pcr试剂盒。
背景技术:
:
山羊支原体山羊肺炎亚种(mycoplasmacapricolumsubsp.capripneumoniae,mccp)是山羊传染性胸膜肺炎(contagiouscaprinepleuropneumonia,ccpp)的病原体,同时也是丝状支原体簇(mycoplasmamycoidescluster,mmcluster)的主要成员之一。其它丝状支原体簇成员包括丝状支原体丝状亚种小菌落型(mycoplasmamycodiessubsp.mycodiessmallcolony,mmmsc)、丝状支原体丝状亚种大菌落型(mycoplasmamycodiessubsp.mycodieslargecolony,mmmlc)、丝状支原体山羊亚种(mycoplasmamycodiessubspcapri,mmc)、山羊支原体山羊亚种(mycoplasmacapricolumsubsp.capricolum,mcc)和牛群支原体7型(mycoplasmabovinegroup7,mbg7)等。由于这些支原体之间具有非常相似或相近的生化和血清学特性,使得由山羊支原体山羊肺炎亚种(mccp)引起的山羊传染性胸膜肺炎(ccpp)的诊断较为困难,容易将ccpp与由其它支原体引起的疾病混淆,或者将由mmc、mmmlc等支原体引起的山羊呼吸道疾病错误地归类于ccpp。
目前,对山羊支原体山羊肺炎亚种的检测方法主要是分离培养、血清学检测、常规pcr检测以及利用传统平板培养相结合的方法进行检测。山羊支原体山羊肺炎亚种对营养要求苛刻、生长缓慢而且难以分离培养,判断结果时只靠肉眼观察,没有足够的可靠依据,影响实验的准确性;血清学检测既费时又费力,而且灵敏度不高;常规pcr检测虽然避免了上述两类方法的缺陷,但存在引物特异性不高、容易污染和临床样品中pcr抑制物存在造成的假阴性等问题,限制了在快速检测诊断上的推广应用。
taqman探针实时荧光定量pcr方法凭借特异性引物和探针,有效地增加了检测的特异性和敏感性,同时大大提高了检测速度和检测结果的准确率,在病原体检测上有广阔的应用前景。目前,国内外尚没有建立一种检测山羊支原体山羊肺炎亚种的taqman探针实时荧光定量pcr方法与试剂盒。2008年,lorenzon等人发表了一种基于sybrgreen染料的实时荧光定量pcr方法(lorenzon,s.,manso-silvan,l.,thiaucourt,f.,2008,specificreal-timepcrassaysforthedetectionandquantificationofmycoplasmamycoidessubsp.mycoidesscandmycoplasmacapricolumsubsp.capripneumoniae.molcellprobes22,324-328.),但是sybrgreen染料法其本身特异性、敏感性均远不及taqman探针方法。因此,本发明利用taqman探针技术、通过优化设计新的引物和探针,建立了一种灵敏度高、特异性强和稳定性好的快速检测山羊支原体山羊肺炎亚种的实时荧光定量pcr试剂盒。
技术实现要素:
:
针对上述问题,本发明要解决的技术问题是提供一种检测山羊支原体山羊肺炎亚种的荧光定量pcr试剂盒。
本发明的一种检测山羊支原体山羊肺炎亚种的荧光定量pcr试剂盒包含引物和探针,所述的引物为:
mccp-specific-forward:5′-gtagcagctatattcttaatca-3′
mccp-specific-reverse:5′-gctacaaataattcttgcatac-3′
所述探针为:
mccp-specific-probe:5′-f-aagtaataccagcagcaacagcaag-q-3′,其中f为荧光报告基团,q为荧光淬灭基团;其中,探针5′端标记有荧光报告基团fam,3′端标记有荧光淬灭基团tamra。
作为优选,所述试剂盒还包括premixextaq(probeqpcr)(2×),roxreferencedyeii(5×)和nuclease-freewater。
作为优选,所述试剂盒还包括阳性标准模板,所述阳性标准模板为构建的pmd18-t/arcd阳性质粒,该质粒是引物扩增的山羊支原体山羊肺炎亚种arcd基因的部分序列,所述的基因序列为
gtagcagctatattcttaatcagctcaattttattagcaattgttaactctttaggagaagaaaaatttattaaagaatttatggctggtgcttgcgatcttttaggagtatgtttagtt
注:字体加粗且有下划线的序列为上下游引物,字体加粗且有着重号的序列为探针反向互补序列。
长度为185bp,克隆至pmd18-t载体,命名为pmd18-t/arcd。
本发明中检测山羊支原体山羊肺炎亚种的荧光定量pcr试剂盒的使用方法包括以下实验步骤:
步骤一、提取样品组织中的总dna;
步骤二、以步骤一中的总dna为模板,mccp-specific-forward和mccp-specific-reverse为引物,mccp-specific-probe为探针,进行实时荧光定量pcr扩增反应;
步骤三、分析数据,包括标准质粒和模板dna的cq值、拷贝数及标准曲线相关参数,其中,taqman探针实时荧光定量pcr反应体系为20μl,各物质浓度及用量为premixextaq(probeqpcr)(2×)10μl,mccp-specific-forward(10um)0.4μl,mccp-specific-reverse(10um)0.4μl,probe(0.5um)0.8μl,roxreferencedyeⅱ(5×)0.2μl,ddh2o6.2μl,dnatemplate2μl,其中taqman探针实时荧光定量pcr反应采用两步法扩增程序:stage1:95℃预变性30s;stage2:95℃变性10s,60℃退火30s,40个循环;
本发明的有益效果:选取山羊支原体山羊肺炎亚种arcd基因的一段序列,基于该基因序列,设计特异性pcr引物和taqman探针,建立了山羊支原体山羊肺炎亚种的taqman探针实时荧光定量pcr检测试剂盒,此种试剂盒检测结果重复性较好,变异系数均小于1%,因此此种试剂盒检测方法稳定,数据可靠。
附图标记:
图1为本发明中检测山羊支原体山羊肺炎亚种的荧光定量pcr试剂盒中各物质浓度及用量图;
图2为实施例中山羊支原体山羊肺炎亚种taqman探针实时荧光定量pcr重复性检测结果图;
图3不同稀释梯度标准质粒(5.96×108拷贝/μl~5.96×102拷贝/μl)的扩增曲线;
图4不同稀释梯度的标准质粒构建的山羊支原体山羊肺炎亚种taqman探针实时荧光定量pcr标准曲线;
图5山羊支原体山羊肺炎亚种taqman探针实时荧光定量pcr灵敏性检测结果图;
图6山羊支原体山羊肺炎亚种taqman探针实时荧光定量pcr特异性检测结果图。
具体实施方式:
本具体实施方式采用以下技术方案和实施例对发明进行进一步的详细说明。
实施例:一种检测山羊支原体山羊肺炎亚种的实时荧光定量pcr试剂盒
1.材料和方法
1.1菌株和部分支原体、细菌基因组dna
山羊支原体山羊肺炎亚种(mccp)m1601、山羊支原体山羊亚种(mcc)c.kid、丝状支原体丝状亚种小菌落型(mmmsc)pg1、丝状支原体丝状亚种大菌落型(mmmlc)y98、y-goat、丝状支原体山羊亚种(mmc)pg3、牛生殖道支原体pg11、猪肺炎支原体mhp、绵羊肺炎支原体mo、牛支原体08m、无乳支原体p2、腐败支原体、牛沙门氏菌、鸡大肠杆菌、金黄色葡萄球菌,副猪嗜血杆菌hps、鸭疫李默氏杆菌、志贺杆菌等的基因组dna均由中国农业科学院兰州兽医研究所提供。
1.2主要仪器设备与试剂
安捷伦mx3000p荧光定量pcr仪、高速离心机eppendorfcentrifuge5804r、核酸浓度测定仪nanodrop-2000,细菌基因组dna提取试剂盒(tianampbacqeriadnakit)购自天根生化科技(北京)有限公司,质粒dna提取试剂盒、pmd18-tcloningkit、premixextaq(probeqpcr)(2×)购自宝生物工程(大连)有限公司。
1.3引物、探针的设计与合成
从ncbi数据库中获取山羊支原体山羊肺炎亚种的arcd基因序列(genbank登录号:ay529462.1),应用dnaman软件(version5.2.10,lynnonbiosoft,vaudreuil,canada)分析基因序列,根据引物和探针设计原则,在多态位点较丰富区域设计扩增片段长度为185bp的一对引物,并在该引物的扩增区域内设计一条荧光探针。引物和探针由宝生物工程(大连)有限公司合成。引物和探针序列分别为:
mccp-specific-forward:5′-gtagcagctatattcttaatca-3′
mccp-specific-reverse:5′-gctacaaataattcttgcatac-3′
mccp-specific-probe:5′-f-aagtaataccagcagcaacagcaag-q-3′
其中,5′端标记有荧光报告基团fam,3′端标记有荧光淬灭基团tamra。
1.4标准质粒的构建及质粒拷贝数的计算
以mccp-specific-forward和mccp-specific-reverse为引物,山羊支原体山羊肺炎亚种的arcd基因为模板,pcr扩增得到大小为185bp的目的片段。pcr产物切胶回收纯化后连接到pmd18-t载体上,然后将连接产物导入到dh-5a感受态细胞,筛选出阳性克隆子,琼脂糖凝胶电泳验证后提取质粒并测定浓度。
dna拷贝数=质粒浓度(ng/μl)×10-9/(660×标准质粒碱基数)×阿伏伽德罗常数。用nanodrop-2000测定标准质粒浓度为188.43ng/μl,pmd18-t载体的碱基数为2692bp,扩增产物大小为185bp,标准质粒的碱基数为2877bp(2692bp+185bp),每个碱基的平均分子量为660da,阿伏伽德罗常熟为6.02×1023copy/mol。根据前述公式,计算得出标准质粒浓度为5.96×1010拷贝/μl。
1.5标准曲线的绘制
用tebuffer将标准质粒依次稀释成5.96×109拷贝/μl~5.96×100拷贝/μl等10个梯度,以5.96×108拷贝/μl~5.96×102拷贝/μl为模板,按照上述pcr反应体系和扩增程序进行实时荧光定量pcr。
1.6反应体系及反应程序
taqman探针实时荧光定量pcr反应体系为20μl,其中premixextaq(probeqpcr)2×10μl,上、下游引物(10um)各0.4μl,探针(0.5um)0.8μl,roxreferencedyeⅱ5×0.2μl,ddh2o6.2μl,dna模板2μl。
taqman探针实时荧光定量pcr反应采用两步法扩增程序:stage1:95℃预变性30s;stage2:95℃变性10s,60℃退火30s,40个循环。1.7引物与探针敏感性分析
以10×倍比稀释的标准质粒(5.96×109拷贝/μl~5.96×100拷贝/μl)为模板,引物、探针浓度分别为10μm和0.5μm检测本试剂盒的敏感性。
1.8特异性检测
以标准质粒pmd18-t/arcd为阳性对照,nuclease-freewater为空白对照,按上述反应体系分别加入山羊支原体山羊肺炎亚种、其它支原体和部分细菌共18种菌株的基因组dna为模板,检测引物和探针的特异性。
1.9重复性分析
按引物、探针浓度分别为10μm和0.5μm配制荧光定量pcr检测反应体系,以构建的标准阳性质粒(5.96×108拷贝/μl~5.96×103拷贝/μl)为模板进行稳定性检测。在同一次实时荧光定量pcr反应中,每个稀释度标准质粒做3个生物学重复,以分析组内差异;用上述相同条件分别进行3次独立重复实验,分析组间差异,计算其变异系数。变异系数(cv)=标准偏差(sd)/平均数(x)。并采用spss19.0软件进行统计学分析,方差分析用于比较不同样本之间的差异,p<0.05有统计学意义。
2.结果
2.1标准曲线
反应结束后,利用分析软件自动生成标准曲线,其中图3为不同浓度梯度标准质粒的扩增曲线图;图4为不同浓度梯度标准质粒cq值与其拷贝数的对数所构成的标准曲线。结果显示,标准质粒浓度与cq值之间呈良好的线性关系,相关系数r2为1.000,扩增效率为97.5%。标准曲线的线性回归方程为:y=-3.384*log(x)+42.60,其中y为cq值,x为标准质粒的拷贝数。
2.2引物与探针敏感性分析
以10×倍比稀释的标准质粒(5.96×109拷贝/μl~5.96×100拷贝/μl)为模板,引物、探针浓度分别为10μm和0.5μm检测其敏感性,最低检出浓度为5.96×100拷贝/μl,即检测灵敏度达5.96个拷贝的目的基因,参照图5。
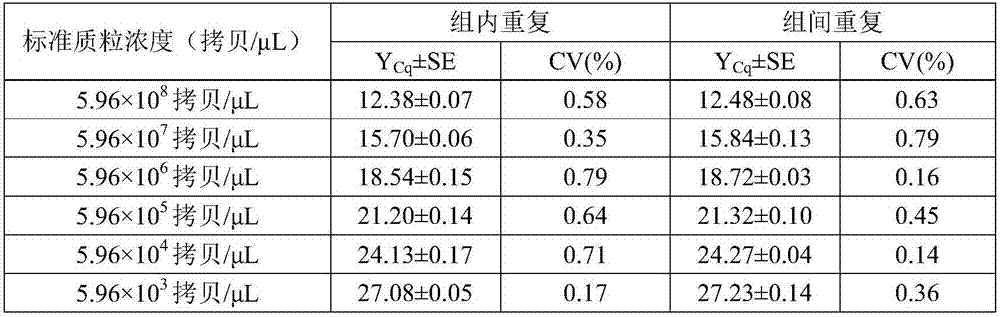
2.3重复性检测
组内各孔之间变异系数在0.17%~0.79%之间,组间重复测定变异系数在0.14%~0.79%之间,均小于1%(图2)。图2为山羊支原体山羊肺炎亚种taqman探针实时荧光定量pcr重复性检测结果图;
注:图中ycq为平均值,se为标准差,cv为变异系数。
2.4特异性检测
以构建的重组质粒(pmd18-t/arcd)作为阳性标准品,以山羊支原体山羊肺炎亚种和其它支原体及细菌共18种菌株的基因组dna作为阴性对照,以nuclease-freewater为空白对照,进行实时荧光定量pcr反应。结果发现,阳性对照(pmd18-t/arcd)和山羊支原体山羊肺炎亚种(m1601株)的基因组dna有明显的扩增信号(cq值小于22),检测结果为阳性;其余支原体和细菌的基因组dna有微弱的扩增信号(cq值均大于31),检测结果为阴性,空白对照ntc无扩增信号参照图6。
本发明选取山羊支原体山羊肺炎亚种arcd基因的一段序列,基于该基因序列,设计特异性引物和taqman探针,建立了山羊支原体山羊肺炎亚种的taqman探针实时荧光定量pcr检测试剂盒。本发明以构建的重组质粒(pmd18-t/arcd)为阳性对照,以山羊支原体山羊肺炎亚种和其它支原体及细菌共18种菌株的基因组dna作为阴性对照,以nuclease-freewater为空白对照,检测本试剂盒的特异性。结果发现:山羊支原体山羊肺炎亚种(m1601株)呈典型的阳性扩增,cq值为21.93;其余支原体和细菌的cq值均大于31,且空白对照nuclease-freewater无扩增信号。表明该试剂盒具有较好的特异性,能够满足一般临床样品的检测要求。本发明以10×倍比稀释后的标准质粒(5.96×109拷贝/μl~5.96×100拷贝/μl)为模板,进行实时荧光定量pcr,以检测本试剂盒的敏感性,结果发现该试剂盒具有较高的敏感性,检测灵敏度达5.96个拷贝的目的基因。为了检测本试剂盒的稳定性,本发明选择5.96×108拷贝/μl~5.96×103拷贝/μl的标准质粒为模板,每个稀释度标准质粒做3个生物学重复,同时用上述相同条件分别进行3次独立重复实验,分析组内差异和组间差异,发现检测结果重复性较好,变异系数均小于1%,表明该试剂盒稳定,数据可靠。因而,本发明建立的taqman探针实时荧光定量pcr检测试剂盒是一种快速、较为准确的山羊支原体山羊肺炎亚种的检测试剂盒。
以上显示和描述了本发明的基本原理和主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
- 还没有人留言评论。精彩留言会获得点赞!