1,1-二羟甲基-四氢-β-咔啉-3-甲酰-GYIGSK,其合成,活性和应用的制作方法
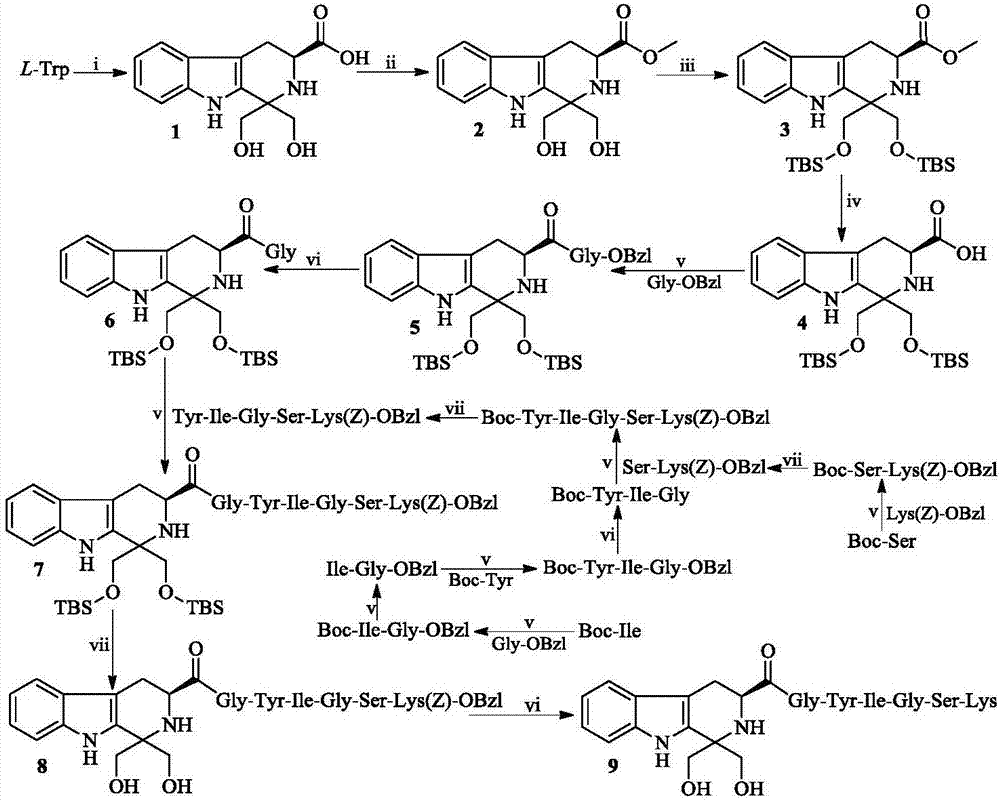
本发明涉及(3s)-1,1-二羟甲基-四氢-β-咔啉-3-甲酰-gly-tyr-ile-gly-ser-lys,涉及它的制备方法,涉及它的抗动脉血栓活性,涉及它的抗静脉血栓活性,涉及它抑制gpiib/iiia表达的活性,涉及它抑制体内p-选择素表达的活性。因而本发明涉及它在制备抗动脉血栓药物中的应用、在制备抗静脉血栓药物中的应用、在制备gpiib/iiia拮抗剂中的应用和在制备凝p-选择素拮抗剂中的应用。本发明属于生物医药领域。
背景技术:
血栓的形成是导致心肌梗死、脑卒中、肺栓塞、深静脉血栓和其他心血管疾病的主要原因,是全球发病率和死亡率的主要原因。目前的抗栓药物,虽然能够用有效的抑制血栓的形成,但由于其影响止血功能或出血风险,降低了其安全性并限制了临床疗效。β-咔啉类生物碱的多种生物活性包括抑制血小板聚集的活性都已公开。发明人也曾经公开了一系列具有抗动脉血栓活性的β-咔啉-3-甲酰寡肽,它们的静脉给药剂量为5μmol/kg。发明人对它们的活性有两点不满意。第一点是,静脉注射使它们进入血液循环并迅速达到高的血药浓度。正是由于高浓度,它们迅速到达血浆和组织而增加发生不良反应的风险。这是静脉给药本身的固有缺陷,只能通过发明可口服的化合物才能解决。第二点是,虽然在咔啉的1-位引入甲基,可使口服有效剂量降低为0.01μmol/kg,但是这样的化合物仅表现出了抗动脉血栓活性,没有抗静脉血栓活性。静脉血栓是肿瘤患者和接受各种手术的患者普遍并发症,可使患者致残或致死,需要终生服用抗静脉血栓药物。由于现有的抗静脉血栓药物,例如华法林可引起致命的出血副反应。此外,因为静脉血栓形成和动脉血栓形成的机理完全不同,所以对动脉血栓有效的化合物往往对静脉血栓无效。于是,发明对动脉血栓和静脉血栓都有效的化合物成为抗血栓药物的前沿。经过反复探索,发明人发现在四氢-β-咔啉-3-羧酸的1-位引入双羟甲基,在3-位引入gly-tyr-ile-gly-ser-lys生成的(3s)-1,1-二羟甲基-四氢-β-咔啉-3-甲酰-gly-tyr-ile-gly-ser-lys在0.01μmol/kg口服剂量下表现出良好的抗动脉血栓活性和抗静脉血栓活性,抗静脉血栓活性比华法林强487倍。因为药物的毒副作用都可以随剂量降低而消失,所以有效剂量降低487倍表明了这种结构修饰有突出的技术效果。于是,发明人提出本发明。
技术实现要素:
本发明的第一个内容是提供下式的(3s)-1,1-二羟甲基-四氢-β-咔啉-3-甲酰gly-tyr-ile-gly-ser-lys。
本发明的第二个内容是提供(3s)-1,1-二羟甲基-四氢-β-咔啉-3-甲酰-gly-tyr-ile-gly-ser-lys的合成方法,该方法包括:
(1)l-色氨酸在稀硫酸催化下与1,3-二羟基丙酮进行pictet-spengler缩合生成(3s)-1,1-二羟甲基-四氢-β-咔啉-3-羧酸;
(2)制备(3s)-1,1-二羟甲基-四氢-β-咔啉-3-羧酸甲酯;
(3)(3s)-1,1-二羟甲基-四氢-β-咔啉-3-羧酸甲酯在咪唑存在下与叔丁基二甲基氯硅烷(tbdmscl)反应生成(3s)-1,1-二(叔丁基二甲基硅氧基)甲基-四氢-β-咔啉-3-羧酸甲酯;
(4)(3s)-1,1-二(叔丁基二甲基硅氧基)甲基-四氢-β-咔啉-3-羧酸甲酯在4n的naoh水溶液中水解生成(3s)-1,1-二(叔丁基二甲基硅氧基)甲基-四氢-β-咔啉-3-羧酸;
(5)以二环己基碳二亚胺和1-羟基苯并三氮唑为催化剂,采用液相缩合法使(3s)-1,1-二(叔丁基二甲基硅氧基)甲基-四氢-β-咔啉-3-羧酸与gly-obzl偶联为(3s)-1,1-二(叔丁基二甲基硅氧基)甲基-四氢-β-咔啉-3-甲酰-gly-obzl;
(6)(3s)-1,1-二(叔丁基二甲基硅氧基)甲基-四氢-β-咔啉-3-甲酰-gly-obzl在h2和pd/c存在下转化成(3s)-1,1-二(叔丁基二甲基硅氧基)甲基-四氢-β-咔啉-3-甲酰-gly;
(7)以二环己基碳二亚胺和1-羟基苯并三氮唑为催化剂,采用液相缩合法合成hcl·tyr-ile-gly-ser-lys(z)-obzl;
(8)以二环己基碳二亚胺和1-羟基苯并三氮唑为催化剂,采用液相缩合法使(3s)-1,1-二(叔丁基二甲基硅氧基)甲基-四氢-β-咔啉-3-甲酰-gly与hcl·tyr-ile-gly-ser-lys(z)-obzl偶联为(3s)-1,1-二(叔丁基二甲基硅氧基)甲基-四氢-β-咔啉-3-甲酰-gly-tyr-ile-gly-ser-lys(z)-obzl;
(9)(3s)-1,1-二(叔丁基二甲基硅氧基)甲基-四氢-β-咔啉-3-甲酰-gly-tyr-ile-gly-ser-lys(z)-obzl在浓度为4n的氯化氢-乙酸乙酯溶液中,0℃脱除叔丁基二甲基硅基,制备(3s)-1,1-二羟甲基-四氢-β-咔啉-3-甲酰-gly-tyr-ile-gly-ser-lys(z)-obzl;
(10)(3s)-1,1-二羟甲基-四氢-β-咔啉-3-甲酰--gly-tyr-ile-gly-ser-lys(z)-obzl在pd/c存在下氢解生成(3s)-1,1-二羟甲基-四氢-β-咔啉-3-甲酰-gly-tyr-ile-gly-ser-lys。
(11)(3s)-1,1-二羟甲基-四氢-β-咔啉-3-甲酰--gly-tyr-ile-gly-ser-lys(z)-obzl在h2和pd/c存在下生成(3s)-1,1-二羟甲基-四氢-β-咔啉-3-甲酰-gly-tyr-ile-gly-ser-lys。
本发明的第三个内容是评价(3s)-1,1-二羟甲基-四氢-β-咔啉-3-甲酰-gly-tyr-ile-gly-ser-lys的抗动血栓活性。
本发明的第四个内容是评价(3s)-1,1-二羟甲基-四氢-β-咔啉-3-甲酰-gly-tyr-ile-gly-ser-lys的抗静血栓活性。
本发明的第五个内容是评价(3s)-1,1-二羟甲基-四氢-β-咔啉-3-甲酰-gly-tyr-ile-gly-ser-lys抑制gpiib/iiia表达的活性。
本发明的第六个内容是评价(3s)-1,1-二羟甲基-四氢-β-咔啉-3-甲酰-gly-tyr-ile-gly-ser-lys抑制p-选择素表达的活性。
附图说明
图1.(3s)-1,1-二羟甲基-四氢-β-咔啉-3-甲酰-gly-tyr-ile-gly-ser-lys的合成路线.i)1,3-二羟基丙酮,浓h2so4,h2o;ii)甲醇,socl2;iii)叔丁基二甲基氯硅烷(tbdmscl),咪唑,无水n,n-二甲基甲酰胺(dmf);iv)4nnaoh,甲醇,冰浴;v)n,n'-二环己基碳二亚胺(dcc),1-羟基苯并三唑(hobt),n-甲基吗啉(nmm),四氢呋喃;vi)pd/c,h2;vii)4n氯化氢的乙酸乙酯溶液;3-7中tbs为叔丁基二甲基硅。
具体实施方式
为了进一步阐述本发明,下面给出一系列实施例。这些实施例完全是例证性的,它们仅用来对本发明进行具体描述,不应当理解为对本发明的限制。
实施例1制备(3s)-1,1-二羟甲基-四氢-β-咔啉-3-羧酸(1)
将6.12g(30mmol)l-色氨酸混悬于100ml蒸馏水中。冰浴下,往里缓慢滴加浓硫酸直至l-色氨酸完全溶解。向溶液中加入3.24g(36mmol)1,3-二羟基丙酮,室温反应72小时。tlc(乙酸乙酯/水/冰醋酸,10/1/2)显示反应完。过滤,滤饼用冰水冲洗,得到6.13g(74%)标题化合物,为黄色粉末。
实施例2制备(3s)-1,1-二羟甲基-四氢-β-咔啉-3-羧酸甲酯(2)
冰盐浴下向55ml甲醇缓慢滴加5.2ml二氯亚砜,搅拌30分钟。向溶液加入5.52g(20mmol)(3s)-1,1-二羟甲基-四氢-β-咔啉-3-羧酸(1),搅拌至完全溶解。室温搅拌12小时。tlc(二氯甲烷/甲醇,20:1)显示反应完全。减压浓缩,残留物用入乙酸乙酯磨洗,得到棕黄色固体。固体用200ml乙酸乙酯溶解,得到的溶液依次用饱和nahco3水溶液洗(30ml×3)及饱和nacl水溶液洗(30ml×3),无水硫酸钠干燥12小时。过滤,滤液减压浓缩,得到5.34g(92%)标题化合物,为黄色固体。esi-ms(m/e):291[m+h]+;1h-nmr(300mhz,dmso-d6):δ/ppm=10.55(s,1h),7.39(d,j=7.5hz,1h),7.34(d,j=7.5hz,1h),7.02(td,j1=7.5hz,j2=1.2hz,1h),6.99(td,j1=7.5hz,j2=0.9hz,1h),4.79(m,2h),3.96(m,1h),3.77(m,1h),3.75(s,3h),3.647~3.499(m,3h),2.96(dd,j1=14.7hz,j2=4.2hz,1h),2.59(dd,j1=14.7hz,j2=11.1hz,1h)。
实施例3制备(3s)-1,1-二(叔丁基二甲基硅氧基)甲基-四氢-β-咔啉-3-羧酸甲酯(3)
将5.22g(18mmol)(3s)-1,1-二羟甲基-四氢-β-咔啉-3-羧酸甲酯(2)与50ml无水n,n-二甲基甲酰胺(dmf)的混合物搅拌至完全溶解。冰浴下,向溶液中加4.4g(64.8mmol)咪唑并搅拌至完全溶解。向溶液中加入8.15g叔丁基二甲基氯硅烷(tbdmscl),室温搅拌12个小时。tlc(石油醚/乙酸乙酯,20/1)显示反应完全。冰浴下先向溶液中加入350ml饱和nacl水溶液,再用乙酸乙酯萃取3次。乙酸乙酯层依次用饱和nahco3水溶液洗(40ml×3)及饱和nacl水溶液洗(40ml×3),无水硫酸钠干燥12小时。过滤,滤液减压浓缩,得到的黄色油状物用硅胶柱层析纯化(石油醚/乙酸乙酯,10/1)。得到8.19g(88%)标题化合物,为无色油状物。esi-ms(m/e):519[m+h]+;1h-nmr(300mhz,dmso-d6):δ/ppm=10.31(s,1h),7.41(d,j=7.5hz,1h),7.33(d,j=7.5hz,1h),7.04(t,j=7.5hz,1h),6.95(t,j=7.5hz,1h),4.00(m,1h),3.79(m,4h),3.72(s,3h),2.99(dd,j1=14.7hz,j2=3.9hz,1h),2.59(dd,j1=15.0hz,j2=11.1hz,1h),0.83(s,9h),0.82(s,9h),0.04(s,3h),0.00(s,3h),-0.05(s,6h)。
实施例4制备(3s)-1,1-二(叔丁基二甲基硅氧基)甲基-四氢-β-咔啉-3-羧酸(4)
冰盐浴下往7.77g(15mmol)(3s)-1,1-二(叔丁基二甲基硅氧基)甲基-四氢-β-咔啉-3-羧酸甲酯(3)与40ml四氢呋喃的溶液中滴加4nnaoh水溶液,调节溶液的ph值为13~14。反应混合物搅拌30分钟。tlc(石油醚/乙酸乙酯,20/1)显示反应完全。冰盐浴下往里滴加2n盐酸溶液,调节溶液的ph值为7。减压浓缩除四氢呋喃及甲醇。冰盐浴下往里滴加饱和khso4水溶液,调节溶液的ph值为2~3。溶液用乙酸乙酯萃取3次。乙酸乙酯层用饱和nacl水溶液洗3次,无水硫酸钠干燥12小时。过滤,滤液减压浓缩,得到6.96g(90%)标题化合物,为无色粉末。esi-ms(m/e):505[m+h]+。
实施例5制备(3s)-1,1-二(叔丁基二甲基硅氧基)甲基-四氢-β-咔啉-3-甲酰-gly-obzl(5)
冰浴下将6.90g(13.4mmol)(3s)-1,1-二(叔丁基二甲基硅氧基)甲基-四氢-β-咔啉-3-羧酸(4),2.76g(13.4mmol)dcc,1.81g(13.4mmol)hobt和150ml无水四氢呋喃的溶液搅拌30分钟。向溶液中加入3.24g(16.08mmol)hcl·gly-obzl,滴加n-甲基吗啉调节反应液的ph为9,室温搅拌8小时。tlc(石油醚/乙酸乙酯,5/1)显示反应完全。反应混合物过滤,滤液减压浓缩,残留物用150ml乙酸乙酯溶解,过滤,滤液依次用5%nahco3水溶液洗(30ml×3),饱和nacl水溶液洗(30ml×3),5%khso4水溶液洗(30ml×3),饱和nacl水溶液洗(30ml×3),5%nahco3水溶液洗(30ml×3),饱和nacl水溶液洗(30ml×3),无水硫酸钠干燥12小时。过滤,滤液减压浓缩,得到的黄色糖浆用硅胶柱层析纯化(石油醚/乙酸乙酯,6/1),得到4.86g(82%)标题化合物,为黄色糖浆。esi-ms(m/e):652[m+h]+。
实施例6制备(3s)-1,1-二(叔丁基二甲基硅氧基)甲基-四氢-β-咔啉-3-甲酰-gly(6)
将4.86g(7.46mmol)(3s)-1,1-二(叔丁基二甲基硅氧基)甲基-四氢-β-咔啉-3-甲酰-gly-obzl(5)溶于100ml甲醇。向溶液中加486mgpd/c,抽出瓶内空气,通入氢气,重复三次后,室温通氢气6小时。tlc(石油醚/乙酸乙酯,5/1)显示反应完全。减压滤除pd/c,滤液减压浓缩,得到4.05g(97%)标题化合物,为黄色粉末。esi-ms(m/e):562[m+h]+。
实施例7制备boc-ile-gly-obzl
采用实施例5的方法从4.62g(20mmol)boc-ile、和4.84g(24mmol)hcl·gly-obzl得到7.24g(96%)标题化合物,为黄色糖浆。esi-ms(m/e):379[m+h]+。
实施例8制备hcl·ile-gly-obzl
冰浴下将7.24g(19.2mmol)boc-ile-gly-obzl用80ml氯化氢的乙酸乙酯(4m)溶液溶解并反应4小时。tlc(石油醚/乙酸乙酯,2/1)显示反应完全。反应混合物减压浓缩,残留物用无水乙酸乙酯溶解,得到的溶液再减压浓缩。该操作重复3次。得到的黄色糖浆样物用无水乙醚充分磨洗,得到5.85g(91%)标题化合物,为黄色固体。esi-ms(m/e):279[m+h]+。
实施例9制备boc-tyr-ile-gly-obzl
采用实施例5的方法从4.40g(15.3mmol)boc-tyr和5.80g(18.4mmol)hcl·ile-gly-obzl得到7.30g(88%)标题化合物,为黄色固体。esi-ms(m/e):542[m+h]+。
实施例10制备boc-tyr-ile-gly
采用实施例6的方法从7.00g(12.9mmol)boc-tyr-ile-gly-obzl得到5.70g(98%)标题化合物,为黄色固体。esi-ms(m/e):452[m+h]+。
实施例11制备boc-ser(bzl)-arg(no2)-obzl
采用实施例5的方法从2.95g(10mmol)boc-ser(bzl)和5.78g(12mmol)hcl·arg(no2)-obzl得到5.30g(90%)标题化合物,为黄色固体。esi-ms(m/e):587[m+h]+。
实施例12制备hcl·ser(bzl)-arg(no2)-obzl
采用实施例8的方法从5.2g(8.87mmol)boc-ser(bzl)-arg(no2)-obzl得到4.78g(97%)标题化合物,为黄色固体。esi-ms(m/e):487[m+h]+。
实施例13制备boc-tyr-ile-gly-ser(bzl)-arg(no2)-obzl
采用实施例5的方法从2.9g(6.46mmol)boc-tyr-ile-gly和4.05g(7.75mmol)hcl·ser(bzl)-arg(no2)-obzl得到4.90g(75%)标题化合物,为黄色固体。esi-ms(m/e):920[m+h]+。
实施例14制备hcl·tyr-ile-gly-ser(bzl)-arg(no2)-obzl
采用实施例8的方法从3.7g(3.67mmol)boc-tyr-ile-gly-ser(bzl)-arg(no2)-obzl得到3.30g(95%)标题化合物,为黄色固体。esi-ms(m/e):487[m+h]+。
实施例15制备boc-ser-lys(z)-obzl
采用实施例5的方法从2.04g(10mmol)boc-ser和5.78g(12mmol)4.88g(12mmol)hcl·lys(z)-obzl得到4.89g(90%)标题化合物,为黄色固体。esi-ms(m/e):557[m+h]+。
实施例16制备hcl·ser-lys(z)-obzl
采用实施例8的方法从3.7g(6.6mmol)boc-ser-lys(z)-obzl得到3.1g(94%)标题化合物,为无色固体。esi-ms(m/e):457[m+h]+。
实施例17制备boc-tyr-ile-gly-ser-lys(z)-obzl
采用实施例5的方法从2.26g(5mmol)boc-tyr-ile-gly和3.0g(6mmol)hcl·ser-lys(z)-obzl得到2.68g(60%)标题化合物,为无色固体。esi-ms(m/e):890[m+h]+。
实施例18制备hcl·tyr-ile-gly-ser-lys(z)-obzl
采用实施例8的方法从2.6g(2.92mmol)boc-tyr-ile-gly-ser-lys(z)-obzl得到2.34g(97%)标题化合物,为无色固体。esi-ms(m/e):790[m+h]+。
实施例19制备(3s)-1,1-二(叔丁基二甲基硅氧基)甲基-四氢-β-咔啉-3-甲酰-gly-tyr-ile-gly-ser-lys(z)-obzl(7)
采用实施例5的方法从1.32g(2.36mmol)(3s)-1,1-二(叔丁基二甲基硅氧基)甲基-四氢-β-咔啉-3-甲酰-gly(6)和2.34g(2.83mmol)hcl·tyr-ile-gly-ser-lys(z)-obzl得到0.48g(15%)标题化合物,为无色固体。esi-ms(m/e):1334[m+h]+;1h-nmr(300mhz,dmso-d6):δ/ppm=10.26(s,1h),9.14(s,1h),8.26(d,j=7.2hz,1h),8.04(m,4h),7.89(d,j=7.8hz,1h),7.71(m,1h),7.35(m,11h),7.22(m,1h),7.04(m,3h),6.94(m,1h),6.15(d,j=8.1hz,1h),5.11(s,1h),5.01(s,2h),4.84(m,1h),4.56(m,1h),4.40(m,1h),4.23(m,2h),3.93(d,j=9.6hz,1h),3.76(m,8h),3.57(m,2h),2.92(m,4h),2.68(m,1h),2.54(m,1h),2.29(m,1h),1.73(m,3h),1.30(m,6h),1.11(m,1h),0.77(m,24h),0.01(s,3h),-0.01(s,3h),-0.05(s,3h),-0.11(s,3h);13c-nmr(75mhz,dmso-d6):δ/ppm=173.43,172.14,171.61,171.56,170.53,169.07,168.87,156.53,156.22,137.74,136.39,136.33,135.11,132.09,131.96,130.62,129.16,128.85,128.78,128.45,128.22,128.17,126.81,121.10,118.62,117.90,115.31,111.45,109.08,66.73,66.34,65.72,65.59,65.48,62.25,59.10,57.63,55.34,54.46,53.40,53.04,52.58,42.50,42.18,40.88,39.21,37.06,30.98,30.48,29.43,26.31,26.17,24.83,23.00,19.11,18.53,18.37,15.79,14.00,11.59,-4.96,-5.00,-5.03。
实施例20制备(3s)-1,1-二羟甲基-四氢-β-咔啉-3-甲酰-gly-tyr-ile-gly-ser-lys(z)-obzl(8)
采用实施例8的方法从0.24mg(0.18mmol)(3s)-1,1-二(叔丁基二甲基硅氧基)甲基-四氢-β-咔啉-3-甲酰-gly-tyr-ile-gly-ser-lys(z)-obzl得到0.18g(90%)标题化合物,为无色固体。esi-ms(m/e):1106[m+h]+。
实施例21制备(3s)-1,1-二羟甲基-四氢-β-咔啉-3-甲酰-gly-tyr-ile-gly-ser-lys(9)
采用实施例6的方法从0.18g(0.16mmol)(3s)-1,1-二羟甲基-四氢-β-咔啉-3-甲酰-gly-tyr-ile-gly-ser-lys(z)-obzl(8)得到42mg(21%)标题化合物,为无色固体。esi-ms(m/e):880[m-h]-;mp:202℃(dec.);
实施例22评价(3s)-1,1-二羟甲基-四氢-β-咔啉-3-甲酰-gly-tyr-ile-gly-ser-lys的抗动脉血栓活性
本实施例选择大鼠颈总动脉-颈外静脉体外旁路循环丝线模型,采用阿司匹林的生理盐水溶液为阳性对照,生理盐水为空白对照,(3s)-1,1-二羟甲基-四氢-β-咔啉-3-甲酰-gly-tyr-ile-gly-ser-lys(化合物9)为治疗药物。旁路循环由三段聚乙烯胶管构成。中段长80.0mm,内径为3.5mm。两端管长100.0mm,内径为1.0mm,外径为2.0mm。为插入大鼠颈动脉或静脉该管的一端拉成尖管。选取重量为4.0±0.1mg长为60.0mm表面毛糙程度均一的丝线作为血栓载体。将三段聚乙烯胶管用1%的硅醚溶液进行硅烷化,待完全晾干后,将丝线置于中段聚乙烯管一端,将三段聚乙烯管组装,并用封口膜对其连接处进行封口及固定。雄性sd大鼠(200±20g)口服阿司匹林的生理盐水溶液(剂量为167μmol/kg)或口服生理盐水或口服化合物9(剂量为0.01μmol/kg)30分钟后,腹腔注射20%乌拉坦溶液(0.7ml/100g体重)进行麻醉。将麻醉大鼠仰卧固定鼠板上,剪开颈部皮肤,分离右颈总动脉和左颈外静脉,并将右颈总动脉和左颈外静脉的远心端用手术线进行结扎。于左颈外静脉剪一斜口,将充满肝素钠溶液的旁路管道的尖管由斜口插入左颈外静脉开口,用手术线将聚乙烯管与静脉血管固定,另一端用注射器加入定量(0.1ml/100g体重)肝素钠抗凝。用动脉夹夹住右颈动脉近心端,于右颈动脉剪一斜口,取下旁路管一段的注射器,插入右颈动脉的近心端,用手术线将聚乙烯管与动脉血管固定,松开动脉夹,血流从右侧动脉流经聚乙烯管流入左侧静脉,建立体外循环。维持血流通畅,体循环15分钟后取出附有血栓的丝线,用滤纸吸去丝线上的血后称重并记录血栓湿重。数据采用t检验进行统计。数据见表1。化合物9治疗的大鼠的动脉血栓显著轻于生理盐水治疗大鼠的动脉血栓,说明化合物9可有效地抑制动脉血栓形成。此外,大鼠颈动脉血用3.8%的橼酸钠水溶液抗凝用于实施例23和实施例24的测定。
表1化合物9的抗动脉血栓活性
a)与生理盐水比p<0.05;n=9。
实施例23评价(3s)-1,1-二羟甲基-四氢-β-咔啉-3-甲酰-gly-tyr-ile-gly-ser-lys的抗静脉血栓活性
本实施例选择大鼠下腔静脉结扎模型,采用华法林钠的生理盐水溶液为阳性对照,生理盐水为空白对照,(3s)-1,1-二羟甲基-四氢-β-咔啉-3-甲酰-gly-tyr-ile-gly-ser-lys(化合物9)为治疗药物。sd雄性大鼠(250±20g)在手术前适应环境并禁食一天。化合物9的口服剂量为0.01μmol/kg。阳性对照华法林钠的口服剂量为4.87μmol/kg。空白对照为生理盐水。给药30min后,大鼠腹腔注射20%乌拉坦溶液。麻醉2min。大鼠固定于大鼠固定板上,腹部备皮消毒,沿腹白线打开腹腔,下至凝固腺,上至露出肝脏一角。移开腹腔内小肠等器官并用浸润过生理盐水的纱布包裹。钝性分离血管周围结缔组织,暴露下腔静脉及其分支,在肾静脉下方将腹主动脉和下腔静脉剥离开,然后用生理盐水浸湿的缝合线在下腔静脉与左肾静脉交汇处将下腔静脉结扎,按解剖位置将肠等器官移回腹腔,用缝合线逐层缝合腹腔。大鼠于25℃环境循环4小时之后,打开腹腔分支结扎,从下腔静脉与左肾静脉交汇处的结扎处开始取出2cm下腔静脉,从中取出血栓称重。统计血栓重,结果进行t检验。实验数据见表2。化合物9治疗的大鼠的静脉血栓显著轻于生理盐水治疗大鼠的静脉血栓,说明在0.01μmol/kg剂量下化合物9可有效地抑制静脉血栓形成。另外,化合物9治疗的大鼠的静脉血栓重与剂量比它高487倍的华法林钠治疗的大鼠的静脉血栓重没有显著差异,说明化合物9的抗静脉血栓活性比华法林钠至少强487倍。这是意想不到的技术效果。
表2化合物9的抗静脉血栓活性
a)与生理盐水比p<0.01,与华法林比p>0.05;n=8
实施例24评价(3s)-1,1-二羟甲基-四氢-β-咔啉-3-甲酰-gly-tyr-ile-gly-ser-lys抑制gpiib/iiia表达的活性
本实施例选择酶联免疫法测定实施例14的大鼠颈动脉血的gpiib/iiia浓度。实施例24的大鼠颈动脉血用3.8%的橼酸钠水溶液抗凝,1000rpm离心15分钟,取上清液室温平衡30分钟,待测定。测定用的试剂盒是大鼠血小板膜gp-iib/iiia酶联免疫试剂盒。试剂盒室温平衡30分钟,待测定。
按照试剂盒要求,先配制标准品。即取试剂盒中的标准品于10000rpm离心30秒。加1ml样品稀释液溶液,用移液枪反复吹打5次使混匀,得到标准品s7。取7个1.5ml离心管(s0-s6)依次排开,各加入250μl样品稀释液。吸取250μl标准品s7到第一个离心管中(s6),轻轻吹打混匀。从s6中吸取250μl到第二个离心管中(s5),轻轻吹打混匀。以此类推进行标准品的倍比稀释。s0为样本稀释液。所得标准品s7的浓度为400ng/ml,s6的浓度为200ng/ml,s5的浓度为100ng/ml,s4的浓度为50ng/ml,s3的浓度为25ng/ml,s2的浓度为12.5ng/ml,s1的浓度为6.25ng/ml,s0的浓度为0ng/ml。
按照试剂盒要求,配制洗涤工作液。即1倍体积的浓洗涤液用25倍体积三蒸水稀释。按照试剂盒要求,配制生物素标记抗体工作液。即1倍体积的生物素标记抗体用100倍体积稀释液稀释。按照试剂盒要求,配制辣根过氧化物酶标记亲和素工作液。即1倍体积的辣根过氧化物酶标记亲和素用100倍体积稀释液稀释。测定步骤如下:
1)酶标板分别设标准孔及待测样本孔。每孔分别加100μl标准品或血清,轻轻晃动混匀,覆上板贴,37℃温育2小时,弃去液体,甩干,不用洗涤。
2)每孔加100μl生物素标记抗体工作液,覆上新的板贴,37℃温育1小时,弃去孔内液体,甩干,洗板3次。每次浸泡2分钟,200μl/孔,甩干。
3)每孔加100μl辣根过氧化物酶亲和素工作液,覆上新的板贴,37℃温育1小时,弃去孔内液体,甩干,洗板3次。每次浸泡2分钟,200μl/孔,甩干。
4)依序每孔加90μl底物溶液,37℃避光显色15-30分钟。
5)依序每孔加50μl终止溶液终止反应。
6)在终止反应5分钟内用酶标仪在450nm波长依序测量各孔的od值。
7)根据标准品的od值绘制标准曲线,计算血清样本的gpiib/iiia浓度,数据见表3。在0.01μmol/kg剂量下化合物9治疗的大鼠血清的gpiib/iiia含量显著低于生理盐水治疗大鼠血清的gpiib/iiia含量。即化合物9可有效地抑制大鼠体内gpiib/iiia表达。此外,0.01μmol/kg化合物9治疗的大鼠血清的gpiib/iiia含量与167μmol/kg阿司匹林治疗大鼠血清的gpiib/iiia含量没有显著差异。可见,化合物9抑制大鼠gpiib/iiia表达的活性比阿司匹林强1670倍。这是意想不到的技术效果。
表3化合物9抑制gpiib/iiia表达活性
a)与生理盐水比p<0.01,与阿司匹林比p>0.05;n=6
实施例25评价(3s)-1,1-二羟甲基-四氢-β-咔啉-3-甲酰-gly-tyr-ile-gly-ser-lys抑制p-选择素表达的活性
本实施例选择酶联免疫法测定实施例24的大鼠颈动脉血的p-选择素浓度。实施例24的大鼠颈动脉血用3.8%的橼酸钠水溶液抗凝,1000rpm离心15分钟,取上清液室温平衡30分钟,待测定。测定用的试剂盒是大鼠p-选择素酶联免疫试剂盒。试剂盒室温平衡30分钟,待测定。
按照试剂盒要求,先配制标准品。即取试剂盒中的标准品于10000rpm离心30秒。加1ml样品稀释液溶液,用移液枪反复吹打5次使混匀,得到标准品s7。取7个1.5ml离心管(s0-s6)依次排开,各加入250μl样品稀释液。吸取250μl标准品s7到第一个离心管中(s6),轻轻吹打混匀。从s6中吸取250μl到第二个离心管中(s5),轻轻吹打混匀。以此类推进行标准品的倍比稀释。s0为样本稀释液。所得标准品s7的浓度为400ng/ml,s6的浓度为200ng/ml,s5的浓度为100ng/ml,s4的浓度为50ng/ml,s3的浓度为25ng/ml,s2的浓度为12.5ng/ml,s1的浓度为6.25ng/ml,s0的浓度为0ng/ml。
按照试剂盒要求,配制洗涤工作液。即1倍体积的浓洗涤液用25倍体积三蒸水稀释。按照试剂盒要求,配制生物素标记抗体工作液。即1倍体积的生物素标记抗体用100倍体积稀释液稀释。按照试剂盒要求,配制辣根过氧化物酶标记亲和素工作液。即1倍体积的辣根过氧化物酶标记亲和素用100倍体积稀释液稀释。测定步骤如下:
1)酶标板分别设标准孔及待测样本孔。每孔分别加100μl标准品或血清,轻轻晃动混匀,覆上板贴,37℃温育2小时,弃去液体,甩干,不用洗涤。
2)每孔加100μl生物素标记抗体工作液,覆上新的板贴,37℃温育1小时,弃去孔内液体,甩干,洗板3次。每次浸泡2分钟,200μl/孔,甩干。
3)每孔加100μl辣根过氧化物酶亲和素工作液,覆上新的板贴,37℃温育1小时,弃去孔内液体,甩干,洗板3次。每次浸泡2分钟,200μl/孔,甩干。
4)依序每孔加90μl底物溶液,37℃避光显色15-30分钟。
5)依序每孔加50μl终止溶液终止反应。
6)在终止反应5分钟内用酶标仪在450nm波长依序测量各孔的od值。
7)根据标准品的od值绘制标准曲线,计算血清样本的p-选择素浓度,数据见表4。在0.01μmol/kg剂量下化合物9治疗的大鼠血清的p-选择素含量显著低于生理盐水治疗大鼠血清的p-选择素含量。即化合物9可有效地抑制大鼠体内p-选择素表达。此外,0.01μmol/kg化合物9治疗的大鼠血清的p-选择素含量与167μmol/kg阿司匹林治疗大鼠血清的p-选择素含量没有显著性差异。可见,化合物9抑制大鼠体内p-选择素表达的活性比阿司匹林强1670倍。这是意想不到的技术效果。
表4化合物9抑制p-选择素表达活性
a)与生理盐水比p<0.01,与阿司匹林比p>0.05;n=6。
- 还没有人留言评论。精彩留言会获得点赞!