一种微囊藻藻株纯培养的预处理方法与流程
本发明涉及微囊藻藻种分离纯化的预处理的方法,具体涉及一种基于有效降低微囊藻附生菌的微囊藻藻株纯培养的预处理方法。
背景技术:
目前,国际上有四种去除微囊藻附生菌的方法:抗生素法、化学试剂法、紫外照射法和平板涂布法。(1)利用抗生素对蓝藻进行除菌的优点是周期短、见效快,近年来越来越多的研究者选择用此法进行蓝藻的纯化。(2)某些化学试剂具备较强的杀菌或者抑菌效果,但蓝藻对其却表现出一定的耐受性,根据这种差异性可选择合适的化学药品对蓝藻进行纯化。(3)紫外照射方法是基于蓝藻和细菌在抵抗紫外照射方面的差异性上建立起来的,由于蓝藻在紫外照射下会启动自身的保护机制,因此相对细菌而言具有较高的抗uv能力。(4)平板涂布与划线是得到纯培养物最传统经典的方法,将藻液涡旋震荡后加入固体培养基倒平板后进行分离。此方法优点在于成本低、操作方便并且对藻细胞本身伤害小。前三种方法均可能对微囊藻的生长速率、藻细胞密度、和叶绿素含量产生影响,使微囊藻的受到不可逆的伤害。从而分离出的微囊藻藻株常与野外藻株存在较大差异。此外,经典的平板涂布法往往缺乏有效的、必要的预处理措施,因此去除附生菌不彻底,无菌化周期较长,有时需反复多次涂布才能得到无菌株,且对于含胶被的微囊藻来说成功率更低。为了进一步研究微囊藻水华形成的机理,应当选择更加温和有效的方法将野外微囊藻群体分离纯化为微囊藻藻株。然而,野外微囊藻群体产生大量胞外多糖(eps),包括包裹在细胞外的胶鞘多糖(beps)和释放到周围环境中的水溶性多糖(seps),胶鞘多糖中常伴生着许多附生菌。如果在分离纯化的过程中,为去除附生菌而采取抗生素抑制或紫外照射杀菌等,则很可能使得微囊藻本身生理结构发生改变,从而失去原有的某些能力(如:聚集形成群体的能力)。因此发明一种温和有效的去除微囊藻附生菌的方法有助于微囊藻的“无伤”纯化,并为进一步明确藻菌关系、获得纯培养的微囊藻藻株奠定基础。
技术实现要素:
本发明的目的是提供一种高效简便地减少微囊藻群体胞外多糖(eps)中附生菌,获得无菌微囊藻藻株的方法,为一种微囊藻藻株纯培养的预处理方法。
为实现上述发明目的,本发明的微囊藻藻株纯培养的预处理方法为在实施平板划线法前,在弱碱性条件下对藻悬液进行恒温水浴加热,以去除微囊藻胞外多糖中的附生菌从而高效获得无菌微囊藻藻株。
优选地,所述澡悬液通过对野外微囊藻群体进行水洗、振荡得到。
优选地,恒温水浴加热的温度为28~30℃。
进一步优选地,恒温水浴加热的温度为30℃。
优选地,所述弱碱性条件为:调节体系ph为7~9。
进一步优选地,调节体系ph为8。
本发明的分离纯化方法相比于经典平板涂布法,加入了在弱碱性条件下温水浴加热这一步骤,更有利于微囊藻群体胶鞘多糖溶解,实现附生菌的有效去除,具有快速、应用范围广、高效等优势。
在一种优选的实施方式中,本发明通过如下方法高效控制微囊藻附生菌从而高效获得无菌微囊藻藻株:
(1)先将采集的野外微囊藻群体的水样先过200μm筛网,再用5μm滤膜过滤后收集滤膜;
(2)用无菌去离子水预先清洗滤膜一次,即随后将滤膜放入无菌试管中,并向无菌试管加入适量无菌去离子水,用旋涡混合仪震荡2~3分钟至滤膜上的藻类群体基本打散后,用无菌镊子取出滤膜,得到微囊藻悬液;
(3)将盛有微囊藻悬液的试管内ph调节为7~9,优选地,用naoh溶液调节,随后将振荡后的试管放入恒温水浴锅中,并在28~30℃下水浴加热3~5h小时;
(4)将水浴加热后的微囊藻悬液过滤到5μm滤膜上,用无菌去离子水清洗数次次;
(5)将水浴加热后的滤膜取出,放入无菌试管中,加入无菌bg-11培养液,振荡1分钟,制成纯净的藻悬液。;
(6):平板划线法分离纯化微囊藻
1)配置1lbg-11培养液(nano31.5g;k2hpo40.04g;mgso4·7h2o0.075g;cacl2·2h2o0.036g;柠檬酸0.006g;柠檬酸铁铵0.006g;na2edta0.001g;nahco30.0158g;微量元素液a50.5ml(h3bo32.86mg/l;na2moo4·2h2o0.390mg/l;mncl2·4h2o15.8mg/l;co(no3)2·6h2o0.049mg/l;znso4·7h2o0.222mg/l:cuso4·5h2o0.079mg/l);无菌去离子水1000ml);
2)在1lbg-11中加入0.6%(w/v)琼脂糖,搅拌均匀后高压蒸汽灭菌,倒入无菌培养皿中,将盛满培养基的培养皿在无菌条件下冷却;
3)取适量100倍藻细胞稀释液置于无菌试管中,用酒精灯灼烧后的接种环在冷却后的固体培养基表面划线,划线完成后将培养基用盖子封住在光照为30μmol·m-2·s-1、温度为28℃下倒置培养7到10天;
(7)将培养后长出藻群落的培养基取出,用接种环挑取单个藻落,置于盛有bg-11培养液的无菌试管中扩大培养;
(8)将扩大培养后的藻细胞进行镜检,如发现藻株不纯,重新执行上述步骤(6)~(8)。
本方法与现有技术相比,有如下优势:
1)微囊藻产生的胞外多糖(eps)的单糖组成具有藻株特异性,多为酸性杂多糖。在碱性条件下温水浴加热可以促进eps的溶解,使附着在多糖上的附生菌能够更加有效地去除;
2)将水洗震荡与水浴加热相结合可以更加高效的去除附生菌,使平板划线法进行分离纯化的过程更加有效,减少划线次数。
附图说明
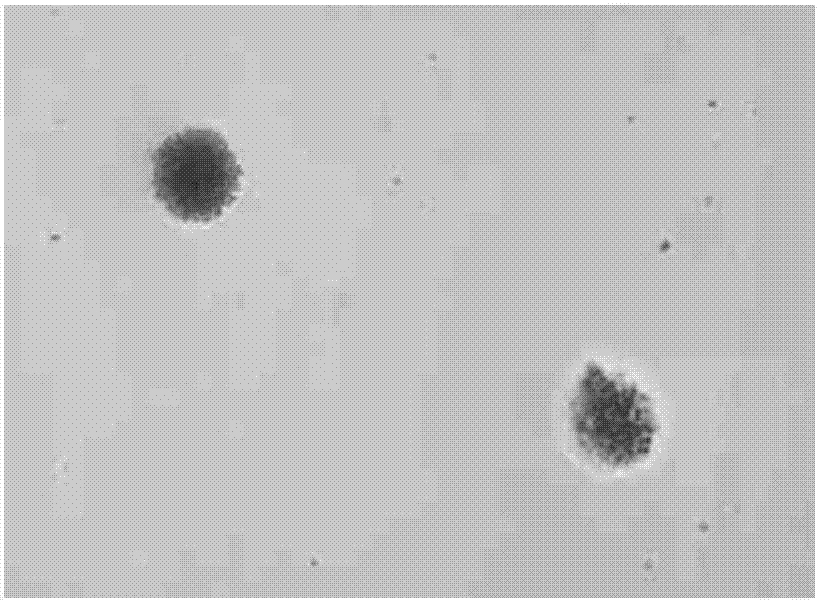
图1和图2为利用本发明预处理方法处理后分离纯化后得到的微囊藻藻细胞的镜检图;
图3和图4为没有利用本发明预处理方法处理后镜检得到的藻细胞;
图5为单个藻群落置于盛有无菌bg-11培养液的锥形瓶中的扩大培养图,其中,tm3为利用该预处理方法分离纯化后扩大培养的微囊藻群体;tm6为没有利用该预处理方法分离纯化后扩大培养的微囊藻群体,
图6为利用本发明预处理方法后光学显微镜镜检结果;
图7为利用本发明预处理方法后荧光显微镜镜检结果;
图8为没有利用本发明预处理方法后光学显微镜镜检结果;
图9为没有利用本发明预处理方法后荧光显微镜镜检结果。
具体实施方式
以下为本发明的优选实施方式,仅用于解释本发明,而非用于限制本发明,且由该说明所作出的改进都属于本发明所附权利要求所保护的范围。
本方法使用的主要设备有:高压蒸汽锅、恒温培养箱、恒温水浴锅、漩涡震荡仪、无菌生物台。
实施例1.
步骤12016年8月在太湖梅粱湾进行采样,用63μm浮游植物网采集浮游植物样品,装于500ml塑料瓶中,低温保存(4℃)后迅速带回实验室进行分析。
步骤2将50ml试管、2l蒸馏水、过滤器、培养基经高温高压(120℃,30min)灭菌后备用。
步骤3将水样先过200μm筛网,收集的滤液用5μm滤膜过滤,收集滤膜。将含有微囊藻群体的滤膜放入50ml无菌试管中,加入30ml无菌去离子水,用旋涡混合仪震荡2分钟后,用无菌镊子取出滤膜。
步骤4将振荡后的微囊藻悬液放入恒温水浴锅中,调节ph为8(naoh溶液),在30℃下水浴加热4小时。
步骤5将步骤4获得的藻悬液过滤到5μm滤膜上,并用无菌去离子水清洗数次。
步骤6将水洗后的滤膜放入无菌离心管中,加入无菌bg-11培养液10ml,振荡1分钟,重新制成藻悬液。
步骤7配置固体培养基,灭菌,倒入培养皿中冷却凝固后使用平板划线法将藻细胞稀释液用酒精灯灼烧后的接种环在无菌柜中接种。(所述培养基中藻细胞稀释液浓度为1.2×104cells/ml)划线完成后将培养基用盖子封住在30μmol·m-2·s-1光照、28℃下倒置培养7到10天。其中,固体培养基配方为:nano31.5g;k2hpo40.04g;mgso4·7h2o0.075g;cacl2·2h2o0.036g;柠檬酸0.006g;柠檬酸铁铵0.006g;na2edta0.001g;nahco30.0158g;微量元素a5液0.5ml(h3bo32.86mg/l;na2moo4·2h2o0.390mg/l;mncl2·4h2o15.8mg/l;co(no3)2·6h2o0.049mg/l;znso4·7h2o0.222mg/l;cuso4·5h2o0.079mg/l);琼脂6g。
步骤8将培养后长出藻群落的培养皿取出,用接种环挑取单个藻群落进行镜检。根据结果可以看出,利用此方法对微囊藻进行预处理后,分离纯化后得到的微囊藻藻细胞较为理想(图1、2),周围没有发现菌斑及其他微生物。而水洗一次后直接分离纯化的微囊藻藻细胞周围出现大面积菌斑,效果不理想(图3、4)。说明利用此方法对微囊藻进行预处理,分离纯化藻种后可以获得较纯的微囊藻藻株。
步骤9将挑取的单个藻群落置于盛有无菌bg-11培养液的锥形瓶中扩大培养(图5)。利用光学显微镜和荧光显微镜分别镜检扩大培养后的藻细胞,镜检结果表明没有利用此方法进行预处理的藻细胞(图8、9)比利用此方法进行预处理的藻细胞(图6、7)出现更多的周边分泌物质。
根据结果分析可确定,利用此方法对微囊藻进行预处理后扩大培养可以获得较纯的无菌微囊藻藻株。
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
- 还没有人留言评论。精彩留言会获得点赞!