本发明涉及一种基于2-氨基十六烷酸的生物可降解材料,具体涉及一种2-氨基十六烷酸-n-羧基内酸酐及其合成,以及由其开环聚合制备的聚合物和该聚合物制备的聚合物胶束和囊泡。
背景技术:
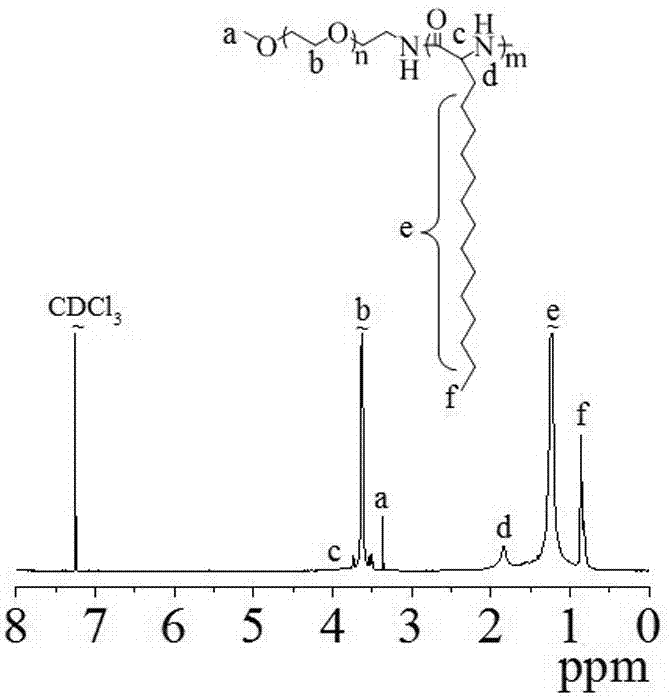
:聚氨基酸由于具有免疫原性较低、良好的降解性能和机械性能以及性能可控而广泛应用于药物控释、组织工程和再生医学等领域。但是,通过α-氨基酸-n-羧基内酸酐聚合得到的疏水性聚氨基酸(例如:聚亮氨酸,聚苯丙氨酸,聚异亮氨酸和聚蛋氨酸等)在有机溶剂中的溶解性极差,进而导致聚合不可控、所得聚合物分子量较小。所以,研究人员通常通过后修饰的方式在聚谷氨酸、聚赖氨酸或聚天冬氨酸等亲水性聚合物的侧链修饰疏水性基团来得到疏水性的聚合物嵌段。但是,这种方式一般要经过一系列的保护和脱保护等过程,从而导致最终产率较低,合成耗费时间长。所以,需要研究合成既具有强疏水性又具有较好的溶剂选择窗的疏水性聚氨基酸;并且这些聚氨基酸具有良好的溶剂选择性和合成可控性,制备所得的两亲性聚合物可以制备得到靶向载药的聚合物胶束或囊泡用于肿瘤的靶向治疗。技术实现要素:本发明的目的是提供一种2-氨基十六烷酸-n-羧基内酸酐单体及其制备方法,并用2-氨基十六烷酸-n-羧基内酸酐通过开环聚合制备嵌段共聚物聚氨基酸,这些聚合物能通过自组装形成聚合物胶束及聚合物囊泡。为达到上述目的,本发明采用的技术方案是:一种具有式i结构的2-氨基十六烷酸-n-羧基内酸酐:式ⅰ。本发明公开了上述2-氨基十六烷酸-n-羧基内酸酐的制备方法,包括如下步骤,以2-氨基十六烷酸、蒎烯、三光气为反应物,在有机溶剂如无水四氢呋喃中反应,制备得到所述2-氨基十六烷酸-n-羧基内酸酐。上述技术方案中,2-氨基十六烷酸、蒎烯以及三光气的摩尔比为2∶4~6∶1~2;所述反应的时间为1~2小时,反应的温度为30~70℃。优选的,2-氨基十六烷酸、α-蒎烯及三光气的摩尔比为2∶3∶1。上述技术方案中,具体反应过程如下:将2-氨基十六烷酸、三光气和α-蒎烯加入到无水四氢呋喃中,搅拌均匀,在50℃下反应1小时后,将反应液自然冷却至室温后旋蒸浓缩,然后用石油醚沉淀得到粗产品;再将该粗产品用无水的四氢呋喃和石油醚重结晶2-3次,最终得到白色粉末状固体,即为2-氨基十六烷酸-n-羧基内酸酐(apa-nca)。上述制备方案可表示如下:本发明还公开了一种聚氨基酸,包括不含靶向分子聚氨基酸或者含靶向分子聚氨基酸;所述不含靶向分子聚氨基酸由上述2-氨基十六烷酸-n-羧基内酸酐在引发剂存在下制备得到;所述含靶向分子聚氨基酸由上述2-氨基十六烷酸-n-羧基内酸酐在引发剂和靶向分子存在下制备得到。本发明制备的聚氨基酸分子结构中,引发剂链段的分子量为2000~10000,(2-氨基十六烷酸)链段的分子量为1000~50000。本发明还公开了一种聚氨基酸的制备方法,由上述2-氨基十六烷酸-n-羧基内酸酐用引发剂开环聚合制备得到;或者由上述2-氨基十六烷酸-n-羧基内酸酐用引发剂开环聚合后偶联靶向分子制备得到。优选的,本发明公开了由上述2-氨基十六烷酸-n-羧基内酸酐用聚乙二醇化合物为引发剂聚合制备的嵌段共聚物聚氨基酸,其中聚乙二醇链段的分子量为2000-10000,聚(2-氨基十六烷酸)链段的分子量为1000~50000。所述聚乙二醇化合物可以为不同分子量的甲氧基聚乙二醇氨基、甲氧基聚乙二醇硅氮烷、丙烯酸酯聚乙二醇氨基、丙烯酸酯聚乙二醇硅氮烷、烯丙基聚乙二醇氨基、烯丙基聚乙二醇硅氮烷、马来酰亚胺聚乙二醇氨基、马来酰亚胺聚乙二醇硅氮烷、叠氮聚乙二醇氨基、叠氮聚乙二醇硅氮烷、炔基聚乙二醇氨基、炔基聚乙二醇硅氮烷、生物素聚乙二醇氨基、生物素聚乙二醇硅氮烷。优选的,所述嵌段共聚物由上述2-氨基十六烷酸-n-羧基内酸酐用聚乙二醇为引发剂经开环聚合制备得到,化学结构式如式ii所示:式ii。上述技术方案中,r为聚乙二醇化合物引发剂的末端官能基团,本发明优选聚乙二醇氨基引发剂。分子式见式iii:式iii其中,r为,,,或者。上述聚氨基酸的制备过程在有机溶剂如n,n-二甲基甲酰胺(dmf)、二氯甲烷(dcm)、三氯甲烷、四氢呋喃(thf)中进行,本发明优选n,n-二甲基甲酰胺作溶剂。本发明得到的聚合物的亲水段peg的末端可以化学偶联特异性靶向分子得到含靶向分子聚氨基酸,包括短肽(crgd、cngq、cc-9、cpp33、cpp44等),小分子靶向分子(叶酸、茴香酰胺等),抗体及抗体片段,多糖和单糖等。本发明制备的聚合物可应用于制备聚合物纳米结构,包括聚合物胶束和聚合物囊泡,并可包载药物,得到纳米药物,结合分散介质比如缓冲液,得到纳米药物体系。本发明还公开了一种聚合物纳米结构及其制备方法,由上述不含靶向分子聚氨基酸和/或含靶向分子聚氨基酸制备得到;或者在上述不含靶向分子聚氨基酸制备得到的纳米结构后再偶联靶向分子制备得到所述聚合物纳米结构。本发明还公开了一种纳米药物,包括上述聚合物纳米结构以及药物,包括多肽和蛋白质药物、疏水性化药及亲水性化药。本发明还公开了一种纳米药物的制备方法,由上述不含靶向分子聚氨基酸和/或含靶向分子聚氨基酸、药物制备得到所述纳米药物;或者在上述不含靶向分子聚氨基酸与药物制备得到的载药纳米结构后再偶联靶向分子制备得到所述纳米药物。本发明还公开了一种纳米药物体系及其制备方法,包括上述纳米药物以及分散介质;将上述纳米药物以及分散介质混合,得到所述纳米药物体系;分散介质可以为缓冲液或者生理盐水等。本发明还公开了2-氨基十六烷酸-n-羧基内酸酐、聚氨基酸、聚合物纳米结构或者纳米药物在制备抗肿瘤药物中的应用。本发明的聚合物具有合适的亲疏水比例,因此可以通过溶剂置换法制备得到一系列尺寸可控的聚合物胶束和聚合物囊泡。具体制备方法可以为:聚合物胶束和囊泡是通过溶剂置换法制备得到。将聚合物溶于n,n-二甲基甲酰胺(dmf)或四氢呋喃(thf)中,然后将聚合物溶液逐滴滴加到水或者是pb中,最后用截留分子量为7000的透析袋透析除去有机溶剂即可得到粒径在50-200nm的聚合物胶束或囊泡。可以通过调节上述靶向和非靶向聚合物的比例制备得到特异性靶向的聚合物胶束或囊泡。靶向分子的引入还可以在聚合物胶束或囊泡制备好以后,通过后修饰方法实现,比如在胶束或囊泡表面的peg端引入短肽(crgd、cngq、cc-9、cpp33、cpp44等),小分子靶向分子(叶酸、茴香酰胺等),抗体及抗体片段,多糖和单糖等。由于上述技术方案的应用,本发明与现有技术相比具有下列优点:本发明制备的α-氨基酸-n-羧基内酸酐为一种长链脂质内酸酐单体,可以通过开环聚合得到性能可控的聚脂肽,该类聚氨基酸相较于其他疏水性聚氨基酸具有更宽的溶剂选择窗和更好的溶解性;本发明利用聚乙二醇为引发剂、通过开环聚合得到分子量可控、分子量分布较窄聚合物,丰富了双亲性生物相容性聚合物的种类;本发明公开的聚合物具有优异的生物相容性,可以制备(肿瘤靶向)聚合物胶束和囊泡,可用于多肽和蛋白质药物、疏水性化药及亲水性化药的高效装载;本发明公开的聚氨基酸是一种聚脂肽,能组装形成纳米结构,同时可装载疏水性化药(如伊立替康)等多种药物用于多种癌症的治疗,还可以作为一种辅料链接到抗原上用于抗癌疫苗的制备,可广泛应用于纳米医药研究领域;本发明制备方法简单,所用原料来源广泛,从而具有良好的应用前景。附图说明图1是实施例一中apa-nca的核磁氢谱和核磁碳谱图;图2是实施例二中peg5k-b-papa3.5k的核磁氢谱图;图3是实施例三中aa-peg6k-b-papa4.2k的核磁氢谱图;图4是实施例三中crgd-peg6k-b-papa4.2k的核磁氢谱图;图5是实施例四和实施例五中crgd修饰的聚合物胶束的粒径分布(a)及透射电子显微镜图(b),血清稳定性(c)和体外释放(d);图6是实施例六和实施例七中crgd修饰的聚合物囊泡的粒径分布(a)及透射电子显微镜图(b),血清稳定性(c)和体外释放(d);图7是实施例八中空聚合物胶束对l929小鼠成纤维细胞和b16f10小鼠黑色素瘤细胞(a)和空聚合物囊泡对l929小鼠成纤维细胞和a549人肺癌细胞的细胞毒性结果图(b);图8是实施例九中载多西紫杉醇聚合物胶束对b16f10小鼠黑色素瘤细胞的细胞毒性(a),和载阿霉素聚合物囊泡对a549人肺癌细胞的细胞毒性(b);图9是实施例十中聚合物胶束(a)和囊泡(b)在小鼠体内的血液循环研究结果图;图10是实施例十一载药聚合物胶束在荷b16f10小鼠黑色素瘤小鼠体内的生物分布研究结果图(a)和载药囊泡在荷a549-luc人肺癌小鼠体内的生物分布研究结果图(b);图11是实施例十二中载dtx的靶向聚合物胶束dtx-crgd-pms在荷小鼠b16f10黑色素瘤c57/bl6小鼠体内的抑瘤情况图,其中a为肿瘤生长曲线,b为小鼠治疗后肿瘤图片,c为体重变化,d为生存曲线;图12是实施例十三中载dox的靶向聚合物囊泡dox-crgd-lpps在荷人a549-luc肺癌原位肿瘤裸鼠体内的抑瘤情况图,其中a为肿瘤生长曲线,b为小鼠体重变化,c为生存曲线。具体实施方式下面结合附图以及实施例对本发明作进一步描述:实施例一2-氨基十六烷酸-n-羧基内酸酐(apa-nca)的合成(1)将准确称取的2-氨基十六烷酸(3g,11mmol)置于经过无水无氧处理的三颈圆底烧瓶中,加入无水thf(100ml),将反应体系置于50℃的油浴中搅拌均匀,再将固体三光气(1.64g,5.5mmol)和α-蒎烯(α-pinene,2.7ml,16.5mmol)加入反应液中;反应1h后用将反应液自然冷却至室温后旋蒸浓缩,之后用石油醚沉淀得到apa-nca粗产品;再将粗产品溶于thf中,然后将溶液旋干,得到白色的产物,再用无水thf和石油醚重结晶三次,最终得到亮白色的粉末中固体即为apa-nca(1.65g,产率50%)。apa-nca核磁表征见附图1,1hnmr(400mhz,dmso-d6):δ9.07(s,1h,-chnhco-),4.41(m,1h,-cochnh-),1.65(d,2h,-ch2ch2ch-),1.29(d,2h,-ch2ch2ch3-),0.84(t,3h,-ch2ch3);13cnmr(100mhz,dmso-d6):δ171.66,151.96,57.04,31.33,30.95,29.06,28.91,28.76,28.43,24.26,22.12,13.93;apa-nca的元素分析为c,68.65;h,10.51;n,4.71(理论:c,68.37;h,10.07;n,4.65)。质谱:[m+na]+320.2202;(理论:320.2205)。实施例二peg-b-papa聚氨基酸嵌段共聚物的制备本发明以端氨基聚乙二醇为引发剂,通过开环聚合制备了两种papa链长不同的聚合物peg-b-papa。以合成peg5k-b-papa3.5k为例:在n2环境下,将大分子引发剂聚乙二醇氨基(mn=5000g/ml,100mg,0.02mmol)的dmf溶液加入到密闭反应器中,在搅拌的条件下将apa-nca(94mg,0.32mmol)的dmf溶液加入密闭反应器,在35℃的恒温油浴中反应48h至apa-nca单体完全聚合(对反应用红外监测,apa-nca单体酸酐的羰基吸收峰1841cm-1消失,表明聚合完全);聚合物溶液在无水冰乙醚中沉淀,经过过滤、常温真空干燥的到产物peg5k-b-papa3.5k。产率:91%。peg-b-papa嵌段共聚物的核磁表征见附图2。通过改变引发剂和单体投料比,可方便制备得到不同分子量和组成的聚合物(表1)。同时,papa聚氨基酸均聚物和peg-b-papa共聚物在氯仿和四氢呋喃溶剂中展现出了很好的溶解性(表2)。表1聚氨基酸共聚物的表征a:用1hnmr分析端基的计算结果;b:gpc的计算结果。表2聚氨基酸溶解性的表征溶剂papapeg5k-b-papa3.5kpeg5k-b-papa9.8k氯仿+++++++++四氢呋喃++++++n,n-二甲基甲酰胺-+-二甲亚砜---丙酮---+++:非常好溶解;++:好溶解;+:一定条件下可溶解;-:不溶。实施例三crgd修饰的peg-b-papa聚合物(crgd-peg-b-papa)的合成本发明合成了两种papa链长不同的crgd-peg-b-papa聚合物。以合成crgd-peg6k-b-papa4.2k为例:用丙烯酸修饰的聚乙二醇氨基(aa-peg-nh2,mw=6000g/mol)作为大分子引发剂,然后按实施例二方法制备聚合物。分两步制备crgd-peg6k-b-papa4.2k。首先,aa-peg6k-b-papa4.2k聚合物的制备:在n2环境下,将大分子引发剂丙烯酸聚乙二醇氨基(mn=6000g/mol,100mg,0.0167mmol)的dmf溶液加入到密闭反应器中,在搅拌的条件下将apa-nca(79.4mg,0.267mmol)的dmf溶液加入密闭反应器,在35℃的恒温油浴中反应48h至apa-nca单体完全聚合(对反应用红外监测,apa-nca单体酸酐的羰基吸收峰1841cm-1消失,表明聚合完全);聚合物溶液在无水冰乙醚中沉淀,经过过滤、常温真空干燥的到产物aa-peg6k-b-papa4.2k。aa-peg6k-b-papa4.2k嵌段共聚物的核磁表征见附图3。然后,通过光点击化学法制备crgd-peg6k-b-papa4.2k。在n2环境下将上述聚合物溶于dmf中,再将crgd-sh和光引发剂i2959加入聚合物溶液中;然后将反应转移至紫外固化箱中冰浴条件下于365nm的紫外光中反应20分钟。反应结束后,将聚合物溶液用截留分子量为3500的透析袋在dmf中透析24h,之后换蒸馏水透48h,最后冷冻干燥得到白色固体。产率:83%。crgd-peg6k-b-papa4.2k嵌段共聚物的核磁表征见附图4。实施例二以及实施例三的反应可表示如下,a为实施例二,b为实施例三。实施例四peg-b-papa聚合物胶束的制备在搅拌状态下,将pb缓冲溶液或超纯水逐滴滴到peg5k-b-papa3.5k的n,n-二甲基甲酰胺(dmf)溶液中,然后用截留分子量为7000的透析袋透析上述溶液除去有机溶剂,透析过程在ph=7.4的pb缓冲液或者纯水中进行。最终,由动态光散射粒度分析仪(dls)测得聚合物胶束的尺寸为78nm,粒径分布较窄。而crgd靶向胶束的制备则是将peg5k-b-papa3.5k和crgd-peg6k-b-papa4.2k按一定摩尔比溶解在1mldmf中,然后用上述透析法制得。靶向聚合物的peg分子量比非靶向聚合物的peg要长,以保证靶向分子能更好的暴露在胶束表面。聚合物胶束表面crgd密度可通过调节含crgd的crgd-peg6k-b-papa4.2k聚合物的比例来控制。用含20%摩尔浓度的crgd-peg6k-b-papa4.2k制得的含靶向分子的胶束尺寸较小(80nm),粒径分布较窄(图5a)。由图5b可知,tem测得该聚合物胶束为实心球状结构。而且,聚合物胶束在10%的胎牛血清环境中具有较好的稳定性(图5c)。实施例五聚合物胶束装载多西紫杉醇及体外释放载药胶束的制备与用溶剂置换法制备聚合物胶束的制备方法类似。具体为,将mpeg5k-b-papa3.5k和crgd-peg6k-b-papa4.2k按摩尔比4:1溶于dmf(5mg/ml)中。将聚合物溶液和多西紫杉醇(dtx,10mg/ml,dmf)混匀置于小瓶子中,再将pb(ph=7.4,10mm)缓冲溶液或超纯水逐滴滴到其中,然后用截留分子量为7000的透析袋透析上述溶液除去有机溶剂和游离的药物,透析过程在ph=7.4的pb缓冲液或者纯水中进行。最后用dls测得载药胶束的粒径为60nm左右,粒径分布在0.18-0.19。hplc测定dtx的包载效率为74%(表3)。得到的载药胶束命名为dtx-crgd-pms,表示包载的药物为dtx,靶向分子为crgd。dtx的体外释放实验在37℃恒温摇床中震荡(200rpm)进行,每组做三个平行样。载dtx的靶向胶束在pb(10mm,ph7.4)中,胶束的浓度为0.2mg/ml,取0.5ml放入释放透析袋(mwco:12,000)中,每个试管中加入响应的透析介质25ml,在预定的时间间隔取出5.0ml透析袋外部介质用作测试,同时向试管中补加5.0ml响应介质。使用hplc测定溶液中药物浓度。附图5d为dtx累积释放量与时间的关系,从图中可以看出载药胶束能通过扩散作用释放药物。表3载多西紫杉醇胶束的表征(理论载药量为15%)a:通过动态光散射测得;b:通过hplc测得;c:通过电泳测得。实施例六peg-b-papa聚合物囊泡的制备在搅拌状态下,将peg5k-b-papa9.8k的thf溶液逐滴滴到pb缓冲溶液或超纯水中,然后用截留分子量为7000的透析袋透析上述溶液除去有机溶剂,透析过程在ph=7.4的pb缓冲液或者纯水中进行。最终,由动态光散射粒度分析仪(dls)测得聚合物囊泡的尺寸为80nm,粒径分布较窄。而crgd靶向聚合物囊泡则是将peg5k-b-papa9.8k和crgd-peg6k-b-papa10k按摩尔比4:1溶于thf中,配成2mg/ml的溶液。在搅拌状态下将聚合物溶液逐滴滴到pb或纯水中,然后透析除去有机溶剂。由动态光散射粒度分析仪(dls)测得聚合物囊泡的尺寸为80nm,粒径分布较窄(图6a)。由图6b可知,tem测得聚合物囊泡为空心球状结构。而且,聚合物囊泡在10%的胎牛血清环境中仍然保持稳定(图6c)。实施例七聚合物囊泡载亲水性药物dox·hcl及体外释放将peg5k-b-papa9.8k和crgd-peg6k-b-papa10k按摩尔比4:1溶于thf中,配成2mg/ml的溶液。将聚合物溶液200μl逐滴滴到800μl的柠檬酸缓冲液(10mm,ph4.0)中,然后用过饱和的na2hpo3将ph调至7.8~8.0,然后再将dox·hcl加到溶液中,而后置于37℃摇床(200rpm)中摇过夜;最后在透析介质(pb,10mm,ph7.4)中透析8h,换五次透析液。载不同比例的药(10~20wt.%)的聚合物囊泡的粒径在80-90nm,粒径分布在0.17-0.20。荧光光谱仪测得dox·hcl的包载效率为68-84%,得到dox-crgd-lpps(表4)。dox·hcl的体外释放实验同实施例五。dox·hcl累积释放量与时间的关系可以看出,dox·hcl可以通过自有扩散作用跨膜释放(图6d)。靶向聚合物的peg分子量比非靶向聚合物的peg要长,以保证靶向分子能更好的暴露在聚合物囊泡的表面。两者按不同比例混合可制备表明具有不同靶向分子密度的聚合物胶束。本发明中,胶束体系和囊泡体系的靶向比例均优先选择20wt.%。表4载阿霉素靶向囊泡的表征a:通过荧光光谱仪测得;b:通过动态光散射测得;c:通过电泳测得。实施例八mtt法测试空聚合物胶束和囊泡的细胞毒性mtt法使用鼠黑色素瘤细胞(b16f10)人肺癌细胞(a549)和鼠成纤维细胞(l929)。以5×103个/ml将细胞种于96孔板,每孔100μl,24小时后养至细胞贴壁70%左右。然后,实验组各孔中分别加入含有不同浓度(0.1-1.0mg/ml)的胶束或囊泡样品(以实施例四的空聚合物胶束和实施例六的空聚合物囊泡为例),另设细胞空白对照孔和培养基空白孔(复4孔)。培养24小时后,每孔加入mtt(5.0mg/ml)10μl,继续培养4小时后每孔加入150μldmso溶解生成的结晶子,用酶标仪于570nm处测吸光度值,以培养基空白孔调零,计算细胞存活率。附图7a为聚合物胶束对l929和b16f10的细胞毒性结果,可看出,当聚合物胶束的浓度从0.1增到1.0mg/ml时,b16f10的存活率仍高于90%,说明该聚合物胶束具有良好的生物相容性。聚合物囊泡的细胞毒性的测定于此类似,见附图7b,毒性均很小,具有良好的生物相容性。实施例九mtt法测载药聚合物胶束对b16f10黑色素瘤细胞和载药聚合物囊泡对a549肺癌细胞的毒性测试对象为实施例五的dtx-crgd-pms和实施例七的dox-crgd-lpps,无靶向的dtx-pms及游离dtx,无靶向的dox-lpps及lipo-dox组分别作为对照组。细胞的培养和实施例八相同,纳米粒或药物与细胞共同培养4小时后,换新培养基继续孵育44h后加入mtt,处理和测定吸光度同实施例八。实验结果参见附图8。图8a结果显示dtx-crgd-pms对b16f10细胞的半致死浓度(ic50)为0.15μg/ml,比dtx-pms的半致死浓度小2.6倍;附图8b是载药囊泡对a549细胞的毒性实验结果,从图中可以看出dox-crgd-lpps对a549细胞的半致死浓度为15.17μg/ml,远低于lipo-dox,比dox-lpps的半致死浓度小1倍。说明本发明的胶束和囊泡能很好的将药物传送到细胞内,并且有效的释放,最终杀死癌细胞,而靶向胶束和靶向囊泡的效果更好。实施例十靶向和非靶向胶束及囊泡的血液循环所有动物实验操作符合苏州大学动物实验中心规定。实验选用体重为18~20克左右,4~6周龄balb/c小鼠。cy5标记的胶束pms-cy5由peg5k-b-papa3.5k和peg5k-b-papa3.5k-cy5按1:1混合制备,此比例形成的cy5标记的胶束粒径为60nm,粒径分布为0.19。crgd-pms-cy5胶束是由crgd-peg6k-b-papa4.2k和peg5k-b-papa3.5k-cy5按1:1混合制备,形成的聚合物胶束粒径为60nm左右,粒径分布为0.18。将pms-cy5和crgd-pms-cy5同过尾静脉注射到小鼠体内(cy5浓度为4μm),在0、0.25、0.5、1、2、4、8、12和24小时定点取血约10μl,通过差量法准确计算血液重量,再加100μl浓度为1%的曲拉通和600μldmf萃取24h;然后离心(20000rpm,20min)后,取上层清液,通过荧光光谱仪测得每个时间点cy5的量。图9a中横坐标为时间,纵坐标为每克血液中的cy5占总的cy5注射量(id%/g)。由图9a可知,靶向聚合物胶束、非靶向聚合物胶束在小鼠体内的消除半衰期分别为2.73和2.33小时,所以本发明的聚合物胶束在小鼠体内稳定,有较长循环时间。同上所述,将dox-lpps和dox-crgd-lpps通过尾静脉注射到小鼠体内(dox的给药量为10mg/kg),在0、0.25、0.5、1、2、4、8、12和24小时定点取血约10μl,通过差量法准确计算血液重量,再加100μl浓度为1%的曲拉通和600μldmf萃取24h;然后离心(20000rpm,20min)后,取上层清液,通过荧光光谱仪测得每个时间点dox的量。图9b中横坐标为时间,纵坐标为每克血液中的dox占总的dox注射量(id%/g)。由图9b可知,靶向聚合物囊泡、非靶向聚合物囊泡在小鼠体内的消除半衰期分别为3.74、3.33小时,所以本发明的聚合物囊泡在小鼠体内稳定,有较长循环时间。实施例十一dtx-pms和dtx-crgd-pms聚合物胶束在荷b16f10黑色素瘤小鼠及dox-lpps和dox-crgd-lpps聚合物囊泡在荷人a549-luc原位肺癌小鼠的体内生物分布动物同实施例十,在c57bl/6黑鼠皮下注射8×107个b16f10鼠黑色素瘤细胞,大约7~8天后肿瘤大小为200mm3左右时开始实验。将dtx-pms和dtx-crgd-pms和游离的dtx通过尾静脉注射到小鼠体内(dtx:10mg/kg),6h后处死老鼠,将肿瘤及心、肝、脾、肺和肾组织取出,清洗称重后加入500μl的无水甲醇,通过匀浆机磨碎后再加入500μl无水甲醇萃取24h。最后,离心(20000rpm,20min),取上清液,用高效液相色谱测所有样品中dtx的量。图10a中横坐标为组织器官,纵坐标为每克肿瘤或组织中的dtx占总dtx注射量(id%/g)。dtx-pms、dtx-crgd-pms和游离dtx注射6小时在肿瘤积累的dtx量分别为2.9、7.9和1.3id%/g,dtx-crgd-pms分别为dtx-pms和dtx的2.5倍和5.5倍,说明dtx-crgd-pms通过主动靶向在肿瘤部位富集较多。在裸鼠左侧肺叶原位注射8×107个a549-luc人肺癌细胞,大约10天后经小鼠活体成像仪检测小鼠肺部生物发光强度为106时开始实验。将dox-lpps、dox-crgd-lpps和商用lipo-dox通过尾静脉注射到小鼠体内(dox·hcl:10mg/kg),6h后处死老鼠,将小鼠心、肝、脾、肺和肾组织取出,清洗称重后加入500μl的浓度为1%的曲拉通溶液,通过匀浆机磨碎后再加入500μln,n-二甲基甲酰胺萃取24h。最后,离心(20000rpm,20min),取上清液,用荧光光谱仪测所有样品中dox的量。图10b中横坐标为组织器官,纵坐标为每克肿瘤或组织中的dox占总dox注射量(id%/g)。dox-lpps、dox-crgd-lpps和lipo-dox注射6小时后在肿瘤积累的dox量分别为3.4、6.1和4.3id%/g,说明dox-crgd-lpps通过主动靶向在肿瘤部位富集较多。实施例十二dtx-crgd-pms和dtx-pms多次低剂量给药和单次高剂量给药在荷b16f10皮下黑色素瘤的小鼠中的抑瘤效果、体重变化和存活率肿瘤的接种以及尾静脉给药同实施例十一,在接种四天后,肿瘤大小为30~50mm3时开始实验。将dtx-crgd-pms(single-dose)、dtx-crgd-pms(multi-dose40&80mg/kg)、dtx-pms、dtx及pbs分别在第0、2、4、6天(单次给药组只在第0天给)通过尾静脉注射到小鼠体内(dtx药量为10mg/kg)。在0~10天,每两天测量小鼠的体重和肿瘤体积,肿瘤体积的计算方法:v=(l×w2)/2,(其中l、w分别为肿瘤的长度和宽度)。持续观察小鼠的生存到40天。由图11可知,在第十天时,dtx-crgd-pms治疗组肿瘤得到明显的抑制,而dtx-pms组的肿瘤有一定的增长,游离dtx对肿瘤的抑制效果并不明显;而对于单次大剂量给药组,40mg/kg组对肿瘤的抑制效果不佳,而80mg/kg组显示出优异的抑瘤效果,且各组肿瘤大小照片进一步验证了该结论。而且各治疗组小鼠的体重均没有明显变化,表明在此给药量下小鼠耐受良好,毒副作用低。在小鼠的存活率方面,dtx-crgd-pms(multi-dose)、dtx-crgd-pms(single-dose40)、dtx-crgd-pms(single-dose80)、dtx-pms、dtx及pbs组的生存中值分别为35d、13d、23d、27d、9d、9d。实施例十三dox-crgd-lpps和dox-lpps在荷a549-luc原位肺癌的小鼠中的抑瘤效果、体重变化和存活率动物同实施例十一,在5周龄的裸鼠在左侧肺叶上注射5×106的a549-luc人肺癌细胞,大约2~3周后肿瘤荧光值大约为105~106时即可开始实验。将dox-crgd-lpps、dox-lpps、lipo-dox和pbs分别在第0、4、8、12天通过尾静脉注射到小鼠体内(dox·hcl注射量:dox-crgd-lpps,dox-lpps组为10.0mg/kg;lipo-dox组为7.5mg/kg)。在第0~20天,每4天称量小鼠的体重,并对小鼠进行生物发光成像,通过荧光值来监测肿瘤的大小。由图12可知,在第20天时,dox-crgd-lpps治疗组肿瘤得到明显的抑制,而dox-lpps和lipo-dox组的肿瘤有一定的增长。经过观察,dox-crgd-lpps、dox-lpps小鼠生存中值分别为36d、24d左右。以peg3.5k-b-papa7k、peg5k-b-papa13k、peg7.5k-b-papa21k、peg10k-b-papa50k为基础制备的聚合物囊泡、靶向聚合物囊泡,测试细胞的存活率都大于90%,毒性均很小,具有良好的生物相容性;载阿霉素聚合物囊泡的粒径在80纳米左右,理论载药为20%时包封率达到83%以上;对a549细胞的半致死浓度为15μg/ml左右;在小鼠体内的消除半衰期都大于3.2小时;dox-lpps和dox-crgd-lpps聚合物囊泡纳米药物注射6小时后在肿瘤积累的dox量分别大于3.2id%/g、6.0id%/g,小鼠生存中值分别为36d、24d左右。以peg10k-b-papa8k、peg7.5k-b-papa6k、peg5k-b-papa5k、peg3.5k-b-papa4k为基础制备的聚合物胶束、靶向聚合物胶束,测试细胞的存活率都大于90%,毒性均很小,具有良好的生物相容性;载多西他赛的聚合物胶束的粒径在60纳米左右,理论载药为15%时包封率达到70%以上;对b16f10细胞的半致死浓度(ic50)为0.15μg/ml左右;在小鼠体内的消除半衰期都大于2.2小时;dtx-pms和dtx-crgd-pms聚合物胶束纳米药物注射6小时后在肿瘤积累的dtx量分别大于2.8id%/g、7.8id%/g,小鼠生存中值分别为35d、26d左右。当前第1页12
