一种四氟取代异靛蓝衍生物及其制备方法与流程
本发明属于有机光伏技术领域,具体涉及一种四氟取代异靛蓝衍生物及其制备方法。
背景技术:
由于靛蓝的染着和耐光坚牢度的特殊性质,一直被广泛应用于染料工业和研究中。对于引起靛蓝特殊光学性质的发色基团的研究证明,连接两个环状结构的碳碳双键和杂环上的氮原子以及羰基是直接影响靛蓝光学性质的因素。由此而发展起来的相应发色基团的取代物的实验制备和理论研究极大地促进了靛蓝系列染料在化学工业生产及生物医学上的应用。靛蓝作为典型的有机染料分子,在化学研究中常用作指示剂检测微量金属离子,而异靛蓝是一种重要染料——靛蓝的异构体,与靛蓝具有相似的性质,同时还具有较窄的带隙,良好的共平面、共轭性能、宽光谱吸收等特点,广泛应用于有机场效应二极管、有机光伏技术等领域。
异靛蓝具有良好的化学修饰性,易通过引入烷基改善溶解性,优化分子的加工性能,也可引入d-a体系,改变分子的电荷分布,调控分子的轨道能级,常用作有机光电分子的受体单元,在已知材料体系中占有较大比重。目前,异靛蓝的修饰常表现在氮原子上取代基的改变,通过改变烷基链的长度和支化程度调节材料在常规溶剂中的溶解性,但是在调节异靛蓝共轭性能上效果甚微。近期,研究人员通过在异靛蓝共轭苯环中引入一个氟原子,制备合成了具有对称和不对称的单氟取代的异靛蓝(j.am.chem.soc.,2012,134,20025;adv.mater.,2014,26,471;energyenviron.sci.,2015,8,585;chem.commun.,2014,50,439;poly.chem.,2014,5,4984;poly.chem.,2015,6,6040),能够精细调节分子的共轭性能和电子性能,能大幅度调节材料的能级结构,在薄膜晶体管、有机太阳能电池等领域具有广泛应用前景。
目前,针对异靛蓝苯环氟原子取代材料多为单氟取代材料,而对于同一个苯环中引入两个甚至是多个氟原子未见报道。众所周知,异靛蓝分子含有两个氧原子,当在单氟取代的基础上再引入氟原子,缩短了与异靛蓝邻近氧原子原子间距离,当有相应的氢原子会形成稳定的六元环分子内氢键,这样增强了整个分子的刚性结构,形成较大的共轭体系,增强材料的吸收性能,但是在国内外仍未见相关报道。
技术实现要素:
为了克服现有多氟受体单元的有机光电材料及中间体种类少、制备困难、路线繁琐、条件苛刻等不足,本发明提供一种四氟取代异靛蓝衍生物,在单氟取代异靛蓝基础上在特定位置再引入氟原子增强材料共轭性能和缺电性能并考察其制备方法。该方法操作简单、产物易分离纯化、易于修饰改性、易用于构建复杂有机光电功能分子,在有机光电领域具有较好的应用前景。
发明构思:氟原子半径较小、可极化率高、电负性强等优点,常用作缺电子基团引入受体单元,进一步降低受体单元的缺电子性,在d-a体系中常用来改变体系电荷分布,降低分子的轨道能级,在有机光伏领域常用来提升开路电压。基于以上思考,本发明将异靛蓝结构中苯环进行多氟原子取代,设计出了四氟取代异靛蓝衍生物及其制备路线,以期在有机光电材料领域得到应用。
一种四氟取代异靛蓝衍生物,其结构式为:
其中r为c1-c10的烷基,其制备方法为:将(e)-5,5-二溴-4,4,6,6-四氟-3,3-二吲哚-2,2-二酮与无机碱溶解于有机溶剂中,氮气保护下,40~80℃反应0.5~2小时,加入烷基溴化物,反应过夜,冷却后经萃取、干燥、浓缩、柱层析或重结晶纯化,即可以30%-40%的分离产率得到四氟取代异靛蓝衍生物。
所述的无机碱指的是碳酸钾、氢氧化钾、氢氧化钠中的一种或多种。
所述的一定摩尔比指的是(e)-5,5-二溴-4,4,6,6-四氟-3,3-二吲哚-2,2-二酮:无机碱:烷基溴化物=1:1~6:2~8。
所述的有机溶剂指的是乙腈、1,4-二氧六环、n,n-二甲基甲酰胺、二甲亚砜中的一种或多种。
本发明的主要优点在于:
1.合成的四氟取代异靛蓝衍生物具有结构新颖,缺电性和共轭性强。
2.合成的四氟取代异靛蓝衍生物具有良好的溶解性,能溶于大部分有机溶剂,如氯仿、二氯甲烷、四氢呋喃和氯苯等。
3.合成的四氟取代异靛蓝衍生物具有合适的电化学能级,适合用于有机太阳能电池材料前体材料。
4.合成的四氟取代异靛蓝衍生物具有活性较高的碳溴键,能通过其他化学反应进行进一步修饰,如suzuki反应,kumada反应等,获得其他衍生物。
附图说明
图1为(e)-5,5'-二溴-4,4',6,6'-四氟-1,1'-二辛基-[3,3'-二吲哚]-2,2'-二酮的1hnmr谱图。
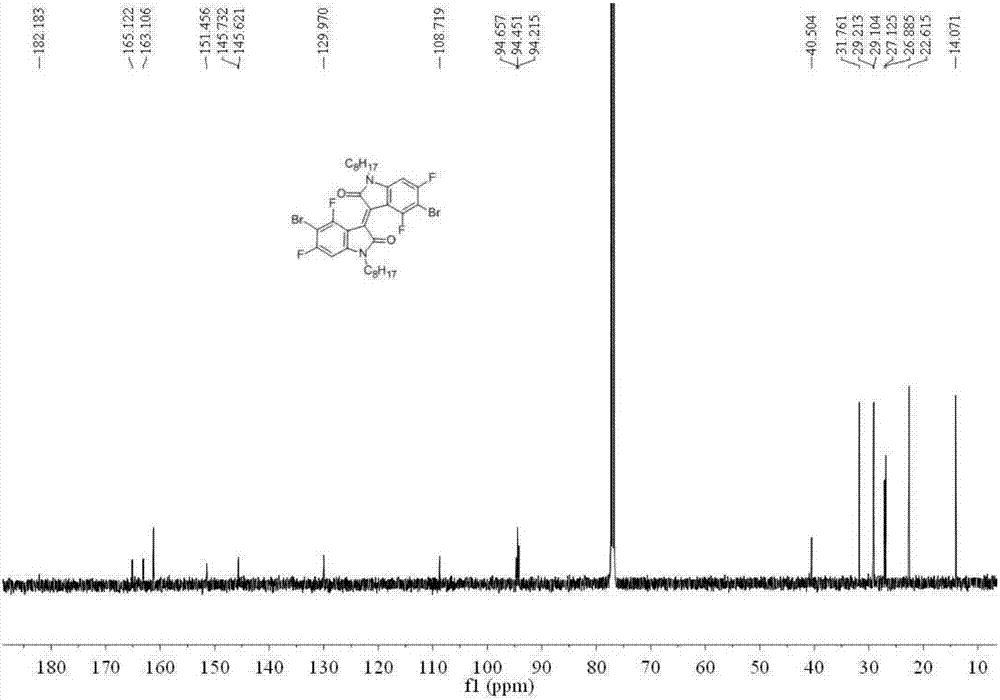
图2为(e)-5,5'-二溴-4,4',6,6'-四氟-1,1'-二辛基-[3,3'-二吲哚]-2,2'-二酮的13cnmr谱图。
图3为(e)-5,5'-二溴-4,4',6,6'-四氟-1,1'-二辛基-[3,3'-二吲哚]-2,2'-二酮的19fnmr谱图。
具体实施方式
下面通过具体实施例对本发明做进一步的解释说明。
四氟取代异靛蓝衍生物的制备路线如下所示,以4-溴-3,5-二氟苯胺1为起始原料,依次经酰化关环、wolff-kishner-黄鸣龙还原、缩合反应过程得到四氟取代异靛蓝衍生物中间体4,然后中间体4在无机盐存在下与溴代烷烃发生氮烷基化反应,最终生成四氟取代异靛蓝衍生物5,详见实施例1-4。
实施例1.5-溴-4,6-二氟吲哚-2,3-二酮(2)合成路线如下:
在250ml单口圆底烧瓶中加入水合氯醛(4.775g,28.94mmol)溶于75ml去离子水,搅拌下依次加入硫酸钠(50g,342.1mmol),4-溴-3,5-二氟苯胺(1)(5.47g,26.32mmol),1m硫酸20ml,盐酸羟胺(5.48g,78.94mmol),将反应体系加热到130℃,反应0.5小时。将反应体系冷却到80℃,趁热过滤,滤饼用去离子水洗涤,真空干燥得到一黄色固体,留待下步反应。
在250ml单口圆底烧瓶中加入50ml浓硫酸,加热到50℃,搅拌下分批次加入上述黄色固体。加毕,保持70℃反应1小时。反应结束,冷却到室温,倒入冰水浴中,抽滤,滤液用乙酸乙酯萃取,合并滤液和滤饼,柱色谱分离纯化(v正己烷:v乙酸乙酯=8:1),最终得到黄色固体5克,产率36%。1hnmr(500mhz,dmso)δ11.5(s,1h),8.82(d,j=7.6hz,1h).13cnmr(126mhz,dmso)δ178.19,165.32(dd,j=255.6,5.5hz),159.39(s),155.76(dd,j=259.9,7.2hz),151.83(dd,j=15.6,8.6hz),104.30(d,j=19.2hz),98.43(dd,j=28.3,3.2hz),90.48(dd,j=26.2,23.7hz).
实施例2.5-溴-4,6-二氟吲哚-2-酮(3)合成路线如下:
在50ml单口圆底烧瓶中加入5-溴-4,6-二氟吲哚-2,3-二酮(2)(1g,3.8mmol)溶于20ml乙醇中,氮气保护下,向反应瓶中滴加80%水合肼0.3ml,回流反应0.5小时,有黄色沉淀生成,抽滤。黄色沉淀溶于20ml无水乙醇中,氮气保护下加入叔丁醇钾(1.33g,11.88mmol),回流反应2小时。反应完成后,将反应体系冷却到室温,加适量水,稀盐酸调节ph=2,用乙酸乙酯萃取,有机相饱和食盐水洗涤,无水硫酸镁干燥,过滤除去不溶物,滤液浓缩后经柱层析纯化(v正己烷:v乙酸乙酯=5:1),最终得到黄色固体0.64克,产率15%。1hnmr(500mhz,dmso)δ10.84(s,1h),6.71(d,j=8.3hz,1h),3.60(s,1h).
实施例3.四氟取代异靛蓝衍生物中间体(4)合成路线如下:
在50ml单口圆底烧瓶中加入5-溴-4,6-二氟吲哚-2,3-二酮(2)(0.32g,1.2mmol),5-溴-4,6-二氟吲哚-2-酮(3)(0.3g,1.2mmol)和冰醋酸25ml,搅拌下向反应瓶中滴加浓盐酸0.1ml,将反应体系加热到回流,反应24小时。将反应体系冷却到室温,抽滤,滤饼用水洗、乙醇洗和乙醚洗涤,真空干燥,最终得到棕红色固体0.27克,产率46%。1hnmr(500mhz,dmso)δ10.74(s,1h),6.31(d,j=8.0hz,1h).13cnmr(126mhz,dmso)δ162.48,151.62,145.73,130.56,96.07,95.84,93.11,92.90.
实施例4.四氟取代异靛蓝衍生物(5)合成路线如下:
在25ml单口圆底烧瓶中加入(e)-5,5'-二溴-4,4',6,6'-四氟-[3,3'-二吲哚]-2,2'-二酮(4)(0.456g,1.0mmol),碳酸钾(0.33g,1.2mmol)和n,n-二甲基甲酰胺10ml,氮气保护下加热到60℃,反应1小时。向反应体系在加热溴辛烷(0.48g,2.5mmol),保持60℃反应12小时。反应结束后,冷却至室温,加入适量水,二氯甲烷萃取,合并有机相,用饱和食盐水洗涤三次,无水硫酸镁干燥,过滤除去不溶物,滤液浓缩后经柱层析纯化(v氯仿:v正己烷:=1:4),最终得到棕红色固体0.2克,产率35%。1hnmr(500mhz,cdcl3)δ6.13(d,j=7.6hz,1h),3.55(t,j=7.4hz,2h),1.67–1.51(m,3h),1.30(dd,j=12.5,5.8hz,10h),0.90(t,j=7.0hz,3h).13cnmr(126mhz,cdcl3)δ182.18,164.11(d,j=253.5hz),161.22(s),151.46,145.68(d,j=13.9hz),129.97,108.72,94.44(t,j=27.8hz),40.50,31.76,29.21,29.10,27.13,26.88,22.61,14.07.19fnmr(471mhz,cdcl3)δ-91.65,-91.64.
- 还没有人留言评论。精彩留言会获得点赞!
- 用于生产化学品及其衍生物的组合物和方法与制造工艺
- 7‑OH‑8‑[(1‑胺基‑1‑苯基衍生物)‑次甲基]‑黄酮化合物及其制备方法及其应用与制造工艺
- 联苯胺衍生物、其制造方法和电子照相感光体与制造工艺
- 包含环糊精衍生物的可注射美法仑组合物及其制备和使用方法与制造工艺
- 含D型非天然氨基酸的抗菌肽类似物及其合成与应用的制造方法与工艺
- 一种黄芪甲苷衍生物及其制备方法和应用与制造工艺
- (Z,E)5‑OH‑3‑(苯基衍生物‑次甲基)‑二氢黄酮‑7‑O‑糖苷及其制备及其应用的制造方法与工艺
- 喹唑啉衍生物的制造方法与工艺
- 一种白杨素氨基酸衍生物的制备方法与制造工艺
- Harrisotone A衍生物的组合物在防治肝脏损伤药物中的应用的制造方法与工艺
- 联苯胺衍生物、其制造方法和电子照相感光体与制造工艺
- 包含环糊精衍生物的可注射美法仑组合物及其制备和使用方法与制造工艺
- 一种黄芪甲苷衍生物及其制备方法和应用与制造工艺
- (Z,E)5‑OH‑3‑(苯基衍生物‑次甲基)‑二氢黄酮‑7‑O‑糖苷及其制备及其应用的制造方法与工艺
- 喹唑啉衍生物的制造方法与工艺
- 吡唑衍生物及其作为大麻素受体介体的用途的制造方法与工艺
- Harrisotone A衍生物的组合物在防治肝脏损伤药物中的应用的制造方法与工艺
- 水生态处理中淤泥及衍生物的再利用处理系统的制造方法与工艺
- Schiglautone A衍生物的组合物用于制备抗缺氧药物的制作方法
- Schiglautone A衍生物的组合物用于制备抗红细胞低下性贫血药物的制作方法
- Harrisotone A衍生物的组合物在防治肝脏损伤药物中的应用的制造方法与工艺
- 水生态处理中淤泥及衍生物的再利用处理系统的制造方法与工艺
- 一种新型罗汉果醇衍生物单体的制作方法
- Schiglautone A衍生物的组合物用于制备抗鼻炎药物的制作方法
- Schiglautone A衍生物的组合物用于制备防治肾纤维化药物的制作方法
- Artalbic acid衍生物的组合物用于制备抗心衰药物的制作方法
- Artalbic acid衍生物的组合物用于制备抗慢性阻塞性肺病药物的制作方法
- Schiglautone A 衍生物的组合物用于制备抗慢性阻塞性肺病药物的制作方法
- Artalbic acid的衍生物的组合物用于制备抗慢性阻塞性肺病药物的制作方法
- Artalbic acid的衍生物的组合物用于制备防治胰腺纤维化药物的制作方法
- 一种新型罗汉果醇衍生物单体的制作方法
- 通过预先占位调控邻位碳硼烷衍生物结构的方法
- Schiglautone A衍生物的组合物用于制备抗鼻炎药物的制作方法
- Schiglautone A衍生物的组合物用于制备防治肾纤维化药物的制作方法
- Artalbic acid衍生物的组合物用于制备抗心衰药物的制作方法
- Artalbic acid衍生物的组合物用于制备抗慢性阻塞性肺病药物的制作方法
- Artalbic acid衍生物的组合物用于制备抗菌药物的制作方法
- Schiglautone A 衍生物的组合物用于制备抗慢性阻塞性肺病药物的制作方法
- Artalbic acid的衍生物的组合物用于制备抗慢性阻塞性肺病药物的制作方法
- Artalbic acid的衍生物的组合物用于制备防治胰腺纤维化药物的制作方法