一种枸杞多糖精制的方法与流程
本发明属于枸杞多糖分离纯化技术领域,具体涉及一种枸杞多糖精制的方法。
背景技术:
枸杞属茄科,主要分布于我国西北地区,已用作传统中药超过2000多年,目前在东亚、欧洲、北美和国内广泛作为功能性食品,市场份额大。研究表明,枸杞子富含多种活性成分,其中包括18种氨基酸(8种人体必须氨基酸)、21种微量元素、黄酮、蛋白、多糖、类胡萝卜素等。
枸杞多糖是枸杞子最主要的活性成分之一,具有多种生物活性如降血糖、降血脂、抗氧化、抗衰老、抗疲劳等,同时还具有免疫调节活性,如促进t细胞、b细胞增值,能够促进no等细胞因子产生。自然界中的活性多糖大多属于鼠李糖半乳聚糖型、阿拉伯聚糖型、阿拉伯半乳聚糖型和果胶类多糖等类型。多糖的理化性质和结构决定了其生物活性,而理化性质和结构受其提取和分离纯化方法的影响,因此枸杞多糖的提取分离纯化工艺对枸杞多糖的生物活性尤为重要。
现有技术中,枸杞多糖主要是通过水提醇沉透析冷冻干燥得枸杞粗多糖,枸杞粗多糖经阴离子交换柱层析,凝胶过滤柱层析等复杂过程才能得到纯度较高的枸杞多糖,收率低,且易丢失活性多糖组分,难以全面评价枸杞多糖的功能。
技术实现要素:
本发明提供的一种枸杞多糖精制的方法,解决了现有技术的枸杞多糖分离纯化方法操作复杂,得率低,容易丢失活性组分,难以全面评价枸杞多糖的功能的问题。
本发明的第一个目的是提供一种枸杞多糖精制的方法,包括以下步骤:
步骤1,枸杞多糖的提取
步骤1.1,将枸杞子粉碎后,室温浸泡于相当于枸杞子重量3倍体积的蒸馏水中,浸泡24h,离心,收集上清液,浓缩,向浓缩液中加入无水乙醇沉淀,离心,收集沉淀物;
步骤1.2,向所述沉淀物中加入蒸馏水,得到复溶液;然后向复溶液中加入相当于复溶液1/5体积的sevage试剂,300r/min搅拌15min,离心,收集上清液;
步骤1.3,重复步骤1.2的操作数次直至无沉淀,将最后一次上清液用玻璃纸透析,收集袋内溶液,冷冻干燥,得到枸杞粗多糖;
步骤1.4,将枸杞粗多糖用蒸馏水复溶后,再用截留分子量为8-14kda的透析袋透析,收集透析袋内透析液,离心,收集上清液冷冻干燥,得到大分子枸杞多糖;收集透析袋外溶液,浓缩冷冻干燥,得到小分子枸杞多糖;
步骤2,大分子枸杞多糖的精制
将大分子枸杞多糖配成水溶液,加入无水乙醇,使乙醇的体积分数为30%,沉淀12h,离心收集第一次多糖上清液和第一次多糖沉淀,向第一次多糖沉淀中加蒸馏水复溶,离心,收集的上清液经冷冻干燥,得到初级纯化的第一个枸杞多糖组分;
接着向第一次多糖上清液中加入无水乙醇,使乙醇的体积分数为50%,沉淀12h,离心收集第二次多糖上清液和第二次多糖沉淀,向第一次多糖沉淀中加蒸馏水复溶,离心,收集的上清液经冷冻干燥,得到初级纯化的第二个枸杞多糖组分;
继续向第二次多糖上清液中加入无水乙醇,使乙醇的体积分数为70%,沉淀12h,离心收集第三次多糖沉淀,向第三次多糖沉淀中加蒸馏水复溶,离心,收集的上清液经冷冻干燥,得到初级纯化的第三个枸杞多糖组分;
将初级纯化的第一、二、三个枸杞多糖组分分别经sephadexg-100柱层析分离纯化,分别得到第一、二、三个高纯度枸杞多糖。
优选的,上述的枸杞多糖精制的方法,步骤1.1、步骤1.2、步骤1.4和步骤2中离心条件均为8000r/min离心10min。
优选的,上述的枸杞多糖精制的方法,步骤1.1的具体操作为:将枸杞子粉碎后,加入相当于枸杞子重量3倍体积的蒸馏水,混匀,用1mol/l氢氧化钠溶液调ph至7.0,浸泡24h,8000r/min离心10min,收集第一次上清液和第一次沉淀;向第一次沉淀中加入相当于枸杞子重量1.5倍体积的蒸馏水,浸泡6h,8000r/min离心10min,收集第二次上清液;合并第一次上清液和第二次上清液,并将其浓缩;然后向浓缩液中加入相当于浓缩液4倍体积的无水乙醇,沉淀12h后,8000r/min离心10min,收集沉淀物。
优选的,上述的枸杞多糖精制的方法,所述sevage试剂由二氯甲烷与正丁醇按照4:1的体积比例混合而成。
优选的,上述的枸杞多糖精制的方法,步骤1.4的具体操作为:将枸杞粗多糖用蒸馏水复溶后,再用截留分子量为8-14kda的透析袋透析72h,收集透析袋内透析液;8000r/min离心10min,收集上清液冷冻干燥,冷冻干燥的条件为温度-50℃、真空度5-10pa,得到大分子枸杞多糖;收集透析袋外的溶液,浓缩,冷冻干燥,冷冻干燥的条件为温度-50℃、真空度5-10pa,得到小分子枸杞多糖。
优选的,上述的枸杞多糖精制的方法,步骤2的具体步骤为:将大分子枸杞多糖配成1g/100ml浓度的水溶液,加入无水乙醇,使溶液中乙醇的体积分数为30%,沉淀12h,8000r/min离心10min,收集第一次多糖上清液和第一次多糖沉淀,向第一次多糖沉淀中加蒸馏水复溶,8000r/min离心10min,收集的上清液经冷冻干燥,冷冻干燥的条件为温度-50℃、真空度5-10pa,得到初级纯化的第一个枸杞多糖组分;
接着向第一次多糖上清液中加入无水乙醇,使乙醇的体积分数为50%,沉淀12h,8000r/min离心10min,收集第二次多糖上清液和第二次多糖沉淀,向第二次多糖沉淀中加蒸馏水复溶,8000r/min离心10min,收集的上清液经冷冻干燥,冷冻干燥的条件为温度-50℃、真空度5-10pa,得到初级纯化的第二个枸杞多糖组分;
继续向第二次多糖上清液中加入无水乙醇,使乙醇的体积分数为70%,沉淀12h,8000r/min离心10min,收集第三次多糖沉淀,向第三次多糖沉淀中加50ml蒸馏水复溶,8000r/min离心10min,收集的上清液经冷冻干燥,冷冻干燥的条件为温度-50℃、真空度5-10pa,得到初级纯化的第三个枸杞多糖组分;
将初级纯化的第一、二、三个枸杞多糖组分分别经sephadexg-100柱层析分离纯化,分别得到第一、二、三个高纯度枸杞多糖。
优选的,上述的枸杞多糖精制的方法,sephadexg-100柱层析分离纯化的条件为:洗脱剂采用0.1mol/lnacl溶液,流速为0.3ml/min。
与现有技术相比,本发明的枸杞多糖精制的方法,具有以下有益效果:
(1)本发明所述的枸杞多糖精制的方法,通过水提醇沉透析冷冻干燥得枸杞粗多糖,枸杞粗多糖经截留分子量为8-14kda的透析袋透析,得到大分子枸杞多糖和小分子枸杞多糖,大分子枸杞多糖经不同浓度的乙醇分级沉淀分离纯化,避免使用阴离子交换柱层析分离纯化得到相对较纯的多糖,再经sephadexg-100凝胶柱层析分离纯化得到高纯度枸杞多糖。整个操作步骤简单,成本低,得率高,且能得到结构组成不同的枸杞多糖组分,操作简单,可以全面评价枸杞多糖的功能。
(2)本发明的方法得到的高纯度多糖,得率高于传统方法;得到的高纯度枸杞多糖均能增强巨噬细胞的吞噬能力、酸性磷酸化酶活力和no释放量;且均能表现出强的自由基清除能力和还原力。
附图说明
图1是lbp-i-1、lbp-i-2和lbp-i-3过凝胶柱层析sephadexg-100分离纯化图;
其中,图1a是lbp-i-1的分离纯化图,图1b是lbp-i-2的分离纯化图,图1c是lbp-i-3的分离纯化图;
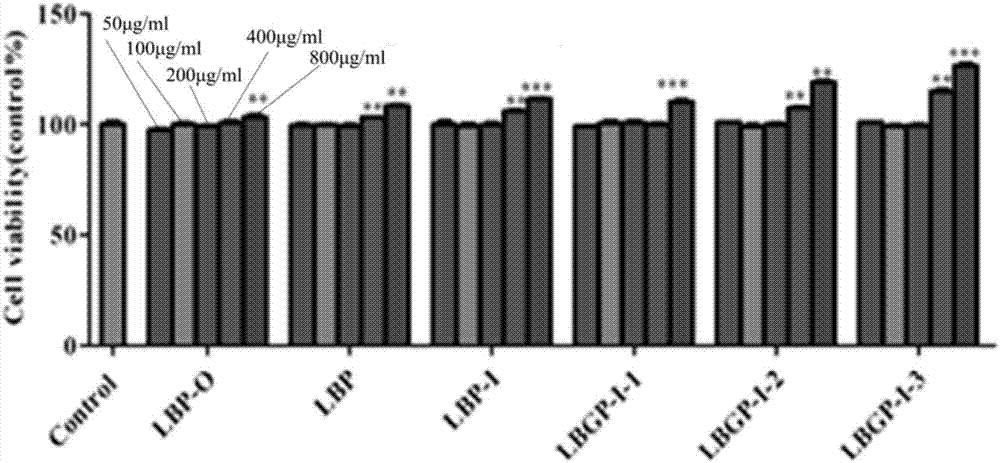
图2是lbp-o、lbp、lbp-i、lbgp-i-1、lbgp-i-2和lbgp-i-3对巨噬细胞活力的影响;
其中,lbp-o、lbp、lbp-i、lbgp-i-1、lbgp-i-2和lbgp-i-3各自对应的柱形图中从左至右浓度依次为50μg/ml、100μg/ml、200μg/ml、400μg/ml、800μg/ml;
图3是lbp-o、lbp、lbp-i、lbgp-i-1、lbgp-i-2、lbgp-i-3和lps对巨噬细胞吞噬能力的影响;
图4是lbp-o、lbp、lbp-i、lbgp-i-1、lbgp-i-2、lbgp-i-3和lps对巨噬细胞no释放量的影响;
图3-4中,lbp-o、lbp、lbp-i、lbgp-i-1、lbgp-i-2、lbgp-i-3各自对应的柱形图中从左至右浓度依次为12.5μg/ml、25μg/ml、50μg/ml、100μg/ml、200μg/ml,lps的浓度是1μg/ml;
图5是lbp-o、lbp、lbp-i、lbgp-i-1、lbgp-i-2、lbgp-i-3和lps对巨噬细胞酸性磷酸化酶活力的影响;
其中,lbp-o、lbp、lbp-i、lbgp-i-1、lbgp-i-2、lbgp-i-3各自对应的柱形图中从左至右浓度依次为12.5μg/ml、25μg/ml、50μg/ml、100μg/ml、200μg/ml,lps的浓度是10μg/ml;
图6是lbp-o、lbp、lbp-i、lbgp-i-1、lbgp-i-2、lbgp-i-3的抗氧化活性的影响;
其中,图6a是lbp-o、lbp、lbp-i、lbgp-i-1、lbgp-i-2、lbgp-i-3对dpph自由基清除的能力,图6b是lbp-o、lbp、lbp-i、lbgp-i-1、lbgp-i-2、lbgp-i-3对超氧阴离子清除的能力,图6c是lbp-o、lbp、lbp-i、lbgp-i-1、lbgp-i-2、lbgp-i-3对羟自由基清除的能力,图6d是lbp-o、lbp、lbp-i、lbgp-i-1、lbgp-i-2、lbgp-i-3的还原力分析。
具体实施方式
下面结合具体实例对本发明进行详细说明,但不应理解为本发明的限制。下面实例中未注明具体条件的实验方法,均按照本领域的常规方法和条件进行。
实施例1
一种枸杞多糖精制的方法,包括以下步骤:
步骤1,枸杞多糖的提取
步骤1.1,取500g的枸杞,用组织捣碎机(金坛新航jj-2组织捣碎匀浆机)将其破碎,浸泡于1500ml蒸馏水中,用1mol/l氢氧化钠溶液调节ph至7.0,浸泡24h,8000r/min离心10min,收集第一次上清液和第一次沉淀;向第一次沉淀中加入750ml蒸馏水,浸泡6h,8000r/min离心10min,收集第二次上清液;合并第一次上清液和第二次上清液,将得到的混合液(约2250ml)置于40℃条件以下旋转蒸发浓缩至400ml;然后向浓缩液中加入1600ml的无水乙醇,沉淀12h后,8000r/min离心10min,收集沉淀物;
步骤1.2,向所述沉淀物中加入400ml蒸馏水,使沉淀物复溶即可,得到复溶液;然后向复溶液中加入80ml的sevage试剂(二氯甲烷与正丁醇按照4:1的体积比例混合而成),将溶液转入圆底烧瓶中,封口,300r/min搅拌15min,8000r/min离心10min,收集上清液;sevage试剂用以除去复溶液中的游离蛋白质;
步骤1.3,重复步骤1.2的操作6-7次,直至游离蛋白除干净,即溶液中无沉淀为止,最后一次上清液经截留分子量为3kda的玻璃纸透析72h,收集袋内溶液,浓缩,冷冻干燥,得到枸杞粗多糖(lbp),冷冻干燥的条件为温度-50℃、真空度5-10pa;
步骤1.4,将枸杞粗多糖溶液用截留分子量为8-14kda的透析袋透析72h,收集透析袋内透析液;8000r/min离心10min,收集上清液冷冻干燥,冷冻干燥的条件为温度-50℃、真空度5-10pa,得到大分子枸杞多糖(lbp-i);另外,收集透析袋外的溶液,冷冻干燥,冷冻干燥的条件为温度-50℃、真空度5-10pa,得到小分子多糖(lbp-o)。
步骤2,大分子枸杞多糖的精制
将大分子枸杞多糖配成1g/100ml浓度的水溶液(溶剂为蒸馏水),取70ml,缓慢加入30ml无水乙醇,使溶液中乙醇的体积分数为30%,沉淀12h,8000r/min离心10min,收集第一次多糖上清液和第一次多糖沉淀,向第一次多糖沉淀中加50ml蒸馏水复溶,8000r/min离心10min,收集的上清液经冷冻干燥,冷冻干燥的条件为温度-50℃、真空度5-10pa,得到初级纯化的第一个枸杞多糖组分(lbp-i-1);
将初级纯化的第一个枸杞多糖组分(lbp-i-1)经sephadexg-100层析柱进一步分离纯化得到第一个高纯度枸杞多糖(lbgp-i-1);
接着向第一次多糖上清液中缓慢加入40ml无水乙醇,使乙醇的体积分数为50%,沉淀12h,8000r/min离心10min,收集第二次多糖上清液和第二次多糖沉淀,向第二次多糖沉淀中加50ml蒸馏水复溶,8000r/min离心10min,收集的上清液经冷冻干燥,冷冻干燥的条件为温度-50℃、真空度5-10pa,得到初级纯化的第二个枸杞多糖组分(lbp-i-2);
将初级纯化的第二个枸杞多糖组分(lbp-i-2)经sephadexg-100层析柱进一步分离纯化得到第二个高纯度枸杞多糖(lbgp-i-2);
继续向第二次多糖上清液中缓慢加入93.3ml无水乙醇,使乙醇的体积分数为70%,沉淀12h,8000r/min离心10min,收集第三次多糖沉淀,向第三次多糖沉淀中加50ml蒸馏水复溶,8000r/min离心10min,收集的上清液经冷冻干燥,冷冻干燥的条件为温度-50℃、真空度5-10pa,得到初级纯化的第三个枸杞多糖组分(lbp-i-3);
将初级纯化的第三个枸杞多糖组分(lbp-i-3)经sephadexg-100层析柱进一步分离纯化得到第三个高纯度枸杞多糖(lbgp-i-3);
其中,步骤2中sephadexg-100层析柱(直径1.8cm×长度80cm)的分离纯化条件均为:洗脱剂采用0.1mol/lnacl溶液,流速为0.3ml/min。
实施例2
一种枸杞多糖精制的方法,包括以下步骤:
步骤1,枸杞多糖的提取
同实施例1的步骤1;
步骤2,大分子枸杞多糖的精制
将大分子枸杞多糖配成1g/100ml浓度的水溶液(溶剂为蒸馏水),取140ml,缓慢加入60ml无水乙醇,使溶液中乙醇的体积分数为30%,沉淀12h,8000r/min离心10min,收集第一次多糖上清液和第一次多糖沉淀,向第一次多糖沉淀中加80ml蒸馏水复溶,8000r/min离心10min,收集的上清液经冷冻干燥,冷冻干燥的条件为温度-50℃、真空度5-10pa,得到初级纯化的第一个枸杞多糖组分(lbp-i-1);
将初级纯化的第一个枸杞多糖组分(lbp-i-1)经sephadexg-100层析柱进一步分离纯化得到第一个高纯度枸杞多糖(lbgp-i-1);
接着向第一次多糖上清液中缓慢加入80ml无水乙醇,使乙醇的体积分数为50%,沉淀12h,8000r/min离心10min,收集第二次多糖上清液和第二次多糖沉淀,向第二次多糖沉淀中加60ml蒸馏水复溶,8000r/min离心10min,收集的上清液经冷冻干燥,冷冻干燥的条件为温度-50℃、真空度5-10pa,得到初级纯化的第二个枸杞多糖组分(lbp-i-2);
将初级纯化的第二个枸杞多糖组分(lbp-i-2)经sephadexg-100层析柱进一步分离纯化得到第二个高纯度枸杞多糖(lbgp-i-2);
继续向第二次多糖上清液中缓慢加入186.6ml乙醇,使乙醇的体积分数为70%,沉淀12h,8000r/min离心10min,收集第三次多糖沉淀,向第三次多糖沉淀中加60ml蒸馏水复溶,8000r/min离心10min,收集的上清液经冷冻干燥,冷冻干燥的条件为温度-50℃、真空度5-10pa,得到初级纯化的第三个枸杞多糖组分(lbp-i-3);
将初级纯化的第三个枸杞多糖组分(lbp-i-3)经sephadexg-100层析柱进一步分离纯化得到第三个高纯度枸杞多糖(lbgp-i-3);
其中,步骤2中sephadexg-100层析柱(直径1.8cm×长度80cm)的分离纯化条件均为:洗脱剂采用0.1mol/lnacl溶液,流速为0.3ml/min。
实施例3
一种枸杞多糖精制的方法,包括以下步骤:
步骤1,枸杞多糖的提取
同实施例1的步骤1;
步骤2,大分子枸杞多糖的精制
将大分子枸杞多糖配成1g/100ml浓度的水溶液(溶剂为蒸馏水),取35ml,缓慢加入15ml无水乙醇,使溶液中乙醇的体积分数为30%,沉淀12h,8000r/min离心10min,收集第一次多糖上清液和第一次多糖沉淀,向第一次多糖沉淀中加30ml蒸馏水复溶,8000r/min离心10min,收集的上清液经冷冻干燥,冷冻干燥的条件为温度-50℃、真空度5-10pa,得到初级纯化的第一个枸杞多糖组分(lbp-i-1);
将初级纯化的第一个枸杞多糖组分(lbp-i-1)经sephadexg-100层析柱进一步分离纯化得到第一个高纯度枸杞多糖(lbgp-i-1);
接着向第一次多糖上清液中缓慢加入20ml无水乙醇,使乙醇的体积分数为50%,沉淀12h,8000r/min离心10min,收集第二次多糖上清液和第二次多糖沉淀,向第二次多糖沉淀中加30ml蒸馏水复溶,8000r/min离心10min,收集的上清液经冷冻干燥,冷冻干燥的条件为温度-50℃、真空度5-10pa,得到初级纯化的第二个枸杞多糖组分(lbp-i-2);
将初级纯化的第二个枸杞多糖组分(lbp-i-2)经sephadexg-100层析柱进一步分离纯化得到第二个高纯度枸杞多糖(lbgp-i-2);
继续向第二次多糖上清液中缓慢加入46.6ml乙醇,使乙醇的体积分数为70%,沉淀12h,8000r/min离心10min,收集第三次多糖沉淀,向第三次多糖沉淀中加50ml蒸馏水复溶,8000r/min离心10min,收集的上清液经冷冻干燥,冷冻干燥的条件为温度-50℃、真空度5-10pa,得到初级纯化的第三个枸杞多糖组分(lbp-i-3);
将初级纯化的第三个枸杞多糖组分(lbp-i-3)经sephadexg-100层析柱进一步分离纯化得到第三个高纯度枸杞多糖(lbgp-i-3);
其中,步骤2中sephadexg-100层析柱(直径1.8cm×长度80cm)的分离纯化条件均为:洗脱剂采用0.1mol/lnacl溶液,流速为0.3ml/min。
目前,提取出的枸杞多糖浓缩液经两种方法处理,一种为醇沉,savage试剂除蛋白,透析后冷冻干燥,得到的多糖含有约占40%分子量低于8kda的低分子多糖;另一种为醇沉后直接冷冻干燥,所得多糖的单糖组成主要为葡萄糖。
为了证明本发明方法的分离纯化效果,我们利用实施例1提取的高纯度枸杞多糖为样品,实施例1中得到的lbp-i-1、lbp-i-2、lbp-i-3三个组分,结果参见图1,得率分别为0.07%、0.04%、0.23%;lbp-i-1、lbp-i-2、lbp-i-3三个组分分别经sephadexg-100柱层析进一步分离纯化得到高纯度枸杞多糖分别为lbgp-i-1、lbgp-i-2、lbgp-i-3,其得率分别为0.05%、0.03%、0.19%,其得率高于传统方法。
对lbgp-i-1、lbgp-i-2、lbgp-i-3进行理化性质分析、体外免疫活性分析、抗氧化活性分析、枸杞多糖单糖组成分析,结果如表1所示,表1的结果表明:lbgp-i-1单糖组成以葡萄糖为主,lbgp-i-2单糖组成以阿拉伯糖、葡萄糖和半乳糖为主,lbgp-i-1和lbgp-i-2单糖组成与传统的方法不同;lbgp-i-3单糖组成以为阿拉伯糖和半乳糖为主,其单糖组成与离子交换柱层析分离纯化的结果一致。
表1枸杞多糖单糖组成相对摩尔比
其中“-”表示未检出。
根据苯酚硫酸法测得lbgp-i-1、lbgp-i-2、lbgp-i-3中糖含量分别为36.23%、55.52%和81.42%。根据考马斯亮蓝法测得lbgp-i-1、lbgp-i-2、lbgp-i-3中蛋白含量分别为60.54%,40.10%和18.50%。
我们还研究了高纯度枸杞多糖对巨噬细胞活力、巨噬细胞吞噬能力、巨噬细胞no释放量和巨噬细胞酸性磷酸化酶活力的影响,以deme培养基作为空白对照control,lps作为阳性对照,结果如图2-5所示。图2是lbp-o、lbp、lbp-i、lbgp-i-1、lbgp-i-2和lbgp-i-3对巨噬细胞活力的影响;其中,lbp-o、lbp、lbp-i、lbgp-i-1、lbgp-i-2和lbgp-i-3各自对应的柱形图中从左至右浓度依次为50μg/ml、100μg/ml、200μg/ml、400μg/ml、800μg/ml;图3是lbp-o、lbp、lbp-i、lbgp-i-1、lbgp-i-2、lbgp-i-3和lps对巨噬细胞吞噬能力的影响;图4是lbp-o、lbp、lbp-i、lbgp-i-1、lbgp-i-2、lbgp-i-3和lps对巨噬细胞no释放量的影响;图3-4中,lbp-o、lbp、lbp-i、lbgp-i-1、lbgp-i-2、lbgp-i-3各自对应的柱形图中从左至右浓度依次为12.5μg/ml、25μg/ml、50μg/ml、100μg/ml、200μg/ml,lps的浓度是1μg/ml;图5是lbp-o、lbp、lbp-i、lbgp-i-1、lbgp-i-2、lbgp-i-3和lps对巨噬细胞酸性磷酸化酶活力的影响;其中,lbp-o、lbp、lbp-i、lbgp-i-1、lbgp-i-2、lbgp-i-3各自对应的柱形图中从左至右浓度依次为12.5μg/ml、25μg/ml、50μg/ml、100μg/ml、200μg/ml,lps的浓度是10μg/ml;图2-5中,*表示与control相比p<0.05,**表示与control相比p<0.01,***表示与control相比p<0.001。
结果表明,lbp、lbp-i、lbgp-i-1、lbgp-i-2和lbgp-i-3均能增强巨噬细胞的活力和吞噬能力、酸性磷酸化酶活力和no释放量,其中lbgp-i-3最为显著。
我们还研究了高纯度枸杞多糖的抗氧化活性,结果如图6所示,图6a是lbp-o、lbp、lbp-i、lbgp-i-1、lbgp-i-2、lbgp-i-3对dpph自由基清除的能力,图6b是lbp-o、lbp、lbp-i、lbgp-i-1、lbgp-i-2、lbgp-i-3对超氧阴离子清除的能力,图6c是lbp-o、lbp、lbp-i、lbgp-i-1、lbgp-i-2、lbgp-i-3对羟自由基清除的能力,图6d是lbp-o、lbp、lbp-i、lbgp-i-1、lbgp-i-2、lbgp-i-3的还原力分析,其中vc作为对照,结果显示,lbp-o、lbp、lbp-i、lbgp-i-1、lbgp-i-2和lbgp-i-3均能表现出强的自由基清除能力和还原力。
需要说明的是,本发明权利要求书中涉及数值范围时,应理解为每个数值范围的两个端点以及两个端点之间任何一个数值均可选用,由于采用的步骤方法与实施例相同,为了防止赘述,本发明的描述了优选的实施例1-3,尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
- 还没有人留言评论。精彩留言会获得点赞!