一种用于抗体‑分子定点偶联的方法及应用与流程
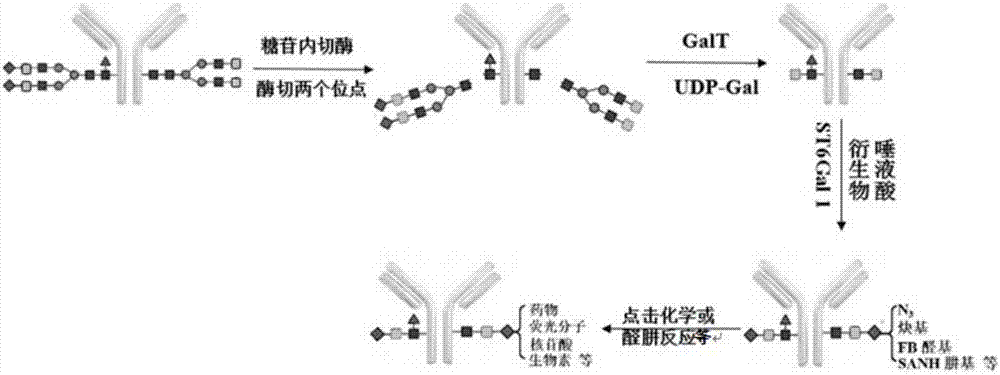
本发明涉及抗体偶联领域,尤其涉及抗体-分子的定点偶联,旨在通过化学法和酶法相结合,提供一种最佳的抗体-分子的定点修饰与偶联方案及其应用。
背景技术:
igg是在血液和其它体液内发现的可溶性抗体。它们由b细胞衍生的浆细胞构成,以对细菌或其它病原体作出反应并压制它。igg是一种分子量约为150kda的y形糖蛋白,包括两条重链和两条轻链。重链的两个羧基末端域形成fc片段(“恒定片段”),重链和轻链的氨基末端域识别抗原,并被称为fab片段(“抗原结合片段”)。igg抗体结构示意图请见图1。
fab结构域负责抗原结合,而fc结构域参与fc受体介导的效应子功能,例如抗体依赖性细胞性细胞毒性(adcc)和补体依赖性细胞毒性(cdc)。fc结构域是在保守的n-糖基化位点(n297)处带有两个n-聚糖的同源二聚体。所附连的寡糖为双触角复杂型,具有相当大的结构非均质性,其中,n-连接的七糖核心可以用核心岩藻糖(fuc)、平分型n-乙酰氨基葡萄糖(glcnac)、末端半乳糖(gal)和末端唾液酸(sa)差异修饰。
目前抗体偶联其他分子的方法大部分是随机偶联,抗体表面一般含有大量的赖氨酸残基(氨基位点超过80个位点)或者抗体链间区域的半胱氨酸残基(由链间二硫键还原所得,4对二硫键有8个巯基位点),抗体反应位点多以及偶联反应的随机性导致与其他分子的交联过程非常复杂,偶联数目和位点不可控,进而导致抗体偶联物的不均一性和重复性差,而且这种随机性会破坏抗体的特异性,进而影响抗体与抗原结合的亲和性。目前制药公司大多数偶联方法用的也是随机偶联,产物的均一性和重复性往往很难达到要求。因此,为了解决抗体偶联物的均一性问题,定点偶联技术近年来显得尤为重要。
现有技术中定点偶联方法主要是通过基因突变来实现位点和数量两方面控制偶联反应,能得到均一性好的偶联物,这种对抗体进行定点突变是通过基因重组方式得到的,需要大量的工作和设计,研发成本高,一般只有个别大的制药公司用或者文献中用到这种方法。
对于抗体定点偶联或修饰的其他方法比如化学法和酶法,目前查到国内最新的方法是上海新理念生物医药科技有限公司发表的两个专利:一种三齿型连接子及其应用(申请号为201310025021.4)和三马来酰亚胺型连接子及其应用(申请号为201510289369.3)。上述两个专利主要是将市面上的连接子smcc两个官能团变成3或4个官能团的连接子,能得到每个抗体随机位点上偶联约3个和4个药物。这种连接子个数可以较好控制在3和4个左右,但是偶联位置仍是随机的,因此产物仍是混合物,对抗体-偶联物的纯度和灵敏度有影响,此外,合成这种连接子的周期长,难度大且步骤多,而且不稳定成本也高。
本发明旨在通过化学法和酶法相结合,提供另外一种最佳的抗体-分子定点修饰与偶联方案及其应用。优选地,利用酶法(采用糖苷内切酶、β-半乳糖苷酶、β-半乳糖基转移酶、β-半乳糖基转移酶突变体和唾液酸糖基转移酶)和化学法(采用点击化学、醛肼反应等)相结合,使抗体定点偶联上相同个数的其他分子(包括但不限于药物、核苷酸、荧光染料、抗生素、蛋白、核酸、磁珠、生物素等)。本方案适用于大部分抗体,从而可以避免对每一种抗体进行繁琐的重组改造以引入定点偶联位点。本发明要解决的技术问题不仅仅是实现抗体的定点修饰与偶联,使得到产物的均一性和重复性更好,更重要的是通过本发明的技术方案准确、可控地得到不同位置和个数裸露的抗体glcnac位点,本申请旨在准确、快速、可控得到2个或4个裸露的抗体glcnac位点,使抗体定点偶联上相同个数的其他分子(包括但不限于药物、核苷酸、荧光染料、抗生素、蛋白、核酸、磁珠、生物素等)。
技术实现要素:
有鉴于现有技术的不足,本专利旨在提供一种最佳的抗体-分子定点偶联方案,利用酶法和化学法相结合,对抗体fc片段的糖苷位点共价偶联其他分子(包括药物、核苷酸、荧光染料、抗生素、蛋白、核酸、磁珠、生物素等),研发成本低,产物均一性很高,不仅仅是实现抗体的定点修饰与偶联,使得到产物的均一性和重复性更好,更重要的是通过本发明的技术方案准确、可控地得到2个或4个裸露的抗体glcnac位点,使抗体定点偶联上相同个数的其他分子(包括但不限于药物、核苷酸、荧光染料、抗生素、蛋白、核酸、磁珠、生物素等)。
首先通过酶法(糖苷内切酶(endoglycosidase)或β-半乳糖苷酶(β-galactosidase))对抗体fc片段的糖苷位点进行脱糖基化暴露出2个或4个glcnac位点;然后由β-半乳糖基转移酶(β-galactosyltransferase,galt)或其突变体通过转糖基作用将半乳糖udp-gal或修饰有特殊官能团(叠氮基、炔基、肼基、醛基等)的供体半乳糖衍生物(尿核苷5'-二磷半乳糖衍生物,udp-galderiatives)分别修饰到抗体的glcnac位点,其中对于修饰有半乳糖gal末端的抗体可以再次利用唾液酸糖基转移酶将修饰有特殊官能团(叠氮基、炔基、肼基、醛基等)的供体唾液酸衍生物(胞苷一磷酸-β-n-乙酰神经氨酸衍生物,cmp-neu5acderiatives)修饰到抗体的2个或4个新的gal末端位点;最后利用化学反应(点击化学、醛肼反应等)将带有特殊官能团(叠氮基、炔基、肼基、醛基等)的其他分子物质定点偶联在抗体的fc区。此法酶切效率高,化学反应专一性好,酶法加上特定的化学反应得到的产物均一性好,纯度高,方法重复性好,最适合目前抗体-分子偶联物的制备。
本发明具体技术方案如下:
一种用于抗体-分子定点偶联的方法,所述方法包括如下步骤:
a.提供igg抗体或igg-fc片段以及酶,所述酶与igg抗体或igg-fc片段的糖苷位点进行酶反应,脱糖基化暴露出不同位置和个数的glcnac位点;
进一步地,所述酶包括β-半乳糖苷酶或糖苷内切酶;
进一步地,所述脱糖基化暴露出的glcnac位点为2个或4个。
b.对抗体特定位点进行特殊官能团修饰:
根据步骤a所得产物glcnac位点是否可直接进行特殊官能团修饰分别进行如下不同操作:
b1.提供相应的酶,通过转糖基作用将半乳糖udp-gal修饰到抗体的glcnac位点;然后利用唾液酸糖基转移酶将修饰有特殊官能团的供体唾液酸衍生物修饰到抗体新的gal末端位点,从而对抗体特定位点进行特殊官能团修饰;
或者
b2.提供相应的酶突变体,通过转糖基作用将修饰有特殊官能团的供体半乳糖衍生物修饰到抗体的glcnac位点,从而对抗体特定位点进行特殊官能团修饰;
进一步地,所述相应的酶包括β-半乳糖基转移酶,所述相应的酶突变体包括β-半乳糖基转移酶突变体;
进一步地,唾液酸糖基转移酶的作用点是修饰有半乳糖gal末端的抗体;
进一步地,所述步骤b1的抗体新的gal末端位点为2个或4个;
进一步地,所述特殊官能团包含但不限于以下一种或几种:叠氮基、炔基、肼基、醛基、生物素;
进一步地,所述修饰有特殊官能团的供体半乳糖衍生物为尿核苷5'-二磷半乳糖衍生物(udp-galderivatives);
进一步地,所述尿核苷5'-二磷半乳糖衍生物(udp-galderivatives)包含但不限于以下一种或几种:udp-gal-n3、udp-gal-炔基、udp-gal-fb、udp-gal-sanh;
进一步地,所述修饰有特殊官能团的供体唾液酸衍生物为胞苷一磷酸-β-n-乙酰神经氨酸衍生物(cmp-neu5acderiatives);
进一步地,所述胞苷一磷酸-β-n-乙酰神经氨酸衍生物(cmp-neu5acderiatives)包含但不限于以下一种或几种:cmp-neu5ac-9n3、cmp-neu5ac-5n3、cmp-neu5ac-5炔基、cmp-neu5ac-5fb、cmp-neu5ac-5sanh;
所述步骤b中的特殊官能团不仅仅在化学偶联中起到作用,针对抗体中没有的官能团同时发挥特异定点的作用,此外特别是针对肼基、醛基,申请人在实验过程中意想不到地选用肼基和醛基反应可以形成腙键结构(在350nm处有紫外吸收峰),在抗体-分子定点偶联反应过程中进行紫外检测,从而时时定性检测抗体-分子定点偶联反应程度,从而时时准确指导用量与反应,得到纯度更好的抗体-分子偶联物,使得产物的均一性和重复性更好。
c.通过化学反应将带有特殊官能团的其他分子物质定点偶联在抗体的fc区,以形成所述具有相同个数的抗体-分子偶联物;
进一步地,所述化学反应包含但不限于以下一种或几种:点击化学、醛肼反应;
进一步地,所述其他分子物质包含但不限于药物、核苷酸、荧光染料、抗生素、蛋白、核酸、磁珠、生物素。
本发明的另一目的是提供一种利用上述任一用于抗体-分子定点偶联的方法制备的可以用于抗体-分子定点偶联的试剂盒,包括糖苷内切酶、β-半乳糖苷酶、β-半乳糖基转移酶、β-半乳糖基转移酶突变体和唾液酸糖基转移酶;
进一步地,还包括说明书,说明书上记载着如上所述任一用于抗体-分子定点偶联的方法;
进一步地,按照如上所述的用于抗体-分子定点偶联的方法使用。
本专利提供一种最佳的抗体-分子定点偶联方案及应用,利用酶法和化学法相结合,对抗体fc片段的糖苷位点共价偶联其他分子(包括药物、核苷酸、荧光染料、抗生素、蛋白、核酸、磁珠、生物素等),酶切效率高,化学反应专一性好,酶法加上特定的化学反应得到的产物均一性好,纯度高,方法重复性好,最适合目前抗体-分子偶联物的制备。与现有技术相比,本发明所提供的技术具有以下优点:
1.本发明提供了一种最佳的抗体-分子定点偶联方案,避免了现有技术中随机偶联导致抗体偶联物的不均一性和重复性差的技术难点,抗体反应位点多以及偶联反应的随机性导致与其他分子的交联过程非常复杂,偶联数目和位点不可控,进而导致抗体偶联物的不均一性和重复性,而且这种随机性会破坏抗体的特异性,进而影响抗体与抗原结合的亲和性。目前制药公司大多数偶联方法用的也是随机偶联,产物的均一性和重复性往往很难达到要求。
2.本发明提供的偶联方法适用于大部分抗体,从而可以避免对每一种抗体进行繁琐的重组改造以引入定点偶联位点,因此具有广泛的应用前景。
3.本发明利用酶法和化学法相结合,进行抗体-分子定点偶联,相比于目前定点偶联方法主要是通过基因突变来实现位点和数量两方面控制偶联反应,能得到均一性好的偶联物,这种对抗体进行定点突变是通过基因重组方式得到的,需要大量的工作和设计,研发成本高,一般只有个别大的制药公司用或者文献中用到这种方法,本发明的利用酶法和化学法相结合的技术方案成本较低、时间周期短、应用更广泛。
4.本发明的技术方案不仅仅是实现抗体的定点修饰与偶联,使得到产物的均一性和重复性更好,更重要的是通过本发明的技术方案准确、可控地得到2个或4个裸露的抗体的glcnac位点,使抗体定点偶联上相同个数的其他分子(包括但不限于药物、核苷酸、荧光染料、抗生素、蛋白、核酸、磁珠、生物素等),据此,本申请提供了一种高效、简单、实用的抗体-分子定点偶联方案。
5.本发明中申请人在实验过程中意想不到地选用可以形成腙键结构(在350nm处有紫外吸收峰)的肼基、醛基作为特殊官能团,在本身高效、简单、实用的抗体-分子定点偶联方案外,不仅仅在化学偶联中起到作用,针对抗体中没有的官能团同时发挥特异定点的作用,更使得在抗体-分子定点偶联反应过程中可以同时进行uv紫外检测,从而时时定量检测抗体-分子定点偶联反应程度,从而时时准确指导用量与反应,得到纯度更好的抗体-分子偶联物,从而产物的均一性和重复性更好。
附图说明
图1是igg抗体结构示意图
图2a是实施例1的实验方案示意图
图2b是一个较佳实施例1的通过点击化学反应得到的igg-荧光染料分子cd22-alexa
图2c是一个较佳实施例1的通过醛肼反应得到的ck19-寡核苷酸偶联物分子的紫外图
图3a是实施例2的实验方案示意图
图3b是一个较佳实施例2的通过点击化学反应得到的igg-荧光染料分子cd22-alexa
图3c是一个较佳实施例2的通过醛肼反应得到的ck19-寡核苷酸偶联物分子的紫外图
图4a是实施例3的实验方案示意图
图4b是一个较佳实施例3的通过点击化学反应得到的igg-荧光染料分子cd22-alexa
图4c是一个较佳实施例3的通过醛肼反应得到的ck19-寡核苷酸偶联物分子的紫外图
图5a是实施例4的实验方案示意图
图5b是一个较佳实施例4的通过点击化学反应得到的igg-荧光染料分子cd22-alexa
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,实施方式只是为了举例说明本发明,而非以任何方式限制发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。
除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。文中所述的较佳实施方法与材料仅作示范之用。
实施例1
a.本实施例方案
步骤一、首先通过酶法(糖苷内切酶)对抗体fc片段的糖苷位点进行脱糖基化,暴露出两个glcnac位点;
步骤二、然后由β-半乳糖基转移酶将半乳糖udp-gal修饰到抗体的两个glcnac位点;
步骤三、利用唾液酸糖基转移酶将修饰有特殊官能团(叠氮基、炔基、肼基、醛基等)的供体唾液酸衍生物(胞苷一磷酸-β-n-乙酰神经氨酸衍生物,cmp-neu5acderiatives)修饰到抗体的两个新的gal位点;
步骤四、最后利用化学反应(点击化学、醛肼反应等)将带有特殊官能团(叠氮基、炔基、肼基、醛基等)的其他分子物质定点偶联在抗体的fc区。
本实施例实验方案流程图请见图2a。
b.具体实验步骤
1)igg抗体的脱糖基化
首先配置反应缓冲液,可以选用25mm的tris缓冲液(150mmnacl,ph7.4)或者10mm的磷酸缓冲液(150mmnacl,ph7.4),为方便后面的实验,优选tris缓冲液;其次将抗体进行tris缓冲液置换,得到抗体浓度为0.5-10mg/ml的溶液;然后将置换后所得抗体溶液与糖苷内切酶在室温或者37℃温度下孵育30min-1h(1u酶对应1μg抗体);最后将脱糖基化的抗体进行亲和层析纯化。
2)半乳糖udp-gal修饰
将β-半乳糖基转移酶(100-200μg)和udp-gal(10-20mm)加入100μg上述步骤1)得到的脱糖基化的抗体-脱糖基化液体中,总体系约200μl,25mm的tris缓冲液(150mmnacl,ph7.4),在30度条件下孵育过夜,将半乳糖udp-gal修饰到抗体的两个glcnac位点。然后进行纯化和缓冲液(50mm二甲胂酸盐缓冲液(cacodylatebuffer)ph7.6)或者100mm的tris缓冲液(ph8.0,50mmnacl)置换。
3)特殊官能团(叠氮基、炔基、肼基、醛基等)修饰的唾液酸衍生物的制备
关于上述特殊官能团的唾液酸衍生物可以通过如下方法制备得到,如有市售,也可以采用市售商品。
a.cmp-neu5ac-9n3(c9位点进行叠氮基修饰)
为了在胞苷一磷酸-β-n-乙酰神经氨酸的c9位点修饰上叠氮基,具体反应步骤如下,首先对n-乙酰神经氨酸的c9位点上的羟基进行甲苯磺酰化,将n-乙酰神经氨酸(1.55mmol)溶于10ml冰的吡啶中,加入对甲基苯磺酰氯(2.88mmol),室温搅拌反应过夜,除去吡啶后的产物用快速柱层析纯化得到白色固体产物;其次将叠氮化钠(nan3,280mg)和上述纯化的产物(500mg)溶于48ml混合溶液(v水:v丙酮=2:6)中,进行悬浮蒸馏反应过夜,产物用快速柱层析纯化得到浅黄色固体产物。将上述浅黄色固体(50mg)溶于9ml的tris–hcl缓冲液(0.1m,ph8.5-8.9)中,加入胞苷三磷酸二钠盐(ctp,126mg,0.24mmol),加入4.0u重组的cmp-唾液酸合成酶和2.0u焦磷酸酶,在37度摇床孵育3-5h(最佳时间3h),用乙醇反复沉淀得到粗产品,进一步通过纯化得到叠氮基修饰的cmp-neu5ac-9n3产物。
b.cmp-neu5ac-5n3(c5位点进行叠氮基修饰)
叠氮乙酸与edc/nhs经过活化形成活性酯叠氮基-nhs,或者直接购买叠氮基-nhs活性酯。盐酸甘露糖胺(2.3mmol)溶于10ml无水甲醇中,加入1.3ml三乙胺,然后与2倍过量的叠氮基-nhs室温反应搅拌过夜,经过纯化得到叠氮基修饰的甘露糖胺(n-azidoacetyl-d-mannosamine,mannac-n3)。
接着经过一锅两步酶反应得到cmp-neu5ac-5n3产物,首先将mannacn3(10mm)、丙酮酸钠(50mm,5倍过量)、ctp(1倍,10mm)加入tris–hcl缓冲液(0.1m,ph8.8)中,再加入唾液酸醛缩酶(sialicacidaldolase)和cmp-唾液酸合成酶,混合溶液在37度摇床孵育2-5h(最佳时间2h),加入甲醇终止反应,然后离心去掉沉淀物,上清液进行凝胶过滤纯化得到cmp-neu5ac-5n3产物。
c.cmp-neu5ac-5炔基(c5位点进行炔基修饰)
制备炔基修饰的cmp-neu5ac-5炔基反应过程与制备叠氮基修饰的cmp-neu5ac-5n3反应过程类似。
盐酸甘露糖胺(2.3mmol)溶于10ml无水甲醇中,加入1.3ml三乙胺,然后与2-5倍当量的炔基-nhs活性酯室温反应搅拌过夜,经过纯化得到炔基修饰的甘露糖胺(mannac-炔基)。
接着经过一锅两步酶反应得到cmp-neu5ac-5炔基产物,首先将mannac炔基(10mm)、丙酮酸钠(50mm,5倍过量)、ctp(1倍,10mm)加入tris–hcl缓冲液(0.1m,ph8.8)中,再加入唾液酸醛缩酶和cmp-唾液酸合成酶,混合溶液在37度摇床孵育2-5h(最佳时间2h),加入甲醇终止反应,然后离心去掉沉淀物,上清液进行凝胶过滤纯化得到cmp-neu5ac-5炔基产物。
d.cmp-neu5ac-5fb(c5位点进行醛基修饰)
制备醛基修饰的cmp-neu5ac-5fb结构图反应过程与制备叠氮基修饰的cmp-neu5ac-5n3反应过程类似。
盐酸甘露糖胺(2.3mmol)溶于10ml无水甲醇中,加入1.3ml三乙胺,然后与2-5倍当量的sfb(4-甲酰苯甲酸n-琥珀酰亚胺酯)室温反应搅拌过夜,经过纯化得到醛基修饰的甘露糖胺(mannac-fb)。
接着经过一锅两步酶反应得到cmp-neu5ac-5fb产物,首先将mannac-fb(10mm)、丙酮酸钠(50mm,5倍过量)、ctp(1倍,10mm)加入tris–hcl缓冲液(0.1m,ph8.8)中,再加入唾液酸醛缩酶和cmp-唾液酸合成酶,混合溶液在37度摇床孵育2-5h(最佳时间2h),加入甲醇终止反应,然后离心去掉沉淀物,上清液进行凝胶过滤纯化得到cmp-neu5ac-5fb产物。
e.cmp-neu5ac-5sanh(c5位点进行肼基修饰)
盐酸甘露糖胺(2.3mmol)溶于10ml无水甲醇中,加入1.3ml三乙胺,然后与2-5倍当量的sanh(对-丙腙基吡啶甲酸n-羟基琥珀酰亚胺酯))室温反应搅拌过夜,经过纯化得到肼基修饰的甘露糖胺(mannac-sanh)。
接着经过一锅两步酶反应得到cmp-neu5ac-5sanh产物,首先将mannac-sanh(10mm)、丙酮酸钠(50mm,5倍过量)、ctp(1倍,10mm)加入tris–hcl缓冲液(0.1m,ph8.8)中,再加入唾液酸醛缩酶和cmp-唾液酸合成酶,混合溶液在37度摇床孵育2-5h(最佳时间2h),加入甲醇终止反应,然后离心去掉沉淀物,上清液进行凝胶过滤纯化得到cmp-neu5ac-5sanh产物。
4)对igg抗体特定位点进行特殊官能团修饰
利用唾液酸糖基转移酶(st6gal1)将修饰有叠氮基、炔基、肼基或醛基等特殊官能团的唾液酸衍生物连在抗体的两个新的糖基受体gal位点上,反应体系100μl,为50mm二甲胂酸盐缓冲液或者100mm的tris缓冲液、4mm的唾液酸衍生物(cmp-neu5ac-n3)、重组半乳糖gal的igg抗体(0.5-10mg/ml(其中本申请较优的igg抗体浓度为2mg/ml)、1u的st6gal1在ph7.6-8.0(其中本申请较优的ph为8.0)、温度30度或37度条件下孵育1h-96h(其中本申请较优的温度和反应时间为30度过夜)。体系中可加入bsa(50μg)和ciap(thecalfintestinealkalinephosphatase,2-10u)阻止cmp抑制酶活。最后进行亲和层析纯化。
5)其他分子(药物、核苷酸、荧光染料、抗生素、蛋白、核酸、磁珠、生物素等等)进行特殊官能团修饰
本实验可以采用药物、核苷酸、荧光染料、抗生素、蛋白、核酸、磁珠、生物素等其他分子进行叠氮基、炔基、肼基或醛基等特殊官能团修饰。包括但不限于如下对分子进行特殊官能团修饰的实验操作示例。
带氨基的药物或其他分子可与叠氮基-nhs或炔基-nhs等活性酯按比例1:5-30,其中本申请较优的比例为1:10,在dmso中或者在ph8.0的磷酸缓冲液中进行反应2h以上,其中本申请较优的反应时间为过夜,然后得到叠氮基n3(分子-n3)或炔基(分子-炔基)修饰的分子。
带氨基的药物或其他分子可与sfb(4-甲酰苯甲酸n-琥珀酰亚胺酯)或sanh(对-丙腙基吡啶甲酸n-羟基琥珀酰亚胺酯)等按比例1:5-30,其中本申请较优的比例为1:10,在dmf(n,n-二甲基甲酰胺)、dmso或0.1m的ph7.4-8.0的磷酸缓冲液中室温反应2h以上,其中本申请较优的反应时间为过夜,经纯化得到醛基(分子-fb)或肼基(分子-sanh)修饰的分子。如采用上述方法获得醛基修饰的寡核苷酸:将50nmol的寡核苷酸用0.1m的ph7.4的磷酸缓冲液配置成溶液;称取500nmol的sfb(4-甲酰苯甲酸n-琥珀酰亚胺酯),用无水dmf(n,n-二甲基甲酰胺)溶解后,在室温反应2.5h,经纯化即可得到寡核苷酸-fb(醛基修饰的寡核苷酸)。
带羧基的药物或其他分子可与叠氮基-nh2或炔基-nh2等进行反应,然后得到炔基或叠氮基修饰的分子。
6)igg抗体与其他分子进行偶联
炔基或叠氮基修饰的分子可与叠氮或炔基修饰的抗体igg进行点击化学反应得到不同igg-偶联物(如cd22-alexa
醛基(分子-fb)或肼基(分子-sanh)修饰的分子可与肼基(igg-sanh)或醛基(igg-fb)修饰的抗体igg进行反应得到不同igg-偶联物(如ck19-寡核苷酸偶联物等)。将ck19-sanh与寡核苷酸-fb按照比例1:10-30,其中本申请较优的摩尔比为1:10,混合涡旋混匀,室温过夜反应,最后得到的产物经过纯化后即可得到所述通用型igg-分子偶联物(如ck19-寡核苷酸偶联物等)。
c.检测
对实施例1所得的igg-分子偶联物进行紫外和标记个数定量检测。
取通过点击化学反应得到的igg-荧光染料分子cd22-alexa
取通过醛肼反应得到的ck19-寡核苷酸偶联物进行nanodrop检测(分光光度计)。igg和寡核苷酸的吸收峰分别在280nm和260nm处,而ck19-寡核苷酸偶联物在354nm下出现新的吸收峰,说明寡核苷酸-fb与ck19-sanh的偶联成功,结果如图2c所示。
取ck19-寡核苷酸偶联物进行bca法(蛋白质浓度测定的定量方法)浓度检测。bca法浓度检测计算偶联物抗体的浓度,用单链定量试剂盒定量ck19-寡核苷酸中寡核苷酸的浓度。可以计算出ck19-寡核苷酸中ck19与寡核苷酸的偶联比为1:1.8。
实施例2
a.本实施例的方案
步骤一、首先通过酶法(糖苷内切酶)对抗体fc片段的糖苷位点进行脱糖基化,暴露出两个glcnac位点;
步骤二、然后由β-半乳糖基转移酶突变体通过转糖基作用将修饰有特殊官能团(叠氮基、炔基、肼基、醛基等)的供体半乳糖衍生物修饰到抗体的glcnac位点;
步骤三、最后利用化学反应(点击化学、醛肼反应等)将带有特殊官能团(叠氮基、炔基、肼基、醛基等)的其他分子物质定点偶联在抗体的fc区。
本实施例实验方案流程图请见图3a。
b.具体实验步骤:
1)igg抗体的脱糖基化
配置反应缓冲液为25mm的tris缓冲液(150mmnacl,ph7.4)或者10mm的磷酸缓冲液(150mmnacl,ph7.4),为方便后面的实验,优选tris缓冲液;抗体进行tris缓冲液置换,浓度为0.5-10mg/ml然后与糖苷内切酶在室温下或者37度孵育30min(1u酶对应1μg抗体)。接着脱糖基化的抗体进行亲和层析纯化。
2)特殊官能团(叠氮基、炔基、肼基、醛基等)的供体半乳糖衍生物
关于上述特殊官能团的供体半乳糖衍生物,可以通过如下方法制备得到,如有市售,也可采用市售商品。
a.udp-gal-n3(叠氮基修饰)
叠氮乙酸与edc/nhs经过活化形成活性酯叠氮基-nhs,或者直接购买叠氮基-nhs活性酯。d-氨基半乳糖盐酸盐(2.3mmol)溶于10ml无水甲醇中,加入1.3ml三乙胺,然后与n3-nhs室温反应搅拌过夜,经过纯化得到叠氮基修饰的半乳糖胺(nacetylazidogalactosamine,gal-2-nhco-ch2-n3)。
接着经过两步酶反应得到udp-gal-n3产物,将3mmgal-2-nhco-ch2-n3、3mmutp、3mmatp加入到2ml含bsa(0.1%)的tris–hcl缓冲液(75mm,ph8.8)中,接着加入三种酶recombinanthumangalnackinasegk2(12μg)、udp-galnacpyrophosphorylaseagx1(1.6μg)、焦磷酸酶(4u)(注:3种酶可以采用市场购买,也可以通过相应方法制备得到,具体制备方法请见文献:《two-stepenzymaticsynthesisofudp-n-acetylgalactosamine》vanessabourgeaux,friedrichpillerandve′roniquepiller*),混合溶液在37度摇床孵育6h,加入13ml甲醇/水混合液(v甲醇:v水=1:1)终止反应,凝胶过滤纯化得到udp-gal-n3产物。
b.udp-gal-炔基(炔基修饰)
d-氨基半乳糖盐酸盐(2.3mmol)溶于10ml无水甲醇中,加入1.3ml三乙胺,然后与2-5倍当量的炔基-nhs室温反应搅拌过夜,经过纯化得到炔基修饰的半乳糖胺(gal-2-nhco-ch2-炔基)。
接着经过两步酶反应得到udp-gal-炔基产物,将3mmgal-2-nhco-ch2-炔基、3mmutp、3mmatp加入到2ml含bsa(0.1%)的tris–hcl缓冲液(75mm,ph8.8)中,接着加入三种酶recombinanthumangalnackinasegk2(12μg)、udp-galnacpyrophosphorylaseagx1(1.6μg)、焦磷酸酶(4u),混合溶液在37度摇床孵育6h,加入13ml甲醇/水混合液(v甲醇:v水=1:1)终止反应,凝胶过滤纯化得到udp-gal-炔基产物。
c.udp-gal-fb(醛基修饰)
d-氨基半乳糖盐酸盐(2.3mmol)溶于10ml无水甲醇中,加入1.3ml三乙胺,然后与2-5倍当量的sfb(4-甲酰苯甲酸n-琥珀酰亚胺酯)室温反应搅拌过夜,经过纯化得到醛基修饰的半乳糖(gal-2-nhco-ch2-fb)。
接着经过两步酶反应得到udp-gal-fb醛基产物,将3mmgal-2-nhco-ch2-fb、3mmutp、3mmatp加入到2ml含bsa(0.1%)的tris–hcl缓冲液(75mm,ph8.8)中,接着加入三种酶recombinanthumangalnackinasegk2(12μg)、udp-galnacpyrophosphorylaseagx1(1.6μg)、焦磷酸酶(4u),混合溶液在37度摇床孵育6h,加入13ml甲醇/水混合液(v甲醇:v水=1:1)终止反应,凝胶过滤纯化得到udp-gal-fb醛基产物。
d.udp-gal-sanh(肼基修饰)
d-氨基半乳糖盐酸盐(2.3mmol)溶于10ml无水甲醇中,加入1.3ml三乙胺,然后与2-5倍当量的sanh(对-丙腙基吡啶甲酸n-羟基琥珀酰亚胺酯)室温反应搅拌过夜,经过纯化得到肼基修饰的半乳糖胺(gal-2-nhco-ch2-sanh)。
接着经过两步酶反应得到udp-gal-sanh肼基产物,将3mmgal-2-nhco-ch2-sanh、3mmutp、3mmatp加入到2ml含bsa(0.1%)的tris–hcl缓冲液(75mm,ph8.8)中,接着加入三种酶recombinanthumangalnackinasegk2(12μg)、udp-galnacpyrophosphorylaseagx1(1.6μg)、焦磷酸酶(4u),混合溶液在37度摇床孵育6h,加入13ml甲醇/水混合液(v甲醇:v水=1:1)终止反应,凝胶过滤纯化得到udp-gal-sanh肼基产物。
3)对igg抗体特定位点进行特殊官能团修饰
利用β-半乳糖基转移酶突变体通过转糖基作用将修饰有特殊官能团(叠氮基、炔基、肼基、醛基等)的供体半乳糖衍生物(udp-galderiatives)修饰到抗体的两个glcnac位点;
将突变酶(100μg)、udp-gal-n3(叠氮修饰的半乳糖,10-20mm)加入100μg抗体-脱糖基化液体中,总体系约200μl,25mm的tris缓冲液(150mmnacl,ph7.4),在30度条件下孵育过夜。然后进行亲和层析纯化。
4)其他分子(药物、核苷酸、荧光染料、抗生素、蛋白、核酸、磁珠、生物素等等)特殊官能团修饰
带氨基的药物或其他分子可与叠氮基-nhs或炔基-nhs活性酯等按比例1:5-30,其中本申请较优的比例为1:10,在dmso中或者在ph8.0的磷酸缓冲液中进行反应2h以上,其中本申请较优的反应时间为过夜,然后得到叠氮基n3(分子-n3)或炔基(分子-炔基)修饰的分子。
带氨基的药物或其他分子可与sfb(4-甲酰苯甲酸n-琥珀酰亚胺酯)或sanh(对-丙腙基吡啶甲酸n-羟基琥珀酰亚胺酯)等按比例1:5-30,其中本申请较优的比例为1:10,在dmf(n,n-二甲基甲酰胺)、dmso或0.1m的ph7.4-8.0的磷酸缓冲液中室温反应2h以上,其中本申请较优的反应时间为过夜,经纯化得到醛基(分子-fb)或肼基(分子-sanh)等修饰的分子。如采用上述方法获得醛基修饰的寡核苷酸:将50nmol的寡核苷酸用0.1m的ph7.4的磷酸缓冲液配置成溶液。称取500nmol的sfb(4-甲酰苯甲酸n-琥珀酰亚胺酯),用无水dmf(n,n-二甲基甲酰胺)溶解后,在室温反应2.5h,经纯化得到寡核苷酸-fb(醛基修饰的寡核苷酸)。
带羧基的药物或其他分子可与叠氮基-nh2或炔基-nh2等进行反应,然后得到叠氮基或炔基修饰的分子。
5)igg抗体与其他分子进行偶联
炔基或叠氮基修饰的分子可与叠氮或炔基修饰的抗体igg进行点击化学反应得到不同igg-偶联物(如cd22-alexa
醛基(分子-fb)或肼基(分子-sanh)修饰的分子可与肼基(igg-sanh)或醛基(igg-fb)修饰的抗体igg进行反应得到不同igg-偶联物(如ck19-寡核苷酸偶联物等)。将ck19-sanh与寡核苷酸-fb按照比例1:10-30,其中本申请较优的摩尔比为1:10,混合涡旋混匀,室温过夜反应,最后得到的产物经过纯化后即可得到所述通用型igg-分子偶联物。
c.检测
对实施例2所得的igg-分子偶联物进行紫外和个数定量检测。
取通过点击化学反应得到的igg-荧光染料分子cd22-alexa
取通过醛肼反应得到的ck19-寡核苷酸偶联物进行nanodrop检测(分光光度计)。igg和寡核苷酸的吸收峰分别在280nm和260nm处,而ck19-寡核苷酸偶联物在354nm下出现新的吸收峰,说明寡核苷酸-fb与ck19-sanh的偶联成功,结果如图3c所示。
取ck19-寡核苷酸偶联物进行bca法(蛋白质浓度测定的定量方法)浓度检测。bca法浓度检测计算偶联物抗体的浓度,用单链定量试剂盒定量ck19-寡核苷酸中寡核苷酸的浓度。可以计算出ck19-寡核苷酸中ck19与寡核苷酸的偶联比为1:2。
实施例3
a.本实施例的方案
步骤一、首先通过酶法(β-半乳糖苷酶)对抗体fc片段的糖苷位点进行脱糖基化,暴露出四个glcnac位点;
步骤二、然后由β-半乳糖基转移酶突变体通过转糖基作用将修饰有特殊官能团(叠氮基、炔基、肼基、醛基等)的供体半乳糖衍生物修饰到抗体的糖苷位点;
步骤三、最后利用化学反应(点击化学、醛肼反应等)将带有特殊官能团(叠氮基、炔基、肼基、醛基等)的其他分子物质定点偶联在抗体的fc区。
本实施例实验方案流程图请见图4a。
b.具体实验步骤
1)igg抗体的脱糖基化
配置反应缓冲液50mm的磷酸缓冲液(150mmnacl,ph6.0),抗体进行磷酸缓冲液置换,浓度为0.5-10mg/ml(100μg,2μg/μl),然后与重组β-半乳糖苷酶(10-20mu)在37度孵育4-24h,其中本申请较优的反应时间为4h。接着脱糖基化的抗体进行亲和层析纯化。
2)特殊官能团(叠氮基、炔基、肼基、醛基等)的唾液酸衍生物的制备
本实验步骤与实施例2中关于特殊官能团(叠氮基、炔基、肼基、醛基等)修饰的半乳糖衍生物的制备方法相同。因此不再赘述,具体请参见实施例2。
3)对igg抗体特定位点进行特殊官能团修饰
利用β-半乳糖基转移酶突变体通过转糖基作用将修饰有特殊官能团(叠氮基、炔基、肼基、醛基等)的供体半乳糖衍生物修饰到抗体的四个glcnac位点;
将突变酶(100μg)、udp-gal-n3(叠氮修饰的半乳糖,10-20mm)加入100μg抗体-脱糖基化液体中,总体系约200μl,25mm的tris缓冲液(150mmnacl,ph7.4),在30度条件下孵育过夜。然后进行亲和层析纯化。
4)其他分子(药物、核苷酸、荧光染料、抗生素、蛋白、核酸、磁珠、生物素等等)进行叠氮基、炔基、肼基或醛特殊官能团基修饰
带氨基的药物或其他分子可与叠氮基-nhs或炔基-nhs活性酯等按比例1:5-30,其中本申请较优的比例为1:10,在dmso中或者在ph8.0的磷酸缓冲液中进行反应2h以上,其中本申请较优的反应时间为过夜,然后得到叠氮基n3(分子-n3)或炔基(分子-炔基)等修饰的分子。
带氨基的药物或其他分子可与sfb(4-甲酰苯甲酸n-琥珀酰亚胺酯)或sanh(对-丙腙基吡啶甲酸n-羟基琥珀酰亚胺酯)等按比例1:5-30,其中本申请较优的比例为1:10,在dmf(n,n-二甲基甲酰胺)、dmso或0.1m的ph7.4-8.0的磷酸缓冲液中室温反应2h以上,其中本申请较优的反应时间为过夜,经纯化得到醛基(分子-fb)或肼基(分子-sanh)等修饰的分子。如采用上述方法获得醛基修饰的寡核苷酸:将50nmol的寡核苷酸用0.1m的ph7.4的磷酸缓冲液配置成溶液。称取500nmol的sfb(4-甲酰苯甲酸n-琥珀酰亚胺酯),用无水dmf(n,n-二甲基甲酰胺)溶解后,在室温反应2.5h,经纯化得到寡核苷酸-fb(醛基修饰的寡核苷酸)。
带羧基的药物或其他分子可与叠氮基-nh2或炔基-nh2等进行反应,然后得到炔基或叠氮基修饰的分子。
5)igg抗体与其他分子进行偶联
炔基或叠氮基修饰的分子可与叠氮或炔基修饰的抗体igg进行点击化学反应得到不同igg-偶联物(如cd22-alexa
醛基(分子-fb)或肼基(分子-sanh)修饰的分子可与肼基(igg-sanh)或醛基(igg-fb)修饰的抗体igg进行反应得到不同igg-偶联物(如ck19-寡核苷酸偶联物等)。将ck19-sanh与寡核苷酸-fb按照比例1:10-30,其中本申请较优的摩尔比为1:20,混合涡旋混匀,室温过夜反应,最后得到的产物经过纯化后即可得到所述通用型igg-分子偶联物。
c.检测
对实施例3所得的igg-分子偶联物进行紫外和个数定量检测。
取通过点击化学反应得到的igg-荧光染料分子cd22-alexa
取通过醛肼反应得到的ck19-寡核苷酸偶联物进行nanodrop检测(分光光度计)。igg和寡核苷酸的吸收峰分别在280nm和260nm处,而ck19-寡核苷酸偶联物在354nm下出现新的吸收峰,说明寡核苷酸-fb与ck19-sanh的偶联成功,结果如图4c所示。
取ck19-寡核苷酸偶联物进行bca法(蛋白质浓度测定的定量方法)浓度检测。bca法浓度检测计算偶联物抗体的浓度,用单链定量试剂盒定量ck19-寡核苷酸中寡核苷酸的浓度。可以计算出ck19-寡核苷酸中ck19与寡核苷酸的偶联比为1:3.9。
实施例4
a.本实施例方案
步骤一、首先通过酶法(β-半乳糖苷酶)对抗体fc片段的糖苷位点进行脱糖基化,暴露出四个glcnac位点;
步骤二、然后由β-半乳糖基转移酶将半乳糖udp-gal修饰到抗体的四个glcnac位点;
步骤三、利用唾液酸糖基转移酶将修饰有特殊官能团(叠氮基、炔基、肼基、醛基等)的供体唾液酸衍生物修饰到抗体的4个新的gal位点;
步骤四、最后利用化学反应(点击化学、醛肼反应等)将带有特殊官能团(叠氮基、炔基、肼基、醛基等)的其他分子物质定点偶联在抗体的fc区。
本实施例实验方案流程图请见图5a。
b.具体实验步骤
1)igg抗体的脱糖基化
配置反应缓冲液50mm的磷酸缓冲液(150mmnacl,ph6.0),抗体进行磷酸缓冲液置换,浓度为0.5-10mg/ml(100μg,2μg/μl),然后与重组β-半乳糖苷酶(10-20mu)在37度孵育4-24h,其中本申请较优的反应时间为4h。接着脱糖基化的抗体进行亲和层析纯化。
2)半乳糖udp-gal修饰
将β-半乳糖基转移酶(100-200μg)、udp-gal(10-20mm)加入100μg上述步骤1)得到的脱糖基化的抗体-脱糖基化液体中,总体系约200μl,25mm的tris缓冲液(150mmnacl,ph7.4),在30度条件下孵育过夜,将半乳糖udp-gal修饰到抗体的四个glcnac位点。然后进行纯化和缓冲液(50mm二甲胂酸盐缓冲液(cacodylatebuffer)ph7.6)或者100mm的tris缓冲液(ph8.0,50mmnacl)置换。
3)特殊官能团(叠氮基、炔基、肼基、醛基等)修饰的唾液酸衍生物的制备
本实验步骤与实施例1中关于特殊官能团(叠氮基、炔基、肼基、醛基等)的唾液酸衍生物的制备方法相同。因此不再赘述,具体请参见实施例1。
4)对igg抗体特定位点进行特殊官能团修饰
利用唾液酸糖基转移酶将修饰有叠氮基、炔基、肼基或醛基等特殊官能团的唾液酸衍生物连在抗体的四个新的糖基受体gal位点上,反应体系100μl,为50mm二甲胂酸盐缓冲液或者100mm的tris缓冲液、8mm的唾液酸衍生物、重组半乳糖gal的igg抗体(0.5-10mg/ml,(其中本申请较优的igg抗体浓度为2mg/ml)、2u的st6gal1在ph7.6-8.0(其中本申请较优的ph为8.0)、温度30度或37度条件下孵育1h-96h(其中本申请较优的温度和反应时间为30度过夜)。体系中可加入bsa(50μg)和ciap阻止cmp抑制酶活。最后进行亲和层析纯化。
5)其他分子(药物、核苷酸、荧光染料、抗生素、蛋白、核酸、磁珠、生物素等等)进行特殊官能团修饰
带氨基的药物或其他分子可与叠氮基-nhs或炔基-nhs等活性酯按比例1:5-30,其中本申请较优的比例为1:10,在dmso中或者在ph8.0的磷酸缓冲液中进行反应2h以上,其中本申请较优的反应时间为过夜,然后得到叠氮基n3(分子-n3)或炔基(分子-炔基)等修饰的分子。
带氨基的药物或其他分子可与sfb(4-甲酰苯甲酸n-琥珀酰亚胺酯)或sanh(对-丙腙基吡啶甲酸n-羟基琥珀酰亚胺酯)等按比例1:5-30,其中本申请较优的比例为1:10,在dmf(n,n-二甲基甲酰胺)、dmso或0.1m的ph7.4-8.0的磷酸缓冲液中室温反应2h以上,其中本申请较优的反应时间为过夜,纯化得到醛基(分子-fb)或肼基(分子-sanh)等修饰的分子。
带羧基的药物或其他分子可与叠氮基-nh2或炔基-nh2等进行反应,然后得到炔基或叠氮基修饰的分子。
6)igg抗体与其他分子进行偶联
炔基或叠氮基修饰的分子可与叠氮或炔基修饰的抗体igg进行点击化学反应得到不同igg-偶联物。将叠氮修饰的igg抗体(cd22-n3或her2-n3)与炔基修饰的分子(alexa
醛基(分子-fb)或肼基(分子-sanh)修饰的分子可与肼基(igg-sanh)或醛基(igg-fb)修饰的抗体igg进行反应得到不同igg-偶联物。将igg-sanh与分子-fb按照比例1:10-30,其中本申请较优的摩尔比为1:20,混合涡旋混匀,室温过夜反应,最后得到的产物经过纯化后即可得到所述通用型igg-分子偶联物。
c.检测
对实施例4所得的igg-分子偶联物进行紫外和个数定量检测。
取通过点击化学反应得到的取igg-荧光染料分子cd22-alexa
以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术无需创造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!