检测TRIM2、TRIM4、TRIM32和/或TRIM46基因或蛋白产品的用途的制作方法
本发明涉及生物技术领域,特别涉及检测trim2、trim4、trim32和/或trim46基因或蛋白产品的用途。
背景技术:
结核病是由结核分枝杆菌感染引起的一种慢性传染性疾病。虽然人类与结核病的斗争从未停止过,但它依然严重威胁着全球的公共健康。据世界卫生组织最新报告,2015年,全球新发结核病病例约为1040万,大约180万人死于结核病,中国的新发病人数为91.8万,死亡人数为3.8万,发病总人数位居世界第四位,流行形势十分严峻。近年来,随着耐多药结核病和广泛耐药结核病的出现,以及hiv的共感染,使结核病的控制面临严峻挑战。控制结核病流行的重要措施之一是切断传染源,而活动性结核病患者是主要的传染源,因此及早的、准确的诊断出活动性结核病人,并给予及时的治疗,便可有效降低结核病的蔓延。
目前,临床上结核病诊断方法均存在显著缺陷,如痰涂片抗酸染色检查—灵敏度较低;传统结核分枝杆菌培养法—操作繁琐、阳性率低且耗时长;自动化快速培养法—需要昂贵的仪器设备;胸部x线检测—肺结核病特征性改变不明显且无法早期及时的发现;结核菌素皮试—不能区分自然感染和卡介苗接种;ifn-r释放试验(igras)—不能区分潜伏感染者和活动性结核病人;genexpertmtb/rif法—直接从痰标本进行的基因检测,在敏感性方面没有显著提高,且存在一定的假阴性率和假阳性率。血清学抗体检测—特异性和敏感性均不理想。因此,迫切需要开发出新的诊断标记物,建立快速、高效、敏感的诊断方法。
人感染结核分枝杆菌后,大约仅有5%~10%的人最终会发展成活动性结核病,而大部分人处于一种无临床症状的潜伏感染状态。然而,大约5%~10%的潜伏感染者,当其免疫力低下时,结核分枝杆菌会再次活化而发展成活动性结核病。结核分枝杆菌感染机体后,宿主细胞的免疫状态在结核病的发病过程中扮演着至关重要的作用,其中,免疫反应中的调节子,如细胞因子,趋化因子、细胞表面受体等,一直都是研究的重点。而近年来研究发现三结构域蛋白(trim)家族可以作为宿主的限制因子,参与天然免疫应答反应,因此而备受关注。
trim蛋白家族由众多成员构成,几乎存在于所有多细胞动物体内,其可作为免疫调节蛋白和e3泛素连接酶,参与机体的固有免疫应答。随着研究的不断深入,人们发现trim蛋白家族不仅可以维持机体的正常生理功能,如细胞生长,细胞分化,膜修复,信号通路和细胞凋亡等,还能参与多种疾病的调控过程。此外,trim蛋白在人类不同疾病中具有特征表达谱,对于疾病的发展、诊断或预后都具有重要的提示作用。如kosaka等发现trim29在胃癌患者中表达上调,且可以作为一个标志物用来指示淋巴结的转移。yamada等发现在睾丸生殖细胞肿瘤(tgct)患者中trim44表达上调,有望成为一个新的预后因子。此外,nenasheva等通过诱导帕金森(pd)患者和健康人的多功能干细胞,比较转录组发现trim6和trim24基因在两组人群中的表达量有明显差异,提示这些基因可以作为疾病发展和免疫系统失调的预警基因。然而,目前关于trim基因在结核病中的表达情况与调节作用的研究还有很多未知之处,若能找到与结核病相关的特征trim基因,就有可能为制备结核病的预防、诊断和治疗的产品提供新的靶点和思路。
因此,亟待对与结核病感染相关的trim基因进行研究,寻找新的诊断标志物,建立一种更快速、高效、敏感的鉴别、诊断、筛查活动性结核病的方法。
技术实现要素:
本发明的一个方面是针对现有技术中缺少更快速、高效、敏感地鉴别、诊断和/或筛查活动性结核病的方法,提供了一种检测trim基因和/或蛋白水平的产品的用途。
为了解决上述技术问题,本发明提供的技术方案为:
检测trim基因和/或蛋白水平的产品的用途,所述产品应用于制备鉴别、诊断和/或筛查活动性结核病的产品;
所述基因为选自trim2、trim4、trim32或trim46中的一种或几种;所述蛋白为选自trim2、trim4、trim32或trim46中的一种或几种基因所表达的蛋白。
在本发明中,任意合适的检测trim基因和/或蛋白水平的产品均能够实现本发明的目的,包括但不限于定量和/或定性产品。但作为优选,在本发明的一个实施方式中,上述检测样本中trim基因和/或蛋白水平的产品为定量检测trim基因和/或蛋白水平的产品。
更优选地,上述检测样本中trim基因和/或蛋白水平的产品为选自基因扩增引物、探针、基因芯片、抗体、蛋白质芯片或抗体中的一种或几种。
更优选地,上述为用于扩增trim2、trim4、trim32或trim46中的一种或几种基因的pcr引物。
进一步优选地,pcr引物为选自seqidno.1-8中的一对或几对pcr引物。
上述pcr引物优选为实时荧光定量pcr(qrt-pcr)引物。
作为优选,在本发明的一个实施方式中,发明人使用以下方法来筛选目标靶点:
1.提供一组目标trim基因,其中包括trim2、trim4、trim32和trim46基因;
2.收集活动性结核病患者和潜伏感染者的外周血,裂解外周血红细胞,提取rna,保存备用;
3.优化实验条件,针对目标基因设计引物,采用qrt-pcr的方法检测两组人群中trim2、trim4、trim32和trim46基因的表达水平;
4.采用2-δδct法对数据进行分析,通过决策树分析trim2、trim4、trim32和trim46基因分别用于鉴别活动性结核病的诊断效果。
本发明的另一个方面是提供了一种用于鉴别、诊断和/或筛查活动性结核病的试剂盒,上述试剂盒包括检测样本中trim基因和/或蛋白水平的产品。
作为优选,上述试剂盒中包括选自基因扩增引物、探针、基因芯片、抗体、蛋白质芯片或抗体中的一种或几种的产品。
更优选地,上述试剂盒中包括用于扩增trim2、trim4、trim32或trim46中的一种或几种基因的pcr引物。
进一步优选地,上述试剂盒中包括选自seqidno.1-8中的一对或几对pcr引物。
上述pcr引物优选为qrt-pcr引物。通常地,上述试剂盒中还包括任意必须的组成部分,如试剂盒说明书等。
本发明的另一个方面是提供了一种上述试剂盒在制备鉴别、诊断和/或筛查活动性结核病中的应用。
本发明的有益效果:
由于ifn-r释放试验(igras)具有快速,敏感度高等特点,目前在临床上应用较为广泛,但是此方法最大的缺陷是不能区分潜伏感染者和活动性结核病人,而本发明的最大优点是弥补这一缺陷。
此外,本发明标本容易获得,具有快速,高效,高敏感度,高准确度,操作相对简便,易于推广的特点。
附图说明
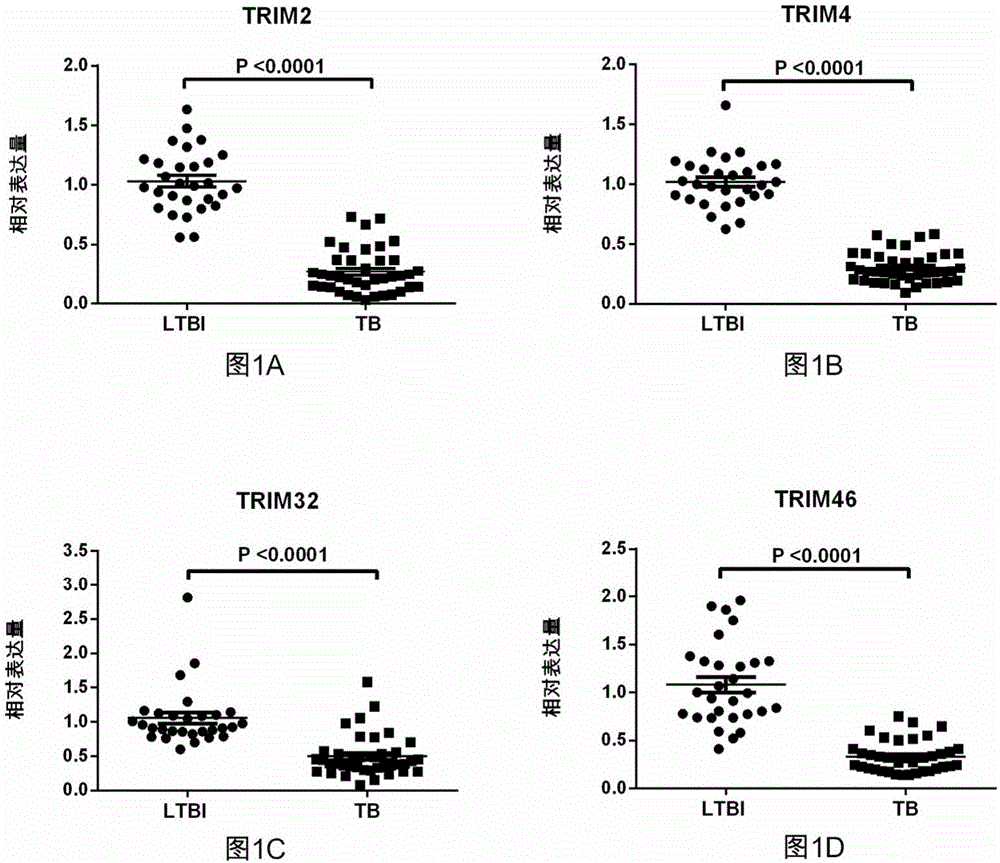
图1为trim基因在潜伏感染者和活动性结核患者中相对表达水平的散点图,其中图1a为trim2,图1b为trim4,图1c为trim32,图1d为trim46,其中,ltbi为潜伏感染者,tb为活动性结核病患者;
图2为trim基因的决策树分析示意图,其中图2a为trim2,图2b为trim4,图2c为trim32,图2d为trim46,其中n为样本数,ltbi为潜伏感染者,tb为活动性结核病患者。
序列说明
seqidno.1-2分别为本发明中trim2的上、下游pcr引物序列;
seqidno.3-4分别为本发明中trim4的上、下游pcr引物序列;
seqidno.5-6分别为本发明中trim32的上、下游pcr引物序列;
seqidno.7-8分别为本发明中trim46的上、下游pcr引物序列。
具体实施方式
本发明公开了一种检测trim基因和/或蛋白水平的产品的用途,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。需要特别指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明,并且相关人员明显能在不脱离本发明内容、精神和范围的基础上对本文所述内容进行改动或适当变更与组合,来实现和应用本发明技术。
在本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。
为了使本领域的技术人员更好地理解本发明的技术方案,下面结合具体实施例对本发明作进一步的详细说明。
在本具体实施方式中,术语“活动性结核病患者”是指具有结核病的临床症状,经涂片或培养阳性,胸部x线片异常,未开始或刚开始系统化学药物治疗的确诊结核病患者。
术语“潜伏感染者”是指无临床主诉症状,结核菌素皮肤试验(tst)试验和t-spot实验均为阳性,胸部x线片阴性者。
以上人群均排除糖尿病,hiv感染和其他自身免疫性疾病。
以上人群来自于首都医科大学附属北京胸科医院。
在本具体实施方式中,发明人将样本分为两组:活动性结核病组(tb,39例)和潜伏感染组(ltbi,29例)。
实施例1外周血有核细胞的制备
空腹采集每例受试者的外周血2ml于肝素钠抗凝的采血管中。采用红细胞裂解液(solarbio,货号r1010)在6h内制备有核细胞,具体步骤如下:
1按照新鲜全血:红细胞裂解液体积比为1:3,加入6ml红细胞裂解液,轻轻涡旋或颠倒混匀。
2冰上放置15min,其间轻轻涡旋混匀两次,红细胞裂解后,溶液应该是清亮透明的。
3收集细胞:4℃,450×g离心10min以沉淀白细胞,弃掉上清液。
4向白细胞沉淀中加入2倍体积(4ml)的红细胞裂解液,重悬白细胞。
5收集细胞:4℃,450×g离心10min沉淀白细胞,小心并彻底吸去上清液。
6加入1mltrizol试剂(invitrogen,货号:15596)裂解细胞,然后转移至离心管中,保存于-80℃,用于后续提取rna。
实施例2应用qrt-pcr方法检测trim基因的表达变化
1.rna的抽提
将实施例1中得到的细胞裂解液,在室温下融化,每管加入0.2ml氯仿,用手上下剧烈振荡15s,产生粉红色浑浊液无分层现象,室温静置3min。12000r/min,4℃离心15min,取出离心管,样品分为三层:无色的上清水相、中间的白色层及粉红色的下层有机相。小心吸取无色上清水相移至新离心管,向得到的上清水相加入1/2trizol体积(500ml)的异丙醇,轻轻混匀,室温静置10min。12000r/min,4℃离心10min,弃掉上清,加入1ml75%的乙醇(无rna酶水配制),轻轻混匀。7500r/min,4℃离心5min,小心吸尽上清,室温干燥沉淀5min,加入30μl的无rnase水溶解rna沉淀,于-80℃保存、待用。
2.反转录
采用takara公司的primescripttmrtreagentkit(货号:rr037q),取1)中得到的rna2μg,进行反转录,总体系为20μl。反应体系配制均在冰上进行,为了保证反应液配制的准确性,减少分装时造成的误差,应按照比实际用量稍大的体积配制反应液,最后加入rna样品。体系如下:
配制好的反应体系,在pcr仪上进行以下反应:37℃,15min;85℃,5s;反应完毕后,向每个cdna样本中加入40μlddh2o,混匀后,保存在4℃。
3.实时荧光定量pcr
3.1引物序列
3.2实时荧光定量pcr检测目的基因
以2)中得到的cdna为模板,采用
反应条件为:95℃预变性40s,1cycle;95℃变性5s,60℃退火34s,40cycle。
3.3数据处理及统计分析
根据实时荧光定量pcr的结果,用abi7500softwarev2.0.6对结果进行分析,以gapdh基因为内参基因,通过2-△△ct的方法计算出活动性结核病患者相对于潜伏感染者的trim基因相对表达量。采用非配对t检验分析方法,阈值设置为p<0.05,具有统计学差异。结果如图1a-d所示,其中横坐标表示不同人群,纵坐标表示相对表达量,纵坐标值越大表明其表达水平越高。结果表明,trim2、trim4、trim32和trim46基因在活动性结核病患者中表达水平均显著低于潜伏感染者的表达水平。在图1a-d中,ltbi为潜伏感染者,tb为活动性结核病患者,横线为平均值±标准误。
实施例3trim基因用于诊断活动性结核病的判定方法
根据上述的实验结果,可通过rt-qpcr诊断活动性结核病患者和结核潜伏感染者。本发明具体提供了四种独立的诊断判定方法,分别使用trim2、trim4、trim32和trim46的相对表达倍数,通过roc曲线分析,确定每个基因的最佳阈值。具体如下:
使用trim2的相对表达倍数时,若trim2的相对表达倍数小于0.5453时,检测结果为阳性,即判定为活动性结核病;若大于等于0.5453时,检测结果为阴性,即判定为潜伏感染者。在本实施例的68例样本(包括39例活动性结核病患者和29例潜伏感染者)中使用该判定方法诊断的敏感性为92.31%,特异性为100%,区分正确度为95.59%(图2a)。
使用trim4的相对表达倍数时,若trim4的相对表达倍数小于0.6069时,检测结果为阳性,即判定为活动性结核病;若大于等于0.6069时,检测结果为阴性,即判定为结核潜伏感染。在本实施例的68例样本(包括39例活动性结核病患者和29例潜伏感染者)中使用该判定方法诊断的敏感性为100%,特异性为100%,区分正确度为100%(图2b)。
使用trim32的相对表达倍数时,若trim32的相对表达倍数小于0.5837时,检测结果为阳性,即判定为活动性结核病;若大于等于0.5837时,检测结果为阴性,即判定为结核潜伏感染。在本实施例的68例样本(包括39例活动性结核病患者和29例潜伏感染者)中使用该判定方法诊断的敏感性为79.49%,特异性均为100%,区分正确度为88.24%(图2c)。
使用trim46的相对表达倍数时,若trim46的相对表达倍数小于0.7133时,检测结果为阳性,即判定为活动性结核病;若大于等于0.7133时,检测结果为阴性,即判定为结核潜伏感染。在本实施例的68例样本(包括39例活动性结核病患者和29例潜伏感染者)中使用该判定方法诊断的敏感性为97.44%,特异性为86.21%,区分正确度为92.65%(图2d)。
本实施例中trim2、trim4、trim32和trim46在活动性结核病患者和潜伏感染者中具有显著的差异表达。以所述trim基因为模板设计特异性引物进行相对定量rt-qpcr检测,可用于活动性结核病外周血的快速检测中,具有较高的敏感性和准确性,操作相对简便,可以提高活动性结核病的早期诊断率。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
序列表
<110>首都医科大学附属北京胸科医院
<120>检测trim2、trim4、trim32和/或trim46基因或蛋白产品的用途
<130>none
<160>8
<170>siposequencelisting1.0
<210>1
<211>19
<212>dna
<213>human
<400>1
tgtgaaaagacccgcaagc19
<210>2
<211>18
<212>dna
<213>human
<400>2
cgtccccgtatgccaaaa18
<210>3
<211>21
<212>dna
<213>human
<400>3
atgctaaagcgattccaagtg21
<210>4
<211>22
<212>dna
<213>human
<400>4
caagaactggctgatgctgtat22
<210>5
<211>19
<212>dna
<213>human
<400>5
atgctgagggcaccgtcta19
<210>6
<211>20
<212>dna
<213>human
<400>6
acgatgagatcaccacgagc20
<210>7
<211>18
<212>dna
<213>human
<400>7
tgcttgagaaccccgaca18
<210>8
<211>20
<212>dna
<213>human
<400>8
tcgctggtccttgctgatag20
- 还没有人留言评论。精彩留言会获得点赞!