利用裂褶菌生物转化人参皂苷制备人参稀有皂苷的方法与流程
本发明涉及人参稀有皂苷的制备方法,公开了一种利用裂褶菌生物转化人参皂苷制备人参稀有皂苷的方法,属于食药用真菌液体发酵技术领域。
背景技术:
人参皂苷为人参属药用植物人参、西洋参和三七的主要有效成分,它具有人参属植物的主要生理活性。到目前为止,分离并确定结构的人参单体皂苷已达100余种。人参皂苷按照苷元的结构不同分为二醇型人参皂苷(rb1、rc、rb2、rd、rg3、rh2、compoundk等)和三醇型人参皂苷(re、rg1、rg2、rf、rh1等),其中人参皂苷rb1、rc、rb2、rd、re和rg1是人参属植物的主要皂苷,在人参皂苷中约占90%。稀有人参皂苷,如人参皂苷rg3、f2、compoundk、rh2、rh3等,在人参中微量存在或不存在。最新药理学研究表明,这些稀有人参皂苷具有多种生理活性,其中抗癌、抗糖尿病、抗氧化和提高免疫力等药理作用非常显著。
人参皂苷的代谢研究表明,人参皂苷经口服,在消化系统酶和肠道微生物的作用下转化为人参稀有皂苷后,被吸收起到药效;1994年日本kobashi等发现了人参皂苷rb1和rg1口服后,经消化系统的微生物转化为稀有人参皂苷后被人体吸收。其主要代谢机理为rb1→rd→f2→ck→苷元;rg1→rh1(或f1)→苷元。以后又相继发现原人参二醇类皂苷rb2、rc等口服后被肠道菌水解为f2、ck等。这些稀有人参皂苷才是真正的发挥药效的物质,但其在人参属植物中的含量很低,要获得进行药物开发必需的量几乎是不可能的。
为了获得具有极高药用价值的人参稀有皂苷,从上世纪八十年代始,国内外化学及生物技术工程研究人员便开始了人参皂苷的结构改造工程,其研究目标主要锁定在对人参二醇型皂苷和三醇型皂苷c3和c20位的糖基结构修饰,利用不同方法进行人参皂苷糖基改造,使人参中含量较高的人参皂苷的糖基经过水解作用,定向转化为稀有人参皂苷。目前,用于人参皂苷糖基改造的主要方法有化学法和微生物转化法。
化学法主要包括酸水解法和碱裂解法,虽然用酸、碱水解人参皂苷操作比较简单,但是存在很多缺点,如:一、酸、碱水解人参皂苷专一性差、得率低;二、在实际的工业生产中高温高压的作业环境存在着许多安全隐患;三、强酸、强碱对设备器皿的腐蚀性特别大;四、由于向环境中排放大量的污染物,严重影响了环境质量;五、化学裂解法反应太剧烈,许多皂苷元在此条件下会发生化学变化生成多种副产物,造成稀有皂苷的得率较低。与化学方法相比较而言,获得稀有人参皂苷的最佳方法就是微生物生物转化法。微生物转化人参皂苷获得稀有人参皂苷已成为当今研究的热点。
微生物转化本质是利用微生物本身所产生的酶对外源底物进行的催化反应。因为某些微生物细胞可以产生一种或多种酶,把特定的化合物变成结构相关的更有经济价值的产物,来完成常规化学方法难以实现的生化反应。多年来,研究者们对人参皂苷的微生物转化途径及产物进行了细致的研究,为人参皂苷的制备提供了广泛的途径。但是这些研究所使用的微生物(细菌和霉菌)大多数是不安全的,不能用于食品和药品的生产。人的肠内菌如bacteroidessp.,bifidobacteriumsp.,bifidobacteriumbifidum,bifidobacteriumbreve,fusobacteriumsp.,lactobacillusdelbrueckii,andleuconostocparamesenterioides等是安全的可以用于食品生产的微生物,许多研究展示了其水解主要人参皂苷为稀有皂苷的能力,但是这些微生物属于厌氧菌,其培养条件复杂,培养基成本较高,人参皂苷的转化率较低。一些丝状真菌如aspergillusniger,aspergillusoryzae,mucorjavanicus,penicillumroqueforti等已经广泛的应用于食品的工业化发酵生产,被认为是安全的微生物,在人参皂苷的生物转化上由于转化率较高而倍受青睐。但是最近的一些研究表明这些真菌会产生一些致病毒素,如aspergillusniger一种最重要的生物工程菌,在工业发酵过程中会产生两种致癌的霉菌毒素:伏马菌素和赭曲霉素。因而寻找一种安全可食用的微生物用于人参皂苷的生物转化,对大规模工业化生产稀有人参皂苷具有重要的意义。
食药用菌是一种重要的生物资源,其种源十分丰富,在我国被用于食品和药品已有上千年的历史。食药用菌在液体培养过程中,产生的菌丝体的营养成分与生理功效与子实体十分接近。因此其液体发酵培养技术越来越受到人们的重视,该技术比之于传统的食药用菌的栽培生产技术有明显的优越性。表现在新陈代谢旺盛、菌丝分裂迅速,在短期内便可获得大量的菌丝体和代谢产物。其发酵液中产生的代谢产物为:多糖、多肽、生物碱、萜类化合物、酚类、甾醇、酶、核酸、氨基酸、维生素等各种化合物,这些物质具有抗炎、抗菌、抗癌、抗衰老、抗溃疡、提高免疫力及防辐射等医疗保健功效。食药用菌的营养和药用价值对人类的健康是有益的、安全的,但直到目前为止没有使用食药用菌高效生物转化人参皂苷的报道。
技术实现要素:
本发明公开一种利用裂褶菌生物转化人参皂苷制备人参稀有皂苷的方法,可以实现使用绿色、高效、安全和可食用的食药用菌生物转化人参皂苷,制备药用价值更高的稀有人参皂苷。克服了过去使用不安全的,不能用于食品和药品生产的细菌和霉菌作为发酵菌种的缺点。
本发明的技术解决方案包括以下步骤:
1)以裂褶菌为发酵菌种,按5%-30%的接种量接种到液体发酵培养基中,培养基ph为2-9,人参皂苷的投料量为1-60g/l,摇床转数为10-300r/min,在15-40℃条件下发酵培养2-10天。
2)发酵结束后,过滤菌液,菌丝用80%乙醇超声提取3-5次,每次30min。提取液在40-60℃下减压回收溶剂,浓缩为水溶液。
3)将浓缩的提取液与菌液合并,用大孔树脂d101进行分离,20%-90%乙醇梯度洗脱,采用薄层色谱法检测,收集、合并与人参稀有皂苷阳性对照品rf值相同的流份溶液,减压回收溶剂。
4)使用制备型液相色谱分离制备,得到稀有人参皂苷f2、compoundk、compoundo、compoundy、compoundmc1、compoundmc、c-mx1和c-mx。
所述的一种利用裂褶菌生物转化人参皂苷制备人参稀有皂苷的方法步骤(1)优选:液体发酵的接种量为8%-10%,发酵培养基的ph为5-6,人参皂苷的投料量为10-20g/l。
所述的一种利用裂褶菌生物转化人参皂苷制备人参稀有皂苷的方法步骤(1)优选:液体发酵的摇床转数为150-180r/min,发酵温度为25-28℃,发酵时间为5-6天。
所述的一种利用裂褶菌生物转化人参皂苷制备人参稀有皂苷的方法步骤(1)优选:生物转化培养基中的营养采用碳源和氮源,其中碳源可为葡萄糖、蔗糖、麦芽糖、淀粉、糊精、饴糖;氮源可为酵母粉、蛋白胨、牛肉膏、玉米粉、花生粉、黄豆粉、鱼粉;此外还需要添加一定比例的无机盐、生长因子、维生素,所述的无机盐为nh4cl、kh2po4、mgso4·7h2o、nh4no3、k2hpo4、kcl、(nh4)2so4、feso4·7h2o或caco3生长因子为生物素、维生素为维生素b1或维生素c;
本发明产品及其提取物可以制成散剂、颗粒剂、片剂、胶囊剂、丸剂或口服液等药物学上的任何剂型,用于治疗癌症,肿瘤,糖尿病,高血脂症,心肌或脑缺血,机体免疫功能受损,以及消化系统等疾病。
本发明的积极效果在于:采用新方法对人参皂苷进行生物转化,在发酵过程中,裂褶菌不但能降解人参皂苷生成大量稀有皂苷,同时还能产生大量的裂褶菌多糖、多肽、生物碱、酶、氨基酸、维生素等各种生物活性物质;最大限度地提高了发酵产品的保健和药用功效。因为裂褶菌是食药用菌,是安全的,可以食用的,因此本发明方法既可以制备单体稀有皂苷,也可以直接提取粗提取物用于产品开发,达到简单、高效、安全绿色、低成本的加工目的,为工业化生产、食品和新药制备提供方法保证。
附图说明
图1:人参皂苷rb1样品的hplc色谱图;
图2:人参皂苷rb1样品生物转化产物的hplc色谱图;
图3:人参皂苷rb2样品的hplc色谱图;
图4:人参皂苷rb2样品生物转化产物的hplc色谱图;
图5:人参皂苷rc样品的hplc色谱图;
图6:人参皂苷rc样品生物转化产物的hplc色谱图;
图7:人参皂苷rd样品的hplc色谱图;
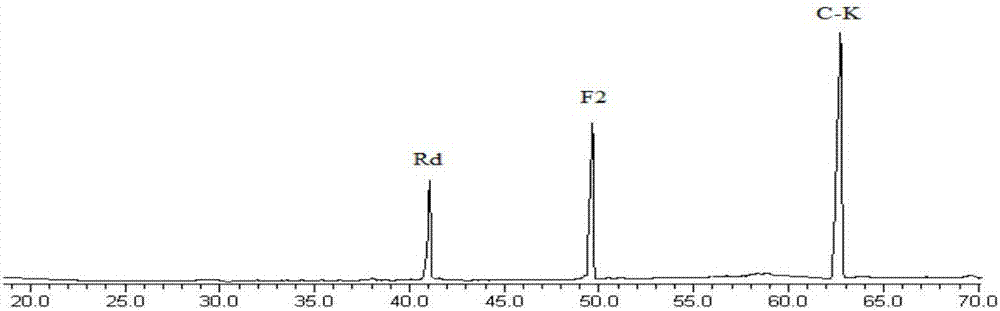
图8:人参皂苷rd样品生物转化产物的hplc色谱图;
图9:人参皂苷rb3样品的hplc色谱图;
图10:人参皂苷rb3样品生物转化产物的hplc色谱图;
图11:人参二醇皂苷样品的hplc色谱图;
图12:人参二醇皂苷样品生物转化产物的hplc色谱图;
图13:温度对人参二醇皂苷转化率的影响;
图14:温度对多糖和菌丝产量的影响;
图15:ph值对人参二醇皂苷转化率的影响;
图16:ph对多糖和菌丝产量的影响;
图17:发酵时间对人参二醇皂苷转化率的影响;
图18:不同发酵时间对多糖和菌丝产量的影响;
图19:摇床转速对人参二醇皂苷转化率的影响;
图20:摇床转速对多糖和菌丝产量的影响;
图21:装液量对人参二醇皂苷转化率的影响;
图22:摇床转速对多糖和菌丝产量的影响;
图23:接种量对人参二醇皂苷转化率的影响;
图24:接种量对多糖和菌丝产量的影响;
图25:底物投料量对人参二醇皂苷转化率的影响。
具体实施方式
通过以下实施例进一步举例描述本发明,并不以任何方式限制本发明,在不背离本发明的技术解决方案的前提下,对本发明所作的本领域普通技术人员容易实现的任何改动或改变都将落入本发明的权利要求范围之内。
实施例1
裂褶菌按5%的接种量接种到液体发酵培养基中,培养基ph为8,人参皂苷rb1的投料量为5g/l,摇床转数为120r/min,在20℃条件下发酵培养4天。发酵结束后,过滤菌液,菌丝用80%乙醇超声提取3次,每次30min。提取液在40℃下减压回收溶剂,浓缩为水溶液,然后将浓缩的提取液与菌液合并;用大孔树脂d101进行分离,20%-90%乙醇梯度洗脱,采用薄层色谱法检测,收集、合并与人参稀有皂苷阳性对照品rf值相同的流份溶液,减压回收溶剂,使用制备型液相色谱分离制备,得到人参皂苷f2和compoundk。转化产物经hplc检测和鉴定,结果见图1和图2。
实施例2
裂褶菌按10%的接种量接种到液体发酵培养基中,培养基ph为7,人参皂苷rb2的投料量为10g/l,摇床转数为140r/min,在22℃条件下发酵培养5天。发酵结束后,过滤菌液,菌丝用80%乙醇超声提取4次,每次30min。提取液在50℃下减压回收溶剂,浓缩为水溶液。然后将浓缩的提取液与菌液合并,用大孔树脂d101进行分离,20%-90%乙醇梯度洗脱,采用薄层色谱法检测,收集、合并与人参稀有皂苷阳性对照品rf值相同的流份溶液,减压回收溶剂,使用制备型液相色谱分离制备,得到compoundo和compoundy。转化产物经hplc检测和鉴定,结果见图3和图4。
实施例3
裂褶菌按15%的接种量接种到液体发酵培养基中,培养基ph为6,人参皂苷rc的投料量为20g/l,摇床转数为160r/min,在25℃条件下发酵培养6天。发酵结束后,过滤菌液,菌丝用80%乙醇超声提取5次,每次30min。提取液在60℃下减压回收溶剂,浓缩为水溶液。然后将浓缩的提取液与菌液合并,用大孔树脂d101进行分离,20%-90%乙醇梯度洗脱,采用薄层色谱法检测,收集、合并与人参稀有皂苷阳性对照品rf值相同的流份溶液,减压回收溶剂,使用制备型液相色谱分离制备,得到compoundmc1和compoundmc。转化产物经hplc检测和鉴定,结果见图5和图6。
实施例4
裂褶菌按20%的接种量接种到液体发酵培养基中,培养基ph为5,人参皂苷rd的投料量为30g/l,摇床转数为180r/min,在28℃条件下发酵培养7天。发酵结束后,过滤菌液,菌丝用80%乙醇超声提取3次,每次30min。提取液在45℃下减压回收溶剂,浓缩为水溶液。然后将浓缩的提取液与菌液合并,用大孔树脂d101进行分离,20%-90%乙醇梯度洗脱,采用薄层色谱法检测,收集、合并与人参稀有皂苷阳性对照品rf值相同的流份溶液,减压回收溶剂,使用制备型液相色谱分离制备,得到人参皂苷f2和compoundk。转化产物经hplc检测和鉴定,结果见图7和图8。
实施例5
裂褶菌按25%的接种量接种到液体发酵培养基中,培养基ph为4,人参皂苷rb3的投料量为40g/l,摇床转数为200r/min,在30℃条件下发酵培养8天。发酵结束后,过滤菌液,菌丝用80%乙醇超声提取4次,每次30min。提取液在55℃下减压回收溶剂,浓缩为水溶液。然后将浓缩的提取液与菌液合并,用大孔树脂d101进行分离,20%-90%乙醇梯度洗脱,采用薄层色谱法检测,收集、合并与人参稀有皂苷阳性对照品rf值相同的流份溶液,减压回收溶剂,使用制备型液相色谱分离制备,得到c-mx1和c-mx。转化产物经hplc检测和鉴定,结果见图9和图10。
实施例6
裂褶菌按30%的接种量接种到液体发酵培养基中,培养基ph为3,人参二醇组皂苷的投料量为60g/l,摇床转数为250r/min,在32℃条件下发酵培养9天。发酵结束后,过滤菌液,菌丝用80%乙醇超声提取5次,每次30min。提取液在60℃下减压回收溶剂,浓缩为水溶液。然后将浓缩的提取液与菌液合并,用大孔树脂d101进行分离,20%-90%乙醇梯度洗脱,采用薄层色谱法检测,收集、合并与人参稀有皂苷阳性对照品rf值相同的流份溶液,减压回收溶剂,得到人参皂苷f2、compoundk、compoundo、compoundy、compoundmc1、compoundmc、c-mx1和c-mx。转化产物经hplc检测和鉴定,结果见图11和图12。
为了进一步说明本发明方法中液体发酵的最佳条件和化学成分变化,以下采用高效液相色谱法对人参皂苷液体发酵产物中皂苷的转化过程和转化产物进行了定量分析实验。
1实验材料和试剂
人参皂苷-rb1、-rb2、-rc、-rd、-rb3标准品(中国药品生物制品检验所)。人参二醇组皂苷、人参皂苷f2、compoundk、compoundo、compoundy、compoundmc1、compoundmc、c-mx1和c-mx为本实验室自制(经ir、ms、nmr鉴定,hplc测定其纯度在99%以上);色谱级乙腈和甲醇(美国fisher公司),其他试剂为分析纯。
2实验方法
2.1菌种的采集与分离
裂褶菌采集于长春市净月潭国家公园,将裂褶菌子实体先用自来水冲洗表面的泥土,再用无菌水漂洗后于无水乙醇中浸泡3分钟,取出用无菌水漂洗,放入1%升汞浸泡3分钟,无菌水漂洗干净后,按无菌操作取一块子实体的组织块移入pda培养基斜面中央,25℃下培养箱中培养7天左右,当菌丝布满斜面,挑选长势好的斜面进行转管纯化,纯化后的菌种留作母种放入冰箱中进行储存,同时经子实体复栽试验确认无误。
2.2培养方法
菌种的活化:取储藏于冰箱中的菌种,按无菌操作要求转接至pda斜面培养基上,25℃培养7天,然后再转接于pda平板培养基上,25℃下培养,待菌丝长满平板后储藏备用。
发酵培养基:20g麦芽糖,3g酵母粉,1gkh2po4,0.5gmgso4,1000ml水,自然ph。
发酵转化条件:发酵温度为25℃,摇床转数为150r.p.m,250ml摇瓶,装液量50ml,培养7d。
2.3发酵条件的优化
2.3.1发酵温度
考察菌株在不同温度下(22℃,25℃,28℃,31℃和34℃)对人参皂苷发酵转化率的变化情况。
2.3.2ph优化
用1nhcl和1nnaoh调节发酵液的ph,考察在不同ph(3.0,4.0,5.0,6.0,7.0,8.0,9.0)条件下菌株对人参皂苷转化率的影响。
2.3.3发酵时间
考察不同转化时间(48h,72h,96h,120h,144h和168h)菌株对人参皂苷转化率的影响。
2.3.4摇床转速
考察不同摇床转速(90r.p.m,120r.p.m,150r.p.m,180r.p.m和210r.p.m)下菌株对人参皂苷转化率的影响。
2.3.5装液量
考察在500ml摇瓶中不同装液量(50ml,100ml,150ml,200ml和250ml)下菌株对人参皂苷转化率的影响。
2.3.6接种量
考察不同接种量(4%,6%,8%,10%和12%,v/v)菌株对人参皂苷转化率的影响。
2.3.7底物投料量
考察不同底物投料量(0.5%,1%,2%,4%和6%)菌株对人参皂苷转化率的影响。
2.4人参皂苷的hplc检测方法
色谱柱:kromasil5c18(5μm,250mm×4.6mm);流动相:乙腈(a)-水(b);0-20min,22%(a),78%(b);22-25min,22%-30%(a),78%-70%(b);25-45min,30%-46%(a),70%-54%(b);45-55min,46%-64%(a),54%-36%(b);55-70min,64%-66%(a),36%-34%(b);70-90min,66%-100%(a),34%-0%(b)。柱温:25℃;检测波长:203nm;流速:1ml/min;进样量:20μl,所有组分均在90min内出完。
2.5粗多糖和生长量的测定
取一定量发酵液4000rpm下离心20min,将上清液和菌丝分离。上清液进行抽滤,向滤液中加入无水乙醇,沉淀过夜获得粗多糖,将粗多糖用无水乙醇冲洗3次;60℃下烘干至恒重,称量重量。菌丝用蒸馏水冲洗3次,烘干至恒重,称重。
粗多糖得率=粗多糖干重(g)/初始发酵液体积(ml)
菌丝得率=菌丝干重(g)/初始发酵液体积(ml)
2.6代谢途径的研究
采用液相色谱法,通过分别对人参单体皂苷在发酵转化过程中不同时间点的取样分析,测定每个时间点代谢产物的含量,来研究菌株转化人参皂苷的代谢途径。
3实验结果
3.1发酵条件的优化
3.1.1发酵温度对人参皂苷转化的影响
微生物利用菌体细胞内的各种糖苷酶来完成人参皂苷的转化,产酶的多少与菌丝的生长状况密切相关。一般来说菌丝的生长受温度影响较大,在较低温度(22℃)下菌丝生长缓慢,菌球生长较大,酶的产量较低,人参皂苷的转化率低;而高温(31℃和34℃)下菌丝生长迅速,菌球多而密,菌体产量极高;但会导致养料和溶氧量供应不足,菌丝发育不良,干扰了正常代谢,使酶的产量下降,皂苷的转化率也下降。在25℃-28℃范围内,皂苷的转化率较高,其中28℃达到最高值69.17%。以此确定28℃为最佳发酵温度(图13和图14)。
3.1.2发酵ph对人参皂苷转化的影响
从图15可知,ph值在5-7时,转化率较高,其中ph值为6时转化率为65.24%,菌丝产量和多糖的含量也达到了最高值。因此选择6.0为最佳初始ph。当ph大于7时,菌丝生长较差,转化率下降较大,其原因可能是酶的产量下降和人参皂苷c-3位糖苷键在偏碱性条件下非常稳定,不易被酶水解。当ph小于5时,转化率也有一定的下降,这可能是过酸的环境对菌丝的生长和酶活产生了一定的抑制作用引起的(图16)。
3.1.3发酵时间对人参皂苷转化的影响
通常菌丝发酵生长曲线大致分为四个阶段:1、调整期(0-24h),此时期菌体生长缓慢。2、增殖期(24-120h),菌体生长旺盛,菌丝迅速分散,菌丝量逐渐增加。3、稳定期(120-144h),菌丝产量不再继续增加,菌球密集,代谢产物大量积累,发酵液粘稠。4、衰老期(144h之后),菌丝趋于老化,有自溶现象,菌球松散。
由于调整期菌体生长缓慢,产酶量少,因此本研究采用了菌株在发酵24h后加入人参皂苷,考察了人参皂苷在除调整期以外的三个生长阶段的转化情况。结果发现,转化24-72小时,菌体量还未达到最高,此时酶量产生还比较少,转化也比较低;转化72-144小时,菌体量逐渐达到峰值,其中144小时转化率到达最高。超过144小时以后,转化率不再增加,可能是随着时间延长,酶不断失活造成的。因此最佳转化时间为144小时(图17和图18)。
3.1.4摇床转速对人参皂苷转化的影响
通过设定不同摇床转速考察人参皂苷发酵对通气量的要求。结果发现,当转速较慢的情况下,培养基中通气量较少,且剪切力小,形成的菌球少而大,从而影响菌丝生长,人参皂苷的转化率较低;随着转速的增加,形成的菌球多而密,人参皂苷的转化率也相应提高;当转速高到180r.p.m.时,人参皂苷的转化率增加不明显。因此选定180r.p.m为最佳摇床转速,可以提供足够的通气量,满足菌丝的生长和人参皂苷的转化(图19和图20)。
3.1.5装液量对人参皂苷转化的影响
由图21和图22可知,装液量在30%-40%时菌丝产率和皂苷的转化率最高。装液量过小,培养基溶氧太多,菌丝前期生长快,但在相同的发酵时间内营养成分少,导致后期菌丝产量少,人参皂苷转化率低。装液量过大,造成溶氧较少,菌体供氧不足,形成菌球较大。
3.1.6接种量对人参皂苷转化的影响
由图23和图24可见,当接种量小于8%时,因为接种量少,菌体密度较小,菌体的产量和人参皂苷的转化率都较低。而当接种量大于10%时,接种量又过大,单位体积内的溶氧和养料供应不足,菌丝不能得到充分生长,干扰了正常代谢,导致了菌丝产量和人参皂苷转化率降低。接种量在8%-10%时菌丝产量、多糖和人参皂苷的转化率达到最大,故选择接种量8%-10%为最佳接种量。
3.1.7底物投料量对人参皂苷转化的影响
一般情况下人参皂苷对微生物的生长有一定的抑制作用,裂褶菌能够在具有高浓度的人参皂苷总提物中正常生长,说明其具有非常高的底物耐受性,但其转化产物都聚集在细胞内,对酶的转化能力提出了考验。本研究通过对人参皂苷发酵投料量考察,寻找最合适的底物浓度。结果表明,人参皂苷投料量在1%-2%之间,随着皂苷浓度的增加转化率逐渐下降,但仍然能够保持较高的转化率,当人参皂苷投料量大于2%时,转化率明显下降(图25)。
3.2人参皂苷转化途径的研究
本研究采用hplc方法,分析了投底物后不同时间点(0,12,24,36,48,60,72,
84和96小时)发酵液中人参皂苷代谢产物的含量,以此来研究rbl,rb2,rc,rd和rb3经裂褶菌转化的代谢途径。根据hplc测定的结果和标准对照品的比对,我们可以推断出其可能的转化途径为:rbl→rd→f2→c-k,rb2→c-o→c-y,rc→c-mc1→c-mc,rd→f2→c-k,rb3→c-mx1→c-mx。
- 还没有人留言评论。精彩留言会获得点赞!
- 20(R)-人参皂苷Rg3在制备用于治疗便秘的药物中的应用即药物的制作方法
- 20(R)-人参皂苷Rg3在制备缓解或/和治疗类风湿病症的药物或保健品中的应用及药物的制作方法
- 20(R)-人参皂苷Rg3在制备预防或/和治疗肥胖症药物中的应用及药物的制作方法
- 人参皂苷c-k与拉莫三嗪的组合物在制备抗癫痫药物中的应用
- 人参皂苷c-k的两种晶型及其制备方法
- 用于预防或治疗非酒精性肝病的包含人参皂苷f2的组合物的制作方法
- 一种富含稀有人参皂苷Rg<sub>3</sub>黑参的制备方法
- 一类呋甾皂苷类化合物及其应用
- 一种人参皂苷Rg3的软胶囊及其制备方法
- 20(R)-人参皂苷Rg3在制备缓解或/和治疗阳痿的药物或保健品中的应用及药物的制作方法