反式复制RNA的制作方法
本发明总体涉及适合于高水平蛋白质产生的系统和方法。本发明提供了包含功能性连接的两种单独rna分子的系统:一种rna分子(复制酶构建体),其包含用于表达甲病毒复制酶的rna构建体,和第二种rna分子(反式复制子),其包含可以通过该复制酶反式复制的rna序列。反式复制子可以包含用于表达的目的基因,例如,编码疫苗的基因。用于表达甲病毒复制酶的rna构建体包含5’-帽。发现5’-帽对于目的基因的反式高水平表达是至关重要的。本发明不需要病毒颗粒的繁殖,并且适合于在靶生物体(例如动物)中有效和安全地产生目的蛋白,例如治疗性蛋白或抗原蛋白,例如疫苗。
背景技术:
为了预防和治疗目的而引入编码一种或更多种多肽的外源遗传信息已成为生物医学研究多年的目标。现有技术方法具有相同的将核酸分子向靶细胞或生物体的递送,但核酸分子和/或递送系统的类型不同:受与使用脱氧核糖核酸(dna)分子相关的安全性问题的影响,近年来,核糖核酸(rna)分子受到越来越多的关注。已经提出了多种方法,包括以裸rna形式、或者以复合或包装形式(例如,在非病毒或病毒递送载体中)施用单链或双链rna。在病毒和病毒递送载体中,遗传信息通常由蛋白质和/或脂质(病毒颗粒)包封。例如,已提出将来源于rna病毒的经改造的rna病毒颗粒作为用于处理植物(wo2000/053780a2)或用于哺乳动物疫苗接种(tubulekas等.,1997,gene,第190卷,第191-195页)的递送载体。
一般而言,rna病毒是具有rna基因组的一类多样化的感染性颗粒。rna病毒可以分组为单链rna(ssrna)和双链rna(dsrna)病毒,并且ssrna病毒通常可以进一步分为正链[(+)链]和/或负链[(-)链]病毒。正链rna病毒作为生物医学中的递送系统初步看来是有吸引力的,因为在宿主细胞中它们的rna可以直接用作用于翻译的模板。
甲病毒(alphavirus)是正链rna病毒的典型代表。甲病毒在感染细胞的细胞质中复制(关于甲病毒生命周期的综述,参见josé等,futuremicrobiol.,2009,第4卷,第837-856页)。许多甲病毒的总基因组长度通常为11,000至12,000个核苷酸,并且基因组通常具有5’-帽和3’poly(a)尾。甲病毒的基因组编码非结构蛋白(参与病毒rna的转录、修饰和复制以及蛋白修饰)和结构蛋白(形成病毒颗粒)。基因组中通常有两个开放阅读框(openreadingframe,orf)。四种非结构蛋白(nsp1-nsp4)通常由在基因组5’末端附近开始的第一个orf一起编码,而甲病毒结构蛋白由位于在第一个orf的下游发现的并延伸靠近基因组的3’末端的第二个orf一起编码。通常,第一个orf多于第二个orf,比例大致为2∶1。
在由甲病毒感染的细胞中,仅非结构蛋白从基因组rna翻译,而结构蛋白可从亚基因组转录物翻译,所述亚基因组转录物是类似于真核信使rna(mrna;gould等,2010,antiviralres.,第87卷,第111-124页)的rna分子。感染后,即在病毒生命周期的早期阶段,(+)链基因组rna像信使rna一样直接用于翻译非结构多聚蛋白(nsp1234)。在一些甲病毒中,在nsp3和nsp4的编码序列之间存在乳白终止密码子(opalstopcodon):当翻译在乳白终止密码子处终止时产生含有nsp1、nsp2和nsp3的多聚蛋白p123以及通过通读该乳白密码子产生的另外含有nsp4的多聚蛋白p1234(strauss&strauss,microbiol.rev.,1994,第58卷,第491-562页;rupp等.,2015,j.gen.virology,第96卷,第2483-2500页)。nsp1234被自体蛋白酶解切割成片段nsp123和nsp4。多肽nsp123和nsp4结合形成(-)链复制酶复合物,其使用(+)链基因组rna作为模板转录(-)链rna。通常在后期阶段,nsp123片段被完全切割成独立蛋白nsp1、nsp2、nsp3和nsp4(shirako&strauss,1994,j.virol.,第68卷,第1874-1885页)。这些蛋白装配以形成(+)链复制酶复合体,其使用基因组rna的(-)链互补序列作为模板合成新的(+)链基因组(kim等.,2004,virology,第323卷,第153-163页,vasiljevaetal.,2003,j.biol.chem.第278卷,第41636-41645页)。
甲病毒结构蛋白(核心核衣壳蛋白c、包膜蛋白p62和包膜蛋白e1,病毒颗粒的所有成分)通常由亚基因组启动子控制下的单个开放阅读框编码(strauss&strauss,microbiol.rev.,1994,第58卷,第491-562页)。亚基因组启动子被顺式作用的甲病毒非结构蛋白所识别。特别地,甲病毒复制酶使用基因组rna的(-)链互补序列作为模板合成(+)链亚基因组转录物。(+)链亚基因组转录物编码甲病毒结构蛋白(kim等.,2004,virology,第323卷,第153-163页,vasiljeva等.,2003,j.biol.chem.第278卷,第41636-41645页)。亚基因组rna转录物用作将编码结构蛋白的开放阅读框翻译为一种多聚蛋白的模板,并且多聚蛋白被切割以产生结构蛋白。在宿主细胞中甲病毒感染的晚期,位于nsp2编码序列内的包装信号确保将基因组rna选择性包装到由结构蛋白包装的出芽病毒粒子(buddingvirion)中(white等.,1998,j.virol.,第72卷,第4320-4326页)。
在感染细胞中,亚基因组rna以及新的基因组rna由nsp1提供5’-帽(pettersson等.1980,eur.j.biochem.105,435-443;rozanov等.,1992,j.gen.virology,第73卷,第2129-2134页),并由nsp4提供多腺苷酸[poly(a)]尾(rubach等.,virology,2009,第384卷,第201-208页))。因此,亚基因组rna和基因组rna二者都类似于信使rna(mrna)。
甲病毒基因组包含四种保守序列元件(conservedsequenceelement,cse),其被认为对宿主细胞中的病毒rna复制是重要的(strauss&strauss,microbiol.rev.,1994,第58卷,第491-562页)。在病毒基因组的5’端或附近发现的cse1,被认为作为从(-)链模板合成(+)链的启动子。位于cse1下游但仍靠近nsp1编码序列中基因组5’端的cse2,被认为作为启动从基因组rna模板的(-)链合成的启动子(注意到不包含cse2的亚基因组rna转录物不作为(-)链合成的模板)。cse3位于非结构蛋白和结构蛋白的编码序列之间的连接区中,并且作为用于亚基因组转录物的有效转录的核心启动子。最后,刚好位于甲病毒基因组3’非翻译区的poly(a)序列的上游的cse4,其被理解为作为启动(-)链合成的核心启动子(josé等,futuremicrobiol.,2009,第4卷,第837-856页)。甲病毒的cse4和poly(a)尾被理解为共同起作用以进行有效的(-)链合成(hardy和rice,j.virol.,2005,第79卷,第4630-4639页)。除甲病毒蛋白质外,宿主细胞因子(可能是蛋白质)也可以与保守序列元件结合(strauss&strauss,microbiol.rev.,1994,第58卷,第491-562页)。
典型的甲病毒——赛姆利基森林病毒病毒(semlikiforestvirus,sfv)的基因组的一些特征在图1a中示出。
甲病毒的宿主包括多种动物,其包括昆虫、鱼类和哺乳动物,例如家养动物和人;因此,甲病毒来源的载体被认为是将外源遗传信息递送到广泛的靶生物体中的潜在载体。strauss&strauss,microbiol.rev.,1994,第58卷,第491-562页和最近ljungbergand
然而,复制不是顺式排斥的,已经描述了依赖于两种单独核酸分子的甲病毒元件的反式复制。来源于甲病毒的反式复制系统包含两种核酸分子,其中一种核酸分子编码病毒复制酶,另一种核酸分子能够通过所述复制酶反式复制(反式复制系统)。对于反式复制,这样的反式复制系统需要在单个宿主细胞中存在这两种核酸分子。
病毒rna载体经常被认为是不利的,因为其有可能通过形成具有繁殖能力的病毒颗粒而在受治疗个体中繁殖。不仅对于受治疗个体,而且对于一般人群,这可能伴随着健康风险:例如,一些甲病毒对人具有致病性(例如基孔肯雅病毒(chikungunyavirus)、委内瑞拉马脑炎病毒(venezuelanequineencephalitisvirus,veev);strauss&strauss,microbiol.rev.,1994,第58卷,第491-562页综述了甲病毒在人和动物疾病中的作用)。
在作为替选的方法中,提出了将非病毒反式复制系统引入宿主细胞中(sanz等,cellularmicrobiol.,2015,第17卷,第520-541页;spuul等,j.virol.,2011,第85卷,第4739-4751页)。根据这些参考文献的反式复制系统基于将dna载体引入宿主细胞中,其中所述载体包含噬菌体t7启动子,并且其中所述宿主细胞是表达t7聚合酶的特化经改造细胞(buchholz等,j.virol.,1999,第73卷,第251-259页)。spuul等人使用的dna构建体编码t7启动子下游的内部核糖体进入位点(internalribosomalentrysite,ires)元件;根据该文章,ires元件参与增强由t7聚合酶合成的可能未加帽的rna转录物在细胞中的表达。sanz等人另外描述了在ires下游直接使用rna复制酶构建体(编码nsp1-4);在不存在帽结构m7g(5’)ppp(5’)g的情况下体外制备该rna构建体。总之,这两项研究表明,反式复制系统既可以作为间接dna载体,其具有用于在表达噬菌体rna聚合酶的经改造宿主细胞中合成rna的噬菌体启动子,或者以包含用于驱动所述聚合酶翻译的ires的直接rna系统的形式起作用。
考虑到安全性问题,医学和兽医界不愿向人或动物施用dna载体或自我复制的病毒核酸。除此之外,许多用于递送核酸、特别是rna的现有技术方法伴随着不令人满意的转基因表达水平。
因此,需要递送编码具有治疗价值的蛋白质(例如疫苗)的核酸的安全有效的方法。如本文所述,本发明的方面和实施方案解决了这种需要。
发明概述
免疫治疗策略是预防和治疗例如传染病和癌症疾病的有希望的选择。鉴定越来越多的病原体相关抗原和肿瘤相关抗原导致得到了合适的免疫治疗靶标的广泛集合。本发明总体包含适合于预防和治疗疾病的有效免疫治疗治疗的药剂和方法。
在第一方面,本发明提供了包含以下的系统:
用于表达甲病毒复制酶的rna构建体,
可以通过该复制酶反式复制rna复制子,
其中所述用于表达甲病毒复制酶的rna构建体包含用于驱动该复制酶翻译的5’-帽。
在一个实施方案中,5’-帽是天然5’-帽或5’-帽类似物。
在一个实施方案中,用于表达甲病毒复制酶的rna构建体不包含内部核糖体进入位点(ires)元件。因此,该复制酶的翻译不是由ires元件驱动的。
在一个实施方案中,用于表达甲病毒复制酶的rna构建体包含编码该复制酶的开放阅读框(orf)。此外,可以存在5’-utr和/或3’-utr。在一个优选的实施方案中,用于表达甲病毒复制酶的rna构建体包含
(1)5’utr,
(2)编码该复制酶的开放阅读框,和
(3)3’utr。
优选地,5’utr和/或3’utr对于该复制酶所来源的甲病毒是异源或非天然的。
优选地,编码甲病毒复制酶的开放阅读框包含rna复制所需的非结构蛋白的编码区。
在一个实施方案中,用于表达甲病毒复制酶的rna构建体包含3’poly(a)序列。
在一个实施方案中,用于表达甲病毒复制酶的rna构建体不能被该复制酶复制。
在一个实施方案中,rna复制子包含:
甲病毒5’复制识别序列,和
甲病毒3’复制识别序列。
在一个实施方案中,甲病毒5’复制识别序列和甲病毒3’复制识别序列能够在复制酶的存在下指导rna复制子的复制。因此,当用于表达甲病毒复制酶的rna构建体和rna复制子共同存在时,这些复制识别序列指导rna的复制。
在一个实施方案中,甲病毒5’复制识别序列和甲病毒3’复制识别序列对于复制酶所来源的甲病毒是天然的。
在一个实施方案中,rna复制子包含异源核酸。
在一个实施方案中,rna复制子包含编码目的蛋白的开放阅读框。
优选地,编码目的蛋白的开放阅读框对于复制酶所来源的甲病毒是非天然的。优选地,编码目的蛋白的开放阅读框不编码甲病毒结构蛋白。
在一个实施方案中,rna复制子包含亚基因组启动子。
优选地,编码目的蛋白的基因(即目的基因)受到亚基因组启动子的控制。这使得编码目的蛋白的开放阅读框的表达受到亚基因组启动子的控制。
优选地,亚基因组启动子对于复制酶所来源的甲病毒是天然的。
优选地,亚基因组启动子是甲病毒结构蛋白的启动子。这意味着亚基因组启动子是对于甲病毒天然的启动子,其控制所述甲病毒中一种或更多种结构蛋白的基因转录。
在一个实施方案中,rna复制子包含3’poly(a)序列。
在一个作为替选或补充的实施方案中,rna复制子包含5’-帽。
在一个实施方案中,用于表达甲病毒复制酶的rna构建体和/或rna复制子不包含编码完整甲病毒结构蛋白的开放阅读框。
在一个实施方案中,甲病毒是赛姆利基森林病毒。
在第二方面,本发明提供了用于表达甲病毒复制酶的rna构建体,其包含用于驱动该复制酶翻译的5’-帽。
在第三方面,本发明提供了dna,其包含编码根据权利要求1至21中任一项所述的系统的用于表达甲病毒复制酶的rna构建体、所述rna复制子或它们两者的核酸序列。优选地,dna编码根据本发明第一方面所述的系统。
在第四方面,本发明提供了在细胞中产生蛋白质的方法,其包括以下步骤:
(a)获得用于表达甲病毒复制酶的rna构建体,
(b)获得可以通过该复制酶反式复制并且包含编码该蛋白的开放阅读框的rna复制子,以及
(c)将用于表达甲病毒复制酶的rna构建体和rna复制子共同接种到细胞中,
其中用于表达甲病毒复制酶的rna构建体包含用于驱动该复制酶翻译的5’-帽。
在该方法的多个实施方案中,用于表达甲病毒复制酶的rna构建体和/或rna复制子如上文对本发明系统所定义。
在第五方面,本发明提供了包含第一方面的系统的细胞。在一个实施方案中,根据第四方面的方法接种细胞。在一个实施方案中,细胞可以通过本发明第四方面的方法获得。在一个实施方案中,细胞是生物体的一部分。
在第六方面,本发明提供了在对象中产生蛋白质的方法,其包括以下步骤:
(a)获得用于表达甲病毒复制酶的rna构建体,
(b)获得可以通过该复制酶反式复制并且包含编码该蛋白的开放阅读框的rna复制子,以及
(c)向该对象施用用于表达甲病毒复制酶的rna构建体和rna复制子,
其中用于表达甲病毒复制酶的rna构建体包含用于驱动该复制酶翻译的5’-帽。
在该方法的多个实施方案中,用于表达甲病毒复制酶的rna构建体和/或rna复制子如上文对本发明系统所定义。
附图说明
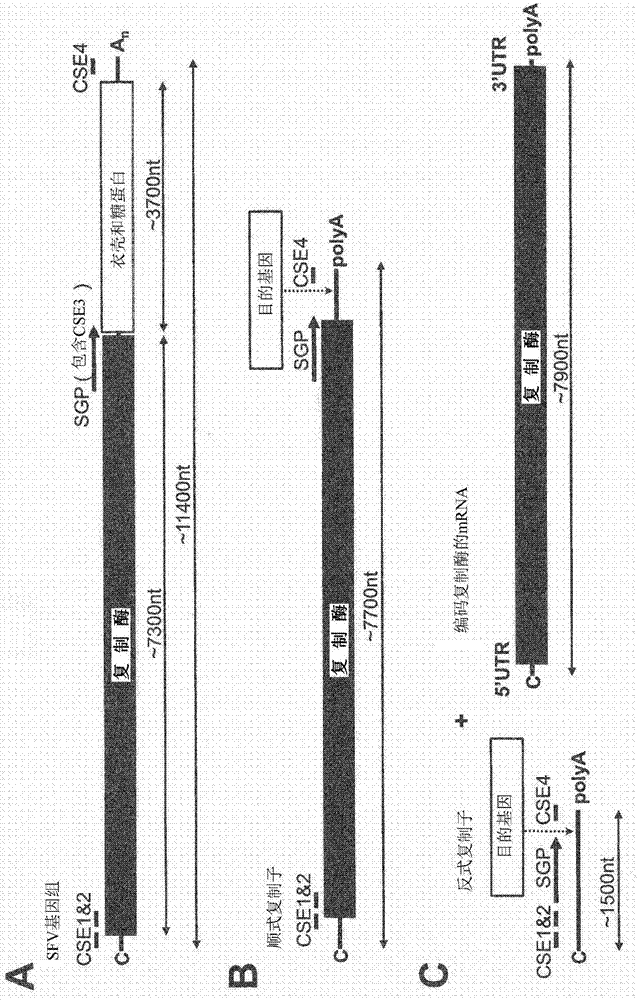
图1:甲病毒基因组组织和包含来源于甲病毒基因组的元件的经改造核酸构建体:
符号和缩写:an:poly(a)尾;c:帽;sgp:亚基因组启动子(包括cse3);sfv:塞姆利基森林病毒;cse:保守序列元件。
图1a:甲病毒的基因组是正义单链rna(ssrna(+)),其编码大型多蛋白的两个开放阅读框(orf)。基因组5’端的orf编码非结构蛋白nsp1至nsp4(nsp1-4),其被翻译并加工成rna依赖性rna-聚合酶(复制酶);3’端的orf编码结构蛋白-衣壳和糖蛋白。3’端的orf受到亚基因组启动子(sgp)的转录控制。甲病毒基因组可以被称为顺式复制系统。
图1b:顺式复制子:通过遗传改造,亚基因组启动子(sgp)下游的结构蛋白可以被目的基因替代。能够被甲病毒复制酶复制的相应构建体被称为顺式复制子。顺式复制子不同于本发明的反式复制子(参见发明详述)。
图1c:本发明的反式复制系统方面的示意图。在反式复制系统中,编码甲病毒复制酶的rna(复制酶构建体)和rna复制子(“反式复制子”)是两种独立的rna分子。rna复制子优选编码目的基因。优选地,复制酶构建体类似于具有以下的一种或更多种,优选全部的细胞mrna:5’-帽、5’-utr、3’-utr和poly(a)尾(编码复制酶的mrna)。复制酶构建体通常缺乏通过甲病毒复制酶复制所需的序列元件。然而,通过甲病毒复制酶复制所需的序列元件位于rna复制子上。在一些实施方案中,rna复制子包含cse1、cse2和cse4;以及sgp。
图2.帽二核苷酸的结构。
上图:天然帽二核苷酸,m7gpppg。
底图:硫代磷酸酯帽类似物β-s-arca二核苷酸:根据在反相hplc中其洗脱特性,由于立体p中心而存在两种β-s-arca的非对映体,称为d1和d2。
图3:由复制子编码的转基因表达的效率取决于编码复制酶的orf的分子环境。将顺式复制子rna和反式复制子rna(左)共同递送,或将编码复制酶的mrna和反式复制子rna(右)共同递送到bhk21细胞中,随后通过facs测量egfp荧光强度(实施例1)。显示了egfp阳性细胞的百分比(柱)和egfp阳性细胞的平均荧光强度(mfi)(菱形)。mrna=根据本发明的复制酶构建体。
图4:原代细胞中的基因表达证实了反式复制系统的效率。将顺式复制系统(egfp复制子rna)递送,或将反式复制系统(包含复制酶rna和反式复制子rna)共同递送到人包皮成纤维细胞中,随后测量egfp荧光强度。将编码痘苗病毒蛋白激酶r(pkr)抑制剂e3的rna共同递送以抑制pkr活化,从而提高rna翻译(实施例2)。显示了egfp阳性细胞的百分比(柱)和egfp阳性细胞的平均荧光强度(mfi)(菱形)。
图5:复制酶rna量和复制酶密码子使用量的影响。
图5a:在用含有不同量的编码复制酶的mrna的原代人包皮成纤维细胞脂质转染后测量的相对光单位[relativelightunit,rlu](分泌型nanoluc)(实施例3)。
图5b:将复制酶rna和反式复制子rna共同递送到bhk21细胞中,随后通过facs测量egfp荧光强度(实施例4)。显示了egfp阳性细胞的百分比(柱)和egfp阳性细胞的平均荧光强度(mfi)(菱形)。如实施例4中所述,修饰密码子使用不利于转基因表达和反式复制子的生产性复制(细节参见实施例4)。hs密码子使用:智人调整的密码子使用;wt密码子使用:野生型甲病毒的密码子使用。
底部:蛋白质印迹,其表明myc-nsp3和肌动蛋白的水平。
图6:由反式复制子编码的转基因的有效体内表达。肌内(i.m.)和皮内(i.d.)共同注射根据本发明的包含编码萤光素酶的反式复制子rna和mrna形式的复制酶构建体的反式复制系统后,小鼠的生物发光成像(bioluminescenceimaging,bli)(实施例5)。发光表示为每秒光子数[p/s]。
图7:编码流感病毒ha作为目的蛋白的反式复制子提供了对致命病毒感染的保护。如实施例6中所述,在3周内用编码流感病毒ha的5μg顺式复制子(r-ha)或者1μg反式复制子(tr-ha)皮内免疫接种balb/c小鼠两次(初次-加强)。如所指出的,将4μg至14μg编码复制酶的mrna与反式复制子共同施用。如所指出的,共同施用不同量的编码痘苗病毒e3的mrna以改善翻译。
阳性对照:灭活病毒(iav)。阴性对照:溶剂(pbs缓冲液)。
图7a:在用致死剂量的流感病毒攻击感染的前一天确定病毒中和滴度(virusneutralizationtiter,vnt)。
图7b:小鼠血清的血细胞凝集素抑制(hemagglutinininhibition,hai)测定。
图7c:显示攻击感染后小鼠存活的kaplan-meier曲线。pbs缓冲液处理的小鼠在5天内死亡。
图8:帽的影响。用由自切割肽p2a(猪捷申病毒属-12a)分离的编码egfp和secnluc(分泌型萤光素酶)的反式复制子rna,与β-s-arca(d2)加帽的复制酶mrna或在复制酶orf上游具有ires(emcv)(来自脑心肌炎病毒的内部核糖体进入位点)的未加帽的mrna一起对bhk21细胞进行电穿孔。电穿孔后24小时,通过facs分析细胞的egfp表达(a),通过nano-
发明详述
尽管下面详细描述了本发明,但应理解本发明不限于本文中所述的特定方法、方案和试剂,因为这些可以变化。还应理解,本文中使用的术语仅用于描述特定实施方案的目的,并不意在限制本发明的范围,本发明的范围仅由所附权利要求书限制。除非另有定义,否则本文中使用的所有技术和科学术语具有与本领域普通技术人员通常理解的含义相同的含义。
优选地,本文中使用的术语如在“amultilingualglossaryofbiotechnologicalterms:(iupacrecommendations)”,h.g.w.leuenberger,b.nagel,和h.
除非另有说明,否则本发明的实践将采用化学、生物化学、细胞生物学、免疫学和重组dna技术的常规方法,这些方法在本领域的文献中有解释(参见,例如,molecularcloning:alaboratorymanual,第2版,j.sambrook等.编辑.,coldspringharborlaboratorypress,coldspringharbor1989)。
在下文中,将描述本发明的一些要素。这些要素与一些特定实施方案一起列出,然而,应理解,它们可以以任何方式和任何数量组合以产生另外的实施方案。不应将多个描述的实施例和优选的实施方案解释为将本发明仅限于明确描述的实施方案。该描述应被理解为公开并涵盖将明确描述的实施方案与任何数量的所公开和/或优选的要素组合的实施方案。此外,除非上下文另有说明,否则本申请中所有描述的元素的任何排列和组合都应被认为通过本说明书公开。
术语“约”意指大约或接近,并且在本文中所述的数值或范围的上下文中,优选意指所列举或要求保护的数值或范围的+/-10%。
除非在本文中另有说明或与上下文明显矛盾,否则在描述本发明的上下文中(特别是在权利要求的上下文中)使用的未限定数量的术语以及类似的引用应被解释为涵盖单数和复数两者。本文中对数值范围的叙述仅旨在用作单独的提及落入该范围内的每个单独值的简写方法。除非本文中另有说明,否则将每个单独的值并入本说明书中,如同其在本文中单独引用一样。除非本文中另有说明或与上下文明显矛盾,否则本文中所述的所有方法均可以任何合适的顺序进行。本文中提供的任何和所有实施例或示例性语言(例如,“例如”)的使用仅旨在更好地说明本发明,而不是对本发明的范围进行限制,除非另外声明。说明书中的任何语言都不应被解释为表示任何对于本发明的实践必不可少的未要求保护的要素。
除非另有明确说明,否则在本文件的上下文中使用术语“包含”来表示除了由“包含”引入的列表的成员之外可以任选地存在其他成员。然而,预期作为本发明的一个具体实施方案,术语“包含”包括不存在其他成员的可能性,即,为了本实施方案的目的,“包含”应理解为具有“由...组成”的含义。
由通用术语表征的组分的相对量的指示意指所述通用术语涵盖的所有特定变体或成员的总量。如果指定由通用术语定义的某个组件以某个相对量存在,并且如果该组件被进一步表征为通用术语所涵盖的特定变体或成员,则意味着没有另外存在由通用术语涵盖的其他变体或成员,使得通用术语所涵盖的组件的总相对量超过指定的相对量;更优选地,根本不存在由通用术语所涵盖的其他变体或成员。
在本说明书的全文中引用了若干文献。本文中引用的每篇文献(包括所有专利、专利申请、科学出版物、制造商的说明书、说明书等),无论是上文中还是下文中,均通过引用整体在此并入。本文中的任何内容均不应被解释为承认本发明无权先于此类公开内容。
本文中使用的术语如“降低”或“抑制”意指引起在水平上总体降低优选为5%或更高、10%或更高、20%或更高、更优选为50%或更高以及最优选75%或更高的能力。术语“抑制”或类似短语包括完全或基本上完全的抑制,即降低至零或基本上降低至零。
术语例如“提高”或“增强”优选涉及提高或增强约至少10%、优选至少20%、优选至少30%、更优选至少40%、更优选至少50%、甚至更优选至少80%、最优选至少100%。
术语“净电荷”是指整个物体(例如化合物或颗粒)上的电荷。
具有总净正电荷的离子是阳离子,而具有总净负电荷的离子是阴离子。因此,根据本发明,阴离子是比质子具有更多电子的离子,使其具有净负电荷;阳离子是比质子具有更少电子的离子,使其具有净正电荷。
关于给定化合物或颗粒,术语“带电荷的”,“净电荷”,“带负电荷的”或“带正电荷的”是指给定化合物或颗粒在ph7.0下溶解或悬浮于水中时的净电荷。
根据本发明的术语“核酸”还包括核酸在核苷酸碱基上、糖上或磷酸酯上的核酸的化学衍生化,以及含有非天然的核苷酸和核苷酸类似物的核酸。在一些实施方案中,核酸是脱氧核糖核酸(dna)或核糖核酸(rna)。
根据本发明,术语“rna”或“rna分子”涉及包含核糖核苷酸残基并且优选完全或基本上由核糖核苷酸残基组成的分子。术语“核糖核苷酸”涉及在β-d-呋喃核糖基的2’-位具有羟基的核苷酸。术语“rna”包括双链rna、单链rna、分离的rna例如部分或完全纯化的rna、基本上纯的rna、合成的rna和重组产生的rna,例如通过添加、缺失、替换和/或改变一个或更多个核苷酸而不同于天然存在的rna之经修饰的rna。这样的改变可包括添加非核苷酸材料,例如添加在rna的一个或更多个核苷酸处,例如添加至rna的末端或内部。rna分子中的核苷酸还可以包含非标准核苷酸,例如非天然存在的核苷酸或化学合成的核苷酸或脱氧核苷酸。这些改变的rna可以称为类似物,特别是天然存在的rna的类似物。
根据本发明,rna可以是单链或双链的。在本发明的一些实施方案中,优选单链rna。术语“单链rna”通常是指其中没有与rna分子伴随的互补核酸链(通常没有互补rna链;即没有互补rna分子)的一些实施方案。单链rna可以作为负链[(-)链]或作为正链[(+)链]存在。(+)链是包含或编码遗传信息的链。遗传信息可以是例如编码蛋白质的多核苷酸序列。当(+)链rna编码蛋白质时,(+)链可直接用作进行翻译(蛋白质合成)的模板。(-)链是(+)链的互补链。在双链rna的情况下,(+)链和(-)链是两个独立的rna分子,并且这两种rna分子彼此结合以形成双链rna(“双链rna”)。
术语rna的“稳定性”涉及rna的“半衰期”。“半衰期”涉及消除一半活性、量或分子数所需的时间。在本发明的上下文中,rna的半衰期表示所述rna的稳定性。rna的半衰期可能影响rna的“表达持续时间”。可以预期具有长半衰期的rna将长期表达。
“片段”或“核酸序列的片段”涉及核酸序列的一部分,即代表在5’和/或3’端缩短的核酸序列的序列。优选地,核酸序列的片段包含来自所述核酸序列的至少80%、优选至少90%、95%、96%、97%、98%或99%的核苷酸残基。在本发明中,优选保留了rna稳定性和/或翻译效率的rna分子的那些片段。
关于例如核酸和氨基酸序列,根据本发明术语“变体”包括任何变体,特别是突变体、病毒株、剪接变体、构象、同种型、等位基因变体、物种变体和物种同源物,特别是天然存在的那些。等位基因变体涉及基因正常序列的改变,其重要性通常不清楚。完整的基因测序通常鉴定给定基因的许多等位基因变体。关于核酸分子,术语“变体”包括简并核酸序列,其中根据本发明的简并核酸是由于遗传密码的简并性而与密码子序列中的参考核酸不同的核酸。物种同源物是具有与给定核酸或氨基酸序列具有不同的起源物种的核酸或氨基酸序列。病毒同源物是与给定核酸或氨基酸序列具有不同的起源病毒的核酸或氨基酸序列。
根据本发明,与参考核酸相比,核酸变体包括单个或多个核苷酸缺失、添加、突变和/或插入。缺失包括从参考核酸中移除一个或更多个核苷酸。添加变体包含一个或更多个核苷酸,例如1、2、3、5、10、20、30、50或更多个核苷酸的5’-和/或3’-末端融合。突变包括但不限于替换,其中移除序列中的至少一个核苷酸并在其位置处插入另一个核苷酸(例如颠换和转换)、无碱基位点、交联位点和化学改变或经修饰的碱基。插入包括在参考核酸中添加至少一个核苷酸。
特定核酸序列的变体优选具有所述特定序列的至少一种功能特性,并且优选与所述特定序列在功能上等同,例如,与特定核酸序列的那些表现出相同或相似的性质的核酸序列。
优选地,给定核酸序列和作为所述给定核酸序列的变体的核酸序列之间的同一性程度将为至少70%、优选至少75%、优选至少80%、更优选至少85%、更优选至少90%、或最优选至少95%、96%、97%、98%或99%。优选对至少约30、至少约50、至少约70、至少约90、至少约100、至少约150、至少约200、至少约250、至少约300,或至少约400个核苷酸的区域给出同一性程度。在优选的实施方案中,对参考核酸序列的整个长度给出同一性程度。
“序列相似性”表示相同或代表保守氨基酸替换的氨基酸的百分比。两个多肽或核酸序列之间的“序列同一性”表示序列之间相同的氨基酸或核苷酸的百分比。
术语“同一性%”意指特别是在待比较的两个序列之间的最佳比对中相同的核苷酸的百分比,所述百分比是纯粹统计学上的,并且两个序列之间的差异可以是在序列的整个长度上随机分布的,并且待比较的序列可以包含与参考序列相比的添加或缺失以便获得两个序列之间的最佳比对。两个序列的比较通常通过在最佳比对后相对于片段或“比较窗”比较所述序列来进行,以鉴定相应序列的局部区域。用于比较的最佳比对可以手动地进行或借助于smith和waterman,1981,adsapp.math.2,482的局部同源性算法、借助于needleman和wunsch,1970,j.mol.biol.48,443的本地同源算法以及借助于pearson和lipman的相似性搜索算法,1988,proc.natlacad.sci.usa85,2444或借助于使用所述算法的计算机程序(在wisconsingeneticssoftwarepackage,geneticscomputergroup,575sciencedrive,madison,wis.中的gap、bestfit、fasta、blastp、blastn和tfasta)进行。
通过确定待比较的序列对应的相同位置的数目,将该数量除以比较的位置数并将该结果乘以100来获得同一性百分比。
例如,可以使用网站http://www.ncbi.nlm.nih.gov/blast/bl2seq/wblast2.cgi上可获得的blast程序“blast2sequences”。
如果两个序列彼此互补,则核酸与另一个核酸“能够杂交”或“杂交”。如果两个序列能够彼此形成稳定的双链体,则核酸与另一个核酸“互补”。根据本发明,杂交优选在允许多核苷酸之间特异性杂交的条件下进行(严格的条件)。严格的条件描述于例如molecularcloning:alaboratorymanual,j.sambrook等.,编辑,第2版,coldspringharborlaboratorypress,coldspringharbor,newyork,1989中,或者molecularbiology,f.m.ausubel等.,编辑,johnwiley&sons,inc.,newyork的currentprotocols中,例如,是指在65℃下在杂交缓冲液(3.5×ssc,0.02%ficoll,0.02%聚乙烯吡咯烷酮,0.02%牛血清白蛋白,2.5mmnah2po4(ph7),0.5%sds,2mmedta)中杂交。ssc为0.15m氯化钠/0.15m柠檬酸钠,ph7。杂交后,将转移了dna的膜洗涤,例如在室温下在2×ssc中洗涤,然后在高达68℃的温度下在0.1-0.5×ssc/0.1×sds中洗涤。
百分比互补性表示核酸分子中可以与第二核酸序列形成氢键(例如,watson-crick碱基配对)的连续残基的百分比(例如,10个中的5、6、7、8、9、10个为50%、60%、70%、80%、90%和100%互补)。“完美互补”或“完全互补”意指核酸序列的所有连续残基将与第二核酸序列中相同数量的连续残基氢键结合。优选地,根据本发明的互补程度为至少70%、优选至少75%、优选至少80%、更优选至少85%、甚至更优选至少90%或最优选至少95%、96%、97%、98%或99%。最优选地,根据本发明的互补程度为100%。
术语“衍生物”包括核酸在核苷酸碱基上、糖上或磷酸上的任何化学衍生化。术语“衍生物”还包括含有非天然存在的核苷酸和核苷酸类似物的核酸。优选地,核酸的衍生化提高了其稳定性。
根据本发明,“来源于核酸序列的核酸序列”是指这样的核酸,其是衍生其的核酸的变体。优选地,当其替代rna分子中的特定序列时,为关于特定序列的变体的序列保留了rna稳定性和/或翻译效率。
术语“转录”涉及通过rna聚合酶读取具有特定核酸序列的核酸分子(“核酸模板”)以使rna聚合酶产生单链rna分子的过程。在转录期间,核酸模板中的遗传信息被转录。核酸模板可以是dna;然而,例如,在从甲病毒核酸模板转录的情况下,模板通常是rna。随后,转录的rna可以翻译成蛋白质。根据本发明,术语“转录”包括“体外转录”,其中术语“体外转录”涉及其中rna,特别是mrna,在无细胞系统中体外合成的方法。优选地,应用克隆载体来产生转录物。这些克隆载体通常称为转录载体,并且根据本发明包含在术语“载体”中。根据本发明,rna优选是体外转录的rna(ivt-rna),并且可以通过体外转录合适的dna模板获得。用于控制转录的启动子可以是任何rna聚合酶的任何启动子。用于体外转录的dna模板可以通过克隆核酸,特别是cdna,并将其引入合适的载体进行体外转录来获得。可以通过rna的逆转录获得cdna。
转录期间产生的单链核酸分子通常具有作为模板的互补序列的核酸序列。
根据本发明,术语“模板”或“核酸模板”或“模板核酸”通常是指可以复制或转录的核酸序列。
术语“从核酸序列转录的核酸序列”是指适当地作为完整rna分子的一部分的核酸序列,其是模板核酸序列的转录产物。通常,转录的核酸序列是单链rna分子。
根据本发明,“核酸的3’端”是指具有游离羟基的末端。在双链核酸,特别是dna的图解表示中,3’端总是在右侧。根据本发明,“核酸的5’端”是指具有游离磷酸基团的末端。在双链核酸,特别是dna的图解表示中,5’端总是在左侧。
5′端5′--p-nnnnnnn-oh-3′3′端
3′-ho-nnnnnnn-p--5′
“上游”描述了核酸分子的第一元件相对于该核酸分子的第二元件的相对定位,其中两个元件均包含在相同的核酸分子中,并且其中与该核酸分子的第二元件相比,第一元件位于更靠近核酸分子的5’端。那么将第二元件称为该核酸分子的第一元件的“下游”。位于第二元件“上游”的元件可以同义地称为位于该第二元件的“5”’。对于双链核酸分子,关于(+)链给出了例如“上游”和“下游”的指示。
根据本发明,“功能连接”或“功能性连接的”涉及功能关系内的连接。如果核酸在功能上与另一核酸序列相关,则它是“功能性连接的”。例如,如果启动子影响所述编码序列的转录,则它与编码序列功能性连接。功能性连接的核酸通常彼此相邻,在适当时通过另外的核酸序列分开,并且在特定的一些实施方案中,通过rna聚合酶转录以产生单个rna分子(共同转录物)。
在一些特定实施方案中,根据本发明,核酸与表达控制序列功能性连接,所述表达控制序列可以与所述核酸同源或异源。
根据本发明,术语“表达控制序列”包括启动子、核糖体结合序列和控制基因转录或衍生rna的翻译的其他控制元件。在本发明的一些特定实施方案中,可以调节表达控制序列。表达控制序列的精确结构可以根据物种或细胞类型而变化,但通常包括分别参与启动转录和翻译的5’-非转录和5’-和3’-非翻译序列。更具体地,5’-非转录的表达控制序列包括启动子区,其包含用于转录控制功能性连接的基因的启动子序列。表达控制序列还可包括增强子序列或上游激活子序列。dna分子的表达控制序列通常包括5’-非转录的和5’-和3’-非翻译的序列,例如tata盒、加帽序列、caat序列等。甲病毒rna的表达控制序列可包括亚基因组启动子和/或一个或更多个保守序列元件。如本文中所述,根据本发明的特定表达控制序列是甲病毒的亚基因组启动子。
本文中指明的核酸序列,特别是可转录的和编码核酸序列,可以与任何表达控制序列(特别是启动子)组合,表达控制序列可以与所述核酸序列同源或异源,其中术语“同源”是指核酸序列也与表达控制序列天然地功能性连接的事实,术语“异源”是指核酸序列不与表达控制序列天然地功能性连接的事实。
如果它们以这样的方式彼此共价连接,使得可转录的并且特别是编码核酸序列的转录或表达受到表达控制序列的控制或影响,则可转录的核酸序列,特别是编码肽或蛋白质的核酸序列,以及表达控制序列彼此“功能性”连接。如果要将核酸序列翻译为功能性肽或蛋白质,则与编码序列功能性连接的表达控制序列的诱导导致所述编码序列的转录,而不会导致编码序列或编码序列的框移位而无法翻译成所需的肽或蛋白质。
术语“启动子”或“启动子区”是指通过提供rna聚合酶的识别和结合位点控制转录物(例如包含编码序列的转录物)合成的核酸序列。启动子区可包括用于参与调节所述基因转录的其他因子的另外的识别或结合位点。启动子可以控制原核或真核基因的转录。启动子可以是“可诱导的”并且响应于诱导物而启动转录,或者如果转录不受诱导物控制,则可以是“组成型的”。如果不存在诱导物,则诱导型启动子仅在非常小的程度上表达或根本不表达。在存在诱导物的情况下,基因被“打开(switchedon)”或转录水平提高。这通常通过特定转录因子的结合来介导。如本文中所述,根据本发明的特异性启动子是甲病毒的亚基因组启动子。另一些特异性启动子是甲病毒的基因组正链或负链启动子。
术语“核心启动子”是指由启动子所包含的核酸序列。核心启动子通常是正确启动转录所需的启动子的最小部分。核心启动子通常包括转录起始位点和rna聚合酶的结合位点。
“聚合酶”通常是指能够催化由单体结构单元合成聚合物分子的分子实体。“rna聚合酶”是能够催化从核糖核苷酸结构单元合成rna分子的分子实体。“dna聚合酶”是能够催化从脱氧核糖核苷酸结构单元合成dna分子的分子实体。对于dna聚合酶和rna聚合酶的情况,分子实体通常是蛋白质或多个蛋白质的装配物或复合物。通常,dna聚合酶基于模板核酸合成dna分子,模板核酸通常是dna分子。通常,rna聚合酶基于模板核酸合成rna分子,模板核酸是dna分子(在这种情况下,rna聚合酶是dna依赖性rna聚合酶,ddrp)或者是rna分子(在这种情况下是rna聚合酶是rna依赖性rna聚合酶,rdrp)。
“rna依赖性rna聚合酶”或“rdrp”是催化从rna模板转录rna的酶。在甲病毒rna依赖性rna聚合酶的情况下,依次合成基因组rna的(-)链互补序列和(+)链基因组rna导致rna复制。因此,甲病毒rna依赖性rna聚合酶被同义地称为“rna复制酶”。在自然界中,rna依赖性rna聚合酶通常由除逆转录病毒之外的所有rna病毒编码。编码rna依赖性rna聚合酶的病毒的典型代表是甲病毒。
根据本发明,“rna复制”通常是指基于给定rna分子(模板rna分子)的核苷酸序列合成的rna分子。合成的rna分子可以例如与模板rna分子相同或互补。通常,rna复制可以通过dna中间体的合成发生,或者可以直接通过rna依赖性rna聚合酶(rdrp)介导的rna依赖性rna复制发生。在甲病毒的情况下,rna复制不会通过dna中间体发生,而是由rna依赖性rna聚合酶(rdrp)介导:模板rna链(第一rna链)用作用于合成与第一rna链或其部分互补的第二rna链的模板。第二rna链可以进而任选地用作合成与第二rna链或其部分互补的第三rna链的模板。因此,第三rna链与第一rna链或其部分相同。因此,rna依赖性rna聚合酶能够直接合成模板的互补rna链,并且能够间接合成相同的rna链(通过互补的中间链)。
根据本发明,术语“基因”是指特定的核酸序列,其负责产生一种或更多种细胞产物和/或用于实现一种或更多种细胞间或细胞内功能。更具体地,所述术语涉及包含编码特定蛋白质或功能或结构rna分子的核酸的核酸区段(通常为dna;但在rna病毒的情况下为rna)。
如本文中使用的“分离的分子”意指基本上不含其他分子例如其他细胞材料的分子。术语“分离的核酸”意指根据本发明,核酸已经(i)在体外扩增,例如通过聚合酶链反应(pcr),(ii)通过克隆重组产生,(iii)纯化,例如通过切割和凝胶电泳分级分离,或(iv)合成,例如通过化学合成。分离的核酸是可通过重组技术操作的核酸。
术语“载体”在本文以其最通常的含义使用,并且包括用于核酸的任何中间载体,所述中间载体例如使得所述核酸能够被引入原核和/或真核宿主细胞中,并且在适当时,被整合到基因组中。优选在细胞中复制和/或表达这样的载体。载体包括质粒、噬菌粒、病毒基因组及其部分。
在本发明的上下文中,术语“重组”意指“通过基因工程制造”。优选地,在本发明的上下文中,“重组对象”例如重组细胞不是天然存在的。
本文中使用的术语“天然存在的”是指对象可以在自然界中发现的事实。例如,存在于生物体(包括病毒)中并且可以从自然界来源中分离并且在实验室中没有被人有意修饰的肽或核酸是天然存在的。术语“在自然界中发现”意指“存在于自然中”并且包括已知对象以及尚未被发现和/或与自然隔离的但可能在未来从天然来源发现和/或隔离的对象。
根据本发明,术语“表达”以其最通常的含义使用,并且包括rna的产生、或rna与蛋白质的产生。它还包括核酸的部分表达。此外,表达可以是瞬时的或稳定的。关于rna,术语“表达”或“翻译”涉及细胞的核糖体中的过程,通过该过程,信使rna的链指导氨基酸序列的装配以产生肽或蛋白。
根据本发明,术语“mrna”意指“信使rna”并且涉及通常通过使用dna模板产生并编码肽或蛋白质的转录物。通常,mrna包含5’-utr、蛋白质编码区、3’-utr和poly(a)序列。mrna可以通过从dna模板进行体外转录产生。体外转录方法是本领域技术人员已知的。例如,市售有多种体外转录试剂盒。根据本发明,可以通过稳定修饰和加帽来修饰mrna。
根据本发明,术语“poly(a)序列”或“poly(a)尾”是指不间断或中断的腺苷酸残基序列,其通常位于rna分子的3’端。不间断序列的特征在于连续的腺苷酸残基。在自然界中,不间断的poly(a)序列是典型的。虽然poly(a)序列通常不在真核dna中编码,但是在转录后通过模板非依赖性rna聚合酶在细胞核中的真核转录期间附着到rna的游离3’端,本发明包括由dna编码的poly(a)序列。
根据本发明,核酸例如rna,例如mrna,可以编码肽或蛋白质。因此,可转录的核酸序列或其转录物可含有编码肽或蛋白质的开放阅读框(orf)。
根据本发明,术语“编码肽或蛋白质的核酸”意指这样的核酸,如果存在于适当的环境中,优选细胞内,可指导氨基酸的装配以在翻译的过程中产生肽或蛋白质。优选地,根据本发明的rna能够与细胞翻译机制相互作用,从而允许翻译肽或蛋白质。
根据本发明,术语“肽”包括寡肽和多肽,并且是指包含两个或更多个、优选3个或更多个、优选4个或更多个、优选6个或更多个、优选8个或更多个、优选10个或更多个、优选13个或更多个、优选16个或更多个、优选20个或更多个、并且优选多达50个、优选100个或优选150个通过肽键彼此连接的连续的氨基酸的物质。术语“蛋白质”是指大肽,优选具有至少151个氨基酸的肽,但术语“肽”和“蛋白质”在本文中通常用作同义词使用。
根据本发明,术语“肽”和“蛋白质”包括不仅含有氨基酸组分而且含有非氨基酸组分例如糖和磷酸酯结构的的物质,以及还包括含有酯、硫醚或二硫键等键的物质。
根据本发明,术语“甲病毒”应广泛地理解,并包括具有甲病毒特征的任何病毒颗粒。甲病毒的特征包括存在(+)链rna,其编码适于在宿主细胞中复制的遗传信息,包括rna聚合酶活性。许多甲病毒的更多特征描述于例如strauss&strauss,microbiol.rev.,1994,第58卷,第491-562页;gould等,2010,antiviralres.,第87卷,第111-124页;rupp等,2015,j.gen.virology,第96卷,第2483-2500页中。术语“甲病毒”包括自然界发现的甲病毒,及其任何变体或衍生物。在一些实施方案中,在自然界中未发现变体或衍生物。
在一个实施方案中,甲病毒是自然界发现的甲病毒。通常,自然界发现的甲病毒对任何一种或更多种真核生物(例如动物(包括脊椎动物如人,以及节肢动物如昆虫))是感染性的。在一些典型的实施方案中,自然界发现的甲病毒对动物是感染性的。自然界发现的许多甲病毒对脊椎动物和/或节肢动物是感染性的(strauss&strauss,microbiol.rev.,1994,第58卷,第491-562页)。
在自然界中发现的甲病毒优选选自:巴马森林病毒复合体(包括巴马森林病毒);东部马脑炎复合体(包括七种抗原类型的东部马脑炎病毒);米德尔堡病毒复合体(包括米德尔堡病毒);恩杜穆(ndumu)病毒复合体(包含恩杜穆病毒);赛姆利基森林病毒复合体(包括贝巴鲁(bebaru)病毒、基孔肯雅病毒、马雅罗(mayaro)病毒及其亚型乌纳(una)病毒、欧尼恩(o’nyongnyong)病毒及其亚型igbo-ora病毒、罗斯河病毒及其亚型贝巴鲁病毒、盖他(getah)病毒、鹭山(sagiyama)病毒、赛姆利基森林病毒及其亚型metri病毒);委内瑞拉马脑炎复合体(包括卡巴斯欧(cabassou)病毒、沼泽地(everglades)病毒,莫斯达斯佩德拉斯(mossodaspedras)病毒、穆坎布(mucambo)病毒、paramana病毒、那皮舒纳(pixuna)病毒、内格罗河(rionegro)病毒、特罗卡拉(trocara)病毒及其亚型比朱桥病毒、委内瑞拉马脑炎病毒);西部马脑炎复合体(包括奥拉(aura)病毒、巴班肯(babanki)病毒、孜拉加奇(kyzylagach)病毒、辛德比斯(sindbis)病毒、奥克尔布(ockelbo)病毒、瓦塔罗阿(whataroa)病毒、博吉河(buggycreek)病毒、摩根堡(fortmorgan)病毒、高地j病毒、西部马脑炎病毒);和一些未分类的病毒,包括鲑鱼胰腺病毒;睡病病毒;南象海豹病毒;图那特(tonate)病毒。更优选地,甲病毒选自赛姆利基森林病毒复合体(包括如上所述的病毒类型,包括赛姆利基森林病毒)、西部马脑炎复合体(包括如上所述的病毒类型,包括辛德毕斯病毒)、东部马脑炎病毒(包括如上所述的病毒类型)、委内瑞拉马脑炎复合体(包括如上所述的病毒类型,包括委内瑞拉马脑炎病毒)。
在另一个优选实施方案中,甲病毒是赛姆利基森林病毒。在替代的另一个优选实施方案中,甲病毒是辛德毕斯病毒。在替代的另一个优选实施方案中,甲病毒是委内瑞拉马脑炎病毒。
在本发明的一些实施方案中,甲病毒不是自然界中发现的甲病毒。通常,在自然界中未发现的甲病毒是自然界中发现的甲病毒的变体或衍生物,其与自然界中发现的甲病毒的区别在于核苷酸序列(即基因组rna)中的至少一个突变。与自然界中发现的甲病毒相比,核苷酸序列中的突变可以选自一个或更多个核苷酸的插入、替换或缺失。核苷酸序列中的突变可以与核苷酸序列编码的多肽或蛋白质中的突变相关或不相关。例如,在自然界中未发现的甲病毒可以是减毒的甲病毒。在自然界中未发现的减毒甲病毒是通常在其核苷酸序列中具有至少一个突变的甲病毒,通过该突变其与自然界中发现的甲病毒区分开,并且其根本不具有传染性,或者具有传染性但具有较低致病的能力或根本没有致病能力。作为示例性实例,tc83是区别于在自然界中发现的委内瑞拉马脑炎病毒(veev)的减毒的甲病毒(mckinney等.,1963,am.j.trop.med.hyg.,1963,第12卷;第597-603页)。
术语“在自然界中发现”意指“存在于自然中”并且包括已知对象以及尚未被发现和/或与自然隔离的但可能在未来从天然来源发现和/或隔离的对象。
甲病毒属的成员也可以基于其在人中的相对临床特征进行分类:主要与脑炎相关的甲病毒和主要与发热、皮疹和多关节炎相关的甲病毒。
术语“甲病毒的”意指在甲病毒中发现的,或例如通过基因工程起源于甲病毒的或来源于甲病毒。
根据本发明,“sfv”代表赛姆利基森林病毒(semlikiforestvirus)。根据本发明,“sin”或“sinv”代表辛德毕斯病毒(sindbisvirus)。根据本发明,“vee”或“veev”代表委内瑞拉马脑炎病毒(venezuelanequineencephalitisvirus)。
术语“保守序列元件”或“cse”是指在甲病毒rna中发现的核昔酸序列。这些序列元件称为“保守的”,因为直系同源物存在于不同甲病毒的基因组中,并且不同甲病毒的直系同源cse优选地共享高百分比的序列同一性和/或相似的二级或三级结构。术语cse包括cse1、cse2、cse3和cse4(详细内容参见josé等,futuremicrobiol.,2009,第4卷,第837-856页)。
根据本发明,术语“亚基因组启动子”或“sgp”是指核酸序列(例如编码序列)上游(5’)的核酸序列,其通过提供rna聚合酶(通常是rna依赖性rna聚合酶)的识别和结合位点来控制所述核酸序列的转录。sgp可以包括另外的因子的其他识别或结合位点。亚基因组启动子通常是正链rna病毒(例如甲病毒)的遗传元件。甲病毒的亚基因组启动子是包含在病毒基因组rna中的核酸序列。亚基因组启动子的特征通常在于它允许在存在rna依赖性rna聚合酶(例如甲病毒复制酶)的情况下启动转录(rna合成)。rna(-)链,即甲病毒基因组rna的互补序列,用作合成(+)链亚基因组rna分子的模板,并且亚基因组(+)链合成通常在亚基因组启动子处或附近起始。出于说明性和非限制性目的,包含在实例甲病毒基因组中的sgp的典型定位在图1a中说明。然而,如本文中使用的术语“亚基因组启动子”不限于包含这样的亚基因组启动子的核酸中的任何特定定位。在一些实施方案中,sgp与cse3相同或与cse3重叠或包含cse3。
术语“自体的”用于描述源自相同对象的任何事物。例如,“自体细胞”是指来源于相同对象的细胞。将自体细胞引入对象是有利的,因为这些细胞克服了原本会导致排斥的免疫屏障。
术语“同种异体的”用于描述源自相同物种的不同个体的任何物质。当位于一个或更多个基因座处的基因不相同时,两个或更多个体彼此被称为是同种异体的。
术语“同源的”用于描述来源于具有相同基因型的个体或组织的任何物质,即同一近交品系的相同双胞胎或动物,或其组织或细胞。
术语“异源的”用于描述由多种不同元素组成的事物。例如,将个体的细胞引入不同的个体中构成了异源移植物。异源基因是来源于对象以外来源的基因。
以下提供本发明的个体特征的具体和/或优选变体。本发明还构想了作为特别优选的实施方案的那些实施方案,其通过组合两个或更多个针对本发明的两个或更多个特征描述的特定和/或优选变体而产生。
本发明的系统
在第一方面,本发明提供了这样的系统,其包含:
用于表达甲病毒复制酶的rna构建体,
可以通过该复制酶反式复制的rna复制子,
其中用于表达甲病毒复制酶的rna构建体包含5’-帽。5’-帽用于驱动该复制酶的翻译。
因此,本发明提供了这样的系统,其包含两种核酸分子:用于表达复制酶(即编码复制酶)的第一rna分子;和第二rna分子(复制子)。用于表达复制酶的rna构建体在本文中同义地称为“复制酶构建体”。
在本发明的系统中,复制酶的作用是反式扩增复制子。因此,复制子可以被称为反式复制子。如果复制子编码目的基因用于表达,则可以通过修饰复制酶的水平来反式调节目的基因的表达水平和/或表达的持续时间。
一般而言,rna代表了dna的有吸引力的替代品以便在人和动物的治疗中规避与使用dna相关的潜在安全风险。rna的治疗用途的优点包括瞬时表达和非转化特性,并且rna不需要为了表达而进入细胞核,从而使肿瘤发生的风险最小化。
尽管具有这些优点,但由于rna的不稳定性和相关的rna的短半衰期,因此rna的临床应用用途特别地受到限制。在本发明中,rna的短半衰期可以通过驱动宿主细胞或生物体中rna复制的系统来补偿。除此之外,本发明提供了有利于rna稳定性的特定rna修饰、制剂、载体和递送模式。这些将在以下描述。实际上,当将本发明系统的rna引入细胞或动物中时,实现了遗传信息的有效表达。
与现有技术方法相比,本发明的一个优点是dna模板的转录和转录物从细胞核到胞质中的运输是不必要的。这消除了对dna依赖性rna聚合酶的正常工作和mrna转运的依赖性。相反,本发明的复制酶构建体可立即用于翻译。
如本文所述,本发明的系统适合于在宿主细胞或宿主生物体中有效产生所需多肽(例如转基因)。本发明的一个优点是与适合于顺式复制的全长复制子的情况相比,可以实现更高的转基因表达。本发明系统的另一个优点是可以在野生型原代细胞(参见实施例2)和活体动物中(即体内)实现目的基因的高水平表达(实施例5和6)。与依赖于表达噬菌体来源的dna依赖性rna聚合酶——t7rna聚合酶的经改造细胞系相比,这是一个显著的优点(spuul等,j.virol.,2011,第85卷,第4739-4751页;sanz等,cellularmicrobiol.,2015,第17卷,第520-541页)。除非经过特别改造,否则哺乳动物细胞通常不表达t7rna聚合酶(buchholz等,j.virol.,1999,第73卷,第251-259页)。总之,本发明的基于rna的系统优于常规基因递送或基因治疗方法。
可以容易地制备本发明的系统。例如,rna分子可以从dna模板体外转录。在一个实施方案中,本发明的rna是体外转录的rna(invitrotranscribedrna,ivt-rna)。因此,在一个实施方案中,本发明的系统包含ivt-rna。优选地,本发明系统的所有rna分子都是ivt-rna。体外转录的rna(ivt-rna)对于治疗方法特别有意义。
本发明的系统包含至少两种核酸分子。因此,其可以包含两种或更多种、三种或更多种、四种或更多种、五种或更多种、六种或更多种、七种或更多种、八种或更多种、九种或更多种、或十种或更多种核酸分子。在一个优选的实施方案中,其恰好包含两种核酸分子,优选地rna分子(复制子和复制酶构建体)。在一些作为替选的优选实施方案中,除复制酶构建体外,该系统还包含多于一种的复制子,每种复制子优选地编码至少一种目的蛋白。在这些实施方案中,由复制酶构建体编码的复制酶可以作用于每种复制子以分别驱动亚基因组转录物的复制和产生。例如,每种复制子可以编码药学活性肽或蛋白质。这是有利的,例如如果需要针对几种不同抗原接种对象。
优选地,本发明的系统不能形成病毒颗粒,特别是下一代病毒颗粒。优选地,本发明的复制酶构建体不能在靶细胞或靶生物体中自我复制。
尽管本文描述了rna的一些方面和优点,但在一些实施方案中,也有可能本发明的系统包含一种或更多种dna分子。在一些实施方案中,本发明系统的任意一种或更多种核酸分子可以是dna分子。复制酶构建体和/或复制子可能是dna分子。在dna分子的情况下,优选地存在dna依赖性rna聚合酶的启动子,从而允许在被感染或经接种的宿主细胞或宿主生物体中转录。
以下描述了本发明的系统的其他实施方案和优点。
复制酶构建体的表征
优选地,用于表达甲病毒复制酶的rna构建体(复制酶构建体)包含编码甲病毒复制酶的开放阅读框(orf)。
根据本发明,“复制酶”是指rna依赖性rna聚合酶(rdrp)。rdrp是酶功能。复制酶通常是指多肽或多于一种相同和/或不相同蛋白质的复合物或缔合物,其能够基于(+)链rna模板催化(-)链rna的合成,和/或其能够基于(-)链rna模板催化(+)链rna的合成。复制酶可以另外具有一种或更多种另外的功能,例如蛋白酶(用于自动切割)、解旋酶、末端腺苷酰转移酶(用于poly(a)尾添加)、甲基转移酶和鸟苷酸转移酶(用于提供具有5’帽的核酸)、核定位位点、三磷酸酶(gould等,2010,antiviralres.,第87卷,第111-124页;rupp等,2015,j.gen.virol.,第96卷,第2483-500页)。
根据本发明,“甲病毒复制酶”是指来自甲病毒的rna复制酶,包括来自天然存在的甲病毒的rna复制酶和来自甲病毒的变体或衍生物(例如来自减毒的甲病毒)的rna复制酶。在本发明的上下文中,术语“复制酶”和“甲病毒复制酶”可互换使用,除非上下文规定任何特定的复制酶不是甲病毒复制酶。术语“复制酶”包括所有变体,特别是翻译后经修饰的变体、构象、甲病毒复制酶的同种型和同源物,其由甲病毒感染的细胞表达或由已经用编码复制酶的核酸转染的细胞表达。此外,术语“复制酶”包括已经通过重组方法产生和可以通过重组方法产生的所有形式的复制酶。例如,包含有助于在实验室中检测和/或纯化复制酶的标签(例如myc-标签、ha-标签或寡组氨酸标签(his-标签))的复制酶可以通过重组方法产生。
任选地,复制酶另外由与以下任意一种或更多种结合的能力功能性限定:甲病毒保守序列元件1(cse1)或其互补序列、保守序列元件2(cse2)或其互补序列、保守序列元件3(cse3)或其互补序列、保守序列元件4(cse4)或其互补序列。优选地,复制酶能够与cse2[即与(+)链]和/或与cse4[即与(+)链]结合,或与cse1的互补[即与(-)链]和/或与cse3的互补[即与(-)链]结合。
复制酶的来源不限于任何特定的甲病毒。在一个优选的实施方案中,甲病毒复制酶来自赛姆利基森林病毒,包括天然存在的赛姆利基森林病毒和赛姆利基森林病毒的变体或衍生物,例如减毒的赛姆利基森林病毒。在一个作为替选的优选实施方案中,复制酶来自辛德毕斯病毒,包括天然存在的辛德毕斯病毒和辛德毕斯病毒的变体或衍生物,例如减毒的辛德毕斯病毒。在一个作为替选的优选实施方案中,复制酶来自委内瑞拉马脑炎病毒(veev),包括天然存在的veev和veev的变体或衍生物,例如减毒的veev。
甲病毒复制酶通常包含甲病毒非结构蛋白(alphavirusnon-structuralprotein,nsp)或由其组成。在本文中,“非结构蛋白”是指甲病毒来源的任意一种或更多种单独的非结构蛋白(nsp1、nsp2、nsp3、nsp4),或包含多于一种甲病毒来源的非结构蛋白的多肽序列的多蛋白质,例如nsp1234。在一些实施方案中,“非结构蛋白”是指nsp123。在另一些实施方案中,“非结构蛋白”是指nsp1234。在另一些实施方案中,“非结构蛋白”是指nsp123(与p123同义)和nsp4的复合物或缔合物。在一些实施方案中,“非结构蛋白”是指nsp1、nsp2和nsp3的复合物或缔合物。在一些实施方案中,“非结构蛋白”是指nsp1、nsp2、nsp3和nsp4的复合物或缔合物。在一些实施方案中,“非结构蛋白”是指选自nsp1、nsp2、nsp3和nsp4中的任意一种或更多种的复合物或缔合物。
优选地,“复合物或缔合物”是多种元素的功能集合。在甲病毒复制酶的上下文中,术语“复合物或缔合物”描述了多种至少两种蛋白质分子,其中至少一种是甲病毒非结构蛋白,其中所述复合物或缔合物具有rna依赖性rna聚合酶(rdrp)活性。复合物或缔合物可以由多种不同的蛋白质组成(异多聚体)和/或一种特定蛋白质的多拷贝组成(同源多聚体)。在多聚体或多种的上下文中,“多”意指多于一种,例如两种、三种、四种、五种、六种、七种、八种、九种、十种或多于十种。
复合物或缔合物还可以包含来自多于一种不同甲病毒的蛋白质。例如,在根据本发明的包含不同甲病毒非结构蛋白的复合物或缔合物中,不需要所有非结构蛋白来源于相同的甲病毒。异源复合物或缔合物同样包含在本发明中。仅出于说明性目的,异源复合物或缔合物可以包含来自第一甲病毒(例如辛德毕斯病毒)的一种或更多种非结构蛋白(例如nsp1、nsp2)和来自第二甲病毒(例如赛姆利基森林病毒)的一种或更多种非结构蛋白(nsp3、nsp4)。
术语“复合物”或“缔合物”是指在空间上接近的两种或更多种相同或不同的蛋白质分子。复合物的蛋白质优选彼此直接或间接物理或物理化学接触。复合物或缔合物可以由多种不同的蛋白质组成(异多聚体)和/或由一种特定蛋白质的多拷贝组成(同源多聚体)。
术语“复制酶”包括每种共翻译或翻译后修饰形式,其包括甲病毒非结构蛋白的碳水化合物修饰(例如糖基化)和脂质修饰形式。
术语“复制酶”包括甲病毒复制酶的每个功能片段。当片段作为rna依赖性rna聚合酶(rdrp)时,其是有功能的。
在一些实施方案中,复制酶能够在表达该复制酶之细胞中形成膜状复制复合物和/或泡(vacuole)。
优选地,复制酶构建体包含如上所限定的复制酶的编码区。编码区可以包含一个或更多个开放阅读框。
在一个实施方案中,复制酶构建体编码甲病毒的全部的nsp1、nsp2、nsp3和nsp4。在一个实施方案中,复制酶构建体将甲病毒nsp1、nsp2、nsp3和nsp4编码为单独的、任选地可切割的多蛋白:nsp1234,其由一个单独的开放阅读框编码。在一个实施方案中,复制酶构建体将甲病毒nsp1、nsp2和nsp3编码为单独的、任选地可切割的多蛋白:nsp123,其由一个单独的开放阅读框编码。在该实施方案中,nsp4可以被单独编码。
优选地,本发明的复制酶构建体不包含甲病毒亚基因组启动子。
优选地,复制酶构建体是mrna分子。mrna分子优选地既不包含cse1也不包含cse4。不希望受到理论束缚,设想这样的mrna不会与复制子竞争复制酶的结合,因此复制子可以由该复制酶非常有效地复制。
复制酶构建体的rna优选非双链的,优选地是单链的,更优选地是(+)链rna。复制酶由复制酶构建体上的开放阅读框编码。
在一个实施方案中,本发明的复制酶构建体是无内含子rna,优选地无内含子mrna。优选地,复制酶构建体是天然无内含子rna(mrna)。例如,无内含子rna(mrna)可以通过体外合成例如通过体外转录获得。在一个实施方案中,复制酶构建体包含编码nsp1234的开放阅读框,其不包含内含子。在一个实施方案中,复制酶构建体包含编码nsp123的开放阅读框,其不包含内含子。优选地,复制酶构建体不包含从兔β-珠蛋白基因获得的内含子(如wo2008/119827a1中所述)。
本文所用的“内含子”被定义为前体mrna(前mrna)的非编码区段,其在rna的编码序列翻译成多肽之前从rna中被去除,即被剪接出。一旦内含子从前mrna被剪接出,就可以将得到的mrna序列翻译成多肽。换言之,内含子的核苷酸序列通常不翻译成蛋白质。无内含子mrna是包含用于翻译成多肽的连续密码子(碱基三联体)的mrna。无内含子的mrna可以是天然无内含子的(即例如在细胞或体外转录中最初合成为无内含子mrna),或者可以通过剪接含有内含子的前体mrna而成熟为无内含子mrna。在本发明中优选天然无内含子的体外转录rna。
本发明的复制酶构建体与甲病毒基因组rna的不同之处至少在于其不能自我复制和/或其不包含受到亚基因组启动子控制的开放阅读框。当不能自我复制时,复制酶构建体也可以被称为“自杀构建体(suicideconstruct)”。
优选地,本发明的复制酶构建体不与甲病毒结构蛋白缔合。优选地,复制酶构建体不被甲病毒结构蛋白包装。更优选地,复制酶构建体不被包装在病毒颗粒中。优选地,复制酶构建体不与病毒蛋白质缔合(无病毒蛋白质系统)。与现有技术的基于辅助病毒的系统(例如由bredenbeek等,同上)相比,无病毒蛋白质系统提供了优点。
优选地,复制酶构建体缺少至少一种基于(+)链模板的(-)链合成和/或基于(-)链模板的(+)链合成所必需的保守序列元件(cse)。更优选地,复制酶构建体不包含来源于甲病毒的任何保守序列元件(cse)。特别是在甲病毒的四种cse中(strauss&strauss,microbiol.rev.,1994,第58卷,第491-562页;josé等,futuremicrobiol.,2009,第4卷,第837-856页),任意一种或更多种以下cse优选不存在于复制酶构建体中。
-cse1,其被认为是作为基于自然界中发现的甲病毒中的(-)链模板合成(+)链的启动子;
-cse2,其被认为是作为基于自然界中发现的甲病毒的(+)链基因组rna合成(-)链的启动子;
-cse3,其被认为有助于自然界中发现的甲病毒中亚基因组(+)链rna的有效转录;
-cse4,其被认为是作为基于自然界中发现的甲病毒中(+)链基因组rna启动(-)链合成的核心启动子。
在一个实施方案中,不存在cse1、cse3和cse4,并且可以存在或不存在cse2。
特别是在不存在任意一种或更多种甲病毒cse的情况下,比起本发明的复制酶构建体类似于甲病毒基因组rna,其更类似于典型的真核mrna。
在一个实施方案中,本发明的复制酶构建体是分离的核酸分子。
帽
用于表达甲病毒复制酶的rna构建体(复制酶构建体)包含5’-帽。术语“5’-帽”、“帽”、“5’-帽结构”、“帽结构”同义使用是指在一些真核原发性转录物如前体信使rna的5’端发现的二核苷酸。5’-帽是这样的结构,其中(任选经修饰的)鸟苷通过5’至5’三磷酸键连接(或在某些帽类似物的情况下为经修饰的三磷酸键连接)与mrna分子的第一个核苷酸键合。这些术语可以指传统的帽或帽类似物。为了说明,一些特定的帽二核苷酸(包括帽类似物二核苷酸)显示在图2中。
“包含5’-帽的rna”或“具有5’-帽的rna”或“用5’-帽经修饰的rna”或“加帽的rna”是指包含5’-帽的rna。例如,提供具有5’-帽的rna可以通过在所述5’-帽存在下体外转录dna模板来实现,其中所述5’-帽被共转录地并入所产生的rna链中,或者rna可以例如通过体外转录产生,并且可以使用加帽酶(痘苗病毒的加帽酶)在转录后将5’-帽与rna连接。在加帽的rna中,(加帽的)rna分子的第一个碱基的3’位置通过磷酸二酯键与rna分子的后续碱基(“第二碱基”)的5’位置连接。为了说明,在图1中,根据本发明的核酸分子中帽的位置用字母c表示。
术语“常规5’-帽”是指天然存在的5’-帽,优选7-甲基鸟苷帽。在7-甲基鸟苷帽中,帽的鸟苷是经修饰的鸟苷,其中修饰由7位甲基化组成(图2的顶部)。
在本发明的上下文中,术语“5’-帽类似物”是指类似于常规5’-帽的分子结构,但是经修饰以具有在与rna连接时稳定rna的能力,优选在体内和/或帽子类似物不是常规5’帽。
本发明与现有技术反式复制系统的区别在于复制酶的翻译是由复制酶构建体上的5’-帽驱动的。本发明人发现,特别是复制酶构建体上的5’-帽不仅对复制酶的表达、而且对作为整体的系统的性能都具有非常积极的影响:可以实现非常有效地产生反式编码的目的基因(参见实施例)。在一个实施方案中,本发明的复制酶构建体不包含内部核糖体进入位点(ires)元件。
一般而言,内部核糖体进入位点(缩写为ires)是允许从来自与mrna序列5’端不同的位置(例如如来自mrna序列中部位置)的信使rna(mrna)翻译起始的核苷酸序列。术语ires和ires元件在本文中可互换使用。ires元件在真核生物以及能够感染真核生物的病毒中发现。然而,迄今为止病毒ires功能的机制比真核ires功能的机制更好地表征(lópez-lastra等,2005,biol.res.,第38卷,第121-146页)。已经建议使用ires来驱动甲病毒复制酶在真核细胞中的表达(例如sanz等,cellularmicrobiol.,2015,第17卷,第520-541页)。本发明人表明,在不同的实施方案中,当复制酶构建体不包含ires时,可以实现在反式复制子上编码的基因的有效基因表达(参见实施例1至6)。因此,在一个实施方案中,用于表达甲病毒复制酶的rna构建体(复制酶构建体)不包含内部核糖体进入位点(ires)元件。优选地,复制酶的翻译不由ires元件驱动。已知在ires下游的开放阅读框中编码的翻译蛋白质的水平变化很大,并且取决于特定ires的类型和序列以及实验设置的细节(balvay等,2009,biochim.biophys.acta,第1789卷,第542-557页中综述)。在现有技术中从含ires的rna的基因表达的情况下,观察到与短反式复制子相比,从较大反式复制子的基因表达效率较低(spuul等,j.virol.,2011,第85卷,第4739-4751页),并且甲病毒复制酶典型的膜状复制复合物的尺寸取决于反式复制子的长度(kallio等,2013,j.virol.,第87卷,第9125-9134页)。含有ires的rna也在体外转录并与反式复制子一起转染到细胞中(sanz等,cellularmicrobiol.,2015,第17卷,第520-541页)。该研究表明,使用体外转录的含ires的mrna能够在细胞中表达复制酶,并且能够反式介导复制子的复制。
本发明的方法与现有技术(spuul等,同上)显著不同,推测它们的rna(在转染细胞中原位产生)未加帽。spuul等人没有预见将帽并入未加帽的rna中:他们选择了一种替代方法,并在t7启动子的下游并入了一个内部核糖体进入位点(ires)元件;根据该参考文献,ires元件参与增强可能未加帽的rna的表达。本发明的复制酶构建体也不同于sanz等人(同上)描述的编码nsp1-4的含ires的未加帽体外转录rna。
在本发明中用5’-帽取代ires(如sanz等(同上)和spuul等(同上)所使用)是不影响由rna分子编码的多肽序列的rna分子的特定修饰(非多肽序列修饰之修饰)。
原则上,任何编码rna都适合于非多肽序列修饰之修饰。在现代分子生物学中,已经在几个系统中研究了非多肽序列修饰之修饰例如对基因表达效率的影响。然而,对于应选择何种类型的非多肽序列修饰之修饰以实现有效的基因表达,例如与未修饰序列相比使得基因表达提高,还没有建立普遍适用的规则。因此,对任何特定编码核酸和/或任何特定表达系统,选择合适的非多肽序列修饰之修饰是一项具有挑战性的任务。在本领域中,已经描述了多种不同的非多肽序列修饰之修饰。例如,对于真核信使rna,已经进行研究的非多肽序列修饰之修饰包括特定非翻译区(utr,如例如在wo2013/143699a1、wo2013/143698a1;holtkamp等,blood,2006,第108卷,第4009-4017页中所述)的选择、内含子的引入(例如兔β-珠蛋白内含子ii序列(例如li等,j.exp.med.,1998,第188卷,第681-688页))、或编码序列的沉默修饰(例如通过在不改变编码的多肽序列的情况下调整宿主细胞或宿主生物体的优先密码子使用(沉默修饰,总体上在例如wo2003/085114a1中描述))。据本发明人所知,目前还没有对于基于多种非多肽序列修饰之修饰在甲病毒的表达系统中的影响的系统性比较研究。
在为实现本发明而进行的研究中,勤勉地试验了涉及例如非多肽序列修饰之修饰的多种方法,结果是,出人意料地发现,用复制酶构建体上的5’-帽特异性地取代ires具有反式有益效果,即在反式复制子的水平下的有益效果:当帽存在于复制酶构建体上时,产生由根据本发明的复制子编码的目的蛋白是有效的。这是显著的,特别是由于作为替选的非多肽序列修饰之修饰,即编码序列修饰的调整,未能改善本发明系统的性能:相反,甚至降低了由复制子编码的目的蛋白的生产效率。这在实施例4中说明。因此,对于基于甲病毒rna元件的反式复制系统的情况,在复制酶构建体上包含5’-帽是特别有利的非多肽序列修饰之修饰。鉴于wo2008/119827a1(其描述了密码子调整赛姆利基森林复制酶在转染的bhk-21宿主细胞中表达,并且得出结论:密码子优化的sfv复制酶具有高活性并且能够增强报告基因反式表达),本发明的发现同样出人意料。因此,wo2008/119827a1指出了与本发明不同的方向,表明作为替选的非多肽序列修饰之修饰,即将内含子引入复制酶的编码序列,有助于有效的复制酶表达。
在真核mrna中,5’-帽的存在被认为尤其在调节mrna的核输出和加工,特别是促进5’近端内含子切除中起作用(konarska等,2014,cell,第38卷,第731-736页)。本发明的复制酶构建体通常既不需要从核输出也不需要进行加工。然而,出人意料地发现5’-帽存在于复制酶构建体上是有利的。
对于真核mrna的情况,5’-帽也通常被描述为参与mrna的有效翻译:通常,在真核生物中,除非存在ires,否则翻译仅在信使rna(mrna)分子的5’端启动。真核细胞能够在核中转录期间提供具有5’-帽的rna:例如当转录物达到20至30个核苷酸的长度时,新合成的mrna通常用5’-帽结构修饰。首先,5’端核苷酸pppn(ppp代表三磷酸;n代表任何核苷)通过具有rna5’-三磷酸酶和鸟嘌呤基转移酶活性的加帽酶在细胞中转化成5’gpppn。随后可以通过具有(鸟嘌呤-7)-甲基转移酶活性的第二种酶在细胞中使gpppn甲基化以形成单甲基化的m7gpppn帽。在一个实施方案中,本发明中使用的5’-帽是天然的5’-帽。
在本发明中,天然5’-帽二核苷酸通常选自非甲基化帽二核苷酸((g(5’)ppp(5’)n;也被称为gpppn)和甲基化帽二核苷酸(m7g(5’)ppp(5’)n;也被称为m7gpppn)。m7gpppn(其中n是g)由下式表示:
本发明的复制酶构建体不依赖于宿主细胞中的加帽机制。设想当转染到宿主细胞中时,本发明的复制酶构建体通常不定位于细胞核,即在其他情况下在典型的真核细胞中发生加帽之位点。
不希望受理论束缚,并且类似于现有技术构建体上的ires,可以设想复制酶构建体上的5’-帽有助于引发复制酶的翻译起始。可以设想,真核翻译起始因子elf4e参与使得根据本发明的加帽mrna与核糖体缔合。本发明的发明人出人意料地发现,5’-帽的存在显著提高了性能。因此,本发明的复制酶构建体包含5’-帽。
在本发明的反式复制系统中,5’-帽的存在还提供了意想不到的协同效应:如实施例中所示,当加帽的复制酶构建体相对于复制子rna以反式提供时,加帽的复制酶构建体引起目的蛋白更有效地产生(参见例如实施例1)。因此,本文证明了5’-帽和反式复制的协同作用,即优于顺式复制。
本发明的加帽rna可以在体外制备,因此不依赖于宿主细胞中的加帽机制。在体外制备加帽rna的最常用方法是在所有四种核糖核苷三磷酸和帽二核苷酸如m7g(5’)ppp(5’)g(也称为m7gpppg)的存在下用细菌或噬菌体rna聚合酶转录dna模板。rna聚合酶以通过m7gpppg的鸟苷部分的3’-oh对下一个模板核苷三磷酸(pppn)的α-磷酸的亲核攻击来启动转录,产生中间体m7gpppgpn(其中n是rna分子的第二个碱基)。通过在体外转录期间将帽与gtp的摩尔比设定在5至10来抑制竞争性gtp引发的产物pppgpn的形成。
在本发明的一些优选实施方案中,5’-帽是5’-帽类似物。如果rna通过体外转录获得,例如是体外转录的rna(ivt-rna),则这些实施方案是特别合适的。最初已经描述了帽类似物通过体外转录促进rna转录物的大规模合成。
与先前描述的经改造甲病毒复制系统(例如wo2008/119827a1、wo2012/006376a2)相反,本发明的复制酶构建体优选包含帽类似物。因此,本发明系统的复制酶的翻译优选由帽类似物驱动。理想地,选择与更高的翻译效率和/或提高的体内降解抗性和/或提高的体外降解抗性相关的帽类似物。因此,本发明提供了与现有技术(wo2012/006376a2,其描述了优选不含任何经修饰核苷酸的甲病毒表达构建体,并且其包含天然帽((m7g(5’)ppp(5’)g);也被称为m7gpppg,任选地通过市售的scriptcapm7g加帽系统(epicenterbiotechnologies)添加)显著不同的方法。
对于信使rna,迄今为止一般地描述了一些帽类似物(合成帽),它们都可以用于本发明的上下文中。优选地,使用仅可以在一个方向上引入到rna链中的帽类似物。pasquinelli等(1995,rnaj.,第1卷,第957-967页)证明,在体外转录过程中,噬菌体rna聚合酶使用7-甲基鸟苷单元启动转录,其中约40-50%的具有帽的转录物具有反向的帽二核苷酸(即,初始反应产物是gpppm7gpn)。与具有正确帽的rna相比,具有反向帽的rna在翻译编码蛋白质方面不起作用。因此,希望将帽以正确的方向引入,即产生具有基本上对应于m7gpppgpn等的结构的rna。已经显示,通过取代甲基化鸟苷单元的2’-或3’-oh基团中的任一种来抑制帽二核苷酸的反向整合(stepinski等,2001;rnaj.,第7卷,第1486-1495页;peng等,2002;org.lett.,第24卷,第161-164页)。在存在这种“抗反向帽类似物”的情况下合成的rna比在常规5’-帽m7gpppg存在下体外转录的rna更有效地翻译。因此,例如holtkamp等,2006,blood,第108卷,第4009-4017页描述了一种帽类似物,其中甲基化鸟苷单元的3’oh基团被och3代替(7-甲基(3’-o-甲基)gpppg;抗反向帽类似物(anti-reversecapanalog,arca))。arca是根据本发明的合适的帽二核苷酸。
在本发明的一个优选实施方案中,本发明的rna基本上不易于脱帽。这是重要的,因为通常,由引入培养的哺乳动物细胞中的合成mrna产生的蛋白质的量受到mrna的天然降解的限制。mrna降解的一个体内途径始于mrna帽的去除。这种去除由异二聚体焦磷酸酶催化,其含有调节亚基(dcp1)和催化亚基(dcp2)。催化亚基在三磷酸桥的α和β磷酸基团之间切割。在本发明中,可以选择或存在对这种类型的切割不敏感或不易受影响的帽类似物。用于此目的的合适的帽类似物可以选自根据式(i)的帽二核苷酸:
其中r1选自任选取代的烷基、任选取代的烯基、任选取代的炔基、任选取代的环烷基、任选取代的杂环基、任选取代的芳基和任选取代的杂芳基,
r2和r3独立地选自h、卤素、oh和任选取代的烷氧基,或r2和r3一起形成o-x-o,其中x选自任选取代的ch2、ch2ch2、ch2ch2ch2、ch2ch(ch3)、和c(ch3)2或r2与r2所连接的环的4’位氢原子结合形成-o-ch2-或-ch2-o-,
r5选自s、se和bh3,
r4和r6独立地选自o、s、se和bh3,
和
n是1、2或3。
r1、r2、r3、r4、r5、r6的一些优选实施方案公开在wo2011/015347a1中,并且可以相应地在本发明中选择。在本发明的一个实施方案中,r1是甲基,r2和r3独立地是羟基或甲氧基。
例如,在本发明的一个优选实施方案中,本发明的rna包含硫代磷酸酯-帽-类似物。硫代磷酸酯-帽-类似物是特定的帽类似物,其中三磷酸链中的三个非桥连o原子之一被s原子取代,即式(i)中的r4、r5或r6之一是s。硫代磷酸酯-帽-类似物由j.kowalska等,2008,rna,第14卷,第1119-1131页描述为针对不希望的去帽过程的解决方案,从而提高体内rna的稳定性。特别地,用氧原子取代5’-帽的β-磷酸基团上的硫原子导致对dcp2的稳定化。在本发明优选的该实施方案中,式(i)中的r5是s;并且r4和r6是o。
在本发明的另一个优选实施方案中,本发明的rna包含硫代磷酸酯-帽-类似物,其中rna5’-帽的硫代磷酸酯修饰与“抗反向帽类似物”(arca)修饰组合。各种arca-硫代磷酸酯-帽-类似物描述于wo2008/157688a2中,并且它们均可用于本发明的rna中。在该实施方案中,式(i)中的r2或r3中的至少一个不是oh,优选r2和r3中的一个是甲氧基(och3),并且r2和r3中的另一个优选是oh。在一个优选的实施方案中,氧原子取代β-磷酸基团上的硫原子(使得式(i)中的r5是s;并且r4和r6是o)。据信,arca的硫代磷酸酯修饰确保在翻译和去帽机器中α、β和γ磷酸盐和硫代磷酸酯基团精确地定位在帽结合蛋白的活性位点内。这些类似物中的至少一些基本上对焦磷酸酶dcp1/dcp2具有抗性。据描述,硫代磷酸酯修饰的arca对eif4e具有比缺乏硫代磷酸酯基团的相应arca高得多的亲和力。
在本发明中特别优选的相应的帽类似物(即m2’7,2’-ogppspg)被称为β-s-arca(wo2008/157688a2;kuhn等,genether.,2010,第17卷,第961-971页)。因此,在本发明的一个实施方案中,用β-s-arca修饰本发明的复制酶构建体。β-s-arca由以下结构表示:
通常,在桥接磷酸酯处用硫原子代替氧原子得到硫代磷酸酯非对映异构体,基于它们在hplc中的洗脱模式,其命名为d1和d2。简而言之,β-s-arca的d1非对映异构体或“β-s-arca(d1)”是β-s-arca的非对映异构体,与β-s-arca的d2非对映异构体(β-s-arca(d2))相比,其首先在hplc柱上洗脱。因此表现出更短的保留时间。通过hplc测定立体化学构型描述于wo2011/015347a1中。
在本发明的第一个特别优选的实施方案中,用β-s-arca(d2)非对映异构体修饰本发明的复制酶构建体。β-s-arca的两种非对映异构体对核酸酶的敏感性不同。已经显示携带β-s-arca的d2非对映异构体的rna几乎完全抵抗dcp2切割(与在未修饰的arca5’-帽存在下合成的rna相比仅有6%的切割),而具有β-s-arca(d1)5’-帽的rna表现出对dcp2切割的中度敏感性(71%切割)。还显示,对dcp2切割的提高的稳定性伴随着哺乳动物细胞中提高的蛋白质表达。特别地,已经显示携带β-s-arca(d2)帽的rna在细胞中比携带β-s-arca(d1)帽的rna更有效地翻译。因此,在本发明的一个实施方案中,用式(i)的帽类似物修饰本发明的复制酶构建体,其特征在于式(i)中包含取代基r5的p原子处的立体化学构型,其对应于在β-s-arca的d2非对映异构体的pβ原子处。在该实施方案中,式(i)中的r5是s;并且r4和r6是o。另外,式(i)中的r2或r3中的至少一个优选不是oh,优选地r2和r3中的一个是甲氧基(och3),并且r2和r3中的另一个优选是oh。
在第二个特别优选的实施方案中,用β-s-arca(d1)非对映异构体修饰本发明的复制酶构建体。该实施方案特别适用于将加帽的rna转移到未成熟的抗原呈递细胞中,例如用于疫苗接种目的。已经证明β-s-arca(d1)非对映异构体在将分别加帽的rna转移到未成熟抗原呈递细胞中时特别适合于提高rna的稳定性,提高rna的翻译效率,延长rna的翻译,提高rna的总蛋白质表达,和/或提高针对由所述rna编码的抗原或抗原肽的免疫应答(kuhn等,2010,genether.,第17卷,第961-971页)。因此,在本发明的一个可替选实施方案中,用式(i)的帽类似物修饰本发明的复制酶构建体,其特征在于式(i)中包含取代基r5的p原子处的立体化学构型,其对应于在β-s-arca的d1非对映异构体的pβ原子处。各种帽类似物及其实施方案描述于wo2011/015347a1和kuhn等,2010,genether.,第17卷,第961-971页。在本发明中可以使用wo2011/015347a1中描述的任何帽类似物,其中在包含取代基r5的p原子处的立体化学构型对应于β-s-arca的d1非对映异构体的pβ原子处的立体化学构型。优选地,式(i)中的r5是s;另外,式(i)中的r2或r3中的至少一个优选不是oh,优选r2和r3中的一个是甲氧基(och3),r2和r3中的另一个优选是oh。
在一个实施方案中,用根据式(i)的5’-帽结构修饰本发明的复制酶构建体,其中任何一个磷酸基团被硼代磷酸酯基团或硒代磷酸酯基团代替。这种帽在体外和体内都具有提高的稳定性。任选地,相应的化合物具有2’-o-或3’-o-烷基(其中烷基优选为甲基);相应的帽类似物称为β-bh3-arca或β-se-arca。特别适合于mrna加帽的化合物包括β-bh3-arca和β-se-arca,如wo2009/149253a2中所述。对于这些化合物,优选包含式(i)中的取代基r5的p原子的立体化学构型,其对应于β-s-arca的d1非对映异构体的pβ原子。
utr
术语“非翻译区”或“utr”涉及转录但不翻译成氨基酸序列的区域,或rna分子(例如mrna分子)中的相应区域。如果存在,3’-utr位于基因的3’端,蛋白质编码区终止密码子下游,但术语“3’-utr”优选不包含poly(a)尾。因此,3’-utr位于poly(a)尾(如果存在)的上游,例如,与poly(a)尾部直接相邻。
如果存在,5’-utr位于基因的5’端,蛋白质编码区的起始密码子的上游。5’-utr位于5’-帽(如果存在的话)的下游,例如与5’-帽直接相邻。
根据本发明,5’和/或3’非翻译区可以与开放阅读框功能性连接,以便这些区域与开放阅读框相关联,使得稳定性和/或包含所述开放阅读框的rna的翻译效率提高。
非翻译区(utr)可以存在于编码复制酶的开放阅读框的5’(上游)(5’-utr)和/或编码复制酶的开放阅读框的3’(下游)(3’-utr)。在一个优选的实施方案中,用于表达甲病毒复制酶的rna构建体(复制酶构建体)包含
(1)5’utr,
(2)编码该复制酶的开放阅读框,和
(3)3’utr。
具体地,在本发明的复制酶构建体的一个实施方案中,术语“3’-utr”涉及位于复制酶编码区3’的区域,术语“5’-utr”涉及位于复制酶编码区5’的区域。
utr涉及rna的稳定性和翻译效率——使用基于rna的疫苗进行有效免疫反应的先决条件。除了关于本文所述的5’-帽和/或3’poly(a)尾的结构修饰之外,通过选择特定的5’和/或3’非翻译区(utr),两者都可以得到改善。utr内的序列元件通常被理解为影响翻译效率(主要是5’-utr)和rna稳定性(主要是3’-utr)。优选存在5’-utr,其有活性以提高核酸序列的翻译效率和/或稳定性。独立地或另外地,优选存在3’-utr,其有活性以提高核酸序列的翻译效率和/或稳定性。
参考第一核酸序列(例如utr)的术语“核酸序列有活性以提高翻译效率”和/或“核酸序列的稳定性”意指在与第二核酸序列的共同转录物中,第一核酸序列能够修饰所述第二核酸序列的翻译效率和/或稳定性,使得所述翻译效率和/或稳定性与不存在所述第一核酸序列时所述第二核酸序列的翻译效率和/或稳定性相比提高。在本文中,术语“翻译效率”涉及rna分子在特定时间段内提供的翻译产物的量,术语“稳定性”涉及rna分子的半衰期。
优选地,复制酶构建体包含5’-utr和/或3’-utr,其对于复制酶所来源的甲病毒是异源的或非天然的。这允许根据所需的翻译效率和rna稳定性设计非翻译区。因此,异源或非天然utr允许高度的灵活性,并且与天然甲病毒utr相比,这种灵活性是有利的。特别是,虽然已知甲病毒(天然)rna还包含5’-utr和/或3’-utr,但甲病毒utr具有双重功能,即(i)驱动rna复制以及(ii)驱动翻译。虽然据报道甲病毒utr的对于翻译是低效率的(berben-bloemheuvel等,1992,eur.j.biochem.,第208卷,第581-587页),但因为它们的双重功能,它们不能容易地被更有效的utr替代。然而,在本发明中,可以选择复制酶构建体的5’-utr和/或3’-utr,而与它们对rna复制的潜在影响无关。
优选地,复制酶构建体包含非病毒来源的5’-utr和/或3’-utr;特别地不是甲病毒来源。在一个实施方案中,rna包含来源于真核生物5’-utr的5’-utr和/或来源于真核生物3’-utr的3’-utr。
根据本发明的5’-utr可包含多于一个核酸序列的任何组合,任选地通过接头分开。根据本发明的3’-utr可包含多于一个核酸序列的任何组合,任选地通过接头分开。
根据本发明的术语“接头”涉及在两个核酸序列之间添加以连接所述两个核酸序列的核酸序列。关于接头序列没有特别限制。
3’-utr通常具有200至2000个核苷酸的长度,例如,500至1500个核苷酸。免疫球蛋白mrna的3’-非翻译区相对较短(少于约300个核苷酸),而其他基因的3’-非翻译区相对较长。例如,tpa的3’非翻译区长度为约800个核苷酸,因子viii的3’非翻译区长度为约1800个核苷酸,促红细胞生成素的3’非翻译区长度为约560个核苷酸。
哺乳动物mrna的3’-非翻译区通常具有称为aauaaa六核苷酸序列的同源区。该序列可能是poly(a)附着信号,并且通常位于poly(a)连接位点上游10至30个碱基处。
3’-非翻译区可含有一个或更多个反向重复,其可折叠以产生茎环结构,所述茎环结构充当外切核糖核酸酶的屏障或与已知提高rna稳定性的蛋白质(例如rna结合蛋白)相互作用。
人β-珠蛋白3’-utr,特别是两个连续相同拷贝的人β-珠蛋白3’-utr有助于高转录稳定性和翻译效率(holtkamp等,2006,blood,第108卷,第4009-4017页)。因此,本发明的复制酶构建体的实施方案包含两个连续相同拷贝的人β-肌球蛋白3’-utr。因此,其在5’→3’方向包含:(a)任选地5’-utr;(b)编码复制酶的开放阅读框;(c)3’-utr;所述3’-utr包含两个连续相同拷贝的人β-珠蛋白3’-utr,其片段,或人β-珠蛋白3’-utr或其片段的变体。
在一个实施方案中,本发明的复制酶构建体包含3’-utr,该3’-utr具有活性以提高复制酶构建体的翻译效率和/或稳定性,但其不是人β-珠蛋白3’-utr、其片段、或人β-珠蛋白3’-utr或其片段的变体。
在一个实施方案中,本发明的复制酶构建体包含5’-utr,其具有活性以提高复制酶构建体的翻译效率和/或稳定性。
根据本发明的含有utr的rna可以例如通过体外转录来制备。这可以通过以允许具有5’-utr和/或3’-utr的rna转录的方式遗传修饰本发明核酸分子(例如dna)的表达来实现。
poly(a)序列
在一个实施方案中,用于表达甲病毒复制酶的rna构建体(复制酶构建体)包含3’poly(a)序列。
在甲病毒中,认为至少11个连续腺苷酸残基或至少25个连续腺苷酸残基的3’poly(a)序列对于负链的有效合成是重要的。特别地,在甲病毒中,至少25个连续腺苷酸残基的3’poly(a)序列被理解为与保守序列元件4(cse4)一起起作用以促进(-)链的合成(hardy&rice,j.virol.,2005,第79卷,第4630-4639页)。然而,在本发明中,通常不需要复制酶构建体的(-)链合成,并且poly(a)序列主要起影响转染的真核细胞中rna稳定性和蛋白质翻译的功能。实际上,已经证明,约120个a核苷酸的3’poly(a)序列对转染的真核细胞中的rna水平以及从存在于3’poly(a)序列的上游(5’)的开放阅读框翻译的蛋白质水平具有有益影响(holtkamp等,2006,blood,第108卷,第4009-4017页)。根据本发明,在一个实施方案中,poly(a)序列包含以下或基本上由以下或由以下组成:至少20个、优选至少26个、优选至少40个、优选至少80个、优选至少100个,且优选至多500个、优选至多400个、优选至多300、优选至多200、特别是至多150个a核苷酸,特别是约120个a核苷酸。在本文中,“基本上由......组成”意指poly(a)序列中的大多数核苷酸,通常为“poly(a)序列”中核苷酸数量的至少50%,优选至少75%,是a核苷酸,但允许剩余的核苷酸是除a核苷酸外的核苷酸,例如u核苷酸(尿苷酸)、g核苷酸(鸟苷酸)、c核苷酸(胞苷酸)。在本文中,“由...组成”意指poly(a)序列中的所有核苷酸,即poly(a)序列中100%数目的核苷酸是a核苷酸。术语“a核苷酸”或“a”是指腺苷酸。
本发明提供了3’poly(a)序列,其在rna转录期间,即在体外转录的rna的制备过程中,基于与编码链互补的链中包含的重复的dt核苷酸(脱氧胸苷酸)的dna模板连接。编码poly(a)序列的dna序列(编码链)称为poly(a)盒。
在本发明的一个优选实施方案中,存在于dna编码链中的3’poly(a)盒基本上由da核苷酸组成,但被具有相等分布的四种核苷酸(da、dc、dg、dt)的随机序列中断。这种随机序列的长度可以是5至50,优选10至30,更优选10至20个核苷酸。这样的盒在wo2016/005004a1中公开。wo2016/005004a1中公开的任何poly(a)盒可用于本发明。基本上由da核苷酸组成但被具有相等分布的四种核苷酸(da、dc、dg、dt)的随机序列中断并且长度为例如5至50个核苷酸的poly(a)盒在dna水平上显示质粒dna在大肠杆菌中的恒定增殖,并且在rna水平上仍然与关于支持rna稳定性和翻译效率的有益特性相关。
因此,在本发明的一个优选实施方案中,本文所述的rna分子中包含的3’poly(a)序列基本上由a核苷酸组成,但被具有具有相等分布的四种核苷酸(da、dc、dg、dt)的随机序列中断。这种随机序列的长度可以是5至50,优选10至30,更优选10至20个核苷酸。
密码子使用
一般而言,遗传密码的简并性将允许用其他密码子(碱基三联体)替换存在于rna序列中的某些密码子(碱基三联体),同时保持相同的编码能力。在本发明的一些实施方案中,由rna分子包含的开放阅读框的至少一个密码子与开放阅读框起源的物种中的相应开放阅读框中的相应密码子不同。在该实施方案中,开放阅读框的编码序列被称为“经调整的”。
例如,当调整开放阅读框的编码序列时,可以选择常用的密码子:wo2009/024567a1描述了核酸分子的编码序列的调整,涉及用更频繁使用密码子替换稀有密码子。由于密码子使用的频率取决于宿主细胞或宿主生物,因此该类型的调整适合于使核酸序列适合于在特定宿主细胞或宿主生物中的表达。一般而言,更常用的密码子通常在宿主细胞或宿主生物中更有效地翻译,尽管并不总是需要对开放阅读框的所有密码子进行调整。
例如,当调整开放阅读框的编码序列时,可以通过选择每种氨基酸的具有最高gc含量的密码子来改变g(鸟苷酸)残基和c(胞苷酸酯)残基的含量。据报道,具有富含gc的开放阅读框的rna分子具有降低免疫激活和改善rna的翻译和半衰期的潜力(thess等,2015,mol.ther.23,1457-1465)。
可以分别对编码根据本发明的复制酶的开放阅读框进行调整。
复制子的表征
本发明的系统包含复制子。能够通过复制酶,优选甲病毒复制酶复制的核酸构建体被称为复制子。通常,根据本发明的复制子是rna分子。
根据本发明,术语“复制子”定义了可以通过rna依赖性rna聚合酶复制的rna分子,其在没有dna中间体的情况下产生rna复制子的一个或更多个相同或基本相同的拷贝。“没有dna中间体”意指在形成rna复制子拷贝的过程中没有形成复制子的脱氧核糖核酸(dna)拷贝或互补序列,和/或在形成rna复制子拷贝或其互补序列的过程中没有使用脱氧核糖核酸(dna)分子作为模板。
根据本发明,术语“可以被复制”通常描述可以制备一种或更多种相同或基本相同的核酸拷贝。当与术语“复制酶”一起使用时,例如“可以通过复制酶复制”,术语“可以复制”描述复制子相对于复制酶的功能特征。这些功能特征包括至少以下一种:(i)复制酶能够识别复制子和(ii)复制酶能够用作rna依赖性rna聚合酶(rdrp)。优选地,复制酶能够(i)识别复制子和(ii)用作rna依赖性rna聚合酶二者。rna依赖性rna聚合酶可以使用复制子、其互补序列或其任何部分作为模板。
“能够识别”的表述描述了复制酶能够与复制子物理缔合,并且优选地,复制酶能够与复制子结合,通常是非共价的。术语“结合”可以意指复制酶具有与保守序列元件1(cse1)或其互补序列(如果由复制子包含)、保守序列元件2(cse2)或其互补序列(如果由复制子包含)、保守序列元件3(cse3)或其互补序列(如果由复制子包含)、保守序列元件4(cse4)或其互补序列(如果由复制子包含))中的任何一个或更多个结合的能力。优选地,复制酶能够与cse2[即与(+)链]和/或与cse4[即与(+)链]结合,或与cse1的互补序列[即与(-)链]和/或与cse3的互补序列[即与(-)链]结合。
“能够充当rdrp”的表述包含如下含义:复制酶能够催化甲病毒基因组(+)链rna合成(-)链互补,其中(+)链rna具有模板功能,和/或该复制酶能够催化合成(+)链甲病毒基因组rna,其中(-)链rna具有模板功能。通常,表达“能够充当rdrp”还可以包含复制酶能够催化合成(+)链亚基因组转录物,其中(-)链rna具有模板功能,并且其中合成(+)链亚基因组转录物通常在甲病毒亚基因组启动子处起始。
“能够结合”和“能够充当rdrp”的表述是指在正常生理条件下的能力。特别地,该表述是指表达甲病毒复制酶或已经用编码甲病毒复制酶的核酸转染之细胞内的条件。细胞优选是真核细胞。结合能力和/或用作rdrp的能力可以例如,在无细胞的体外系统或真核细胞中通过实验测试。任选地,所述真核细胞是来自其中代表复制酶起源的特定甲病毒是感染性的物种的细胞。例如,当使用对人具有感染性的来自特定甲病毒的甲病毒复制酶时,正常的生理条件是人细胞中的条件。更优选地,真核细胞(在一个实例中是人细胞)来自与代表复制酶起点的特定甲病毒对其是感染性的相同组织或器官。
鉴于这些功能特性,本发明的复制子和本发明的复制酶构建体形成功能对。甲病毒复制酶可以是根据本发明的任何甲病毒复制酶,并且复制子rna的核苷酸序列没有特别限制,只要该复制子可以通过甲病毒复制酶反式复制即可。
当将本发明的系统引入细胞,优选真核细胞中时,可以对在复制酶构建体上编码的复制酶进行翻译,从而产生复制酶。翻译后,复制酶能够反式复制rna复制子。因此,本发明提供了用于反式复制rna的系统。因此,本发明的系统是反式复制系统。因此,根据本发明的复制子是反式复制子。
本文中,反式(例如在反式作用,反式调节的情况下)通常意指“来自不同分子的作用”(即,分子间)。它与顺式相反(例如在顺式作用,顺式调节的情况下),后者通常意指“来自同一分子的作用”(即,分子内)。在rna合成(包括转录和rna复制)的背景下,反式作用元件包括含有编码能够进行rna合成的酶(rna聚合酶)的基因的核酸序列。复制酶在合成第二核酸分子(即不同分子)中起作用。反式作用rna和其编码的蛋白质都被称为“反式作用于”靶基因。在本发明的上下文中,反式作用rna编码甲病毒rna聚合酶。甲病毒rna聚合酶能够复制rna,因此称为复制酶。该复制酶反式作用于第二rna分子(复制子)。根据本发明可以通过复制酶反式复制的复制子在本文中同义地称为“反式复制子”或“根据本发明的复制子”。
最初在20世纪80年代发现了甲病毒复制酶通常能够反式识别并复制模板rna的事实,但是反式复制用于生物医学应用的潜力尚未得到认可,尤其是因为反式复制的rna被认为抑制有效复制:在感染细胞中有缺陷的干扰(defectiveinterfering,di)rna与甲病毒基因组共复制的情况下发现(barrett等,1984,j.gen.virol.,第65卷(pt8),第1273-1283页;lehtovaara等,1981,proc.natl.acad.sci.u.s.a,第78卷,第5353-5357页;pettersson,1981,proc.natl.acad.sci.u.s.a,v第78卷,第115-119页)。dirna是反式复制子,其可以在具有高病毒载量的细胞系感染期间准自然地发生。di元件如此有效地共复制以降低亲本病毒的毒力,从而起抑制性寄生rna的作用(barrett等,1984,j.gen.virol.,第65卷(pt11),第1909-1920页)。虽然没有认识到生物医学应用的潜力,但是在一些旨在阐明复制机制的基础研究中使用了反式复制现象,而不需要顺式地从相同分子表达复制酶;此外,复制酶和复制子的分离也允许涉及病毒蛋白突变体的功能研究,即使相应的突变体是功能丧失的突变体(lemm等,1994,emboj.,第13卷,第2925-2934页)。这些功能丧失研究和dirna并未表明基于甲病毒元件的反式激活系统最终可用于治疗目的。用于将rna体内递送至脊椎动物的最近的方法建议了包含自我复制rna分子的顺式复制系统(wo2012/006376a2)。
与现有技术中的建议相反,本发明的反式复制系统非常适合于基因表达:其伴随着高表达水平、高抗原滴度,并且即使当编码抗原的rna水平相对较低也能实现接种动物的令人满意的存活程度。特别地,施用本发明系统的1μg反式复制子-rna可以引起与施用5μg顺式复制子相当的病毒中和滴度和ha滴度(参见实施例6和图7)。这体现了对本领域的显著贡献,特别是动物疫苗接种领域的进步,因为可以降低编码疫苗的核酸的总量。这节省了生产成本和时间,并且至少由于以下原因而重要:
首先,本发明系统(包括两个独立的rna分子)的多功能性允许复制子和复制酶构建体可以在不同时间和/或不同位点设计和/或制备。在一个实施方案中,在第一时间点制备复制酶构建体,并在稍后的时间点制备复制子。例如,在其制备之后,复制酶构建体可以储存以供稍后使用。与顺式复制子相比,本发明提供了提高的灵活性:当出现新的病原体时,通过将编码引发针对新病原体的免疫应答的多肽的核酸克隆到复制子中,本发明的系统可以设计用于疫苗接种。可以从储存中回收先前制备的复制酶构建体。因此,在设计和制备复制酶构建体时,不需要已知特定病原体的性质或特定病原体的抗原。因此,在设计和制备复制酶构建体时,不需要编码引发针对特定新病原体的免疫应答的多肽的复制子可用。换句话说,可以独立于任何特定的复制子设计和制备复制酶构建体。这允许对新病原体或以至少一种新抗原的表达为特征的病原体的出现迅速作出反应,因为缺乏复制酶的复制子的制备比顺式复制子的制备需要更少的努力和资源。历史告诉我们需要一种允许对病原体快速反应的系统:这通过例如近年来由于引起严重急性呼吸综合征(severeacuterespiratorysyndrome,sars)的病原体、埃博拉病毒和多种流感病毒亚型的出现说明。
第二,在动物疫苗接种的情况下,疫苗的成本是其在兽医和农业社区取得成功的关键。由于本发明的复制子可以在功能性甲病毒非结构蛋白的存在下复制,例如,在接种疫苗的动物的细胞中,所以即使施用相对低量的复制子rna,也可以实现目的基因的高水平表达。少量复制子rna对每个对象的疫苗成本产生积极影响。
第三,根据本发明的反式复制子通常是比典型的顺式复制子更短的核酸分子。这使得能够更快地克隆编码目的蛋白(例如,免疫原性多肽)的复制子,并提供高产量的目的蛋白(例如参见实施例1)。
在一个优选的实施方案中,可以通过来自赛姆利基森林病毒(包括天然存在的赛姆利基森林病毒和赛姆利基森林病毒的变体或衍生物,例如减毒的赛姆利基森林病毒)的甲病毒复制酶对复制子进行复制。在一个作为替选的优选实施方案中,可以通过来自辛德毕斯病毒(包括天然存在的辛德毕斯病毒和辛德毕斯病毒的变体或衍生物,例如减毒的辛德毕斯病毒)的甲病毒复制酶对复制子进行复制。在一个作为替选的优选实施方案中,可以通过来自委内瑞拉马脑炎病毒(veev)(包括天然存在的veev和veev的变体或衍生物,例如减毒的veev)的甲病毒复制酶对复制子进行复制。
根据本发明的rna复制子优选是单链rna分子。通常,编码单链的核酸分子包含两倍于每重量单位(例如μg)核酸材料的遗传信息。因此,与例如spuul等人(同上)所使用的双链现有技术dna载体相比,单链性质代表了另一个优点。根据本发明的复制子通常是(+)链rna分子。
在一个实施方案中,rna复制子是分离的核酸分子。
本发明的反式复制系统适合于接种宿主细胞和目的基因在宿主细胞中表达(参见例如实施例1-3)。在本发明的一些实验实施例中,反式复制子rna包含作为目的基因的编码报告蛋白(例如荧光蛋白,例如gfp或egfp)的基因,其允许容易地确定各目的基因的表达效率。如实施例2中所示,与顺式复制(egfp复制子rna)相比,包含两种rna的反式复制系统与显著更高的目的基因表达效率相关。
本发明的反式复制系统适合于目的基因在人或动物中有效表达,例如,适合于高水平表达。特别地,实施例5表明可以有效地产生报告蛋白,并且实施例6表明在通过本发明的系统处理的动物中可以实现免受病原体感染的治疗效果。
不希望受到任何特定理论的束缚,可以设想例如在自然界中发现的典型甲病毒中编码复制酶的约7400个核苷酸,由于需要扩增全长复制子,因此其对细胞造成负担。可以设想当非复制性复制酶构建体,例如,非复制型复制酶构建体(例如以mrna的形式)用于复制酶表达时,这种负荷的主要部分被消除。这允许将反式复制子用于rna扩增和转基因表达。如果复制酶构建体不在细胞中复制(即,复制的唯一外来构建体是本发明的反式复制子),则避免了细胞能量和资源(核苷酸等)的浪费,这可以解释优异的表达水平。此外,较短的复制子rna可能需要较少的时间用于rna合成。因此可以设想,节省时间、细胞能量和/或资源有助于更高水平的复制。
保守序列元件
在一个实施方案中,复制子是甲病毒基因组rna或包含甲病毒基因组rna或来源于甲病毒基因组rna。在一个实施方案中,根据本发明的复制子包含一种或更多种保守序列元件(cse)(strauss&strauss,microbiol.rev.,1994,第58卷,第491-562页)。特别地,复制子可以包含自然界中发现的甲病毒或其变体或衍生物的保守序列元件(cse)的一种或更多种:
-cse1,其被认为作为从(-)链模板合成(+)链的启动子。如果存在,cse1通常位于复制子rna的5’端或附近。
-cse2,其被认为充当从基因组(+)链rna模板合成(-)链的启动子或增强子。如果存在,cse2通常位于cse1的下游,但位于cse3的上游。
-cse3,其被认为有助于亚基因组rna的有效转录;如果存在,cse3通常位于目的基因(如果有的话)的编码序列的上游,但位于cse2的下游。
-cse4,其被认为是作为启动(-)链合成的核心启动子。如果存在,cse4通常位于目的基因(如果有的话)的编码序列的下游。无论如何,cse4通常存在于cse3的下游。hardy和rice,j.virol.,2005,第79卷,第4630-4639页中已经描述了在不同的甲病毒中cse4(也被称为3’cse)序列的细节,并且在本发明中,例如,可以根据该文献的教导选择cse4的序列。
在一个实施方案中,根据本发明的rna复制子包含:
甲病毒5’复制识别序列,和
甲病毒3’复制识别序列。
在一个实施方案中,甲病毒5’复制识别序列包含甲病毒cse1和/或cse2。在天然存在的甲病毒中,cse1和/或cse2通常包含在5’复制识别序列中。
在一个实施方案中,甲病毒3’复制识别序列包含甲病毒cse4。在天然存在的甲病毒中,cse4通常包含在3’复制识别序列中。
在一个实施方案中,甲病毒5’复制识别序列和甲病毒3’复制识别序列能够在复制酶的存在下指导根据本发明的rna复制子的复制。因此,当单独存在或优选地共同存在时,这些识别序列在复制酶的存在下指导rna复制子复制。不希望受到任何特定理论的束缚,应理解甲病毒保守序列元件(cse)1、2和4是(或包含于)在复制酶的存在下指导rna复制子复制的识别序列。因此,在该实施方案中,复制子通常包含cse1、2和4。
优选地,由复制酶构建体编码的复制酶是甲病毒复制酶,其能够识别复制子的甲病毒5’复制识别序列和甲病毒3’复制识别序列两者。
在一个实施方案中,当甲病毒5’复制识别序列和甲病毒3’复制识别序列对于复制酶所来源的甲病毒是天然的时,实现了这一点。天然意指这些序列的天然来源是相同的甲病毒。在一个实施方案中,cse1、cse2和cse4对于复制酶所来源的甲病毒是天然的。
在一个作为替选的实施方案中,如果甲病毒复制酶能够识别复制子的5’复制识别序列(和/或cse1和/或cse2)和3’复制识别序列(和/或cse4)两者,则5’复制识别序列(和/或cse1和/或cse2)和/或甲病毒3’复制识别序列(和/或cse4)对于该复制酶所来源的甲病毒是非天然的。换言之,该复制酶与5’复制识别序列(和/或cse1和/或cse2)和3’复制识别序列(和/或cse4)相容。当非天然甲病毒复制酶能够识别相应的序列或序列元件时,该复制酶被认为是相容的(交叉病毒相容性)。关于(3’/5’)复制识别序列和cse分别与来自不同甲病毒的非天然复制酶的交叉病毒相容性的实例是本领域已知的(例如,由strauss&strauss综述,microbiol.rev.,1994,第58卷,第491-562页)。只要存在交叉病毒相容性,(3’/5’)复制识别序列和cse分别与甲病毒复制酶的任何组合都是可能的。通过将待测的复制酶与rna一起孵育,本发明的技术人员可以容易地测试交叉病毒的相容性,其中rna在适合于rna的条件下(例如在合适的宿主细胞中)具有待测的3’-和5’复制识别序列。如果复制发生,则确定(3’/5’)复制识别序列和该复制酶是相容的。
亚基因组启动子
在特定实施方案中,根据本发明的rna复制子包含表达控制序列。典型的表达控制序列是启动子或包含启动子。在一个实施方案中,根据本发明的rna复制子包含亚基因组启动子。优选地,亚基因组启动子是甲病毒亚基因组启动子。亚病毒启动子的核苷酸序列在甲病毒中是高度保守的(strauss&strauss,microbiol.rev.,1994,第58卷,第491-562页)。
优选地,亚基因组启动子是甲病毒结构蛋白的启动子。这意味着亚基因组启动子是对于甲病毒天然并且控制所述甲病毒中一种或更多种结构蛋白的基因转录的启动子。
优选地,亚基因组启动子与复制酶构建体的复制酶相容。在本上下文中,相容意指甲病毒复制酶能够识别亚基因组启动子。因此,优选地,由复制酶构建体编码的复制酶是能够识别复制子亚基因组启动子的甲病毒复制酶。
在一个实施方案中,这在当亚基因组启动子对于复制酶所来源的甲病毒是天然的时得以实现。天然意指亚基因组启动子和该复制酶的天然来源是相同的甲病毒。
在一个作为替选的实施方案中,如果甲病毒复制酶能够识别复制子的亚基因组启动子,则亚基因组启动子对于复制酶所来源的甲病毒是非天然的。换言之,复制酶与亚基因组启动子相容(交叉病毒相容性)。只要存在交叉病毒相容性,亚基因启动子和复制酶的任何组合都是可能的。通过使待测的复制酶与rna一起孵育,本发明的技术人员可以容易地测试交叉病毒相容性,其中在适合于从亚基因组启动子合成rna的条件下,rna含有待测的亚基因组启动子。如果制备了亚基因组转录物,则确定亚基因组启动子和复制酶是相容的。已知交叉病毒相容性的多种实例:在一些情况下,非天然亚基因组启动子甚至引起比天然亚基因组启动子更有效的转录(由strauss&strauss综述,microbiol.rev.,1994,第58卷,第491-562页)。
优选地,根据本发明的复制子包含来自甲病毒的保守序列元件3(cse3)。cse3被认为有助于亚基因组rna的有效转录。已知当存在cse3时,亚基因组rna的转录非常有效地发生。通常,cse3是约24个核苷酸的多核苷酸段。在甲病毒基因组中,cse3位于非结构蛋白和结构蛋白的编码序列之间的连接区。在本发明的反式复制子中,cse3通常存在于受到亚基因组启动子控制的开放阅读框(orf)的上游(5’)。在根据本发明的复制子含有一个受亚基因组启动子控制的orf的情况下,cse3位于该一个orf的5’。在根据本发明的复制子含有多于一个受到亚基因组启动子控制的orf的情况下,cse3可以位于每个这样的orf的5’。在一个实施方案中,cse3对于复制酶所来源的甲病毒是天然的。在一个作为替选的实施方案中,如果甲病毒复制酶能够识别复制子的cse3,则cse3对于复制酶所来源的甲病毒是非天然的。
复制子的任选其他特征
在一个实施方案中,根据本发明的rna复制子包含3’poly(a)序列。已经描述了甲病毒rna的poly(a)序列在病毒非结构蛋白的翻译效率和rna稳定性中起作用,类似于其在细胞mrna中的作用(hardy和rice,j.virol.,2005,第79卷,第4630-4639页)。在本发明中,设想poly(a)序列在目的基因的翻译效率和复制子稳定性中起作用。根据本发明的复制子的3’poly(a)序列的实施方案和优选实施方案可以从本文所公开的复制酶构建体的3’poly(a)序列的那些实施方案中选择。除此之外,在一个实施方案中,poly(a)序列(如果存在于根据本发明的复制子上)处于甲病毒保守序列元件4(cse4)之前。优选地,其与cse4直接相邻,使得cse4的最3’核苷酸与poly(a)尾的最5’a核苷酸直接相邻。
在一个实施方案中,根据本发明的rna复制子包含5’-帽(包括帽类似物)。为了说明,在图1中,帽(或帽类似物)由字母c表示。除了帽的存在对rna复制子的情况不是必需的之外,根据本发明的复制子的帽(或类似物)的方面与本文所述的复制酶构建体的帽(或类似物)的方面相同。因此,在一个作为替选的实施方案中,根据本发明的rna复制子不包含帽。在该实施方案中,其可以包含游离的5’oh端,或任何合适的5’修饰。尽管图1示意性地描述了其中rna复制子包含用字母c表示的帽的作为替选的实施方案,该实施方案同样包含本发明。
在一个实施方案中,存在于根据本发明的复制子(如果有的话)上的开放阅读框的编码序列是经过调整的。根据本发明的复制子的密码子调整的实施方案和优选实施方案可以从本文所公开的复制酶构建体的密码子适用的情况的那些实施方案中选择。开放阅读框的密码子可以适合于在宿主细胞或宿主生物体中表达。
异源核酸序列
在一个实施方案中,复制子另外包含至少一种不来源于病毒,特别是不来源于甲病毒的核酸序列。在优选的实施方案中,根据本发明的rna复制子包含异源核酸序列。根据本发明,术语“异源”是指核酸序列不与甲病毒核酸序列(例如甲病毒表达控制序列,特别是甲病毒亚基因组启动子)天然功能性连接的情况。异源核酸序列包含复制子的核酸序列。
优选地,异源核酸序列受到亚基因组启动子,优选甲病毒亚基因组启动子的控制。更优选地,异源核酸序列位于亚基因组启动子的下游。甲病毒亚基因组启动子非常有效,因此适合于高水平的异源基因表达(josé等,futuremicrobiol.,2009,第4卷,第837-856页)。优选地,亚基因组启动子控制包含异源核酸序列的转录物或其部分的亚基因组rna的产生。
优选地,亚基因组启动子是甲病毒结构蛋白的启动子。这意味着亚基因组启动子是对于甲病毒天然的、并且控制所述甲病毒中一种或更多种结构蛋白的编码序列的转录的启动子。根据本发明,异源核酸序列可以部分或完全取代病毒核酸序列,例如编码甲病毒结构蛋白的核酸序列。优选地,异源核酸序列不来源于甲病毒;特别地,优选地异源核酸序列不来源于与亚基因组启动子所来源的甲病毒相同的甲病毒。在一个实施方案中,复制子包含cse3,并且异源核酸序列与cse3是异源的。
目的蛋白
在一个实施方案中,根据本发明的rna复制子包含编码目的肽或目的蛋白的开放阅读框。优选地,目的蛋白由异源核酸编码。优选地,编码目的蛋白的基因(即目的基因)与表达控制序列共同存在。优选地,目的基因受到启动子的控制,优选地受到如本文所述的亚基因组启动子的控制。更优选地,目的基因位于亚基因组启动子的下游。
编码目的蛋白的基因同义地被称为“目的基因”或“转基因”。转基因存在于根据本发明的复制子上,优选受到亚基因组启动子的控制,因此其定位类似于甲病毒中结构基因的定位。优选地,亚基因组启动子下游的位置使得亚基因组转录物包含目的基因转录物。优选地,目的基因包含含有包含起始密码子(碱基三联体),通常是aug(在rna分子中)或atg(在相应的dna分子中)的开放阅读框。
优选地,在根据本发明的复制子rna包含至少一个开放阅读框(蛋白质编码区)的情况下,复制子是mrna分子。
根据本发明的复制子可以编码单个多肽或多个多肽。多个多肽可以编码为单个多肽(融合多肽)或分开的多肽。如果多肽被编码为单独的多肽,则可以向这些多肽中的一个或更多个提供上游ires或另外的病毒启动子元件。或者,根据本发明的复制子可以包含多于一个的开放阅读框,每个开放阅读框都受到亚基因组启动子的控制。当将这样的多orf复制子位于真核细胞中时,将制备多种亚基因组转录物,每种亚基因组转录物由其本身的亚基因组启动子启动(strauss&strauss,microbiol.rev.,1994,第58卷,第491-562页)。或者,多蛋白或融合多肽包含由自催化蛋白酶(例如口蹄疫病毒2a蛋白)或内含肽分离的单个多肽。
优选地,编码目的蛋白的开放阅读框对于复制酶所来源的甲病毒是非天然的。优选地,受到亚基因组启动子控制的开放阅读框不编码任何甲病毒蛋白。在优选的实施方案中,受到亚基因组启动子控制的开放阅读框不编码任何全长甲病毒非结构蛋白(nsp)或其片段,和/或不编码任何全长甲病毒结构蛋白(sp)或其片段。优选地,受到亚基因组启动子控制的编码目的蛋白的开放阅读框不编码任何甲病毒结构蛋白。在一个实施方案中,本发明的系统不包含编码一种或更多种甲病毒结构蛋白的核酸序列。在一个实施方案中,系统不包含编码任何核心核衣壳蛋白c、包膜蛋白p62和/或包膜蛋白e1的核酸序列。
本发明的系统的一个优点是它不需要存在或施用编码甲病毒结构蛋白的辅助病毒。这与现有技术(例如bredenbeek等,j.virol,1993,第67卷,第6439-6446页,其描述了能够将缺少结构蛋白orf的复制子载体包装到病毒颗粒中的反式复制系统,其中结构蛋白必须由辅助rna反式表达)相比是有利的。这些编码甲病毒结构蛋白的辅助rna的复制通常依赖于由编码抗原的复制子rna表达的复制酶。辅助rna本身缺乏功能性复制酶,其仅含有复制所需的保守rna序列元件(smerdou和
在一个实施方案中,开放阅读框编码报告蛋白。在该实施方案中,开放阅读框包含报告基因。可以选择某些基因作为报告基因,因为它们赋予表达它们的细胞或生物的特征可以容易地鉴定和测量,或者因为它们是可选择的标记。报告基因通常用作指示某种基因是否被细胞或生物群体吸收或表达。优选地,报告基因的表达产物是视觉上可检测的。常见的视觉可检测的报告蛋白通常具有荧光或发光蛋白。特定报告基因的实例包括编码以下的基因:水母绿色荧光蛋白(gfp),其导致表达它的细胞在蓝光下发出绿光;酶萤光素酶,其催化与萤光素反应产生光;以及红色荧光蛋白(rfp)。任何这些特定报道基因的变体都是可能的,只要该变体具有视觉上可检测的特性即可。例如,egfp是gfp的点突变体变体。报告蛋白实施方案特别适合于在体外和体内测试由本发明的反式复制系统介导的表达,参见例如实施例2和4。例如,在两种情况下(分别为顺式复制系统和反式复制系统),报告蛋白的存在预示着制备了包含编码报告蛋白的核酸序列的亚基因组转录物。反之,细胞中亚基因组转录物的产生预示着复制酶构建体存在于该细胞中,并且表达复制酶基因。
在一个替选的实施方案中,开放阅读框不编码报告蛋白。例如,当本发明的系统被设计用于将药学活性肽或蛋白质引入人或动物对象中时,例如如实施例6中所示,可能没有荧光报告蛋白被编码。例如,药学活性蛋白质可以是由受到亚基因组启动子控制的开放阅读框编码的唯一蛋白质。
根据本发明,在一个实施方案中,复制子的rna包含药学活性rna或由药学活性rna组成。“药物活性rna”可以是编码药学活性肽或蛋白质的rna。优选地,根据本发明的rna复制子编码药学活性肽或蛋白质。优选地,开放阅读框编码药学活性肽或蛋白质。优选地,rna复制子包含编码药学活性肽或蛋白质的开放阅读框,其优选地受到亚基因组启动子控制。
当以治疗有效量施用于对象时,“药学活性肽或蛋白质”对对象的病症或疾病状态具有积极或有利的作用。优选地,药学活性肽或蛋白质具有治疗或缓解性质,并且可以施用以改善、减轻、缓解、逆转疾病或病症的一种或更多种症状,延迟其发作或减轻其严重性。药学活性肽或蛋白质可具有预防性质,并且可以用于延迟疾病的发作或减轻这种疾病或病理状况的严重性。术语“药学活性肽或蛋白质”包括完整蛋白质或多肽,并且还可以指其药学活性片段。其还可以包括肽或蛋白质的药学活性类似物。术语“药学活性肽或蛋白质”包括作为抗原的肽和蛋白质,即肽或蛋白质在对象中引发免疫应答,其可以是治疗性的或部分或完全保护性的。药学活性肽或蛋白质也可以被称为治疗性肽或治疗性蛋白质。
在一个实施方案中,药学活性肽或蛋白质是免疫活性化合物或抗原或表位或者包含免疫活性化合物或抗原或表位。
根据本发明,术语“免疫活性化合物”涉及改变免疫应答的任何化合物,优选通过诱导和/或抑制免疫细胞的成熟,诱导和/或抑制细胞因子生物合成,和/或通过刺激b细胞的抗体产生而改变体液免疫来改变。在一个实施方案中,免疫应答涉及刺激抗体应答(通常包括免疫球蛋白g(igg))。免疫活性化合物具有强力的免疫刺激活性,包括但不限于抗病毒和抗肿瘤活性,并且还可以下调免疫应答的其他方面,例如使免疫应答离开th2免疫应答,这对于治疗大量th2介导的疾病是有用的。
根据本发明,术语“抗原”或“免疫原”涵盖引发免疫应答的任何物质。特别地,“抗原”涉及与抗体或t淋巴细胞(t细胞)特异性反应的任何物质。根据本发明,术语“抗原”包括包含至少一个表位的任何分子。优选地,在本发明的上下文中的抗原是任选地在加工后诱导免疫反应的分子,所述免疫反应优选是抗原特异的。根据本发明,可以使用任何合适的抗原,其是免疫反应的候选物,其中免疫反应可以是体液免疫反应也可以是细胞免疫反应。在本发明实施方案的上下文中,在mhc分子的情况下,抗原优选由细胞,优选由抗原呈递细胞呈递,其导致针对抗原的免疫反应。抗原优选是对应于或来源于天然存在的抗原的产物。这些天然存在的抗原可以包括或可以来源于变应原、病毒、细菌、真菌、寄生虫和其他感染因子和病原体,或者抗原也可以是肿瘤抗原。根据本发明,抗原可以对应于天然存在的产物,例如病毒蛋白或其部分。在一个优选的实施方案中,抗原是表面多肽,即是在细胞、病原体、细菌、病毒、真菌、寄生虫、变应原或肿瘤的表面上天然展示的抗原。抗原可以引发针对细胞、病原体、细菌、病毒、真菌、寄生虫、变应原或肿瘤的免疫应答。
术语“病原体”是指能够在生物体,优选在脊椎动物生物体中引起疾病的致病生物材料。病原体包括微生物,如细菌、单细胞真核生物(原生动物)、真菌、以及病毒。
术语“表位”、“抗原肽”、“抗原表位”、“免疫原性肽”和“mhc结合肽”在本文中可互换使用,并且指分子(如抗原)中的抗原决定簇,即,免疫活性化合物的被免疫系统识别,例如被t细胞识别的部分或片段,特别是当在mhc分子的情况下呈递时。蛋白质的表位优选包含所述蛋白质的连续的或不连续的部分,并且优选长度为5至100,优选5至50、更优选8至30、最优选10至25个氨基酸,例如,表位的长度可以优选为9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25个氨基酸。根据本发明,表位可以与mhc分子,例如细胞表面上的mhc分子结合,因此可以是“mhc结合肽”或“抗原肽”。术语“主要组织相容性复合物”和缩写“mhc”包括mhci类和mhcii类分子,并且涉及存在于所有脊椎动物中的基因复合物。mhc蛋白质或分子对于免疫反应中淋巴细胞和抗原呈递细胞或患病细胞之间的信号传导是重要的,其中mhc蛋白质或分子结合肽并呈递它们以供t细胞受体识别。由mhc编码的蛋白质在细胞表面上表达,并将自身抗原(来自细胞本身的肽片段)和非自身抗原(例如入侵微生物的片段)展示给t细胞。优选的此类免疫原性部分与mhci类或ii类分子结合。如本文所用,如果使用本领域已知的任何测定法检测到这种结合,则称免疫原性部分与mhci类或ii类分子“结合”。术语“mhc结合肽”涉及与mhci类和/或mhcii类分子结合的肽。在i类mhc/肽复合物的情况下,结合肽的长度通常为8-10个氨基酸,尽管更长或更短的肽也可能是有效的。在ii类mhc/肽复合物的情况下,结合肽的长度通常为10-25个氨基酸,特别地长度为13-18个氨基酸,而更长和更短的肽也可能是有效的。
在一个实施方案中,根据本发明的目的蛋白包含适于靶生物的疫苗接种的表位。本领域技术人员知道,免疫生物学和疫苗接种的原理之一是基于以下事实:通过用与待治疗疾病在免疫学上相关的抗原来免疫生物体,产生了免疫保护反应。根据本发明,抗原选自自身抗原和非自身抗原。非自身抗原优选为细菌抗原、病毒抗原、真菌抗原、变应原或寄生虫抗原。优选地,抗原包含能够在靶生物体中引发免疫应答的表位。例如,表位可以引发针对细菌、病毒、真菌、寄生虫、变应原或肿瘤的免疫应答。
在一些实施方案中,非自身抗原是细菌抗原。在一些实施方案中,抗原引发针对感染动物的细菌的免疫应答,所述动物包括鸟类、鱼类和哺乳动物,包括家养动物。优选地,引发针对其的免疫应答的细菌是致病细菌。
在一些实施方案中,非自身抗原是病毒抗原。病毒抗原可以是例如来自病毒表面蛋白的肽,例如衣壳多肽或刺突多肽。在一些实施方案中,抗原引发针对感染动物的病毒的免疫应答,所述动物包括鸟类、鱼类和哺乳动物,包括家养动物。优选地,引发针对其的免疫应答的病毒是致病病毒。
在一些实施方案中,非自身抗原是来自真菌的多肽或蛋白质。在一些实施方案中,抗原引发针对感染动物的真菌的免疫应答,所述动物包括鸟类、鱼类和哺乳动物,包括家养动物。优选地,引发针对其的免疫应答的真菌是致病真菌。
在一些实施方案中,非自身抗原是来自单细胞真核寄生虫的多肽或蛋白质。在一些实施方案中,抗原引发针对单细胞真核寄生虫,优选针对致病性单细胞真核寄生虫的免疫应答。致病性单细胞真核寄生虫可例如来自疟原虫(plasmodium)属,例如恶性疟原虫(p.falciparum)、间日疟原虫(p.vivax)、三日疟原虫(p.malariae)或卵形疟原虫(p.ovale),来自利什曼原虫(leishmania)属,或来自锥虫(trypanosoma)属,例如克氏锥虫(trypanosomacruzi)或布氏锥虫(t.brucei)。
在一些实施方案中,非自身抗原是变应原性多肽或变应原性蛋白。变应原性蛋白或变应原性多肽适用于变应原免疫治疗(也称为脱敏)。
在一些实施方案中,抗原是自身抗原,特别是肿瘤抗原。肿瘤抗原及其测定是本领域技术人员已知的。
在本发明的上下文中,术语“肿瘤抗原”或“肿瘤相关抗原”涉及在正常条件下在有限数量的组织和/或器官中或在特定发育阶段中特异性表达的蛋白质,例如,肿瘤抗原可以在正常条件下在胃组织(优选在胃粘膜)中,在生殖器官(例如在睾丸)中,在滋养细胞组织(例如在胎盘)中,或在种系细胞中特异性表达,并且在一种或更多种肿瘤或癌症组织中表达或异常表达。在本文中,“有限数量”优选表示不超过3个,更优选不超过2个。本发明上下文中的肿瘤抗原包括,例如:分化抗原,优选细胞类型特异性分化抗原,即,在正常条件下在特定分化阶段特定细胞类型中特异性表达的蛋白质;癌症/睾丸抗原,即在正常条件下在睾丸和有时在胎盘中特异性表达的蛋白质;和种系特异性抗原。在本发明的上下文中,肿瘤抗原优选与癌细胞的细胞表面缔合,并且优选正常组织中不表达或仅很少表达。优选地,肿瘤抗原或肿瘤抗原的异常表达鉴定癌细胞。在本发明的上下文中,由对象(例如患有癌症疾病的患者)中的癌细胞表达的肿瘤抗原优选是所述对象中的自身蛋白。在一些优选的实施方案中,本发明上下文中的肿瘤抗原在正常条件下在非必需的组织或器官中(即在被免疫系统损伤时不会导致对象死亡的组织或器官)或在免疫系统无法或几乎无法进入的身体器官或结构中特异性表达。优选地,在正常组织中表达的肿瘤抗原和在癌组织中表达的肿瘤抗原之间,肿瘤抗原的氨基酸序列相同。
可用于本发明的肿瘤抗原的实例是p53、art-4、bage、β-连环蛋白/m、bcr-ablcamel、cap-1、casp-8、cdc27/m、cdk4/m、cea,封闭蛋白家族的细胞表面蛋白,如claudin-6、claudin-18.2和claudin-12,c-myc、ct、cyp-b、dam、elf2m、etv6-aml1、g250、gage、gnt-v、gap100、hage、her-2/neu、hpv-e7、hpv-e6、hast-2、htert(或htrt)、lage、ldlr/fut,mage-a,优选mage-a1、mage-a2、mage-a3、mage-a4、mage-a5、mage-a6、mage-a7、mage-a8、mage-a9、mage-a10、mage-a11或mage-a12、mage-b、mage-c、mart-1/melan-a、mc1r、肌球蛋白/m、muc1、mum-1、-2、-3、na88-a、nf1、ny-eso-1、ny-br-1、p190minorbcr-abl、pm1/rara、prame、蛋白酶3、psa、psm、rage、ru1或ru2、sage、sart-或sart-3、scgb3a2、scp1、scp2、scp3、ssx、survivin、tel/aml1、tpi/m、trp-1、trp-2、trp-2/int2、tpte和wt。特别优选的肿瘤抗原包括claudin-18.2(cldn18.2)和claudin-6(cldn6)。
在一些实施方案中,不要求药学活性肽或蛋白质是引发免疫应答的抗原。合适的药学活性肽或蛋白质可选自以下:细胞因子和免疫系统蛋白质,例如免疫活性化合物(例如白细胞介素、集落刺激因子(csf)、粒细胞集落刺激因子(g-csf)、粒细胞-巨噬细胞集落刺激因子(gm-csf)、促红细胞生成素、肿瘤坏死因子(tnf)、干扰素、整合素、地址素、选择素、归巢受体、t细胞受体、免疫球蛋白)、激素(胰岛素、甲状腺激素、儿茶酚胺、促性腺激素、营养激素、催乳素、催产素、多巴胺、牛生长激素、瘦素等)、生长激素(例如人生长激素)、生长因子(例如表皮生长因子、神经生长因子、胰岛素样生长因子等)、生长因子受体、酶(组织纤溶酶原激活物、链激酶、胆固醇生物合成或降解、类固醇激素合成酶、激酶、磷酸二酯酶、甲基化酶、去甲基化酶、脱氢酶、纤维素酶、蛋白酶、脂肪酶、磷脂酶、芳香酶、细胞色素、腺苷酸或鸟苷酸环化酶、神经酰胺酶等)、受体(类固醇激素受体、肽受体)、结合蛋白(生长激素或生长因子结合蛋白等)、转录和翻译因子、抑制肿瘤生长的蛋白质(如抑制血管生成的蛋白质)、结构蛋白(如胶原蛋白、丝心蛋白、纤维蛋白原、弹性蛋白、微管蛋白、肌动蛋白和肌球蛋白)、血液蛋白(凝血酶、血清白蛋白、因子vii、因子viii、胰岛素、因子ix、因子x、组织纤溶酶原激活物、蛋白质c、血管性血友病因子、抗凝血酶iii、葡糖脑苷脂酶、促红细胞生成素粒细胞集落刺激因子(gcsf)或修饰的因子viii、抗凝血剂等。在一个实施方案中、根据本发明的药物活性蛋白质是参与调节淋巴样体内稳态的细胞因子,优选参与并优选诱导或增强t细胞的发育、引发、扩增、分化和/或存活的细胞因子。在一个实施方案中,细胞因子是白细胞介素,例如il-2、il-7、il-12、il-15或il-21。
本发明系统的多功能性
本发明系统的优点包括独立于核转录和在两个单独的rna分子上存在关键遗传信息,这提供了前所未有的设计自由度。鉴于其可彼此组合的多功能元件,本发明允许优化复制酶表达以获得所需水平的rna扩增,用于所需靶生物体,用于所需目的蛋白的产生水平等。可以独立设计可以通过反式复制酶复制的复制子。
例如,基于本文的公开内容,可以单独选择、设计和/或调整以下元件:复制酶构建体的加帽(特别是特定帽的选择);复制酶构建体的5’-utr;编码复制酶的orf编码序列(密码子优化);复制酶构建体的3’-utr;复制酶构建体的poly(a)尾;复制子的5’-utr(只要该复制子包含甲病毒复制酶的5’复制识别序列即可);亚基因组启动子序列;由复制子产生的亚基因组转录物的5’-utr;编码目的基因的orf的编码序列(密码子优化);复制子的和/或由复制子产生的亚基因组转录物的3’-utr(只要该复制子包含甲病毒复制酶的3’复制识别序列即可);复制子的和/或由复制子产生的亚基因组转录物的poly(a)尾。
除此之外,本发明允许体外或体内共同转染最佳量的复制子和复制酶构建体用于任何给定的细胞类型——静息或循环。
本发明实施例的安全特征
以下特征在本发明中是优选的,单独或以任何合适的组合:
优选地,本发明的系统不包含任何甲病毒结构蛋白,例如核心核衣壳蛋白c、包膜蛋白p62和/或包膜蛋白e1。
优选地,本发明的系统不是是颗粒形成系统。这意味着,在用本发明的系统接种宿主细胞后,宿主细胞不产生病毒颗粒,例如下一代病毒颗粒。在一个实施方案中,该系统完全不含编码任何甲病毒结构蛋白(例如核心核衣壳蛋白c,包膜蛋白p62和/或包膜蛋白e1)的遗传信息。本发明的这一方面在安全性方面提供了超过现有技术系统的另外价值,其中结构蛋白在反式复制辅助rna上编码(例如bredenbeek等,j.virol,1993,第67卷,第6439-6446页)。
优选地,复制子和复制酶构建体都不能驱动其自身的复制,即顺式复制。在一个实施方案中,复制子不编码功能性甲病毒复制酶。在一个实施方案中,复制酶构建体缺少基于(+)链模板的(-)链合成和/或基于基于(-)链模板的(+)链合成所需的至少一个序列元件(优选至少一个cse)。在一个实施方案中,复制酶构建体不包含cse1和/或cse4。
优选地,根据本发明的复制子和根据本发明的复制酶构建体均不包含甲病毒包装信号。例如,可以去除包含在sfv的nsp2编码区中的甲病毒包装信号(white等.1998,j.virol.,第72卷,第4320-4326页),例如,通过缺失或突变。去除甲病毒包装信号的合适方式包括调整nsp2编码区的密码子使用。遗传密码的简并性可以允许删除包装信号的功能而不影响编码的nsp2的氨基酸序列。
在一个实施方案中,本发明的系统是分离的系统。在该实施方案中,该系统不存在于细胞内,例如哺乳动物细胞内,或不存在于病毒衣壳内,例如在包含甲病毒结构蛋白的外壳内。在一个实施方案中,本发明的系统存在于体外。
干扰素(ifn)信号传导的抑制
已经报道,其中已经引入rna用于表达的细胞(特别是如果细胞用rna转染多次)的活力降低。作为解决方案,发现与ifn抑制剂共转染增强了其中表达rna的细胞的活力(wo2014/071963a1)。如wo2014/071963a1中所述的细胞内ifn信号传导或细胞外ifn信号传导的任何抑制剂都适合于本发明。优选地,抑制剂是ifni型信号传导抑制剂。
在本发明的一个实施方案中,本发明的系统可以被设计成用于增强翻译,特别是用于抑制对翻译的负面影响。这可以包括抑制细胞中的细胞内干扰素(ifn)信号传导和通过细胞外ifn阻止ifn受体的接合。通过阻止ifn受体被细胞外ifn结合并抑制细胞内的细胞内ifn信号传导,使得可以在细胞中稳定表达rna。作为替代或补充,阻止ifn受体被细胞外ifn结合并抑制细胞内ifn信号传导增强了细胞的存活,特别是如果细胞用rna重复转染的情况下。不希望受理论束缚,设想细胞内ifn信号传导可导致翻译和/或rna降解的抑制。这可以通过抑制一种或更多种ifn诱导型抗病毒活性效应蛋白来解决。ifn诱导型抗病毒活性效应蛋白可选自rna依赖性蛋白激酶(pkr)、2’,5’-寡腺苷酸合成酶(oas)和rna酶l。抑制细胞内ifn信号传导可包括抑制pkr依赖性途径和/或oas依赖性途径。抑制pkr依赖性途径可包括抑制eif2-α磷酸化。抑制pkr可包括用至少一种pkr抑制剂处理细胞。pkr抑制剂可以是pkr的病毒抑制剂。pkr的优选的病毒抑制剂是痘苗病毒e3。如果用肽或蛋白质(例如e3、k3)抑制细胞内ifn信号传导,则优选肽或蛋白质的细胞内表达。
痘苗病毒e3是25kdadsrna结合蛋白(由基因e3l编码),其结合并隔离dsrna以阻止pkr和oas的活化。e3可以直接结合pkr并抑制其活性,导致eif2-α的磷酸化降低。其他合适的ifn信号传导抑制剂是单纯疱疹病毒icp34.5、托斯卡纳病毒nss、家蚕核多角体病毒pk2和hcvns34a。
细胞内ifn信号传导的抑制剂可以以编码细胞内ifn信号传导抑制剂的核酸序列(例如rna)的形式提供给细胞。
在一个实施方案中,细胞内或细胞外ifn信号传导的抑制剂由mrna分子编码。该mrna分子可以包含如本文所述的非多肽序列修饰之修饰,例如帽、5’-utr、3’-utr、poly(a)序列、密码子使用的调整。
在一个作为替选的实施方案中,细胞内或细胞外ifn信号传导的抑制剂由复制子编码,优选地反式复制子。复制子包含允许通过甲病毒复制酶复制的核酸序列元件,通常是cse1、cse2和cse4;优选地,还包含允许产生亚基因组转录物的核酸序列元件,即亚基因组启动子,通常包含cse3。复制子还可包含一个或更多个如本文所述的非多肽序列修饰之修饰,例如帽、poly(a)序列、密码子使用的调整。
用于表达甲病毒复制酶的rna构建体
在第二方面,本发明提供了用于表达甲病毒复制酶的rna构建体(复制酶构建体),其包含用于驱动该复制酶翻译的5’-帽。在第二方面,可能不存在根据本发明的甲病毒复制子。换言之,在本发明的第二方面,如本文所述,本发明的复制酶构建体可以独立于本发明的复制子提供。在第二方面,复制酶构建体可以通过本发明第一方面的复制酶构建体的任意一种或更多种特征独立地表征。在一个实施方案中,用于表达甲病毒复制酶的rna构建体是分离的核酸分子。这包括从其他核酸分子中分离,即基本上不含其他核酸分子的实施方案。
根据第二方面的rna构建体适合于例如以系统或试剂盒形式与合适的复制子组合。
根据本发明的dna
在第三方面,本发明提供了dna,其包含编码根据本发明第一方面的用于表达甲病毒复制酶的rna构建体(复制酶构建体)、根据本发明第一方面的rna复制子,或两者的核酸序列。
在一个实施方案中,根据本发明的dna分子编码根据本发明第一方面的系统的复制子和复制酶构建体。在一个作为替选的实施方案中,第一dna分子编码根据本发明第一方面的系统的一种rna元件(复制子或复制酶构建体),并且第二dna分子编码根据本发明的系统的相应另一种rna元件。
优选地,dna是双链的。
在一个优选的实施方案中,根据本发明第三方面的dna是质粒。如本文所用,术语“质粒”通常涉及染色体外遗传物质的构建体,通常是环状dna双链体,其可独立于染色体dna复制。
本发明的dna可包含可被dna依赖性rna聚合酶识别的启动子。这允许编码的rna(例如本发明的rna)在体内或体外转录。ivt载体可以以标准化方式用作体外转录的模板。根据本发明优选的启动子的实例是sp6、t3或t7聚合酶的启动子。
在一个实施方案中,本发明的dna是分离的核酸分子。
制备rna的方法
根据本发明的任何rna分子,无论是否是本发明系统的一部分,都可以通过体外转录获得。体外转录的rna(ivt-rna)在本发明中是特别感兴趣的。ivt-rna可通过从核酸分子(特别是dna分子)转录获得。本发明第三方面的dna分子适用于此目的,特别是如果包含可被dna依赖性rna聚合酶识别的启动子的情况下。
根据本发明的rna可以在体外合成。这允许将帽-类似物添加到体外转录反应中。通常,poly(a)尾部由dna模板上的聚(dt)序列编码。或者,可以在转录后酶促实现加帽和poly(a)尾部添加。
体外转录方法学是本领域技术人员已知的。例如,如wo2011/015347a1中所述,各种体外转录试剂盒是可商购的。
试剂盒
本发明还提供了包含根据本发明第一方面的系统或根据本发明第二方面的用于表达甲病毒复制酶的rna构建体的试剂盒。
在一个实施方案中,试剂盒的组分作为单独的实体存在。例如,试剂盒的一种核酸分子可以存在于一个实体中,并且试剂盒的另一种核酸可以存在于单独的实体中。例如,开放或封闭的容器是合适的实体。密闭容器是优选的。使用的容器应优选不含rna酶或基本上不含rna酶。
在一个实施方案中,本发明的试剂盒包含用于接种细胞和/或用于施用于人或动物对象的rna。
根据本发明的试剂盒任选地包含标签或其他形式的信息元件,例如,电子数据载体。标签或信息元件优选地包括指令,例如,印刷的书面说明书或可任选打印的电子形式的说明书。说明书可以涉及试剂盒的至少一种合适的可能用途。
药物组合物
本文所述的用于表达甲病毒复制酶的构建体和/或复制子可以以药物组合物的形式存在。根据本发明的药物组合物可包含至少一种根据本发明的核酸分子,优选地rna。根据本发明的药物组合物包含可药用稀释剂和/或可药用赋形剂和/或可药用载体和/或可药用载剂。可药用载体、载剂、赋形剂或稀释剂的选择不受特别限制。可以使用本领域已知的任何合适的可药用载体、载剂、赋形剂或稀释剂。
在本发明的一个实施方案中,药物组合物可以另外包含溶剂,例如含水溶剂或任何能够保持rna完整性的溶剂。在一个优选的实施方案中,药物组合物是包含rna的水溶液。水溶液可任选地包含溶质,例如盐。
在本发明的一个实施方案中,药物组合物是冻干组合物的形式。通过冷冻干燥各自的含水组合物可获得冻干组合物。
在一个实施方案中,药物组合物包含至少一种阳离子实体。通常,阳离子脂质、阳离子聚合物和具有正电荷的其他物质可以与带负电荷的核酸形成复合物。通过与阳离子化合物,优选与聚阳离子化合物(例如阳离子或聚阳离子肽或蛋白质)复合,可以稳定根据本发明的rna。在一个实施方案中,根据本发明的药物组合物包含选自鱼精蛋白、聚乙烯亚胺、聚-l-赖氨酸、聚-l-精氨酸、组蛋白或阳离子脂质的至少一种阳离子分子。
根据本发明,阳离子脂质是阳离子两亲性分子,例如包含至少一个亲水和亲脂部分的分子。阳离子脂质可以是单阳离子的或聚阳离子的。阳离子脂质通常具有亲脂部分,例如甾醇、酰基或二酰基链,并且具有总净正电荷。脂质的头部基团通常带有正电荷。阳离子脂质优选具有1至10价的正电荷,更优选具有1至3价的正电荷,更优选具有1价的正电荷。阳离子脂质的实例包括但不限于1,2-二-o-十八烯基-3-三甲基铵丙烷(dotma);二甲基二十八烷基铵(ddab);1,2-二油酰-3-三甲基铵-丙烷(dotap);1,2-二油酰-3-二甲基铵-丙烷(dodap);1,2-二酰氧基-3-二甲基铵丙烷;1,2-二烷氧基-3-二甲基铵丙烷;二十八烷基二甲基氯化铵(dodac)、1,2-二肉豆蔻酰氧基丙基-1,3-二甲基羟乙基铵(dmrie)和2,3-二油酰氧基-n-[2(精胺甲酰胺)乙基]-n,n-二甲基-1-丙胺三氟乙酸盐(dospa)。阳离子脂质还包括具有叔胺基团的脂质,包括1,2-二乙烯基氧基-n,n-二甲基-3-氨基丙烷(dlindma)。阳离子脂质适合于在如本文所述的脂质制剂中配制rna,例如脂质体、乳剂和脂质复合物。通常,正电荷由至少一种阳离子脂质贡献,负电荷由rna贡献。在一个实施方案中,除阳离子脂质外,药物组合物还包含至少一种辅助脂质。辅助脂质可以是中性或阴离子脂质。辅助脂质可以是天然脂质,例如磷脂,或天然脂质的类似物,或与天然脂质没有相似性的完全合成的脂质或脂质样分子。在药物组合物包含阳离子脂质和辅助脂质的情况下,考虑到制剂的稳定性等,可以适当地确定阳离子脂质与中性脂质的摩尔比。
在一个实施方案中,根据本发明的药物组合物包含鱼精蛋白(protamine)。根据本发明,鱼精蛋白可用作阳离子载体剂。术语“鱼精蛋白”是指具有相对低分子量的多种强碱性蛋白质中的任何一种,其富含精氨酸并且特别是与dna相关联以代替动物如鱼类的精子细胞中的体细胞组蛋白。特别地,术语“鱼精蛋白”是指在鱼精子中发现的蛋白质,其是强碱性的,可溶于水,加热不凝结,并且包含多个精氨酸单体。根据本发明,如本文所用的术语“鱼精蛋白”意指包含从天然或生物来源获得或衍生的任何鱼精蛋白氨基酸序列,包括其片段和所述氨基酸序列或其片段的多聚体形式。此外,该术语包括(合成的)多肽,其是人工的并且是为特定目的而特别设计的,并且不能从天然或生物来源中分离。
在一些实施方案中,本发明的组合物可包含一种或更多种佐剂。可以在疫苗中加入佐剂以刺激免疫系统的反应;佐剂通常本身不提供免疫力。示例性佐剂包括但不限于以下:无机化合物(例如明矾、氢氧化铝、磷酸铝、磷酸氢钙);矿物油(例如石蜡油)、细胞因子(例如il-1、il-2、il-12);免疫刺激多核苷酸(如rna或dna;例如含cpg的寡核苷酸);皂苷(例如来自皂树、大豆、美远志(polygalasenega)的植物皂苷);油乳剂或脂质体;聚氧乙烯醚和聚氧乙烯酯制剂;聚磷腈(pcpp);胞壁酰肽;咪唑喹诺酮类化合物;缩氨基硫脲化合物;flt3配体(wo2010/066418a1);或本领域技术人员已知的任何其他佐剂。根据本发明的用于施用rna的优选佐剂是flt3配体(wo2010/066418a1)。当flt3配体与编码抗原的rna一起施用时,可观察到抗原特异性cd8+t细胞的强烈提高。
可以缓冲根据本发明的药物组合物(例如,用乙酸盐缓冲液、柠檬酸盐缓冲液、琥珀酸盐缓冲液、tris缓冲液、磷酸盐缓冲液)。
含有rna的颗粒
在一些实施方案中,由于未受保护的rna的不稳定性,所以有利的是以复合或包封形式提供本发明的rna分子。在本发明中提供各种药物组合物。特别地,在一些实施方案中,本发明的药物组合物包含含有核酸的颗粒,优选含有rna的颗粒。各药物组合物称为颗粒制剂。在根据本发明的颗粒制剂中,颗粒包含根据本发明的核酸和适于递送核酸的可药用载体或可药用载体。含核酸之颗粒可以是例如蛋白质颗粒的形式或含脂质之颗粒的形式。合适的蛋白质或脂质被称为颗粒形成剂。先前已经描述了适合于以颗粒形式递送甲病毒rna的蛋白质颗粒和含脂质之颗粒(例如strauss&strauss,microbiol.rev.,1994,第58卷,第491-562页)。特别地,甲病毒结构蛋白(例如由辅助病毒提供)是用于递送蛋白质颗粒形式的rna的合适载体。
当根据本发明的系统配制成颗粒制剂时,每种rna种类(例如复制子、复制酶构建体和任选的其他rna种类,例如编码适于抑制ifn的蛋白质的rna)可以单独配制成单独颗粒制剂(individualparticulateformulation)。在那种情况下,每个单独颗粒制剂包含一种rna种类。单独颗粒制剂可以作为单独的实体存在,例如,在单独的容器中。通过分别提供每种rna种类(通常各自以含rna溶液的形式)和颗粒形成剂来提供这样的制剂,从而允许形成颗粒。各个颗粒将仅包含在形成颗粒时提供的特定rna种类(单独颗粒制剂)。
在一个实施方案中,根据本发明的药物组合物包含多于一种单独颗粒制剂。各药物组合物称为混合颗粒制剂。根据本发明的混合颗粒制剂可通过单独形成如上所述的单独颗粒制剂,然后混合单独颗粒制剂的步骤而获得。通过混合步骤,可获得包含含有rna的颗粒的混合群的一种制剂(为了说明:例如,第一颗粒群可包含根据本发明的复制子,并且第二种颗粒制剂可包含根据本发明的复制酶构建体)。单独颗粒群可以一起在包含混合的单独颗粒制剂群的一个容器中。
或者,可以将药物组合物的所有rna种类(例如复制子、复制酶构建体和任选的其他物种,例如编码适于抑制ifn的蛋白质的rna)一起配制成组合颗粒制剂。通过提供所有rna种类和颗粒形成剂的组合制剂(通常为组合溶液),从而允许形成颗粒,可以获得这样的制剂。与混合颗粒制剂相反,组合颗粒制剂通常包含含有多于一种rna种类的颗粒。在组合颗粒组合物中,不同的rna种类通常一起存在于单个颗粒中。
在一个实施方案中,本发明的颗粒制剂是纳米粒制剂。在该实施方案中,根据本发明的组合物包含纳米粒形式的根据本发明的核酸。纳米粒制剂可通过各种方案和各种复合化合物获得。脂质、聚合物、低聚物或两亲性物是纳米粒制剂的典型组分。
如本文所用,术语“纳米粒”是指具有这样的直径的任何颗粒,所述直径使得颗粒适合于特别是核酸的全身性,特别是肠胃外施用,通常直径为1000纳米(nm)或更小。在一个实施方案中,纳米粒的平均直径为约50nm至约1000nm,优选约50nm至约400nm,优选约100nm至约300nm,例如约150nm至约200nm。在一个实施方案中,纳米粒的直径为约200至约700nm,约200至约600nm,优选约250至约550nm,特别是约300至约500nm或约200至约400nm。
在一个实施方案中,通过动态光散射测量的本文所述纳米粒的多分散指数(pi)为0.5或更小,优选0.4或更小,或甚至更优选0.3或更小。“多分散指数”(pi)是颗粒混合物中单独颗粒(例如脂质体)的均匀或不均匀尺寸分布的量度,并且表示混合物中颗粒分布的宽度。例如,可以如wo2013/143555a1中所述确定pi。
如本文所用,术语“纳米粒制剂”或类似术语是指含有至少一种纳米粒的任何颗粒制剂。在一些实施方案中,纳米粒组合物是纳米粒的均匀集合。在一些实施方案中,纳米粒组合物是含脂质的药物制剂,例如脂质体制剂或乳液。
含有脂质的药物组合物
在一个实施方案中,本发明的药物组合物包含至少一种脂质。优选地,至少一种脂质是阳离子脂质。所述含有脂质的药物组合物包含根据本发明的核酸。在一个实施方案中,根据本发明的药物组合物包含包封在囊泡(例如脂质体)中的rna。在一个实施方案中,根据本发明的药物组合物包含乳液形式的rna。在一个实施方案中,根据本发明的药物组合物包含与阳离子化合物形成复合物的rna,从而形成例如所谓的脂质复合物(lipoplexes)或聚合复合物(polyplexes)。rna在囊泡(例如脂质体)内的包封不同于例如脂质/rna复合物。脂质/rna复合物可以例如当rna例如与预先形成的脂质体混合时获得。
在一个实施方案中,根据本发明的药物组合物包含包封在囊泡中的rna。这种制剂是根据本发明的特定颗粒制剂。囊泡是卷成球形壳的脂质双层,其包围小空间并将该空间与囊泡外的空间隔开。通常,囊泡内的空间是含水空间,即包含水。通常,囊泡外部的空间是含水空间,即包含水。脂质双层由一种或更多种脂质(形成囊泡的脂质)形成。包围囊泡的膜是层状相,类似于质膜。根据本发明的囊泡可以是多层囊泡、单层囊泡或其混合物。当包封在囊泡中时,rna通常与任何外部培养基分离。因此,其以受保护的形式存在,在功能上等同于天然甲病毒中的受保护形式。合适的囊泡是如本文所述的颗粒,特别是纳米粒。
例如,rna可以包封在脂质体中。在该实施方案中,药物组合物是或包含脂质体制剂。脂质体内的包封通常将保护rna免于rna酶消化。脂质体可能包含一些外部rna(例如在其表面上),但至少一半rna(并且理想地全部rna)被包封在脂质体的核心内。
脂质体是微观脂质囊泡,通常具有一个或更多个形成囊泡的脂质的双层,例如磷脂,并且能够包封药物,例如rna。在本发明的上下文中可以使用不同类型的脂质体,包括但不限于多层囊泡(multilamellarvesicle,mlv)、小单层囊泡(smallunilamellarvesicle,suv)、大单层囊泡(largeunilamellarvesicle,luv)、空间稳定化脂质体(stericallystabilizedliposome,ssl)、多泡囊泡(multivesicularvesicle,mv)和大多泡囊泡(largemutivesicularvesicle,lmv)以及本领域已知的其他双层形式。脂质体的大小和层质(lamellarity)将取决于制备方式。存在多种其他形式的超分子组织,其中脂质可以存在于含水介质中,包括层状相、六方相(hexagonalphase)和反六方相、立方相、胶束、由单层组成的反胶束。这些相也可以与dna或rna组合获得,并且与rna和dna的相互作用可以显著影响相状态。这些相可以存在于本发明的纳米粒rna制剂中。
可以使用技术人员已知的标准方法形成脂质体。各种方法包括反向蒸发方法、乙醇注入方法、脱水-再水合方法、超声处理或其他合适的方法。在脂质体形成之后,可以调整脂质体的大小以获得具有基本上均匀的大小范围的脂质体群。
在本发明的一个优选实施方案中,rna存在于脂质体中,所述脂质体包含至少一种阳离子脂质。相应的脂质体可以由单一脂质或脂质混合物形成,条件是使用至少一种阳离子脂质。优选的阳离子脂质具有能够被质子化的氮原子;优选地,这种阳离子脂质是具有叔胺基团的脂质。具有叔胺基团的特别合适的脂质是1,2-二乙烯基氧基-n,n-二甲基-3-氨基丙烷(dlindma)。在一个实施方案中,根据本发明的rna存在于脂质体制剂中,如wo2012/006378a1中所述:脂质体,其具有包封含有rna的含水核心的脂质双层,其中脂质双层包含pka为5.0至7.6的脂质,其优选具有叔胺基团。具有叔胺基团的优选阳离子脂质包括dlindma(pka5.8)并且通常描述于wo2012/031046a2中。根据wo2012/031046a2,包含相应化合物的脂质体特别适合于包封rna,并因此适合于rna的脂质体递送。在一个实施方案中,根据本发明的rna存在于脂质体制剂中,其中脂质体包含至少一种阳离子脂质,其头部基团包含至少一个能够被质子化的氮原子(n),其中脂质体和rna的n∶p比为1∶1至20∶1。根据本发明,“n∶p比”是指阳离子脂质中的氮原子(n)与包含在含脂质之颗粒(例如脂质体)中的rna中的磷酸根原子(p)的摩尔比,如wo2013/006825a1所述。n∶p比为1∶1至20∶1与脂质体的净电荷和rna向脊椎动物细胞的递送效率有关。
在一个实施方案中,根据本发明的rna存在于脂质体制剂中,所述脂质体制剂包含至少一种包含聚乙二醇(peg)部分的脂质,其中rna包封在peg化的脂质体内,使得peg部分存在于脂质体的外部,如wo2012/031043a1和wo2013/033563a1中所述。
在一个实施方案中,根据本发明的rna存在于脂质体制剂中,其中脂质体的直径为60-180nm,如wo2012/030901a1中所述。
在一个实施方案中,根据本发明的rna存在于脂质体制剂中,其中含rna之脂质体具有接近零或负的净电荷,如wo2013/143555a1中所公开的。
在另一些实施方案中,根据本发明的rna以乳液的形式存在。先前已经描述了乳液用于将核酸分子(例如rna分子)递送至细胞。本文优选的是水包油乳液。各乳液颗粒包含油核心和阳离子脂质。更优选的是阳离子水包油乳液,其中根据本发明的rna与乳液颗粒复合。乳液颗粒包含油心和阳离子脂质。阳离子脂质可以与带负电荷的rna相互作用,从而将rna锚定在乳液颗粒上。在水包油乳液中,乳液颗粒分散在水性连续相中。例如,乳液颗粒的平均直径通常可为约80nm至180nm。在一个实施方案中,本发明的药物组合物是阳离子水包油乳液,其中乳液颗粒包含油核心和阳离子脂质,如wo2012/006380a2中所述。如wo2013/006834a1中所述,根据本发明的rna可以以包含阳离子脂质的乳液形式存在,其中乳液的n∶p比率为至少4∶1。如wo2013/006837a1中所述,根据本发明的rna可以以阳离子脂质乳液的形式存在。特别地,该组合物可包含与阳离子水包油乳液颗粒复合的rna,其中油/脂质的比为至少约8∶1(摩尔∶摩尔)。
在另一些实施方案中,根据本发明的药物组合物包含脂质复合物形式的rna。术语“脂质复合物”或“rna脂质复合物”是指脂质与核酸(如rna)的复合物。脂质复合物可由阳离子(带正电荷)脂质体和阴离子(带负电荷)核酸形成。阳离子脂质体还可包括中性“辅助”脂质。在最简单的情况下,通过用某些混合方案将核酸与脂质体混合自发形成脂质体复合物,然而可以应用各种其他方案。应当理解,带正电荷的脂质体和带负电荷的核酸之间的静电相互作用是脂质复合物形成的驱动力(wo2013/143555a1)。在本发明的一个实施方案中,rna脂质复合物颗粒的净电荷接近于零或为负。已知rna和脂质体的电中性或带负电荷的脂质复合物在全身给药后导致脾脏树突细胞(dc)中的大量rna表达,并且与已报道的带正电荷的脂质体和脂质体复合物的毒性升高无关(参见wo2013/143555a1)。因此,在本发明的一个实施方案中,根据本发明的药物组合物包含纳米粒形式的rna,优选脂质复合物纳米粒,其中(i)纳米粒中的正电荷数不超过纳米粒中负电荷数,和/或(ii)纳米粒具有中性或净负电荷,和/或(iii)纳米粒中正电荷与负电荷的电荷比为1.4∶1或更小,和/或(iv)纳米粒的ζ电位为0或更小。如wo2013/143555a1中所述,ζ电位是胶体系统中的电动势的科学术语。在本发明中,纳米粒中的(a)ζ电位和(b)阳离子脂质与rna的电荷比可如wo2013/143555a1中所公开的那样计算。总之,本发明的上下文中优选的药物组合物是如wo2013/143555a1中所公开的具有确定粒径的纳米粒脂质复合物制剂的药物组合物,其中颗粒的净电荷接近于零或为负。
产生蛋白质的方法
在第四方面,本发明提供了在细胞中产生蛋白质的方法,其包括以下步骤:
(a)获得用于表达甲病毒复制酶的rna构建体,
(b)获得可以通过复制酶反式复制并且包含编码该蛋白质的开放阅读框的rna复制子,以及
(c)将用于表达甲病毒复制酶的rna构建体和rna复制子共同接种到细胞中,
其中用于表达甲病毒复制酶的rna构建体包含用于驱动该复制酶翻译的5’-帽。
根据(a)的用于表达甲病毒复制酶的rna构建体可以通过包含在根据本发明第一方面的系统中的复制酶构建体的任意一个或更多个特征来表征。
根据(b)的rna复制子可以通过包含在根据本发明第一方面的系统中的复制子的任意一个或更多个特征来表征。
在一个实施方案中,在细胞中产生蛋白质的方法中使用的根据(a)的用于表达甲病毒复制酶的rna构建体和根据(b)的rna复制子是根据本发明的系统的组成部分。
可以将一种或更多种核酸分子接种到其中的细胞称为“宿主细胞”。根据本发明,术语“宿主细胞”是指可以用外源核酸分子转化或转染的任何细胞。术语“细胞”优选是完整细胞,即具有完整膜的细胞,其未释放其正常的细胞内组分,例如酶、细胞器或遗传物质。完整细胞优选是活细胞,即能够发挥其正常代谢功能的活细胞。根据本发明,术语“宿主细胞”包括原核(例如大肠杆菌)或真核细胞(例如人和动物细胞、昆虫细胞)。特别优选哺乳动物细胞,例如来自人、小鼠、仓鼠、猪,驯养动物,包括马、牛、绵羊和山羊,以及灵长类动物的细胞。细胞可以来源于多种组织类型,并且包括原代细胞和细胞系。具体实例包括角质形成细胞、外周血白细胞、骨髓干细胞和胚胎干细胞。在另一些实施方案中,宿主细胞是抗原呈递细胞,特别是树突细胞、单核细胞或巨噬细胞。核酸可以以单个或多个拷贝存在于宿主细胞中,并且在一个实施方案中,在宿主细胞中表达。
细胞可以是原核细胞或真核细胞。原核细胞在本文中适用于例如传播根据本发明的dna,并且真核细胞在本文中合适于例如表达复制子的开放阅读框。
在本发明的方法中,可以使用根据本发明的任何系统,或根据本发明的试剂盒,或根据本发明的药物组合物。rna可以以药物组合物的形式使用,或者以裸rna使用,例如用于电穿孔。先前已经描述了将包含rna的组合物接种到细胞中以及将裸rna电穿孔到细胞中(参见本文在描述根据本发明的药物组合物的部分中引用的参考文献)。
根据本发明的方法,可以实现宿主细胞中目的基因的有效表达(参见例如实施例1和2)。
在根据本发明的在细胞中产生蛋白质的方法中,根据第一方面的不同rna分子(复制子和复制酶构建体)可以在相同的时间点接种,或者其可以作为替选地在不同的时间点接种。在第二种情况下,通常在第一时间点接种复制酶构建体,并且通常在稍后的第二时间点接种复制子。在这种情况下,设想由于复制酶已经在细胞中翻译,因此复制子将立即复制。第二时间点通常是在第一时间点之后不久,例如,第一时间点后1分钟到24小时。
在一个实施方案中,可以将细胞接种另外的rna分子,优选mrna分子。任选地,另外的rna分子编码适于抑制ifn的蛋白质,例如如本文所述的e3。任选地,可以在接种根据本发明的复制子或复制酶构建体或系统之前接种另外的rna分子。
在根据本发明的细胞中产生蛋白质的方法中,细胞可以是抗原呈递细胞,并且该方法可以用于表达编码抗原的rna。为此,本发明可涉及将编码抗原的rna引入抗原呈递细胞如树突细胞中。对于转染抗原呈递细胞如树突细胞,可以使用包含编码抗原的rna的药物组合物。
在一个实施方案中,用于在细胞中产生蛋白质的方法是体外方法。在一个实施方案中,用于在细胞中产生蛋白质的方法不包括通过手术或治疗从人或动物对象中移出细胞。
在该实施方案中,可以将根据本发明第四方面接种的细胞施用于对象,以便在对象中产生蛋白质并向对象提供蛋白质。相对于对象,细胞可以是自体的、同系的、同种异体的或异源的。
在另一个实施方案中,细胞中产生蛋白质的方法中的细胞可以存在于对象例如患者中。在本实施方案中,用于在细胞中产生蛋白质的方法是体内方法,其包括向对象施用rna分子。
在该方面,本发明还提供了在对象中产生蛋白质的方法,其包括以下步骤:
(a)获得用于表达甲病毒复制酶的rna构建体,
(b)获得可以通过该复制酶反式复制并且包含编码该蛋白质的开放阅读框的rna复制子,以及
(c)向对象施用用于表达甲病毒复制酶的rna构建体和rna复制子,
其中用于表达甲病毒复制酶的rna构建体包含用于驱动该复制酶翻译的5’-帽。
根据(a)的用于表达甲病毒复制酶的rna构建体可以通过包含在根据本发明第一方面的系统中的复制酶构建体的任意一个或更多个特征来表征。根据(a)的rna构建体可以例如如本文所述获得。
根据(b)的rna复制子可以通过包含在根据本发明第一方面的系统中的复制子的任意一个或更多个特征来表征。优选地,根据(b)的复制子编码药学活性肽或蛋白质作为目的蛋白。在一个实施方案中,药学活性肽或蛋白质是免疫活性化合物或抗原。根据(b)的rna复制子可以例如如本文所述获得。根据本发明的在对象中产生蛋白质的方法特别适合于预防性和治疗性应用。优选地,在用于在对象中产生蛋白质的方法中,rna复制子编码作为目的基因的药学活性蛋白质或多肽。
在用于在对象中产生蛋白质的方法中,根据(a)的rna复制酶构建体和根据(b)的复制子可以在相同的时间点施用,或者可以作为替选地在不同的时间点施用。在第二种情况下,通常在第一时间点施用根据(a)的复制酶构建体,并且通常在第二稍后的时间点施用根据(b)的复制子。在这种情况下,设想由于复制酶已经在细胞中翻译,因此复制子将立即复制。第二时间点通常是在第一时间点之后不久,例如,第一时间点后1分钟到24小时。优选地,复制子的施用在与复制酶构建体的施用相同的位点并通过相同的施用途径进行,以提高复制子和复制酶构建体到达相同靶组织或细胞的前景。“位点”是指对象身体的位置。合适的位点是例如左臂、右臂等。
在一个实施方案中,可以向对象施用另外的rna分子,优选mrna分子。如本文所述的,任选地,另外的rna分子编码适于抑制ifn的蛋白质,例如e3。任选地,可以在施用根据本发明的复制子或复制酶构建体或系统之前施用另外的rna分子。
根据本发明的系统、或根据本发明的试剂盒、或根据本发明的药物组合物中的任一种可用于根据本发明的在对象中产生蛋白质的方法中。例如,在本发明的方法中,rna可以以药物组合物的形式使用,例如,如本文所述,或作为裸rna。先前已经描述了包含rna的药物组合物的施用,参见例如本文在描述根据本发明的药物组合物的部分中引用的参考文献。
鉴于向对象施用的能力,根据本发明的系统、或根据本发明的试剂盒、或根据本发明的药物组合物中的每一种可称为“药物”等。本发明预见到提供本发明的系统、试剂盒和/或药物组合物用作药物。该药物可用于治疗对象。“治疗”是指将本文所述的化合物或组合物或其他实体施用至对象。该术语包括通过疗法治疗人体或动物体的方法。
上述药物通常不包含dna,因此与现有技术中描述的dna疫苗(例如wo2008/119827a1)相比伴随着另外的安全特征。
根据本发明的替代医学用途包括根据本发明第四方面在细胞中产生蛋白质的方法,其中所述细胞可以是抗原呈递细胞,例如树突细胞,然后将所述细胞引入到对象中。例如,可以将编码药学活性蛋白质(例如抗原)的包含复制子的系统导入(转染)到离体抗原呈递细胞中,例如,取自对象的抗原呈递细胞和,并且可以将任选离体克隆繁殖的抗原呈递细胞重新引入相同或不同的对象。可以使用本领域已知的任何方法将转染的细胞重新引入对象体内。
可以向有需要的对象施用根据本发明的药物。本发明的药物可用于治疗对象的预防性以及治疗性方法。
根据本发明的药物以有效量施用。“有效量”涉及足以单独或与其他剂量一起引起反应或所需效果的量。在治疗对象中的某种疾病或某种病症的情况下,期望的效果是抑制疾病进展。这包括疾病进展的减缓,特别是疾病进展的中断。治疗疾病或病症的期望效果还可以是疾病爆发的延迟或疾病爆发的抑制。
有效量将取决于所治疗的病症、疾病的严重程度、患者的个体参数,包括年龄、生理状况、尺寸和体重、治疗持续时间、伴随治疗的类型(如果有的话)、具体施用方式和其他因素。
疫苗接种
术语“免疫接种”或“疫苗接种”通常是指出于治疗或预防原因而治疗对象的过程。治疗,特别是预防性治疗,优选是或旨在包括旨在诱导或增强对象的针对一种或更多种抗原的免疫应答的治疗。根据本发明,如果期望通过使用如本文所述的rna诱导或增强免疫应答,则可以通过rna引发或增强免疫应答。在一个实施方案中,本发明提供预防性治疗,其优选地是或包括对对象进行疫苗接种。本发明的一个实施方案特别适用于疫苗接种,其中复制子编码作为目的蛋白的药学活性肽或蛋白质,它们是免疫活性化合物或抗原。
先前已经描述了rna用于针对包括病原体的外来物质或癌症的疫苗接种(最近由ulmer等,2012,vaccine,第30卷,第4414-4418页综述)。与现有技术中的常规方法相反,根据本发明的复制子是用于有效疫苗接种的特别合适的元件,因为其能够被由本发明的复制酶构建体编码的复制酶反式复制。根据本发明的疫苗接种可用于例如诱导对弱免疫原性蛋白质的免疫应答。在根据本发明的rna疫苗的情况下,蛋白质抗原从未暴露于血清抗体,但是在rna翻译后由转染的细胞自身产生。因此,过敏反应不应成为问题。因此,本发明允许患者重复免疫而没有过敏反应的风险。
从重组蛋白的非常强的表达可以看出,本发明的实施例5使得含有转基因的复制子在接种疫苗的动物中达到高拷贝数是合理的。实施例6证明了根据本发明的其中复制子编码治疗性蛋白质的疫苗接种是非常有效的。因此,本发明使能够用基于甲病毒的反式复制rna系统进行有效的疫苗接种。
在涉及根据本发明的疫苗接种的方法中,将本发明的药物施用于对象,特别是如果需要治疗患有涉及抗原的疾病或具有涉及抗原的疾病的风险的对象。
在涉及根据本发明的疫苗接种的方法中,由根据本发明的复制子编码的目的蛋白编码待由免疫应答针对的细菌抗原,待由免疫应答针对的病毒抗原,或待由免疫应答针对的癌症抗原。疫苗接种的效力可通过已知的标准方法评估,例如通过测量来自生物体的抗原特异性igg抗体。在涉及根据本发明的变应原特异性免疫治疗的方法中,由根据本发明的复制子编码的目的蛋白编码与过敏相关的抗原。变应原特异性免疫治疗(也称为脱敏)定义为向具有一种或更多种过敏的生物体施用优选提高剂量的变应原疫苗,以达到减轻与随后暴露于致病变应原的相关的症状减轻的状态。变应原特异性免疫治疗的功效可通过已知的标准方法评估,例如通过测量来自生物体的变应原特异性igg和ige抗体。
本发明的药物可以施用于对象,例如,用于治疗对象,包括对象的疫苗接种。
术语“对象”涉及脊椎动物,特别是哺乳动物。例如,在本发明的上下文中的哺乳动物是人,非人灵长类动物,驯养的哺乳动物如狗、猫、绵羊、牛、山羊、猪、马等,实验动物如小鼠、大鼠、兔、豚鼠等,以及圈养的动物,如动物园的动物。术语“对象”还涉及非哺乳动物脊椎动物,例如鸟类(特别是家禽,例如鸡、鸭、鹅、火鸡)和鱼类(特别是养殖鱼类,例如鲑鱼或鲶鱼)。如本文所用的术语“动物”还包括人。
在一些实施方案中,向家养动物如狗、猫、兔、豚鼠、仓鼠、绵羊、牛、山羊、猪、马、骆驼、鸡、鸭、鹅、火鸡或野生动物如狐狸、鹿、狍、野猪施用是优选的。例如,根据本发明的预防性疫苗接种可适用于接种动物群体,例如,在农业中,或野生动物群体。圈养的其他动物种群如宠物或动物园的动物可以接种疫苗。
当施用于对象时,用作药物的复制子和/或复制酶构建体优选不包含来自对于治疗对象所属的物种或属具有感染性的甲病毒类型的序列。优选地,在那种情况下,复制子和/或复制酶构建体不包含来自可以感染相应物种或属的甲病毒的任何核苷酸序列。该实施方案具有以下优点:即使施用rna的对象(例如,意外地)受到感染性甲病毒的影响,也不可能与感染性(例如全功能型或野生型)甲病毒重组。作为说明性实例,对于猪的治疗,使用的复制子和/或复制酶构建体不包含来自可感染猪的甲病毒的任何核苷酸序列。
施用方式
根据本发明的药物可以以任何合适的途径应用于对象。
例如,药物可以全身性施用,例如静脉内(i.v.)、皮下(s.c.)、皮内(i.d.)或通过吸入。
在一个实施方案中,将根据本发明的药物例如皮下施用于肌肉组织,例如骨骼肌或皮肤。通常理解的是,rna转移到皮肤或肌肉中导致高度和持续的局部表达,同时强烈诱导体液和细胞免疫应答(johansson等.2012,plos.one.,7,e29732;geall等,2012,proc.natl.acad.sci.u.s.a,第109卷,第14604-14609页)。
施用于肌肉组织或皮肤的替代方案包括但不限于:皮内、鼻内、眼内、腹膜内、静脉内、间质、经颊、透皮或舌下施用。皮内和肌肉内施用是两种优选的途径。
可以以多种方式实现给药。在一个实施方案中,通过注射施用根据本发明的药物。在一个优选的实施方案中,通过针头注射。可以使用无针注射作为替代方案。
通过附图和实施例详细描述和说明本发明,这些附图和实施例仅用于说明目的而不是限制性的。根据描述和实施例,技术人员可以获得同样包括在本发明中的其他一些实施方案。
实施例
材料和方法:
以下材料和方法用于以下描述的实施例中。
编码复制子、复制酶构建体和e3l的dna;以及体外转录
(1)如下制备编码实施例中使用的顺式复制子的dna:制备适合于体外转录能够被赛姆利基森林病毒(sfv)复制酶复制的rna复制子的dna质粒:参考赛姆利基森林病毒复制子质粒(psfv-gen-gfp)由k.lundstrom友情提供(lundstrom等,2001,histochem.cellbiol.,第115卷,第83-91页;ehrengruber和lundstrom,1999,proc.natl.acad.sci.u.s.a,第96卷,第7041-7046页)。将psfv-gen-gfp编码的poly(a)盒从原始载体中的62个腺苷酸残基延伸至120个腺苷酸残基,并将sapi限制性位点置于紧邻poly(a)盒的下游。该poly(a)设计被描述为增强合成mrna的表达(holtkamp等,2006,blood,第108卷,第4009-4017页)。最后,噬菌体聚合酶启动子从sp6变为t7。
(2)通过删除编码甲病毒复制酶的开放阅读框的主要部分(复制酶orf的核苷酸222至6321)同时保留载体骨架,从上述顺式复制子中改造编码反式复制子的dna。
(1a,2a)我们独立地将报告基因萤火虫萤光素酶、分泌型nanoluc(两者由promega,madison,wi,usa商品化)、流感病毒a/波多黎各/08/1934血细胞凝集素(ha)和增强型绿色荧光蛋白(egfp,在图中“gfp”或“egfp”)克隆到顺式和反式复制子的亚基因组启动子3’端。
(3)为了产生复制酶构建体,将编码sfv复制酶的开放阅读框克隆到pst1质粒中,该质粒的特征在于人β-珠蛋白3’utr、poly(a120)尾和紧邻poly(a)尾下游的sapi限制性位点的串联拷贝(holtkamp等,2006,blood,第108卷,第4009-4017页)。
(4)将编码痘苗病毒e3l的开放阅读框克隆到pst1质粒中,该质粒的特征在于人β-珠蛋白3’utr、poly(a120)尾和紧邻poly(a)尾下游的sapi限制性位点的串联拷贝(holtkamp等,2006,blood,第108卷,第4009-4017页)。
如前所述进行从pst1来源和psfv-gen-gfp来源的质粒的体外转录[(1a)、(2a)、(3)和(4)]和rna的纯化,除了使用β-s-arca(d2)帽类似物替代arca(holtkamp等,同上;kuhn等,2010,genether.,第17卷,第961-971页)。通过分光光度法评价经纯化rna的质量,并在2100bioanalyzer(agilent,santaclara,usa)上进行分析。实施例中使用的rna是经纯化的ivt-rna。
rna转移到细胞中:
对于电穿孔,在室温下使用方波电穿孔装置(btxecm830,harvardapparatus,holliston,ma,usa)使用以下设置:750v/cm,1脉冲16毫秒(ms))将rna电穿孔到细胞中。对于电穿孔,将rna以62.5μl/mm小池间隙尺寸的最终体积重悬。
使用lipofectaminernaimax按照制造商的说明书(lifetechnologies,darmstadt,germany)进行rna脂质转染。将细胞以约20,000个细胞/cm2生长区铺板,并用总量为260ng/cm2的rna和1μl/cm2的rnaimax转染。将rna种类在无rna酶的eppendorf管中混合并保持在冰上直至用于转染。
细胞培养:除非另有说明,否则所有生长培养基、胎牛血清(fcs)、抗生素和其他补充剂均由lifetechnologies/gibco提供。从systembioscience(hff,neonatal)或atcc(ccd-1079sk)获得的人包皮成纤维细胞在37℃下在含有15%fcs、1单位/ml青霉素、1μg/ml链霉素、1%非必需氨基酸、1mm丙酮酸钠的极限必需培养基(mem)中培养。细胞在37℃下在平衡至5%co2的潮湿气氛中生长。bhk21细胞(atcc;ccl10)在补充有10%fcs的eagle极限必需培养基中生长。
流式细胞术:除非另有说明,否则在转染后16小时收获转染的细胞以通过流式细胞术(facs)测量生产性转染的效率和转基因(egfp)表达。通过流式细胞术使用facscantoii流式细胞仪(bdbioscience,heidelberg,germany)进行测量,并通过相应的diva软件或flowjo软件(treestarinc.,ashland,or,usa)分析获得的数据。
萤光素酶测定:为了评价萤光素酶在转染细胞中的表达,将转染细胞接种到96孔白色微孔板(nunc,langenselbold,germany)中。用bright-glo萤光素酶检测系统检测萤火虫萤光素酶;使用nanoglo试剂盒(两者均来自promega,madison,wi,usa)根据制造商的说明检测nanoluc。使用微孔板发光读数器infinitem200(tecangroup,mannedorf,switzerland)测量生物发光。数据以相对萤光素酶单位[rlu]表示,使用萤光素酶阴性细胞以减去背景信号。
动物:6-8周龄的balb/c小鼠购买自janvierlabs(saintberthevincedex,france),并在具有昼夜节律光照/黑暗暗循环并可自由摄入标准小鼠饲料和自来水的正常的实验室条件下饲养。所有实验均由区域委员会动物实验伦理委员会批准(koblenz/rhineland-palatinate,germany,g13-8-063)。
流感病毒制备和滴度测定。对于感染,使madin-darby犬肾ii(mdck-ii)细胞在含有0.2%牛血清白蛋白(30%特别是无igg的bsa;sigma)代替fcs的mem(感染培养基)中培养。在含有1μg/ml甲苯磺酰基苯丙氨酰基氯甲基酮(tpck)-胰蛋白酶(sigma)的感染培养基中的mdck-ii细胞中繁殖小鼠调整流感病毒a/puertorico/08/1934。通过低速离心使细胞上清液清澈并储存在-80℃。用噬斑测定法使用70-80%汇合的mdck-ii细胞单层(12孔板)确定病毒滴度(噬斑形成单位(pfu)/ml)。用200μl连续10倍稀释的病毒制剂(10-2至10-8)接种细胞。使病毒在37℃下吸附1小时,随后用低黏度培养基avicel覆盖细胞,以降低病毒扩散并允许斑块形成。用2xmem/1μg/mltpck-胰蛋白酶稀释2.4%avicel溶液以达到最终avicel浓度为1.2%。三天后除去覆盖物,并使用含有10%甲醛的水性1%结晶紫溶液对细胞进行染色(室温下10分钟)。用水洗涤染色的细胞,对每孔的噬菌斑计数并计算pfu/ml。
血细胞凝集滴度(ha滴度):根据who2011年在“manualforthelaboratorydiagnosisandvirologicalsurveillanceofinfluenza”中发布的建议,使用鸡红细胞(rbc;fitzgerald,usa)确定血细胞凝集单位(hau)。简言之,在v形96孔板中进行病毒制剂的连续稀释(2倍),然后用50μl的0.5%鸡rbc(“标准化rbc”)在25℃下孵育30分钟。当rbc在用病毒制剂孵育后仍处于悬浮状态而非凝集的rbc沉淀在孔的底部时,血细胞凝集被认为是完全的。将ha滴度记录为显示完全凝集的最低稀释度的倒数,并定义为每50μl一个血细胞凝集单位(hau),即凝集等体积标准化rbc所必需的病毒量。
血细胞凝集抑制(hai)测定。为了确定抑制免疫小鼠中血细胞凝集的抗ha抗体的血清水平,收集血清并用1:5比例的受体破坏酶ii“seiken”(rde(ii),denkaseikenco.ltd.,japan)处理过夜,随后在56℃下热灭活30分钟。将血清一式两份使用,并进行连续稀释(1∶2),随后添加25μlpr8病毒稀释液(4hau/50μl)。在室温下孵育15分钟后,添加50μl0.5%rbc并将混合物孵育30分钟,随后评价凝集。将hai滴度记录为抑制凝集的最低稀释度的倒数(hai/50μl)。
病毒中和滴度(vnt)测定:为了确定接种疫苗小鼠血清中病毒中和抗体的滴度,我们测定了血清抗体预防madin-darby犬肾(mdck)细胞感染并由此从madin-darby犬肾(mdck)细胞中从头释放病毒的能力。为此目的,将来自接种疫苗和对照小鼠的1∶2连续稀释的热灭活血清(56℃,30分钟)与固定浓度的感染性流感病毒(2tcid50/μl)一起孵育(组织培养感染剂量(50)))。对照包括在每个微量滴定板上无血清和无病毒的对照,以及在不存在血清的情况下反向滴定的病毒制剂以确定病毒制备的滴度。在1μg/ml甲苯磺酰基苯丙氨酰基氯甲基酮(tpck)-胰蛋白酶的存在下将所有制剂(血清-病毒混合物和对照样品)于37℃孵育2小时,随后在37℃下将mdck细胞暴露于制剂3天。3天后,从mdck细胞收获细胞培养物上清液,并如上所述进行ha滴度测定。
皮内免疫、病毒攻击感染和动物评价:8-10周龄的雌性balb/c小鼠用于免疫实验。通过异氟醚吸入麻醉小鼠,剃去背部区域,并且在第0天和第21天皮内注射溶解在20μl无rna酶的pbs中的ha--复制子rna与复制酶和e3mrna的组合,在第一次免疫后第20、35和55天通过眼眶静脉丛出血在异氟烷麻醉下取血。通过离心从血液中沉淀细胞碎片,并将血清样品直接用于血细胞凝集素(hai)测定。为了评价针对流感病毒感染的保护,在用氯胺酮/赛拉嗪麻醉的同时,用10倍ld50的小鼠调整流感病毒a/puertorico/08/1934(pr8)鼻内攻击免疫小鼠。每天对小鼠称重并在攻击后14天或当满足终止标准(减轻25%体重)时实施安乐死。
实施例1:转基因表达的效率取决于编码复制酶的rna分子的类型。
编码复制酶和在sgp下游编码萤光素酶的rna顺式复制子(“顺式复制子rna”)或编码复制酶的合成mrna(“mrna”),每个与在sgp下游编码egfp的rna反式复制子一起通过电穿孔引入到bhk21细胞中(图3)。通过facs测量egfp的荧光来确定反式复制子的表达,来自顺式复制子的萤光素酶的表达不是感兴趣的。特别地,通过确定由egfp阳性细胞的百分比(图3中的柱)反映的转染率;并通过确定由egfp阳性细胞的平均荧光强度(mfi)(图3中的菱形)反映的egfp的表达水平来量化实验的成功。如图3所示,与由能够顺式复制的复制子(“顺式复制子rna”)表达的复制酶相比,反式复制系统(其中复制酶以mrna的形式反式提供)产生更高百分比的egfp阳性细胞以及更高的egfp阳性细胞的平均荧光强度。因此,由能够顺式复制的复制子表达的复制酶对于扩增反式复制子的亚基因组转录物的效力较低,导致转基因表达水平较低。另外,如从egfp阳性细胞的百分比中推断的(图3中的柱),包含共同递送到bhk21细胞中的复制酶mrna和反式复制子rna的系统,更有可能有效地复制反式复制子。
总之,可以得出结论,当使用mrna递送复制酶时,在反式复制系统中表达目的基因更有效。
实施例2:由mrna编码的复制酶和编码转基因的反式复制子组成的反式复制系统在原代细胞中也提供高水平的转基因表达,并且与编码转基因的顺式复制子相比引起更高的表达。
使能够顺式复制的rna复制子(“egfp-复制子rna”);或编码复制酶的mrna(“复制酶mrna”)与rna反式复制子(“egfp反式复制子rna”)一起转染到原代人包皮成纤维细胞中(图4)。为了降低蛋白激酶r的活性,将编码痘苗病毒蛋白e3的mrna添加到每个rna样品中。通过将rna或rna的混合物与rnaimax转染试剂组合并将该制剂添加到细胞培养基中来进行转染(因此可能是在相同脂质体中共同递送rna)。
通过测量egfp的荧光,即通过确定egfp阳性细胞的百分比(图4中的柱)并通过确定egfp阳性细胞的平均荧光强度(mfi)(图4中的菱形)来确定目的基因的表达。反式复制系统(“egfp反式复制子rna”连同“复制酶mrna”)产生比顺式复制系统(“egfp-复制子rna”)更高的egfp阳性细胞百分比以及更高的egfp阳性细胞的平均荧光强度。因此,在反式复制系统的情况下,发生编码转基因的rna的生产性复制的可能性更高。在两个系统中,建立生产性复制的可能性是剂量依赖性的,但50ng反式复制子rna与625ng参考复制子(顺式复制子)一样有效;并且10ng反式复制子与500ng参考复制子一样有效。此外,反式复制系统产生比参考复制子更高的每个细胞的转基因表达水平(由mfi反映)(图4中的菱形)。
实施例3:目的蛋白的产生依赖于复制酶的剂量。
如图5a所示,将编码复制酶的rna(“复制酶mrna”)与rna反式复制子(“反式复制子”)和e3mrna一起脂质转染到原代人包皮成纤维细胞中。rna反式复制子编码分泌型报告蛋白nanoluc萤光素酶作为目的基因。如通过测量分泌型nanoluc所证明的(图5a),蛋白质产生的效率可以通过复制酶rna的量以剂量依赖性方式调节。
实施例4:修饰复制酶构建体的密码子使用是不利的非多肽序列修饰之修饰。
在本实施例中,使用反式复制系统,其中复制酶构建体编码myc标记的nsp3。将myc标签插入nsp3的可变区以允许通过western印迹用抗myc抗体检测nsp3的水平(反映总复制酶量)。插入nsp3可变区不影响复制酶多蛋白的活性(spuul等,2010,j.virol,第85卷,第7543-7557页)。myc标记的复制酶的密码子使用(“复制酶wt密码子使用”)任选地调整为智人密码子使用(以产生“复制酶hs密码子使用”)。如所示,将编码egfp作为目的基因的反式复制子与不同量的复制酶rna一起共同脂质转染到bhk21细胞中(图5b)。
通过测量egfp的荧光,即通过确定egfp阳性细胞的百分比(图5b中的柱);并且通过测定egfp阳性细胞的平均荧光强度(mfi)(图5b中的菱形)来确定目的基因的表达。
密码子使用的修饰引起复制酶水平(myc标记的nsp3的水平)提高,但这不利于来自编码egfp的反式复制子的目的基因的表达:与非密码子优化的复制酶rna相比,来自密码子优化的rna的高得多的复制酶表达未通过更高的egfp表达反映(图5b中的菱形),并且如egfp阳性细胞的百分比(图5b中的柱)所示,建立反式复制子的生产性复制的可能性降低。
实施例5:可以在体内实现由根据本发明的复制子编码的转基因的有效表达。
将编码复制酶的ivtrna与rna反式复制子和编码痘苗病毒蛋白e3的mrna一起重悬于磷酸盐缓冲盐水(pbs),并共同注射到小鼠中(皮下)或胫骨前肌内(肌内)。反式复制子的开放阅读框编码报告蛋白萤光素酶作为目的蛋白。
使用两组动物,每组3只。每只动物在两个位置注射。如所述测量体内萤光素酶表达(kuhn等,2010,genether.,第17卷,第961-971页)。如分别在肌内(i.m.)和皮内(i.d.)共同注射rna后的小鼠的生物发光成像(bli)所示,表达持续至少9天。结果如图6所示。
实施例6:用包含编码流感ha作为目的蛋白的根据本发明的复制子的反式复制系统接种,提供了对致死病毒感染的保护。
如图7所示,用编码血球凝集素(ha)作为目的基因的rna复制子(图7中:“r-ha”);或者用编码复制酶的rna(图7中的“复制酶”)和用编码血球凝集素(ha)作为目的基因的反式复制子rna(图7中的“tr-ha”)在3周内皮内接种balb/c小鼠两次(初次免疫-加强免疫)。为了增强翻译,如所指出的,共同转染编码痘苗病毒e3的mrna。对照动物用灭活病毒(iav)接种或接受溶剂(pbs)。
在用致死剂量的流感病毒攻击感染前一天,收集所有动物的血清并用于确定病毒中和滴度(vnt)。在参考复制子组中,所有动物显示了接近iav处理的动物的滴度的vnt。在反式复制子组中,vnt提高,共转移的复制酶mrna越多。当复制酶mrna相对于反式复制子14倍过量时,实现了与复制子对照中一样高的vnt,这意味着只有20%的编码抗原的rna(1μgtr-ha对比5μgr-ha)产生相当的vnt滴度(图7a)。
还对小鼠血清进行血球凝集素抑制(hai)测定。所有rna接种的动物显示出相当的hai滴度(图7b)。
监测攻击感染后小鼠的存活率。缓冲液处理的小鼠在5天内死亡。除了在用tr-ha和15μge3接种的组中有一个例外之外,所有接种疫苗的小鼠均存活(图7c)。
总之,可以得出结论,用编码ha的反式复制子进行疫苗接种提供了对致死病毒感染的保护,并且允许降低编码抗原的rna的量。
实施例7:帽的影响。
用由自切割肽p2a(猪捷申病毒属-12a)分离的编码egfp和secnluc(分泌型萤光素酶)的反式复制子rna,与β-s-arca(d2)加帽的复制酶mrna或在复制酶orf上游具有ires(emcv)(来自脑心肌炎病毒的内部核糖体进入位点)的未加帽的mrna一起对bhk21细胞进行电穿孔。电穿孔后24小时,通过facs分析细胞的egfp表达(图8a),通过nano-
如图8a中所示,加帽的复制酶mrna引起建立反式复制子复制的更高可能性,如通过egfp阳性的百分比(柱)所测量的;以及阳性细胞中更高的egfp表达水平(菱形)。
为了量化差异,测量分泌的萤光素酶的活性并显示出两种复制酶mrna都是功能性的(测定背景为约10rlu),但是当使用加帽的mrna时,如图8b所示,所述的反式复制系统的效力高37倍。
如图8c中所示,上述观察的原因是如通过用抗myc抗体探测样品所示(上部印迹),与ires(右侧泳道)相比,当表达是由帽(左侧泳道)驱动时,复制酶蛋白浓度更高。如已在图8a中所示,用抗egfp抗体探测样品(中部印迹)证实了更高的egfp表达。通过用相应的抗体检测细胞蛋白质α-微管蛋白(下部印迹)来确定凝胶的相同加样量。
- 还没有人留言评论。精彩留言会获得点赞!