用于微藻的选择性生物反应器的制作方法
本发明涉及用于选择微藻株系的生物反应器。本发明还涉及用于选择微藻株系的方法。
背景技术:
存在原核以及真核光合微生物,这些光合微生物合在一起构成术语“微藻”。原核光合微生物以蓝藻细菌(有时被称作“蓝绿藻”)为代表。真核光合微生物以众多的类别为代表,其中可提及绿藻纲(chlorophycées)、硅藻(diatomées)、金藻纲(chrysophycées)、颗石纲(coccolithophycées)、裸藻纲(euglénophycées)以及红藻纲(rhodopycées)。通常而言,微藻细胞的尺寸在1μm和100μm之间。
目前的估计表明存在超过一百万物种的微藻,其中几万个物种被编入了目录。微藻是普遍存在的并且它们被同样地发现于淡水、半咸水和海水中。
微藻的生产是快速增长的行业。这是因为微藻合成大量具有不同性质的产品,其中可提及蛋白质、抗氧化剂、色素以及长链多不饱和脂肪酸dha(二十二碳六烯酸)和epa(二十碳五烯酸)。
因而,微藻在多个技术领域中有应用,并且尤其在化妆品工业、制药工业、水产养殖、功能性食品或者食品补充剂中有应用。
微藻还用于生物能的生产。微藻具有捕获光能的能力以在能量分子中从二氧化碳(co2)固定和代谢无机碳。微藻与co2的结合以及微藻常常富含糖或者油的事实意味着微藻在生物燃料的生产中具有很大益处。这种结合也是微藻所具有的净化性能的来源。
微藻是光合物种。微藻的细胞需要光以增殖。微藻可使用自然光(太阳光)或者人工光培养。存在培养池(也被称作“跑道”池)类型的开放培养系统,以及例如间歇式生物反应器、补料分批生物反应器或连续式生物反应器的封闭培养系统。
通常而言,所有的培养系统具有旨在接收包含营养素的培养基的槽。微藻分散于培养基中并且接收光。连续式生物反应器具有的优点在于具有与控制器相关联的用于培养基的输入和输出。控制器使得能够连续地控制槽在一个工作周期期间处于在培养基中的选定的微藻浓度。
在开放或者封闭培养系统中,光主要被接近光源的细胞吸收。当微藻密度高时,大部分的光不能深入地穿透槽。因此,在槽中深度处的微藻位于黑暗中并且不能合适地增殖。
该培养系统具有接近光源的细胞的过度曝光的问题以及在培养基中位于深度处的细胞的曝光不足的问题。这种在培养系统内的光梯度限制了微藻的生产。
现有技术提出了一种在于基因修饰微藻的方法。该方法包括减少集光复合物(叶绿素分子)的尺寸或者数目和/或改进在微藻的不同色素(尤其是叶绿素a、叶绿素b、叶绿素c、类胡萝卜素和其它色素)之间的比,以使得它们更加透明。
文献wo2014/089533公开了具有减少的集光复合物的突变的微藻。
在该方法中,每一个微藻细胞捕获少量的光,使得光能够深入地穿透槽。位于距离光源最远区域的细胞因此遮蔽较少。然而,该方法需要复杂且昂贵的基因工程方法或者突变选择方法,例如通过紫外线或γ辐照的化学诱变或者处理。此外,该培养系统仅包含单一类型的突变体:这些是微藻单一培养物。单一培养物是不太稳健的,尤其当遭遇工业生产条件时。现有技术还提出了在于选择富含用在生物燃料生产中的成分的微藻株系的方法。
文献wo2013/012329公开了用于选择具有提高的储存用于生产生物燃料的成分的能力的微藻的方法。
在该方法中,不同的微藻株系的培养物经受营养应激。只有能够储存高密度营养素的株系在这种应激下存活。这种株系在上文所述的培养系统中被收集和培养。与光梯度相关的问题仍然存在。
技术实现要素:
本发明将改善这种情况。
为此,本发明将引入一种生物反应器,其包含光源;面向所述光源的光传感器;以及设置在该光源和该光传感器之间的旨在接收包含光合微生物的细胞培养物的培养基的槽;连接至该光传感器以在工作周期期间控制槽处于在培养基中的选定的细胞培养物浓度的控制器,所述光源能够在槽的方向上发射具有输入光强度的入射光,并且该光传感器能够测量输出光强度以及向该控制器传送与该强度相关的数据以用于控制该槽;以及光源的控制系统,该控制系统被设置以在小于或等于所述工作周期的时间周期期间将该输入光强度调节为使得能够在至少一些所述光合微生物中诱导细胞应激的设定值。
该设定值可大于或等于500μmol量子/m2·s。其优选大于或等于800μmol量子/m2·s。在培养基中的选定的细胞培养物浓度(xi)可在0.001g/l和10g/l之间。
根据一种实施方案,在培养基中的选定的细胞培养物浓度(xi)在0.001g/l和0.1g/l之间,优选在0.05g/l和0.1g/l之间。
该控制系统可被设置以将光调节为处于低于设定值的休眠值的输入光强度(iin),并且在该工作周期期间在该休眠值和该设定值之间转换。该控制系统可被设置以确定第一辐照周期,对于该第一辐照周期来说将光调节为处于休眠值的输入光强度(iin),和第二辐照周期,对于该第二辐照周期来说将光调节为该设定值,该第一辐照周期大于该第二辐照周期,并且被设置以应用相继的第一和第二辐照周期。该第一和第二辐照周期可被确定以便从该休眠值和该设定值计算的在该工作周期期间的输入光强度(iin)的平均值小于或等于所述设定值的三分之一。在一种实施方案中,该第一辐照周期是该第二辐照周期的至少三倍。该控制系统可被设置以确定多个第一和第二辐照周期,在该多个第一和第二辐照周期期间,在每一个第一辐照周期期间将光调节为处于该休眠值的输入光强度(iin)并且在每一个第二辐照周期期间将光调节为处于该设定值的输入光强度(iin)。该控制系统可被设置以确定在每一个第二辐照周期的该设定值。
在另一实施方案中,在培养基中的选定的细胞培养物浓度(xi)在0.1g/l和10g/l之间,优选在1g/l和10g/l之间。在该实施方案中,该控制系统可被设置以维持输入光强度(iin)在该设定值以便输出光强度(iout)在小于或等于该工作周期的时间周期期间基本上恒定。
本发明还涉及用于选择光合微生物的方法,包括以下步骤:
1.提供生物反应器,其包含光源,以及面向该光源设置的旨在接收包含光合微生物的细胞培养物的培养基的槽(cuve),所述光源能够在槽的方向上发射具有输入光强度iin的光,
2.用培养基填充该槽;
3.用由光合微生物构成的细胞培养物接种该培养基;
4.在工作周期期间控制该槽处于在培养基中的选定的细胞培养物浓度xi;
5.将输入光强度iin调节为使得能够在至少一些所述光合微生物中诱导细胞应激的设定值;
6.在小于或等于所述工作周期的时间周期期间维持输入光强度iin处于该设定值以便引起至少一部分的所述光合微生物的细胞降解以及由此选择具有提高的耐受光抑制性的光合微生物;以及
7.从所述培养基收集具有提高的耐受光抑制性的光合微生物。
当培养基包含由超过75%、优选超过90%、甚至更优选基本上100%的具有提高的耐受光抑制性的微生物构成的光合微生物的细胞培养物时,可进行在步骤7.的收集。
在一种实施方案中,该方法实施步骤5.和6.的相继重复,直到获得由具有提高的耐受光抑制性的微生物构成的光合微生物的细胞培养物。
本发明方法的步骤6.可包括以下子步骤:
6a.在小于所述工作周期的时间周期期间将光调节为具有处于低于该设定值的休眠值的输入光强度(iin);
6b.在小于所述工作周期的时间周期期间维持输入光强度(iin)处于该休眠值;以及
6c.在该工作周期期间在该休眠值和该设定值之间相继地转换。
本发明的方法还可包括以下步骤:
8.在生物反应器中用在步骤7.中收集的光合微生物接种培养基;以及
9.控制步骤8.的生物反应器,以用于生产由所述光合微生物构成的生物质。
在该方法中使用的生物反应器还可包含相对于槽与光源相对设置的光传感器,该光传感器能够测量输出光强度(iout)。在该实施方案中,该方法还包括测量输出光强度(iout)的步骤4a.。在该实施方案中,在步骤5.的输入光强度(iin)根据在步骤4a.中测量的输出光强度(iout)来调节。
附图说明
通过阅读以下的详细描述以及附图,可以清楚地显现本发明的其他特征以及优点,其中:
-图1显示了用于在培养系统中生产微藻的图;
-图2显示了在工作周期期间本发明的生物反应器的原理示意图;
-图3显示了在工作周期结束时图2的生物反应器的原理示意图;
-图4显示了表征野生微藻株系的不透明度以及通过本发明的生物反应器选择的株系的不透明度的图;以及
-图5显示了野生株系以及来自图4的选择的株系的生物质的生产。
具体实施方式
在下文中的附图和说明实质上含有确定的特性要素。它们构成说明书的一个组成部分,并且可因此不仅用于更好地理解本发明,还在必要时对于其定义做出贡献。
为了微藻(或者微藻生物质)的良好生产,合适的是,在富含营养素(氮、磷、硫、微量元素、维生素)的培养基中培养它们并且提供足够的光。营养素的存在对于使得微藻能够通过代谢co2转换光能来说是必要的。该转换导致生产氧气以及通过微藻的增殖(通过细胞分裂繁殖)增加生物质。
传统地,使用能够发射具有被微藻强烈吸收的波长的光的光源以获得高的生长速率。
出版物lightrequirementsinmicroalgalphotobioreactors:anoverviewofbiophotonicaspects–carvalho等人,applmicrobiologyandbiotechnology,2011年,第89卷,第5期:1275-1288页以及lightemittingdiodes(leds)appliedtomicroalgalproduction–schulze等人,trendsinbiotechnology,2014年,第32卷,第8期:422-430页描述了光在微藻培养系统中用于获得良好细胞生长的用途。
在生物反应器中,微藻可接收过量的光子,这可导致光合效率的下降。这对应于被称为非光化学猝灭的能量耗散。非光化学猝灭的现象尤其描述于文章non-photochemicalquenching.aresponsetoexcesslightenergy–müller等人,plantphysiol,2001年,第125卷,第4期:1558-1566页中。此外,过量的光子吸收可导致光合器官的劣化,这减少或者甚至阻止了微藻的增殖。该现象被称为光抑制。
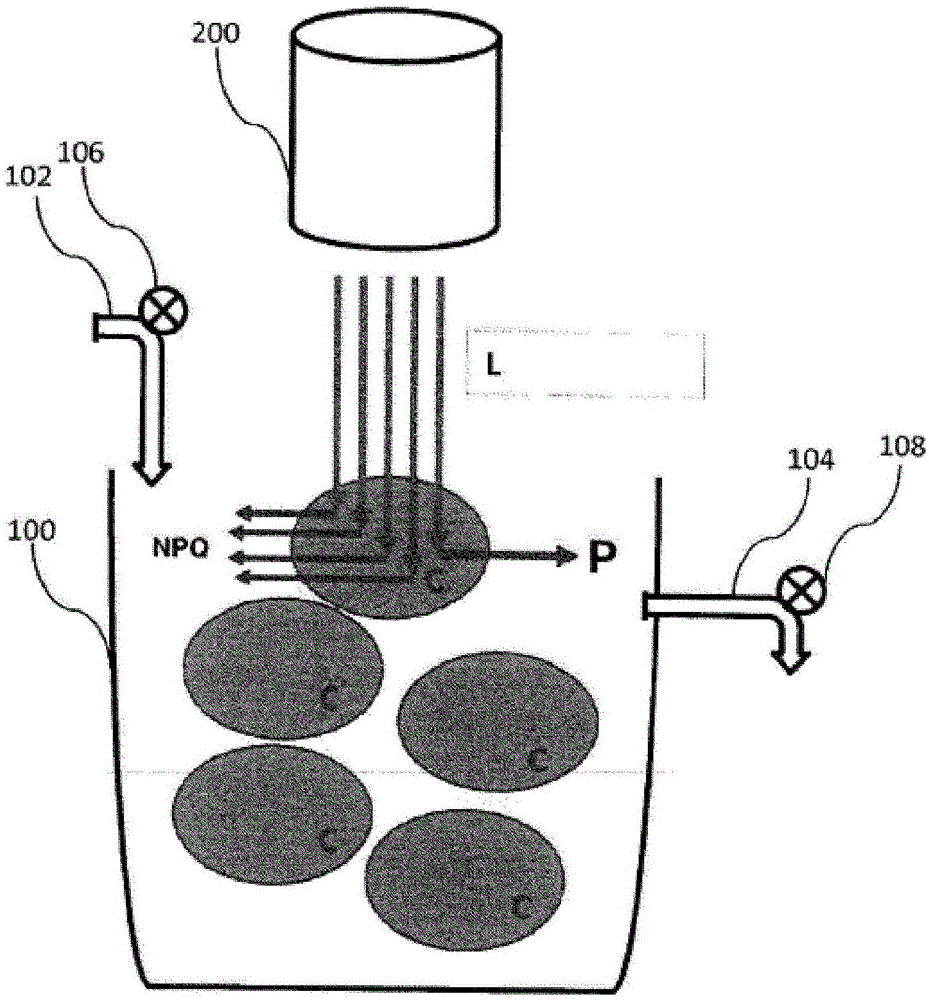
图1显示了用于在连续式生物反应器中生产微藻生物质的图。
该生物反应器包含能够接收包含微藻的培养基的槽100。微藻分散在培养基中或者为生物膜的形式。微藻由光合微生物的细胞c构成。该生物反应器包含分别与流量调节装置相关联的输入102和输出104。因而,输入102和输出104分别与第一阀(或者泵)106和第二阀(或者泵)108相关联以打开和关闭输入102和输出104。输入102和第一阀106使得能够控制在槽100中新鲜培养基的供应。输出104和第二阀108使得能够控制培养基的排出,以及在必要时的至少一些细胞c的排出。该输入和该输出使得能够连续地控制生物反应器用于生产微藻生物质p。
通常而言,在连续式培养系统中生物质的生产的控制依赖于微藻培养物的细胞生长的管理。微藻在培养基中的浓度x[g/l]根据比生长率μ(x)[h-1]以及培养基的稀释率d[h-1]变化。该稀释率d通过输入流量(l/h)除以培养基的体积(l)而定义。
微藻在培养基中的浓度x[g/l]随时间变化。对于给定的微藻株系,这种变化可由下式f1表示:
因此,对于在生物反应器的槽100中的生物质的生产(在恒定的体积下):
-如果μ(x)>d:细胞繁殖(通过细胞分裂)比细胞排出得更快;细胞的数目并且因此其浓度(生物质)将上升。
-如果μ(x)<d:细胞繁殖(通过细胞分裂)不如细胞排出得快;细胞的数目并且因此其浓度(生物质)将下降。
-如果μ(x)=d:细胞的数目随着时间保持恒定。随培养基从该槽排出的细胞的数目等于在该槽内在培养基中通过细胞繁殖获得的细胞的数目。该浓度是稳定的。
该生物反应器包含光源200。光源200能够发射入射光l。光l被典型地选择为覆盖全部太阳光谱,其包含蓝光(优选从430nm至470nm)和红光(优选从650nm至700nm)。这种波长范围能够实现微藻的良好生长速率,因为它们被后者强烈吸收。
在生物反应器的槽中的光子的吸收和代谢的光学现象被详细地描述于以下著作中:microalgalbiotechnology:potentialandproduction,c.posten和c.walter,degruyter,2012年以及handbookofmicroalgalculture:appliedphycologyandbiotechnology,第2版,a.richmond和q.hu,wiley-blackwell,2013年。
入射光l基本上照射接近光源200的微藻细胞。这些微藻接收光源200发射的大多数光子。这诱导了非光化学猝灭npq的现象以及光抑制。位于槽100的深度处的微藻细胞没有被照射或者几乎没有被照射,这阻碍了微藻细胞的增殖。这对于高细胞密度来说(即当槽100中的微藻浓度高(例如在1g/l和10g/l之间)时)尤其如此。
所得生物质的产量p并不令人满意。为了解决这个问题,现有技术的一些培养系统使用改进的混合装置促进在槽内的微藻的循环。以这种方式,所有的细胞均暴露在光下。
然而,这些装置的使用代表了显著的能量成本并且与光抑制和光梯度相关的存在的问题并没有得到解决。
本发明提出了一种截然不同的方法。因而,与尝试避免光抑制的作用不同,本发明提出利用该光抑制的作用。
本申请人令人惊讶地发现,在培养系统中光抑制使得能够选择适合于工业利用的微藻。该系统可被连续地控制或者补料分批类型的半连续地控制。
一些微藻物种能够根据所接收的光调整其感光色素的含量。该现象被称为光驯化。暴露于高光强度的微藻被这种高光强度驯化并且变得更加半透明。通过减少在细胞内的感光色素的存在,微藻尤其变得更加半透明。微藻细胞由此变得更加耐受光抑制。例如,具有提高的耐受光抑制性的物种chlorellasorokiniana是已知的,参见chlorellasorokinianautex2805,aheatandintense,sunlight-tolerantmicroalgawithpotentialforremovingammoniumfromwastewater–bashan,l.e.,trejo,a.,huss,v.a.,hernandez,j.p.,&bashan,y.,bioresourcetechnology,99(11),4980-4989页,2008年。通常而言,耐受高光强度性可源自一些物种降低其色素含量的能力。在培养系统中,这些半透明的微藻允许大部分的入射光穿过直至槽的深处。减少或者甚至解决了与在槽中的光梯度相关的问题。
然而,目前存在很少的具有提高的耐受光抑制性的已知物种。
此外,当这些微藻物种暴露于低光强度时,它们被该低光强度驯化并且变得更加不透明。因而,在高密度(如大于0.1g/l的微藻浓度)的培养系统中,在槽的深度处的平均光强度是低的。因此,微藻失去了它们在暴露于高光强度期间取得的透明性的益处。
本发明的一个目的因此尤其在于产生新的微藻株系,其即使在弱光(在低光强度)下仍具有低色素含量和/或其经历含色素器官的改性。则在培养系统中可获得更多的生物质。通常而言,光应激导致微藻细胞的适应。这种适应尤其体现于在微藻细胞内的基因突变。换句话说,通过光应激诱导的天然基因突变引起基因适应机制。基因突变能够从一个细胞传递给其子细胞并且因此能够从一代传递给下一代。基因突变可例如导致在微藻细胞中的感光器(例如叶绿素)的含量减少。基因突变也可导致提高色素的循环速率以及因此的其活跃的产生/降解,或者导致在细胞中不同色素的比率的改变。以这种方式,微藻变得更加半透明并且允许大部分的入射光穿过,这减少或者解决了与在培养系统的槽中的光梯度相关的问题。
图2显示了在工作周期期间本发明的生物反应器的原理示意图。
该生物反应器包含具有培养基的槽100。培养基包含光合微生物的细胞培养物的分散体。细胞培养物包含浓度分别为x1、x2、x3……xn的光合微生物的n个不同的株系(“不同的株系”是指一个或多个微藻物种的不同的基因型或者表型)。光合微生物的不同的株系是或多或少耐受光抑制的。槽100具有用于混合培养基的装置。
该生物反应器还包含输入102和输出104。输入102使得能够向槽100供应新鲜的培养基。输出104使得能够从槽100排出培养基和微藻。
输入102和输出104与控制器400相关联。控制器400使得能够在工作周期期间连续地控制槽100。该工作周期根据在培养基中存在的微藻株系而变化。该工作周期优选持续至少1个月(没有时间上限),这通常对应于至少20代的微藻(即20次相继的细胞分裂)。根据本发明,该工作周期大于一次微藻细胞循环所需的时间。在一种实施方案中,该工作周期持续6至12个月。
控制器400连续地控制槽100至稀释率d。为此,控制器400包含一个或多个光电元件以测量在槽100内的组合的培养基/微藻的光密度。以这种方式,该控制器可在该工作周期期间将在培养基中的细胞培养物浓度σxi维持在0.001g/l和10g/l之间、优选在0.05g/l和0.1g/l之间或者在0.1和5g/l之间,并且通过供应和排出培养基调适稀释率d。换句话说,在该工作周期期间由不同微藻株系的各自浓度x1、x2、x3……xn构成的总浓度在0.05g/l和0.1g/l之间。该浓度使得能够在槽100内实现良好的光扩散。
该生物反应器包含光源200,其发射具有足够高的输入光强度iin的入射光l以穿过填充有包含微藻分散体的培养基的槽100。在本实施方案中,光源200能够发射可一直达到5000μmol量子/m2·s的输入光强度iin。
该生物反应器还包含面向所述光源设置的用于测量穿过槽100的光l的光强度的光传感器300。穿过填充有包含微藻分散体的培养基的槽100的光的强度被称为输出光强度iout。光传感器300测量该输出光强度iout并且向控制器400传送数据以用于控制槽。经由下文所述的控制系统500,该传送可直接地或者间接地进行。
控制系统500连接至光源200并且使得能够将输入光强度iin维持恒定、增加它或者降低它。控制系统500被设置以将输入光强度iin调节到设定值。在此处描述的实施方案中,控制系统500也连接至光传感器300。与光传感器300的连接使得控制系统500能够接收通过传感器300测量的与输出光强度iout相关的数据。控制系统500因而可向控制器400传送这些数据以使得其能够连续地控制该槽处于设定浓度。
输入光强度iin以及输出光强度iout在该工作周期期间是可变化的。因而,控制系统500被设置以在小于或等于该工作周期的时间周期期间将输入光强度iin调节为该设定值。
输入光强度iin和输出光强度iout之间随时间变化的关系通过下式f2定义:
其中,ai是微藻的衰减系数(即被微藻吸收的光的量);xi是微藻的浓度;并且p是光源200和光传感器300之间的距离。
通过调节输入光强度iin,控制系统500还可控制输出光强度iout。
根据本发明,控制系统500被设置以在小于或等于所述工作周期的时间周期期间将输入光强度iin调节为设定值,从而在存在于细胞培养物中的至少一些微藻中诱导细胞应激。在一种优选的实施方案中,控制系统500被设置以将输入光强度iin调节为大于或等于500μmol量子/m2·s的设定值。
控制系统500被设置以接收与该设定值相关的数据。该设定值可尤其根据存在于槽100中的一个或多个光合微生物的物种而变化。该设定值也可根据在培养基中的细胞培养物浓度xi而变化。
该设定值在该工作周期期间可变化。在一种实施方案中,该工作周期由相继的预定的不同时间间隔周期构成。每一个时间间隔小于该工作周期。在该实施方案中,控制系统500可在每一个所述时间间隔周期期间将输入光强度(iin)调节为该设定值。该设定值可针对每一个时间间隔具体确定。该设定值可因此从一个时间间隔至另一个时间间隔是不同的。在一种优选的实施方案中,该设定值从一个时间间隔至下一个时间间隔是增加的,例如以100-200μmol量子/m2·s逐步地增加。这些时间间隔可具有相同的持续时间或者不同的持续时间。
在另一实施方案中,控制系统500可根据与通过传感器300测量的输出光强度iout相关的数据控制输入光强度iin。在该实施方案中,控制系统500可被设置以接收来自传感器300的数据,然后根据所接收的数据调整输入光强度iin至期望的设定值。
控制系统500可被设置以将输入光强度(iin)维持在设定值,以便输出光强度(iout)在小于或等于该工作周期的时间周期期间基本上恒定。
在一种实施方案中,输出光强度(iout)可在整个工作周期期间基本上恒定。在该实施方案中,控制系统500因此将输入光强度(iin)调节为该设定值并且在整个工作周期期间维持该设定值。该光强度(iin)例如根据在培养基中的细胞培养物浓度xi而调整。该浓度增加得越多,该光强度(iin)下降得越多以维持恒定的输出光强度(iout)。
在另一实施方案中,输出光强度(iout)在小于该工作周期的预定时间周期期间基本上恒定。在该实施方案中,控制系统500在该预定时间周期期间(例如也根据在培养基中的细胞浓度的变化)将输入光强度(iin)调节为该设定值。
在另一实施方案中,输出光强度(iout)在不同的预定时间间隔周期期间基本上恒定,每一个预定时间间隔周期小于该工作周期。在该实施方案中,控制系统500在每一个所述的时间间隔周期期间将输入光强度(iin)调节为该设定值。该设定值可针对每一个时间间隔具体确定。该设定值可因此从一个时间间隔至另一个时间间隔是不同的。在一种优选的实施方案中,该工作周期由相继的时间间隔构成。该设定值在贯穿整个所述工作周期内是变化的并且以100-200μmol量子/m2·s逐步地增加。该时间间隔可具有相同的持续时间或者不同的持续时间。
诱导在某些微藻中的细胞应激的事实具有至少两个结果:
-第一种结果是被细胞应激影响的一些微藻可遭受光抑制现象。光合器官的一些关键蛋白质被损坏并且生长放缓。该现象可持续直到停止细胞循环;细胞停止分裂或者经历细胞死亡;
-第二种结果是被细胞应激影响的其它微藻可基因适应(尤其通过核苷酸的点突变)。它们较少被损坏并且这些微藻的细胞循环并没有停止;它们具有提高的耐受光抑制性。如上所解释的,该耐受性与这些微藻变得更加透明(低色素含量)的事实相关。
控制器400在比一次微藻细胞循环所需的时间大得多的工作周期期间连续地控制槽100处于稀释率d。
因此,槽100逐渐清空了被第一种结果影响的微藻细胞。这是因为受影响的细胞停止了分裂,并且其比生长率变得低于该流量(μ(x)<d)。
另一方面,被第二种结果影响的微藻细胞在贯穿整个工作周期内在槽100中保持出现,因为它们的比生长率(μ(x))没有受影响,或者仅轻微地受影响。
此外,具有提高的耐受光抑制性并且已经存在于细胞培养物中的微藻株系的细胞也在贯穿整个工作周期内在槽100中保持出现。它们的比生长率(μ(x))没有受影响或者仅轻微地受影响。
优选地,该工作周期大于存在于培养基中的每一个初始微藻细胞的至少20次细胞循环、优选100次细胞循环所需的时间。在本实施方案中,该工作周期是20天并且优选100天。
在一种实施方案中,控制系统500被设置以将该光调节为处于休眠值iin0的输入光强度。因而,控制系统500可相继地在被调节为该休眠值的光强度与被调节为该设定值的光强度之间转换。
在一种实施方案中,该休眠值小于或等于100μmol量子/m2·s。因而,控制系统500可在该工作周期期间在小于或等于100μmol量子/m2·s的强度iin0(被称为“低强度”)和大于或等于500μmol量子/m2·s的强度iin1(被称为“高强度”)的入射光之间相继地转换。转换时间t小于该工作周期(典型地为在30分钟和1小时之间)。因而,控制系统500可在具有诱导细胞应激的输入光强度iin1(被称为“高强度”)的光(在该周期的分段p期间)和具有低强度iin0的光(在该周期的分段(1-p)期间)之间转换。该分段p典型地为小于或等于0.1。因而,控制系统500可确定持续时间(1-p).t的在低强度下的第一辐照周期以及持续时间p.t的在高强度下的第二辐照周期。
因此被用于低密度培养的细胞所接收的平均光是
以上的参数根据微藻物种而选择和/或调适。进行选择以便一方面在高强度阶段期间诱导存在于细胞培养物中的至少一些微藻的细胞应激,并且另一方面细胞被反映高密度培养条件(它们将因而处于最大色素合成的条件下)的低平均光
根据本发明的一种实施方案,确定辐照周期以便从该休眠值和该设定值计算的在该工作周期期间的输入光强度(iin)的平均值小于或等于所述设定值的三分之一。在一种优选的实施方案中,第一辐照周期是第二辐照周期的至少三倍。可定义多个第一和第二辐照周期。在多个第一和第二辐照周期期间,可将光调节为在每一个第一辐照周期期间具有处于该休眠值的输入光强度(iin)以及将光调节为在每一个第二辐照周期期间具有处于该设定值的输入光强度(iin)。该设定值可针对每一个第二辐照周期确定。以这种方式,该设定值可在贯穿整个工作周期内变化。
在另一实施方案中,控制系统500调节输入光强度iin以便输出光强度iout基本上恒定在高至足以诱导光抑制的值。例如,该值可大于或等于500μmol量子/m2·s。在该实施方案中,在贯穿整个工作周期内,接近光源200的微藻细胞经受高强度,即经受具有被调节至能够诱导在微藻中的细胞应激的设定值的强度的光。该细胞培养物的微藻细胞的至少一部分因此持续地经受细胞应激。该实施方案对于识别具有提高的耐受光抑制性的株系来说特别有利,该具有提高的耐受光抑制性的株系初始包含在微藻群体的初始多样性中或者它们在该工作周期期间通过基因突变的方法出现。在一种实施方案中,该工作周期为6个月;输出光强度iout为1000μmol量子/m2·s;以及稀释率为0.3j-1。
如以上所解释的,在该实施方案中,该设定值可在该工作周期内逐步地变化。
图3显示了在该工作周期结束时本发明图2的生物反应器的原理示意图。
在槽100中的培养基初始包含微藻的细胞培养物的分散体,其包含在x1、x2、x3……xn的各自浓度下或多或少耐受光抑制的天然可变性的个体,不同的微藻株系或多或少耐受光抑制(参照图2)。
在该工作周期结束时,槽100包含微藻的细胞培养物的分散体,其具有浓度xsel的一个或者多个微藻株系,所述微藻株系各自具有提高的耐受光抑制性。该控制器被设置以在该工作周期期间调适稀释率d。在一种实施方案中,浓度xsel与初始浓度xi基本上相同,即在0.05g/l和0.1g/l之间。控制器400使得能够关闭输入102以及输出104,从而收集具有提高的耐受光抑制性的微藻株系。可尤其通过从槽100提取来进行该收集。
本发明的生物反应器因此使得能够获得具有提高的耐受光抑制性的光合微生物。提高的耐受性是指对于是最佳生长强度的两倍的光强度而言生长速率的少量下降(约-25%的下降)。
光强度越大,选择越严格。有利地,应激水平在该工作周期期间逐渐提高。这可通过在该工作周期期间提高平均光强度来进行,尤其通过随着该工作周期的推进提高该设定强度来进行。
本发明的生物反应器的运行独立于存在于培养基中的微藻株系的数目。在其它实施方案中,这可涉及单一培养物,即只包含一种微藻株系的培养物。在这些实施方案中,微藻细胞可通过本发明的生物反应器被适应或者转化,例如通过在其核苷酸序列中的点突变来实现。
实施例
实施例使用具有多个探测器和传感器的生物反应器。该生物反应器尤其包含用于测量培养基的温度和ph的探测器,用于测量光合辐射的par传感器,用于测量在750nm处的光学密度的浊度探测器,用于测量呼吸率的荧光氧传感器以及由捕获光iin的光电二极管或者附加的光源如led或者激光束制成的光衰减传感器。
该生物反应器还具有600nm激光屏障类型的水平传感器。该生物反应器被耦联至计算机控制的海洋环境模拟器(simulateurd'environnementmarinpilotéparordinateur(sempo)),该模拟器使得能够在实验上再现促进微藻增殖的海洋环境,参见theeffectsofacontrolledfluctuatingnutrientenvironmentoncontinuousculturesofphytoplanktonmonitoredbycomputers–bernard,o.,malara,g.,&sciandra,a.,journalofexperimentalmarinebiologyandecology,197(2),263-278页,1996年以及anautomaticdeviceforinvivoabsorptionspectraacquisitionandchlorophyllestimationinphytoplanktoncultures–lefloc'h,e.,malara,g.,&sciandra,a.,journalofappliedphycology,14(6),435-444页,2002年。该生物反应器还被耦联至使得能够确定营养素(no2和no3)浓度条件的technicon自动分析仪。该生物反应器还被耦联至使得能够监测生物质的产生的来自hiac(注册商标)公司的粒子计数器。
培养基的ph在工作周期期间借助于在培养基内的空气和co2的气泡幕发生器进行调节。培养基的温度通过包括在生物反应器的槽的周围在设定温度下的循环水的恒温器进行调节。光源包含长条状灯和/或滤光器,其使得能够在不同的光强度下照射。细胞培养物的营养素供应通过取决于浊度测量的培养基的稀释被控制。可连续地或者以可变频率添加用于产生生物质所需的营养素。
该槽主要由具有1.9升体积的不锈钢制成。该槽具有两个由有机玻璃制成的壁(可互换为聚碳酸酯壁)。接近光源设置第一壁以便光可以穿透到槽内以照射细胞培养物。第二壁接近光传感器设置以便后者可测量输出光强度。
该光源包含具有高功率电致发光二极管(led)的长条状灯。该光源能够发射具有5000μmol光子/m2·s的光强度的光。
该工作周期为6个月。该细胞培养物由tisochrysislutea细胞的野生株系组成。
所述循环由在高强度iin1(应激阶段)下大约30分钟随后在黑暗iin0(休眠阶段)中90分钟的时间周期构成。高光强度iin1在该工作周期开始时为800μmol光子/m2·s,然后其在所述循环期间逐步地增加直到1600μmol光子/m2·s。下表1显示了每个循环的细节:
表1:应用的选择循环的参数。iin1:具有被调节到该设定值的强度的光;imoyen:在一次循环期间的平均光强度;tin1=单位时隙的时长[即在高光强度下的辐照周期(或者具有被调节到该设定值的强度的第二辐照周期)];tin0=在iin0的单位时隙的时长[即休眠周期或者在低光强度下的辐照周期(或者具有被调节到该休眠值的强度的第一辐照周期)]。
此处,差值iin1-imoyen被选择以便至少大于400μmol/m2·s或者使得imoyen小于iin1的三分之一。
图4显示在该工作周期之后tisochrysislutea的野生株系的不透明度以及通过本发明的生物反应器选择的tisochrysislutea的株系的不透明度。选择的株系具有提高的耐受光抑制性。该株系可被称为“适应株系”因为其来自tisochrysislutea的野生株系的基因适应(点突变)。
不透明度的(或者有效部分的)测量显示适应株系的细胞比野生株系透明6倍多。该有效部分代表集光复合物(antennes)的总表面积。该表面积的下降等同于使得微藻更加透明。
图5显示在具有110μmol光子/m2·s光强度的连续光的间歇类型的传统培养系统中野生株系的生物质的产量以及适应株系的生物质的产量。
适应株系的生物质的产量是野生株系的生物质的产量的两倍。本发明的生物反应器因此在微藻生物质的工业生产中具有大益处。
生物质传统上在玻璃制圆柱形光生物反应器中在下述条件下以间歇类型的控制方式生产:110μmol光子/m2·s的恒定光强度、28℃的恒定温度以及8.2的恒定ph。
本发明还涉及如上所定义的生物反应器用于生产细胞培养物的生物质的用途,该细胞培养物选自绿藻纲类别,例如chlamydomonassp.,dunaliellasalina和haematococcuspluvialis,硅藻纲(diatomophyceae)类别,例如phaeodactylumtricornutum和odontellaaurita,等鞭金藻科(isochrysidaceae)类别,例如isochrysisgalbana和tisochrysislutea,共球藻纲(trebouxiophyceae)类别,例如chlorellavulgaris,和蓝藻纲(cyanophyceae)类别,例如arthrospiraplatensis。
本发明还涉及用于选择光合微生物的方法。该方法使得能够从光合微生物(或者光合微生物的细胞培养物)的群体中选择具有提高的耐受光抑制性的光合微生物的株系。选择的株系可被用于生物质的生产。所选择的光合微生物的工业利用提供了良好的生产收率。该方法包括以下步骤:
1.提供生物反应器,其包含光源和面向该光源设置的旨在接收包含光合微生物的细胞培养物的培养基的槽,所述光源能够在槽的方向上发射具有输入光强度iin的光;
2.用培养基填充该槽;
3.用由光合微生物构成的细胞培养物接种该培养基;
4.在工作周期期间控制槽处于在培养基中的选定的细胞培养物浓度xi;
5.将输入光强度iin调节为使得能够在至少一些所述光合微生物中诱导细胞应激的设定值;
6.在小于或等于所述工作周期的时间周期期间维持输入光强度iin处于该设定值,以便引起至少一部分的所述光合微生物的细胞降解以及由此选择具有提高的耐受光抑制性的光合微生物;以及
7.从所述培养基收集具有提高的耐受光抑制性的光合微生物。
细胞降解是指导致细胞从培养基中消除的任何降解。其可最特别地为细胞死亡。细胞死亡可由物理或者化学损伤引起-这涉及到细胞坏死;细胞死亡可由细胞自杀引起-这涉及到细胞凋亡。此外,其可涉及到有丝分裂死亡(细胞分裂停止),其中细胞不能再复制并且当生物反应器被连续控制时最终会从生物反应器排出。
对细胞应激敏感的细胞降解导致在培养基中耐受性细胞(或者通过基因突变已经变得具有耐受性的细胞)的群体增加。因而,当培养基包含由大于75%、优选大于90%、甚至更优选基本上100%的具有提高的耐受光抑制性的微生物构成的光合微生物的细胞培养物时进行在步骤7.的收集。
步骤6.可包括以下子步骤:
6a.在小于所述工作周期的时间周期期间将光调节为具有处于低于该设定值的休眠值的输入光强度iin;
6b.在小于所述工作周期的时间周期期间维持输入光强度iin处于该休眠值;以及
6c.在该工作周期期间在该休眠值和该设定值之间相继地转换。
当然,在该实施方案中,在步骤6.中的输入光强度iin在该设定值的维持在小于该工作周期的时间周期期间实施。这对于能够在贯穿整个工作周期内在该休眠值和该设定值之间进行转换来说是必要的。
此外,在该实施方案中,该方法可包括以下子步骤:
-确定第一辐照周期,对于该第一辐照周期来说将光调节为处于该休眠值的输入光强度iin;以及
-确定第二辐照周期,对于该第二辐照周期来说将光调节为该设定值。
出于光驯化的原因,该第一辐照周期优选大于该第二辐照周期。该实施方案因此导致相继的第一辐照周期和第二辐照周期。每一个第一辐照周期(在该第一辐照周期期间将光调节为处于该休眠值的输入光强度iin)之后是第二辐照周期(在该第二辐照周期期间将光调节为处于该设定值的输入光强度iin)。微藻细胞因而经受相继的应激阶段和光驯化阶段(或者休眠阶段)。应当注意,处于该休眠值的输入光强度iin可对应于没有光,即黑暗;因而为0μmol量子/m2·s。在其它实施方案中,该休眠值可在10和200μmol量子/m2·s之间,例如50μmol量子/m2·s或100μmol量子/m2·s。
优选地,确定第一和第二辐照周期以便从该休眠值和该设定值计算的在该工作周期期间的输入光强度iin的平均值小于或等于所述设定值的三分之一。这确保了对于细胞能在应激条件下被驯化来说足够的休眠时间。在一种特别的实施方案中,该第一辐照周期是该第二辐照周期的至少三倍。
优选地,该工作周期大于存在于培养基中的每一个初始微藻细胞的至少20次细胞循环、优选100次细胞循环所需的时间。
有利地,该方法实施步骤5.和6.的相继重复,直到获得基本上由具有提高的耐受光抑制性的微生物构成的光合微生物的细胞培养物。这些步骤的重复使得能够获得令人满意的选择并且促进细胞的光驯化。
该方法还可包括以下步骤:
8.在生物反应器中用在步骤7.中收集的光合微生物接种培养基;以及
9.控制步骤8.的生物反应器以用于生产由所述光合微生物构成的生物质。
该步骤可在相同的生物反应器中或者在特别适合于生产生物质的单独的生物反应器中进行。例如,该生物反应器可为培养池(“跑道”类型的池)以及封闭培养系统如间歇式生物反应器、补料分批生物反应器或者连续式生物反应器。
本发明的方法还可包括子步骤4a.,该子步骤4a.包括测量输出光强度iout。则在步骤5.的输入光强度iin可根据在步骤4a.中测量的输出光强度iout来调节。在该实施方案中,该生物反应器包含相对于该槽与所述光源相对设置的光传感器(该传感器面向该光源)。设置该光传感器以便测量输出光强度(iout)。
优选地,输入光强度iin的设定值大于或等于500μmol量子/m2·s。在一种特别的实施方案中,该设定值大于或等于800μmol量子/m2·s。
在另一特别的实施方案中,该设定值在该工作周期内逐步地增加(例如以200μmol量子/m2·s逐步地增加)。这使得能够进一步增加选择。因此能实现更为严格的选择。在该工作周期结束时,只有高耐受光抑制性的微藻留存在培养基中。可尤其相继地应用以下的设定值:800μmol量子/m2·s;1000μmol量子/m2·s;1200μmol量子/m2·s;1400μmol量子/m2·s;1600μmol量子/m2·s。将输入光强度iin调节为该设定值的阶段可任选地随后为将输入光强度iin调节为该休眠值的阶段,该休眠值例如为接近或等于0μmol量子/m2·s(黑暗)或者接近50-100μmol量子/m2·s的值。这使得微藻能够被驯化并且在必要时开始在分子水平的修饰(尤其是基因突变)。
优选地,在浓度(例如在0.001g/l-10g/l、优选在0.05g/l和0.1g/l之间或者在0.1g/l和5g/l之间的值)下进行在步骤4.中的控制。
- 还没有人留言评论。精彩留言会获得点赞!