蛋白质OsMADS27在调控植物种子的萌发时间和调控植物种子的休眠中的应用的制作方法
本发明涉及生物技术领域,具体涉及蛋白质osmads27在调控植物种子的萌发时间和调控植物种子的休眠中的应用。
背景技术:
种子休眠是植物适应多变自然环境的一个重要生物学特性。对农作物而言,由于休眠能够直接影响其产量、种子品质以及农业生产和应用,因此受到遗传和育种学家的广泛关注。深入研究水稻种子的休眠机制,对于提高粮食产量和品质具有极其重要的实际意义。水稻作为重要的农作物之一,其种子的萌发是保证作物正常生长进而保证产量的第一个也是很重要的一个环节。目前为止,对如水稻种子休眠机制的了解仍知之甚少。
技术实现要素:
本发明所要解决的技术问题是如何促进植物种子的萌发和/或解除植物种子的休眠。
为解决上述技术问题,本发明首先提供了蛋白质osmads27在调控植物种子的萌发时间和/或调控植物种子的休眠中的应用。蛋白质osmads27的中文名称为水稻mads-box转录因子27。
上述应用中,所述蛋白质osmads27可为a1)或a2)或a3):
a1)氨基酸序列是序列表中序列2所示的蛋白质;
a2)在序列表中序列2所示的蛋白质的n端或/和c端连接标签得到的融合蛋白质;
a3)将序列表中序列2所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与植物种子的萌发时间和/或植物种子的休眠相关的蛋白质。
其中,序列表中序列2由240个氨基酸残基组成。
为了使a1)中的蛋白质便于纯化,可在序列表中序列2所示的蛋白质的氨基末端或羧基末端连接上如表1所示的标签。
表1标签的序列
上述a3)中的蛋白质,所述一个或几个氨基酸残基的取代和/或缺失和/或添加为不超过10个氨基酸残基的取代和/或缺失和/或添加。
上述a3)中的蛋白质可人工合成,也可先合成其编码基因,再进行生物表达得到。
上述a3)中的蛋白质的编码基因可通过将序列表中序列1所示的dna序列中缺失一个或几个氨基酸残基的密码子,和/或进行一个或几个碱基对的错义突变,和/或在其5′端和/或3′端连上表1所示的标签的编码序列得到。
编码所述蛋白质osmads27的核酸分子在调控植物种子的萌发时间和/或调控植物种子的休眠中的应用也属于本发明的保护范围。
上述应用中,编码所述蛋白质osmads27的核酸分子可为如下b1)或b2)或b3)或b4)所示的dna分子:
b1)核苷酸序列是序列表中序列1所示的dna分子;
b2)编码区如序列表中序列1所示的dna分子;
b3)与b1)或(b2)限定的核苷酸序列具有75%或75%以上同一性,且编码所述蛋白质osmads27的dna分子;
b4)在严格条件下与(b1)或(b2)限定的核苷酸序列杂交,且编码所述蛋白质osmads27的dna分子。
其中,所述核酸分子可以是dna,如cdna、基因组dna或重组dna;所述核酸分子也可以是rna,如mrna或hnrna等。
序列表中序列1由723个核苷酸组成,序列表中序列1的核苷酸编码序列表中序列2所示的氨基酸序列。
本领域普通技术人员可以很容易地采用已知的方法,例如定向进化和点突变的方法,对本发明的蛋白质osmads27的核苷酸序列进行突变。那些经过人工修饰的,具有与本发明分离得到的蛋白质osmads27的核苷酸序列75%或者更高同一性的核苷酸,只要编码蛋白质osmads27且具有蛋白质osmads27功能,均是衍生于本发明的核苷酸序列并且等同于本发明的序列。
这里使用的术语“同一性”指与天然核酸序列的序列相似性。“同一性”包括与本发明的编码序列表的序列2所示的氨基酸序列组成的蛋白质osmads27的核苷酸序列具有75%或更高,或80%或更高,或85%或更高,或90%或更高,或95%或更高同一性的核苷酸序列。同一性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。
上述任一所述的应用中,所述调控植物种子的萌发时间可为促进植物种子的萌发或延迟植物种子的萌发。
上述任一所述的应用中,所述调控植物种子的休眠可为解除植物种子的休眠或延长植物种子的休眠。
上述任一所述的应用中,所述植物可为如下c1)至c6)中的任一种:
c1)双子叶植物;
c2)单子叶植物;
c3)禾本科植物;
c4)水稻;
c5)水稻osmads27-1突变体;
c6)水稻osmads27-3突变体。
上述应用中,水稻osmads27-1突变体和水稻osmads27-3突变体具体可为美国ucd突变体库(网址为http://sundarlab.ucdavis.edu/rice/seedorder/instructions.htm)的产品,编号分别为rgt1942_5.1和rgt395_5.1。osmads27-1突变体和osmads27-3突变体的背景均为水稻品种日本晴。
为解决上述技术问题,本发明还提供了培育转基因植物的方法。
本发明所提供的培育转基因植物的方法,具体可为培育转基因植物的方法一,包括将编码所述蛋白质osmads27的核酸分子导入出发植物中,得到转基因植物的步骤;所述转基因植物与所述出发植物相比种子提前萌发和/或种子的休眠解除。
上述培育转基因植物的方法一中,编码所述蛋白质osmads27的核酸分子可为如下b1)或b2)或b3)或b4)所示的dna分子:
b1)核苷酸序列是序列表中序列1所示的dna分子;
b2)编码区如序列表中序列1所示的dna分子;
b3)与b1)或(b2)限定的核苷酸序列具有75%或75%以上同一性,且编码所述蛋白质osmads27的dna分子;
b4)在严格条件下与(b1)或(b2)限定的核苷酸序列杂交,且编码所述蛋白质osmads27的dna分子。
其中,所述核酸分子可以是dna,如cdna、基因组dna或重组dna;所述核酸分子也可以是rna,如mrna或hnrna等。
序列表中序列1由723个核苷酸组成,序列表中序列1的核苷酸编码序列表中序列2所示的氨基酸序列。
所述“将编码所述蛋白质osmads27的核酸分子导入出发植物中”可通过向出发植物中导入重组载体实现;所述重组载体可为向载体插入编码所述蛋白质osmads27的核酸分子得到的重组质粒。所述重组载体具体可为重组质粒pcambia23a-osmads27。所述重组质粒pcambia23a-osmads27的构建过程如下:(1)用限制性内切酶bamhi和kpni双酶切质粒osjnba0079m09,回收约12kb的片段;(2)用限制性内切酶bamhi和kpni双酶切载体pcambia23a,回收载体骨架;(3)将片段和载体骨架连接,得到重组质粒pcambia23a-osmads27。所述重组质粒pcambia23a-osmads27表达序列表中序列2所示的osmads27蛋白。
本发明所提供的培育转基因植物的方法,具体可为培育转基因植物的方法二,包括在出发植物中抑制所述蛋白质osmads27的表达和/或活性,得到转基因植物的步骤;所述转基因植物与所述出发植物相比种子延迟萌发和/或种子的休眠延长。
上述培育转基因植物的方法二中,所述“在出发植物中抑制所述蛋白质osmads27的表达和/或活性”可通过t-dna插入、rna干扰、同源重组、基因定点编辑等本领域熟知的方法,达到在出发植物中抑制所述蛋白质osmads27的表达和/或活性的目的。
为解决上述技术问题,本发明还提供了植物育种方法。
本发明所提供的植物育种方法,具体可为植物育种方法一,包括如下步骤:增加植物中所述蛋白质osmads27的含量或活性,从而种子提前萌发和/或种子的休眠解除。
上述植物育种方法一中,所述“增加植物中所述蛋白质osmads27的含量或活性”可通过多拷贝、改变启动子、调控因子、转基因等本领域熟知的方法,达到增加植物中所述蛋白质osmads27的含量或活性的效果。
本发明所提供的植物育种方法,具体可为植物育种方法二,包括如下步骤:降低植物中所述蛋白质osmads27的含量或活性,从而种子延迟萌发和/或种子的休眠延长。
上述植物育种方法二中,所述“降低植物中所述蛋白质osmads27的含量或活性”可通过rna干扰、同源重组、基因定点编辑等本领域熟知的方法,达到降低植物中所述蛋白质osmads27的含量或活性的目的。
上述任一所述的方法中,所述植物可为如下c1)至c6)中的任一种:
c1)双子叶植物;
c2)单子叶植物;
c3)禾本科植物;
c4)水稻;
c5)水稻osmads27-1突变体;
c6)水稻osmads27-3突变体。
上述方法中,水稻osmads27-1突变体和水稻osmads27-3突变体具体可为美国ucd突变体库(网址为http://sundarlab.ucdavis.edu/rice/seedorder/instructions.htm)的产品,编号分别为rgt1942_5.1和rgt395_5.1。osmads27-1突变体和osmads27-3突变体的背景均为水稻品种日本晴。
上文中,所述转基因植物理解为不仅包含将所述核酸分子转化受体植物得到的第一代转基因植物,也包括其子代。对于转基因植物,可以在该物种中繁殖所述核酸分子,也可用常规育种技术将所述核酸分子转移进入相同物种的其它品种,特别包括商业品种中。所述转基因植物包括种子、愈伤组织、完整植株和细胞。
实验证明,向水稻osmads27-1突变体或水稻osmads27-3突变体中导入蛋白质osmads27的编码基因,得到种子提前萌发和/或种子的休眠解除的转基因植物。因此,蛋白质osmads27在调控植物种子的萌发时间和调控植物种子的休眠中具有重要的理论意义和实用价值。
附图说明
图1为osmads27-1突变体和osmads27-3突变体的分子鉴定。
图2为osmads27-1突变体和osmads27-3突变体的表型观察。
图3为表达模式分析。
图4为原位杂交分析。
图5为利用互补实验验证osmads27基因与osmads27-1突变体表型的相关性。
图6为实施例4的实验结果。
图7为实施例5的实验结果。
图8为实施例6的实验结果。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。
下述实施例中的实验方法,如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
osmads27-1突变体(编号为rgt1942_5.1)和osmads27-3突变体(编号为rgt395_5.1)均购自美国ucd突变体库(网址为http://sundarlab.ucdavis.edu/rice/seedorder/instructions.htm)。osmads27-1突变体和osmads27-3突变体的背景均为水稻品种日本晴。osmads27-1突变体以下简称27-1。osmads27-3突变体以下简称27-3。
水稻品种日本晴购自中国农科院作物科学研究所。水稻品种日本晴在下文中命名为野生型水稻或wt。
trizolrna提取试剂和反转录试剂盒均为promega公司产品。原位杂交试剂为roche公司产品。根癌农杆菌eha105为天根生化科技(北京)有限公司的产品。载体pcambia23a为上海北诺生物科技有限公司的产品。质粒osjnba0079m09为中国科学院国家基因研究中心的产品,其含有osmads27基因的核苷酸序列。
光照交替培养即光培养和暗培养交替,条件为:28℃;14小时光照培养/10小时黑暗培养;光照培养时的光照强度为90μe/m2/s。
yeb液体培养基:将牛肉浸膏5g、酵母膏1g、蛋白胨5g、蔗糖5g、mgso4·7h2o0.04g溶于1l去离子水,用10mnaoh水溶液调节ph至7.2,高温高压灭菌20min。
诱导培养基:将50×n6大量母液20ml、100×b5微量母液10ml、200×ms铁盐母液5ml、1000×b5有机母液1ml、水解酪蛋白300mg、谷氨酰胺500mg、脯氨酸2.8g、2,4-d2.0mg、蔗糖30.0g和植物凝胶4.5g溶于1l蒸馏水,调节ph至5.8,121℃灭菌15min。
共培养培养基:将50×n6大量母液20ml、100×b5微量母液10ml、200×ms铁盐母液5ml、1000×b5有机母液1ml、水解酪蛋白300mg、谷氨酰胺500mg、脯氨酸2.8g、2,4-d2.0mg、蔗糖30.0g、植物凝胶4.5g、羧苄青霉素100mg和头孢霉素400mg溶于1l蒸馏水,调节ph至5.2,121℃灭菌15min,待冷却至50~60℃时加入经过0.22μm过滤除菌的葡萄糖10g、羧苄青霉素100mg和头孢霉素400mg和乙酰丁香酮,乙酰丁香酮在体系中的终浓度为100μm。
一次筛选培养基:将50×n6大量母液20ml、100×b5微量母液10ml、200×ms铁盐母液5ml、1000×b5有机母液1ml、水解酪蛋白300mg、谷氨酰胺500mg、脯氨酸2.8g、2,4-d2.0mg、蔗糖30.0g、植物凝胶4.5g溶于1l蒸馏水,调节ph至5.8,121℃灭菌15min,待冷却至50~60℃时加入经过0.22μm过滤除菌的潮霉素30mg、羧苄青霉素100mg和头孢霉素400mg。
二次筛选培养基:除将一次筛选培养基中的潮霉素30mg替换为潮霉素50mg,其它成分及含量均不变。
分化培养基:将20×ms大量母液50ml、200×ms微量母液5ml、200×ms铁盐母液5ml、200×ms有机母液5ml、水解酪蛋白1000mg、谷氨酰胺500mg、蔗糖30.0g、山梨醇20g、naa0.4mg、6-ba2.0mg、kt1mg和植物凝胶4.5g溶于1l蒸馏水,调节ph至5.8,121℃灭菌15min。
生根培养基:将20×ms大量母液25ml、200×ms微量母液2.5ml、200×ms铁盐母液2.5ml、200×ms有机母液2.5ml、蔗糖15g和植物凝胶4.5g溶于1l蒸馏水,调节ph至5.8,121℃灭菌15min,待冷却至50~60℃时加入经过0.22μm过滤除菌的潮霉素30mg。
1/2ms培养液:将20×ms大量母液25ml、200×ms微量母液2.5ml、200×ms铁盐母液2.5ml、200×ms有机母液2.5ml溶于1l蒸馏水中,调节ph至5.8。
50×n6大量母液的溶质及其浓度为:141.50g/lkno3、20g/lkh2po4、23.15g/l(nh4)2so4、9.25g/lmgso4·7h2o、8.30g/lcacl2·2h2o,溶剂为水,ph自然。
100×b5微量母液的溶质及其浓度为:0.3g/lh3bo3、1g/lmnso4·4h2o、0.0025g/lcocl2·6h2o、0.0025g/lcuso4·5h2o、0.2g/lznso4·7h2o、0.025g/lna2moo4·2h2o、0.075g/lki,溶剂为水,ph自然。
1000×b5有机母液的溶质及其浓度为:2g/l甘氨酸、100g/l肌醇、1g/l烟酸、1g/l盐酸吡哆醇、10g/l盐酸硫胺素,溶剂为水,ph自然。
20×ms大量母液的溶质及其浓度为:38.00g/lkno3,8.80g/lcacl2·2h2o,7.40g/lmgso4·7h2o,3.40g/lkh2po4,33.00g/lnh4no3,溶剂为水,ph自然。
200×ms微量母液的溶质及其浓度为:4.46g/lmnso4·4h2o,0.166g/lki,1.24g/lh3bo3,1.72g/lznso4·7h2o,0.050g/lna2moo4·2h2o,0.005g/lcuso4·5h2o,0.005g/lcocl2·6h2o,溶剂为水,ph自然。
200×ms铁盐母液的溶质及其浓度为:5.56g/lfeso4·7h2o,7.46g/lna2·edta·2h2o,溶剂为水,ph自然。
200×ms有机母液的溶质及其浓度为:20g/l肌醇,100mg/l烟酸,100mg/l盐酸吡哆醇,100mg/l盐酸硫胺素,400mg/l甘氨酸,溶剂为水,ph自然。
萌发率=萌发的种子数/种子总数×100%。
实施例1、osmads27-1突变体和osmads27-3突变体的鉴定和表型观察
一、osmads27-1突变体和osmads27-3突变体的鉴定
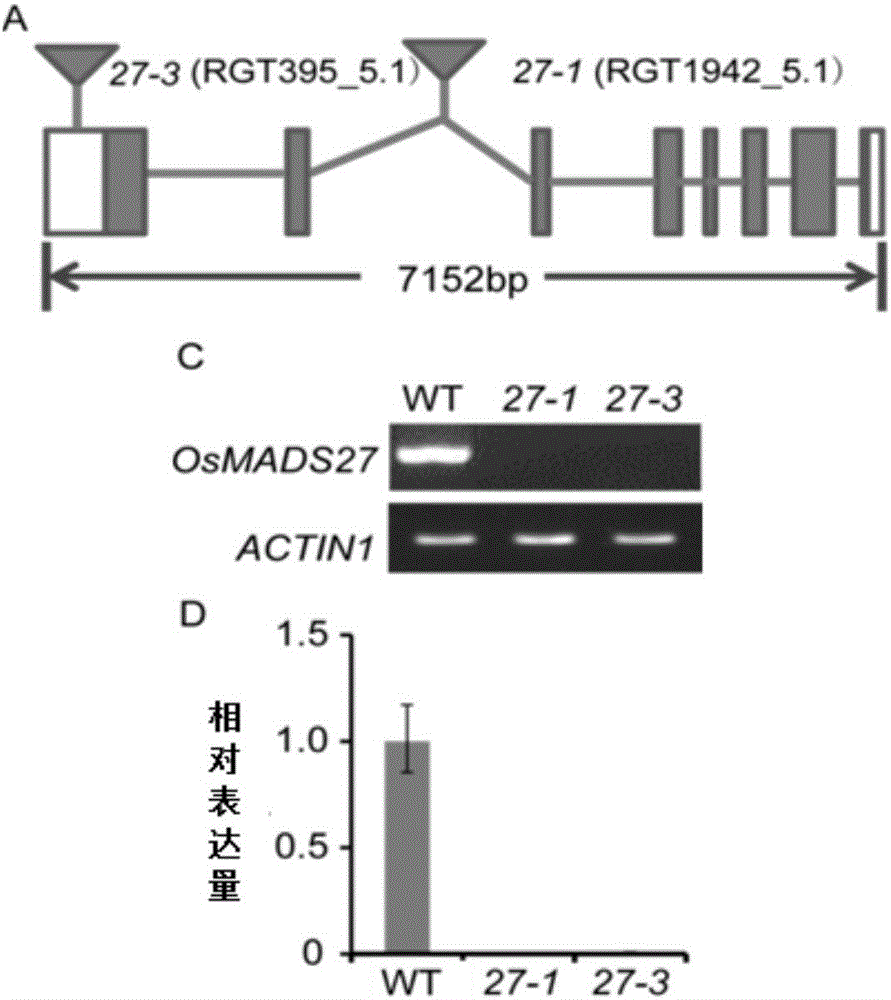
1、osmads27基因全长7152bp,包含8个外显子和7个内含子(图1中a,白色矩形代表utr,蓝色矩形代表外显子,线条代表内含子,三角形代表ds插入)。
对osmads27-1突变体和osmads27-3突变体的全基因组进行测序。
osmads27-1突变体的测序结果为:osmads27-1突变体的t-dna插入位置在第二个内含子;除插入的t-dna外,osmads27-1突变体的基因组的其它位置的核苷酸序列与水稻品种日本晴的完全一致。
osmads27-3突变体的测序结果为:osmads27-3突变体的t-dna插入位置在5′utr;除插入的t-dna外,osmads27-3突变体的基因组的其它位置的核苷酸序列与水稻品种日本晴的完全一致。
2、提取27-1或27-3的叶片的基因组dna,利用“三引物法”pcr扩增对突变体的基因型进行鉴定(引物分别为:bp(美国ucd突变体库网站上提供的ds载体边界序列)、lp和rp(lp和rp均为插入位置附近的特异序列))。
结果表明,27-1和27-3均为纯合突变体。
3、采用trizolrna提取试剂提取萌发5-7d的水稻(osmads27-1突变体、osmads27-3突变体或野生型水稻)植株的幼嫩根尖的总rna,将该总rna用反转录试剂盒反转录出第一链cdna。
以上述cdna为模板,rt-pcr检测osmads27基因的相对表达量(以actin1基因作为内参基因)。鉴定osmads27基因的引物为:5′-aagcacctaggcactggttt-3′和5′-tttccatggatgctagtgcc-3′。鉴定actin1基因的引物为:5′-ccaatcgtgagaagatgaccca-3′和5′-ccatcaggaagctcgtagctct-3′。
以上述cdna为模板,qrt-pcr检测osmads27基因的相对表达量(以actin1基因作为内参基因)。鉴定osmads27基因的引物为:5′-gccaagcatgcacttaatca-3′和5′-tcaacaagcaacaagcaagc-3′。鉴定actin1基因的引物为:5′-ccaatcgtgagaagatgaccca-3′和5′-ccatcaggaagctcgtagctct-3′。
rt-pcr的实验结果见图1中c(wt为野生型水稻),qrt-pcr的实验结果见图1中d(wt为野生型水稻)。结果表明,野生型水稻植株中可检测到osmads27基因的表达,osmads27-1突变体的植株和osmads27-3突变体的植株中不能检测到osmads27基因的表达。可见,osmads27-1突变体和osmads27-3突变体中osmads27基因被完全敲除。
二、osmads27-1突变体和osmads27-3突变体的表型观察
取osmads27-1突变体、osmads27-3突变体或野生型水稻的种子,置于装有适量1/2ms培养液的培养皿中,28℃培养(即吸水培养)120h。观察不同吸水时间的种子的萌发情况,并统计萌发率(实验重复三次取平均值,每次重复50粒种子)。
种子的萌发情况见图2中a(wt为野生型水稻,0h为吸水时间0h,36h为吸水时间36h,60h为吸水时间60h,72h为吸水时间72h,84h为吸水时间84h)。结果表明,与野生型水稻种子相比,27-1种子和27-3种子的萌发时间均延迟12~24h。
不同吸水时间时种子的萌发率见图2中b(wt为野生型水稻)。结果表明,吸水时间为72h时,野生型水稻种子的萌发率约70%,而27-1种子和27-3种子的萌发率均仅为30%;吸水时间为120h时,野生型水稻种子、27-1种子和27-3种子的萌发率均达到100%。之后的生长,27-1植株、27-3植株和野生型水稻植株在株高、根长等方面均无显著差异,可见osmads27基因特异的在种子萌发阶段发挥功能。27-1和27-3中osmads27基因的表达量及表型基本一致。
实施例2、osmads27基因的表达模式分析
一、检测不同组织中osmads27基因的相对表达量
进行三次重复试验,每次重复试验的步骤均如下:
1、获得样本
取萌发5-7d的野生型水稻植株的根,放入液氮保存,得到样本1。
取处于幼苗期的野生型水稻植株的叶片,放入液氮保存,得到样本2。
取处于抽穗期的野生型水稻植株的穗,放入液氮保存,得到样本3。
取受精第22天的野生型水稻种子的胚,放入液氮保存,得到样本4。
取野生型水稻干种子的胚,放入液氮保存,得到样本5。
取野生型水稻干种子的胚,用蒸馏水浸泡12h,然后放入液氮保存,得到样本6。
2、osmads27基因的表达模式分析
采用trizolrna提取试剂提取步骤1中样本(样本1、样本2、样本3、样本4、样本5或样本6)的总rna,将该总rna用反转录试剂盒反转录出第一链cdna。
以该cdna为模板,rt-pcr检测样本中osmads27基因的相对表达量(以actin1基因作为内参基因)。鉴定osmads27基因的引物为:5′-gcttgagacaacaactgcac-3′和5′-ttcagcatacaagggtgtag-3′。鉴定actin1基因的引物为:5′-ccaatcgtgagaagatgaccca-3′和5′-ccatcaggaagctcgtagctct-3′。
按照上述方法,将cdna替换为去离子水,其它步骤均不变,作为阴性对照。
实验结果见图3(nc为阴性对照,g为样本6,r为样本1,l为样本2,p为样本3,e22为样本4,ds为样本5)。结果表明,osmads27基因在水稻的根中的相对表达量最高,在受精第22天的胚中的相对表达量次之,在叶片和经蒸馏水浸泡12h的干种子的胚中表达量较低,在穗和干种子的胚中不表达。
二、原位杂交分析osmads27基因在根和胚中的表达情况
采用原位杂交试剂分别取野生型水稻植株的根的不同部位和处于不同发育阶段的胚进行原位杂交,以确定osmads27基因在根和胚中具体表达部位和时期。
实验结果见图4(其中f为正义探针作为对照)。结果表明,osmads27基因在根尖分生区的表达量最高(图4中a);在表皮、皮层及维管柱也有一定程度的表达(图4中b,ep为表皮,v为维管柱);在伸长区基部的表达主要集中在外皮层(图4中c,ed为外皮层);在靠近成熟区的伸长区检测不到osmads27基因的表达(图4中d);胚胎形成期(受精第3天),osmads27基因在种子的胚中不表达(图4中e);胚胎发育期(受精第8天),osmads27基因在种子的胚中表达(图4中g);胚胎成熟期(受精第15天),osma基因ds27的表达主要集中在维管系统(图4中h);受精第22天,osmads27基因的表达集中在胚根、根冠、外胚叶及胚根鞘处(图4中i,cr为胚根鞘,eb为外胚叶);种子浸泡12h后,osmads27基因的表达集中在胚根、胚根鞘(图4中j,rd为胚根,rc为根冠rootcap)。
实施例3、利用互补实验验证osmads27基因与osmads27-1突变体表型的相关性
一、互补载体的构建
1、用限制性内切酶bamhi和kpni双酶切质粒osjnba0079m09,回收约12kb的片段。
2、用限制性内切酶bamhi和kpni双酶切载体pcambia23a,回收载体骨架。
3、将步骤1回收的片段和载体骨架连接,得到重组质粒pcambia23a-osmads27,即互补载体。
二、水稻的遗传转化
1、将步骤一构建的重组质粒pcambia23a-osmads27通过电击导入根癌农杆菌eha105,得到重组农杆菌,命名为eha105-pcambia23a-osmads27。
2、将eha105-pcambia23a-osmads27单克隆接种于20ml含卡那霉素50mg/l和利福平50mg/l的yeb液体培养基,28℃、220rpm震荡培养12~16h后,然后按2%(v/v)的比例接种于含乙酰丁香酮100μm的yeb液体培养基,28℃、220rpm振荡培养至od600值达到0.5左右,得到农杆菌侵染液。
3、osmads27-1突变体的种子去壳脱粒,置于100ml三角瓶中,加入70%(v/v)乙醇水溶液浸泡30sec,再置于25%(v/v)次氯酸钠水溶液中,120rpm震荡灭菌30min,无菌水冲洗3次,用滤纸吸干水分,然后将种子胚朝下置于诱导培养基上诱导愈伤,30℃全光照诱导7天,长出的愈伤掐芽后用于水稻转化。
4、完成步骤3后,取生长状态较好的胚性愈伤组织,浸泡于步骤2得到的农杆菌侵染液,28℃、80rpm摇床轻摇愈伤,侵染30min,然后,放在铺有一层灭菌滤纸的共培养培养基上,25℃暗培养4天。
5、取步骤4得到的愈伤组织,置于一次筛选培养基,光照交替培养2周后,更换新的一次筛选培养基,愈伤组织继续光照交替培养2周,将原愈伤组织上长出的抗性愈伤组织转移至二次筛选培养基上,光照交替培养2周。
6、完成步骤5后,取生长旺盛的抗性愈伤组织,置于分化培养基,光照交替培养3周,抗性愈伤组织上分化出抗性小芽。
7、完成步骤6后,取抗性小芽,置于生根培养基,光照交替培养,得到抗性植株。待抗性植株长至6~10cm时,进行开放式水培养,长出新根后移栽温室,得到t0代拟转基因水稻植株。随机选择获得的7个t0代拟转基因水稻植株(依次命名为拟转基因水稻植株1-拟转基因水稻植株7)进行鉴定。
提取拟转基因水稻植株(拟转基因水稻植株1、拟转基因水稻植株2、拟转基因水稻植株3、拟转基因水稻植株4、拟转基因水稻植株5、拟转基因水稻植株6或拟转基因水稻植株7)的总rna,将该总rna用反转录试剂盒反转录出第一链cdna。以该cdna为模板,rt-pcr检测拟转基因水稻植株中osmads27基因的相对表达量(以actin1基因作为内参基因)。鉴定osmads27基因的引物为:5′-gcttgagacaacaactgcac-3′和5′-ttcagcatacaagggtgtag-3′。鉴定actin1基因的引物为:5′-ccaatcgtgagaagatgaccca-3′和5′-ccatcaggaagctcgtagctct-3′。
按照上述方法,将cdna替换为去离子水,其它步骤均不变,作为阴性对照。
按照上述方法,将拟转基因水稻植株替换为野生型水稻植株,其它步骤均不变,作为阳性对照。
实验结果见图5中a(1为拟转基因水稻植株1,2为拟转基因水稻植株2,3为拟转基因水稻植株3,4为拟转基因水稻植株4,5为拟转基因水稻植株5,6为拟转基因水稻植株6,7为拟转基因水稻植株7,wt为野生型水稻植株,nc为水)。能够扩增获得大小约为480bp条带的拟转基因水稻植株即为阳性t0代转基因水稻植株。因此,拟转基因水稻植株1、拟转基因水稻植株2、拟转基因水稻植株3、拟转基因水稻植株4、拟转基因水稻植株6和拟转基因水稻植株7均为阳性t0代转基因水稻植株且osmads27基因的相对表达量和野生型水稻植株无显著差异,拟转基因水稻植株5为非阳性t0代转基因水稻植株。每个植株即为一个株系,因此,上述阳性t0代转基因水稻植株依次命名为互补株系l1、互补株系l2、互补株系l3、互补株系l4、互补株系l6和互补株系l7。
将互补株系l3的t2代纯合体种子命名为bac,进行后续步骤四的实验。
三、转空载体植株的获得
按照步骤二的方法,将重组质粒pcambia23a-osmads27替换为载体pcambia23a,得到转空载体植株。
四、osmads27-1突变体植株的表型分析
将野生型水稻种子、转空载体植株的t2代纯合体种子、osmads27-1突变体种子和bac置于1/2ms培养液,25℃培养(即吸水培养)。观察萌发的种子表型,并统计培养不同时间的种子萌发率。实验重复三次取平均值,每次重复50粒种子。
结果表明,转空载体植株的t2代纯合体种子和osmads27-1突变体种子的萌发率无显著差异,萌发表型也无显著差异;bac的萌发率有较大程度的恢复(图5中c),萌发表型也有较大程度的恢复(图5中b),基本与野生型水稻一致。
结果表明,osmads27-1突变体萌发延迟的表型与osmads27基因的缺失有关,osmads27基因在调控水稻种子的萌发时间中具有重要的作用。
实施例4、osmads27-1突变体对外施植物激素的敏感程度
植物激素ga和aba在种子的萌发过程中发挥着重要作用,其中ga可以促进萌发,而aba则抑制萌发。为探究27-1萌发延迟的现象是否与ga缺乏或aba有关,进行如下实验。
一、osmads27-1突变体对ga的敏感程度
将待测种子(野生型水稻种子或osmads27-1突变体种子)置于1/2ms培养液或含5μmga的1/2ms培养液上,25℃培养(即吸水培养)。统计培养不同时间种子的萌发率。实验重复三次取平均值,每次重复30粒。
实验结果见图6中a(1/2mswt为置于1/2ms培养液的野生型水稻种子,1/2ms27-1为置于1/2ms培养液的osmads27-1突变体种子,gawt为置于含5μmga的1/2ms培养液的野生型水稻种子,ga27-1为置于含5μmga的1/2ms培养液的osmads27-1突变体种子)。结果表明,外源施加ga不能恢复27-1的表型,27-1的萌发延迟的表型不是由于ga缺乏造成的;27-1对ga的响应与野生型水稻一致,说明27-1中ga信号通路是正常的。
二、osmads27-1突变体对aba的敏感程度
将待测种子(野生型水稻种子或osmads27-1突变体种子)置于1/2ms培养液、含2μmaba的1/2ms培养液、含5μmaba的1/2ms培养液或含10μmaba的1/2ms培养液上,25℃培养(即吸水培养)5天。统计种子的萌发率。统计培养不同时间种子的萌发率。实验重复三次取平均值,每次重复30粒。
实验结果见图6中b(wt为野生型水稻种子,27-1为osmads27-1突变体种子)。结果表明,随着培养基中aba浓度的增加,萌发率逐渐降低,且27-1的萌发率降低程度更明显。表明萌发阶段27-1对aba的敏感性增强。
实施例5、种子萌发过程中aba含量的测定
1、将待测水稻种子(野生型水稻种子或osmads27-1突变体种子)用蒸馏水先浸泡0h或6h,得到待测样品。由北京林业大学的仪器中心对待测样品的胚中aba的含量进行测定,测定方法为植物激素hplc-decamax-msn分析法。
实验结果见图7中左图(wt为野生型水稻种子,27-1为osmads27-1突变体种子)。结果表明,待测种子浸泡0h或6h,osmads27-1突变体种子的aba含量均高于野生型水稻种子,这与实施例4的实验结果相一致,即27-1萌发延迟的表型与aba含量升高有关;同时浸泡6h,在野生型水稻种子和osmads27-1突变体种子中aba含量的下降程度接近,均为52%,这表明萌发阶段27-1中aba的代谢过程是正常的,造成27-1中aba含量升高的原因是种子成熟过程中aba积累量的增加,这一实验结果与浸泡0h时27-1中的aba含量高于野生型水稻种子相一致。
由北京林业大学的仪器中心对待测水稻(野生型水稻或osmads27-1突变体)受精第3天的种子、受精第8天的种子、受精第15天的种子或受精第30天的种子的胚中aba的含量进行测定,测定方法为植物激素hplc-decamax-msn分析法。
实验结果见图7中右图(wt为野生型水稻种子,27-1为osmads27-1突变体种子)。结果表明,野生型水稻受精第3天的种子和osmads27-1突变体受精第3天的种子中的aba含量接近,约为300ng/gdw,这与此阶段osmads27基因尚未表达的实验结果(见实施例2步骤二,图4中e)相一致;野生型水稻受精第8天的种子中aba含量约为450ng/gdw,而osmads27-1突变体受精第8天的种子中的aba含量约为700ng/gdw,明显高于野生型水稻;在之后的发育阶段中野生型水稻种子和osmads27-1突变体种子中aba的含量均下降,但27-1中的aba含量仍高于野生型水稻,这与osmads27基因在这些阶段均表达的实验结果(见实施例2步骤二)相一致。上述结果说明,野生型水稻和osmads27-1突变体中aba含量的差异出现在种子发育阶段,一直持续至萌发阶段。此外,受精第30天的bac中aba含量约为180ng/gdw,与野生型水稻受精第30天的种子中的aba含量约为170ng/gdw相接近,表明27-1中aba含量升高确实是由于osmads27基因缺失所致。
实施例6、osmads27-1突变体种子的休眠时间延长
1、将开花后6周的待测水稻种子(野生型水稻种子、osmads27-1突变体种子或bac)置于1/2ms培养液,25℃培养(即吸水培养)。逐日统计种子萌发率,并观察7天后的生长状态。实验重复三次取平均值,每次重复30粒种子。
结果表明,bac则可以部分恢复osmads27-1突变体的表型(图8中a)。培养7天后,野生型水稻的萌发率接近50%,bac的萌发率接近40%,而osmads27-1突变体的萌发率明显低于野生型水稻,约为20%(图8中b)。这一结果表明,造成osmads27-1突变体种子萌发延迟的真正原因是27-1种子的休眠时间延长。
2、开花后4周的待测水稻种子(野生型水稻种子、osmads27-1突变体种子或bac)、开花后6周的待测水稻种子(野生型水稻种子、osmads27-1突变体种子或bac)、开花后8周的待测水稻种子(野生型水稻种子、osmads27-1突变体种子或bac)或后熟的待测水稻种子(野生型水稻种子、osmads27-1突变体种子或bac)置于1/2ms培养液,25℃培养(即吸水培养)7d,然后统计种子萌发率。实验重复三次取平均值,每次重复30粒种子。
实验结果表明(图8中c),开花后4周的待测水稻种子均不能萌发,随着种子成熟度的提高,萌发率逐渐升高,但osmads27-1突变体种子的萌发率明显低于野生型水稻,bac的萌发率介于osmads27-1突变体和野生型水稻之间;后熟的待测种子的萌发率均达到100%,表明解除休眠后的osmads27-1突变体的萌发过程是正常的。
上述结果表明,osmads27基因缺失后,导致种子的休眠延长,进而影响了种子的萌发过程。
将实施例2至实施例6中的27-1替换为27-3,其它步骤均不变,27-3的实验结果与27-1的实验结果基本一致。
<110>中国科学院植物研究所
<120>蛋白质osmads27在调控植物种子的萌发时间和调控植物种子的休眠中的应用
<160>2
<170>patentinversion3.5
<210>1
<211>723
<212>dna
<213>水稻(oryzasatival.)
<400>1
atggggagggggaagattgtgatccgccggatcgacaactcgacgagccggcaggtgacg60
ttctcgaagcggaggaacgggatcttcaagaaggccaaggagctggccatcctctgcgac120
gccgaggtcggcctcatgatcttctccagcaccggccgcctctacgagtactccagcacc180
agcatgaagtcagttatagatcggtatggcaagtccaaggatgagcagcaagccgtcgca240
aatcccaactcggagcttaagttttggcaaagggaggcagcaagcttgagacaacaactg300
cacaacttgcaagaaaatcatcggcagttgatgggcgaagatctatctgggctgaatgtt360
aaggaattgcaatctctagagaatcagctggaaataagtctacgtagtgtccgtacaaag420
aaggaccacgtcttgattgatgaaattcatgaactgaatcggaagggaagtctagttcac480
caagaaaacatggaattatacaagaagatcagtttaattcgtcaagaaaatgctgagtta540
tataagaagatctacgagactgaaggaccaagtgaagtcaatcgggattcaccaactcct600
tacaattttgcagtaattgaaaaaacaaatgttcctgtgcaacttggactcagcacacta660
ccacaacatagtgacgccgaacaatcaactgctcctaagctagggttacagttgaatcca720
tga723
<210>2
<211>240
<212>prt
<213>水稻(oryzasatival.)
<400>2
metglyargglylysilevalileargargileaspasnserthrser
151015
argglnvalthrpheserlysargargasnglyilephelyslysala
202530
lysgluleualaileleucysaspalagluvalglyleumetilephe
354045
serserthrglyargleutyrglutyrserserthrsermetlysser
505560
valileaspargtyrglylysserlysaspgluglnglnalavalala
65707580
asnproasnsergluleulysphetrpglnargglualaalaserleu
859095
argglnglnleuhisasnleuglngluasnhisargglnleumetgly
100105110
gluaspleuserglyleuasnvallysgluleuglnserleugluasn
115120125
glnleugluileserleuargservalargthrlyslysasphisval
130135140
leuileaspgluilehisgluleuasnarglysglyserleuvalhis
145150155160
glngluasnmetgluleutyrlyslysileserleuileargglnglu
165170175
asnalagluleutyrlyslysiletyrgluthrgluglyproserglu
180185190
valasnargaspserprothrprotyrasnphealavalileglulys
195200205
thrasnvalprovalglnleuglyleuserthrleuproglnhisser
210215220
aspalagluglnserthralaprolysleuglyleuglnleuasnpro
225230235240
- 还没有人留言评论。精彩留言会获得点赞!