一种抗赤点石斑鱼神经坏死病毒青鳉单倍体胚胎干细胞的制备方法及应用与流程
本发明属于生物技术领域,具体涉及一种抗鱼类神经坏死病毒青鳉单倍体胚胎干细胞的制备方法及其应用。
背景技术:
单倍体细胞只具有一套染色体,没有等位基因的存在,细胞中每个基因均只有一个,且每个基因均能发挥自己的作用,因此单倍体细胞是研究基因功能的良好材料。目前单倍体细胞已经在基因筛选鉴定、病原学、动物育种和转基因动物等方面得到广泛的应用。例如,通过对人类单倍体细胞进行深度基因插入突变,成功鉴定粘多糖与裂谷热病毒感染密切相关。通过对人类单倍体细胞进行全基因组功能缺失筛选实验,成功鉴定一系列与汉坦病毒膜融合相关的宿主因子。
单倍体胚胎干细胞(haesc)同时具有单倍体细胞和胚胎干细胞的特性,因此更是研究基因功能的理想模型,具有巨大的应用潜力。目前,多个物种的haesc已被成功建立,包括青鳉、猴、大鼠和人等。haesc的最大优势是可以大范围筛选隐性基因,在正反向遗传学的研究中起到了重要作用,一方面可以通过基因打靶、crispr-cas9技术等方式敲除或敲入基因,让部分基因功能缺失,通过表型改变来研究目的基因的功能和作用。另一方面,通过化学诱导对基因组进行大规模突变,快速地建立涵盖整个基因组的基因突变细胞库,形成可遗传的突变表型,进而深度挖掘该表型对应的基因,最终揭示该表型的形成机制。
乙烷基亚硝基脲(ethylnitrosourea,enu)是一种人工合成的能导致多种生物体发生随机、单碱基突变的化合物。enu能不依赖于任何代谢过程,而通过烷化反应将其乙烷基加入dna碱基的部分基团,从而引起碱基配对错误。利用enu可在较短时间内诱导生物体产生大量随机突变表型,筛选获得具有特殊表型的动物或细胞模型后,可以定位克隆突变基因,联系表型特征进而推测相应基因的功能。目前enu已被广泛应用于基因功能的研究。
鱼类神经坏死病毒是一种单股正链rna病毒,隶属于诺达病毒科(nodaviridae)家族。该病毒引发的鱼类神经坏死病是一种世界范围内流行的鱼类传染性疾病,至今已有120多种鱼类被该病毒感染,被感染鱼类的死亡率高达50-100%,对世界水产养殖业造成巨大经济损失。然而,目前对该病毒的致病机制尚不清楚,特别是与该病毒感染直接相关的宿主基因尚不清楚。
技术实现要素:
本发明的目的是提供一种抗赤点石斑鱼神经坏死病毒(rgnnv)青鳉单倍体胚胎干细胞的制备方法,通过enu诱变青鳉单倍体胚胎干细胞(hx1细胞),进而筛选得到抗rgnnv青鳉单倍体胚胎干细胞g1。本发明的另一目的是提供抗rgnnv青鳉单倍体胚胎干细胞g1在抗病毒鱼的遗传育种领域的应用。
本发明的技术方案为:
一种抗rgnnv青鳉单倍体胚胎干细胞的制备方法,包括以下步骤:
(1)青鳉单倍体胚胎干细胞传代培养:将hx1细胞在esm4培养基中培养,加入蛋白补充剂,细胞用胰蛋白酶消化后传至铺有明胶的6孔细胞培养板,放置于28℃培养箱中培养24h;
(2)enu诱变:在培养基中加入浓度为10um的o6-bg预处理24h,然后去掉培养基,更换为enu终浓度为10mg/ml的esm4培养基,继续培养48h,将诱变后的hx1细胞接种于24孔细胞培养板,每孔3×104细胞,置于28℃培养箱培养24h;
(3)rgnnv感染:去掉培养基,加入含有rgnnv的esm4培养基,将存活的enu诱变hx1细胞(ehx1细胞)继续传代,ehx1细胞经连续传代稳定生长后,经胰蛋白酶消化后重悬于esm4培养基,取重悬液接种于直径为10cm的培养皿中,放置于28℃培养箱继续培养,每隔3天更换一半的培养基;
(4)制备抗rgnnv青鳉单倍体胚胎干细胞:待克隆样细胞生长至直径为200μm时,在体式显微镜下挑取克隆样细胞,并接种于提前铺有明胶的96孔细胞培养板中,待96孔细胞培养板中细胞长至密度为90%-100%时,继续先后传代至48孔细胞培养板,12孔细胞培养板和6孔细胞培养板,最终传至10cm培养皿,成功获得50个单克隆hx1细胞系,选择生长状态良好的g1细胞系。
优选地,步骤(1)中所述蛋白补充剂为青鳉胚胎提取物(mee),鱼血清和碱性成纤维细胞生长因子(bfgf)。
优选地,步骤(1)中所述胰蛋白酶质量分数为0.25%。
优选地,步骤(1)中所述6孔板中细胞含量为105个细胞/孔。
优选地,步骤(2)中所述enu浓度为10mg/ml。
优选地,步骤(3)中所述esm4培养基中rgnnv含量为moi=5。
优选地,步骤(3)中所述重悬液接种密度为104个细胞/皿。
上述抗赤点石斑鱼神经坏死病毒青鳉单倍体胚胎干细胞于2018年1月17日保藏于中国典型培养物保藏中心,保藏地址:中国武汉武汉大学,保藏编号为cctccno:c201832;保藏培养物名称为:抗鱼类神经坏死病毒青鳉单倍体胚胎干细胞g1。
上述抗rgnnv青鳉单倍体胚胎干细胞系在抗病毒鱼的遗传育种领域的应用。
本发明的有益效果如下:
本发明通过enu诱变hx1细胞,进而筛选得到抗rgnnv的青鳉单倍体胚胎干细胞g1,并对其细胞单倍性及生长特性,多能性以及病毒抗性进行研究。结果表明,g1细胞为单倍体细胞;在28℃培养条件下,g1细胞在含15%胎牛血清的esm4培养基中生长速率最快;g1细胞能够在体外形成拟胚体,且多能性相关基因在g1细胞大量表达。在rgnnv感染后,g1细胞具有抗rgnnv特性,能够抑制rgnnv的入侵,并且g1细胞对rgnnv具有清除作用。综上所述,通过enu诱导及rgnnv感染,成功获得具有抗rgnnv特性的青鳉单倍体胚胎干细胞g1,这为进一步鉴定参与病毒感染的宿主因子提供了实验和理论基础,并为抗病毒鱼的遗传育种提供了新途径。
附图说明
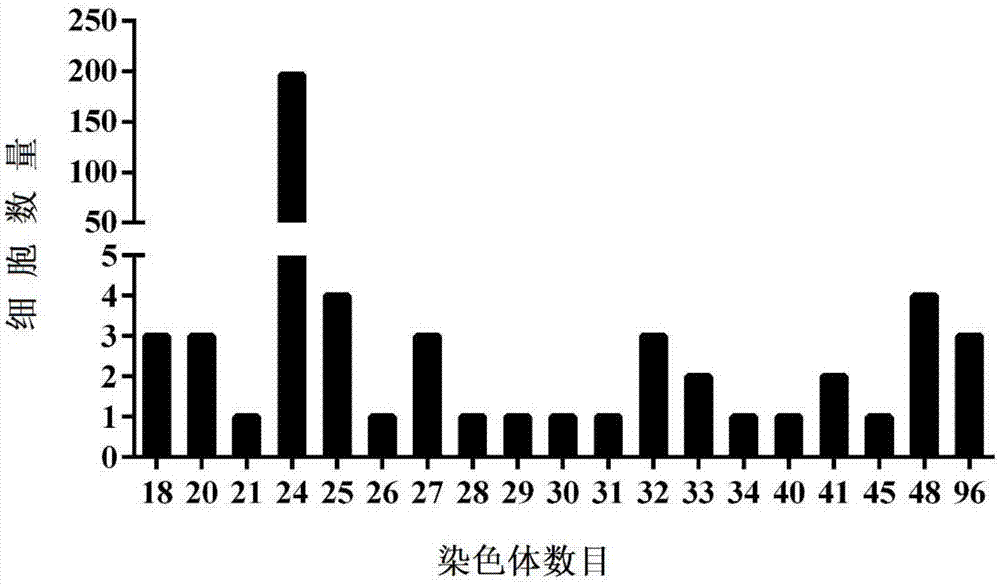
附图1为g1细胞中染色体数目分布图;
附图2为g1细胞、青鳉精巢细胞和肝细胞的细胞流式周期分析图;
附图3为g1细胞在不同浓度胎牛血清下的生长曲线图;
附图4为g1细胞在不同温度下的生长曲线图;
附图5a为g1细胞碱性磷酸酶染色图片,附图5b为青鳉肝细胞碱性磷酸酶染色图片,附图5c为青鳉脑细胞碱性磷酸酶染色图片;
附图6a为g1细胞形成拟胚体图片,附图6b为g1细胞拟胚体分化为神经细胞的图片,附图6c为g1细胞拟胚体分化为肌肉细胞的图片;
附图7为g1细胞和hx1细胞中多能性基因的表达情况对比图;
附图8为g1细胞和拟胚体中多能性基因和内中外胚层标记基因的表达情况对比图;
附图9为g1细胞拟胚体分化后细胞中神经和肌肉标记基因表达情况图;
附图10a、10b、10c、10d分别为hx1细胞对照组及感染rgnnv后0h、24h、48h和72h的图片,附图10e、10f、10g、10h分别为g1细胞对照组及感染rgnnv后0h、24h、48h和72h的图片;
附图11为hx1细胞和g1细胞在感染rgnnv后第24h,48h和72h时rdrp基因表达情况图,其中*表示差异达到显著水平(p<0.05),**差异达到极显著水平(p<0.01);
附图12为hx1细胞和g1细胞在感染rgnnv后第2h和4h时的rdrp基因表达情况图,其中*表示差异达到显著水平(p<0.05),**差异达到极显著水平(p<0.01);
附图13为rgnnv感染g1细胞后,细胞连续传代,第1至15代g1细胞中rdrp基因表达情况图;
附图14为hx1细胞和g1细胞的透射电镜图,其中14a为hx1细胞(×50,000)中透射电镜图;14b为rgnnv感染后的hx1细胞(×50,000)的透射电镜图;14c为g1细胞(×50,000)的透射电镜图;14d为rgnnv感染后的g1细胞(×50,000)的透射电镜图;14e为rgnnv感染后的g1细胞传代至第5代(×50,000)细胞的透射电镜图;14f为rgnnv感染后的g1细胞传代第15代(×50,000)的透射电镜图;
附图15为hx1细胞和g1细胞在感染rgnnv前后的ifn基因表达情况图,其中*表示差异达到显著水平(p<0.05),**差异达到极显著水平(p<0.01);
附图16为hx1细胞和g1细胞在感染rgnnv前后的isg15基因表达情况图,其中*表示差异达到显著水平(p<0.05),**差异达到极显著水平(p<0.01);
附图17为hx1细胞和g1细胞在感染rgnnv前后的isg56基因表达情况图,其中*表示差异达到显著水平(p<0.05),**差异达到极显著水平(p<0.01);
附图18为hx1细胞和g1细胞在感染rgnnv前后的gig基因表达情况图,其中*表示差异达到显著水平(p<0.05),**差异达到极显著水平(p<0.01)。
具体实施方式
下面结合具体实施方式,对本发明的技术方案作进一步的详细说明,但不构成对本发明的任何限制。
实施例1
本实施例中,rgnnv来自本实验室;enu(sigma)溶解于等体积的质量分数为95%的乙醇和pcs缓冲液(50mm柠檬酸,100mm磷酸氢钠,ph=5.0);o6-bg溶解在二甲基亚砜中;esm4培养基是青鳉的第4种es细胞培养基,以dmem(dulbecco’smodifiedeaglemedium)为基础,辅以生长因子、青鳉胚胎抽提物和鱼血清配制而成。
(1)将hx1细胞在esm4培养基中培养,加入mee,鱼血清和bfgf作为蛋白补充剂,细胞用质量分数为0.25%的胰蛋白酶消化后传至铺有明胶的6孔细胞培养板,105个细胞/孔,放置于28℃培养箱中培养24h;
(2)enu诱变:在培养基中加入浓度为10μm的o6-bg预处理24h,然后去掉培养基,更换为enu终浓度为10mg/ml的esm4培养基,继续培养48h,约有50-60%的细胞发生死亡,将诱变后存活的hx1细胞接种于24孔细胞培养板,每孔3×104细胞,置于28℃培养箱培养24h;
(3)rgnnv感染:去掉培养基,加入rgnnv(moi=5),将存活的ehx1细胞继续传代,ehx1细胞经连续传代稳定生长后,经胰蛋白酶消化后重悬于esm4培养基,取重悬液接种于直径为10cm的培养皿中,接种密度为104个细胞/皿,放置于28℃培养箱继续培养,每隔3天更换一半的培养基;
(4)待克隆样细胞生长至直径为200μm时,在体式显微镜下挑取克隆样细胞,并接种于提前铺有明胶的96孔细胞培养板中,待96孔细胞培养板中细胞长至密度为90%-100%时,继续先后传代至48孔细胞培养板,12孔细胞培养板和6孔细胞培养板,最终传至10cm培养皿,成功获得50个单克隆hx1细胞系,选择生长状态良好的g1细胞系开展后续实验。
一、细胞遗传学分析
1、染色体核型分析
将上述g1细胞系传代于6孔细胞培养板(105个细胞/孔),待其生长到80%丰度时,去掉培养基,加入秋水仙素终浓度为2μg/ml的esm4培养基,继续培养6h。将秋水仙素处理后的细胞用胰酶消化,加入pbs缓冲液将细胞收集至1.5mlep管中,1000rpm离心5min;弃去pbs缓冲液,加入0.075m的氯化钾进行低渗45min,继续加入200ul现配的固定液(甲醇和冰乙酸的体积比为3:1)进行预固定,1000rpm离心5min;弃上清,继续加入1ml的固定液固定10min,1000rpm离心5min;如此重复固定两次后弃去上清液,余留200μl进行滴片。从4℃冰箱取出在酒精中浸泡的载玻片,用冰水冲洗2次,放桌面在距其50cm处将细胞滴片,载玻片室温干燥1h后用吉姆萨染液染色15min,清洗玻片,干燥,镜检。通过观察100个染色体核型分析表明,得到细胞中染色体数目分布图如附图1所示,g1细胞染色体数目分布为20至96条,其中主要为24条染色体分布。
2、单倍性分析
采用流式细胞技术分别检测g1细胞、青鳉精巢细胞和肝细胞的染色体倍数,得到细胞流式周期分析图如附图2所示,流式细胞周期分析显示,在g1细胞中有一个显著的单倍体峰,与精巢细胞中的单倍体峰一致,肝细胞对照则为二倍体峰,表明g1细胞为单倍体细胞。
二、细胞生长特性
1、取生长状态良好的培养于25cm2培养皿的g1细胞进行细胞传代,平均传至3个12孔细胞培养板中(104个细胞/孔),在28℃培养6h。观察细胞贴壁后,分别将3个12孔细胞培养板中的培养基更换为10%,15%和20%浓度胎牛血清(fbs)的esm4培养基中,并在28℃连续培养1-5天。每天用胰蛋白酶消化收集3个孔的细胞进行计数,得到g1细胞在不同浓度fbs下的生长曲线图如附图3所示,可知,g1细胞在含15%fbs的esm4培养基中生长速率最快。
2、取生长状态良好的培养于25cm2培养皿的g1细胞进行传代,所用培养基为fbs浓度为15%的esm4培养基,平均传至3个12孔细胞培养板中(104个细胞/孔),然后分别将3个培养板放置于20℃,28℃和32℃恒温培养箱中培养1-5天。每天用胰蛋白酶消化收集3个孔的细胞进行计数,得到g1细胞在不同温度下的生长曲线图如附图4所示,可知,g1细胞在28℃时生长速度最快。
三、细胞多能性分析
1、将g1细胞传代至6细胞培养板(103个细胞/孔),培养至细胞覆盖50%-60%的皿底。用pbs缓冲液轻轻洗一遍,取现配的固定液(甲醇和丙酮体积比为1:1)1ml固定细胞10min,然后用pbs缓冲液清洗两遍,加入100μl的碱性磷酸酶-bcip/nbt底物溶液覆盖细胞避光染色2h,然后用200μl甘油覆盖细胞,在显微镜下镜检,另外将青鳉肝细胞和脑细胞分别用上述方法进行碱性磷酸酶染色,并在显微镜下镜检。附图5a为g1细胞碱性磷酸酶染色的镜检图片,附图5b为青鳉肝细胞碱性磷酸酶染色的镜检图片,附图5c为青鳉脑细胞碱性磷酸酶染色的镜检图片,可知,g1细胞经碱性磷酸酶染色后,均被染成棕色,显示出胚胎干细胞的未分化特性,而对照组中已经分化的肝和脑细胞不能被碱性磷酸酶染色。
2、将g1细胞传代于6孔细胞培养板(105个细胞/孔),培养24h后待其生长至80%时,用胰蛋白酶消化后用含有ra(retinoicacid)终浓度为10μm的esm4培养基重悬细胞,将细胞转移至35mm培养皿中悬浮培养,中间不定时轻轻摇晃培养基防止细胞贴壁。每隔一天更换ra的终浓度不变的esm4培养基。在第10天时,收集在悬浮培养基中形成的拟胚体,通过显微镜观察得到的镜检图如附图6a所示,可知,g1细胞具有在悬浮培养时形成三维拟胚体的性能;将悬浮的拟胚体吸出转移至6孔细胞培养板中正常贴壁培养来诱导细胞分化,每隔一天更换培养基,通过显微镜观察得到如附图6b所示的分化的神经细胞的镜检图片和如附图6c所示的分化的肌细胞的镜检图片,可知,g1细胞具有在悬浮培养时形成拟胚体以及诱导后分化的多能性。
3、分别将hx1细胞、g1细胞、g1细胞形成的拟胚体、g1细胞形成的拟胚体分化后的细胞进行rt-pcr扩增,观察各自的多能性基因表达情况。其中附图7为g1细胞和hx1细胞中多能性基因的表达情况对比图,可知,oct4、nanog、klf4、myc、ronin、sa114、tcf3a、tcf3b以及zfp281基因在g1与hx1细胞中表现出相似的表达趋势。附图8为g1细胞和拟胚体中多能性基因和内中外胚层标记基因的表达情况对比图,可知,相对于g1细胞对照,g1细胞形成的拟胚体中多能性基因oct4和nanog表达下降,分化标志基因表达激活,其中内胚层分化的标志基因(sox17)和神经嵴标志基因(mitf)仅在g1拟胚体中显示表达。其它基因包括外胚层(nf200),中胚层(actinin2和ntl),内胚层(hnf3b),和神经嵴(sox10)的基因表达水平均高于对照g1细胞。附图9为g1细胞拟胚体分化后细胞中神经和肌肉标记基因表达情况图,可知,分化的细胞中神经元标记基因(sox10)和肌细胞标记基因(myod)具有高表达。上述结果均表明,g1细胞具有多能性。
四、g1细胞抗rgnnv能力分析
rt-pcr的具体步骤:使用rnaiso试剂(品牌为takara)提取细胞总rna。将6孔细胞培养板中的细胞用胰酶消化收集后,加入1mltrizol试剂裂解细胞5min后加入1/5体积的氯仿混匀,12000rpm离心15min。将上清吸至新的1.5mlep管加入等体积的异丙醇,12000rpm离心10min。弃去上清,加入1ml75%乙醇后7500rpm离心5min沉淀rna。弃去上清,使用rnase-free水溶解rna。利用primescript逆转录酶将1μg总rna反转录合成cdna。
参考takara的sybrpremixextaqⅱqrt-pcrkit说明书在lightcycler480ⅱ(roche)荧光定量pcr仪进行qrt-pcr,使用,以青鳉β-actin为内参基因,每个实验重复3次。pcr反应体系如下:cdna模板0.5μl,ultrasybrmixture5μl,primer-f0.2μl,primer-r0.2μl,双蒸水4.1μl。按以下程序进行pcr:94℃10min;94℃15s,60℃1min,共40个循环;95℃15s,60℃1min,95℃15s,60℃15s;利用相对定量分析法中的2-△△ct方法对基因表达差异进行分析。所有试验数据均采用spss16.0软件进行单因素方差分析(one-wayanova),*表示差异达到显著水平(p<0.05),**差异达到极显著水平(p<0.01)。
透射电镜的具体步骤:将rgnnv感染后的细胞和对照组正常细胞用胰酶消化,重悬于pbs缓冲液中,1000rpm离心10min,弃去上清液,加入1ml的0.1m的pbs(ph7.4)缓冲液配置的质量分数为2.5%的戊二醛溶液,放置4℃固定24h。离心弃去固定液,继续加入1ml的0.1m的pbs(ph7.4)缓冲液配置的质量分数为2%的四氧化锇溶液,4℃固定24h。然后进行超薄切片,使用飞利浦cm10透射电子显微镜观察和记录。
1、g1细胞能够抵抗rgnnv的感染
通过显微镜观察被rgnnv感染后的g1和hx1细胞,如附图10所示,其中附图10a、10b、10c、10d分别为hx1细胞感染rgnnv后0h、12h、24h、48h的镜检图片,附图10e、10f、10g、10h分别为g1细胞感染rgnnv后0h、12h、24h、48h的镜检图片,可知,hx1在感染后24h时便出现典型的cpe,细胞呈圆形颗粒和胞质空泡,在72h时单层细胞部分或完全脱落。而g1细胞在rgnnv感染后24h至72h内均未表现出明显的cpe,初步说明g1细胞具有潜在的抗rgnnv的特性。
将rgnnv感染后不同时间点的hx1和g1细胞分别进行rt-pcr扩增,检测细胞中rdrp基因的表达量,得到hx1细胞和g1细胞在感染rgnnv后第24h,48h和72h时的rdrp基因表达情况如附图11所示。可知,在不同感染时间点,g1细胞中的rdrp基因表达量均显著低于hx1细胞,说明g1细胞能够抵抗rgnnv的感染。
2、g1细胞抑制rgnnv的进入
将rgnnv感染后2h和4h的g1细胞和hx1细胞分别进行qrt-pcr扩增,检测细胞中rdrp基因表达量,如附图12所示,在rgnnv感染g1细胞2h至4h内,g1细胞中的rdrp基因表达水平显著低于hx1,说明g1细胞能够抑制rgnnv的入侵。
3、g1细胞能够清除病毒
通过rt-pcr和透射电镜法分别检测rgnnv感染后不同代数的g1细胞中病毒rna水平和病毒颗粒情况。如附图13所示,随着g1细胞传代,rdrp基因的转录水平逐渐下降,在g1细胞传代至第15代时,完全检测不到rdrp基因的表达。同时,附图14中透射电镜检测结果也表明,g1细胞感染rgnnv后,随着细胞传代,细胞中的病毒粒子减少,并在第15代时病毒粒子完全消失。上述结果表明g1细胞抑制rgnnv复制,具有清除胞内rgnnv的能力。
4、g1细胞上调干扰素相关基因的表达
将未感染rgnnv的hx1细胞和g1细胞以及感染rgnnv后的hx1细胞和g1细胞分别进行qrt-pcr扩增,检测细胞中ifn、isg15、isg56和gig的基因表达量,如图15-18所示,其中附图15为hx1细胞和g1细胞在感染rgnnv前后的ifn基因表达情况图,其中附图16为hx1细胞和g1细胞在感染rgnnv前后的isg15基因表达情况图,其中附图17为hx1细胞和g1细胞在感染rgnnv前后的isg56基因表达情况图,其中附图18为hx1细胞和g1细胞在感染rgnnv前后的gig基因表达情况图。可知,在未感染rgnnv的情况下,g1细胞中的isgs包括gig,ifn,isg15,isg56的表达水平均极显著高于hx1细胞。rgnnv感染后,gig,ifn,isg15和isg56在g1细胞中的表达量极显著高于这些基因在hx1细胞中的表达量。因此,g1细胞可能通过上调干扰素相关基因的表达来发挥抗病毒作用。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其它的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!