一种将人造血祖细胞转变为造血干细胞的方法与流程
本发明涉及造血干细胞技术领域,特别涉及利用化学小分子由人造血祖细胞制备人造血干细胞的方法。
背景技术:
造血干细胞是成体内极其重要的一类干细胞,尽管其仅占人体血细胞比例不到万分之一,但具备极强的自我更新能力和分化能力,能长期重建机体整个血液系统和免疫系统,具备各世系血细胞和免疫细胞的分化潜能。因此,造血干细胞被广泛应用于白血病、淋巴瘤等恶性血液疾病的临床治疗。不仅如此,造血干细胞移植还能帮助治疗代谢性疾病、先天性免疫缺陷、糖尿病等病症。据统计,每年全世界有超过40,000例造血干细胞移植手术。目前,造血干细胞的供体主要来源于患者自体或者与患者hla匹配的捐献者的骨髓和动员的外周血造血干细胞。尽管该移植技术疗效很好,但由于其存在hla配型的严格配对要求,仍有大约70%的患者不能获得合适的供体而无法接受治疗;即使接受了治疗,多数患者也会经受程度各异的移植物抗宿主病(gvhd)的折磨。脐带血造血干细胞对于hla配型的要求相对较低,且免疫原性低,再加上其获取方便、来源丰富,逐渐成为造血干细胞移植供体的一大来源。然而由于单份脐带血所含造血干细胞数量少,不足以短时间内重建成人患者的免疫系统,从而增高机会性感染致死率,急需一种增加脐带血造血干细胞数量的方法。
造血祖细胞是一类自我更新能力和分化潜能低于造血干细胞的细胞类型,虽然表达cd34表面抗原,但不表达造血干细胞特异的cd90表面分子,而为cd45ra阳性。因此,可以利用cd90和cd45ra区分造血干细胞和造血祖细胞。造血祖细胞具备短期(不到一个月)的体内移植能力,能分化为红细胞、淋巴细胞、髓系细胞等多种血液细胞。由于其不具备长期移植重建受体血液系统的能力,常常被排除在血液细胞移植治疗恶性血液病的手术之外。但造血祖细胞体内含量远远高于造血干细胞(0.03%vs0.0001%),若能够将造血祖细胞转变为造血干细胞,则将大大拓宽造血干细胞的供体来源。
表观修饰在调控细胞命运方面具有重要作用。基因座的甲基化、乙酰化,组蛋白的各类基团修饰直接影响邻近区域基因的开放程度和转录因子结合难度,进而调控基因的表达,完成对细胞状态及命运的调节。因此,表观修饰在更高的层面上影响细胞功能。人们研发了许多表观修饰物来改变细胞命运。近年研究发现表观修饰物对人造血干细胞的体外扩增也有明显促进作用。丁酸钠在细胞重编程领域也引起高度重视,因其能够促进细胞命运改变,被用作ips制备的催化剂。
技术实现要素:
针对相关技术中的上述技术问题,本发明提供了一种利用人造血祖细胞制备人造血干细胞的方法。
为实现上述技术目的,本发明的技术方案是这样实现的:
一种利用人造血祖细胞制备人造血干细胞的方法,包括以下步骤:
s1从人脐带血获取cd34+cd90-和cd34+cd45ra+脐带血造血祖细胞;
s2所述cd34+cd90-和cd34+cd45ra+脐带血造血祖细胞悬浮接种于脐带血造血干细胞专用转化培养基中培养,所述脐带血造血干细胞专用转化培养基采用stemspansfemii无血清培养基,添加100ng/mlscf,100ng/mlflt3,50ng/mltpo;24孔板中细胞接种密度为:cd34+cd90-细胞为0.55x104/孔,cd34+cd45ra+细胞为0.13x104/孔;添加丁酸钠1μm;置于37℃,5%co2培养箱培养;和
s3根据细胞培养状态,每隔2天补加所述脐带血造血干细胞专用转化培养基500μl,7~10天获得数量较多的细胞,扩增倍数约为4~20倍。
本发明的有益效果:丁酸钠通过表观修饰的调节有望将造血祖细胞诱导为造血干细胞,进而实现体外扩增造血干细胞,可应用于脐带血、胎盘血、外周血、骨髓来源的造血干细胞;利用人造血祖细胞制备的造血干细胞数量高,且具备各谱系分化潜能,能够为临床应用提供造血干细胞供体。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
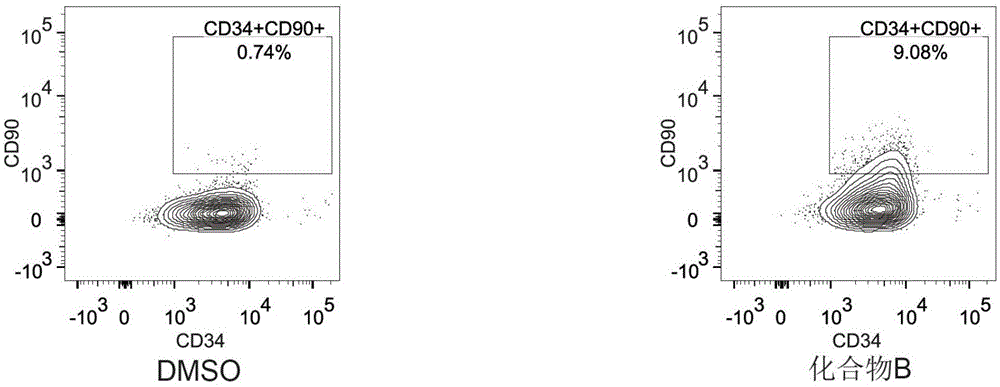
图1a是cd34+cd90-祖细胞培养5天后的造血干细胞流式检测图(dmso为对照组);
图1b是cd34+cd45ra+祖细胞培养5天后的造血干细胞流式检测图(dmso为对照组);
图2a是cd34+cd90-祖细胞培养5天后的造血干细胞比例和数目统计图(dmso为对照组);
图2b是cd34+cd45ra+祖细胞培养5天后的造血干细胞比例和数目统计图图(dmso为对照组)。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,以下的实施例用于为本领域中的普通技术人员提供有关如何实施和使用本发明的完整披露和描述,并且这些例子并非意在对发明人所认为的发明范围进行限制,亦非意指下文的实验是被实施的全部实验而且是仅可实施的实验。实施例中未注明具体条件的试剂和设备,通常为本技术领域常规市购的试剂、设备;实施例中未注明具体条件的实验方法,通常按照常规条件或按照厂商所建议的条件。
具体地,关于下面实施例中涉及的原料生产厂家如下表(表1):
表1原料信息
下面结合附图和具体实施方式进一步详细说明本发明。
实施例1:利用人脐带血造血干细胞专用转化培养基由造血祖细胞获得大量的脐带血造血干细胞,包括如下步骤:
1.获取外周血单个核细胞(pbmc)。
(1)用一次性血袋(含肝素钠等抗凝剂)采集脐带血80~120ml,将脐带血由血袋转移至500ml培养瓶中,加生理盐水稀释2~3倍,混匀后逐滴加入0.4倍体积淋巴细胞分离液中,注意不要破坏界面。
(2)1500~2000rpm/分钟离心20分钟,因密度不同离心管中由上到下分为四层:第一层为血浆层,第二层为环状乳白色单个核细胞层(pbmc),第三层为透明分离液层,第四层为红细胞层。
(3)用吸管小心吸取第二层环状乳白色单个核细胞层(pbmc)到另一50ml离心管中,补加生理盐水,1500~2000rpm/分钟离心5~10分钟。
(4)弃上清,加生理盐水重悬,1500~2000rpm/分钟离心5~10分钟,弃上清,得到pbmc细胞团块。
2.利用磁珠分选(macs)从上述pbmc中获得cd34+脐带血造血干、祖细胞。
(1)每份脐带血pbmc采用50ul人cd34+磁珠和50ulfcr阻滞剂(blockerreagent)及150ul0.5%bsa的混合液重悬,4℃孵育30分钟。
(2)与此同时,将磁铁和磁力架至于超净台中紫外线照射30分钟。
(3)加入10ml无菌pbs,混匀后,1500~2000rpm/分钟离心5~10分钟,弃上清。
(4)将macs专用吸附柱放进磁铁中,加入500ul0.5%bsa润洗,流出的液体用15ml管接住。
(5)500ul0.5%bsa重悬步骤(3)中pbmc团块,混匀,转移到macs专用吸附柱中,待液体完全流出。
(6)500ul0.5%bsa洗涤3次,取下吸附柱,置于15ml管中。
(7)加入1ml0.5%bsa,用活塞把液体推入15ml管中,所得液体即含cd34+脐带血造血干、祖细胞。
(8)稀释,计数,如要必要,用冻存保护剂二甲亚砜(dmso)将上述液体冻存于液氮中。
3.将cd34+细胞利用流式抗体cd34、cd90、cd45ra染色半小时,通过流式分选仪分选得到cd34+cd90-和cd34+cd45ra+造血祖细胞。
4.所述cd34+cd90-和cd34+cd45ra+脐带血造血祖细胞悬浮接种于脐带血造血干细胞专用转化培养基中培养。采用stemspansfemii无血清培养基,添加100ng/mlscf,100ng/mlflt3,50ng/mltpo;24孔板中细胞接种密度为:cd34+cd90-细胞为0.55x104/孔,cd34+cd45ra+细胞为0.13x104/孔;化合物b(丁酸钠)添加1μm,对照组添加dmso(0.1%);置于37℃,5%co2培养箱培养。
5.根据细胞培养状态,每隔2天补加脐带血造血干细胞专用转化培养基500μl,7~10天可获得数量较多的细胞,扩增倍数约为4~20倍。
实施例2:将上述分离的人胎盘血造血干细胞进行表型鉴定、活率和纯度检测及功能鉴定,包括如下步骤:
1.细胞计数
分别对培养后的cd34+cd90+和cd34+cd45ra-造血干细胞进行计数。
表2cd34+cd90-造血祖细胞培养后的细胞数目统计
表3cd34+cd45ra+造血祖细胞培养后的细胞数目统计
2.细胞流式分析
采用bd公司facsverse流式检测仪,取细胞悬液20μl,加入溶解于0.5%bsa中的0.2μlfitc标记的cd34,pe标记的cd38,apc-cy7标记的cd45ra,apc标记的cd90。各管涡旋后室温下避光孵育15分钟,加入适量pbs,1600rpm室温离心5分钟,弃上清液,加入pbs200μl,然后上机分析。
3.集落形成单位分析
采用methoculttmgfh4534半固体培养基,在六孔板中加入培养基1ml/孔,cd34+细胞接种密度为1000细胞/孔,置于37℃5%co2培养箱培养14天后,计算各谱系集落数目,并拍摄照片。
由图1a、图1b及图2a、图2b可以得知,含丁酸钠的专用转化培养基能诱导cd34+cd90+和cd34+cd45ra-表型的造血干细胞产生,而普通培养基不能。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!