基于类器官方法构建正常免疫小鼠人胃癌移植瘤模型的方法和应用与流程
本发明属于医药领域,具体地涉及一种医学肿瘤动物模型—基于“类器官”技术,利用微载体(nmc1)构建人胃癌正常免疫小鼠移植瘤模型,及建立该模型的方法,以及它们在肿瘤研究、临床实验、药敏检测和其他药学领域中的应用。
背景技术:
肿瘤是一类严重威胁人类健康的多发病和常见病,其发病机制尚未完全阐明,治疗效果亦不尽人意。现有的肿瘤模型研究主要基于两种,一是体外模型,即建立二维和三维肿瘤模型;二是建立动物模型,主要是人肿瘤荷瘤裸鼠模型。
就动物模型而言,传统建模方式是将人肿瘤细胞直接注入裸鼠皮下,这种方法容易造成细胞的流失,而且由于无基质的支持,细胞间的连接不紧密,因此在裸鼠中成瘤率都不高,更不用说存在免疫排斥的正常小鼠体内。究其原因,可能是由于忽视了细胞与基质间的相互作用这一重要环节,难以提供与人体内肿瘤相仿的微环境。这对于重现人体肿瘤细胞局部黏附、侵袭以及远处转移有很大的影响。新进研究成果类器官(organoids)被评为2017年生命科学领域最有潜力的“年度技术”,“类器官”技术是一种微型的三维细胞培养模型,源自患者原发性肿瘤,并在实验室中进行培养的技术。从类器官形成之初、到进行药物治疗之后,这些类器官在组织学、分子水平和功能上能够持续与来源肿瘤组织保持高度一致,很好地反映其特点。肿瘤类器官是将肿瘤细胞,放入3d培养体系中,经调整培养方案,制造出的一种微型的三维细胞培养模型,其表型和基因型分析显示了它们与原发性肿瘤的高度相似。
另一方面,因裸鼠缺乏t细胞,scid鼠同时缺乏t细胞和b细胞,它们存在免疫功能缺陷,难以阐明肿瘤发生、发展和转移与机体免疫的关系,也不是研究肿瘤免疫治疗和开发新型抗肿瘤药物的最理想模型。正常免疫功能的小鼠移植肿瘤模型,弥补了因免疫缺陷小鼠缺乏免疫细胞,尤其是t细胞而不能准确模拟机体免疫系统对肿瘤的免疫攻击的重要缺点,从而更准确地还原患者肿瘤组织的分子生物学和组织学特点及肿瘤微环境,能更好地用于研究肿瘤发生机制以及抗肿瘤新药研发等。
技术实现要素:
本发明的目的是基于“类器官”技术,以微载体(nmc1)为支架材料,复合人胃癌sgc-7901/mkn-45细胞接种于正常免疫小鼠皮下构建体内肿瘤工程化人胃癌移植瘤模型,从而解决目前人胃癌移植瘤模型存在的采用裸鼠、scid鼠等免疫缺陷小鼠,不易饲养,价格昂贵,成瘤率不高的问题;尤其是解决了免疫缺陷小鼠人胃癌移植瘤模型无法反映机体免疫系统在肿瘤发生、发展过程中所起的重要作用的问题,以及免疫缺陷小鼠人移植瘤模型存在成瘤周期长(一般需要4-6个月),难以解决临床急迫需要药物治疗患者的药敏需求。因此建立新型人胃癌正常免疫小鼠移植瘤模型具有重要的意义。
本发明的基于类器官方法的正常免疫小鼠人胃癌移植瘤模型构建方法,它是按照以下步骤进行的:
1)人胃癌肿瘤细胞的获取:
取人胃癌肿瘤细胞sgc-7901/mkn-45复苏后,加入含有10%的胎牛血清的dmem完全培养液,在温度为37℃、5%co2培养箱中培养,24~48小时后换液,继续培养,传代3-4次;
2)以类器官方法建立三维肿瘤细胞培养模型:
将微载体在体积百分含量为75%的酒精中浸泡48h后,用1×pbs缓冲液清洗5遍,于dmem培养基中孵育24~48h;
取步骤1)传代后指数生长期的人胃癌肿瘤细胞sgc-7901/mkn-45,若台盼蓝计数活细胞数>95%,则调整人胃癌肿瘤细胞sgc-7901/mkn-45浓度至2×107/ml;将调整后的人胃癌肿瘤细胞sgc-7901/mkn-45悬液与孵育好的微载体混合,得细胞-微载体复合体;将其在温度为37℃、5%co2培养箱中培养24~48h;
3)小鼠胃癌移植瘤的构建:
用1×pbs缓冲液清洗步骤2)孵育好的细胞-微载体复合体清洗4遍,再用1×pbs缓冲液重悬细胞并调整细胞浓度至2×107/ml,调整微载体浓度至200ug~350ug/ml,得细胞-微载体混悬液,并置于冰上备用;将细胞-微载体混悬液注射于6-8周的c57bl/6小鼠,体内植入20-30天后,即构建完成正常免疫小鼠人胃癌移植瘤模型。
本发明包含以下有益效果:
本发明引入了肿瘤三维培养技术,基于“类器官”技术,利用3d材料为载体建立了三维细胞培养模型,为肿瘤的进一步研究奠定基础。
本发明利用“类器官”三维培养技术构建体内肿瘤模型主要是将肿瘤细胞接种于微载体(nmc1)支架材料上,然后直接将细胞-材料复合体注入正常免疫小鼠体内构建肿瘤模型。
本发明利用“类器官”培养技术,以微载体(nmc1)为基底材料,复合人胃癌细胞sgc-7901/mkn-45接种于c57bl/6小鼠皮下成功构建了具有正常免疫功能的人胃癌小鼠移植肿瘤模型。与已有的免疫缺陷小鼠移植肿瘤模型相比,该模型可以更好的研究和进一步阐明肿瘤在免疫功能正常机体中发生、发展机制,同时也为抗癌药的研发提供了较以往更有价值的新的动物模型。
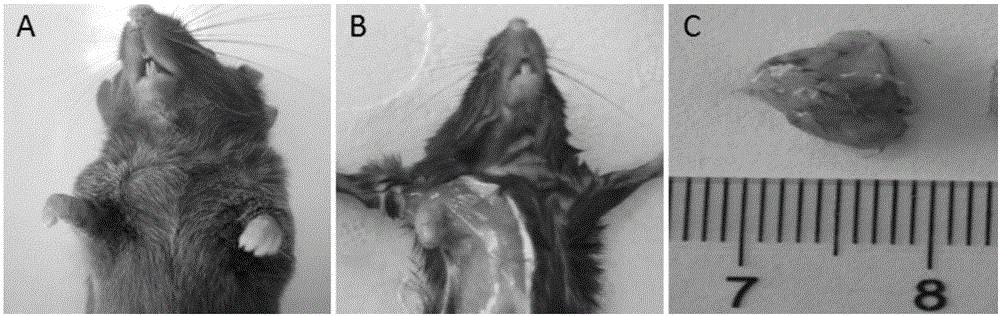
本发明将人胃癌细胞sgc-7901/mkn-45-微载体复合体接种至c57bl/6小鼠,自接种后开始至第10天,小鼠摄食正常,活动状况好,第10天开始,小鼠活动稍减少,但食欲,毛发,体质量无明显差异。在接种后8~10d即可触及肿瘤,成瘤率为75%(15/20只),移植瘤形态相对规整,多为圆形或椭圆形,颜色以灰白色或灰红色为主。
附图说明
图1荷瘤鼠和移植瘤的大体观察图;其中,a:图,b:图,c:图;
图2体外成功建立sgc-7901/mkn-45细胞三维培养体系图;其中,a:sgc-7901/mkn-45细胞二维培养×100图;b:nmc1×100图;c:共培养24h×100图;d:共培养24h(dapi)×100图;
图3人胃癌移植瘤he染色图;其中,a:×100he染色图;b:×100he染色图;c:×200he染色图;d:×400he染色图;
图4人胃癌移植瘤免疫组织化学染色图;其中,a:ca199×200染色图;b:cea×200染色图;c:cdx-2染色图。
具体实施方式
具体实施方式一:本实施方式的基于类器官方法的正常免疫小鼠人胃癌移植瘤模型构建方法,它是按照以下步骤进行的:
1)人胃癌肿瘤细胞的获取:
取人胃癌肿瘤细胞sgc-7901/mkn-45复苏后,加入含有10%的胎牛血清的dmem完全培养液,在温度为37℃、5%co2培养箱中培养,24~48小时后换液,继续培养,传代3-4次;
2)以类器官方法建立三维肿瘤细胞培养模型:
将微载体在体积百分含量为75%的酒精中浸泡48h后,用1×pbs缓冲液清洗5遍,于dmem培养基中孵育24~48h;
取步骤1)传代后指数生长期的人胃癌肿瘤细胞sgc-7901/mkn-45,若台盼蓝计数活细胞数>95%,则调整人胃癌肿瘤细胞sgc-7901/mkn-45浓度至2×107/ml;将调整后的人胃癌肿瘤细胞sgc-7901/mkn-45悬液与孵育好的微载体混合,得细胞-微载体复合体;将其在温度为37℃、5%co2培养箱中培养24~48h;
3)小鼠胃癌移植瘤的构建:
用1×pbs缓冲液清洗步骤2)孵育好的细胞-微载体复合体清洗4遍,再用1×pbs缓冲液重悬细胞并调整细胞浓度至2×107/ml,调整微载体浓度至200ug~350ug/ml,得细胞-微载体混悬液,并置于冰上备用;将细胞-微载体混悬液注射于6-8周的c57bl/6小鼠,体内植入20-30天后,即构建完成正常免疫小鼠人胃癌移植瘤模型。
具体实施方式二:本实施方式与具体实施方式一不同的是:步骤2)中人胃癌肿瘤细胞sgc-7901/mkn-45悬液与孵育好的微载体的体积比为1:3-5;较优值为1:4。其它与具体实施方式一相同。
具体实施方式三:本实施方式与具体实施方式一不同的是:步骤1)中培养至细胞长至90%密度以上进行传代,每两天换液一次。其它与具体实施方式一相同。
具体实施方式四:本实施方式与具体实施方式一不同的是:步骤2)中在温度为37℃、5%co2培养箱中培养24~48h,在镜下观察细胞在微载体内达到饱和状态后进行下一步操作。其它与具体实施方式一相同。
具体实施方式五:本实施方式与具体实施方式一不同的是:步骤3)中细胞-微载体混悬液注射小鼠的部位为右腋下皮下,每只注射100ul。其它与具体实施方式一相同。
具体实施方式六:本实施方式与具体实施方式一不同的是:所述的微载体是由可正电化有机复合多聚物组成,呈多层孔状条索样,相互交联卷曲形成有足够空间的“迷宫”样不规则结构。其它与具体实施方式一相同。
该微载体孔径大小、表面正电荷密度、载体颗粒大小可通过化学合成调节,是纯有机化合物,不易污染,不含杂质,具有低免疫原性、生物兼融性及可代谢性等特点,可为细胞生长提供稳定的微环境。微载体内部足够的空间解决了细胞生长营养和代谢废物浓度不均的问题,同时,由于该微载体“迷宫”样不规则结构可以(短时间内)起到屏障作用,在一定程度上阻挡免疫细胞对肿瘤细胞的直接杀伤。另外,用sdf-1α和vegf对微载体进行修饰后,可加速血管形成,诱导血管长入,为肿瘤的快速生长提供血供营养。
需要说明的是,本发明将微载体命名为nmc1,凡在本发明出现的nmc1即指本实施方式所限定的微载体。
具体实施方式七:本实施方式利用实施方式一构建的正常免疫小鼠人胃癌移植瘤模型应用,它是用于胃癌药物研发。
具体实施方式八:本实施方式与具体实施方式六不同的是:它在抗胃癌药物筛选中的临床应用。其它与具体实施方式六相同。
本发明内容不仅限于上述各实施方式的内容,其中一个或几个具体实施方式的组合同样也可以实现发明的目的。
通过以下实例验证本发明的有益效果:
实施例1
本实施例的模型方法如下:
步骤1:胃癌细胞的培养
人胃癌细胞sgc-7901/mkn-45购买于中国科学院上海细胞库,采用dmem培养基培养,加10%胎牛血清;细胞长至90%密度以上进行传代,每两天换液一次;细胞放置于37℃、5%co2培养箱中进行培养。
步骤2:液相微载体的制备
将微载体nmc1浸泡于75%酒精48h,1×磷酸盐缓冲液(pbs)清洗4遍,于dmem培养基中孵育24-48h备用。
步骤3:三维肿瘤细胞培养模型的建立
取指数生长期的sgc-7901/mkn-45细胞,台盼蓝计数活细胞数>95%,将sgc-7901/mkn-45细胞悬液与孵育好的微载体(nmc1)混合(体积比1:4),制成含2×107个细胞/ml的细胞-微载体混悬液;在37℃、5%co2培养箱中培养24-48小时,使细胞在微载体(nmc1)内达到饱和状。
步骤4:小鼠胃癌移植瘤的构建
用1×pbs液清洗孵育好的细胞-微载体复合体3遍,再用1×pbs液重悬细胞-微载体复合体(细胞浓度为2×107/ml,微载体浓度为250/ml),将所制备好的细胞-微载体(nmc1)混悬液放在冰上备用;随后将细胞—微载体复合体注射于6-8周大的c57bl/6小鼠,部位为右腋下皮下,每只100ul,皮下形成一小丘表示接种成功,体内植入20-30天,构建正常免疫小鼠人胃癌移植瘤模型。
步骤5:小鼠成瘤情况
移植后每日观察小鼠的精神、饮食、活动、大小便等一般情况,移植处皮下是否成瘤。从接种之日起至接种部位出现可触摸到的实体肿块时为潜伏期,发现成瘤后开始每天用游标卡尺测量肿瘤的最大直径(dmax)和最小直径(dmin),按公式v=1/2×dmax×(dmin)2计算肿瘤体积。
步骤6:病理学检查
肿块生长20-30天,颈椎脱臼处死小鼠,取出完整肿瘤,10%中性福尔马林固定,制作石蜡切片,苏木素-伊红(he)染色,免疫组化检测ca199、cea、cox-2蛋白的表达。
小鼠一般情况和移植瘤生长状况
自接种后开始至第10天,小鼠摄食正常,活动状况好,第10天开始,小鼠活动稍减少,但食欲,毛发,体质量无明显差异。在接种后8~10d即可触及肿瘤,成瘤率为75%(15/20只),移植瘤形态相对规整,多为圆形或椭圆形,颜色以灰白色或灰红色为主。
体外建立sgc-7901/mkn-45细胞三维培养体系
二维环境观察sgc-7901/mkn-45细胞贴壁,呈不规则形;微载体(nmc1)镜下观察为不规则团状或长梭状,质地疏松;sgc-7901/mkn-45细胞与微载体(nmc1)共培养24-48小时后可以看到sgc-7901/mkn-45细胞可以很好的贴附在微载体(nmc1)上,达到饱和状态。
肿瘤病理学
he染色:移植瘤组织在光镜下可见大量核大深染、大小不一、异形性明显、杂乱排列的细胞,并向皮肤、脂肪、肌肉组织浸润生长;伴有坏死,位于肿瘤中央;尚未被清除的少许微载体(nmc1)被包绕形成肉芽肿;瘤组织中新生毛细血管丰富,多位于肿瘤边缘。
免疫组化染色:ca199、cea、cox-2主要表达于癌细胞膜和胞质,结果显示,ca199、cea、cox-2均为阳性表达,进一步证实异型性细胞为人肿瘤细胞。
由上述实验可知,本实施例建立的模型为异种植移具有正常免疫功能小鼠肿瘤模型,具有方法简便,周期短,易于饲养,成瘤率高的优点。该模型可以更好的研究和进一步阐明肿瘤在免疫功能正常机体中发生、发展机制,临床实验、抗癌药敏检测,同时也为抗癌药的研发提供了较以往更有价值的新型动物模型。
- 还没有人留言评论。精彩留言会获得点赞!