重组Martentoxin的制备、表征及应用的制作方法
本发明涉及重组martentoxin的制备、表征及应用,属于多肽毒素和生物技术工程领域。具体地,本发明涉及一种从东亚钳蝎(buthusmartensikarsch,bmk)毒液中分离纯化得到的毒素—martentoxin的重组制备技术和理化性质的表征,以及该重组毒素在大电导钙离子和电压激活的钾离子(bk)通道中的应用。
背景技术:
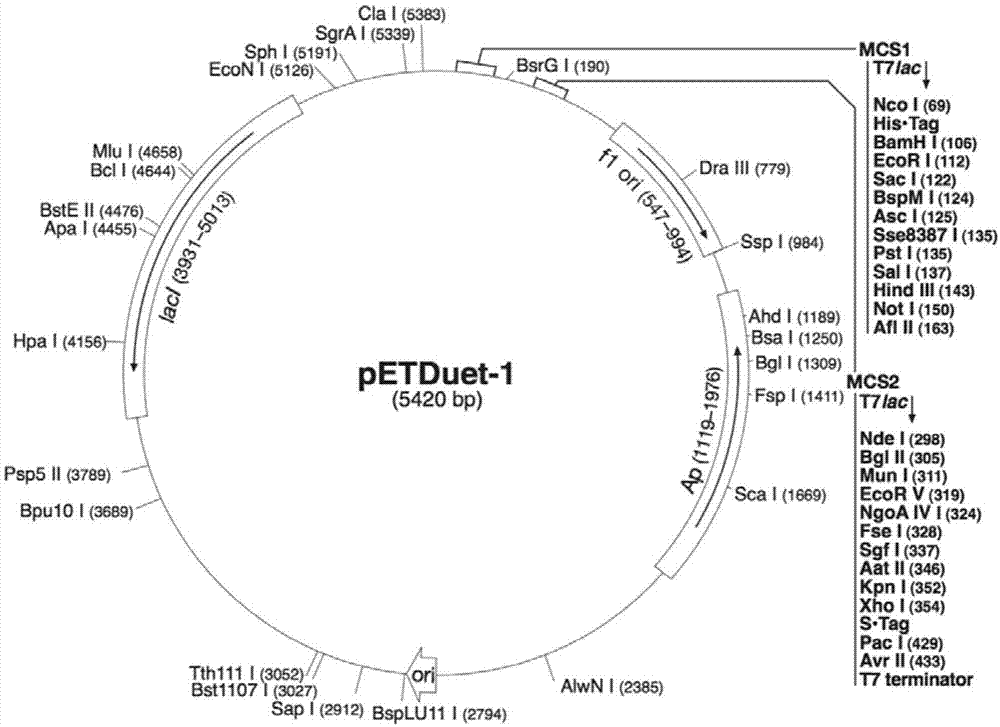
:研究表明,蛇、蜈蚣、蝎子、蜘蛛、海葵、锥螺等有毒生物的毒液中含有大量具有药理活性的多肽。目前有多种含分子内二硫键的毒液衍生物通过fda批准,治疗高血压、疼痛及糖尿病[venomstodrugs:venomasasourceforthedevelopmentofhumantherapeutics[m].city:royalsocietyofchemistry,2015]。更多毒素分子正处于临床研究中,它们靶向癫痫、癌症和自身免疫等疾病[curr.pharm.des.2007,13,2927-2934;toxins2010,2,2851-2871;expertopi.biol.ther.2011,11,1469-1484]。东亚钳蝎(buthusmartensikarsch,bmk)的蝎毒中富含多种具有天然活性的多肽,其中大部分可作用于离子通道。迄今为止,该蝎毒通过分离纯化已获得14种短链钾离子通道阻断剂(bmtx1-3、bmktx、bmp01-3、bmp05、bmp09、bmkk1-4和martentoxin)[biochemistry1997,36,13473-13482;j.biol.chem.2004,279,34562-34569;eur.j.biochem.1997,245,457-64]。这种martentoxin(简称martx)由37个氨基酸构成,具有三对二硫键,是一种特异性作用于bk通道的短链多肽毒素[j.neurochem.2003,84,325-335],可显著抑制神经型(α+β4)bk通道电流。目前,人工获取多肽的方法主要有三种:重组表达法、内源提取法和化学合成法。其中,内源提取法是最古老也最直接的方法,但提取出的多肽种类有限,产量较低。应用最多的化学合成法为fmoc(9-芴甲氧羰基)固相合成法。该方法涉及线性肽链的合成、碘氧化体系、半胱氨酸的保护与保护基的脱除、以及变复性等诸多有机体系,步骤繁琐复杂,二硫键易错配,产率低下,且未能实现多肽类药物的绿色制造。而对于重组表达法,由于martx毒素分子量较小,且含多对二硫键易导致包涵体表达,因此运用该方法较难获得大量的、可溶的、高纯度蛋白。因此,本领域迫切需要开发一种martx毒素的制备方法,以获得高产量、高纯度和高活性的martx毒素生物活性蛋白。技术实现要素:本发明的目的就是提供一种高产量、高纯度和高活性的martx毒素的制备方法。在本发明的第一方面,提供了一种融合蛋白,所述融合蛋白从n端到c端具有式i所示结构:p1-p2-p3-p4(式i)式中,p1为纯化标签元件;p2为麦芽糖结合蛋白元件(mbp);p3为蛋白酶识别位点元件;p4为martx多肽元件;“-”表示连接上述元件的肽键。在另一优选例中,所述p1为6×his序列。在另一优选例中,所述融合蛋白可不包括p1元件。在另一优选例中,所述p2的序列为seqidno:4.在另一优选例中,所述p2的序列为在seqidno:4的基础上进行一个或多个氨基酸的替换、缺失、改变、插入或增加,所得到的氨基酸序列。在另一优选例中,所述蛋白酶选自下组:hrv3c蛋白酶、thrombin酶、factorxa、肠激酶(enterkinase)、tev酶、prescission、tagzyme、sumo蛋白酶,或其组合。在另一优选例中,所述蛋白酶为thrombin酶。在另一优选例中,所述p4的序列为seqidno:2。在另一优选例中,所述p4的序列为在seqidno:2的基础上进行一个或多个氨基酸的替换、缺失、改变、插入或增加,所得到的氨基酸序列。在另一优选例中,所述式i的序列的n端或c端可添加1至30个氨基酸残基,较佳地1至10个氨基酸残基,更佳地1至5个氨基酸残基。在另一优选例中,所述p1和p2之间、p2和p3之间,或p3和p4之间,可添加1至30个氨基酸残基,较佳地1至10个氨基酸残基,更佳地1至5个氨基酸残基。在另一优选例中,所述融合蛋白的序列中,从n端到c端各元件之间的排序还包括:p2-p1-p3-p4、p4-p3-p2-p1、p2-p3-p4-p1或p4-p3-p1-p2。在本发明的第二方面,提供了一种分离的多核苷酸,所述多核苷酸编码本发明第一方面所述的融合蛋白。在另一优选例中,所述多核苷酸包括从5’到3’的式ii的核酸构建物,z1-z2-z3-z4(式ii)式中,z1、z2、z3和z4分别编码本发明第一方面中式i中的p1、p2、p3和p4;其中,所述z2的序列为seqidno:3。在另一优选例中,所述z4的序列为seqidno:1。在另一优选例中,所述多核苷酸的序列中,从5’到3’各元件之间的排序还包括:z2-z1-z3-z4、z4-z3-z2-z1、z2-z3-z4-z1或z4-z3-z1-z2。在本发明的第三方面,提供了一种载体,所述载体含有本发明第二方面所述的多核苷酸。在另一优选例中,所述载体为petduet-martx-1,所述petduet-martx-1为在载体petduet-1中插入序列seqidno:3所得。在本发明的第四方面,提供了一种宿主细胞,所述宿主细胞含有本发明第三方面所述的载体或基因组中整合有本发明第二方面所述的多核苷酸。在另一优选例中,所述宿主细胞为e.coliorigamib(de3)。在本发明第五方面,提供了一种产生本发明第一方面所述的融合蛋白的方法,包括步骤:在适合表达的条件下,培养本发明第四方面所述的宿主细胞,从而表达出本发明第一方面所述的融合蛋白。在本发明第六方面,提供了一种制备martx多肽的方法,包括步骤:(i)用蛋白酶对本发明第一方面所述的融合蛋白酶切,从而获得酶切产物,该酶切产物对应于martx多肽;和(ii)从酶切产物中分离或纯化出所述的martx多肽。在另一优选例中,所述蛋白酶选自下组:hrv3c蛋白酶、thrombin酶、factorxa、肠激酶(enterkinase)、tev酶、prescission、tagzyme、sumo蛋白酶,或其组合。在另一优选例中,所述蛋白酶为thrombin酶。在另一优选例中,所述方法纯化得到的martx多肽,从每升表达菌体所得的产量为≥2mg,较佳地≥3mg,更佳地≥4mg。在本发明第七方面,提供了一种(α+β4)bk通道电流抑制剂的药物筛选方法,包括步骤:(i)使用本发明第六方面所述的方法,纯化制备martx多肽;(ii)以martx多肽作为阳性对照,对(α+β4)bk通道电流抑制剂候选药物进行筛选。在另一优选例中,所述步骤(ii)中,martx多肽阻断(α+β4)bk通道电流的半数效应浓度(ec50)值为c0,所述抑制剂候选药物阻断(α+β4)bk通道电流的半数效应浓度(ec50)值为c1,当c1≤c0时,则所述抑制剂候选药物是优于martx多肽的(α+β4)bk通道抑制剂。应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。附图说明图1显示了表达载体petduet-1的物理图谱和多克隆位点。图2显示了martx基因pcr过程及琼脂糖凝胶电泳。(a)pcr引物。上游引物(primer-up)的bamhi位点和下游引物(primer-do)的xhoi位点已用横线标出。(b)pcr反应体系组成。(c)pcr反应程序。(d)反应完成后琼脂糖凝胶电泳图。图3显示了表达载体petduet-1和martentoxin基因的双酶切琼脂糖凝胶电泳图。图中m表示dnamarker(dl5000),从下至上为100bp,250bp,500bp,750bp,1000bp,1500bp,2000bp,3000bp,5000bp。泳道1为petduet-1载体经限制性内切酶ecori和noti双酶切结果,泳道2为martentoxin基因片段的ecori和noti双酶切结果。图4显示了重组表达载体petduet-1-martx图谱示意图。图5显示了pgex-4t-3-martx重组质粒及纯化凝胶色谱图:(a)pgex-4t-3-martx表达质粒示意图;(b)martxsuperdex75峰图。图6显示了pgex-6p-1-martx重组质粒及纯化凝胶色谱图。(a)pgex-6p-1-martx表达质粒示意图。(b)martxsuperdex75峰图。图7显示了psmt3-martx重组质粒及纯化凝胶色谱图。(a)psmt3-martx表达质粒示意图。(b)martxsuperdex75峰图。图8显示了petduet-1-martx重组质粒表达毒素的纯化。(a)镍柱纯化结果。融合蛋白已用红线标出。(b)酶切后amyloseresin层析柱纯化结果。(c)凝胶色谱柱superdex75紫外吸收峰图。(d)重组martx纯化后的sds-page检测。图9显示了重组martx毒素的一维氢谱。图10显示了重组martx毒素的圆二色谱。图11显示了重组martx毒素的maldi-tof质谱鉴定。图12显示了重组martx毒素的20个最优溶液结构叠加图(二级结构部分叠加)。多肽的n端、c端已标出。图13显示了重组martx毒素20个最优溶液构象的拉氏图。图14显示了重组martx毒素与天然毒素的结构叠加图。红色表示重组martx,绿色表示已报道的martx结构(pdb:1m2s)。二硫键以及n端、c端已标出。图15显示了重组martx毒素对(α+β4)bk通道电流的抑制效应。(a)重组martx毒素对(α+β4)bk通道hek293t的全细胞电流,钳制电位为-80mv,电流由+80mv的电压刺激和300nm的内钙诱发。(b)重组martx毒素抑制(α+β4)bk通道的剂量依赖曲线,if表示各浓度毒素作用下的残余电流百分比,曲线由hill方程拟合。具体实施方式本发明人经过广泛而深入的研究,经过大量的筛选,意外地开发出一种纯化制备martx多肽的方法。具体地,在martx的重组质粒的构建中,在目标蛋白所对应的基因片段的5’端,加入编码his标签以及编码mbp标签的基因序列,并且将构建得到的重组质粒转化至载体菌株e.coliorigamib(de3),并进行培养和诱导表达。对纯化得到的martx多肽的表征实验数据表明,用所述方法得到的目标蛋白,相比于对比实施方案所得的目标蛋白,具有更高的表达量、纯度和活性。在此基础上完成了本发明。术语martentoxin蛋白及其编码序列如本文所用,“martentoxin蛋白”、“martx毒素”和“martx多肽”“重组martx毒素”可互换使用,指martentoxin蛋白,其由37个氨基酸构成,具有三对二硫键,是一种特异性作用于bk通道的短链多肽毒素,可显著抑制神经型(α+β4)bk通道电流。应理解,尽管本发明的实例中提供的基因来源于东亚钳蝎,但是来源于其它类似的物种(尤其是与东亚钳蝎属于同一科或属的蝎类)的、与本发明的序列(优选地,序列如seqidno:1所示)具有一定同源性(保守性)的martx的基因序列,也包括在本发明的范围内,只要本领域技术人员在阅读了本申请后根据本申请提供的信息可以方便地从其它物种(尤其是蝎类)中分离得到该序列。本发明的多核苷酸可以是dna形式或rna形式。dna形式包括:dna、基因组dna或人工合成的dna,dna可以是单链的或是双链的。dna可以是编码链或非编码链。编码成熟多肽的编码区序列可以与seqidno:1所示的编码区序列相同或者是简并的变异体。编码成熟多肽的多核苷酸包括:只编码成熟多肽的编码序列;成熟多肽的编码序列和各种附加编码序列;成熟多肽的编码序列(和任选的附加编码序列)以及非编码序列。术语“编码多肽的多核苷酸”可以是包括编码此多肽的多核苷酸,也可以是还包括附加编码和/或非编码序列的多核苷酸。本发明还涉及上述多核苷酸的变异体,其编码与本发明有相同的氨基酸序列的多苷或多肽的片段、类似物和衍生物。此多核苷酸的变异体可以是天然发生的等位变异体或非天然发生的变异体。这些核苷酸变异体包括取代变异体、缺失变异体和插入变异体。如本领域所知的,等位变异体是一个多核苷酸的替换形式,它可能是一个或多个核苷酸的取代、缺失或插入,但不会从实质上改变其编码的多肽的功能。本发明还涉及与上述的序列杂交且两个序列之间具有至少50%,较佳地至少70%,更佳地至少80%相同性的多核苷酸。本发明特别涉及在严格条件下与本发明所述多核苷酸可杂交的多核苷酸。在本发明中,“严格条件”是指:(1)在较低离子强度和较高温度下的杂交和洗脱,如0.2×ssc,0.1%sds,60℃;或(2)杂交时加有变性剂,如50%(v/v)甲酞胺,0.1%小牛血清/0.1%ficoll,42℃等;或(3)仅在两条序列之间的相同性至少在90%以上,更好是95%以上时才发生杂交。应理解,虽然本发明的martx基因优选来自东亚钳蝎,但是来自其它物种(尤其是蝎类)的与东亚钳蝎martx基因高度同源(如具有80%以上,如85%,90%,95%甚至98%序列相同性)的其它基因也在本发明考虑的范围之内。比对序列相同性的方法和工具也是本领域周知的,例如blast。本发明的martx核苷酸全长序列或其片段通常可以用pcr扩增法、重组法或人工合成的方法获得。对于pcr扩增法,可根据本发明所公开的有关核苷酸序列,尤其是开放阅读框序列来设计引物,并用市售的dna库或按本领域技术人员已知的常规方法所制备的cdna库作为模板,扩增而得有关序列。当序列较长时,常常需要进行两次或多次pcr扩增,然后再将各次扩增出的片段按正确次序拼接在一起。一旦获得了有关的序列,就可以用重组法来大批量地获得有关序列。通常是将其克隆入载体,再转入细胞,然后通过常规方法从增殖后的宿主细胞中分离得到有关序列。此外,还可用人工合成的方法来合成有关序列,尤其是片段长度较短时。通常,通过先合成多个小片段,然后再进行连接可获得序列很长的片段。目前,已经可以完全通过化学合成来得到编码本发明蛋白(或其片段,或其衍生物)的dna序列。然后可将该dna序列引入本领域中已知的各种现有的dna分子(或如载体)和细胞中。此外,还可通过化学合成将突变引入本发明蛋白序列中。本发明涉及一种用于治疗癫痫的martx多肽及其变体,在本发明的一个优选例中,所述多肽的氨基酸序列如seqidno:2所示。本发明的多肽能够有效治疗和/或预防癫痫。本发明还包括与本发明的seqidno:2所示序列具有50%或以上(优选60%以上,70%以上,80%以上,更优选90%以上,更优选95%以上,最优选98%以上,如99%)同源性的具有相同或相似功能的多肽或蛋白。所述“相同或相似功能”主要是指:“缓解癫痫的症状”。本发明的多肽可以是重组多肽、天然多肽、合成多肽。本发明的多肽可以是天然纯化的产物,或是化学合成的产物,或使用重组技术从原核或真核宿主(例如,细菌、酵母、植物、昆虫和哺乳动物细胞)中产生。根据重组生产方案所用的宿主,本发明的多肽可以是糖基化的,或可以是非糖基化的。本发明的多肽还可包括或不包括起始的甲硫氨酸残基。本发明还包括具有martx多肽活性的martx多肽片段和类似物。如本文所用,术语“片段”和“类似物”是指基本上保持本发明的天然martx多肽相同的生物学功能或活性的多肽。本发明的多肽片段、衍生物或类似物可以是:(i)有一个或多个保守或非保守性氨基酸残基(优选保守性氨基酸残基)被取代的多肽,而这样的取代的氨基酸残基可以是也可以不是由遗传密码编码的;或(ii)在一个或多个氨基酸残基中具有取代基团的多肽;或(iii)成熟多肽与另一个化合物(比如延长多肽半衰期的化合物,例如聚乙二醇)融合所形成的多肽;或(iv)附加的氨基酸序列融合到此多肽序列而形成的多肽(如前导序列或分泌序列或用来纯化此多肽的序列或蛋白原序列,或融合蛋白)。根据本文的定义这些片段、衍生物和类似物属于本领域熟练技术人员公知的范围。本发明中,所述的多肽变体是如seqidno.:2所示的氨基酸序列,经过若干个(通常为1-10个,较佳地1-8个,更佳地1-4个,最佳地1-2个)取代、缺失或添加至少一个氨基酸所得的衍生序列,以及在c末端和/或n末端添加一个或数个(通常为10个以内,较佳地为5个以内,更佳地为3个以内)氨基酸。例如,在所述蛋白中,用性能相近或相似的氨基酸进行取代时,通常不会改变蛋白质的功能,在c末端和/或n末端添加一个或数个(如1-3个)氨基酸通常也不会改变蛋白质的功能。这些保守性变异最好根据表1进行替换而产生。表1最初的残基代表性的取代优选的取代ala(a)val;leu;ilevalarg(r)lys;gln;asnlysasn(n)gln;his;lys;argglnasp(d)gluglucys(c)sersergln(q)asnasnglu(e)aspaspgly(g)pro;alaalahis(h)asn;gln;lys;argargile(i)leu;val;met;ala;pheleuleu(l)ile;val;met;ala;pheilelys(k)arg;gln;asnargmet(m)leu;phe;ileleuphe(f)leu;val;ile;ala;tyrleupro(p)alaalaser(s)thrthrthr(t)sersertrp(w)tyr;phetyrtyr(y)trp;phe;thr;serpheval(v)ile;leu;met;phe;alaleu本发明还包括所要求保护的蛋白的类似物。这些类似物与天然seqidno:2差别可以是氨基酸序列上的差异,也可以是不影响序列的修饰形式上的差异,或者兼而有之。这些蛋白的类似物包括天然或诱导的遗传变异体。诱导变异体可以通过各种技术得到,如通过辐射或暴露于诱变剂而产生随机诱变,还可通过定点诱变法或其他已知分子生物学的技术。类似物还包括具有不同于天然l-氨基酸的残基(如d-氨基酸)的类似物,以及具有非天然存在的或合成的氨基酸(如β、γ-氨基酸)的类似物。应理解,本发明的蛋白并不限于上述列举的代表性的蛋白。修饰(通常不改变一级结构)形式包括:体内或体外蛋白的化学衍生形式如乙酸化或羧基化。修饰还包括糖基化,如那些在蛋白质合成和加工中进行糖基化修饰。这种修饰可以通过将蛋白暴露于进行糖基化的酶(如哺乳动物的糖基化酶或去糖基化酶)而完成。修饰形式还包括具有磷酸化氨基酸残基(如磷酸酪氨酸,磷酸丝氨酸,磷酸苏氨酸)的序列。本发明融合蛋白本发明提供了一种融合蛋白,其特征在于,所述融合蛋白从n端到c端具有式i所示结构:p1-p2-p3-p4(式i)式中,p1为纯化标签元件;p2为麦芽糖结合蛋白元件(mbp);p3为蛋白酶识别位点元件;p4为martx多肽元件;“-”表示连接上述元件的肽键。在一个优选的实施方式中,所述的融合蛋白可不包括所述p1的纯化标签元件,仅利用所述p2的麦芽糖结合蛋白元件也可进行amyloseresin层析柱的纯化。即包括或不包括所述p1元件的差别仅在于纯化的效率有所差异,但无论包括或不包括所述p1元件,本发明的融合蛋白在本发明宿主细胞中的表达量以及所得蛋白的构象稳定性均显著优于现有技术中已有的重组martx毒素的其它形式。在一个优选的实施方案中,所述蛋白酶选自下组:hrv3c蛋白酶、thrombin酶、factorxa、肠激酶(enterkinase)、tev酶、prescission、tagzyme、sumo蛋白酶,或其组合。在另一优选例中,所述蛋白酶为thrombin酶。在其它优选的实施方式中,所述融合蛋白的序列还包括:p2-p1-p3-p4、p4-p3-p2-p1、p2-p3-p4-p1或p4-p3-p1-p2。即,his标签、mbp标签以及martx多肽的序列之间的顺序可灵活变动,只需保证所述p3元件所对应的酶切位点紧邻martx多肽,并位于martx多肽与mbp标签之间,使得经过蛋白酶酶切以后的martx多肽中,不包含p2所述的mbp标签即可。而最终所得的martx多肽是可以包含his标签的,因为his标签仅为6和his残基,其存在不会影响martx多肽的活性和结构。本发明制备方法本发明提供的纯化制备martx多肽的方法,包括步骤:(i)用蛋白酶对本发明第一方面所述的融合蛋白酶切,从而获得酶切产物,该酶切产物对应于martx多肽;和(ii)从酶切产物中分离或纯化出所述的martx多肽。在本发明中,对于所述融合蛋白的表达,是在载体菌株e.coliorigamib(de3)中进行的,其培养和诱导表达的条件,均为该菌株的培养和表达蛋白的常规条件。在一个优选的实施方式中,所述的p1为his标签,其用于将所述融合蛋白用镍柱进行亲和层析。在一个优选的实施方式中,所述的p2与martx多肽序列中存在一段thrombin的酶切位点,使用6u/ml的thrombin酶进行过夜酶切,酶切同时使蛋白溶液在3.5kda透析袋中搅拌过夜。在一个优选的实施方式中,所述的p2为mbp标签,其用于将融合蛋白酶切产物用amyloseresin层析柱进行纯化。在这一步骤中,是将切下来的p1-p2结合在亲和层析柱上,而将目标蛋白martx多肽穿流。收集穿流成分,从而获得不带标签的martx多肽。在一个优选的实施方式中,还包括凝胶色谱柱进行纯化的步骤,即分子筛。在这一步骤中,收集保留体积为110ml所有的洗脱峰,即为不带标签的martx多肽蛋白峰。经这一步骤纯化后,可获得纯度较纯的martx多肽。本发明的主要优点包括:1)相比其他表达质粒和纯化方法,本发明获得的重组martx毒素产量较高,2l菌体可得到约3mg多肽,相比于现有的其它martx毒素表达纯化技术,产量提高了近10倍。2)本发明方法制备所得的martx多肽,纯度高、各方面理化性质正确,同时具有电生理活性。由于天然martx毒素产量低,获得困难,因此可运用该专利获得的重组martx毒素替代天然martx毒素进行对bk通道药理机制等的研究,具有重大意义。3)本发明的重组表达法,克服了martx毒素由于多肽分子量较小,且含多对二硫键易导致包涵体表达,从而较难获得大量的、可溶的、高纯度蛋白的缺陷。4)本发明方法实现了martx多肽的绿色制造,可为类似多肽药物的生产制备提供新思路,成为药物合成和精细化学品领域的研究热点。下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。如无特别说明,实施例所用的材料和试剂均为市售产品。实施例1:martx重组质粒构建martx(martentoxin)质粒由上海大学吉永华课题组提供,共37个氨基酸,通过protparam在线软件对martx进行预测,相对分子量约为4.065kda,理论pi值为8.65。基因片段位于pgex-4t-3载体的bamhi和smai克隆位点之间,融合表达的gst标签与目的多肽之间存在肠激酶酶切位点(图5)。宿主菌e.colidh5α、bl21(de3)和origamib(de3)菌种均购自novagen公司,后均由本实验室自主制备。1.1pgex-6p-1-martx重组质粒的构建a)pcr反应首先设计pcr引物,在martx基因片段的5’端和3’端添加bamhi和xhoi酶切位点和保护碱基,以pgex-4t-3-martx重组质粒为模版进行pcr反应,完成后通过1%的琼脂糖凝胶电泳鉴定。电泳图显示目的条带明亮单一,pcr成功(图2)。随后进行目的基因片段的割胶回收工作。b)pgex-6p-1载体和基因片段的双酶切、连接反应分别取25μlpcr回收产物和pgex-6p-1载体溶液,加入takara公司的3μl10×kbuffer,bamhi和xhoi内切酶各1μl组成30μl双酶切体系,于37℃水浴锅中酶切2小时,之后进行1%琼脂糖凝胶电泳鉴定并割胶回收。在200μl灭菌ep管中加入双酶切后的载体0.5μl,martx切后片段4.5μl,加入t4连接酶1μl,ddh2o3μl组成10μl连接体系,置于16℃金属浴中连接过夜。c)转化、测序鉴定连接完成后,转入扩增菌株e.colidh5α感受态中,转化步骤如下:1)取出-80℃保存的高效感受态细胞dh5α100μl,置于冰上缓慢解冻10min;2)取5-10μl连接反应液加至感受态细胞中,轻轻吹打混匀,置于冰上30min;3)42℃水浴热激90s,迅速置于冰上2-3min;4)加入800μllb培养液至管中,于37℃190rpm振荡培养40min;5)3000rpm离心10min,弃去大部分培养液,使细胞在余下的培养液中悬浮,接种至含相应抗生素的固体lb培养基上,涂布均匀;6)该固体培养皿于37℃培养箱倒置过夜,一般培养14-16h。次日挑取大小均一的菌落进行培养,菌液浑浊后送上海铂尚生物技术有限公司进行测序鉴定。经过以上步骤我们成功构建了pgex-6p-1-martx重组质粒。1.2psmt3-martx重组质粒的构建对于psmt3-martx重组质粒,将毒素的基因片段插入bamhi和xhoi之间,这与pgex-6p-1-martx重组质粒的克隆位点相同。因此,通过相同的操作步骤:pcr反应、psmt3载体和基因片段的双酶切(bamhi和xhoi内切酶)、连接反应以及转化、测序鉴定成功构建了psmt3-martx重组质粒。1.3petduet-1-martx重组质粒的构建petduet-1质粒中存在两个多克隆位点mcs1和mcs2。将编码麦芽糖结合蛋白的mbp标签构建于mcs1的ncoi和ecori位点之间,同时于mbp标签的n端设计6个his-tag。首先通过pcr反应将martx基因片段的5’端加入thrombin酶切位点和ecori克隆位点,于3’端加入noti克隆位点,引物设计如表2所示。表2petduet-1-martx重组质粒的引物设计按照1.1的步骤,以pgex-4t-3-martx重组质粒为模版完成pcr反应,然后进行petduet-1质粒和martx基因片段的双酶切(ecori和noti内切酶)、连接反应以及转化、测序鉴定,成功构建了petduet-1-martx重组质粒。实施例2:重组martx毒素的原核表达对于petduet-1-martx重组质粒,将其转入e.coliorigamib(de3)表达菌株中进行表达。本发明选用e.coliorigamib(de3)作为表达菌株。步骤如下:制备e.coliorigamib(de3)感受态细胞,利用热休克法(42℃热激90秒)将测序正确的重组表达载体petduet-1-martx转化至origamib(de3)中,得到含有重组质粒的表达菌株。高效原核表达的步骤如下:1)从平板上挑取表达菌株单克隆接种至含5mllb培养基(含氨苄抗生素)的试管中,37℃、220rpm培养过夜;2)次日将5ml摇浑的菌液接入100ml(含氨苄抗生素)中瓶lb培养液中,37℃、220rpm振荡培养3h;3)取其中20ml转接入1l(含氨苄抗生素)lb培养液中37℃220rpm培养至od600达0.6-0.8左右时,用冰水浴冷却,加入iptg至终浓度为0.5mm,于18℃220rpm诱导表达;4)表达20h后,18℃、5000rpm离心15min收集菌体弃上清,-80℃保存待用。同样地,将pgex-4t-3-martx重组质粒转入e.colibl21(de3)宿主细胞中进行表达;对于pgex-6p-1-martx重组质粒,将其转入e.colibl21(de3)表达菌株中进行表达;对于psmt3-martx重组质粒,将该质粒转入e.colibl21(de3)感受态细胞中进行表达。实施例3:重组martx毒素的纯化制备3.1纯化步骤对于petduet-1-martx重组质粒表达的融合蛋白,即mbp标签重组martx多肽,每升菌体加入15ml破菌buffera(成分详见表2),重悬均匀后加入蛋白酶抑制剂pmsf至终浓度为0.1mm。用高压破菌仪降温至4℃左右破菌,压力设置1000bar左右,重复破菌3次。将破菌液收集至离心管中,4℃16000rpm离心50min后,收集含重组融合蛋白的上清。具体纯化方法步骤如下:1)处于buffera环境中的融合蛋白先与镍柱结合,然后用bufferb咪唑盐溶液进行梯度洗脱除去大部分杂蛋白,完成第一根亲和柱纯化并进行sds-page电泳检测,参见附图8a;2)收集目的融合蛋白(约46.8kda)于18℃、2lbufferc中进行透析酶切,按照6u/ml加入thrombin酶,于3.5kda透析袋中搅拌酶切过夜;3)随后用恒流泵将酶切混合物加载至amyloseresin层析柱上,收集穿流成分(fl)和bufferd洗脱成分。his-mbp-tag经buffere洗脱除去,完成第二根亲和柱纯化并进行sds-page电泳检测,参见附图8b;4)然后将fl成分和bufferd洗涤液(通常含有少量重组martx毒素)浓缩至2ml进行下一步凝胶色谱柱纯化;5)凝胶色谱柱superdex75提前用bufferf平衡,然后将样品加载到柱子上,用bufferf进行洗脱。收集保留体积为110ml左右的洗脱峰即为重组martx毒素样品,之前的吸收峰为mbp-tag或未切开的融合蛋白。紫外吸收峰图参见附图8c;6)sds-page检测纯化效果,参见附图8d。纯化过程中的相关缓冲液组分如表3所示。表3重组martx毒素纯化过程中的相关缓冲液缓冲液名称缓冲液组分buffera25mmtris,500mmnacl,ph7.50bufferb25mmtris,500mmnacl,500mmimidazole,ph7.50bufferc25mmtris,150mmnacl,ph7.50bufferd25mmtris,150mmnacland0.5mmedta,ph7.50buffere25mmtris,150mmnacland0.5mmedta,300mmmaltose,ph7.50bufferf25mmnah2po4,100mmnacl,ph6.80对实施例1中构建的其它重组质粒所表达的重组蛋白,采用类似相应的纯化方式。对于pgex-4t-3-martx重组质粒表达的融合蛋白,带有gst标签,因此纯化时先将蛋白与gst柱结合,然后用还原型谷胱甘肽溶液进行梯度洗脱除去大部分杂蛋白。之后于室温下进行肠激酶酶切去除gst标签,再进行第二次gst柱和一次凝胶色谱柱纯化,从而得到martx多肽。对于pgex-6p-1-martx重组质粒表达的融合蛋白,带有gst标签,纯化时先将蛋白与gst柱结合,然后用还原型谷胱甘肽溶液进行梯度洗脱除去大部分杂蛋白。之后于4℃下进行3c酶酶切将多肽与gst标签分开,再进行第二次gst柱和一次凝胶色谱柱纯化,从而得到martx多肽。对于psmt3-martx重组质粒表达的融合蛋白,带有his标签,因此纯化时先将蛋白与镍柱结合,然后用咪唑盐溶液进行梯度洗脱除去大部分杂蛋白。之后于4℃下进行ulpi酶酶切,再进行第二次镍柱纯化和一次凝胶色谱柱纯化,从而得到martx多肽。3.2纯化结果对于pgex-4t-3-martx重组质粒表达的融合蛋白,经过不同诱导温度和时间的摸索(18℃诱导20h或28℃诱导5h),以及尝试了不同厂家的肠激酶,都未能获得足够量的martx进行后续的实验研究,2l菌体最多只能得到约0.3mg多肽,表达量太低(图5)。因此需要进一步优化重组质粒,尝试将其基因片段构建于其他载体中,并对表达纯化方法进行改进。对于pgex-6p-1-martx重组质粒表达的融合蛋白,我们发现3c酶不易将融合蛋白的gst标签与毒素切开,酶切后得到的martx仍较少,实验失败(图6)。对于psmt3-martx重组质粒表达的融合蛋白,经过第一次镍柱纯化、4℃条件下ulpi酶酶切、第二次镍柱纯化和凝胶色谱柱纯化,该重组质粒也未能得到目的毒素,实验再一次失败(图7)。然而,对于petduet-1-martx重组质粒表达的融合蛋白,经以上表达及纯化后,获得了产量和纯度均较高的重组martx毒素,2llb培养基的菌体可得到约3mg多肽,参见附图8c。相比上海大学提供的pgex-4t-3-martx表达纯化方案,2l菌体可得到约3mg多肽,产量提高了近10倍,满足了后续实验毒素的样品需求。实施例4:重组martx毒素的表征为了进一步确认得到的重组martx毒素是否正确,对重组毒素的分子量以及二级结构进行了验证,同时利用一维氢谱考察了毒素在溶液中的折叠情况。4.1重组martx毒素的1hnmr重组martx浓度为0.42mm,于25mmnah2po4,100mmnacl,ph6.80的buffer中加入10%的d2o,在600mhz核磁谱仪上采集一维氢谱,采样温度为20℃,实验谱图参见附图9。获得的重组martx毒素的核磁信号比较发散,在高场区附近有明显的甲基特征峰,且毒素的酰胺氢和芳环氢于6.5-10.5ppm的低场区分布广泛,说明多肽未发生聚集,空间结构折叠良好。4.2重组martx毒素的圆二色谱为了进一步对毒素的二级结构进行验证,测定了重组martx的圆二色谱(cd光谱)。将毒素的buffer条件交换至ddh2o中,样品浓度为0.5mg/ml,实验结果参见附图10。由此可知,本发明的重组毒素包含已发表结构的α螺旋和β折叠二级结构元件,说明折叠正常。4.3重组martx毒素的质量测定将纯化后的毒素样品buffer条件交换至ddh2o中,经maldi-tof测定,重组martx的分子量为4200.5444,参见附图11。重组martx经thrombin酶切后其n端多gs两个氨基酸,理论分子量为4208.80,因此测定的分子量与理论值大致相当。4.4重组martx毒素的溶液结构解析对重组martx样品进行了二维nmr谱图采集。实验于aligent600mhz谱仪上进行,样品浓度为1mm,采样温度为20℃,采样buffer为25mmnah2po4,100mmnacl,10%d2o,ph6.80。采集的二维同核nmr谱图如表4所示。表4重组martx毒素谱图采集及参数设置experimentnumberofincrementssw(hz)carrierfrequency(ppm)dqf_cosy1000(h)×256(h)6906(h)×6906(h)4.82(h)×4.82(h)tocsy1024(h)×256(h)9579(h)×6010(h)4.82(h)×4.82(h)noesy1024(h)×256(h)12019(h)×9597(h)4.82(h)×4.82(h)对以上谱图进行信号归属,然后进行结构计算和精修得到100个溶液结构。从100个精修结构中按照能量排序选出20个能量最低的结构作为重组martx毒素的代表性构象,对20个最优溶液结构进行叠加,结果表明除了毒素中比较灵活的loop外,其余二级结构部分相对收敛,参见附图12。运用procheck_nmr软件对重组martx毒素的20个最优溶液构象进行评估,参见附图13。ramachandran图分析结果显示其角和ψ角都处于可接受区域,20个最优构象平均有91.8%的残基处在最允许区域,4.4%的残基处在次允许区域,没有残基处于不允许区域,表明结构合理。将得到的结构与已报道的天然martx(pdb:1m2s)溶液结构进行叠加,rmsd值为参见附图14。表明核磁解析的重组martx毒素结构与从东亚钳蝎毒液中提取的天然毒素结构一致,说明通过本发明的原核表达体系成功制备得到了martx毒素,可用于下一步对毒素活性的考察中。实施例5:重组martx毒素对(α+β4)bk通道电流的抑制文献[biophys.j.2008,94,3706-3713]表明martx毒素与bk通道β4辅助亚基的胞外loop区相互作用,从而抑制了(α+β4)bk通道电流。本发明通过膜片钳实验考查了重组martx毒素对(α+β4)bk通道的电生理活性。实验步骤:人类胚胎肾细胞(hek293t)在含10%热灭活的fbs的dmem(gibco公司,美国)培养液中培养,细胞在培养皿中的生长条件为5%co2、恒温37℃、恒湿95%。采用瞬时转染技术,通过脂质体转染法将人源(α+β4)bk通道质粒(含hsloα(u23767)、β4(kcnmb4;af207992)的基因序列)转入hek293细胞中表达。在室温(21℃-25℃)下利用epc-9放大器(hekaeletronik,德国)进行全细胞电压膜片钳实验。实验中细胞外液为nacl135mm,kcl5mm,mgcl21.2mm,cdcl22.5mm,hepes5mm,glucose10mm(以naoh调节ph至7.4);电极内液为nacl10mm,kcl117mm,mgso42mm,hepes10mm,mgatp2mm,egta1mm(以koh调节ph至7.2)。数据处理:数据通过pulsefit8.5(hekaeletronik,germany)和origin8.5(northampton公司,美国)进行分析。实验结果用平均值±标准误差(mean±s.e.m)表示,n为实验细胞个数。fractionofcurrent为加入药物(重组martx毒素)后bk通道的稳态电流与未加入药物时对照电流的比值。实验结果:经以上膜片钳实验测定发现,利用本发明发展的原核重组表达系统,获得的重组martx毒素具有电生理活性,参见附图15a。10μm重组martx毒素可显著抑制(α+β4)bk通道电流,if(fractionofcurrent)=0.33±0.06,n=6,与文献报道的药理学性质相符。实施例6:重组martx毒素阻断(α+β4)bk通道半数效应浓度的测定10μm重组martx毒素可有效抑制由(α+β4)bk通道产生的电流,且具有剂量依赖性特点,参见附图15b。量效曲线显示的重组martx毒素阻断(α+β4)bk通道的半数效应浓度(ec50)为0.32±0.012μm。由此可得,经本发明原核表达纯化得到的重组martx毒素可实现对(α+β4)bk通道电流的有效阻断,可作为神经型bk通道的抑制剂,用于与神经型bk通道功能相关的癫痫等疾病的研究。讨论在本发明的实施例中,有三组进行平行实验的对比例,具体地,分别将martx基因整合至载体质粒pgex-4t-3(其表达gst标签)、pgex-6p-1(其表达gst标签)和psmt3(其表达his标签和sumo标签)中,并分别在e.colibl21(de3)中进行表达。根据其分别的表达和纯化的结果(参见实施例3),三组对比例相较于本发明融合蛋白的纯化结果,得到的蛋白产量低或纯度低。分析其原因,对于pgex-4t-3-martx和pgex-6p-1-martx,均含有gst标签,gst标签分子量约26kda,而目的毒素只有约4kda,并且由于gst标签的结构特征,可能将蛋白酶酶切位点及多肽包裹其中,使蛋白酶无法实现酶切功能,从而导致酶切后的目的多肽量极少。对于psmt3-martx,其表达量就已经很少,即在表达步骤就已经失败。总结对比例效果较差的原因,本发明人推测可能因为martx毒素分子量较小,不易与融合标签切开。且毒素中含有三对二硫键,不易重构正确。而二硫键蛋白表达系统有利于二硫键的正确折叠。origamib(de3)属于大肠杆菌克隆型菌种,含有trxb/gor基因突变。同时突变这两个基因使得该菌株能够更加高效地在细胞质内生成二硫键,有助于含二硫键的活性蛋白形成。因此,经过了大量的尝试和摸索,本发明人最终开发出了本发明的martx多肽制备方法,使用本发明所述的重组质粒,并使用所述e.coliorigamib(de3)菌株,成功获得产量和纯度均较高的martx毒素样品,克服了martx毒素由于多肽分子量较小,且含多对二硫键易导致包涵体表达,从而较难获得大量的、可溶的、高纯度蛋白的缺陷。本发明的技术方案相比现有技术中已有的martx毒素的表达纯化方案,2l菌体可得到约3mg多肽,产量提高了近10倍,实现了martx多肽的高效绿色制造。在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。序列表<110>中国科学院上海有机化学研究所<120>重组martentoxin的制备、表征及应用<130>p2018-1737<160>6<170>patentinversion3.5<210>1<211>114<212>dna<213>东亚钳蝎(buthusmartensikarsch)<400>1tttggactcatagacgtaaaatgttttgcatctagtgaatgttggacagcttgcaaaaaa60gtaacaggatcgggacaaggaaagtgccagaataatcaatgtcgatgctactga114<210>2<211>37<212>prt<213>东亚钳蝎(buthusmartensikarsch)<400>2pheglyleuileaspvallyscysphealaserserglucystrpthr151015alacyslyslysvalthrglyserglyglnglylyscysglnasnasn202530glncysargcystyr35<210>3<211>1101<212>dna<213>大肠杆菌(escherichiacoli)<400>3atgaaaatcgaagaaggtaaactggtaatctggattaacggcgataaaggctataacggt60ctcgctgaagtcggtaagaaattcgagaaagataccggaattaaagtcaccgttgagcat120ccggataaactggaagagaaattcccacaggttgcggcaactggcgatggccctgacatt180atcttctgggcacacgaccgctttggtggctacgctcaatctggcctgttggctgaaatc240accccggacaaagcgttccaggacaagctgtatccgtttacctgggatgccgtacgttac300aacggcaagctgattgcttacccgatcgctgttgaagcgttatcgctgatttataacaaa360gatctgctgccgaacccgccaaaaacctgggaagagatcccggcgctggataaagaactg420aaagcgaaaggtaagagcgcgctgatgttcaacctgcaagaaccgtacttcacctggccg480ctgattgctgctgacgggggttatgcgttcaagtatgaaaacggcaagtacgacattaaa540gacgtgggcgtggataacgctggcgcgaaagcgggtctgaccttcctggttgacctgatt600aaaaacaaacacatgaatgcagacaccgattactccatcgcagaagctgcctttaataaa660ggcgaaacagcgatgaccatcaacggcccgtgggcatggtccaacatcgacaccagcaaa720gtgaattatggtgtaacggtactgccgaccttcaagggtcaaccatccaaaccgttcgtt780ggcgtgctgagcgcaggtattaacgccgccagtccgaacaaagagctggcaaaagagttc840ctcgaaaactatctgctgactgatgaaggtctggaagcggttaataaagacaaaccgctg900ggtgccgtagcgctgaagtcttacgaggaagagttggcgaaagatccacgtattgccgcc960accatggaaaacgcccagaaaggtgaaatcatgccgaacatcccgcagatgtccgctttc1020tggtatgccgtgcgtactgcggtgatcaacgccgccagcggtcgtcagactgtcgatgaa1080gccctgaaagacgcgcagact1101<210>4<211>367<212>prt<213>大肠杆菌(escherichiacoli)<400>4metlysileglugluglylysleuvaliletrpileasnglyasplys151015glytyrasnglyleualagluvalglylyslyspheglulysaspthr202530glyilelysvalthrvalgluhisproasplysleugluglulysphe354045proglnvalalaalathrglyaspglyproaspileilephetrpala505560hisaspargpheglyglytyralaglnserglyleuleualagluile65707580thrproasplysalapheglnasplysleutyrprophethrtrpasp859095alavalargtyrasnglylysleuilealatyrproilealavalglu100105110alaleuserleuiletyrasnlysaspleuleuproasnproprolys115120125thrtrpglugluileproalaleuasplysgluleulysalalysgly130135140lysseralaleumetpheasnleuglngluprotyrphethrtrppro145150155160leuilealaalaaspglyglytyralaphelystyrgluasnglylys165170175tyraspilelysaspvalglyvalaspasnalaglyalalysalagly180185190leuthrpheleuvalaspleuilelysasnlyshismetasnalaasp195200205thrasptyrserilealaglualaalapheasnlysglygluthrala210215220metthrileasnglyprotrpalatrpserasnileaspthrserlys225230235240valasntyrglyvalthrvalleuprothrphelysglyglnproser245250255lysprophevalglyvalleuseralaglyileasnalaalaserpro260265270asnlysgluleualalysglupheleugluasntyrleuleuthrasp275280285gluglyleuglualavalasnlysasplysproleuglyalavalala290295300leulyssertyrgluglugluleualalysaspproargilealaala305310315320thrmetgluasnalaglnlysglygluilemetproasnileprogln325330335metseralaphetrptyralavalargthralavalileasnalaala340345350serglyargglnthrvalaspglualaleulysaspalaglnthr355360365<210>5<211>55<212>dna<213>人工序列(artificialsequence)<400>5ccggaattcctggtccctagaggttcttttggactcatagacgtaaaatgttttg55<210>6<211>45<212>dna<213>人工序列(artificialsequence)<400>6ctgcggccgctcagtagcatcgacattgattattctggcactttc45当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1