一种双细胞耦合催化生产戊二酸的方法与流程
本发明涉及戊二酸制备技术领域,具体涉及一种双细胞耦合催化生产戊二酸的方法。
背景技术:
戊二酸,别名:胶酸,α,γ一丙烷二竣酸,1,3一丙二竣酸,分子式为c5h8o4,是一种重要的有机化工原料和中间体,在化学、建筑、医药、农业等方面具有广泛的应用。在塑料工业中,戊二酸及其戊二酸烷基酯类主要作为增塑剂的中间体,是聚氯乙烯、聚酯、聚酰胺以及聚氯乙烯的聚酯增塑剂的组成成分。在医药方面,戊二酸主要用于合成戊二酸酐,而戊二酸酐又可以作为很多药物的中间体,可用于合成新一代降血脂类药匹伐他汀和瑞舒伐他汀钙片。由于其良好的广谱杀菌能力,可以用来合成各种杀菌消毒洗液和医用药品等等。戊二酸也可合成液态聚酯,用于改良pet纤维的分子结构,从而改进pet纤维的染色性,提高上染率。利用戊二酸配制粘合剂可广泛粘接纺织品、金属等。此外,戊二酸或其酯也可用于聚酯多醇的合成、去垢剂的配制、含硫等烟道气的洗涤。
合成戊二酸的传统方法有回收法,化学合成法。回收法生产戊二酸主要依赖从己二酸的副产物中分离提纯,此法操作繁琐流程长,回收率低且不稳定。合成法主要有环戊酮液相氧化法、,γ-丁内酯法、二氢吡喃法和戊二腈法。合成法大多原料昂贵不易得,试剂毒性大污染环境,产品收率低,合成路线复杂等缺点。
sijaepark等人采用过表达了davab和gabdt的重组e.coliwl3110菌株,在含有赖氨酸,葡萄糖和α-酮戊二酸的培养基里共同发酵生产了1.7g/l戊二酸。此法发酵周期长且转化率低,且需要添加昂贵的α-酮戊二酸作为氨基受体,大大增加了生产成本。
jia-leyu等人采用过表达了hgdh,、gctab、hgdabc、ter和tesb的重组e.coli菌株,以α-酮戊二酸为底物厌氧培养得到了3.8mg/l戊二酸。此法反应体系复杂,原料昂贵且有副产物生成,戊二酸摩尔收率低。
经检索,一种经济高效的双细胞耦合生产戊二酸的方法尚未见报道。
技术实现要素:
针对现有技术的不足,本发明的目的在于提供一种双细胞耦合催化生产戊二酸的方法,该方法简单,催化效果好,且中间产物少。
为解决现有技术问题,本发明采取的技术方案为:
一种双细胞耦合催化生产戊二酸的方法,包括以下步骤:
步骤1,构建重组菌株e.colibl-22ab和e.colibl-ydt;
步骤2,选取重组菌株e.colibl-22ab和e.colibl-ydt混合后,催化l-赖氨酸反应生产戊二酸。
作为改进的是,步骤1中重组菌株e.colibl-22ab和e.colibl-ydt的构建方法,包括以下步骤:第一步,提取重组质粒pet22b–davba和pacyc-gabtd,并以酶切位点ndei进行酶切验证;第二步,将第一步中验证无误的重组质粒pet22b–davba导入e.colibl21(de3),得到重组菌株e.colibl-22ab;第三步,将第一步中验证无误的重组质粒pacyc-gabtd导入e.colibl21(de3)中,得到重组菌株e.colibl-ydt。
作为改进的是,步骤2中重组菌株e.colibl-22ab和e.colibl-ydt的od比例为1:3。
作为改进的是,步骤2中催化l-赖氨酸反应的温度为37℃,转速为200rpm。
作为改进的是,步骤2中催化l-赖氨酸反应的ph为7.4。
作为改进的是,步骤2中催化l-赖氨酸反应中还包括cu2+。
作为改进的是,步骤2中催化l-赖氨酸反应的底物浓度为20g/l。
有益效果:
与现有技术相比,本发明公开了一种双细胞耦合催化生产戊二酸的方法,通过将davab和gabdt分开表达在两个细胞中,利用双细胞耦合催化生产的方式,使得中间产物5-氨基戊酸的积累减少,终产物戊二酸的产量提高。相比于将davab和gabdt共表达在一个细胞中,戊二酸的摩尔收率提高了19.2%。
其次,通过对细胞比例的优化,解决了中间产物5-氨基戊二酸的积累问题,使得戊二酸的产量有了一定的提升,再者通过对催化体系的优化,筛选出最适温度,最适ph以及cu2+,对酶的活性有进一步的提升。最后通过分批补料解决底物l-赖氨酸对酶活的抑制,最终得到了高效产戊二酸的方法。
附图说明
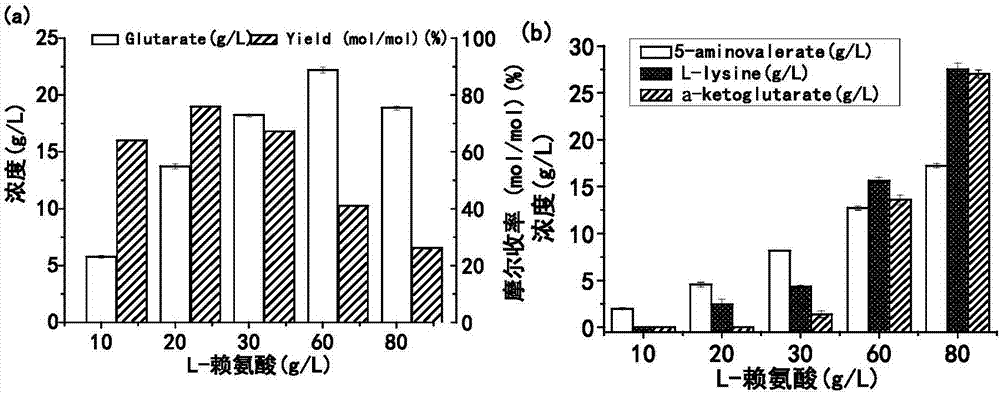
图1为e.colibl-22ab-ydt细胞od600=20单细胞与不同浓度l-赖氨酸的情况下催化产物的情况,(a)为戊二酸,(b)为底物l-赖氨酸,α-酮戊二酸以及中间产物5-氨基戊酸;
图2为e.colibl-22ab细胞od600=20与e.colibl-22ab-ydt细胞od600=20在浓度为20g/l的l-赖氨酸下催化情况,5-氨基戊酸的积累情况;
图3为e.colibl-ydt细胞od600=20与e.colibl-22ab-ydt细胞od600=20在5-氨基戊酸15g/l,α-酮戊二酸30g/l时,戊二酸的积累情况;
图4为e.colibl-22ab细胞od600=10,e.colibl-ydt细胞od600=10双细胞耦合催化与e.colibl-22ab-ydt细胞od600=20单细胞催化,在l-赖氨酸20g/l时戊二酸的积累情况;
图5为e.colibl-22ab细胞od600=10,e.colibl-ydt细胞od600=10,初始赖氨酸20g/l,多次补加赖氨酸高浓度母液后戊二酸和5-氨基戊酸的积累情况。
具体实施方式
下面结合具体实施例对本发明的发明方法进行详细描述和说明。其内容是对本发明的解释而非限定本发明的保护范围。
实施例1重组菌株e.colibl-22ab-ydt的构建
(1)重组质粒pet22b–davba和pacyc-gabtd由本实验提供,质粒提取使用tiangen公司的质粒小提试剂盒进行质粒提取;
(2)将提取出来的重组质粒pet22b–davba和pacyc-gabtd以酶切位点ndei经相对应的快速内切酶以最适温度酶切30min;
(3)将(2)中的转化液取微量进行琼脂糖凝胶电泳验证,电压80v-120v,电泳15-30min,结束后,在透射紫外灯下观察成像;
(4)将(3)中验证无误的重组质粒pet22b–davba导入e.colibl21(de3)中,并涂布在含有100mg/l氨苄青霉素抗性的平板上,37℃过夜培养,得到重组菌株e.colibl-22ab;
(5)将(3)中验证无误的重组质粒pacyc-gabtd导入e.colibl21(de3)中,并涂布在含有35mg/l氯霉素抗性的平板上,37℃过夜培养,得到重组菌株e.colibl-ydt;
(6)将(3)中验证无误的重组质粒pet22b–davba和pacyc-gabtd共同导入e.colibl21(de3),并涂布在含有100mg/l氨苄青霉素抗性和35mg/l氯霉素抗性的平板上,37℃过夜培养,得到重组菌株e.colibl-22ab-ydt。
实施例2
在大肠杆菌中共表达davba和gabdt催化生产戊二酸
(1)从实施例1中的平板上挑取重组菌株e.colibl-22ab-ydt的单菌落接种到含有100mg/l氨苄青霉素抗性和35mg/l氯霉素抗性的5mllb摇管里,37℃培养6-8h后,转接到含有100mg/l氨苄青霉素抗性和35mg/l氯霉素抗性的100ml摇瓶里,37℃培养至od600=0.6,加入0.5mmol的iptg,20℃诱导12h,7000g离心5min,得到重组菌株e.colibl-22ab-ydt的细胞,将其作为催化剂,4℃保存;
(2)将(1)中收集好的细胞用ph7.0的pbs重悬并浓缩共同加入到催化体系,使体系中e.colibl-22ab-ydt的细胞od600为20,并加入配制好的ph7.0的l-赖氨酸母液和α-酮戊二酸母液,改变体系中l-赖氨酸的终浓度,依次为10g/l、20g/l、30g/l、60g/l和80g/l(l-赖氨酸和α-酮戊二酸的摩尔比为1:1);
(3)催化反应体系在37℃,转速200rpm条件下进行,并定期取样(样品12000rpm,离心2min),并用液相检测戊二酸的生成情况和5-氨基戊酸的积累情况。
其中戊二酸的检测方法为色谱柱:bio-radaminexhpx-87h(300mm*7.8mm),柱温:55°c,流动相:8mmh2so4,流速:0.6ml/min,检测器:紫外。5-氨基戊酸的检测方法为色谱柱:gracec18(5ul,5μm,4.6mm×25mm),柱温:28.5ºc,流动相:0.7%(v/v)三氟乙酸水溶液,流速:1ml/min,检测器温度:115ºc,载气:氮气(纯度99.9%),载气流速:3.2l/min,检测器:蒸发光散射检测器(elsd);
(4)经检测,当l-赖氨酸浓度为60g/l时,戊二酸产量最高为22.2g/l,当l-赖氨酸浓度为20g/l时,戊二酸摩尔收率最高仅为75.9%,在l-赖氨酸浓度增加至80g/l时,摩尔收率低至26.1%,且不论l-赖氨酸初始浓度如何,中间产物5-氨基戊酸都大量积累。见图1。
实施例3
双细胞耦合催化与单细胞催化生产戊二酸的对比
(1)从实施例1中的平板上挑取重组菌株e.colibl-22ab的单菌落接种到含有100mg/l氨苄青霉素抗性的的5mllb摇管里,37℃培养6-8h后,转接到含有100mg/l氨苄青霉素抗性的的100ml摇瓶里,37℃培养至od600=0.3,加入1mmol的iptg,20℃诱导12h,7000g离心5min,得到重组菌株e.colibl-22ab的细胞,将其作为催化剂,4℃保存;
(2)从实施例1中的平板上挑取重组菌株e.colibl-ydt的单菌落接种到含有35mg/l氯霉素抗性的5mllb摇管里,37℃培养6-8h后,转接到含有35mg/l氯霉素抗性的100ml摇瓶里,37℃培养至od600=1.0,加入0.5mmol的iptg,20℃诱导12h,7000g离心5min,得到重组菌株e.colibl-ydt的细胞,将其作为催化剂,4℃保存;
(3)从实施例1中的平板上挑取重组菌株e.colibl-22ab-ydt的单菌落接种到含有100mg/l氨苄青霉素抗性和35mg/l氯霉素抗性的5mllb摇管里,37℃培养6-8h后,转接到含有100mg/l氨苄青霉素抗性和35mg/l氯霉素抗性的100ml摇瓶里,37℃培养至od600=0.6,加入0.5mmol的iptg,20℃诱导12h,7000g离心5min,得到重组菌株e.colibl-22ab-ydt的细胞,将其作为催化剂,4℃保存;
(4)将(1)中收集好的细胞用ph7.0的pbs重悬并浓缩加入到催化体系,使体系中e.colibl-22ab的细胞od600为20,并加入配制好的ph7.0的l-赖氨酸母液,使体系中l-赖氨酸的终浓度为20g/l。将(3)中收集好的细胞用ph7.0的pbs重悬并浓缩加入到催化体系,使体系中e.colibl-22ab-ydt的细胞od600为20,并加入配制好的ph7.0的l-赖氨酸母液,使体系中l-赖氨酸终浓度都为20g/l;
(5)将(2)中收集好的细胞用ph7.0的pbs重悬并浓缩加入到催化体系,使体系中e.colibl-ydt的细胞od600为20,并加入配制好的ph7.0的α-酮戊二酸母液和5-氨基戊酸,使体系中α-酮戊二酸母液和5-氨基戊酸的终浓度分别为30g/l和15g/l;
(6)将(3)中收集好的细胞用ph7.0的pbs重悬并浓缩加入到催化体系,使体系中e.colibl-22ab-ydt的细胞od600为20,并加入配制好的ph7.0的α-酮戊二酸母液和5-氨基戊酸,使体系中α-酮戊二酸母液和5-氨基戊酸的终浓度分别为30g/l和15g/l;
(7)使得(4)和(5)中的催化反应都在在37℃,转速200rpm条件下进行,并定期取样(样品12000rpm,离心2min),并用液相检测戊二酸的生成情况和5-氨基戊酸的积累情况;
经检测,20g/ll-赖氨酸浓度下,e.colibl-22ab积累了14.18g/l5-氨基戊酸而e.colibl-22ab-ydt仅积累了11g/l5-氨基戊酸。15g/l5-氨基戊酸浓度下,e.colibl-ydt积累了15.32g/l戊二酸,而e.colibl-22ab-ydt仅积累了10.36g/l戊二酸。见图2和图3。
实施例4
双细胞耦合催化与单细胞催化生产戊二酸的对比
(1)按照实施例3中(1),(2),(3)收集细胞,作为催化剂,4℃保存;
(2)将按照实施例3中(1)和(2)收集好的细胞用ph7.0的pbs重悬并浓缩共同加入到催化体系,使体系中e.colibl-22ab和e.colibl-ydt的细胞od600都为10,并加入配制好的ph7.0的l-赖氨酸母液和α-酮戊二酸母液,使体系中l-赖氨酸和α-酮戊二酸的终浓度都为20g/l。将按照实施例3(3)中收集好的细胞用ph7.0的pbs重悬并浓缩加入到催化体系,使体系中e.colibl-22ab-ydt的细胞od600为20,并加入配制好的ph7.0的l-赖氨酸母液和α-酮戊二酸母液,使体系中l-赖氨酸和α-酮戊二酸的终浓度都为20g/l;
(3)催化反应体系在37℃,转速200rpm条件下进行,并定期取样(样品12000rpm,离心2min),并用液相检测戊二酸的生成情况和5-氨基戊酸的积累情况;
经检测,重组菌株e.colibl-22ab和重组菌株e.colibl-ydt双细胞耦合催化生产戊二酸与重组菌株e.colibl-22ab-ydt单细胞催化生产戊二酸相比,降低了中间产物5-氨基戊酸的积累,并且提高了戊二酸的产量,双细胞体系下,最终戊二酸积累了17.18g/l,见图4。
实施例5
双细胞耦合催化生产戊二酸催化温度条件优化
(1)按照实施例2中的方法进行收集重组菌株e.colibl-22ab和e.colibl-ydt的细胞;
(2)将收集好的细胞用ph7.0的pbs重悬并浓缩加入到催化体系中,使体系中e.colibl-22ab和e.colibl-ydt的细胞od600都为5,并加入配制好的ph7.0的l-赖氨酸母液和α-酮戊二酸母液,使体系中l-赖氨酸和α-酮戊二酸的终浓度都为10g/l,分别在20℃、30℃、37℃、45℃和55℃温度下进行催化反应;
经检测,经过30h反应,在37℃温度下催化该反应,戊二酸产量最高,为5.9g/l。
实施例6
双细胞耦合催化生产戊二酸催化ph条件优化
(1)按照实施例2中的方法进行收集重组菌株e.colibl-22ab和e.colibl-ydt的细胞;
(2)将收集好的细胞用ph7.0的pbs重悬并浓缩加入到催化体系中,使体系中e.colibl-22ab和e.colibl-ydt的细胞od600都为5,并加入配制好的ph7.0的l-赖氨酸母液和α-酮戊二酸母液,使体系中l-赖氨酸和α-酮戊二酸的终浓度都为10g/l,将反应初始ph分别控制在5、5.8、6.6、7.4和8.2下,在37℃温度下进行催化反应,每隔5h检测ph值并进行相应的调控;
经检测,30h反应后,当反应体系ph值控制在7.4左右时,戊二酸产量最高,过酸或者过碱都会使得戊二酸产量下降。
实施例7
双细胞耦合催化生产戊二酸金属离子条件优化
(1)按照实施例2中的方法进行收集重组菌株e.colibl-22ab和e.colibl-ydt的细胞;
(2)将收集好的细胞用ph7.0的pbs重悬并浓缩加入到催化体系中,使体系中e.colibl-22ab和e.colibl-ydt的细胞od600都为5,并加入配制好的ph7.0的l-赖氨酸母液和α-酮戊二酸母液,使体系中l-赖氨酸和α-酮戊二酸的终浓度都为10g/l,然后在体系1中不加金属离子,体系2中加入zn2+,体系3中加入sr2+,体系4中加入cu2+,体系5中加入co2+,体系6中加入fe3+,体系7中加入mg2+,体系8中加入k+,体系9中加入mn2+,体系10中加入ca2+,体系11中加入fe2+,然后在相同条件下进行催化反应;
经过30h的催化反应后,取样检测。从结果上发现,无金属离子添加的体系1作为空白对照,戊二酸的产量为5.3g/l,摩尔收率为58.57%,添加了cu2+的体系4中戊二酸的产量为6.32g/l,与空白对照相比摩尔收率提高了9.82%。
实施例8
双细胞耦合催化生产戊二酸细胞比例条件优化
(1)按照实施例2中的方法进行收集重组菌株e.colibl-22ab和e.colibl-ydt的细胞;
(2)将收集好的细胞用ph7.0的pbs重悬并浓缩加入到催化体系中,使体系中其他条件不变,改变e.colibl-22ab细胞和e.colibl-ydt细胞od比例,控制e.colibl-22ab细胞od600为5,改变e.colibl-ydt细胞od,依次为2.5、5、10、15、20、25和30,然后在相同条件下进行催化反应,并且隔一定时间取样检测戊二酸和中间产物5-氨基戊酸的积累情况;
经检测,增加e.colibl-ydt细胞比例能够减少中间产物5-氨基戊酸的积累,并且在e.colibl-22ab细胞和e.colibl-ydt细胞od比例为1:3的时候,戊二酸产量最高,为6.6g/l,摩尔收率为72.3%。
实施例9
双细胞耦合催化生产戊二酸底物浓度条件优化
(1)按照实施例2中的方法进行收集重组菌株e.colibl-22ab和e.colibl-ydt的细胞;
(2)将收集好的细胞用ph7.0的pbs重悬并浓缩加入到催化体系中,使体系中e.colibl-22ab细胞和e.colibl-ydt细胞od比例为1:3,改变l-赖氨酸和α-酮戊二酸的终浓度,依次为10g/l、20g/l、30g/l、60g/l和80g/l。然后在相同条件下进行催化反应,并且隔一定时间取样检测戊二酸和中间产物5-氨基戊酸的积累情况;
经检测,当底物浓度为20g/l时,戊二酸摩尔收率最高,为95.1%。
实施例10
分批补料催化生产戊二酸
(1)按照实施例2中的方法进行收集重组菌株e.colibl-22ab和e.colibl-ydt的细胞;
(2)将收集好的细胞用ph7.0的pbs重悬并浓缩加入到催化体系中,使体系中e.colibl-22ab和e.colibl-ydt的细胞od600分别为5和15,并加入配制好的ph7.0的l-赖氨酸母液和α-酮戊二酸母液,使体系中l-赖氨酸和α-酮戊二酸的终浓度都为20g/l,cu2+的终浓度为5mol/l,tritonx-100的添加量为0.5%。催化反应在37℃,转速200rpm条件下进行,并定期取样(12000rp,2min),并用生物传感仪检测l-赖氨酸的剩余量;
(3)待赖氨酸基本耗尽,向催化体系中补加高浓度赖氨酸母液,使体系中赖氨酸浓度维持在20g/l左右,直到反应达到平衡,检测戊二酸和中间产物5-氨基戊酸的积累情况;
(4)经高效液相色谱紫外检测器检测,通过多次补料,80h后反应达到平衡,戊二酸积累到42g/l,见图5。
- 还没有人留言评论。精彩留言会获得点赞!