用于EB病毒DNA检测的引物和crRNA及其应用的制作方法
本发明涉及肿瘤诊断领域,具体涉及与肿瘤诊断相关的分子检测,更具体涉及一种eb病毒dna的特异性检测引物和一种靶向eb病毒的特异性crrna,以及利用该引物和crrna对鼻咽癌患者进行eb病毒dna的定量检测方法。
背景技术:
鼻咽癌(nasopharyngealcarcinoma,npc)是发生于鼻咽腔顶部和侧壁黏膜上皮细胞的恶性肿瘤。在中国华南地区鼻咽癌是常见的恶性肿瘤,其发生率高达20/100000,故亦称广东癌,在所有恶性肿瘤发病率中排名前十。
临床研究显示血浆eb病毒dna水平是鼻咽癌的独立生物标志物。mutirangura等首次发现能从鼻咽癌患者血浆中检测到eb病毒dna(clinicalcancerresearch,1998)。在此研究基础上,卢煜明院士利用实时荧光定量pcr技术分别检测鼻咽癌患者和健康人血浆中的eb病毒dna,发现鼻咽癌患者血浆中eb病毒dna阳性率显著高于健康人,血浆中eb病毒dna含量可作为鼻咽癌筛查方法(cancerresearch,1999)。曾木圣课题组通过利用实时荧光定量pcr技术检测鼻咽癌患者血浆中eb病毒dna含量,可对鼻咽癌患者进行分期(journalofthenationalcancerinstitute,2015)。
然而,实时荧光定量pcr技术所需要的仪器较为复杂,难以在偏远地区进行推广。rpa,即重组酶聚合酶扩增技术,主要依赖重组酶、单链结合蛋白和链置换dna聚合酶进行等温核酸扩增,是一种可以替代传统pcr的新型核酸检测技术。
技术实现要素:
本发明目的在于提供一种用于eb病毒dna检测的特异性引物和特异性crrna,以及利用该引物和crrna对鼻咽癌患者血浆eb病毒dna的早期快速定量检测方法,该方法具有不依赖qpcr仪等复杂仪器等特点。
本发明所采取的技术方案是:
一种用于检测eb病毒dna的引物对,其正向引物核苷酸序列如seqidno:1所示,其反向引物核苷酸序列如seqidno:2所示。
一种用于检测eb病毒dna的crrna,其核苷酸序列如seqidno:3所示。
一种检测eb病毒dna的试剂盒,其特征在于:包含上述所述的引物对和crrna。
进一步的,上述试剂盒中还含有lwcas13a蛋白和底物报告rnarnasealertv2。
进一步的,上述试剂盒中还含有rna酶抑制剂,atp,gtp,utp,ctp,t7聚合酶,mgcl2和mgac。
一种检测eb病毒dna的方法,包括以下步骤:
1)提取待测样品dna,得模板;
2)将所得模板dna在反应体系进行相应的反应程序,先利用重组酶聚合酶扩增技术和上述所述引物对在25~37℃条件下对模板dna进行扩增反应,然后在25~37℃条件下对扩增产物进行转录反应得到转录产物rna,使用上述所述的crrna、lwcas13a在25~37℃条件下对转录产物进行荧光信号检测;上述所有扩增反应和转录反应均的同一反应体系中进行或分开在不同体系中进行;
3)根据荧光信号值对待测样品中eb病毒dna进行定量。
进一步的,上述同一反应体系为每100μl反应体系中包括:
0.48μmseqidno:1所示正向引物
0.48μmseqidno:2所示反向引物
1xrpa再水合缓冲液
模板dna
45nmlwcas13a蛋白
22.5nmseqidno:3所示crrna
125nm底物报告rna
2.5μl鼠rna酶抑制剂
2mmatp
2mmgtp
2mmutp
2mmctp
1μlt7聚合酶混合物
5mmmgcl2
14mmmgac。
进一步的,步骤2)中,所述荧光信号检测的程序为:在荧光读板仪中于25~37℃条件下反应2~3h,每4~6分钟测量一次荧光信号。
本发明的有益效果是:
本发明目的在于提供一种用于eb病毒dna检测的特异性引物和特异性crrna,以及利用该引物和crrna对鼻咽癌患者血浆eb病毒dna的早期快速定量检测方法,该方法具有不依赖qpcr仪等复杂仪器等特点。
附图说明
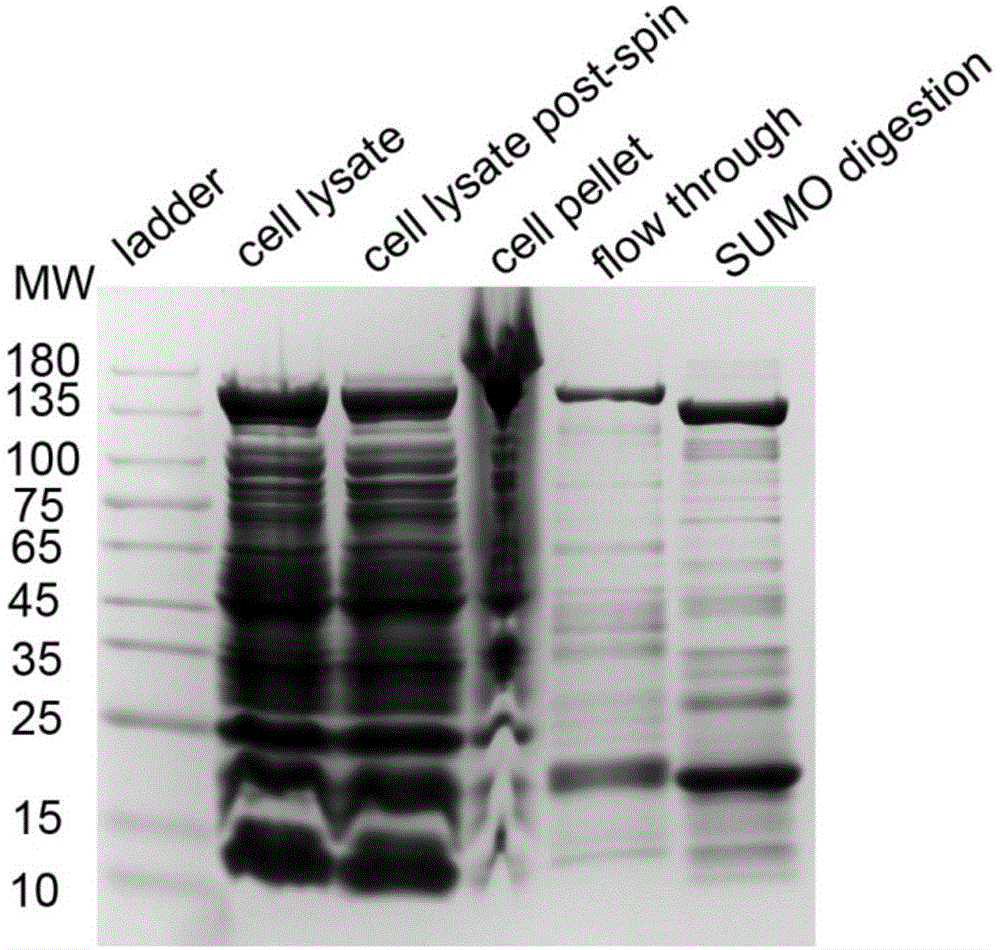
图1利用sds–page分析纯化lwcas13a蛋白各个过程中的蛋白产物;ladder:蛋白分子量maker,celllysate:细胞裂解液,celllysatepost-spin:离心后的细胞裂解液,cellpellet:细胞沉淀,flowthrough:流出液,sumodigestion:sumo酶消化后的蛋白产物。
图2对纯化的lwcas13a蛋白终产物进行sds-page分析;ladder:蛋白分子量maker,purifiedlwcas13a:纯化的lwcas13a。
图3利用分子筛检测通过蛋白纯化获得的lwcas13a蛋白;finalsecelutionoflwcas13a:分子筛纯化后获得的lwcas13a蛋白终产物。
图4筛选eb病毒dna检测前向rpa引物(n=3个技术重复;bar表示平均值±sd)。
图5筛选用于eb病毒dna检测的反向rpa引物(n=3个技术重复;bar表示平均值±sd)。
图6lwcas13蛋白与不同输入eb病毒dna拷贝孵育后产生的sherlock动力学曲线(n=3个技术拷贝;条代表平均值±sd)。
图7lwcas13蛋白与不同输入eb病毒dna拷贝孵育后产生的sherlock标准曲线。
图8用qpcr测定的血浆eb病毒dna浓度与用sherlock技术测定的血浆eb病毒dna浓度之间的相关性。
具体实施方式
下面结合具体实施例对本发明作进一步的说明。
实施例1lwcas13a蛋白表达和纯化
将细菌表达载体转化到rosettatm2(de3)plysssingles感受态细胞(millipore)。在terrificbroth4生长培养基(12g/l胰蛋白胨,24g/l酵母提取物,9.4g/lk2hpo,2.2g/lkh2po4,sigma)(tb)中将16ml起始培养物培养过夜,再将其接种4l的tb中在37℃和300rpm下生长至od600值达到0.5。此时,通过向iptg(sigma)补充iptg诱导蛋白质最终表达浓度为500μm,并将细胞冷却至18℃16小时以进行蛋白质表达。然后将细胞在4℃以5200g离心15分钟。收集细胞沉淀并储存在-80℃用于下一步纯化。
蛋白质纯化的所有后续步骤在4℃下进行。细胞沉淀被粉碎并重悬于裂解缓冲液(20mmtris-hcl,500mmnacl,1mmdtt,ph8.0),补充蛋白酶抑制剂(completeultraedta-free片剂)和溶菌酶(500μg/1ml),然后经benzonase酶切后使用lm20microfluidizer系统在27,000psi条件下进行高压细胞破碎。通过在4℃以10,000g离心1小时清除裂解物,上清液通过stericup0.22μm过滤器(emdmillipore)过滤。过滤后上清液通过streptactinsepharose(ge)并旋转温育1小时,然后用裂解缓冲液洗涤streptactin树脂三次。树脂用sumo消化缓冲液(30mmtris-hcl,500mmnacl,1mmdtt,0.15%igepal(np-40),ph8.0)加上250单位的sumo蛋白酶(thermofisher)重悬,并在4℃旋转过夜温育。将悬浮液加到柱上以通过重力流动使其从树脂中洗脱和分离。用1倍柱体积的裂解缓冲液洗涤树脂两次以最大程度洗脱蛋白质。用阳离子交换缓冲液(20mmhepes,1mmdtt,5%甘油,ph7.0)稀释洗脱healthcarelifesciences),并用盐梯度为250mm至2mnacl的洗脱缓冲液(20mmtris-hcl,1mmdtt,5%甘油,ph7.0)洗脱。
洗脱部分通过sds-page检测lwcas13a的存在(见图1),并且将含有蛋白质的洗脱成分合并,并用s200缓冲液(10mmhepes,1mnacl,5mmmgcl2,2mmdtt,ph7.0)通过离心过滤器浓缩至1ml。将浓缩的蛋白通过fplc上样到凝胶过滤柱(
实施例2引物的设计
前向引物和反向引物设计
通过测试多对引物,筛选出来的效果最好的引物。先筛选重组酶聚合酶扩增技术(rpa)的正向引物(见图4),发现前向引物中f5效果最好;再用前向引物f5,筛选重组酶聚合酶扩增技术(rpa)反向引物(见图5),发现f5和r3的引物组合效果最好。
正向引物f5:
5’-aattctaatacgactcactataggcctaagaaggcaccggtcgcccagtcctacc-3’(seqidno:1),
反向引物r3:
5’-tgaaccgcttaccacctcctcttcttgctgga-3’(seqidno:2)。
crrna的设计
crrna序列为:
5’-ggggauuuagacuaccccaaaaacgaaggggacuaaaacucuacggacucgucuggguucuuggccc-3’(seqidno:3)。
crrna制备
对eb病毒dna标准品和待测血浆模板使用hiscribet7quickhighyieldrna合成试剂盒(newenglandbiolabs)在30℃下与t7聚合酶一起温育过夜,所得rna用megacleartranscriptionclean-upkit(thermofisher)进行纯化。为了制备crrna,构建体被命名为带有附加的t7启动子序列dna(integrateddnatechnologies)。将crrnadna退火至短t7引物(最终浓度10μm),使用hiscribet7quickhighyieldrna合成试剂盒(newenglandbiolabs),与t7聚合酶在37℃下孵育过夜。使用2倍比例于反应体积的纯化rnaxp清洁珠(beckmancoulter)加上额外1.8倍的异丙醇(sigma)进行crrna纯化。
实施例3一种用crrna进行eb病毒dna的定量检测方法
(1)提取待测患者的血浆,分离血浆总游离细胞dna,得模板;
(2)将所得模板dna在反应体系进行相应的反应程序,先利用重组酶聚合酶扩增技术和seqidno:1~2所述引物对在25~37℃条件下对模板dna进行扩增反应,然后在25~37℃度条件下对扩增产物进行转录得到对应rna,并使用seqidno:3所述的crrna、lwcas13a在25~37℃条件下对转录产物进行荧光信号检测,所述荧光信号检测程序为:在荧光读板仪(biotek)中于25~37℃条件反应2-3小时,每5分钟测量一次荧光信号。上述所有反应均可整合到同一反应体系中同时进行,可以不分步进行,反应条件是25~37℃,无需进行温度变化。
所述同一反应体系为每100μl单一反应体系中包括:
0.48μmseqidno:1所示正向引物;
0.48μmseqidno:2所示反向引物;
1xrpa再水合缓冲液;
模板dna;
45nmlwcas13a蛋白;
22.5nmseqidno:3所示crrna;
125nm底物报告rna(rnasealertv2,invitrogen);
2.5μl鼠rna酶抑制剂(newenglandbiolabs);
2mmatp;
2mmgtp;
2mmutp;
2mmctp;
1μlt7聚合酶混合物(newenglandbiolabs);
5mmmgcl2;
14mmmgac。
(3)根据荧光信号值对待测血浆中eb病毒dna进行定量检测。根据标准品在特定时间点的荧光强度绘制扩增曲线与标准曲线,计算各样品的eb病毒dna定量结果。
实施例4临床血浆样品eb病毒dna的定量检测
(1)临床血浆样本
本研究的98例临床血浆样本来自中山大学肿瘤防治中心。这项研究得到了中山大学癌症中心伦理委员会的批准。
(2)血浆dna的提取
使用qiaamp血液迷你试剂盒(qiagen,inc.,valencia,ca,usa)分离血浆总游离细胞dna
(3)运用qpcr对血浆eb病毒dna进行定量检测
qpcr所用正向引物f:5′-agtctctgcctcagggca-3′(seqidno:4),反向引物r:5′-acagagggcctgtccaccg-3′(seqidno:5),探针t:5′-[fam]cactgtctgtaaagtccagcctcc[tamra]-3′(seqidno:6)。
实验仪器:rochelightcycler480。
正式实验体系配制:
模板dna4ul
2xsybrgreenpcrmastermix5ul(roche)(使用前需振荡均匀,含探针)
正向引物f0.5ul(10um)
反向引物r0.5ul(10um)
总体积10ul
计算好实验中需用多少份体系,则按具体量配置。体系分装会有损失,一般多配0.5份--1份体系。
总的体系配好后,在振荡器中振荡均匀或用枪吸打均匀,然后将样品点到96孔板中,每孔10微升。在bio-rad荧光定量pcr仪上测量荧光强度。通过标准品ct值绘制标准曲线,再利用各样品的ct值得到对应定量结果。
(4)运用本发明方法对临床血浆样品eb病毒dna的定量检测
运用crispr-cas13对血浆eb病毒dna进行定量检测:100μl单一反应体系测定包括0.48μm正向引物,0.48μm反向引物,1xrpa再水合缓冲液,不等量的dna输入,45nmlwcas13a,22.5nmcrrna,125nm底物报告rna(rnasealertv2),2.5μl鼠rna酶抑制剂(newenglandbiolabs),2mmatp,2mmgtp,2mmutp,2mmctp,1μlt7聚合酶混合物(newenglandbiolabs),5mmmgcl2和14mmmgac。反应在荧光读板仪(biotek)上(除非另有说明)37℃进行1-3小时,每5分钟测量一次荧光信号。根据标准品在特定时间点的荧光强度绘制扩增曲线与标准曲线(见图6和图7),计算各样品的eb病毒dna定量结果。
(5)与qpcr法的结果进行比较
将常规使用的高灵敏度qpcr技术作为金标准。利用sherlock技术,检测48例eb病毒dna阳性临床血浆样本,可以检测出其中46例阳性,灵敏度为96%。利用sherlock技术,检测50例eb病毒dna阴性临床血浆样本,可以检测出其中0例阳性,特异度为100%。sherlock技术获得的eb病毒dna检测结果与qpcr法获得的eb病毒dna检测结果显著相关(见图8)。
综上所述,采用本发明方法可在不依赖实时荧光定量pcr(qpcr)仪等复杂仪器情况下检测eb病毒dna,获得的结果与qpcr法检测结果基本一致(临床血浆样本量98例,灵敏度96%,特异度100%)。
实施例5一种用crrna检测血浆eb病毒dna的方法,
(1)提取待测患者的血浆,分离血浆总游离细胞dna,得模板;
(2)使用引物对f5和r3作为扩增引物,利用重组酶聚合酶扩增技术扩增血浆游离dna;
(3)对扩增产物进行转录得到对应rna;
(4)使用实施例2中所述的crrna、lwcas13a蛋白和rna荧光探针(rnarnasealertv2)对转录产物rna进行荧光信号检测;
(5)根据荧光信号值对待测血浆中eb病毒dna进行定量检测。
上述方法中,重组酶聚合酶扩增血浆游离dna、扩增产物的转录和crispr-cas13系统对报告rna的附带剪切可在室温坏境中在单一反应体系下同时进行。
患者血浆样品是鼻咽癌患者血浆样品。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
sequencelisting
<110>中山大学
<120>用于eb病毒dna检测的引物和crrna及其应用
<130>
<160>6
<170>patentinversion3.5
<210>1
<211>55
<212>dna
<213>人工序列
<400>1
aattctaatacgactcactataggcctaagaaggcaccggtcgcccagtcctacc55
<210>2
<211>32
<212>dna
<213>人工序列
<400>2
tgaaccgcttaccacctcctcttcttgctgga32
<210>3
<211>67
<212>rna
<213>人工序列
<400>3
ggggauuuagacuaccccaaaaacgaaggggacuaaaacucuacggacucgucuggguuc60
uuggccc67
<210>4
<211>18
<212>dna
<213>人工序列
<400>4
agtctctgcctcagggca18
<210>5
<211>19
<212>dna
<213>人工序列
<400>5
acagagggcctgtccaccg19
<210>6
<211>24
<212>dna
<213>人工序列
<400>6
cactgtctgtaaagtccagcctcc24
- 还没有人留言评论。精彩留言会获得点赞!