一种多西他赛衍生物及其制备方法和应用与流程
本发明涉及一种新的抗癌药物化合物及其制备方法和应用,特别是涉及一种多西他赛衍生物,以及该化合物的制备方法以及作为抗癌药物的应用。
背景技术:
多西他赛(docetaxel,式1)又名多烯紫杉醇,是一种亲脂性的紫杉烷类抗肿瘤药物,属于细胞抑止剂类药物,通过加强微管蛋白聚合作用和抑制微管解聚作用,形成稳定的非功能性微管束,从而破坏肿瘤细胞的有丝分裂达到抗肿瘤的效果。多西他赛细胞内浓度比紫杉醇高3倍,在细胞内滞留时间长,因此比紫杉醇具有更强的抗肿瘤活性。临床主要用于治疗主要治疗晚期乳腺癌、卵巢癌、非小细胞肺癌,头颈部癌、小细胞肺癌;对胃癌、胰腺癌、黑色素瘤等也有一定疗效。
多西他赛抗肿瘤活性高,安全性及耐受性较好,自上市以来其临床应用日趋广泛,但与其他抗肿瘤药物一样,它对肿瘤细胞和正常细胞没有选择性识别作用,使得其副作用表现也尤为凸显,关于其不良反应的报道也逐渐增加,目前发现的主要不良反应有体液潴留,皮肤毒性如全身红斑、瘙痒和皮疹,严重虚弱和麻痹;血液学毒性包括白细胞减少症、中性粒细胞减少症和热性中性粒细胞减少症;非血液毒性有脱发、感觉和运动神经毒性,口炎、虚弱以及恶心、呕吐、腹泻等消化系统反应。
为了降低多西他赛的毒副作用,扩大其临床应用范围,国内外诸多药物研究者致力于多西他赛新剂型的研发。多西他赛不溶于水,导致其临床剂型的载药量小,从而限制了它的给药剂量,影响了临床疗效;其口服生物利用度差,低于8%。目前,多西他赛的上市剂型为多西他赛注射液,该制剂中使用tween80为溶剂,有一定的毒副作用,且多西他赛在含水溶液中易发生降解、不易保存。
为解决以上弊端,很多研究者致力于新型给药系统的研究与开发。如①脂质体剂型,采用薄膜超声法制备多西他赛纳米脂质载体,能够达到粒径小、药物包封率高且控释的目的;②由亲水性物质聚乙二醇修饰的载体材料包载多西他赛制备而成长循环制剂,能在体内逃脱肝脾网状内皮系统的吞噬,延长其在血液中的循环时间;③将大豆油和三酰甘油作为油相,泊洛沙姆188和大豆磷脂为乳化剂制备可注射的多西他赛微乳,该微乳稳定性较好,且载药量的增加不影响粒径大小以及药物包封率;④胶束制剂,常用的装载多西他赛的胶束载体有聚乙二醇-聚乳酸嵌段共聚物、聚乙烯吡咯酮-外消旋聚乳酸嵌段共聚物等,还有ph敏感嵌段共聚物胶束以及热敏感聚合物胶束;⑤多西他赛主动靶向纳米给药系统的研究。这些新剂型都围绕多西他赛水溶性、降低毒副作用、提高药物的生物利用率,并取得了很大的进展,不仅为提高多西他赛水溶性、降低毒副作用、提高药物的生物利用率提供了可能,也为癌症患者提供了更安全用药的希望。但各种给药系统或多或少存在缺陷,如包封率低、药物渗漏和稳定性等问题有待进一步解决。
技术实现要素:
本发明的目的在于提供一种新的多西他赛衍生物,所述的衍生物是一类新的抗癌化合物,不仅抗肿瘤活性高、毒副作用低,而且易于制成乳剂、脂质体剂和胶束剂等。
本发明的另一目的在于提供所述的多西他赛衍生物的合成方法。
本发明的另一目的还在于提供所述的多西他赛衍生物的制剂,包括脂质体、乳剂和胶束剂等。
同时,本发明的另一目的还在于提供所述的多西他赛衍生物在制备抗癌药物中的应用。
本发明的多西他赛衍生物是由对-[双(2-氯乙基)氨基]苯烷基醇或对-[双(2-氯乙基)氨基]苯酚或对-[双(2-氯乙基)氨基]苯烷基胺或对-[双(2-氯乙基)氨基]苯胺通过连接分子与抗癌药物化合物多西他赛(docetaxel)以酯键共价结合形成本发明的抗癌药物化合物。
实现本发明目的采用以下技术方案:一种多西他赛衍生物,其分子式可以用以下通式i表示:
其中n=0-10的整数,x为o或nh;
r是链接基团,为下述基团之一:
a)-(c=o)-;
b)-p(=o)(r’)-,其中r’是c1-c6烷基、c1-c6烷氧基或芳基;
c)-(c=o)(ch2)m(c=o)-,其中m=1-10的整数;
d)-(c=o)ch2-o-ch2(c=o)-;
e)-(ch2)m(c=o)-,其中m=1-10的整数。
本发明将具有抗癌活性的药物化合物分子多西他赛与对-[双(2-氯乙基)氨基]苯烷基醇或对-[双(2-氯乙基)氨基]苯酚或对-[双(2-氯乙基)氨基]苯烷基胺或对-[双(2-氯乙基)氨基]苯胺通过连接基团共价结合,得到的多西他赛衍生物具有较高的抗癌活性和较低的毒副作用。所述的连接基团是由含两个或两个以上活性基团的连接分子所提供,例如:乙二酰氯(o=ccl2)提供羰基-(c=o)-,磷酰二氯酯(o=por’cl2)提供-p(=o)(or’)-基团,卤代羧酸或卤代羧酸酯提供亚烷基羰基(-(ch2)nco-),不同的二元羧酸(ch2)n(cooh)2或环状酸酐
本发明还涉及一种所述的多西他赛衍生物的制备方法,包括以下步骤:
1)对-[双(2-氯乙基)氨基]苯烷基醇或对-[双(2-氯乙基)氨基]苯酚与连接分子发生酯化或醚化反应,生成对-[双(2-氯乙基)氨基]苯烷基醇或对-[双(2-氯乙基)氨基]苯酚的衍生物;或者对-[双(2-氯乙基)氨基]苯烷基胺或对-[双(2-氯乙基)氨基]苯胺与连接分子发生酰胺化反应,生成对-[双(2-氯乙基)氨基]苯烷基胺或对-[双(2-氯乙基)氨基]苯胺的衍生物;
2)步骤1)所得到的对-[双(2-氯乙基)氨基]苯烷基醇或对-[双(2-氯乙基)氨基]苯酚的衍生物,或对-[双(2-氯乙基)氨基]苯烷基胺或对-[双(2-氯乙基)氨基]苯胺的衍生物,或者它们的酰氯化产物,在催化剂作用下与多西他赛发生酯化反应,生成所述的多西他赛衍生物i。
更具体和优化地,所述的方法包括以下步骤:
1)对-[双(2-氯乙基)氨基]苯烷基醇或对-[双(2-氯乙基)氨基]苯酚的羟基与连接分子发生酯化或醚化反应,生成对-[双(2-氯乙基)氨基]苯烷基酯或醚,或对-[双(2-氯乙基)氨基]苯酯或醚衍生物;或者对-[双(2-氯乙基)氨基]苯烷基胺或对-[双(2-氯乙基)氨基]苯胺的氨基与连接分子发生酰胺化反应,生成对-[双(2-氯乙基)氨基]苯烷基酰胺或对-[双(2-氯乙基)氨基]苯酰胺衍生物;所产生的衍生物含有羧基、酰氯或磷酰氯基团;
2)步骤1)中所得到含有羧基的对-[双(2-氯乙基)氨基]苯烷基酯、醚或酰胺衍生物,或对-[双(2-氯乙基)氨基]苯基酯、醚或酰胺衍生物与酰氯化试剂(优选二氯亚砜)反应生成酰氯化产物;
3)步骤2)所得到酰氯化产物或步骤1)中所得到的磷酰氯化合物,以碱为催化剂,与多西他赛发生酯化反应生成所述的多西他赛衍生物i;或者
步骤1)中所得到含有羧基的对-[双(2-氯乙基)氨基]苯烷基酯、醚或酰胺衍生物,或对-[双(2-氯乙基)氨基]苯基酯、醚或酰胺衍生物以4-二甲氨基吡啶和2-氯-1-甲基吡啶鎓碘化物,或n,n′-二环己基碳化二亚胺和4-二甲氨基吡啶为催化剂,直接与多西他赛发生酯化反应,生成所述的多西他赛衍生物i。
上述方法中,所述的连接分子为含有两个以上活性基团的下列分子之一:
(1)乙二酰氯o=ccl2;
(2)磷酰二氯烷基酯、烷氧基酯或芳基酯o=por’cl2,其中r’是c1-c6烷基、c1-c6烷氧基或芳基;
(3)二元羧酸(ch2)n(cooh)2或环状酸酐
(4)二甘醇酸或二甘醇酸酐;
(5)卤代羧酸或卤代羧酸酯z-(ch2)ncoor’,其中n=1-10的整数,z为cl、br或i,r’为烷基。
所述的多西他赛衍生物i制备方法中,步骤3)所述的碱催化剂选自三乙胺、吡啶、4-二甲氨基吡啶、碳酸钠、碳酸钾或碳酸铯等。
例如:以4-{对-[双(2-氯乙基)氨基]苯}丁醇(1)为原料合成所述的多西他赛衍生物i,合成方法包括以下步骤(如式2所示):
1)以2-乙基己酸锡(ii)或其他路易士酸或碳酸铯为催化剂,4-{对-[双(2-氯乙基)氨基]苯}丁醇(1)与二甘醇酸酐或环酸酐(如:丁二酸酐、戊二酸酐、己二酸酐等)反应,或者以4-二甲氨基吡啶和2-氯-1-甲基吡啶鎓碘化物,或n,n′-二环己基碳化二亚胺和4-二甲氨基吡啶为催化剂,与过量的二甘醇酸或二元羧酸(如:丁二酸、戊二酸、己二酸等)反应,生成二元羧酸4-{对-[双(2-氯乙基)氨基]苯}丁醇单酯(2);
2)二元羧酸4-{对-[双(2-氯乙基)氨基]苯}丁醇单酯(2)与二氯亚砜反应生成酰氯化产物(3);
3)以碱为催化剂,酰氯化产物(3)与多西他赛反应,生成多西他赛衍生物i;或以4-二甲氨基吡啶(dmap)和2-氯-1-甲基吡啶鎓碘化物(cmpi)为催化剂,或以n,n′-二环己基碳化二亚胺(dcc)和4-二甲氨基吡啶(dmap)为催化剂,二元羧酸4-{对-[双(2-氯乙基)氨基]苯}丁醇单酯(2)与多西他赛反应,生成多西他赛衍生物i。
本领域技术人员不难理解,对-[双(2-氯乙基)氨基]苯烷基醇或对-[双(2-氯乙基)氨基]苯酚与其他连接分子的反应,可以在现有技术条件下实现,比如,以碱(如三乙胺,吡啶,碳酸钠,碳酸钾,碳酸铯)为催化剂,与卤代羧酸反应,或与卤代羧酸酯反应后产物脱烷基后生成羧酸;或者以碱(如三乙胺,吡啶,碳酸钠,碳酸钾,碳酸铯)为催化剂,与烷基膦酰二氯、烷氧基膦酰二氯或芳基膦酰二氯反应,生成含有磷酰氯基团的衍生物;以碱(如三乙胺或吡啶)为催化剂,与乙二酰氯反应,生成含有酰氯基团的衍生物。
对-[双(2-氯乙基)氨基]苯烷基胺或对-[双(2-氯乙基)氨基]苯胺与连接分子的酰胺化反应或取代胺基的反应与上述酯化或醚化反应在基本相同的条件下进行。
本发明还涉及所述的多西他赛衍生物作为抗癌药物化合物的制剂,包括脂质体剂、乳剂、胶束剂等,其中包含所述的多西他赛衍生物i。脂质体剂包括新发明的抗癌药物化合物、磷脂(最具有代表性的是卵磷脂、磷脂酰胆碱)、胆固醇或维生素e或维生素e醋酸酯、水相。乳剂包括新发明的抗癌药物化合物、一种或多种表面活性剂、油相(亲脂性介质)和水相。乳剂可以是水包油型或油包水型。胶束剂包括新发明的抗癌药物化合物、助溶剂和一种或多种表面活性剂和水相。
所述的多西他赛衍生物抗癌药物化合物的脂质体制剂,其成分包含:
1)具有式ⅰ结构的多西他赛衍生物;
2)磷脂(卵磷脂、磷脂酰胆碱或大豆磷脂);
3)胆固醇、维生素e或维生素e乙酸酯;
4)水相。
所述的多西他赛衍生物抗癌药物化合物的乳剂,其成分包含:
1)油相,包括:
a)具有式ⅰ结构的多西他赛衍生物;
b)生物相容的亲脂性介质;
2)表面活性剂和助溶剂;
3)水相。
所述的多西他赛衍生物抗癌药物化合物的胶束剂,其成分包含:
1)具有式ⅰ结构的多西他赛衍生物;
2)表面活性剂;
3)助溶剂;
4)水相。
上述制剂中,水相包括但不限于去离子水、生理盐水(0.9%氯化钠)、葡萄糖(5%)溶液、蔗糖溶液等。
上述制剂中,具有代表性的生物相容的亲脂性介质包括:
a)脂溶性的维生素e及衍生物。维生素e是指以天然或人工合成的维生素e系列,它们通常称为生育酚和生育三烯酚(tocopherols和tocotrienols),生育酚包括α-生育酚(d型、dl型、l型)、β-生育酚(d型、dl型、l型)、γ-生育酚(d型、dl型、l型)和δ-生育酚(d型、dl型、l型)。生育三烯酚在结构上与生育酚相似,但生育三烯酚在碳-2的侧链植基(phytyl)上有三个双键。生育三烯酚包括α-生育三烯酚(d型、dl型、l型)、β-生育三烯酚(d型、dl型、l型)、γ-生育三烯酚(d型、dl型、l型)和δ-生育三烯酚(d型、dl型、l型)。维生素e衍生物包括所有生育酚和生育三烯酚的衍生物,如维生素e琥珀酸酯,维生素e醋酸酯等。
b)可作为亲脂性介质的油脂,包括不同链长的脂肪酸及酯,它们大多是直链的,但也可以是支链的,例如癸酸、辛酸、己酸、月桂酸、肉豆蔻、硬脂酸、油酸、亚油酸、以及其它饱和或不饱和脂肪酸及酯类。
c)脂肪酸与甘油酯化反应所形成的甘油单酯、甘油二酯或甘油三酯,无论它们是合成的还是天然的,都可作为亲脂性介质,例如,甘油酯,如豆油,棉籽油,菜籽油,鱼油,乙酰化单甘酯,甘油单油酸酯,三醋酸甘油酯,和双乙酰酒石酸酯,单甘酯,蓖麻油等。
d)脂肪醇,如苄醇、硬脂醇、月桂醇等,或是它们的酯或醚,如苯甲酸苄酯。
上述制剂中,具有代表性的表面活性剂包括:
a)聚乙二醇表面活性剂,如聚氧乙烯蓖麻油el(cremophorel)、吐温系列表面活性剂。
b)磷脂表面活性剂(phospholipids),如卵磷脂(lecithin)、聚乙二醇磷脂(pegylatedphospholipids)。
c)聚乙二醇维生素e衍生物,如维生素e琥珀酸酯聚乙二醇(d-α-tocopherolpolyethyleneglycol1000succinate,tpgs)。
d)聚氧乙烯聚氧丙烯嵌段共聚物:poloxamers或pluronics的嵌段共聚物(h(och2ch2)a(oc3h6)b(och2ch2)aoh)。
上述制剂中,具有代表性的溶剂包括:
乙醇、聚乙二醇、丙二醇、甘油、n-甲基吡咯烷酮等。聚乙二醇(peg)是亲水性的,重复单元的化学结构组成为-ch2ch2o-,通式为h-(ch2ch2)n-oh,分子量范围一般从200至10000。例如,聚乙二醇200、聚乙二醇300、聚乙二醇400等。
上述各种制剂其配方中都包含有效治疗量的本发明的多西他赛衍生物抗肿瘤药物化合物及可选的辅料。
本发明还提供了新发明的多西他赛衍生物抗癌药物化合物在制备抗癌药物中的应用。本发明所述的多西他赛衍生物作为抗癌药物化合物用于治疗癌症,包括但不限于①血液系统的癌症,如白血病、淋巴瘤、骨髓瘤;②非血液癌症,如实体瘤癌(如乳腺癌、卵巢癌、胰腺癌、结肠癌、直肠癌、非小细胞肺癌、膀胱癌、胃癌、肝癌等)、肉瘤、皮肤癌和胶质瘤等。
本发明的多西他赛衍生物抗癌药物化合物的疗效和毒性用体外细胞或体内动物实验来确定,例如ed50(50%effectivedose,半数有效量:50%实验对象出现阳性反应时的药量)、ld50(50%lethaldose,半数致死量:杀死一半试验对象的剂量)和gi50(concentrationoftheanti-cancerdrugthatinhibitsthegrowthofcancercellsby50%,抑制50%的实验对象生长的药物浓度)。通常将半数致死量(ld50)/半数有效量(ed50)的比值称为治疗指数,用以表示药物的安全性。治疗指数大的药物相对治疗指数小的药物更安全。
新发明的多西他赛衍生物抗癌药物化合物旨在提高治疗指数和药物的安全性,同时也提高治疗效果。从体外细胞实验和体内动物实验获得的药物剂量可以用来制定用于人体的剂量范围。这种化合物的剂量最好在很少或根本没有毒性的ed50范围内。剂量变化通常取决于采用的剂型、病人的敏感性和给药途径等。通常可用相同或类似药物,如
本发明的多西他赛衍生物抗癌药物化合物可以单独使用,也可与一个或多个其它的治疗药物一起使用。例如,在癌症的治疗时,本发明的药物化合物可与以下治疗药物一起使用,包括但不限于:雄激素抑制剂,如氟他胺(flutamide)和鲁珀若利得(luprolide);抗雌激素,如他莫昔芬(tomoxifen);抗代谢药物和细胞毒性药物,如道诺红菌素(daunorubicin)、五氟脲嘧啶(fluorouracil)、氟尿苷(floxuridine)、α-干扰素(interferonalpha)、甲氨蝶呤(methotrexate)、光神霉素(plicamycin)、硫基嘌呤(mecaptopurine)、硫鸟嘌呤(thioguanine)、阿霉素(adriamycin)、卡莫司汀(carmustine)、洛莫司汀(lomustine)、阿糖胞苷(cytarabine)、环磷酰胺(cyclophosphamide)、阿霉素(doxorubicin)、雌莫司汀(estramustine)、六甲蜜胺(altretamine)、羟基脲(hydroxyurea)、异环磷酰胺(ifosfamide)、甲基苄肼(procarbazine)、突变霉素(mutamycin)、白消安(busulfan)、米托蒽醌(mitoxantrone)、卡铂carboplatin)、顺铂(cisplatin)、链脲佐菌素(streptozocin)、博莱霉素(bleomycin)、放线菌素(dactinomycin)、和依达比星(idamycin);激素,如甲孕酮(medroxyprogesterone)、炔雌二醇(ethinylestradiol)、雌二醇(estradiol,)、.亮丙瑞林(leuprolide)、甲地孕酮(megestrol)、奥曲肽(octreotide)、己烯雌酚(diethylstilbestrol)、氯烯雌醚(chlorotrianisene)、足叶乙甙(etoposide)、鬼臼毒素(podophyllotoxin)和戈舍瑞林(goserelin);氮芥衍生物,如苯丙酸氮芥(melphalan)、苯丁酸氮芥(chlorambucil)和塞替派(thiotepa);类固醇,如倍他米松(betamethasone);和其他抗肿瘤药物,如活牛分枝杆菌(livemycobacteriumbovis)、达卡巴嗪(dicarbazine)、天冬酰胺酶(asparaginase)、甲酰四氢叶酸(leucovorin)、米托坦(mitotane)、长春新碱(vincristine)、和长春碱(vinblastine)等。
有益效果:本发明将具有抗癌活性的药物化合物分子多西他赛与4-[双(2-氯乙基)氨基]苯丁醇通过连接基团共价结合,得到多西他赛衍生物抗癌药物化合物。本发明的新的抗癌药物化合物具有较高的抗癌活性和较低的毒副作用。所述的药物化合物可以制成注射剂,广泛应用于血液系统和非血液系统癌症的治疗,为多西他赛的临床应用提供了一种新的方法和途径。
下面结合具体实施例对本发明进行详细描述。本发明的保护范围并不以具体实施方式为限,而是由权利要求加以限定。
附图说明
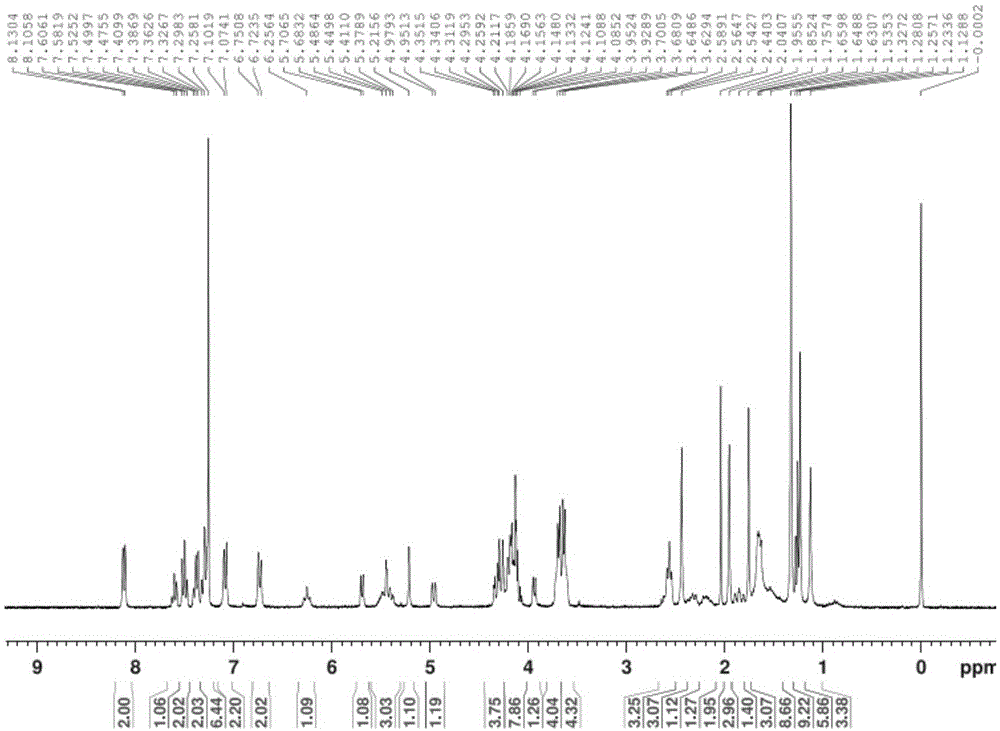
图1多西他赛衍生物抗癌药物化合物:(4-{对-[双(2-氯乙基)氨基]苯}丁醇多西他赛-2’-二甘醇酸酯)的核磁共振氢谱图。
图2多西他赛衍生物抗癌药物化合物:(4-{对-[双(2-氯乙基)氨基]苯}丁醇多西他赛-2’-二甘醇酸酯)的质谱图。
具体实施方式
下面的实施例用来说明本发明的多西他赛衍生物的合成、制剂、体内药效学等。实施例中,申请人以(4-[双(2-氯乙基)氨基]苯丁醇多西他赛-2’-二甘醇酸酯为例进行详细描述,对于本发明范围内的其它多西他赛衍生物可以采用相同或相似方法合成,并经验证具有相同或相似的结果。所述的实施例有助于对本发明的理解和实施,并不构成对于本发明的限制。
实施例1.4{对-[双(2-氯乙基)氨基]苯}丁醇多西他赛-2’-二甘醇酸酯(yy-015)的合成
所述多西他赛衍生物的合成包括以下步骤:
1)4-{对-[双(2-氯乙基)氨基]苯}丁醇的合成
反应式如下式所示:
实验步骤:
苯丁酸氮芥(608.4mg,2.0mmol)溶于20ml的四氢呋喃中,0℃下搅拌,硼烷甲硫醚(1.2ml,2.4mmol,2.0m四氢呋喃溶液)慢慢滴加到上述溶液中,继续在0℃下搅拌4小时,向反应液中加入1ml甲醇,再加入20ml的乙酸乙酯,搅拌,反应液用1n的碳酸氢钠溶液洗涤三次(20ml×3)。合并有机相,用无水硫酸钠干燥,浓缩,硅胶柱层分离,得0.501g产物,收率86%。
2)二甘醇酸4-{对-[双(2-氯乙基)氨基]苯}丁醇单酯的合成
反应式如下式所示:
实验步骤:
方法一:在100ml圆底烧瓶中,加入0.697g(2.4mmol)干燥后的4-[双(2-氯乙基)氨基]苯丁醇、0.557g(4mmol)二甘醇酸酐和200mg2-乙基己酸锡,再加入30ml二甲苯,搅拌,氮气保护下加热回流至反应完成。用旋转蒸发仪除去反应液中的二甲苯后,加入20ml乙酸乙酯,搅拌,再加入10ml乙醚,析出白色固体,过虑除去固体物质,用旋转蒸发仪将虑液浓缩至10ml,柱层分离,得0.802g二甘醇酸4-{对-[双(2-氯乙基)氨基]苯}丁醇单酯,收率82.3%。
方法二:在100ml圆底烧瓶中,加入0.644g(4.8mmol)二甘醇酸、1.450g(12mmol)4-二甲氨基吡啶、1.530g(6mmol)2-氯-1-甲基吡啶鎓碘化物和30mln,n-二甲基乙酰胺,电磁搅拌,慢慢向反应液中滴加0.697g(2.4mmol)4-{对-[双(2-氯乙基)氨基]苯}丁醇和30mln,n-二甲基乙酰胺的溶液。在室温和氮气的保护下反应12h,用旋转蒸发仪将虑液浓缩至10ml,柱层分离,得0.619g二甘醇酸4-{对-[双(2-氯乙基)氨基]苯}丁醇单酯,收率65.1%。
3)4-{对-[双(2-氯乙基)氨基]苯}丁醇多西他赛-2’-二甘醇酸酯的合成
反应式如下式所示:
实验步骤:
在100ml圆底烧瓶中,将0.609g(1.50mmol)二甘醇酸4-{对-[双(2-氯乙基)氨基]苯}丁醇单酯溶解在30ml的无水甲苯中,加入550μl(7.45mmol)二氯亚砜,2滴dmf。电磁搅拌,在室温和氮气的保护下反应4h。减压蒸馏除去甲苯和过量的二氯亚砜,得到粘稠液体,加入10ml无水氯仿得溶液a。
在50ml的反应瓶中,将0.958g(1.18mmol)的多西他赛溶解在20ml的氯仿中,加入495.9μl(3.558mmol)干燥的三乙胺,冰盐浴冷却,搅拌,慢慢加入10ml溶液a,在室温和氮气的保护下反应4h。反应完毕后,减压蒸馏除去反应液中的氯仿,再向反应瓶中加入20ml的乙酸乙酯,搅拌,过滤除去白色固体,再将虑液浓缩至10ml。柱层分离,得0.932g4-{对-[双(2-氯乙基)氨基]苯}丁醇多西他赛-2’-二甘醇酸酯i,产率63.6%。
合成得到的化合物其核磁共振氢谱和质谱见图1和图2。
ms(positiveesi):m/z=1217.47,1195.49.
1hnmr(300mhz,cdcl3):δppm:8.1304~8.1058(d,2h,j=7.38hz),7.6311~7.5819(t,1h,j=7.38hz),7.5252~7.4755(t,2h,j=7.45hz),7.4099~7.3626(t,2h,j=7.10hz),7.3267~7.2581(m,3h),7.1019-7.0741(d,2h,j=8.34hz),6.7508~6.7235(d,2h,j=6.69hz),6.2842~6.2275(t,1h,j=8.50hz),5.7065~5.6832(d,1h,j=6.99hz),5.4864~5.3789(m,3h),5.2156(s,1h),4.9793~4.9513(d,1h,j=8.40hz),4.3515~4.0696(m,9h),3.9524~3.9289(d,1h,j=7.05hz),3.7005~3.6294(m,8h),2.6500~2.5427(m,3h),2.4403(s,3h),2.3800~2.2000(m,2h),1.9550(s,3h),1.9000~1.8100(m,1h),1.7574(s,3h),1.6598~1.5353(m,7h),1.3272(s,9h),1.2571(s,3h),1.1288(s,3h)。
实施例2.4-{对-[双(2-氯乙基)氨基]苯}丁醇多西他赛-2’-丁二酸酯(yy-019)的合成
所述多西他赛衍生物的合成包括以下步骤:
1)丁二酸4-{对-[双(2-氯乙基)氨基]苯}丁醇单酯的合成
反应式如下式所示:
实验步骤:
在100ml的圆底烧瓶中,加入1g(6.45mmol)4-[双(2-氯乙基)氨基]苯丁醇、0.587g(5.87mmol)的丁二酸酐、1.4g(3.45mmol)的辛酸亚锡和20ml的甲苯,搅拌,氮气保护下加热回流至反应完成。用旋转蒸发仪除去反应液中的甲苯后,柱层分离,得1.10g丁二酸4-{对-[双(2-氯乙基)氨基]苯}丁醇单酯,收率81.5%。
2)4-{对-[双(2-氯乙基)氨基]苯}丁醇多西他赛-2’-丁二酸酯的合成
反应式如下式所示:
实验步骤:
在100ml圆底烧瓶中,将1.1g(2.81mmol)丁二酸4-{对-[双(2-氯乙基)氨基]苯}丁醇单酯溶解在15ml的氯仿中,加入1ml(14mmol)二氯亚砜,2滴dmf。电磁搅拌,在室温和氮气的保护下反应4h。减压蒸馏除去氯仿和过量的二氯亚砜,得到粘稠液体,加入10ml无水氯仿得溶液a。
在50ml的反应瓶中,将0.950g(1.17mmol)的多西他赛溶解在30ml的氯仿中,加入410μl(3.558mmol)干燥的三乙胺,冰盐浴冷却,搅拌,慢慢加入10ml溶液a,在室温和氮气的保护下反应4h。反应完毕后,减压蒸馏除去反应液中的氯仿,再向反应瓶中加入20ml的乙酸乙酯,搅拌,过滤除去白色固体,再将虑液浓缩至10ml。柱层分离,得1.0g4-{对-[双(2-氯乙基)氨基]苯}丁醇多西他赛-2’-丁二酸酯i,产率47.6%。
实施例3多西他赛衍生物(yy-015)抗癌药物化合物的脂质体冻干粉制剂
称取多西他赛衍生物5g、磷脂70g、胆固醇5.5g,加入圆底烧瓶内,加入适量的氯仿溶解为透明液体,置50℃水浴减压干燥成膜,保温1.5h,加入适量5%蔗糖溶液溶解膜,用超声波仪超声粉碎、用高压均质机进行匀浆,再用0.22μm滤膜过滤,分装于安培瓶内,使每瓶内含有多西他赛衍生物10mg。进行冷冻干燥,通惰性气体封口,得白色固体状多西他赛衍生物脂质体制剂。
实施例4.多西他赛衍生物(yy-015)抗癌药物化合物的乳剂
本实施例中,每一组分在配方中的含量按重量百分比计算。配方中的药物化合物可以本发明的其它抗癌药物化合物(如yy-019)替换。
乳剂一:将多西他赛衍生物溶解于豆油、d-α-生育酚聚乙二醇1000琥珀酸酯(tpgs)和聚乙二醇peg(200)的混合物中,再加入去离子水(diwater),然后搅拌、超声、均质乳化,所生产的乳液的组成如下:
制成的乳液药品通过一个孔径0.22微米的过滤器过滤,再封装于无菌的玻璃瓶。
乳剂二:将多西他赛衍生物溶解于d-α-生育酚乙酸酯、d-α-生育酚聚乙二醇1000琥珀酸酯(tpgs)和聚乙二醇peg(200)的混合物中,再加入去离子水(diwater),然后搅拌、超声、均质乳化,所生产的乳液的组成如下:
制成的乳液药品通过一个孔径0.22微米的过滤器过滤,再封装于无菌的玻璃瓶。
实施例5.多西他赛衍生物(yy-015)抗癌药物化合物的胶束剂
将适量的多西他赛衍生物溶解于吐温80(tween80)中得到透明的液体,再封装于无菌的玻璃瓶。
使用前加入适量生理盐水或5%葡萄糖注射液,摇动至形成透明液体,方可使用。所生产的胶束液的组成如下:
多西他赛衍生物2.5%
吐温805%
去离子水至100%
实施例6.多西他赛衍生物(yy-015)抗癌药物化合物脂质体粒径的测定
多西他赛衍生物抗癌药物化合物脂质体溶于水后形成的纳米颗粒的粒径采用美国brookhaven公司的zetaplus型激光散射粒度仪测量,测量方法为:称取脂质体冻干粉药品5mg和10mg,分别加入到2ml蒸馏水中,超声搅拌,使其充分溶解,静置10min,待气泡消失后将该液体加入到样品池(比色皿)中,注意加入样品过程中不能产生气泡,然后将比色皿放入样品池底座相应的凹槽内,开始测量,各样品分别平行测量三次取其平均值。
结果表明:当多西他赛衍生物抗癌药物化合物脂质体的水溶液浓度为2.5mg/ml和5mg/ml时,其平均粒径分别为100至200纳米之间。
实施例7.多西他赛衍生物抗癌药物化合物(实施例1的化合物yy-015)胶束及冻干粉对动物移植性肿瘤h22的抑制作用
1)药物配制方法:
yy-015胶束制剂配制方法:准确称量0.146g的yy-015粉末,加入1.168g的药用级吐温80,搅拌至溶解。每一次配药时,称取43.22mg的上述溶液,用3ml的0.9%氯化钠注射液振荡将其溶解(0.9%氯化钠注射液生产厂家:安徽双鹤药业有限责任公司;批号:1701206g;规格:100ml*0.9%),配制成1.48mg/ml的溶液,给药体积为0.2ml/20g,即为剂量14.8mg/kg。现用现配。
yy-015脂质体冻干粉剂:准确称取0.4585g的yy-015冻干粉(制剂代号:30),用3ml的0.9%氯化钠注射液振荡将其溶解(0.9%氯化钠注射液生产厂家:安徽双鹤药业有限责任公司;批号:1701206g;规格:100ml*0.9%),配制成1.48mg/ml的溶液,给药体积为0.2ml/20g,即为剂量14.8mg/kg。每次临用前新鲜配制。
多西他赛注射液配制方法:原多西他赛注射液每瓶规格为20mg/0.5ml(江苏恒瑞医药股份有限公司,批号:15011215),取上述规格的注射用多西他赛0.5ml加入多西他赛注射液溶剂1.5ml,浓度为10mg/ml,用生理盐水充分稀释成1mg/ml,给药体积为0.2ml/20g,即剂量为10mg/kg。
2)实验动物
icr小鼠,清洁级,南京市江宁区青龙山动物繁殖场提供,许可证号:scxk(苏)2017-0001;体重:18-22g;性别:雌。
3)实验动物分组
4)肿瘤株
h22最初由南京市凯基生物技术有限公司提供,培养后接种腹水,待腹水成熟之后抽取并冻存的细胞液,直接接种小鼠腹水,并在小鼠身上传4代后,再种鼠并给药(zmy005/p58,细胞代号:h22-x-17-12-27-f4)。
5)实验方法
取icr小鼠,按移植性肿瘤研究法,接种腹水瘤(在无菌操作下取腹水,pbs溶液按照1:2稀释,制备细胞悬液,容器置冰块上,用空针抽吸,每次抽吸前将细胞混匀,每只小鼠右前肢腋窝皮下接种0.2ml,接种后24小时称鼠重,并随机分为4组。各给药组于接种24小时后(d1)第一次给药。尾静脉注射方案给药,1次/2天,共给药4次。给药体积均为0.2ml/20g。于接种后第8天(d8)处死荷瘤小鼠称重,并分离瘤块称重,所得数据进行统计学处理(t检验)。
6)实验结论
结果表明,与模型对照组相比,yy-015胶束(14.8mg/kg)对h22肿瘤生长具有较显著的抑制作用,yy-015冻干粉(14.8mg/kg)及多西他赛(10mg/kg)组对h22肿瘤生长具有非常显著的抑制作用;给药后,yy-015冻干粉(14.8mg/kg)及多西他赛(10mg/kg)组对实验鼠体重有显著性影响,与此同时,yy-015胶束(14.8mg/kg)组对实验鼠体重有较显著性影响。
表1yy-015胶束及冻干粉对小鼠移植瘤h22抑制作用
实施例8.药物yy-015胶束及冻干粉对动物移植性肿瘤s180的抑制作用
1)药物配制方法:
14.8mg/kgyy-015胶束剂配制方法:准确称量16.19mg的yy-015粉末,加入399.87mg的药用级吐温(myy-015:mtween80=1:27),搅拌至溶解。每一次配药时,称取166.31mg的胶束,用4ml的0.9%氯化钠注射液振荡将其溶解(0.9%氯化钠注射液生产厂家:安徽双鹤药业有限责任公司;批号:1701209c格:100ml*0.9%),配制成1.48mg/ml的溶液,给药体积为0.2ml/20g,即为剂量14.8mg/kg。每次临用前新鲜配制。
14.8mg/kgyy-015脂质体冻干粉剂配制方法:准确称取0.4585g的yy-015冻干粉(制剂代号:30),用3ml的0.9%氯化钠注射液振荡将其溶解(0.9%氯化钠注射液生产厂家:安徽双鹤药业有限责任公司;批号:1701209c格:100ml*0.9%),配制成1.48mg/ml的溶液,给药体积为0.2ml/20g,即为剂量14.8mg/kg。每次临用前新鲜配制。
10mg/kg多西他赛注射液配制方法:准确称取10mg的多西他赛原料药,加入270mg干燥后的药用级吐温,搅拌至溶解,给药时先用13%乙醇溶液1ml振动溶解,再从取400μl溶液加入到3600μl的生理盐水稀释即可,配成浓度为1.0mg/ml的液体,给药体积为0.2ml/20g,即给药剂量为10mg/kg。(0.9%氯化钠注射液生产厂家:安徽双鹤药业有限责任公司;批号:1701209c格:100ml*0.9%)
2)实验动物
icr小鼠,清洁级(南京市江宁区青龙山动物繁殖场提供,许可证号:scxk(苏)2017-0001),体重:18-22g,性别:雌。
3)瘤株来源
s180最初由南京市凯基生物技术有限公司提供,培养后接种腹水,待腹水成熟之后抽取并冻存的细胞液,于2018-8-20号复苏1支,细胞培养三代后,于2018-9-16接种小鼠54只,并于24h后第一次给药(zmy005/p91-p96),细胞代号:s180-x-18-9-16-f4)。
4)实验动物分组
共设5组
5)实验方法
取icr小鼠,按移植性肿瘤研究法,接种腹水瘤(在无菌操作下取腹水,pbs溶液按照1:2稀释,制备细胞悬液,容器置冰块上,用空针抽吸,每次抽吸前将细胞混匀,每只小鼠右前肢腋窝皮下接种0.2ml,接种后24小时称鼠重,并随机分为5组。各给药组于接种24小时后(d1)第一次给药。尾静脉注射方案给药,1次/2天,共给药4次。给药体积均为0.2ml/20g。于接种后第9天(d9)处死荷瘤小鼠称重,并分离瘤块称重,所得数据进行统计学处理(t检验)。
6)实验结果:
结果表明,与模型对照组相比,yy-015胶束(14.8mg/kg)、yy-015冻干粉(14.8mg/kg)及多西他赛(10mg/kg)组对s180肿瘤生长具有非常显著的抑制作用;给药后,多西他赛(10mg/kg)组对实验鼠体重有非常显著性影响。
表2.yy-015胶束及冻干粉对小鼠移植瘤s180抑制作用
- 还没有人留言评论。精彩留言会获得点赞!