一种用于废弃胚胎囊胚发育的培养方法与流程
本发明属于微流控技术与生殖生物学的交叉领域,具体涉及一种用于废弃胚胎囊胚发育的培养方法。
背景技术:
人类胚胎干细胞(humanembryonicstemcell,hes)是由囊胚的内细胞团(innercellmass,icm)分离培养而来的,具有全能分化特性的细胞,具有自我更新和多向分化潜能,在细胞治疗、胚胎发育、药物筛选、基因治疗以及遗传、表观遗传机制研究等领域具有很需要意义。人类胚胎干细胞研究始于1998年,它已成为继人类基因组计划后生命科学中最活跃的研究领域。1998年,美国威斯康星大学thomson实验室利用36枚临床治疗不孕夫妇捐赠的新鲜或冷冻的囊胚,首次成功地分离、建立了5株hes细胞系(science,1998,282:1145-1147)。迄今国际上有美国、英国、新加坡、澳大利亚、瑞典、日本、中国、韩国等20余个实验室建有400株左右hes细胞,公开发表的有关hes细胞建系的论著有300多篇(stemcells,200624(10),2187-91),如何提高hes建系效率是生命科学研究领域的热点。
目前hes细胞的总体建系效率不高,只有5-15%,难以满足生物医学发展的需要。由于人类胚胎来源较为困难,获得更多hes细胞系的根本途径是改善培养体系,提高建系效率。目前hes细胞的建系基本路线仍然延续thomson的方法,即胚胎培养至囊胚后,去除透明带和滋养层细胞,分离icm,接种到饲养层上培养形成原代克隆,然后消化传代扩大培养,建立干细胞系,然后进行鉴定。在干细胞建系过程中,有很多因素影响建系效率,如囊胚质量、icm分离方法、传代方法等等。囊胚质量是影响建系效率的主要因素。新鲜的高质量囊胚能够获得优良的icm,这是建立hes细胞系的理想来源,然而由于社会伦理的限制,很难获得足够的新鲜囊胚。目前用于hes细胞研究的囊胚大部分来源于ivf中心废弃的胚胎。这些发育迟缓或形态较差的废弃胚胎,很少能够发育到囊胚期,即使形成囊胚,icm细胞数目也很少,给建系带来一定困难。
本发明结合单胚胎培养微流控芯片,旨在公开一种提高废弃胚胎囊胚发育的新方法,提高废弃胚胎的囊胚形成率及囊胚质量,对建立人类不同hla型别的hes库具有重要意义。
技术实现要素:
本发明涉及一种用于废弃胚胎囊胚发育的微流控芯片,以及该芯片用于废弃胚胎囊胚发育的培养方法。
本发明涉及的一种用于废弃胚胎囊胚发育的微流控芯片该芯片为凹陷阵列结构的“倒金字塔型”或“倒v型”芯片,且芯片表面涂覆有pluronicf-127,其“倒金字塔型”或者“倒v型”凹陷结构的侧壁具有一定的倾斜角度,接种胚胎后,在倾斜侧壁的作用下,迫使细胞聚集在凹陷结构的底部,可实现快速、高效、高通量、自动捕获单胚胎并进行原位培养以及分析评价。
所制备微流控芯片的材质为聚合物材料,具体为pdms、pmma或ps;所述所述凹陷结构边长为100μm~400μm。
一种用于废弃胚胎囊胚发育的微流控芯片的制备方法,按照以下步骤进行:
(1)“倒金字塔型”或“倒v型”芯片的制备;
(2)pluronicf-127的涂覆。
所述“倒金字塔型”或“倒v型”芯片的制备;,按照以下步骤进行:
(1)在玻璃或硅片基底表面旋涂200-800微米厚的su-8光刻胶,95℃前烘2-8小时,
(2)将边长为200-400微米的正方形的阵列掩膜固定于含有光刻胶的基底表面,并置于可以调节倾斜角度以及自由旋转的平台上,
(3)紫外曝光时,可以调节平台的倾斜角度(15-75度),同时每次曝光后平台可以以45度或90度的转角旋转后进行下一次曝光,
(4)95℃后烘10-30分钟,自然冷却后用丙二醇甲醚醋酸酯溶掉未曝光的su-8胶,形成具有“倒金字塔”样的阵列模板,
(5)180℃坚膜2小时,最后用此模板制备不同聚合物组成的微流控芯片。
所述pluronicf-127的涂覆,按照以下步骤进行:
1)将微流控芯片在无水乙醇中浸泡15-40min,用去离子水冲洗,真空干燥,备用;
2)将清洗好的微流控芯片放入等离子发生器中,抽真空至0-1pa,通入氧气至10-200pa,调整放电功率在5-300w,进行射频放电0.5-10min;
3)在真空状态下将一定体积的蛋白浓度为0.2-2%pluronicf-127溶液涂覆在芯片表面,孵育2-6小时(37℃)或者12-24小时(4℃);
4)弃去步骤(3)芯片表面溶液,并用无菌去离子水冲洗3遍,干燥,封装,即得。
一种用于废弃胚胎囊胚发育的培养方法,采用上述的微流控芯片,按照以下步骤进行:
a.取得保存在胚胎库中的在体外授精或单精注射后第三天的不适宜进行胚胎移植或冷冻的低质量胚胎;
b.将该胚胎置于微流控芯片中进行培养,胚胎悬液以1×103个/ml~5×103个/ml的胚胎密度加入芯片表面,利用负压驱动和重力作用,将单个胚胎引入单个捕获阱内;待胚胎沉降至捕获阱底部凹陷,在上面覆盖新鲜培养基,并覆盖矿物油以防止蒸发,37℃、5%co2、饱和湿度培养箱内;
c.将废弃胚胎在上述胚胎微流控芯片中培养5-6天,每两天进行培养基更换,为胚胎补加营养物质,排出代谢废物;每天观察胚胎发育情况直至第7天,并且对形成的囊胚进行分级,分级方法参照gardner等人的囊胚分级法。
所述单胚胎捕获步骤如下:将芯片置于真空培养箱抽真空2~8min;将单胚胎悬液覆盖芯片表面,利用负压驱动和重力作用,将单个胚胎引入单个捕获阱内;待胚胎沉降至捕获阱底部,在上面覆盖新鲜培养基,并覆盖矿物油以防止蒸发;每两天进行培养基更换,为胚胎补加营养物质,排出代谢废物;
所述微流控芯片的单个胚胎的捕获效率由胚胎密度和凹陷结构边长协同影响,所述单胚胎悬液密度为1×103个/ml~5×103个/ml;所述凹陷结构边长为100μm~400μm;
所捕获的单个胚胎可在芯片的阵列结构中长期原位培养,可实时观察生长状态。所捕获的单细胞可在芯片大量增殖、分化以及药物刺激等生理学行为。
本发明是通过下述技术方案加以实现,其特征在于,微流控芯片表面修饰pluronicf-127。pluronicf-127是通过物理沉降的方式沉积到微流控芯片胚胎培养区域表面,具有较好的稳定性和均一性。
所述提高胚胎发育为提高胚胎囊胚发育率及提高囊胚发育质量,
所述早期胚胎发育为从受精卵发育开始至囊胚形成。
所述胚胎为人和小鼠胚胎。
用于胚胎培养的涂覆有pluronicf-127的微流控芯片可在芯片的阵列结构中对胚胎进行原位培养,实时观察生长状态。所捕获的单细胞可在芯片大量增殖、分化以及药物刺激等生理学行为。
本发明所述的胚胎培养芯片与培养方法,能够显著提高废弃胚胎的囊胚发育率,对建立人类不同hla型别的hes库具有重要意义。
附图说明
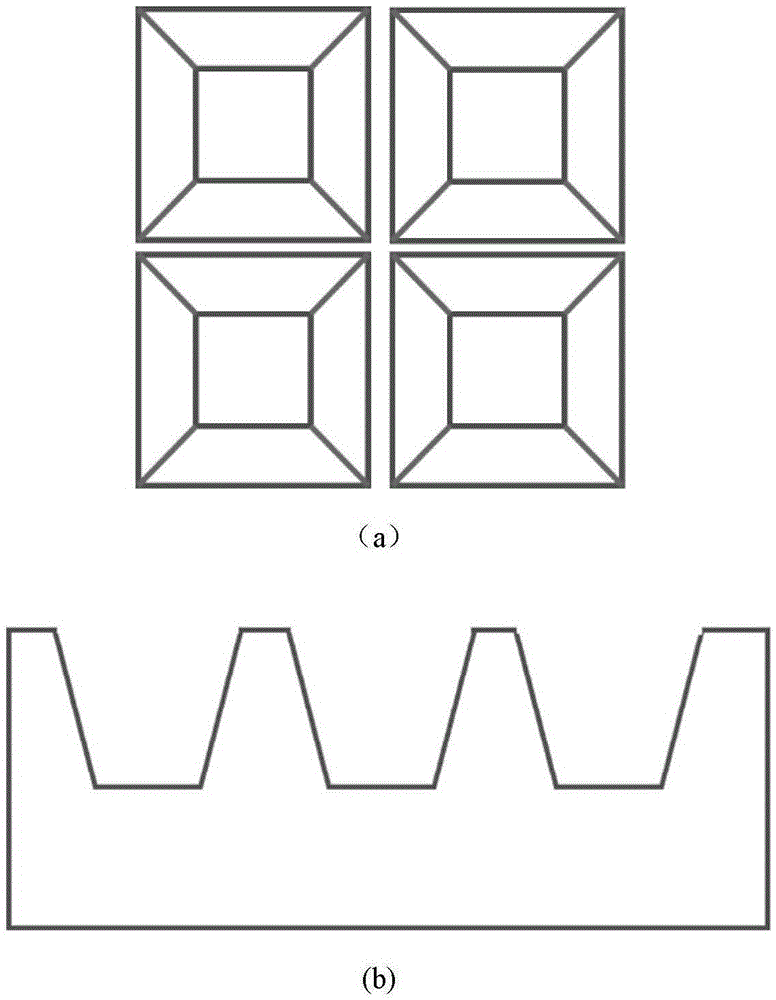
图1“倒金字塔”样凹陷三维胚胎培养芯片示意图,a)俯视图;b)侧视图
图2pluronicf-127修饰的微流控芯片上胚胎实时动态发育情况,包括受精卵期,2细胞期,4细胞期,桑葚期和囊胚期。
具体实施方法
一种用于废弃胚胎囊胚发育的微流控芯片如图1所示,该芯片为凹陷阵列结构的“倒金字塔型”或“倒v型”芯片,且芯片表面涂覆有pluronicf-127,
所述“倒金字塔型”或者“倒v型”凹陷结构的侧壁具有一定的倾斜角度,接种胚胎后,在倾斜侧壁的作用下,迫使细胞聚集在凹陷结构的底部,可实现快速、高效、高通量、自动捕获单胚胎并进行原位培养以及分析评价。
一种“倒金字塔型”或“倒v型”三维胚胎培养芯片的制备方法,利用倾斜曝光的软光刻技术制备出具有“金字塔”和“v型”样结构的模板,再利用该模板制备pdms聚合物芯片,聚合物材质也可为pdms、pmma及ps等。该芯片的特点在于每个凹陷结构都具有倾斜的侧壁,在其作用下迫使接种的胚胎聚集在凹陷结构的底部。
实施例1
pluronicf-127修饰微流控芯片的制备
1)将微流控芯片在无水乙醇中浸泡15-40min,用去离子水冲洗,真空干燥,备用;
2)将清洗好的微流控芯片放入等离子发生器中,抽真空至0-1pa,通入氧气至10-200pa,调整放电功率在5-300w,进行射频放电0.5-10min;
3)在真空状态下将一定体积的蛋白浓度为0.2-2%pluronicf-127溶液涂覆在芯片表面,孵育2-6小时(37℃)或者12-24小时(4℃);
4)弃去步骤(3)芯片表面溶液,并用无菌去离子水冲洗3遍,干燥,封装,即得。
实施例2
pluronicf-127修饰微流控芯片对胚胎发育的影响
实施例1制备的微流控芯片和未经pluronicf-127修饰的微流控芯片分别经75%乙醇浸泡,置于真空培养箱抽真空10min,随后,快速将胚胎悬液以1×103个/ml的胚胎密度加入芯片表面,利用负压驱动和重力作用,将单个胚胎引入单个捕获阱内;待胚胎沉降至捕获阱底部,在上面覆盖新鲜培养基,并覆盖矿物油以防止蒸发;每两天进行培养基更换,为胚胎补加营养物质,排出代谢废物。
将上述pluronicf-127修饰的微流控芯片和pluronicf-127未修饰的的对照组微流控芯片从接种胚胎开始培养算起,每24小时观察一次胚胎发育情况包括卵裂率,胚胎的形态(如2细胞,4细胞等)情况。
结果如图2所示,pluronicf-127修饰的微流控芯片上接种的胚胎经过6天的发育能正常发育到囊胚期,属于早期囊胚状态,囊胚腔体积小于囊胚总体积一半。内细胞团细胞数目多且结合紧密,滋养外胚层细胞数目多,囊胚四周均有细胞分布。将明场不同时间的细胞进行计数囊胚形成率(形成囊胚数/总培养胚胎数(总培养胚胎数为微流控芯片接种的存活胚胎数))统计,实验重复三次,结果取平均值,如表1所示。
表1为不同阶段阳性胚胎发育状况统计
- 还没有人留言评论。精彩留言会获得点赞!