DC细胞培养基,含有该培养基的组合产品及其应用的制作方法
本发明涉及外泌体分离技术领域,具体而言,涉及一种dc细胞培养基,含有该培养基的组合产品及其应用。
背景技术:
树突状细胞(dendriticcells,dcs)是体内最有效的抗原提呈细胞,表面表达b7、mhc-ⅱ类分子、icam-1等多种共刺激分子,激活辅助t细胞,促使其分泌il-2等细胞因子,传递特异性抗原信号,最终活化细胞毒性t细胞,因此dc细胞在体内起到启动一系列免疫反应的关键作用,在机体的免疫功能以及肿瘤的免疫治理中有重要意义。
大多数dc细胞来源于骨髓,由骨髓进入外周血,再分布到全身各组织中,dc广泛分布于除脑以外的全身各脏器,但数量极少,仅占外周血单个核细胞的1%以下。dc前体细胞随血液分布到肠道、心、肝等各非淋巴器官后,发育为不成熟dc细胞。此时,dc细胞具有较强的抗原摄取加工能力,而激活t细胞的能力低下。
不成熟dc通常指的是未被外来抗原或者外界环境中的炎症因子所刺激的dc,它具有强大的胞吞功能,即通过巨胞饮吞噬水溶性的抗原,受体介导的内吞作用摄取蛋白质和抗原-抗体免疫复合物,或者直接吞唾消化整个细胞。它表面低表达mhcii,cd80,cd86等分子。
外泌体(exosomes),是一种脂质分子膜包裹的小囊泡。电镜下观察呈杯状,直径约为40-100nm,密度约为1.13-1.19g/ml。外泌体含有来源细胞的胞质和脂质包膜成分,外泌体内部包含有丰富的mrna,microrna和蛋白质成分。
外泌体形成是通过多囊泡胞内体(mve)的细胞区室向内出芽的形式形成,内囊泡内含有蛋白质、microrna及mrna。当mve与细胞膜融合时,内囊泡就被释放到细胞外成为外泌体,释放出来的外泌体能够运行到距离较远的组织而影响细胞的行为和生理上的改变。
正常状态下,免疫系统维持稳态,即对自身抗原耐受,而对外来抗原启动免疫应答,以清除外来抗原。dc的成熟状态在免疫系统维持稳态的这一过程中起着非常重要的作用。成熟dc表面高表达mhcii、cd80、cd86等分子,能够刺激初始t淋巴细胞对外来抗原进行应答,进而消灭外来抗原。而不成熟dc提呈自身抗原,诱导t淋巴细胞免疫耐受,从而避免免疫系统对自身组织的攻击。因而,不成熟dc细胞的外泌体在多种自身免疫性疾病方面有广阔的应用前景,然而现有技术中缺乏一种完善的不成熟dc细胞的培养基。
有鉴于此,特提出本发明。
技术实现要素:
本发明的目的在于提供一种dc细胞培养基,该培养基能够抑制dc细胞的分化和成熟,还具有较高的外泌体收率。
为了实现本发明的上述目的,特采用以下技术方案:
本发明涉及一种dc细胞培养基,其由无血清培养基中添加如下组份得到:
0.8~1.2v/v%无外泌体自体血浆、gm-csf30~50ng/ml、il-430~50ng/ml、tgf-β10~20ng/ml以及vegf40~50ng/ml。
根据本发明的另一方面,本发明还涉及一种dc细胞培养基组合产品,其包括如上所述的dc细胞培养基,以及第二培养基;
所述第二培养基为在无血清基础培养基中添加如下组份得到:
0.8~1.2v/v%无外泌体自体血浆、gm-csf40~60ng/ml以及il-440~60ng/ml。
根据本发明的另一方面,本发明还涉及如上所述的dc细胞培养基组合产品在不成熟dc细胞外泌体制备中的应用。
与现有技术相比,本发明的有益效果为:
(1)通过优选的培养基配方,不仅能够提高不成熟树突状细胞的比例,还能获得更好的外泌体收率。
(2)本发明提供的培养基,搭配的培养方法简便易行,分离得到的外周血不成熟dc细胞外泌体稳定可靠。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
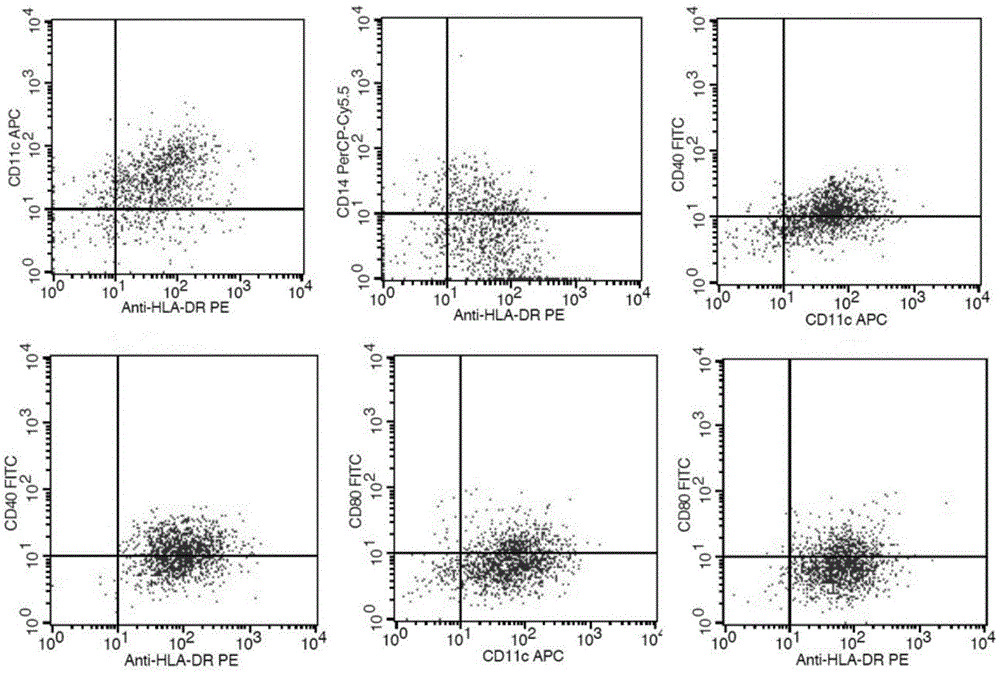
图1为本发明一个实施例中制备得到dc细胞的流式图;
图2为本发明一个实施例中制备得到的dc细胞外泌体cd81和cd11c表型的流式图。
具体实施方式
为了促进理解本文描述的实施方式这一目的,将参考某些实施方式,并且将使用特定语言来描述这些实施方式。本文所使用的术语仅用于描述具体实施方式目的,而不旨在限制本公开的范围。
本发明涉及一种dc细胞培养基,其由在无血清培养基中添加如下组份得到:
0.8~1.2v/v%无外泌体自体血浆、gm-csf30~50ng/ml、il-430~50ng/ml、tgf-β10~20ng/ml以及vegf40~50ng/ml。
在一些实施方式中,其由在无血清培养基中添加如下组份得到:
0.9~1.1v/v%无外泌体自体血浆、gm-csf35~45ng/ml、il-435~45ng/ml、tgf-β12~18ng/m以及vegf42~48ng/ml。
在一些实施方式中,其由在无血清培养基中添加如下组份得到:
0.9~1.1v/v%无外泌体自体血浆、gm-csf40ng/ml、il-440ng/ml、tgf-β15ng/m以及vegf45ng/ml。
在一些实施方式中,所述无血清培养基为aim-v培养基。
根据本发明的另一方面一种dc细胞培养基组合产品,其包括如上所述的dc细胞培养基,以及第二培养基;
所述第二培养基为在无血清基础培养基中添加如下组份得到:
0.8~1.2v/v%无外泌体自体血浆、gm-csf40~60ng/ml以及il-440~60ng/ml。
在一些实施方式中,所述第二培养基为在无血清基础培养基中添加如下组份得到:
0.9~1.1v/v%无外泌体自体血浆、gm-csf45~55ng/ml以及il-445~55ng/ml。
在一些实施方式中,所述第二培养基为在无血清基础培养基中添加如下组份得到:
1.0v/v%无外泌体自体血浆、gm-csf50ng/ml以及il-450ng/ml。
在一些实施方式中,所述无血清基础培养基为aim-v培养基。
根据本发明的另一方面,本发明还涉及如上所述的dc细胞培养基组合产品在不成熟dc细胞外泌体制备中的应用。
在一些实施方式中,所述dc细胞培养基组合产品用于培育外周血dc细胞以制备不成熟dc细胞外泌体。
在一些实施方式中,依此用所述第二培养基和所述dc细胞培养基培养dc细胞,再从培养液中收集不成熟dc细胞外泌体。
在一些实施方式中,使用所述第二培养基的培养时间为4d~6d;
使用所述dc细胞培养基的培养时间为36h~60h。
在一些实施方式中,使用所述第二培养基的培养时间为5d;
使用所述dc细胞培养基的培养时间还可以选择40h,48h,56h。
在一些实施方式中,所述的应用具体包括:
1)将从外周血中分离得到的pbmc细胞使用第二培养基,得到离体不成熟树突状细胞;
2)将所述离体未成熟树突状细胞在dc细胞培养基中培养后,将培养液低温离心以去除死细胞和碎片,过滤去除囊泡;得到的液体进行超速离心,弃上清,得到不成熟dc细胞外泌体。
在一些实施方式中,所述方法涉及到的细胞培养条件均在35至40℃之间和在1至10%的co2之间,优选为36至38℃之间和在4至6%的co2之间。
在一些实施方式中,在使用第二培养基培养之前还包括贴壁培养,在所述贴壁培养中,pbmc细胞的接种密度为4~6×107/20ml。
在一些实施方式中,pbmc细胞的接种密度还可以选择为5×107/20ml/50ml。
在一些实施方式中,以所述贴壁培养所用培养瓶的可用的细胞培养面积175cm2计,所述贴壁培养所用的培养基的添加量为15~25ml,还可以选择20ml。
在一些实施方式中,所述贴壁培养所用的培养基为包含0.8~1.2%自体血浆的aim-v培养基。
在一些实施方式中,以步骤1)培养所用培养瓶的可用的细胞培养面积175cm2计,步骤1)培养所用的培养基的添加量为25~35ml,还可以选择30ml。
在一些实施方式中,在将所述离体未成熟树突状细胞从第二培养基转移到dc细胞培养基中时,将第二培养基中的细胞收集到离心管中,离心后去上清,用dc细胞培养基重悬并转移到新培养瓶中;
在一些实施方式中,所述离心的条件为1300~1500rpm离心3min~7min;
在一些实施方式中,所述离心的条件为1400rpm离心5min;
在一些实施方式中,所述将第二培养基中的细胞收集到离心管中的过程包括:
a).先将含有游离细胞的第二培养基收集到离心管中;
b).将培养瓶中加入缓冲液,置于2℃~6℃的温度中5min~15min后拍打培养瓶,收集缓冲液;
任选的,重复步骤b)一次或多次。
在一些实施方式中,在步骤2)中,培养时所用的培养瓶预先经过自体血浆包被;
血浆包被可抑制单核细胞向巨噬细胞分化,自体血浆为dc细胞原先的生长环境一致,是促进单核细胞向dc细胞分化的理想基质。
在一些实施方式中,所述包被的方法包括:
以瓶底培养面积为75cm2计,加入6ml~8ml自体血浆包被8h~16h。
在一些实施方式中,所述包被的方法包括:
以瓶底培养面积为75cm2计,加入7ml自体血浆包被12h。
在一些实施方式中,所述无外泌体自体血浆通过以下方法制备得到:
血浆于110000g~130000g的转速离心8h~16h;
吸取上层澄清血清并用0.20μm~0.24μm滤膜过滤,收集滤液即得。
在一些实施方式中,所述无外泌体自体血浆通过以下方法制备得到:
血浆于120000g的转速离心12h;
吸取上层澄清血清并用0.22μm滤膜过滤,收集滤液即得。
在一些实施方式中,步骤2)的培养时间为36h~60h,还可以选择40h,48h,56h。
在一些实施方式中,所述低温离心为2℃~6℃下以1800g~2200g离心;
在一些实施方式中,所述低温离心的时间为5min~15min;还可以选择10min;
在一些实施方式中,过滤去除囊泡所用的滤网的孔径为0.20μm~0.24μm;还可以选择0.22μm。
在一些实施方式中,所述超速离心的转速为100000g~130000g,离心时间为3h~6h。
在一些实施方式中,所述超速离心的转速为120000g,离心时间为4h。
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
实施例1
本发明的主要目的是建立一种外周血不成熟dc细胞外泌体分离方法。
1.外周血dc细胞培养基
1)dc普通培养:aim-v培养基(含0.8%自体血浆),gm-csf浓度60ng/ml,il-4浓度40ng/ml。
2)dc无外泌体培养基:aim-v培养基(含0.8%无外泌体自体血浆),gm-csf30ng/ml、il-450ng/ml、tgf-β10ng/ml、vegf50ng/ml。
2.外周血不成熟dc细胞外泌体分离方法
1)无外泌体自体血浆制备:无菌条件下将自体血浆倒入专用超离离心管中,每管38.6ml,4管,确认配平后,放入超速离心机中,110000g离心16h。
2)第二天,小心吸取上层澄清血清到新的无菌离心管中,0.20μm滤膜过滤至另一离心管中,确保血清的无菌状态,封口,备用。
3)培养第0天,取1个t175培养瓶,将得到的pbmc细胞加到培养瓶中,每瓶细胞数4×107,加入aim-v培养基15ml,加400ul自体血浆,培养箱贴壁培养2h。
4)培养2h后,取出培养瓶,倒去上清液,加入30mlaim-v培养基洗培养瓶,洗2次。加入配好的dc普通培养基30ml,培养箱培养。
5)第3天,取出培养瓶,拍打培养瓶,使贴壁细胞漂浮。补加dc培养基普通20ml,培养箱培养。
6)第4天取1个新的t75培养瓶,加入7ml无外泌体自体血浆,置于培养箱中包被过夜。
7)第5天,取出dc培养瓶,拍打培养瓶,使细胞悬浮,将细胞液收集到50ml离心管内。此时观察有大量细胞贴壁,向培养瓶中加15mlpbs,置于4℃15min。取出培养瓶,拍打,大部分细胞漂浮。将pbs倒出,再加入15mlpbs,置于4℃5min。5min后,取出培养瓶,拍打,细胞基本漂浮,将pbs倒入50ml离心管,离心,1400rpm,5min,离心后,倒去上清。
8)用pbs清洗细胞3次。
9)取出第4天包被的t75培养瓶,倒去包被液。将细胞转移到t75培养瓶内,加入20mldc无外泌体培养基。
10)36h后收集培养基到离心管中,即得到富含不成熟dc细胞外泌体的培养基。
11)提前打开普通低温离心机和超速离心机,预冷至2℃。
12)1800g,离心15min,去除死细胞和碎片。
13)0.20μm滤膜过滤去除较大囊泡。
14)上清转至超速离心管中,用pbs配平,100000g,离心6h。
15)弃去上清,用无菌滤纸小心吸走管壁残留液体,管底即为不成熟dc细胞外泌体。
16)用1mlpbs将各管外泌体重悬,混合,-80℃保存。
实施例2
本发明的主要目的是建立一种外周血不成熟dc细胞外泌体分离方法。
1.外周血dc细胞培养基
1)dc普通培养基:aim-v培养基(含1.2%自体血浆),gm-csf浓度40ng/ml,il-4浓度60ng/ml。
2)dc无外泌体培养基:aim-v培养基(含1.2%无外泌体自体血浆),gm-csf50ng/ml、il-430ng/ml、tgf-β20ng/ml、vegf40ng/ml。
2.外周血不成熟dc细胞外泌体分离方法
1)无外泌体自体血浆制备:无菌条件下将自体血浆倒入专用超离离心管中,每管38.6ml,4管,确认配平后,放入超速离心机中,130000g离心8h。
2)第二天,小心吸取上层澄清血清到新的无菌离心管中,0.24μm滤膜过滤至另一离心管中,确保血清的无菌状态,封口,备用。
3)培养第0天,取1个t175培养瓶,将得到的pbmc细胞加到培养瓶中,每瓶细胞数6×107,加入aim-v培养基25ml,加600ul自体血浆,培养箱贴壁培养2h。
4)培养2h后,取出培养瓶,倒去上清液,加入30mlaim-v培养基洗培养瓶,洗2次。加入配好的dc普通培养基30ml,培养箱培养。
5)第3天,取出培养瓶,拍打培养瓶,使贴壁细胞漂浮。补加dc培养基普通20ml,培养箱培养。
6)第4天取1个新的t75培养瓶,加入7ml无外泌体自体血浆,置于培养箱中包被过夜。
7)第5天,取出dc培养瓶,拍打培养瓶,使细胞悬浮,将细胞液收集到50ml离心管内。此时观察有大量细胞贴壁,向培养瓶中加15mlpbs,置于4℃15min。取出培养瓶,拍打,大部分细胞漂浮。将pbs倒出,再加入15mlpbs,置于4℃5min。5min后,取出培养瓶,拍打,细胞基本漂浮,将pbs倒入50ml离心管,离心,1400rpm,5min,离心后,倒去上清。
8)用pbs清洗细胞3次。
9)取出第4天包被的t75培养瓶,倒去包被液。将细胞转移到t75培养瓶内,加入20mldc无外泌体培养基。
10)60h后收集培养基到离心管中,即得到富含不成熟dc细胞外泌体的培养基。
11)提前打开普通低温离心机和超速离心机,预冷至6℃。
12)2200g,离心5min,去除死细胞和碎片。
13)0.24μm滤膜过滤去除较大囊泡。
14)上清转至超速离心管中,用pbs配平,130000g,离心3h。
15)弃去上清,用无菌滤纸小心吸走管壁残留液体,管底即为不成熟dc细胞外泌体。
16)用1mlpbs将各管外泌体重悬,混合,-80℃保存。
实施例3
本发明的主要目的是建立一种外周血不成熟dc细胞外泌体分离方法。
1.外周血dc细胞培养基
1)dc普通培养基:aim-v培养基(含1%自体血浆),gm-csf浓度50ng/ml,il-4浓度50ng/ml。
2)dc无外泌体培养基:aim-v培养基(含1%无外泌体自体血浆),gm-csf40ng/ml、il-440ng/ml、tgf-β15ng/ml、vegf45ng/ml。
2.外周血不成熟dc细胞外泌体分离方法
1)无外泌体自体血浆制备:无菌条件下将自体血浆倒入专用超离离心管中,每管38.6ml,4管,确认配平后,放入超速离心机中,120000g,过夜离心。
2)第二天,小心吸取上层澄清血清到新的无菌离心管中,0.22μm滤膜过滤至另一离心管中,确保血清的无菌状态,封口,备用。
3)培养第0天,取1个t175培养瓶,将得到的pbmc细胞加到培养瓶中,每瓶细胞数5×107,加入aim-v培养基20ml,加500ul自体血浆,培养箱贴壁培养2h。
4)培养2h后,取出培养瓶,倒去上清液,加入30mlaim-v培养基洗培养瓶,洗2次。加入配好的dc普通培养基30ml,培养箱培养。
5)第3天,取出培养瓶,拍打培养瓶,使贴壁细胞漂浮。补加dc培养基普通20ml,培养箱培养。
6)第4天取1个新的t75培养瓶,加入7ml无外泌体自体血浆,置于培养箱中包被过夜。
7)第5天,取出dc培养瓶,拍打培养瓶,使细胞悬浮,将细胞液收集到50ml离心管内。此时观察有大量细胞贴壁,向培养瓶中加15mlpbs,置于4℃15min。取出培养瓶,拍打,大部分细胞漂浮。将pbs倒出,再加入15mlpbs,置于4℃5min。5min后,取出培养瓶,拍打,细胞基本漂浮,将pbs倒入50ml离心管,离心,1400rpm,5min,离心后,倒去上清。
8)用pbs清洗细胞3次。
9)取出第4天包被的t75培养瓶,倒去包被液。将细胞转移到t75培养瓶内,加入20mldc无外泌体培养基。
10)48h后收集培养基到离心管中,即得到富含不成熟dc细胞外泌体的培养基。
11)提前打开普通低温离心机和超速离心机,预冷至4℃。
12)2000g,离心10min,去除死细胞和碎片。
13)0.22μm滤膜过滤去除较大囊泡。
14)上清转至超速离心管中,用pbs配平,120000g,离心4h。
15)弃去上清,用无菌滤纸小心吸走管壁残留液体,管底即为不成熟dc细胞外泌体。
16)用1mlpbs将各管外泌体重悬,混合,-80℃保存;
其中dc细胞的流式图如图1所示,外泌体的流式图如图2所示。
对比例1
同实施例3,区别仅在于,将dc无外泌体培养基的成分替换为:aim-v培养基(含1%无外泌体自体血浆),gm-csf浓度50ng/ml,il-4浓度50ng/ml。
对比例2
同实施例3,区别仅在于,将dc无外泌体培养基的成分替换为:aim-v培养基(含1%无外泌体自体血浆),gm-csf40ng/ml、il-440ng/m、tgf-β30ng/ml、vegf30ng/ml。
对比例3
同实施例3,区别仅在于,将dc无外泌体培养基的成分替换为:aim-v培养基(含1%无外泌体自体血浆),tgf-β15ng/ml、vegf45ng/ml。
对比例4
同实施例3,区别仅在于,将dc普通培养基的成分替换为:(含1%自体血浆),gm-csf40ng/ml、il-440ng/m、tgf-β15ng/ml、vegf45ng/ml。
实验例
将实施例3及对比例1~4每组做6个重复,并进行下述检测。
1.测定实施例3及对比例1~4的外泌体浓度。
测定方法:使用bca蛋白浓度测定试剂盒进行蛋白浓度测定:
1)配制蛋白标准溶液:将0.8ml蛋白标准配制液加入到20mgbsa中,使其充分溶解后进一步稀释至终浓度为0.5mg/ml。
2)bca工作液的配置:bca试剂a:试剂b=50:1,根据样品数加标准品数配制适量体积bca工作液。
3)取96孔板,分别将0,1,2,4,8,12,16,20μl蛋白标准品(0.5mg/ml)及待测样品适量,用标准品稀释液pbs将各孔体积补足至20μl。
4)以上每孔各加入200μlbca工作液,37℃放置20-30min。
5)酶标仪上选择波长562nm,测定标准曲线并根据标准曲线计算样品蛋白浓度。
结果如下表所示:
*p<0.05,vs实施例3。
从上表可知,除对比例3和4外,不同配方的培养基,对dc外泌体的分泌量无明显影响。由于外泌体的分泌量与dc的细胞数量有关,为说明上述现象,申请人进一步检测了各组培养后dc的细胞数量变化。
经过细胞计数,各组的细胞数量如下表所示:
*p<0.05,vs实施例3。
从上表可知,高浓度/长时间给予的tgf-β和vegf4的共同作用会抑制dc增值,进而造成外泌体浓度降低。
2.细胞表型分析:
采用流式细胞术检测各组的表面表征物,并进行比较:
从上表可知,与对比例1相比,实施例3、对比例2-4中的不成熟dc细胞所占比例明显更高(对比例2种不成熟dc含量相对较低);且实施例3与对比例3-4相近,且明显优于对比例2,因此,综合外泌体产率及不成熟dc所占比重,实施例3中的技术方案较优。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,但本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 还没有人留言评论。精彩留言会获得点赞!