胍基化壳聚糖的制备方法及其应用与流程
本发明涉及功能高分子材料领域,具体涉及一种胍基化壳聚糖的制备方法及采用胍基化壳聚糖制备抗菌性纳米微球的方法及应用。
背景技术:
溶菌酶是专一作用于细菌细胞壁的天然抗菌蛋白,可通过切断细胞壁肽聚糖网络上的n-乙酰胞壁酸和n-乙酰葡萄糖胺之间的β-1,4糖苷键联结,解体肽聚糖支架从而分解细菌。近年来,溶菌酶已广泛用于畜禽饲料的添加剂中,也被开发为注射剂、凝胶剂、喷雾剂等多种剂型用于人或动物的抗菌、抗病毒等治疗。研究表明,溶菌酶对革兰氏阳性菌(g+)和酵母型真菌、丝状真菌的抑菌效果较好,还具有抗炎、免疫调节等作用。但是,由于革兰氏阴性菌(g-)的细胞壁表面覆盖着一层由磷脂、脂多糖、脂蛋白组成的脂质外膜,肽聚糖网络被包裹在内层且比g+的少,因此溶菌酶对g-的抑制效果较弱。同时,溶菌酶分子上的六个色氨酸残基是参与溶菌酶和底物结合的活性位点,在体循环过程中易氧化失活。alahdad等将葡聚糖结合到溶菌酶上,在g-细胞膜50℃加热20min的条件下有明显g-抑制效果;martinez等将脂肪酸与溶菌酶联用,可在生理温度下有效抑制g-,但对溶菌酶结构上的色氨酸没有保护作用;ibrahim等将三氯生与溶菌酶复合,保护色氨酸残基的同时提高g-的抑菌效率,但近年亦有三氯生可能致癌的报导。研究者还以透明质酸-酪氨共聚物(kurisawa等)、聚乳酸-聚乳酸共聚物(singh等)、玉米蛋白(zhong等)等高分子材料为载体包裹溶菌酶,可以保护溶菌酶的活性并控制释放,但对改善其g-抑制作用的效果不明显。
壳聚糖是自然界中广泛存在的甲壳素的脱乙酰产物,分子表面的伯胺基(-nh2)质子化后带正电,对细菌细胞膜脂质层的静电亲和能力赋予了其抑菌特性,也是普遍用于食品、医疗、农业等领域的天然抑菌剂。研究表明,高分子量的壳聚糖对g+的抑制作用明显高于g-,但随着分子量的减小,壳聚糖逐渐显示出对g-的抑制优势,g+的抑制效果减弱。vallapa等认为不同分子量壳聚糖的抑菌谱变化与其对细胞膜的作用机理有关,高分子量的壳聚糖吸附在细菌细胞表面,形成一层高分子膜,阻止了营养物质向细胞内运输,从而起到抑菌作用;而低分子量的壳聚糖则可透过细胞膜进人细菌细胞内,与细胞内带负电的物质结合,使细胞的正常生理功能受到影响,导致细菌死亡。以中低分子量壳聚糖为包裹溶菌酶的载体,壳聚糖通过与细胞膜的静电吸附作用破坏g-外膜脂质结构的稳定性或直接穿透外膜,内壁层的肽聚糖暴露出来被溶菌酶水解,则可二者协同作用,增强对g-的抑制效果。但是,壳聚糖仅酸性条件下的水溶性及较高粘度限制了其在生理中性ph条件下的抗菌性应用,需通过结构修饰进一步改善其性能。
抗菌肽结构中的胍基和伯氨基分别为发挥正电性的效应基团,与pka10.8的伯胺基相比,pka12.5的胍基质子化能力更强,可在中性至碱性条件下保持正电性。xiao等的研究表明,精氨酸修饰后的壳聚糖衍生物碱性和水溶性提高,对电负性细胞膜的吸附能力增强,从而减小了最低抑菌浓度(mic)并扩增了有效抑菌的ph范围。同时,胍基内部的共轭效应相对于伯氨基而言分散了正电荷密度,具有更低的细胞毒性。申请人的前期研究结果(cn201710089012.x)中,胍基修饰的高分子载体除了可吸附在细胞膜表面,还可穿透细胞膜在细胞内明显聚集。但是其采用n,n'-羰基二咪唑(简称cdi)作为胍基修饰的缩合剂,cdi溶于醇,不溶于水,需要先在甲醇中进行精氨酸活化,再在水溶液中实现精氨酸与壳聚糖的接枝,即反应需分两步在两种溶剂体系中进行;在第一步活化精氨酸的反应中,还应严苛维持反应体系干燥,操作繁琐;此外,cdi活化的精氨酸上羧基还易于与甲醇发生酯化反应,使得精氨酸与壳聚糖上的氨基发生酰胺化反应的程度降低,导致目标产物胍基化壳聚糖的产出量较少,即产率较低,仅为30%左右。
综上所述,一种产率较高、工艺简单、且用时较少的胍基化壳聚糖的制备方法亟待开发。
技术实现要素:
鉴于以上所述现有技术的缺点,本发明的目的在于为了解决现有技术中合成胍基化壳聚糖的方法中胍基化壳聚糖产量较低、工艺苛刻复杂的技术问题;
本发明目的是提供一种胍基化壳聚糖的制备方法,通过提供的胍基化壳聚糖制备方法采用一步法合成较高产率的胍基化壳聚糖,工艺简单,用时较短,反应温和;
本发明还有一个目的是通过对壳聚糖进行胍基化改性,以提高其生物碱性及水溶性,并增强其对电负性细胞膜的作用能力;
本发明还有一个目的是提供一种可以缓慢、长期释放抑菌成分的胍基化壳聚糖抗菌性纳米微球;
本发明还有一个目的是提供一种制备胍基化壳聚糖抗菌性纳米微球的方法,该方法以硫酸葡聚糖为交联剂,制得包裹有溶菌酶的胍基化壳聚糖纳米微球,其利用中低分子量胍基化壳聚糖对细胞膜的穿透作用破坏g-外膜脂质结构的稳定性,使内壁层的肽聚糖暴露出来,进而被溶菌酶水解,通过二者协同作用,增强对g-的抑制效果。
为实现上述目的及其他相关目的,本发明提供一种胍基化壳聚糖的制备方法,将壳聚糖(cs)、精氨酸(l-arginine)、及4-(4,6-二甲氧基三嗪)-4-甲基吗啉盐酸盐(dmt-mm)同时加入甲醇-水混合溶剂中,室温下搅拌6~8h,真空状态下除去溶剂,产物溶解在超纯水中,透析,冻干,得到胍基化壳聚糖,合成路线为:
优选的,所述壳聚糖的分子量为5~60kda,脱乙酰度>75%。
优选的,精氨酸、4-(4,6-二甲氧基三嗪)-4-甲基吗啉盐酸盐(dmt-mm)、及壳聚糖的摩尔比例:1:1~3:0.003~0.05;甲醇-水混合溶剂中甲醇与水的比例为1:0.2~5。
优选的,相同条件下,随着壳聚糖分子量的降低,精氨酸的接枝率升高,即壳聚糖的胍基化程度提高。
本发明还提供了一种采用胍基化壳聚糖抗菌纳米微球,配置含溶菌酶的胍基化壳聚糖(gcs)溶液及硫酸葡聚糖(ds)溶液,分别对上述两溶液加入适量nacl调节其离子强度为0.1mol/l并先用微孔滤膜过滤;以ds为底液,采用注射泵以一定的速度向其中加入所述含溶菌酶的胍基化壳聚糖(gcs)溶液;持续搅拌10min,静置6h后,将混合液倒入离心管中,以5000rpm的速度离心20min,倒掉清液,再进行去离子水分散、离心两次,最后将下层微球冷冻干燥两天,制得抗菌纳米微球,4℃干燥避光保存待用。
优选的,所述硫酸葡聚糖、所述胍基化壳聚糖、及所述溶菌酶的质量比为:1:0.2~1:0.05~0.5;注射泵以10~20ml/h的速度向底液ds溶液中加入0.2~2ml所述含溶菌酶的胍基化壳聚糖(gcs)溶液。
优选的,所述溶菌酶的浓度为0.5~5mg/ml,所述胍基化壳聚糖的浓度为1~5mg/ml,所述硫酸葡聚糖的浓度为1~5mg/ml,所述胍基化壳聚糖抗菌纳米微球的载药率15~50%及包封率20~60%。
优选的,所述抗菌性纳米微球的粒径小于250nm。
优选的,所述抗菌性纳米微球在生理ph下的体外释放至少7天。
本发明还提供一种胍基化壳聚糖抗菌纳米微球的应用:
步骤一,将一定浓度所述抗菌纳米微球加入到培养至对数期的革兰氏阴性菌(g-)菌液中,37℃振荡培养;
步骤二,取步骤一中的部分所述菌液培养一段时间后测定其电导率值,以电导率值变化反映抗菌纳米微球对细菌细胞外膜的影响情况;如果菌液中电导率显著升高,表明由于胍基化壳聚糖的细胞外膜穿透作用,导致细胞外膜通透性增大,引起了电解质的外渗;如果电导率无明显增加,表明胍基化壳聚糖无法穿透细胞外膜;
步骤三,另取一部分步骤一中的所述菌液,在3500rpm条件下离心10min,取菌液上清液测定其碱性磷酸酶(akp)含量,以akp含量的变化反映抗菌纳米微球对细菌细胞壁的影响情况;如果akp含量明显上升,表明抗菌纳米微球中释放的溶菌酶在胍基化壳聚糖的帮助下可以穿透细胞外膜,破坏细胞壁的完整性;如果akp含量无明显变化,则抗菌纳米微球中释放的溶菌酶无法穿透细胞外膜,也无法作用于细胞壁;
步骤四,通过步骤二及步骤三所得出的抗菌纳米微球对细菌细胞外膜及细胞壁的影响情况,分析改性壳聚糖与溶菌酶的协同抑菌机理;如果步骤二中电导率显著升高且步骤三中akp含量有明显变化,则表明胍基化壳聚糖与溶菌酶协同抑制了革兰氏阴性菌(g-)的生长;如果步骤二中电导率无显著升高或步骤三中akp含量无明显变化则表明胍基化壳聚糖与溶菌酶无法抑制革兰氏阴性菌(g-)的生长。
如上所述,本发明的胍基化壳聚糖的制备方法及其应用具有以下有益效果:
1)本发明采用dmt-mm一步法合成胍基化壳聚糖,缩合剂dmt-mm为高度水溶性,可以在醇、水、或醇/水混合溶剂体系中反应,使得反应条件温和,工艺简单,用时较短,易于控制;
2)本发明采用dmt-mm可有效提高目标酰胺化反应的选择性,降低酯化副反应,其目标产物胍基化壳聚糖的产率可提高至至少70%;而且因为采用为新的合成路线减低了对壳聚糖的要求,只需要脱乙酰度>75%即可完成反应,扩大了此合成方法的应用范围;
3)本发明中抗菌性纳米微球采用了胍基化壳聚糖包裹溶菌酶的协同抑菌思路;利用中低分子量胍基化壳聚糖的细胞膜穿透性质,以及溶菌酶的细胞壁专一分解能力,共同增强微球对革兰氏阴性菌(g-)的抗菌效果,实现了该抗菌性微球的广谱抑菌作用;
4)本发明的抗菌性微球可维持长时间缓慢释放,起到持续预防细菌性疾病的目的;
5)本发明的抗菌性微球原料安全,制备工艺简单,微球无毒,可生物降解,生物相容性好,可以作为抗菌性生物制剂应用,或负载在其他材料表面作为抗菌性组分应用。
附图说明
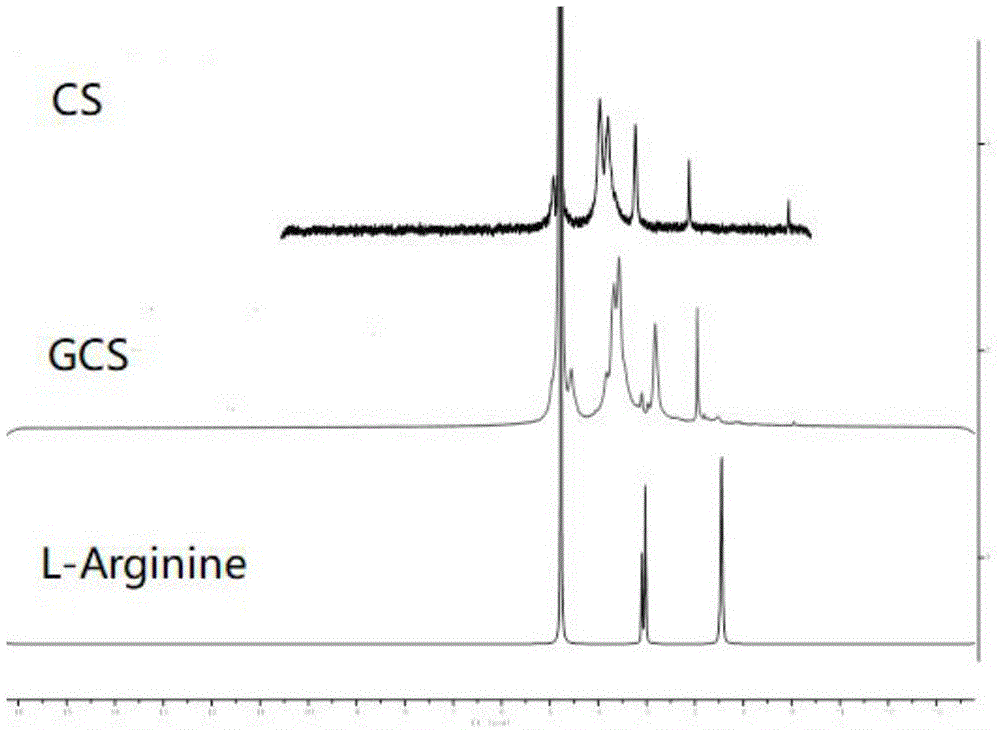
图1为本发明实施例1所述的胍基化壳聚糖1hnmr谱图;
图2为本发明实施例1所述的胍基化壳聚糖13cnmr谱图;
图3为本发明实施例1所述的胍基化壳聚糖的xrd谱图((a)壳聚糖cs(b)胍基化壳聚糖gcs);
图4为本发明实施例2所述的不同分子量的胍基化壳聚糖制成的抗菌性纳米微球的(a)载药率(b)包封率;
图5为本发明实施例2所述的不同溶菌酶浓度的胍基化壳聚糖抗菌性纳米微球的(a)载药率(b)包封率;
图6为本发明实施例2所述不同分子量的胍基化壳聚糖抗菌性纳米微球的体外释放曲线;
图7为本发明实施例2不同分子量的胍基化壳聚糖抗菌性纳米微球的细胞相容性;
图8为本发明实施例2所述的同分子量的胍基化壳聚糖抗菌性纳米微球对革兰氏阴性菌大肠杆菌(e.coli)的抑制曲线;
图9为本发明实施例2所述不同分子量的胍基化壳聚糖抗菌性纳米微球对革兰氏阳性菌大肠杆菌(s.aureus)的抑制曲线;
图10为本发明实施例3中gcs2抗菌性纳米微球微球对大肠杆菌(e.coli)细胞壁的影响;
图11为本发明实施例3中gcs2抗菌性纳米微球对大肠杆菌(e.coli)细胞膜的影响。
具体实施方式
以下由特定的具体实施例说明本发明的实施方式,熟悉此技术的人士可由本说明书所揭露的内容轻易地了解本发明的其他优点及功效。
实施例1:
本发明提供一种胍基化壳聚糖的制备方法,将壳聚糖(cs)、精氨酸(l-arginine)、及4-(4,6-二甲氧基三嗪)-4-甲基吗啉盐酸盐(dmt-mm)同时加入甲醇-水混合溶剂中,室温下搅拌6~8h,真空状态下除去溶剂,产物溶解在超纯水中,透析,冻干,得到胍基化壳聚糖,合成路线为:
分别选取分子量8kda、16kda、40kda、52kda的壳聚糖与精氨酸以摩尔比1:300反应,分别得到胍基化壳聚糖gcs1、gcs2、gcs3、gcs4。上述胍基化壳聚糖中壳聚糖的脱乙酰度可选用>75%的任意一个值,如脱乙酰度为76%、78%、85%,88%、90%或95%,脱乙酰度的选取对以下实验的结果影响不大。
1、胍基化壳聚糖的1hnmr表征:
以gsc2为例,通过对比胍基化前后的壳聚糖1hnmr谱(如图1所示)可以看出,c1-h、c2-h和-nh2*的位置发生了很明显的偏移,而且在3.13ppm和1.41ppm处出现了新的峰,是精氨酸上的氢质子峰,说明精氨酸已经与壳聚糖发生了反应且修饰点在-nh2上。
2、胍基化壳聚糖的13cnmr表征:
以gsc2为例,如图2所示,与精氨酸反应之后的壳聚糖原本骨架上的碳发生了一定的化学位移,在碳谱中我们可以看到,173.74ppm处的峰为精氨酸与壳聚糖氨基反应生成的酰胺碳峰;156.63ppm处的峰为精氨酸中胍基的碳峰;另外52.09、40.57、35.87和24.53ppm处的峰均为精氨酸的碳峰。故而碳谱也说明了精氨酸已经成功接枝在壳聚糖上形成胍基化壳聚糖。
3、胍基壳聚糖的xrd分析:
以gsc2为例,如图3所示,壳聚糖在11.5°和20.0°处出现两个很强的特征峰,表明壳聚糖具有很高的结晶度。胍基化壳聚糖与之相比,原壳聚糖两个特征峰处的峰强明线变弱,表明胍基化后分子结构的结晶度大幅度下降。壳聚糖属于单斜晶系,分子链上有大量的自由氨基和羟基,形成大量的分子内和分子间氢键,结构有序,结晶度很高。胍基的引入破坏了cs有序的结构,产生空间位阻,阻碍了分子间和分子内氢键的形成,氨基葡萄糖单元形成的结晶区被破坏,规整性下降,因此结晶度较低。
4、胍基化接枝率:
本案采用元素分析法测定胍基化壳聚糖胍基化接枝率,如表1:
从元素分析结果表1中可见,随着分子量的降低,胍基的接枝率增高。
5、产率:
如表2:
实施例2:
分别配置含溶菌酶的胍基化壳聚糖(gcs)溶液及硫酸葡聚糖(ds)溶液,分别对上述两溶液加入适量nacl调节其离子强度为0.1mol/l并先用微孔滤膜过滤;以ds为底液,采用注射泵以一定的速度向其中加入所述含溶菌酶的胍基化壳聚糖(gcs)溶液或者以所述含溶菌酶的胍基化壳聚糖(gcs)溶液为底液,采用注射泵以一定的速度向其中加入ds溶液;持续搅拌10min,静置6h后,将混合液倒入离心管中,以5000rpm的速度离心20min,倒掉清液,再进行去离子水分散、离心两次,最后将下层微球冷冻干燥两天,制得抗菌纳米微球,4℃干燥避光保存待用。
1、抗菌纳米微球的粒径研究:
本案分别以ds为底液、gcs为注射液,以及gcs为底液、ds为注射液进行了胍基化壳聚糖抗菌纳米微球制备条件的探索(gcs为实施例1中的gcs2):
表3.不同制备条件下的胍基化壳聚糖gcs2抗菌纳米微球粒径
(通用制备条件:ds溶液(2mg/ml),gcs2溶液(2mg/ml,不添加溶菌酶),注射液流量20ml/h)
由表3可以看出,随着注射液体积的增加,微球的粒径逐渐增加,当体积超过一定峰值(约1.2ml左右),微球逐渐絮凝沉降;随着微球形成时搅拌速率的增加,微球的粒径呈现出逐步降低的趋势,由于可通过渗透作用穿越细胞膜的微粒粒径一般<250nm,本案制备的胍基化壳聚糖微球也需符合上述要求,对比不同制备条件制得的微球粒径,以ds为底液时制得的微球粒径相对较小,且随其他条件变化的增减趋势较为显著,故我们选取ds为底液,gcs为注射液为下一步包裹溶菌酶的胍基化壳聚糖微球的基础条件。为了得到粒径适宜(<250nm)、包载量较多的微球,我们将其他条件设定为:gcs2注射液体积分别为0.6ml、0.8ml;搅拌速度500rpm继续以下研究:
表4.不同制备条件下的cs、gcs2包裹溶菌酶的抗菌纳米微球粒径
(通用制备条件:底液为ds溶液(2mg/ml),注射液为含溶菌酶的cs或gcs2溶液(2mg/ml),注射液流量20ml/h)
分别以壳聚糖、胍基壳聚糖为溶菌酶的包裹材料,在溶菌酶的浓度为0.5、1.0、1.5、2.0、2.5mg/ml时制备抗菌纳米微球,由表4可知,当其他条件相同时,包裹溶菌酶的胍基壳聚糖抗菌纳米微球粒径比相应的壳聚糖微球粒径要低,表明胍基壳聚糖的强烈正电性可与带负电的硫酸葡聚糖结合更为紧密,因此微球粒径减少。随着溶菌酶浓度的增加,抗菌纳米微球的粒径也显示出增加的趋势,表明同样正电性的溶菌酶也与硫酸葡聚糖发生了一定作用,被包裹在抗菌纳米微球内部或表面。但是,粒径在250nm以下的抗菌纳米微球理论上依然可通过跨越细菌细胞膜,破坏其细胞结构,发挥抑菌作用。综合考量溶菌酶的浓度和抗菌纳米微球的粒径,本案选择胍基壳聚糖体积为0.8ml和溶菌酶1mg/ml,搅拌转速为500rpm,注射泵速度为20ml/h时的制备条件用于后续实验研究。
2、胍基化壳聚糖抗菌纳米微球的载药率和包封率:
本案制备包裹溶菌酶的胍基化壳聚糖抗菌纳米微球,溶菌酶在抗菌纳米微球内的含量是影响后续抗菌纳米微球抑菌效率的重要因素之一,因此我们通过测定抗菌纳米微球的包封率和载药率来评价溶菌酶的含量。具体方法为:将冷冻干燥后的溶菌酶抗菌纳米微球和空白纳米微球在37℃下搅拌至完全溶解,得到澄清溶液。溶液中溶菌酶的含量通过bca试剂盒在570nm波长下测定吸光度求得。空白微球溶解液的吸光度值作为空白校对。抗菌纳米微球对溶菌酶的载药率(dl)和包封率(ee)计算公式分别如下:
dl%=(w/wn)×100%;ee%=(w/w0)×100%
其中,w:被包载溶菌酶的质量(即澄清溶液中溶菌酶的质量);wn:抗菌纳米微球的质量;w0:溶菌酶的总投入质量。
如图4所示,溶菌酶与胍基化壳聚糖在微球形成的介质中均带正电荷,因此二者不具备相互之间的静电吸引作用。溶菌酶在胍基化壳聚糖抗菌纳米微球中被包载的机理为凝胶嵌入,即胍基化壳聚糖滴加到硫酸葡聚糖溶液中会即可发生凝胶化反应,溶菌酶则是被包裹在胍基化壳聚糖与硫酸葡聚糖形成的三维网格中。当胍基化壳聚糖的分子量由8kda增加到52kda时,抗菌纳米微球(通用制备条件:底液为2ml的ds溶液(2mg/ml),注射液为0.8ml的含溶菌酶(1mg/ml)的gcs溶液(2mg/ml)注射液流量20ml/h)的载药率和包封率都随之增加。这是由于随着胍基化壳聚糖分子量的增加,链段上的正电荷基团增多,从而有更多的硫酸葡聚糖与之交联反应,从而增加溶菌酶的包裹量,但同时也会带来抗菌纳米微球粒径的显著增加,分子量16kda的gcs2抗菌纳米微球溶菌酶载药率33.45%,包封率43.64%。
图5显示了不同溶菌酶浓度对抗菌纳米微球(通用制备条件:底液为2ml的ds溶液(2mg/ml),注射液为0.8ml的含溶菌酶的gcs2溶液(2mg/ml),注射液流量20ml/h)的载药率和包封率的影响,,由图可知,当溶菌酶的浓度从0.5mg/ml提高到2.5mg/ml时,溶菌酶的载药率也逐渐增加。这是由于溶菌酶的初始浓度增加,当胍基化壳聚糖与硫酸葡聚糖发生凝胶化反应时,会有更多的溶菌酶被包裹在其中。但是随着更多溶菌酶的引入,则会在抗菌纳米微球形成过程中由于正电荷的过剩导致形成絮凝沉淀,因此抗菌纳米微球中包裹的溶菌酶载药量的增加趋于平缓。也正是由于高初始浓度的溶菌酶会引发的絮凝,导致了包封率的下降趋势。
3、胍基化壳聚糖抗菌纳米微球的体外释放特性测定:
将胍基化壳聚糖抗菌纳米微球和空白纳米微球(制备条件:底液为2ml的ds溶液(2mg/ml),注射液为0.8ml的含溶菌酶(1mg/ml)的gcs溶液(2mg/ml),注射液流量20ml/h)置于ph=7.4的pbs缓冲溶液中,在37℃的摇床中54rpm恒温释放。在适当的时间点,取样品4℃离心(速率8500rpm)30min,取出lml上层清夜,同时补充lml新鲜pbs溶液。通过bca试剂盒测出上清液中的溶菌酶质量,通过胍基滴定法计算上清液中胍基化壳聚糖的质量,绘制二者的经时释放曲线。每次测定取3个平行样进行,空白微球的释放情况作为对照,其中,空白胍基化壳聚糖微球的制备方法如下:
配置2mg/ml的胍基化壳聚糖溶液(gcs)和2mg/ml的硫酸葡聚糖溶液(ds),向其中加入nacl调节它们的离子强度为0.1mol/l;先用微孔过滤两溶液,以2ml的ds为底液,采用注射泵以20ml/h的速度向其中加入不同体积的gcs溶液,持续搅拌10min,静置6h后,将样品倒入离心管中,以离心速度5000rpm离心20min,倒掉清液,再进行去离子水分散、离心两次,最后将下层微球冷冻干燥两天,样品在4℃干燥避光保存待用,制得空白胍基化壳聚糖微球。
本案制备的胍基化壳聚糖抗菌纳米微球在生理ph下的体外释放过程如图6所示,微球在1天以内会有个突释的过程,释放约40~50%的溶菌酶,然后在1~7天之间释放速率逐渐变缓,即为缓释过程;比较不同分子量的胍基化壳聚糖微球,溶菌酶的释放速率随着分子量的增加而降低;采用分子量8kda壳聚糖制成的gcs1抗菌纳米微球释放曲线的斜率较大,释放7天即基本释放完毕;采用分子量16~52kda之间的壳聚糖制成的抗菌纳米微球释放溶菌酶较为平缓,7天左右可释放60%以上;当聚合物的分子量增加时,聚合物的链长将会增加,形成的微球渗透性会由于链段间相互缠结作用的增加而降低,因此,本案制备的胍基化壳聚糖微球的分子量增加时,微球的渗透性将会降低,溶菌酶在微球中通过扩散作用而释放的过程将会变缓,从而释放速度降低。本发明旨在制备一种重在预防,而非治疗的抗菌制剂,可以在较长时间(>7天)内低剂量缓慢的释放抑菌组分,从而预防细菌性疾病的发生,所以采用16~52kda之间的壳聚糖制成的gcs抗菌纳米微球更适合此应用。
4、胍基化壳聚糖抗菌纳米微球细胞毒性研究:
以hela细胞为细胞模型,采用mtt法评价该生物酶制剂的细胞相容性:
胍基化壳聚糖抗菌纳米微球(制备条件:底液为2ml的ds溶液(2mg/ml),注射液为0.8ml的含溶菌酶(1mg/ml)的gcs溶液(2mg/ml),注射液流量20ml/h)的细胞相容性如图7所示,本案所涉及的四种中低分子量的胍基化壳聚糖微球与细胞共培养,其细胞增值率都在90%以上。本案选取的原料壳聚糖是fda批准的药用辅料,溶菌酶是常用的饲用添加剂之一,改性工艺与微球制备工艺温和,杂质去除彻底,显著降低了本项目胍基化壳聚糖抗菌纳米微球的安全性风险,进一步扩大了其应用范围。
5、胍基化壳聚糖抗菌微抑菌活性:
分别以革兰氏阳性菌金黄色葡萄球菌(s.aureus)和革兰氏阴性菌大肠杆菌(e.coli)为细菌模型,选取对数生长期的细菌进行抑菌活性研究。具体方法为:从37℃培养16~20h的平板中挑取单菌落(直径2~3mm),转到含有100mltsb培养基的1l烧瓶中,于37℃剧烈振培6~7h。每隔15~20min测定od600值来检测。当od值达到0.35时,收获细菌。
取胍基化壳聚糖包裹溶菌酶制备的系列抗菌纳米微球,以预实验选定的浓度20g/l加入到细菌培养液中,摇床中37℃培养,分别于2h,4h,6h,8h,10h,12h,16,20h,24h时取出5ml样品,测定od600值以评价细菌的生长情况。以未加酶制剂的细菌样品为阴性对照,计算出各组样品的经时抑菌率。以未有胍基化壳聚糖包裹溶菌酶制成的微球为阳性对照,比较各胍基化壳聚糖抗菌纳米微球的抑菌效率。
(1)、图8显示了采用不同分子量壳聚糖制成的胍基化抗菌纳米微球对革兰氏阴性菌大肠杆菌(e.coli)的抑制能力(胍基化壳抗菌纳米微球制备条件:底液为2ml的ds溶液(2mg/ml),注射液为0.8ml的含溶菌酶(1mg/ml)的gcs溶液(2mg/ml),注射液流量20ml/h),未胍基化的壳聚糖包裹溶菌酶制成的抗菌纳米微球对e.coli的抑制效果较差,与之相比,胍基化壳聚糖包裹溶菌酶制成的微球抑菌能力明显增强,24h的抑菌效率均在50%以上,表明了胍基化壳聚糖与溶菌酶的协同作用有效加强了其对革兰氏阴性菌(g-)的抑制能力。分子量16kda的gcs2抗菌纳米微球抑菌效果最佳,这可能与微球粒径、溶菌酶载药率、及体外释放能力密切相关。随着胍基化壳聚糖分子量的增加,微球粒径增加,体外释放能力变缓,减弱了二者协同的g-抑制能力;而溶菌酶载药率随着胍基化壳聚糖分子量的增加而增加,则对其抑菌效率起到了促进作用,gcs2包裹溶菌酶制备的微球在这三大影响因素之间取得了平衡,因此抑菌效果最好。
(2)、图9显示了不同分子量的壳聚糖制成的的胍基化壳抗菌纳米微球对革兰氏阳性菌金黄色葡萄球菌(s.aureus)的抑制能力(胍基化壳抗菌纳米微球制备条件:底液为2ml的ds溶液(2mg/ml),注射液为0.8ml的含溶菌酶(1mg/ml)的gcs溶液(2mg/ml),注射液流量20ml/h),从图中可以看出,由于溶菌酶对革兰氏阳性菌(g+)较强的抑制能力,所以作为阳性对照的未胍基化壳聚糖包裹溶菌酶制成的微球抑菌能力最强;胍基化壳聚糖包裹溶菌酶制成的抗菌纳米微球因为其缓释特性,24h内释放出的溶菌酶含量不及阳性对照,因此抑菌效率有所降低。对比不同分子量的胍基化壳聚糖微球,其抑菌效率随着分子量的增加而略有降低,这主要与体外释放的溶菌酶含量有关。gcs1由于载药率相对较低,因此虽然从体外释放曲线来看溶菌酶释放最快,但是实际含量还是较gcs2、gcs3要低。
实施例3:
1、胍基化壳聚糖抗菌纳米微球对e.coli细胞壁的作用:
碱性磷酸酶(akp)存在细胞壁与细胞膜之间,正常情况下该酶不能透过细胞壁渗透到细胞外。但当细胞壁遭到一定程度的破坏后,细胞壁通透性增加,akp会大量渗透到胞外,因此通过检测细胞外akp含量的变化可以反映细菌细胞壁受破坏的情况。由图10(胍基化壳聚糖抗菌纳米微球制备条件:底液为2ml的ds溶液(2mg/ml),注射液为0.8ml的含溶菌酶(1mg/ml)的gcs2溶液(2mg/ml),注射液流量20ml/h)可知,当大肠杆菌与胍基化壳聚糖/溶菌酶微球共培养2h后,akp含量即有一定上升,2~6h内akp的上升趋势较快,表明微球中释放的溶菌酶在胍基化壳聚糖的帮助下2~6h内已可穿透细胞膜,破坏细胞壁的完整性。未有胍基化壳聚糖包裹的溶菌酶几乎无法穿越大肠杆菌的细胞外膜作用于细胞壁,因此胞外的akp值几乎无明显变化。
2、胍基化壳聚糖抗菌纳米微球对e.coli细胞膜的作用:
细胞膜是细菌的保护屏障,当细菌遇到不利生长条件或者抑菌作用时,细胞膜的半透性将丧失,流动性降低,进而菌体的保护屏障被打破,内部电解质(如k+)大量渗入至培养液,导致培养液的电导率上升。本案通过菌液电导率的变化,来探讨胍基化壳聚糖的作用对细菌细胞膜通透性的影响。由图11(胍基化壳聚糖抗菌纳米微球制备条件:胍基化壳聚糖抗菌纳米微球底液为2ml的ds溶液(2mg/ml),注射液为0.8ml的含溶菌酶(1mg/ml)的gcs2溶液(2mg/ml),注射液流量20ml/h)可知,gcs2微球共培养的细菌在0.5~2h内电导率显著升高,表明由于胍基化壳聚糖的细胞膜穿透作用,细胞膜遭到破坏,导致通透性增大,引起了电解质的外渗。
本案制备的胍基化壳聚糖抗菌纳米微球的关键成分中,溶菌酶具有细胞壁专一分解能力,而胍基化壳聚糖则是作用于细胞膜。我们选择了中低分子量壳聚糖进行改性,进而与硫酸葡聚糖进行交联,希望利用中低分子量壳聚糖对g-细胞外膜的穿透作用,从而增加细胞膜的通透性,递送溶菌酶到细胞壁,对其进行瓦解,综合图10与11可以看出,当微球与e.coli共培养1h左右,细胞膜的通透性增加,进而细胞壁的完整性被破坏,细胞内电解质外泄,表明胍基化壳聚糖与溶菌酶按照项目设计预期协同发挥了对革兰氏阴性菌的抑制作用。
对比例1:
称取精氨酸2.0g,n,n'-羰基二咪唑4.84g,溶于50ml无水甲醇,在0~5℃下搅拌3小时,得到羧基活化的精氨酸,备用。称取壳聚糖(分子量16kda,脱乙酰度90%)2.7g溶于100mlmes水溶液,然后将上一步制得的羧基活化精氨酸直接滴加至壳聚糖溶液中,滴加完毕后,室温下搅拌6h。真空状态下除去溶剂,产物溶解在超纯水中,透析(mwco6000)3~4天,冷冻干燥。制得的胍基化壳聚糖产率为29.3%。
对比例2:
称取精氨酸1.9g,n,n'-羰基二咪唑3.72g,溶于100ml无水甲醇,在25℃下搅拌6小时,得到羧基活化的精氨酸,备用。称取壳聚糖(分子量8kda,脱乙酰度88%)1.6g溶于100mlmes水溶液,然后将上一步制得的羧基活化精氨酸直接滴加至壳聚糖溶液中,滴加完毕后,室温下搅拌20h。真空状态下除去溶剂,产物溶解在超纯水中,透析(mwco3400)3~4天,冷冻干燥。制得的胍基化壳聚糖产率为28.1%。
对比例3:
称取精氨酸2.0g,n,n'-羰基二咪唑4.84g,溶于50ml无水甲醇,在0~5℃下搅拌3小时,得到羧基活化的精氨酸,备用。称取壳聚糖(分子量16kda,脱乙酰度76%)2.7g溶于100mlmes水溶液,然后将上一步制得的羧基活化精氨酸直接滴加至壳聚糖溶液中,滴加完毕后,室温下搅拌6h。真空状态下除去溶剂,产物溶解在超纯水中,透析(mwco6000)3~4天,冷冻干燥。制得的胍基化壳聚糖产率为0。
对比例4:
称取精氨酸1.9g,n,n'-羰基二咪唑3.72g,溶于100ml无水甲醇,在25℃下搅拌6小时,得到羧基活化的精氨酸,备用。称取壳聚糖(分子量8kda,脱乙酰度78%)1.6g溶于100mlmes水溶液,然后将上一步制得的羧基活化精氨酸直接滴加至壳聚糖溶液中,滴加完毕后,室温下搅拌20h。真空状态下除去溶剂,产物溶解在超纯水中,透析(mwco3400)3~4天,冷冻干燥。制得的胍基化壳聚糖产率为0。
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
- 还没有人留言评论。精彩留言会获得点赞!