一种精准调控谷氨酸棒杆菌基因表达的方法与流程
本发明涉及一种精准调控谷氨酸棒杆菌基因表达的方法,属于合成生物技术领域。
背景技术:
谷氨酸棒状杆菌(corynebacteriumglutamicum)在生物界中广泛分布的革兰氏阳性菌,广泛应用于发酵生产人类所需要的氨基酸,如谷氨酸、精氨酸、瓜氨酸、鸟氨酸、丝氨酸、异亮氨酸、苏氨酸、苯丙氨酸、赖氨酸、蛋氨酸等。
目前代谢工程改造为以大肠杆菌、谷氨酸棒杆菌、枯草芽孢杆菌为代表的重要的工业微生物菌种的提高生产性状的主要手段,即应用基因工程的技术对目标微生物进行遗传改造,定向改造其代谢系统,改变代谢流量的分布,构建新的代谢途径,使代谢流向理想的方向流通,强化目的产物的合成,减少副产物的积累,使得改造后的微生物具有更强的产物合成效率,底物转化效率等。但是,对遗传改造通常造成对微生物代谢行为的过度干扰,如,简单粗放的增加,减少或删除某一条代谢途径导致微生物代谢流量未能按照预期设计分配,不仅减少目的产物的积累量,甚至不利于细胞的正常生长,极大的影响微生物生长及生产性能。因此,需要通过合成生物学的策略,精准调节代谢途径中的关键基因的表达调控元件,对流量进行精准的分配,系统地平衡菌体的自身代谢与合成产物之间的关系,实现高效的产物的积累。
基因表达调控元件是构成代谢通路的基本元素,因此基因表达调控元件的特性和功能直接影响到代谢流量的精确分布,目的产物的高效积累。基因表达调控元件包括复制起始位点、启动子、核糖体结合位点(rbs)、基因间序列、终止子、功能蛋白等等。在谷氨酸棒杆菌的基因表达调控中,最重要的调控元件为启动子和rbs,这两个元件分别调控基因表达中的转录和翻译步骤,决定基因的转录以及核糖体起始翻译的强弱。
启动子是位于结构基因5'端上游,rna聚合酶能够特异性识别并结合的一段dna序列。启动子与转录因子结合,激活rna聚合酶,并在其催化下启动转录。rbs是位于mrna的起始密码子aug上游约8-13核苷酸处的一段由4-9个嘌呤核苷酸组成的序列,rrna能够准确地识别出这段序列并与之结合启动翻译过程。
目前,改造启动子进而调控基因表达水平的手段已有许多报道,但是采用的具体方法效率低,需要首先筛选内源型启动子文库,再从中挑选强度适宜的启动子,替换目的基因前本来的启动子序列,实现目标基因表达量上调或下调的目的。此外也有个别通过改造rbs从而实现基因表达调控的研究,但是存在启动子一样的问题,即标准化元减少,需要首先进行筛选。究其原因在于启动子和rbs的标准化、元件化程度低,因此无法建立标准文库。同时,基因表达受到不同的调控元件的协同调节,多个元件的多重调节下,才导致了基因表达的总体水平,因此仅仅改造单一元件很多情况下效果不佳。
技术实现要素:
为了克服现有技术中所存在的启动子和rbs标准化程度低、单一调控效果差的问题,本发明提供了一种标准化的启动子与rbs联用以精准调控基因表达的方法,显著拓展了基因表达的调控强度,并且免去了筛选的环节,大大缩小的改造周期。本发明还提供了启动子与rbs联用在谷氨酸棒杆菌中的具体应用。
本发明的第一个目的是提供一种精准调控谷氨酸棒杆菌基因表达的方法,包括如下步骤:
(1)将启动子、rbs和目的基因插入到表达载体中,构建启动子与rbs联用重组表达载体;
(2)将步骤(1)的重组表达载体导入谷氨酸棒杆菌宿主中,调控目的基因的表达;
所述的启动子为对-10延伸区保守序列和/或-35区保守序列中的碱基进行突变,得到的系列强度的启动子;
所述的rbs为对rbs保守序列aaagg到翻译起始密码子atg之间序列进行碱基突变,得到的系列强度的rbs。
在本发明的一种实施方式中,所述的启动子的核苷酸序列如seqidno.1、seqidno.2、seqidno.3、seqidno.4或seqidno.5所示。
在本发明的一种实施方式中,所述的rbs的核苷酸序列如seqidno.6、seqidno.7、seqidno.8、seqidno.9或seqidno.10所示。
在本发明的一种实施方式中,所述的目的基因为谷氨酸棒杆菌中的任意表达基因。
在本发明的一种实施方式中,所述的表达载体为pdxw系列、pxmj19或pmd19-t。
本发明的第二个目的是提供一种精准调控谷氨酸棒杆菌基因表达的重组表达载体,包括在表达载体上插入启动子和rbs,所述的启动子为对-10延伸区保守序列和/或-35区保守序列中的碱基进行突变,得到的系列强度的启动子;所述的rbs为对rbs保守序列aaagg到翻译起始密码子atg之间序列进行碱基突变,得到的系列强度的rbs。
本发明的第三个目的是提供一种重组谷氨酸棒杆菌,所述重组谷氨酸棒杆菌包含所述的重组表达载体。
在本发明的一种实施方式中,所述的重组谷氨酸棒杆菌的宿主菌为谷氨酸棒杆菌atcc14067。
本发明的第四个目的是提供所述的重组谷氨酸棒杆菌在发酵生产氨基酸中的应用。
本发明的有益效果是:
标准化的最简启动子与rbs文库,使针对目标基因表达量的调控的改造工作大幅缩短,省去了内源启动子或rbs的筛选和强度表征环节,平均一个目标基因的改造周期可以由之前的30-40天缩短为10天以内。
所述调控方法的强度跨度较单一元件高一百倍以上,由此可实现对代谢途径的大幅度调控及生物系统的功能优化。
较以往的粗线条的上调或下调基因表达量的方法,本发明中的利用标准元件组合调控的方法可以更加精准、定量的调控目的基因。使代谢途径得到进行更加精准的调控,尤其是分支点处的流量调节,可提高目标产物产量,同时防止某些基因过度表达给细胞带来的代谢负担。
附图说明
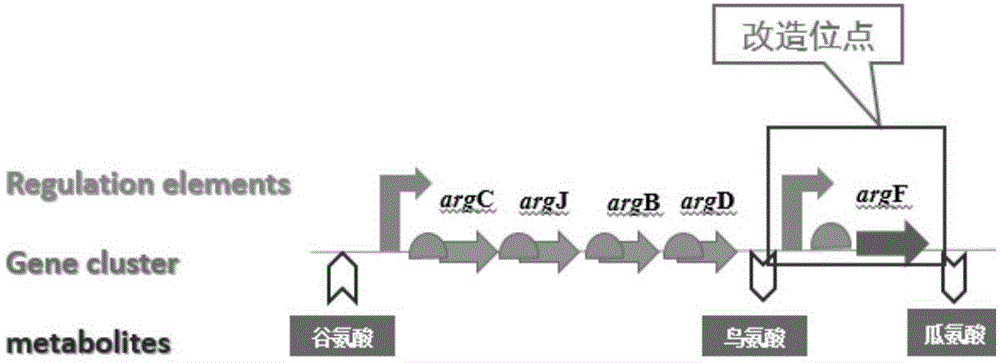
图1为与谷氨酸、瓜氨酸和鸟氨酸代谢密切相关的基因簇结构及改造位点;
图2为谷氨酸棒杆菌关键基因argf上游调控元件经标准元件替换改造后的代谢物积累量。
具体实施方式
下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
我们将典型强度的启动子和典型强度的rbs组合,根据组合调控下egfp表达的荧光蛋白的荧光强度,评价典型强度的启动子与典型强度的rbs的组合效应,分析启动子与rbs对基因表达调控的层级关系以及相互影响。通过以谷氨酸棒杆菌为模式菌株,初步探讨针对同一报告基因,这两个调控元件之间的组合效应,分析启动子和rbs之间存在的可能的层级关系或制约关系,探究这两个元件分别起到的作用,是否它们对应主开关和次开关的地位和作用。
实施例1
启动子序列的获得及表征其强度,包括以下步骤:
在发明人前期研究的基础上,对谷氨酸棒杆菌内源型的启动子序列的基础上,依据谷氨酸棒杆菌启动子的核心位点和碱基序列特征,通过分别对-10延伸区保守序tgngnta(c/t)aatgg及-35区保守序列ttgnca中的碱基的理性改造,得到一系列强度的启动子序列,本发明的启动子序列如下(seqidno.1~5):
p1:ccggaattgacagctggggcgccctcagaggcacaatggccctgcaa
p2:tgagctgttgacaattaatcatcggctcgtataatgtgtggaattgtgagcggataacaatt
p3:tgagctgttgacaattaatcatcgtgtggtaccatgtgtgtgcttgtgagcggataacaatt
p4:tgagctgttgccaattaatcatcgtgtggtaccatgtgtggaattgtgagcggataacaatt
p5:tgagctgttgacaattaatcatcgtgtggtataattgaattgtgagcggataacaatt
上述在启动子序列5’端和3’端分别加上hindiii和bamhi的酶切位点,并合成反向互补链,用寡核苷酸退火法得到启动子双链;利用双酶切将上述启动子序列与探针质粒pdxw-13-egfp连接,并将连接产物转化导入大肠杆菌,得到转化子,并进一步测序,得到一系列启动子重组质粒;将重组质粒转化导入谷氨酸棒杆菌,筛选培养,通过定量检测egfp表达的荧光蛋白的荧光强度表征启动子强度,结果见表1所示。
实施例2:
rbs序列的获得并表征其强度,包括以下步骤:
根据发明人前期研究工作,根据rbs的二级结构特征以及核心保守序列特征,得到若干强度不同的rbs序列,再经过序列优化、删除冗余片段,仅保留核心的最简rbs序列,便于人工合成,本发明的5个rbs序列如下(seqidno.6~10):
r1:cgaattcgtaaagtccaagaaagcatttcaaaagg
r2:caagtcagttaagtactaacaacttagaacttt
r3:gattaaggcacaacgcataaggggggaggcaaag
r4:acactagaaagcgaaggaggtaaaaa
r5:taataactaccaataaaaggaggtacgag
在上述rbs序列前后加上bsai的酶切位点,并合成反向互补链,用寡核苷酸退火法得到rbs双链,用goldengateassembly技术与探针质粒pdxw-13-δbsai-a16-1相连,并转化导入大肠杆菌,得到转化子;并进一步测序,得到一系列的rbs重组质粒,转化导入谷氨酸棒杆菌,筛选培养,通过定量检测egfp表达的荧光蛋白的荧光强度表征rbs强度,结果如表1所示。
实施例3:
构建启动子与rbs联用表达载体并表征其组合强度,包括以下步骤:
将rbs序列插入上述启动子的重组表达载体pdxw-13-δbsai-a16-1,再将载体转化导入大肠肝菌,筛选培养、测序,获得启动子和rbs共同联用的重组表达质粒,将启动子和rbs共同联用的重组表达质粒转化至谷氨酸棒杆菌atcc14067感受态细胞中,筛选获得启动子和rbs共同联用的重组表达菌株,扩大培养启动子和rbs共同联用的重组表达菌株并表征启动子与rbs联用的强度,通过定量检测报告基因egfp表达的荧光蛋白荧光强度表征启动子与rbs联用的组合强度,如表1所示。
可以发现,在标准的启动子和rbs的组合调控下,以荧光蛋白基因(egfp)为目标基因,其强度由最弱的183.9增强到132527.82,强度跨度为720倍,而单一的启动子和rbs单独调控,强度跨度分别为1.4倍和20.8倍。组合调控的效果显著的高于单独元件的调控效果,并且这种调控幅度的增加体现出协同增效的结果。
表1.不同强度的启动子和rbs组合调控下荧光蛋白表达量的比较
实施例4:
在基因组水平实现联合改造,包括以下步骤:
在谷氨酸棒杆菌h-7中对argf基因的上游的调控序列利用本发明中得到的标准启动子和rbs元件进行替换改造,通过调控关键基因argf的表达量对谷氨酸、瓜氨酸和鸟氨酸几种代谢产物的碳流进行精确调控,具体基因簇结构以及对应的氨基酸代谢产物如图1。具体实施步骤如下:提取谷氨酸棒杆菌h-7基因组dna,利用argf-1和argf-6扩增argf基因,以其为模板,用argf-1和argf-2扩增argf基因上游同源臂argf-f,argf-5和argf-6扩增argf基因下游同源臂argf-r,以前期构建的质粒为模板,用argf-3和p-argf-4扩增终止子和启动子片段t+p2+r2(其中t为终止子,p2代表2个不同的启动子,r2代表两个不同的rbs)。以argf-r和t+p2+r2基因片段为模板利用argf-3/argf-6引物对融合pcr扩增出t+p2+r2-argf-r基因片段。再以t+p2+r2-argf-r和argf-f基因片段为模板利用argf-1/argf-6引物对融合pcr扩增出argff-t+p2+r2-argfr基因片段。纯化回收的argff-t+p2+r2-argfr基因片段和质粒pk18mobsacb质粒双酶切连接,转化至大肠杆菌jm109感受态,抗性平板培养筛选转化子,经测序正确,将重组质粒电转至谷氨酸棒杆菌中,经两次同源重组后替换成功。发酵性能见图2。
从各代谢物产量性状可以发现出发菌株能够积累一定水平的谷氨酸、鸟氨酸和瓜氨酸,对关键的基因argf上游调控序列以最弱的启动子(p1)和rbs(r1)替换,得到结果发现瓜氨酸积累量显著降低。更多的碳流滞留在鸟氨酸节点。而对启动子或rbs两个元件之一进行单一元件替换为强元件,即将p1替换为p5,或将r1替换为r5后,结果为p5+r1和p1+r5。这两株单一元件增强的菌株并没有显著提升瓜氨酸的积累量,甚至p1+r5有一定程度的降低,而将两个元件联合替换为标准的强元件p5+r5后,结果体现出显著增加的瓜氨酸积累量,瓜氨酸提高到7.8g/l,是出发菌株的5.1倍,是标准弱启动子和弱rbs(p1+r1)调控下的5.7倍。也较单一替换启动子或rbs的菌株提高了5.6和5.5倍。这一结果充分体现了组合调控在基因组水平的实际应用效果,较单一元件替换的调控幅度得到显著增强。
以上所述实施例仅是为充分说明本发明而所举的较佳的实施例,本发明的保护范围不限于此。本技术领域的技术人员在本发明基础上所作的等同替代或变换,均在本发明的保护范围之内。本发明的保护范围以权利要求书为准。
序列表
<110>江南大学
<120>一种精准调控谷氨酸棒杆菌基因表达的方法
<160>10
<170>siposequencelisting1.0
<210>1
<211>47
<212>dna
<213>(人工序列)
<400>1
ccggaattgacagctggggcgccctcagaggcacaatggccctgcaa47
<210>2
<211>62
<212>dna
<213>(人工序列)
<400>2
tgagctgttgacaattaatcatcggctcgtataatgtgtggaattgtgagcggataacaa60
tt62
<210>3
<211>62
<212>dna
<213>(人工序列)
<400>3
tgagctgttgacaattaatcatcgtgtggtaccatgtgtgtgcttgtgagcggataacaa60
tt62
<210>4
<211>62
<212>dna
<213>(人工序列)
<400>4
tgagctgttgccaattaatcatcgtgtggtaccatgtgtggaattgtgagcggataacaa60
tt62
<210>5
<211>58
<212>dna
<213>(人工序列)
<400>5
tgagctgttgacaattaatcatcgtgtggtataattgaattgtgagcggataacaatt58
<210>6
<211>35
<212>dna
<213>(人工序列)
<400>6
cgaattcgtaaagtccaagaaagcatttcaaaagg35
<210>7
<211>33
<212>dna
<213>(人工序列)
<400>7
caagtcagttaagtactaacaacttagaacttt33
<210>8
<211>34
<212>dna
<213>(人工序列)
<400>8
gattaaggcacaacgcataaggggggaggcaaag34
<210>9
<211>26
<212>dna
<213>(人工序列)
<400>9
acactagaaagcgaaggaggtaaaaa26
<210>10
<211>29
<212>dna
<213>(人工序列)
<400>10
taataactaccaataaaaggaggtacgag29
- 还没有人留言评论。精彩留言会获得点赞!