在薄膜培养装置中快速检测大肠杆菌的制作方法
相关申请的交叉引用本申请要求2017年4月3日提交的美国临时专利申请62/480,630的权益,该专利申请的公开内容以引用方式全文并入本文。
背景技术:
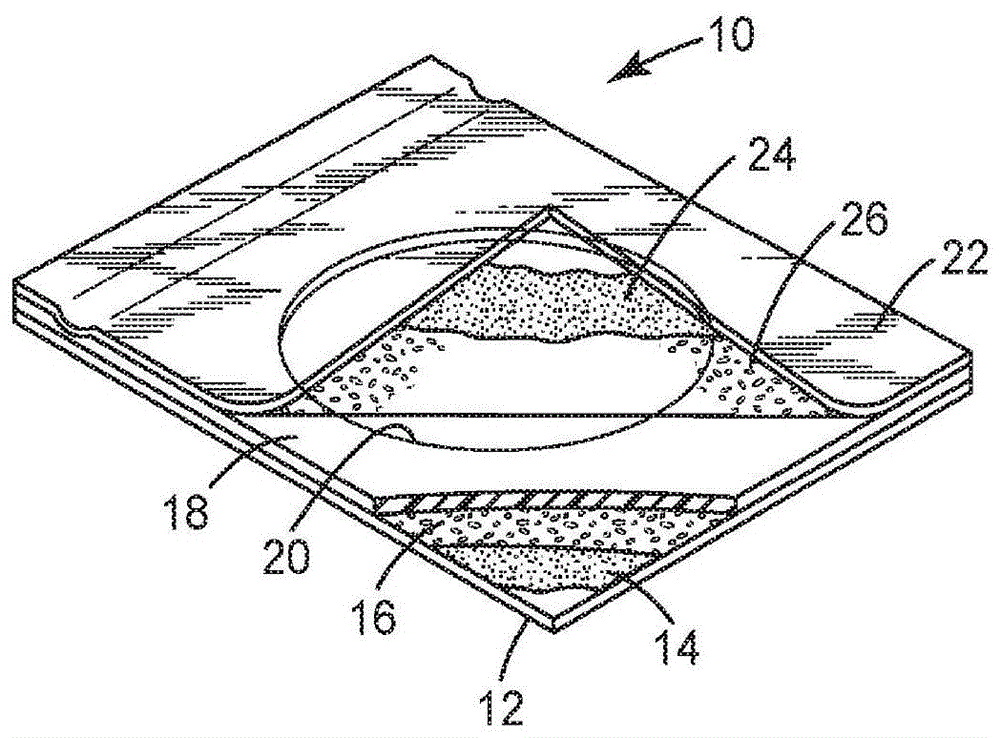
:在食品和饮料安全测试中,大肠型细菌的存在或不存在被认为是质量的重要证据。在世界许多国家,饮料和某些食品(例如乳制品)中允许的大肠型细菌的量受到控制。大肠型细菌包括粪便大肠菌群,诸如大肠杆菌(escherichiacoli)。食品或水样品中存在的粪便大肠菌群被用作食品或水的粪便污染以及可能存在的其他病原微生物的主要指示剂。用于检测、鉴定和/或计数食品样品中的微生物的方法通常根据食品的性质以及可能存在于样品中的微生物的类型而有所不同。用于测试食品样品的方法概要包括由美国公共卫生协会(华盛顿特区(washington,d.c.))公布的第27版增刊“standardmethodsfortheexaminationofdairyproducts(乳品检验标准方法)”,以及由美国食品药品监督管理局(华盛顿特区(washington,d.c.))公布的“bacteriologicalanalyticalmanual(细菌学分析手册)”(“bam”)。通常将固体食品悬浮于含水介质中,并混合和/或研磨以得到可用于微生物定量分析方法中的食品材料的匀浆液。然而,上述方法通常相对昂贵,涉及多个步骤,需要约24小时至48小时的温育时间段才能计数菌落,并且/或者需要相对复杂的仪器和/或相对高度训练的人员。需要用于计数食品和饮料样品中的活大肠菌群和大肠杆菌(e.coli)微生物的更快的方法。技术实现要素:一般来讲,本公开涉及检测和计数样品中的微生物。具体地,本公开涉及可用于在半固体培养基中使大肠型细菌的菌落形成单位(cfu)生长以及差分计数大肠菌群cfu和大肠杆菌cfu的培养装置。本发明培养装置尤其可用于检测和区分弱产气的大肠杆菌的菌落,从而提供对样品中存在的微生物的更准确计数。此外,该装置中使用的培养基比先前的薄膜培养装置更快地检测和计数大肠型细菌和大肠杆菌。本公开还提供了使用培养装置的方法。本文所公开的本发明方法提供大肠菌群和大肠杆菌细菌的生长、检测和区分。与使用薄膜培养装置计数大肠菌群和大肠杆菌菌落的先前方法相比,该方法允许更快且更准确地计数大肠菌群和大肠杆菌菌落。在一个方面,本公开提供一种用于差分计数大肠菌群和大肠杆菌微生物的菌落的装置。该装置可包括不透水的第一片;不透水的第二片,该第二片附接到第一片;干燥的可再水合培养基,该培养基包含粘附到第一片的第一冷水可溶性胶凝剂;微生物生长区,该微生物生长区设置在第一片和第二片之间;乳糖发酵指示剂体系,该乳糖发酵指示剂体系设置在微生物生长区中;β-d-葡糖苷酸酶指示剂体系,该β-d-葡糖苷酸酶指示剂体系设置在生长区中;氧化还原指示剂体系和第二冷水可溶性胶凝剂,该第二冷水可溶性胶凝剂粘附到第二片。培养基可包含促进大肠菌群微生物生长的有机氮营养物质、乳糖发酵指示剂体系、β-d-葡糖苷酸酶指示剂体系、氧化还原指示剂、和有效量的至少一种选择性地抑制非大肠菌群微生物生长的试剂。培养基的粘附到第一片的区域限定生长区。乳糖发酵指示剂体系包含d-乳糖、增强β-半乳糖苷酶产生的第一诱导剂化合物和ph指示剂。β-d-葡糖苷酸酶指示剂体系包含5-溴-4-氯-3-吲哚基-β-d-葡糖苷酸和增强β-葡糖苷酸酶酶活性产生的至少一种化合物。氧化还原指示剂体系优选地包含氯化四唑(ttc)。第一片附接到第二片,使得培养基面向第二冷水可溶性胶凝剂。第一片和第二片被构造成阻滞二氧化碳从其中穿过。在上述实施方案中的任一个实施方案中,该装置包括增强大肠杆菌中的β-葡糖苷酸酶活性的多种化合物,其中多种化合物设置在微生物生长区中。在上述实施方案中的任一个实施方案中,第一片和/或第二片可包括聚酯膜。在上述实施方案中的任一个实施方案中,第二片可包含聚对苯二甲酸乙二醇酯。在上述实施方案中的任一个实施方案中,生长区可由粘附到第一片的间隔物限定。在上述实施方案中的任一个实施方案中,培养基还包含当用含水液体复水时,在介于约6.5和约7.5之间的ph下缓冲培养基的试剂。在上述实施方案中的任一个实施方案中,有机氮营养物质选自酵母提取物、猪蛋白胨、明胶的酶消化物、动物蛋白胨的酶消化物以及上述有机氮营养物质中的任何两种或更多种的组合物。在上述实施方案中的任一个实施方案中,试剂可选自胆汁盐、十二烷基硫酸钠以及它们的组合物。在另一个方面,本公开提供一种差分计数大肠菌群和大肠杆菌微生物的菌落的方法。该方法可包括词语“优选的”和“优选地”是指在某些情况下可提供某些有益效果的本发明实施方案。然而,在相同的情况或其它情况下,其它实施方案也可以是优选的。此外,对一个或多个优选实施方案的表述并不暗示其它实施方案是不可用的,且并非旨在将其它实施方案排除在本发明范围之外。术语“包括”及其变型在说明书和权利要求书中出现这些术语的地方不具有限制的含义。如本文所用,“一个”、“一种”、“所述”、“至少一种(个)”以及“一种(个)或多种(个)”可互换使用。因此,例如,营养素可被理解为“一种或多种”营养素。术语“和/或”意指所列要素中的一个或全部,或者所列要素中的任何两个或更多个的组合。另外,在本文中,通过端点表述的数值范围包含该范围内所含的所有数值(例如,1至5包含1、1.5、2、2.75、3、3.80、4、5等)。本发明的上述
发明内容并非旨在描述本发明的每个公开的实施方案或每种实施方式。以下描述更为具体地举例说明了例示性实施方案。在本申请全文的若干处,通过实施例列表提供了指导,这些实施例能够以各种组合使用。在每种情况下,所引用的列表都只用作代表性的组,并且不应被理解为排他性列表。这些及其它实施方案的附加细节在下文附图和描述中示出。通过具体实施方式、附图和权利要求书,其它特征、目标和优点将变得显而易见。附图说明参考附图可以进一步说明本发明,其中:图1为本公开的优选微生物生长装置的局部剖视顶部透视图;图2为图1的装置的剖视图;图3为可印刷在图1的装置的第一片或第二片上的网格图案的顶视图。尽管上述各图示出了本公开的若干个实施方案,但是如讨论所述,还可以想到其它实施方案。在所有情况下,本公开通过示例性而非限制性的方式介绍本发明。应当理解,本领域的技术人员可以设计出大量其它修改形式和实施方案,这些修改形式和实施方案均落在本发明的范围内并符合本发明原理的实质。附图可不按比例绘制。具体实施方式在详细解释本公开的任何实施方案之前,应当理解,本发明在其应用中不限于下文说明中所提及或下文附图中所示出的构造细节和部件布置方式。本发明能够具有其它实施方案,并且能够以各种方式实践或实施。而且,应当理解,本文使用的措辞和术语是用于说明目的而不应视为限制性的。本文中“包括”、“包含”或“具有”及其变型的使用意指涵盖其后所列举的项目及其等同形式以及附加的项目。除非另外说明或限定,否则术语“连接”和“联接”及其变型均按广义使用,并且涵盖直接和间接这两方面的连接和联接。此外,“连接”和“联接”不限于物理或机械连接或联接。应当理解,在不偏离本公开范围的情况下,可采用其它实施方案并且可进行结构变化或逻辑变化。此外,术语诸如“前部”、“后部”、“顶部”、“底部”等仅用于在元件彼此相关时描述元件,但绝非意在描述设备的具体取向、指示或暗示设备的必要或必需取向、或规定本文所述的本发明在使用时将如何使用、安装、显示或定位。如本文所用,术语微生物的“培养”或“生长”是指通过使微生物体在预定的培养基中在对于其生长有益的条件下繁殖来使其倍增的方法。更具体地,其为提供合适的培养基和条件以有利于微生物的至少一个细胞分裂的方法。培养基是含有微生物生长所需的所有营养物质和必需物理生长参数的固体、半固体或液体介质。如本文所用,术语“富集”是指通过以下方式选择性地富集特定微生物的生长的培养方法:提供具有有利于该特定微生物的生长的特定的和已知属性的介质和条件。富集培养的环境将积极地影响所选微生物的生长,和/或消极地影响其它微生物的生长。本公开大体涉及在含有冷水可溶性胶凝剂的薄膜培养装置中生长以及检测和差分计数大肠菌群和大肠杆菌菌落的方法。“大肠型细菌”共同指代若干个细菌属(例如,柠檬酸杆菌属(citrobacter)、肠杆菌属(enterobacter)、哈夫尼菌属(hafnia)、沙雷氏菌属(serratia)、克雷伯氏菌属(klebsiella)和埃希氏菌属(escherichia))的群组,其具有发酵乳糖以及导致产生酸和气体的能力。大多数大肠型细菌通常被认为对人类为非病原性的。然而,一些大肠型细菌(例如,大肠杆菌)包括具有高度病原性的菌株。大肠菌群存在于哺乳动物的粪便物中,并且通常用作食品和/或水的粪便污染的指示剂。合适的样品材料可得自或源自多种源。术语“源”通常用来指期望测试微生物的食品或非食品。源可为固体、液体、半固体、凝胶状材料、气体(例如空气)以及它们的组合。在一些实施方案中,源可由捕集元件提供,该捕集元件用于例如从感兴趣的表面或者从空气收集该源。在一些实施方案中,液体组合物可包括捕集元件,该捕集元件还可被破碎分开(例如在搅动或溶解过程期间)以增强该源和任何感兴趣的微生物的回收。感兴趣的表面可包括多种表面的至少一部分,该表面包括但不限于壁(包括门)、地板、天花板、排水沟、冷却系统、管道(例如空气管道)、通风孔、马桶座圈、把手、门把手、扶手、工作台面、桌面、用餐表面(例如盘子、碟子等)、工作表面、设备表面、服装等以及它们的组合。该源的全部或一部分可用于该方法中。当使用该源的一部分时,这有时可以被称作该源的“样品”。然而,术语“样品”在本文中通常用来指得自源并被引入测试装置中以用于微生物检测的那部分体积或质量的材料。术语“食品”通常用于指固体、液体(例如,包括但不限于溶液、分散液、乳液、悬浮液等以及它们的组合)和/或半固体可食用组合物。食品的示例包括但不限于肉类、家禽、蛋、鱼、海鲜、蔬菜、水果、预加工食品(例如汤、调味汁、糊)、谷物产品(例如面粉、谷类食品、面包)、罐装食品、乳、其它乳制品(例如奶酪、酸奶、酸奶油)、脂肪、油类、甜点、调味品、香料、面食、饮料、水、啤酒、动物饲料、其它合适的可食用材料以及它们的组合。在美国专利4,565,783中描述了本领域已知的一种类型的薄膜培养装置,该装置包括两个邻接片以及粘附在它们之间的干燥培养基。这些装置可用于生长、检测和计数多种微生物,包括例如总有氧细菌或大肠型细菌。在一个方面,本公开提供一种装置。图1和图2示出根据本公开的装置的一个实施方案。微生物生长装置10包括主体构件,该主体构件包括具有上表面和下表面的自支承防水第一片12。第一片12优选地为诸如聚酯、聚丙烯或聚苯乙烯的材料的相对刚性膜,该材料将不吸收水或不以其它方式受水影响。已发现大约0.1mm至0.18mm厚的聚酯膜、大约0.1mm至0.2mm厚的聚丙烯膜、以及大约0.38mm厚的聚苯乙烯膜极为奏效。其它合适的第一片包括具有聚乙烯或其它防水涂层的印像纸,如美国专利4,565,783中所述。第一片12可为透明的或不透明的,这取决于是否想要透过第一片观察细菌菌落。为了有利于细菌菌落的计数,第一片12可在其上印刷有图案(例如方块网格图案),如图3所示。粘附到第一片12的是包含本文所述的第一冷水可溶性胶凝剂的培养基16。另外(直接或间接地)粘附到装置10的第一片12的是第二片22。第二片22优选地为透明的以有利于计数装置中的细菌菌落,并且细菌和水蒸汽基本上不可渗透。如说明书和权利要求书中所用,“细菌和湿蒸汽基本上不可渗透的”指这样的第二片:在装置运输、储存和使用期间其能防止脱水培养基的不期望污染(例如,微生物污染),并且其提供将在温育时间段期间支持微生物生长的环境。第一片12和第二片22被构造成阻滞二氧化碳从其中穿过。通常,第二片22将具有类似于第一片12的特性,但无需为刚性的。用于第二片的合适的材料包括具有比40μm厚双轴向取向的聚丙烯(bopp)更低的二氧化碳渗透性的膜(例如聚酯膜)。约40μm至70μm厚的聚对苯二甲酸乙二醇酯(pet)是高度适用作第二片22的材料的一个示例。pet的密度(例如,约1.38g/mm3)高于bopp的密度(例如,约0.92g/mm3)。第一片12任选地在其主表面中的一个主表面上涂覆有粘合剂层14,该粘合剂层用于将干燥的可再水合培养基16以均匀的单层形式保持在第一片上。虽然培养基16是可再水合的,但在优选的情况下,无需再水合,尽管其通常不是有害的。粘合剂14(当使用时)和粘合剂24优选地为水不溶性的并且不抑制微生物的生长。优选地,粘合剂在润湿时是充分透明的,以使得能够透过涂覆有粘合剂的膜观察细菌菌落。用于粘合剂14和粘合剂24的合适的粘合剂包括例如压敏粘合剂。然而,还可使用热活化粘合剂,其中较低熔点物质涂覆到较高熔点物质上。水活化粘合剂诸如粘胶也可能是有用的。粘合剂14应当以基本上不干扰或阻止观察(例如,手动或机械观察)在装置中生长的微生物菌落和/或基本上不干扰或阻止用于观察微生物菌落的电磁辐射(例如可见光)的透射的厚度涂覆到第一片12上。适用于本公开的装置中的粘合剂的非限制性示例为丙烯酸异辛酯/丙烯酰胺的共聚物(摩尔比为94/6)。可使用的其它压敏粘合剂包括丙烯酸异辛酯/丙烯酸(摩尔比为95/5或94/6)和硅橡胶。在暴露于水时变成乳状的粘合剂是次优选的,但可结合不透明的第一片使用或在不要求菌落可视化的情况下使用。涂覆到任选的粘合剂14的至少一部分上和/或直接涂覆到第一片12上的是包含干燥的可再水合培养基16的涂层。干燥培养基16基本上不含水。如说明书和权利要求书中所用,短语“基本上不含水的”指这样的涂层:一旦已允许所述涂层与周围环境平衡,它的水含量就不大于脱水涂层的大致水含量。期望干燥培养基16的均匀单层以确保再水合培养基的均匀性。干燥的可再水合培养基应具有暴露于微生物生长区中的足够的表面区域以用于在使用期间水合。通常,厚度在约5μm至约13μm范围内的粘合剂层是合适的。作为图1和图2的例示性实施方案的替代形式,设想本公开的装置可包括其上设置有培养基的基座,并且可以类似于美国专利6,632,661中所公开的培养装置的方式组装;该文献全文以引用方式并入本文。如图所示,第二片22涂覆有粘合剂24和粉末26的层。粘合剂24应当以基本上不干扰或阻止观察(例如,手动或机械观察)在装置中生长的微生物菌落和/或基本上不干扰或阻止用于观察微生物菌落的电磁辐射(例如可见光)的透射的厚度涂覆到第二片22上。通常,厚度在约5μm至约13μm范围内的粘合剂层是合适的。粉末26包含干燥的第二冷水可溶性胶凝剂。第二冷水可溶性胶凝剂具有类似于第一冷水可溶性胶凝剂的特性,并且可包括与第一冷水可溶性胶凝剂相同的冷水可溶性胶凝剂。粉末26粘附到第二片22(例如,粘附到粘合剂24,该粘合剂粘附到第二片22)。粉末26涂覆到粘合剂24上,如美国专利4,565,783中所述。干粉26的均匀单层是优选的。粉末26应具有暴露于微生物生长区中的足够的表面区域,以与干燥培养基16协同作用,以吸收在装置使用期间沉积在生长区中的预定体积的含水液体。如说明书和权利要求书中所用,术语“粉末”指具有小于400微米的平均直径的细碎颗粒材料。如说明书和权利要求书中所用,术语“冷水溶性”指在室温下形成水溶液的材料。微生物生长区是装置中的区域,在装置接种期间将样品置于该区域中。第一片12和第二片22包封微生物生长区,其中培养基16和粉末26在微生物生长区中面向彼此。通常,微生物生长区与第一片12和第二片22的边缘间隔开,以便防止样品污染和/或防止样品渗漏出装置。在将含水液体(例如,含有待测试的样品)置于微生物生长区中之后,微生物生长区中干燥的可再水合培养基16和粉末26被液体水合以形成半固体培养基以用于生长大肠型细菌菌落。微生物生长区不含防止细菌菌落可视化的基质。在任一实施方案中,微生物生长区任选地由施加到第一片12的表面的间隔元件限定,干燥培养基16涂覆到该第一片的表面上。间隔元件包括一片间隔物18,该间隔物具有穿过中心以暴露干燥培养基16的孔20(例如,圆形孔、方形孔、矩形孔)。孔20的壁提供预定大小和形状的井凹以限定水合后的培养基。间隔物18应足够厚以形成期望体积的井凹,例如约1毫升、约2毫升、约3毫米或约5毫升。聚乙烯闭孔泡沫是间隔物18的合适材料的一个示例,但可使用任何疏水性(非湿润性)、对微生物惰性且能够承受灭菌的材料。孔20在培养装置中形成微生物生长区的周边。在接收到期望(预定)体积时,该装置形成促进大肠菌群菌落生长和计数的水合培养基。干燥的可再水合培养基16包含有利于大肠菌群微生物生长的有机氮营养物质、有效量的至少一种选择性地抑制非大肠菌群微生物生长的试剂、和第一冷水可溶性胶凝剂。培养基16的有机氮营养物质提供快速恢复(例如,由热应激、ph应激、水应激)和大肠菌群微生物的生长。有机氮营养物质提供例如氨基酸和/或低聚肽和/或维生素。在根据本公开的装置的任一实施方案中,合适的有机氮营养物质的非限制性示例包括酵母提取物、猪蛋白胨、明胶的酶消化物、动物蛋白胨的酶消化物以及上述有机氮营养物质中的任何两种或更多种的组合物。本公开的装置的培养基16包含有效量的至少一种选择性地抑制非大肠菌群微生物生长的试剂。在本公开的装置中,试剂相对于至少一种非大肠菌群微生物为大肠菌群微生物的生长提供竞争优势。此类筛选剂(包括例如抗生素)是本领域的普通技术人员所熟知的。在任一实施方案中,试剂包括胆汁盐、十二烷基硫酸钠、或胆汁盐和十二烷基硫酸钠的组合。选择有效量,使得当在生长区中沉积预定体积的含水液体时,再水合培养基具有一定浓度的至少一种试剂,该浓度足够高以选择性地抑制非大肠菌群微生物的生长,但不太高以致于其基本上抑制大肠菌群微生物的生长(即,在约37℃至约45℃的温度下温育约24小时内,大肠菌群微生物形成可观察且可鉴定的菌落)。本公开的装置的培养基16是冷水可溶性的。用于本发明的装置中的“冷水溶解度”的培养基包含培养基中的第一冷水可溶性胶凝剂。包含在培养基16中的合适的第一冷水可溶性胶凝剂包括在室温下形成水溶液的天然胶凝剂和合成胶凝剂两者。凝胶剂,诸如聚丙烯酰胺、刺槐豆胶和琼脂例如在室温下形成水溶液,并且为用于提供根据本公开的“冷水可溶性”干燥的可再水合培养基的合适第一冷水可溶性胶凝剂。用于培养基l6的优选的第一冷水可溶性胶凝剂包括例如瓜尔胶和黄原胶,这些胶凝剂可单独使用或彼此组合使用,并且与其它冷水可溶性胶凝剂组合使用。用于大肠菌群微生物生长的有机氮营养物质在室温下形成水溶液。在将培养基涂覆到第一片上并在其上干燥之后,粘附到第一片的干燥培养基具有涂布量。选择干燥培养基的涂布量,使得当用预定体积的含水液体(例如包含大肠菌群和大肠杆菌微生物的待测试样品的含水液体)再水合生长区时,再水合培养基具有适当浓度的每种成分以促进大肠菌群和大肠杆菌微生物的生长和差分计数。在任一实施方案中,粘附到第一片的干燥培养基的涂布量可为约130mg/100cm2至约195mg/100cm2。根据本公开的装置的干燥的可再水合培养基包含设置在微生物生长区中的乳糖发酵指示剂体系。乳糖发酵指示剂体系提供了在装置中生长的大肠型细菌的菌落的两个指示:由于乳糖发酵而产生的第一指示(酸产生)和由于乳糖发酵而产生的第二指示(气体产生)。由乳糖发酵产生酸和气体(co2)两者证实了在装置中生长的大肠菌群微生物的菌落的存在。因此,乳糖发酵指示剂体系包含d-乳糖和ph指示剂。ph指示剂具有约7.0的过渡范围。合适的ph指示剂包括例如磺酞ph指示剂,诸如酚红和氯酚红。乳糖发酵指示剂体系还包含第一诱导剂化合物,其增强了用于利用乳糖的酶(例如β-半乳糖苷酶)的产量。合适的第一诱导剂化合物的非限制性示例包括异丙基-β-d-硫代半乳糖苷(iptg)和苯基-β-d-半乳糖苷。乳糖发酵指示剂体系(例如,在干燥的可再水合培养基中)设置在培养装置的微生物生长区中。因此,在任一实施方案中,可在将培养基涂覆到第一片12和/或第一粘合剂14上之前,将乳糖发酵指示剂体系的组分中的至少一种组分添加到培养基中。另选地,可将乳糖发酵指示剂体系的至少一种组分包含在含水液体(例如,水、缓冲液和/或样品)中,当再水合培养基以供使用时,将该含水液体沉积到微生物生长区中或上。在其中乳糖设置在干燥培养基中的装置中的任一实施方案中,乳糖以约8.5mg/100cm2至约27mg/100cm2的涂布量存在于干燥培养基中。根据本公开的装置的干燥的可再水合培养基包含设置在微生物生长区中的β-d-葡糖苷酸酶指示剂体系。β-d-葡糖苷酸酶指示剂体系提供了产生β-d-葡糖苷酸酶酶活性的菌落(诸如大肠杆菌菌落)的指示。因此,β-d-葡糖苷酸酶指示剂体系提供了一种将存在于装置中的大肠杆菌菌落与存在于该装置中的非大肠杆菌-大肠菌群菌落进行区分的方法。因此,β-d-葡糖苷酸酶指示剂体系包含显色β-d-葡糖苷酸酶酶底物。β-d-葡糖苷酸酶指示剂体系还包含增强大肠杆菌中β-葡糖苷酸酶活性的至少一种化合物。增强大肠杆菌中β-葡糖苷酸酶酶活性的合适化合物的非限制性示例包括甲基-β-d-葡糖苷酸、苯基-β-d-葡糖苷酸和d-葡糖醛酸。在任一实施方案中,β-d-葡糖苷酸酶指示剂体系包含增强大肠杆菌中的β-葡糖苷酸酶酶活性的多种化合物。在任一实施方案中,增强大肠杆菌中β-葡糖苷酸酶酶活性的第一化合物选自甲基-β-d-葡糖苷酸和苯基-β-d-葡糖苷酸。在任一实施方案中,增强大肠杆菌中β-葡糖苷酸酶酶活性的第二化合物为d-葡糖醛酸。令人惊讶的是,具有增强大肠杆菌中β-葡糖苷酸酶酶活性的第一化合物和第二化合物的组合的装置在许多情况下能够更好地检测β-葡糖苷酸酶阳性大肠杆菌。这一点以前没有报告过。不受理论的约束,据信增强大肠杆菌中β-葡糖苷酸酶酶活性的多种化合物中的至少一种化合物可诱导细胞产生更多的β-葡糖苷酸酶酶。另选地或除此之外,增强大肠杆菌中β-葡糖苷酸酶酶活性的多种化合物中的至少一种化合物可增强β-葡糖苷酸酶酶分子在与显色酶底物(例如,5-溴-4-氯-3-吲哚基-β-d-葡糖苷酸)反应时的活性。将β-d-葡糖苷酸酶指示剂体系(例如,在干燥的可再水合培养基中)设置在培养装置的微生物生长区中。因此,在任一实施方案中,可在将培养基涂覆到第一片12和/或第一粘合剂14上之前,将β-d-葡糖苷酸酶指示剂体系的组分中的至少一种组分添加到培养基中。另选地,可将β-d-葡糖苷酸酶指示剂体系的至少一种组分包含在含水液体(例如,水、缓冲液和/或样品)中,当再水合培养基以供使用时,将该含水液体沉积到微生物生长区中或上。在任一实施方案中,本公开的装置可任选地包括设置在微生物生长区中的d-葡糖醛酸。d-葡糖醛酸有利于通过促进观察菌落中β-葡糖苷酸酶酶活性产物来快速检测和鉴定一些大肠杆菌微生物菌落。将d-葡糖醛酸(例如,在干燥的可再水合培养基中)设置在培养装置的微生物生长区中。因此,在任一实施方案中,可在将培养基涂覆到第一片12和/或第一粘合剂14上之前,将d-葡糖醛酸的组分中的至少一种组分添加到培养基中。另选地,可将d-葡糖醛酸包含在含水液体(例如,水、缓冲液和/或样品)中,当再水合培养基以供使用时,将该含水液体沉积到微生物生长区中或上。在任一实施方案中,本公开的装置可包括当培养基在使用期间用含水液体复水时缓冲培养基的试剂。试剂可在介于约6.5和7.5之间的ph下缓冲培养基(当在使用期间水合时)。用于缓冲培养基的合适试剂的非限制性示例为磷酸盐(例如na2hpo4、nah2po4、k2hpo4、kh2po4,或上述试剂中的任何两种或更多种试剂的组合)。将试剂(例如,在干燥的可再水合培养基中)设置在培养装置的微生物生长区中。因此,在任一实施方案中,可在将培养基涂覆到第一片12和/或第一粘合剂14上之前将试剂添加到培养基中。另选地,可将试剂包含在含水液体(例如,水、缓冲液和/或样品)中,当再水合培养基以供使用时,将该含水液体沉积到微生物生长区中或上。培养基的组分可在含水液体中混合在一起并涂覆到第一片上,例如,如美国专利4,565,783的实施例12中所述。在将培养基涂覆到第一片上之后,将培养基层干燥,直至其基本上不含水。任选地,在将培养基涂覆到第一片上之前,第一片涂覆有如本文所公开的粘合剂层。然后,将培养基涂覆到粘合剂层上并干燥,直至培养基层基本上不含水。在任一实施方案中,可能期望的是将非特异性指示剂(例如,染料)掺入微生物生长区中,以便指示在该装置中生长的微生物菌落的存在。在一些实施方案中,指示剂可掺入培养基16中。另选地,可将指示剂掺入粘合剂14中。合适的指示剂是由生长的微生物代谢的那些以及引起菌落着色以更易于可视化的那些。此类指示剂的示例包括氯化三苯基四唑、对甲苯基四唑红、四唑紫、藜芦基四唑蓝和相关染料。任选地,在任一实施方案中,本公开的装置还包括设置在微生物生长区中的粉末状婴儿配方食品。婴儿配方食品可作为干燥培养基的组分提供在生长区中,或者另选地,其可与粘附到第二片上的粘合剂层24的第二冷水可溶性胶凝剂混合。婴儿配方食品提供可促进大肠菌群微生物生长的多种营养物质(例如蛋白质、碳水化合物、矿物质和维生素)。适用于本公开的装置中的粉末状婴儿配方食品的非限制性示例是购自新泽西州弗洛勒姆帕克的雀巢婴儿营养公司(nestleinfantnutrition;florhampark,nj)的goodgentle(阶段1)。在其中婴儿配方食品设置在干燥培养基中的装置中的任一实施方案中,婴儿配方食品以至多约27mg/100cm2的涂布量存在于干燥培养基中。在任一实施方案中,婴儿配方食品可以至多约14mg/100cm2的涂布量存在于干燥培养基中。在任一实施方案中,婴儿配方食品可以至多约19mg/100cm2的涂布量存在于干燥培养基中。已使用薄膜培养装置来生长和计数微生物(例如,病原性大肠杆菌的物种)的菌落,并且随后菌落被转移(例如,“印迹”)到膜上以用于鉴定微生物,例如,如美国专利5,137,812中所述;该文献全文以引用方式并入本文。设想在一些实施方案中,根据本公开的薄膜培养装置也可用于生长和计数微生物的菌落,该菌落随后被转移(例如,“印迹”)到膜上以用于鉴定微生物。在任一实施方案中,本公开的培养装置可包括粘附到第一片的干燥的可再水合培养基,其中干燥的可再水合培养基包含表1中所列的组分。表1:本公开的示例性干燥的可再水合培养基组分的列表。组分酵母提取物猪蛋白胨酚红胆汁盐十二烷基硫酸钠mgcl2乳糖甲基葡糖苷酸d-葡糖醛酸bcigk2hpo4kh2po4婴儿配方食品粉末明胶的酶消化物动物组织的酶消化物柠檬酸铁铵cacl2iptg重新提取的瓜尔胶在另一个方面,本公开提供一种差分计数大肠菌群和大肠杆菌微生物的菌落的方法。该方法包括将样品和含水液体在本公开的培养装置的任一实施方案的微生物生长区中接触以形成经接种的培养装置。在任一实施方案中,样品可包括含水液体。一般来讲,选择胶凝剂;指示剂;和干燥培养装置在微生物生长区中的量,以提供有效浓度,从而用于当它们(即胶凝剂、指示剂和营养物质)用预定体积(例如,1毫升、2毫升、5毫升)的含水液体复水时,检测和区分大肠型细菌和大肠杆菌的菌落。在任一实施方案中,含水液体可与样品材料一起添加(例如,样品材料可被溶解、均化、悬浮和/或稀释在含水液体诸如例如无菌水、含水缓冲液或含水营养培养基中)。在任一实施方案中,其中样品包括固体材料(例如,在其上或其中具有保留材料的膜过滤器)或半固体材料,预定体积的液体(例如,无菌水、含水营养培养基)可用于在将固体或半固体样品用于接种培养装置之前或之后复水该装置。将具体参考图1和图2的装置来讨论本发明的装置的使用。为了将图1和图3的装置用作倾注平板,将第二片22向后拉,并将预定量的水或含水测试样品置于由间隔构件18限定的微生物生长区中的第一片12上。通过粘合剂14粘附到第一片12的干燥培养基16的组分被快速水合或溶解,并且形成营养凝胶。然后将第二片22替换在第一片上,并且将加重板置于顶部上以将样品完全铺展在整个微生物生长区中。然后将装置温育预定的时间段。可使用本领域已知的方法(例如,通过倾倒或将液体样品移取到培养装置中)来使样品与培养装置的微生物生长区接触。在任一实施方案中,第二片通常被提起(例如,如图1所示)以允许样品在第一片和第二片之间沉积;优选地,沉积到培养装置中的间隔物的孔(如果存在)中。在任一实施方案中,将样品与含水液体和胶凝剂在微生物生长区中接触,形成经接种的培养装置。在形成经接种的培养装置之后,放低第二片以在温育期间形成对抗污染和/或防止含水液体过度蒸发的保护屏障。在任一实施方案中,样品可例如通过将加重板置于被覆盖装置的顶部上而均匀铺展在整个微生物生长区上。在任一实施方案中,该方法还包括将经接种的培养装置(例如,在温度受控环境室中)温育一时间段。温育条件(例如,温育温度)可影响样品中存在的大肠型细菌的生长速率。本领域的普通技术人员将认识到检测大肠型细菌的合适的温育温度。本公开的经接种的培养装置可例如在约35℃至约45℃(例如包括35℃和45℃)的温度下温育。在任一实施方案中,培养装置可在有氧(例如,正常大气)气体环境中温育。将经接种的培养装置温育足够允许大肠型细菌生长的时间段。检测大肠型细菌所需的最小温育时间段与培养装置温育的温度相关。例如,在其中培养装置在约35°下温育的任一实施方案中,该时间段可为约12小时至约24小时,包括端值在内。在其中培养装置在约42°下温育的任一实施方案中,该时间段可为约8小时至约18小时,包括端值在内。在其中培养装置在约42°下温育的任一实施方案中,该时间段可为约8小时至约12小时,包括端值在内。本公开的方法还包括在培养装置中检测大肠型细菌的菌落和/或检测大肠杆菌细菌的菌落(例如,观察培养装置中大肠型细菌的菌落和/或检测大肠杆菌细菌的菌落)。在任一实施方案中,检测培养装置中的大肠型细菌的菌落可包括在培养装置中检测与指示剂体系中的至少一个指示剂体系(例如,乳糖发酵指示剂体系和β-d-葡糖苷酸酶指示剂体系)反应的菌落。大肠型细菌的菌落通过其将乳糖发酵成酸和气态最终产物的能力来区分。因此,检测大肠菌群菌落包括观察接近菌落(例如,在菌落的周边的约1mm至2mm内)的酸区(如装置中的ph指示剂所证明;例如,其中ph指示剂为酚红的黄色区),以及还观察截留在邻近菌落(例如,接触菌落的周边或在菌落的周边的约1mm内)的半固体培养基中的气泡。除了观察邻近菌落的酸区和一个或多个气泡之外,检测和区分大肠杆菌细菌的菌落还包括检测β-葡糖苷酸酶酶活性的产物。例如,当β-葡糖苷酸酶指示剂体系包含bcig时,大肠杆菌菌落将呈现为蓝色(或蓝绿色),具有或不具有围绕菌落中的每个菌落的小蓝色(或浅蓝色)区。在任一实施方案中,本公开的方法还包括在温育经接种的培养装置之后,计数经接种的培养装置中大肠型细菌的菌落(如果存在)和大肠杆菌的菌落(如果存在)。因此,在如本文所述检测大肠菌群和大肠杆菌细菌的菌落之后,手动或使用本领域已知的自动化方法(例如,使用自动化菌落计数器,诸如例如购自明尼苏达州圣保罗的3m公司(3mcompany;st.paul,mn)的petrifilm平板读取器)测定所检测菌落的数目示例性实施方案实施方案a为一种用于差分计数大肠菌群和大肠杆菌微生物的菌落的装置,所述装置包括:不透水的第一片;不透水的第二片,所述第二片附接到所述第一片;干燥的可再水合培养基,所述培养基粘附到所述第一片;其中所述培养基包含:有机氮营养物质,所述有机氮营养物质促进大肠菌群微生物生长;乳糖发酵指示剂体系,所述乳糖发酵指示剂体系包含d-乳糖、增强β-半乳糖苷酶产生的第一诱导剂化合物和ph指示剂;β-d-葡糖苷酸酶指示剂体系,所述β-d-葡糖苷酸酶指示剂体系包含5-溴-4-氯-3-吲哚基-β-d-葡糖苷酸和增强大肠杆菌中的β-葡糖苷酸酶活性的至少一种化合物;氧化还原指示剂;有效量的至少一种试剂,所述试剂选择性地抑制非大肠菌群微生物生长;和第一冷水可溶性胶凝剂;微生物生长区,所述微生物生长区设置在所述第一片和所述第二片之间,其中所述培养基的粘附到所述第一片的区域限定所述生长区;和第二冷水可溶性胶凝剂,所述第二冷水可溶性胶凝剂粘附到所述第二片;其中所述第一片附接到所述第二片,使得所述培养基面向所述第二冷水可溶性胶凝剂;其中所述第一片和所述第二片被构造成阻滞二氧化碳从其中穿过。实施方案b为根据实施方案a所述的装置,所述装置还包括设置在所述微生物生长区中的d-葡糖醛酸。实施方案c为根据实施方案a或实施方案b所述的装置,其中所述第一片包括聚酯膜。实施方案d为根据前述实施方案中任一项所述的装置,其中所述第二片包括聚酯膜。实施方案e为根据实施方案d所述的装置,其中所述第二片包含聚对苯二甲酸乙二醇酯。实施方案f为根据前述实施方案中任一项所述的装置,其中所述生长区由粘附到所述第一片的间隔物限定。实施方案g为根据前述实施方案中任一项所述的装置,其中所述冷水可溶性胶凝剂包括瓜尔胶。实施方案h为根据前述实施方案中任一项所述的装置,其中粘附到所述第一片的所述培养基具有约130mg/100cm2至约195mg/100cm2的涂布量。实施方案i为根据前述实施方案中任一项所述的装置,其中乳糖设置在粘附到所述第一片的所述干燥培养基中,其中所述乳糖以约8.5mg/100cm2至约27mg/100cm2的涂布量存在于所述干燥培养基中。实施方案j为根据前述实施方案中任一项所述的装置,其中所述培养基还包含当用含水液体复水时,在介于约6.5和约7.5之间的ph下缓冲所述培养基的试剂。实施方案k为根据前述实施方案中任一项所述的装置,其中所述ph指示剂包括磺酞ph指示剂。实施方案l为根据实施方案k所述的装置,其中所述ph指示剂选自氯酚红和酚红。实施方案m为根据前述实施方案中任一项所述的装置,其中所述有机氮营养物质选自酵母提取物、猪蛋白胨、明胶的酶消化物、动物蛋白胨的酶消化物以及上述有机氮营养物质中的任何两种或更多种的组合物。实施方案n为根据前述实施方案中任一项所述的装置,其中所述生长区被构造成接收具有约1毫升至约5毫升的预定体积的含水液体,并且在接收到所述预定体积时,形成促进大肠菌群菌落生长和计数的水合培养基。实施方案o为根据前述权利要求中任一项所述的装置,其中所述试剂选自胆汁盐、十二烷基硫酸钠以及它们的组合物。实施方案p为根据前述权利要求中任一项所述的装置,其中所述第二冷水可溶性胶凝剂以干燥颗粒或干燥团聚颗粒的形式设置在第二膜薄片上。实施方案q为根据前述实施方案中任一项所述的装置,其中增强β-半乳糖苷酶产生的所述第一诱导剂化合物包括异丙基-β-d-硫代半乳糖苷。实施方案r为根据前述实施方案中任一项所述的装置,其中β-d-葡糖苷酸酶指示剂体系包含增强大肠杆菌中的β-葡糖苷酸酶酶活性的多种化合物。实施方案s为根据实施方案r所述的装置,其中增强大肠杆菌中的β-葡糖苷酸酶酶活性的所述多种化合物中的第一化合物选自甲基-β-d-葡糖苷酸和苯基-β-d-葡糖苷酸。实施方案t为根据实施方案r或实施方案s所述的装置,其中增强大肠杆菌中的β-葡糖苷酸酶酶活性的所述多种化合物中的第二化合物为d-葡糖醛酸。实施方案u为根据前述实施方案中任一项所述的装置,所述装置还包括设置在所述微生物生长区中的干燥婴儿配方食品。实施方案v为一种方法,所述方法包括:将样品和含水液体在本公开的培养装置的任一实施方案的微生物生长区中接触以形成经接种的培养装置;在介于35℃和45℃之间的温度下将所述经接种的培养装置温育一时间段;观察细菌菌落的所述微生物生长区;观察邻近所述细菌菌落的所述微生物生长区,以检测邻近所述菌落的周边的酸区的指示;观察邻近所述细菌菌落的所述微生物生长区和所述细菌菌落,以检测所述菌落内或邻近所述菌落的所述周边的β-葡糖苷酸酶活性的指示;以及观察通过β葡糖苷酸酶非产生细菌将ttc还原成甲臜。实施方案w为根据实施方案v所述的方法,其中将所述经接种的培养装置温育一时间段包括将所述经接种的培养装置温育约12小时至约24小时的时间段,其中观察所述微生物生长区包括在所述时间段之后4小时内观察所述微生物生长区。实施方案x为根据实施方案v或实施方案w所述的方法,其中检测所述酸区或检测邻近所述菌落的所述周边的β-葡糖苷酸酶活性的指示包括检测所述酸区或检测在所述菌落的所述周边的1mm内的指示。实施方案y为根据实施方案v至x中任一项所述的方法,所述方法还包括观察邻近所述细菌菌落的所述微生物生长区以检测气泡。实施方案z为根据实施方案y所述的方法,其中检测邻近所述菌落的所述周边的所述气泡包括检测所述菌落的所述周边的1mm内的所述气泡。实施方案aa为根据实施方案v至z中任一项所述的方法,所述方法还包括计数菌落的第一数目,所述菌落具有酸区和邻近所述菌落的气泡两者。实施方案aa为根据实施方案v至z中任一项所述的方法,所述方法还包括计数菌落的第二数目,所述菌落具有酸区和邻近所述菌落的气泡,并且还在所述菌落内或附近具有β-葡糖苷酸酶活性的指示。以下实施例进一步说明了本发明的目的和优点,但这些实施例中列举的具体材料及其量以及其它条件和细节不应被解释为是对本发明的不当限制。实施例实施例1至9:微生物检测制品的制造。培养基的制备:在单独的容器中制备表2和表3中所示的混合物。用去离子水将混合物的液体体积升至1000ml。第一片的制备:表2和表3中所示的混合物通过首先将瓜尔胶添加到水中并用桨叶搅拌15分钟以溶胀胶凝剂来制备。之后,添加剩余组分,同时继续搅拌。然后将混合物加热至80℃持续几分钟,伴随持续混合,以便巴斯德灭菌该混合物,并且完成溶解,并且均匀分布混合物中的组分。在加热步骤之后,允许混合物冷却至环境温度。将混合物储存在4℃下直至使用。将液体混合物升温至环境温度并涂覆到聚酯膜上,并且如美国专利4,565,783的实施例11中所公开的那样干燥涂覆的层。涂覆到单独膜上的每个单独培养基的干燥涂布量为大约0.2g/155cm2至0.3g/155cm2。将涂覆的片切割成10.2cm×7.6cm的矩形。使用得自伊利诺伊州绍姆堡的美国富士密封件公司(americanfijiseal(shaumberg,il))的聚苯乙烯泡沫(0.51mm厚)来制备间隔元件。将泡沫片的一侧粘附到涂覆有粘合剂(3m927转移粘合剂)的剥离衬垫。从泡沫片冲切圆圈(大约6cm直径)。将泡沫片切割成10.2cm×7.6cm的矩形,其中圆形孔大致在矩形中居中。移除剥离衬垫,并且将间隔元件(经由泡沫片上的粘合剂)粘附到干燥的涂覆培养基的片,使得培养基暴露于泡沫片的圆形开口中。第二片的制备:按照us4,565,783的实施例11中所描述的程序,用含有三苯基氯化四唑(ttc,物料编号17779;密苏里州圣路易斯的西格玛化学公司(sigmachemicalco.;st.louis,mo))的粘合剂(3m927转移粘合剂)涂覆聚对苯二甲酸乙二醇酯(pet,0.074mm厚)。随后用瓜尔胶粉末涂覆被粘合剂涂覆的bopp膜,如美国专利4,565,783的实施例11中所述。将第二片切割成10.6cm×7.6cm的矩形。培养装置的组装:沿着泡沫间隔物的边缘中的一个边缘(沿着较窄的尺寸)将双面胶带施加在第一片中的每个第一片上。将第二片叠加在第一片上(如图1所示),使得第二片的涂覆的表面面向粘附到第一片的泡沫间隔物,并且将片压在一起以将第二片固定到双面胶带。表2:培养基。表中的所有值均以克为单位报告。将每种混合物溶解于总共1000ml去离子水中。表3:培养基。表中的所有值均以克为单位报告。将每种混合物溶解于总共1000ml去离子水中。实施例1:通过将涂覆有培养基87的第一片粘附到如上所述制备的第二片来制备装置。实施例2:通过将涂覆有培养基88的第一片粘附到如上所述制备的第二片来制备装置。实施例3:通过将涂覆有培养基89的第一片粘附到如上所述制备的第二片来制备装置。实施例4:通过将涂覆有培养基85的第一片粘附到如上所述制备的第二片来制备装置。实施例5:通过将涂覆有培养基90的第一片粘附到如上所述制备的第二片来制备装置。实施例6:通过将涂覆有培养基59的第一片粘附到如上所述制备的第二片来制备装置。实施例7:通过将涂覆有培养基60的第一片粘附到如上所述制备的第二片来制备装置。实施例8:通过将涂覆有培养基61的第一片粘附到如上所述制备的第二片来制备装置。实施例9:通过将涂覆有培养基62的第一片粘附到如上所述制备的第二片来制备装置。比较例1至9:如上文针对实施例1至9所述制备比较例培养装置,不同的是对于比较例,用于第二片的材料为双轴向取向聚丙烯(bopp,0.04mm厚)而不是pet膜。比较例1:通过将涂覆有培养基87的第一片粘附到如上所述制备的第二片来制备装置。比较例2:通过将涂覆有培养基88的第一片粘附到如上所述制备的第二片来制备装置。比较例3:通过将涂覆有培养基89的第一片粘附到如上所述制备的第二片来制备装置。比较例4:通过将涂覆有培养基84的第一片粘附到如上所述制备的第二片来制备装置。比较例5:通过将涂覆有培养基90的第一片粘附到如上所述制备的第二片来制备装置。比较例6:通过将涂覆有培养基59的第一片粘附到如上所述制备的第二片来制备装置。比较例7:通过将涂覆有培养基60的第一片粘附到如上所述制备的第二片来制备装置。比较例8:通过将涂覆有培养基61的第一片粘附到如上所述制备的第二片来制备装置。比较例9:通过将涂覆有培养基62的第一片粘附到如上所述制备的第二片来制备装置。实施例10:使用培养装置生长和计数大肠菌群或大肠杆菌菌落。将大肠杆菌fr8储存于甘油中直至使用,该大肠杆菌fr8是一种分离自食品的天然大肠杆菌菌株,当其在发酵乳糖时表现出弱气体产生。根据需要将大肠杆菌fr8的过夜培养物连续稀释于巴特菲尔德磷酸缓冲液中以在培养装置上(实施例1至9和比较例1至9)提供可计数的菌落(例如,15cfu/ml至150cfu/ml)。将1ml稀释的样品接种到原型板上。将经接种的平板在两个温度(35℃和42℃)下温育,并且在24小时±6小时观察平板。作为对照,根据制造商的说明,将稀释的培养物接种到3mtmpetrifilmtm大肠杆菌/大肠菌群计数平板(pfec)(得自明尼苏达州圣保罗的3m保健公司(3mhealthcare;st.paul,mn)),温育24小时±6小时,并根据制造商的说明书计数菌落。在温育时间段之后,观察来自实施例1至9和比较例1至9的培养装置以检测和计数显示为蓝色的可见菌落(即,葡糖苷酸酶阳性,指示大肠杆菌菌落),该菌落被黄色酸区(即,乳糖发酵菌落)与一个或多个相邻气泡(即,乳糖发酵菌落)围绕。实施例1至9和比较例1至9中的每一者的菌落计数类似于对照petrifilm平板计数器上的计数。此外,对于菌落的酸和气体的产生,定性分析平板中的每个平板上的菌落。在pfec平板或比较例1至9中的相邻菌落中未观察到气泡。在实施例1至9的装置中的相邻菌落中观察到气泡。本文引用的所有专利、专利申请和出版物的全部公开内容以及可供使用的电子版材料均以引用的方式并入。在本申请的公开内容和以引用的方式并入本文的任何文献的公开内容之间存在任何不一致的情况下,应以本申请的公开内容为准。前述详细描述和示例仅为了清楚地理解本发明而给出。但它们不应被理解为不必要的限制。本发明不限于示出的和描述的具体细节,对本领域的技术人员而言显而易见的变型将包括在由权利要求书所限定的本发明中。所有的标题是为了阅读者方便,而不应该用于限制该标题后面的正文的含义,除非如此规定。在不脱离本发明的实质和范围的前提下,可做出各种修改。这些实施方案以及其它实施方案均在以下权利要求书的范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1