血液恶性肿瘤的治疗的制作方法
本发明提供了新型的核酸序列、载体、修饰的细胞、肽和药物组合物,其可用于治疗患δnpm阳性血液恶性肿瘤的人受试者。还提供了相应的方法和用途。
背景技术:
血液恶性肿瘤是影响血液和淋巴系统的癌症。所述癌症可能始于血液形成组织(例如骨髓)或免疫系统的细胞。血液恶性肿瘤的例子包括骨髓性恶性肿瘤,例如急性骨髓性白血病(aml)。
急性骨髓性白血病是骨髓的恶性疾病,其特征在于在分化中聚集的髓性前体细胞的积累。目前,标准治疗包括诱导化疗,然后强化巩固化疗或高剂量治疗与自体或异体造血干细胞移植(allosct)相结合,最终≤65岁患者的5年生存率为40-45%,而>65岁患者的5年生存率仅为10%。1-2allosct与低复发率相关,但是这种益处受到高毒性的限制。因此,allosct的治疗仅限于状态良好的患者,但由于化疗后的不良的细胞遗传学或分子异常或可检测到的持续性或复发性疾病,预后较差。在大多数患者中,复发在开始化疗后的3年内发生,表明迫切需要高效的且无毒性或毒性有限的新的靶向治疗,以治疗患有aml的患者并提高其生存率。2
在过去的几十年中,aml的分子表征已加速。全基因组和外显子组测序表明,aml具有低突变负荷,每位患者平均有13个编码突变。对于具有高突变负荷的癌症类型(例如黑色素瘤和肺癌),已显示一小部分的体细胞突变编码新抗原。3新抗原是由肿瘤特异性dna突变产生的肽,当在肿瘤细胞上发生hla时,可以被特异性t细胞识别。这些抗原的形成是概率性过程,其中每个额外的突变增加产生新抗原的机会。由于aml中的突变负荷低,因此新抗原的数量有望受到限制。3
在使用检查点抑制剂进行治疗或体外扩增的肿瘤浸润淋巴细胞(til)的过继转移后,新抗原可在体内充当癌症排斥抗原。3-4检查点抑制剂是能阻断ctla-4(易普利姆玛(ipilimumab))或pd-1(帕博利珠单抗(pembrolizumab)和纳武单抗(nivolumab))介导的t细胞抑制信号的抗体,从而刺激免疫系统靶向新抗原。检查点抑制剂和til疗法已经证明对于具有高突变负荷的肿瘤是成功的,但是对于具有低突变负荷的肿瘤是无效的。但是,尽管aml的总体突变负荷低,但是体细胞异常通常发生在有限数量的驱动基因中,这些基因在多位患者中反复发生突变。5结果,aml中反复突变产生的新抗原与靶向免疫治疗的开发相关。
需要新的免疫疗法来治疗血液恶性肿瘤,包括例如aml的骨髓性恶性肿瘤。
技术实现要素:
发明人已经认识到,核磷蛋白的突变形式(δnpm1或npm1mut)是例如髓样恶性肿瘤(特别是aml)的血液恶性肿瘤的免疫疗法的理想靶标,因为突变蛋白的形成限于恶性造血细胞。
核磷蛋白(npm1)是一种驱动基因,其在大约30%的aml患者中经常发生突变。5在其他类型的血液恶性肿瘤(例如其他骨髓性恶性肿瘤)中也观察到了突变的npm1,尽管在aml以外的肿瘤中的频率要低得多。具有突变的npm1(δnpm1或npm1mut)的患者在基因的外显子12中携带特征性4个碱基对(4-bp)移码插入。所得的δnpm1蛋白比野生型配对物长4个氨基酸(aa),并且其c末端11个aa是在可变阅读框(claveevslrk)中翻译的。结果,δnpm1蛋白从核仁(在那里作为核质穿梭蛋白起作用)向细胞质脱位。6因此,δnpm1蛋白位于细胞内。但是,hla限制的δnpm1衍生肽在细胞表面可被t细胞受体访问,因此可以被t细胞识别。
通过研究原发性aml的hlai类配体组,发明人确定了由hlai类呈递的δnpm1选择阅读框编码的5种肽。所述5种鉴定的肽是claveevsl(seqidno:1)、aveevslrk(seqidno:26)、claveevslrk(seqidno:27)、veevslrk(seqidno:28)和aveevslr(seqidno:29)。这些肽可用作治疗剂(例如疫苗),以治疗或预防δnpm1阳性aml23。或者,它们可以用作靶抗原,用于治疗具有本文所述修饰细胞的这类患者(例如具有特异性识别所述肽之一的t细胞受体的外周血淋巴细胞或肿瘤浸润淋巴细胞(til))。
有利地,表达对选自claveevsl(seqidno:1)、aveevslrk(seqidno:26)、claveevslrk(seqidno:27)、veevslrk(seqidno:28)和aveevslr(seqidno:29)的肽特异的tcr的t细胞可用作治疗δnpm1阳性aml的有效免疫疗法。因此,使用这些肽特异性tcr的tcr基因转导方法可为δnpm1阳性aml患者带来新的治疗方式。
发明人首次表明,claveevsl存在于从hla-a*02:01阳性aml患者中分离出的原发性aml细胞的表面上。有利地,所述肽因此可以用作治疗或预防hla-a*02:01阳性人类患者中δnpm1阳性aml的治疗剂(例如疫苗)。或者,它可以用作靶抗原,用于治疗具有本文所述修饰细胞的这类患者(例如具有特异性识别claveevsl的t细胞受体的外周血淋巴细胞或肿瘤浸润淋巴细胞(til))。
为了研究在hla-a*02:01的情况下存在的具有特异于claveevsl的t细胞受体(tcr)的t细胞是否存在于健康个体的t细胞库中,针对claveevsl及其半胱氨酰化变体产生了hla-a*02:01四聚体,并将四聚体阳性cd8t细胞与健康个体的外周血单个核细胞(pbmc)分离。测试了几种四聚体阳性t细胞克隆,只有两种显示出与claveevsl的特异性结合以及hla-a*02:01和δnpm1阳性aml的识别。对最具反应性的克隆(1a2)的t细胞受体进行测序,并将其引入cd8+和cd4+t细胞,这证明了具有δnpm1的hla-a*02:01阳性原发性aml的特异性识别和裂解是通过共受体独立方式进行的。
因此,本发明人已经鉴定了特异性结合新抗原claveevsl的tcr。
有利地,表达对claveevsl特异的tcr的t细胞因此可以用作治疗具有δnpm1阳性aml的hla-a*02:01阳性患者的有效免疫疗法。因此,使用claveevsl特异的tcr的tcr基因转导方法可以为δnpm1阳性aml的hla-a*02:01阳性患者带来新的治疗方式。
此外,所述肽claveevsl(特别是其半胱氨酰化形式,即c*laveevsl)因此可以用作治疗剂(例如疫苗),以治疗或预防hla-a*02:01阳性患者中δnpm1阳性aml。因此,该肽本身也具有效用,例如以分离的形式,或当配制成药物组合物时。
通过研究原发性aml的hlai类配体组,发明人还鉴定了由δnpm1的可变阅读框(分别为aveevslrk和claveevslrk)编码的不同的9聚体肽和11聚体肽。aveevslrk和claveevslrk中的每一个与hla-a*03:01和hla-a*11:01的结合通过用于四聚体生产的单体折叠来证实(如本文对claveevsl肽的详细描述)。因此,aveevslrk和claveevslrk肽中的每一种都可以用作治疗或预防hla-a*03:01或hla-a*11:01阳性人类患者中δnpm1阳性aml的治疗剂(例如疫苗)。或者,这些肽中的每一种都可以用作靶抗原,用于治疗具有本文所述修饰细胞的这类患者(例如具有分别特异性识别aveevslrk或claveevslrk的t细胞受体的外周血淋巴细胞或肿瘤浸润淋巴细胞(til))。
对于具有hla-a*01:01的aveevslrk,也已经成功显示了用于四聚体生产的单体折叠(如本文中对claveevsl肽的详细描述)。因此,已经证实了aveevslrk结合hla-a*01:01的能力。在缺乏hla-a*03:01和hla-a*11:01的hla-a*01:01阳性aml受试者(aml4443)的hlai类配体组中也发现了aveevslrk(参见图2)。因此,肽aveevslrk也可以用作治疗剂(例如疫苗),以治疗或预防hla-a*01:01阳性人类患者中δnpm1阳性aml。或者,该肽可以用作靶抗原,用于治疗具有本文所述修饰细胞的这类患者(例如具有特异性识别aveevslrk的t细胞受体的外周血淋巴细胞或肿瘤浸润淋巴细胞(til))。
为了研究在hla-a*03:01或hla-a*11:01的情况下存在的具有特异于aveevslrk的t细胞受体(tcr)的t细胞是否存在于来自健康个体的t细胞库中,针对aveevslrk制备了hla-a*03:01四聚体和hla-a*11:01四聚体,并将四聚体阳性cd8t细胞与健康个体的外周血单个核细胞(pbmc)分离。测试了几种四聚体阳性t细胞克隆,并且在hla-a*03:01的情况下,其中一种被鉴定为与aveevslrk具有特异性结合(反应性克隆(3b3);图37)。此外,在hla-a*11:01的情况下,一种t细胞克隆被鉴定为与aveevslrk具有特异性结合(反应性克隆(6f11);图37)。还测试了这些克隆(6f11和3b3)中的每一种的反应性(图38和39),其中仅在适当的hla-a的情况下呈现以δnpm1肽时,每种克隆证明了细胞因子释放。
因此,本发明人已经鉴定了在hla-a*03:01(来自克隆3b3的tcr)或hla-a*11:01(来自克隆6f11的tcr)的情况下特异性结合新抗原aveevslrk的两个tcr。
有利地,在具有δnpm1阳性aml的hla-a*03:01、hla-a*11:01或hla-a*01:01阳性患者的治疗中,表达对aveevslrk特异的tcr的t细胞因此可以用作有效的免疫疗法。因此,使用claveevsl特异的tcr的tcr基因转导方法可以为具有δnpm1阳性aml的hla-a*03:01、hla-a*11:01或hla-a*01:01阳性患者带来新的治疗方式。
此外,肽aveevslrk可用作治疗剂(例如疫苗),以治疗或预防hla-a*03:01、hla-a*11:01或hla-a*01:01阳性患者中δnpm1阳性aml。因此,该肽本身也具有效用,例如以分离的形式,或当配制成药物组合物时。
发明人已经表明,肽claveevslrk(seqidno:27)由hla-a*03:01或hla-a*11:01呈现。因此,在合适的hla的情况下可以发生与所述肽的任意一种的特异性结合(即,如上所述,仅当其由适当的hla呈现时,才与所述肽发生特异性结合)。
为了研究在hla-a*03:01的情况下存在的具有特异于claveevslrk的t细胞受体(tcr)的t细胞是否存在于健康个体的t细胞库中,针对claveevslrk及其半胱氨酰化变体产生了hla-a*013:01四聚体,并将四聚体阳性cd8t细胞与健康个体的外周血单个核细胞(pbmc)分离。测试了几种四聚体阳性t细胞克隆,有一种在hla-a*03:01的情况下被鉴定为与c*laveevslrk具有特异性结合(反应性克隆(1f2);图37)。
因此,本发明人已经鉴定了在hla-a*03:01(来自克隆1f2的tcr)的情况下特异性结合新抗原c*laveevslrk的tcr。
有利地,在具有δnpm1阳性aml的hla-a*03:01或hla-a*11:01阳性患者的治疗中,表达对claveevslrk(特别是对半胱氨酰化形式即c*laveevslrk)特异的tcr的t细胞因此可以用作有效的免疫疗法。因此,使用claveevslrk特异的tcr的tcr基因转导方法可以为具有δnpm1阳性aml的hla-a*03:01或hla-a*11:01阳性患者带来新的治疗方式。
此外,所述肽claveevslrk(特别是其半胱氨酰化形式,即c*laveevslrk)因此可以用作治疗剂(例如疫苗),以治疗或预防hla-a*03:01或hla-a*11:01阳性患者中δnpm1阳性aml。因此,该肽本身也具有效用,例如以分离的形式,或当配制成药物组合物时。
本发明在治疗具有δnpm1阳性aml的患者中具有特异性应用。但是,δnpm1也存在于患有其他形式的血液恶性肿瘤尤其是骨髓性恶性肿瘤的患者的子集中。因此,本发明同样适用于具有δnpm1阳性血液恶性肿瘤的患者,例如但不限于骨髓性恶性肿瘤(例如aml)。
因此,在一个方面,本发明提供了分离的核酸序列,其编码:
(a)包含tcrα链多肽的cdr3的多肽,所述多肽特异性结合选自claveevsl(seqidno:1)、aveevslrk(seqidno:26)、claveevslrk(seqidno:27)、veevslrk(seqidno:28)和aveevslr(seqidno:29)的肽;和/或
(b)包含tcrβ链多肽的cdr3的多肽,所述多肽特异性结合选自claveevsl(seqidno:1)、aveevslrk(seqidno:26)、claveevslrk(seqidno:27)、veevslrk(seqidno:28)和aveevslr(seqidno:29)的肽。
所述核酸序列可以编码(a)和(b),其中(a)和(b)一起特异性结合选自claveevsl(seqidno:1)、aveevslrk(seqidno:26)、claveevslrk(seqidno:27)、veevslrk(seqidno:28)和aveevslr(seqidno:29)的肽。
所述编码的多肽可以特异性结合claveevsl(seqidno:1)。所述肽可以是半胱氨酰化的形式。因此,所述编码的多肽可以仅特异性结合c*laveevsl(半胱氨酰化形式)。
或者,所述编码的多肽可以特异性结合aveevslrk(seqidno:26)。
或者,所述编码的多肽可以特异性结合claveevslrk(seqidno:27)。所述肽可以是半胱氨酰化的形式。因此,所述编码的多肽可以仅特异性结合c*laveevslrk(半胱氨酰化形式)。
(a)的cdr3可以具有与cavtgarlmf(seqidno:2)具有至少90%序列同一性的氨基酸序列。任选地,(a)的cdr3由seqidno:3或seqidno:4的核酸序列或其遗传简并序列(即由于遗传密码的简并性编码相同蛋白质的其他核酸序列)编码。
(b)的cdr3可以具有与casspgglsneqf(seqidno:5)具有至少90%序列同一性的氨基酸序列。任选地,(b)的cdr3由seqidno:6或seqidno:7的核酸序列或其遗传简并序列(即由于遗传密码的简并性编码相同蛋白质的其他核酸序列)编码。
(a)的cdr3可以在与所选肽(即seqidno:1、seqidno:26、seqidno:27、seqidno:28或seqidno:29)特异性结合的tcrα链可变区内。
(a)可进一步包含tcrα链恒定区。换句话说,(a)的多肽可包含特异性结合所选肽的全长tcrα链可变区和全长tcrα链恒定区。
tcrα链可变区可以具有与seqidno:8具有至少90%序列同一性的氨基酸序列。任选地,(a)的tcrα链可变区由seqidno:9或seqidno:10的核酸序列或其遗传简并序列(即由于遗传密码的简并性编码相同蛋白质的其他核酸序列)编码。
(b)的cdr3可以在特异性结合所选肽(即seqidno:1、seqidno:26、seqidno:27、seqidno:28或seqidno:29)的tcrβ链可变区内。
(b)可进一步包含tcrβ链恒定区。换句话说,(b)的多肽可包含特异性结合所选肽的全长tcrα链可变区和全长tcrα链恒定区。
(b)的tcrβ链可变区可以具有与seqidno:11具有至少90%序列同一性的氨基酸序列。任选地,(b)的tcrβ链可变区由seqidno:12或seqidno:13的核酸序列或其遗传简并序列(即由于遗传密码的简并性编码相同蛋白质的其他核酸序列)编码。
(a)的cdr3可以在与seqidno:8具有至少90%序列同一性的tcrα链可变区内,其中cdr3具有seqidno:2的氨基酸序列。任选地(a)包含tcrα链恒定区。
在本文所述的任何实施方案中,tcrα链可变区cdr1可具有seqidno:14的氨基酸序列,而tcrα链可变区cdr2可具有seqidno:15的氨基酸序列。
(b)的cdr3可以在与seqidno:11具有至少90%序列同一性的tcrβ链可变区内,其中cdr3具有seqidno:5的氨基酸序列。任选地,(b)包含tcrβ链恒定区。
在本文所述的任何实施方案中,tcrβ链可变区cdr1可具有seqidno:16的氨基酸序列,而tcrβ链可变区cdr2可具有seqidno:17的氨基酸序列。
所选择的肽claveevsl(seqidno:1)可以是半胱氨酰化的。
所选择的肽claveevslrk(seqidno:27)可以是半胱氨酰化的。
核酸序列可以编码t细胞受体。
为了避免疑惑,发明人已经鉴定出肽claveevsl(seqidno:1)由hla-a*02:01呈现(即是hla-a*02:01限制性的)。此外,发明人已经确定,肽aveevslrk和claveevslrk各自由hla-a*03:01或呈现,并且aveevslrk也由hla-a*01:01呈现。因此,在合适的hla的情况下可以发生与这些肽的任意一种的特异性结合(即,如上所述,仅当其由适当的hla呈现时,才与所述肽发生特异性结合)。
本发明的核酸序列可以是非天然存在的核酸序列(例如,可能整个序列本质上并不完全存在)。例如,本发明的核酸序列可以与启动子可操作地连接,其中所述启动子与天然的等效人核酸序列(例如人tcr序列或其片段)不是天然缔合的;即不是在其天然环境中与核酸天然缔合的整个启动子。在此情况下,这样的启动子可以被认为是外源性启动子。合适的启动子的实例在别处描述。
在另一方面,本发明提供了包含本发明的核酸序列的载体。
所述载体可以是质粒或病毒载体。任选地,所述载体由以下组成的组:选自腺病毒、腺相关病毒、牛痘病毒、金丝雀痘病毒、疱疹病毒、微环载体和合成dna或rna。如上所述,任选地,所述载体包括与核酸序列可操作地连接的启动子。
在另一方面,本发明提供了用本发明的核酸序列或本发明的载体转染或转导的修饰的细胞。
如上所述,本发明的转染或转导的核酸序列或本发明的载体可以可操作地连接至启动子。
所述修饰的细胞可选自由以下组成的组:cd8t细胞、cd4t细胞、nk细胞、nkt细胞、γ-δt细胞、造血干细胞、祖细胞、t细胞系或nk-92细胞系。
所述修饰的细胞可以是人细胞。
在另一方面,本发明提供了分离的肽,其包含选自以下的氨基酸序列:
(i)claveevsl(seqidno:1),其中半胱氨酸氨基酸可以是或可以不是半胱氨酰化的;
(ii)aveevslrk(seqidno:26);
(iii)claveevslrk(seqidno:27);其中半胱氨酸氨基酸可以是或可以不是半胱氨酰化的;
(iv)veevslrk(seqidno:28);和
(v)aveevslr(seqidno:29)。
在一个具体的实施方案中,seqidno:1的半胱氨酸氨基酸是半胱氨酰化的。
在一个具体的实施方案中,seqidno:27的半胱氨酸氨基酸是半胱氨酰化的。
所述肽可具有不超过20个氨基酸。
所述肽可由选自以下的序列组成:
(i)seqidno:1,其中半胱氨酸氨基酸可以是或可以不是半胱氨酰化的;
(ii)seqidno:26;
(iii)seqidno:27,其中半胱氨酸氨基酸可以是或可以不是半胱氨酰化的;
(iv)seqidno:28;和
(v)seqidno:29。
在一个具体的实施方案中,所述肽可以由seqidno:1的序列组成,其中seqidno:1的半胱氨酸氨基酸是半胱氨酰化的。
在一个具体的实施方案中,所述肽可以由seqidno:27的序列组成,其中seqidno:27的半胱氨酸氨基酸是半胱氨酰化的。
在另一方面,本发明提供编码本发明肽的分离的核酸序列。
在另一方面,本发明提供包含本发明的核酸序列的载体。
在另一方面,本发明提供了一种药物组合物,其包含本发明的核酸序列、本发明的载体、本发明的修饰的细胞或本发明的分离的肽,以及药学上可接受的赋形剂、佐剂、稀释剂和/或载体。
当所述组合物包含本发明的分离的肽(或编码所述分离的肽的核酸或载体)时,所述药物组合物可以被制为疫苗。用于肽和核酸的合适的疫苗制剂是本领域众所周知的。
在另一方面,本发明提供了治疗或预防人类受试者中δnpm1阳性血液恶性肿瘤的方法,所述方法包括向所述受试者施用治疗有效量的本发明的药物组合物。
治疗或预防人类受试者中δnpm1阳性血液恶性肿瘤的方法可以包括向受试者施用治疗有效量的本文所述的肽(或编码该肽的核酸(例如rna或dna)或载体)。
作为实例,分离的肽包含选自以下的氨基酸序列或由选自以下的氨基酸序列组成:
(i)claveevsl(seqidno:1),其中半胱氨酸氨基酸可以是或可以不是半胱氨酰化的;
(ii)aveevslrk(seqidno:26);
(iii)claveevslrk(seqidno:27);其中半胱氨酸氨基酸可以是或可以不是半胱氨酰化的;
(iv)veevslrk(seqidno:28);和
(v)aveevslr(seqidno:29)
其可以作为免疫疗法(例如作为疫苗)施用
在一个具体的实施方案中,seqidno:1的半胱氨酸氨基酸是半胱氨酰化的。
在一个具体的实施方案中,seqidno:27的半胱氨酸氨基酸是半胱氨酰化的。
所述血液恶性肿瘤可以是骨髓性恶性肿瘤。
所述骨髓性恶性肿瘤可以是急性骨髓性白血病。
所述方法可以在受试者中诱导或增强细胞介导的免疫应答。
为了避免疑惑,发明人已经鉴定出肽claveevsl(seqidno:1)是hla-a*02:01限制性的。此外,发明人已经鉴定出,肽aveevslrk和claveevslrk各自由hla-a*03:01和hla-a*11:01中的任一种呈现,并且aveevslrk也由hla-a*01:01呈现。
claveevsl和/或claveevslrk可以特别地为半胱氨酰化的形式。
因此,治疗或预防hla-a*02:01阳性人类受试者中δnpm1阳性血液恶性肿瘤的方法可以优先使用包含编码与claveevsl特异性结合的多肽的核酸序列的药物组合物、编码此类核酸序列的载体、包含此类核酸序列或载体的修饰的细胞,或者编码claveevsl的核酸、编码此类核酸序列的载体或包含序列claveevsl的蛋白质或肽(所有这些都将在本文其他地方更详细地描述)。claveevsl可以特别地为半胱氨酰化形式。
类似地,治疗或预防hla-a*03:01或hla-a*11:01阳性的人类受试者中δnpm1阳性血液恶性肿瘤的方法可优先使用包含编码与aveevslrk或claveevslrk特异性结合的多肽的核酸序列的药物组合物、编码此类核酸序列的载体、包含此类核酸序列或载体的修饰细胞,或者编码aveevslrk或claveevslrk的核酸、编码此类核酸序列的载体或包含序列aveevslrk或claveevslrk的蛋白质或肽(所有这些都将在本文其他地方更详细地描述)。
此外,治疗或预防hla-a*01:01呈阳性的人类受试者中δnpm1阳性血液恶性肿瘤的方法可优先使用包含编码与aveevslrk特异性结合的多肽的核酸序列的药物组合物、编码此类核酸序列的载体、包含此类核酸序列或载体的修饰细胞,或者编码aveevslrk的核酸、编码此类核酸序列的载体或包含序列aveevslrk的蛋白质或肽(所有这些都将在本文其他地方更详细地描述)。
claveevslrk可以特别地为半胱氨酰化的形式。
在另一方面,本发明提供了用于治疗或预防人类受试者中δnpm1阳性血液恶性肿瘤的本发明的药物组合物。
用于治疗或预防人类受试者中δnpm1阳性血液恶性肿瘤的本发明的药物组合物可以包含治疗有效量的本文所述的肽(或编码该肽的核酸(例如rna或dna)或载体)。
例如,药物组合物可以包含分离的肽,该分离的肽包含选自以下的氨基酸序列或由其组成:
(i)claveevsl(seqidno:1),其中半胱氨酸氨基酸可以是或可以不是半胱氨酰化的;
(ii)aveevslrk(seqidno:26);
(iii)claveevslrk(seqidno:27);其中半胱氨酸氨基酸可以是或可以不是半胱氨酰化的;
(iv)veevslrk(seqidno:28);和
(v)aveevslr(seqidno:29)。
所述药物组合物可以用作免疫疗法(例如作为疫苗)。
在一个具体的实施方案中,seqidno:1的半胱氨酸氨基酸是半胱氨酰化的。
在一个具体的实施方案中,seqidno:27的半胱氨酸氨基酸是半胱氨酰化的。
所述血液恶性肿瘤可以是骨髓性恶性肿瘤。
所述骨髓性恶性肿瘤可以是急性骨髓性白血病。
所述药物组合物可以用于在受试者中诱导或增强细胞介导的免疫应答。
如前所述,发明人已经鉴定出肽claveevsl(seqidno:1)是hla-a*02:01限制性的。此外,发明人已经鉴定出,肽aveevslrk和claveevslrk各自由hla-a*03:01和hla-a*11:01呈现,并且aveevslrk也由hla-a*01:01呈现。
claveevsl和/或claveevslrk可以特别地为半胱氨酰化形式。
因此,在治疗或预防hla-a*02:01阳性人类受试者中δnpm1阳性血液恶性肿瘤时,可以优先使用包含编码与claveevsl特异性结合的多肽的核酸序列的药物组合物,编码此类核酸序列的载体,包含此类核酸序列或载体的修饰细胞,或编码claveevsl的核酸,编码此类核酸序列的载体或包含序列claveevsl的蛋白质或肽(所有这些都将在本文其他地方更详细地描述)。claveevsl可以特别地为半胱氨酰化形式。
类似地,在治疗或预防hla-a*03:01或hla-a*11:01阳性的人类受试者中δnpm1阳性血液恶性肿瘤时,可优先使用包含编码与aveevslrk或claveevslrk特异性结合的多肽的核酸序列的药物组合物、编码此类核酸序列的载体、包含此类核酸序列或载体的修饰细胞,或者编码aveevslrk或claveevslrk的核酸、编码此类核酸序列的载体或包含序列aveevslrk或claveevslrk的蛋白质或肽(所有这些都将在本文其他地方更详细地描述)。
此外,在治疗或预防hla-a*01:01呈阳性的人类受试者中δnpm1阳性血液恶性肿瘤时,可优先使用包含编码与aveevslrk特异性结合的多肽的核酸序列的药物组合物、编码此类核酸序列的载体、包含此类核酸序列或载体的修饰细胞,或者编码aveevslrk的核酸、编码此类核酸序列的载体或包含序列aveevslrk的蛋白质或肽(所有这些都将在本文其他地方更详细地描述)。
claveevslrk可以特别地为半胱氨酰化形式。
在另一方面,本发明提供了本发明的药物组合物在制备用于治疗或预防人类受试者中δnpm1阳性血液学恶性肿瘤的药物中的用途。
所述药物组合物可以包含治疗有效量的本文所述的肽(或编码该肽的核酸(例如rna或dna)或载体)。
作为实例,所述药物组合物可以包含分离的肽,该分离的肽包含选自以下的氨基酸序列或由其组成:
(i)claveevsl(seqidno:1),其中半胱氨酸氨基酸可以是或可以不是半胱氨酰化的;
(ii)aveevslrk(seqidno:26);
(iii)claveevslrk(seqidno:27);其中半胱氨酸氨基酸可以是或可以不是半胱氨酰化的;
(iv)veevslrk(seqidno:28);和
(v)aveevslr(seqidno:29)。
所述药物组合物可以用作免疫疗法(例如作为疫苗)。
在一个具体的实施方案中,seqidno:1的半胱氨酸氨基酸是半胱氨酰化的。
在一个具体的实施方案中,seqidno:27的半胱氨酸氨基酸是半胱氨酰化的。
所述血液恶性肿瘤可以是骨髓性恶性肿瘤。
所述骨髓性恶性肿瘤可以是急性骨髓性白血病。
如本文其他地方所述,发明人已经鉴定出肽claveevsl(seqidno:1)是hla-a*02:01限制性的。此外,发明人已经鉴定出,肽aveevslrk和claveevslrk各自由hla-a*03:01和hla-a*11:01呈现,并且aveevslrk也由hla-a*01:01呈现。claveevsl和/或claveevslrk可以特别地为半胱氨酰化形式。
因此,包含编码与claveevsl特异性结合的多肽的核酸序列的药物组合物、编码此类核酸序列的载体、包含此类核酸序列或载体的修饰细胞,或者编码claveevsl的核酸、编码此类核酸序列的载体或包含序列claveevsl的蛋白质或肽(所有这些都将在本文其他地方更详细地描述)可以优先用于制备治疗或预防hla-a*02:01阳性人类受试者中δnpm1阳性血液恶性肿瘤的药物。claveevsl可以特别地为半胱氨酰化形式。
类似地,包含编码与aveevslrk或claveevslrk特异性结合的多肽的核酸序列的药物组合物、编码此类核酸序列的载体、包含此类核酸序列或载体的修饰细胞,或者编码aveevslrk或claveevslrk的核酸、编码此类核酸序列的载体或包含序列aveevslrk或claveevslrk的蛋白质或肽(所有这些都将在本文其他地方更详细地描述)可以优先用于制备治疗或预防hla-a*03:01或hla-a*11:01阳性人类受试者中δnpm1阳性血液恶性肿瘤的药物。
此外,包含编码与aveevslrk特异性结合的多肽的核酸序列的药物组合物、编码此类核酸序列的载体、包含此类核酸序列或载体的修饰细胞,或者编码aveevslrk的核酸、编码此类核酸序列的载体或包含序列aveevslrk的蛋白质或肽(所有这些都将在本文其他地方更详细地描述)可以优先用于制备治疗或预防hla-a*01:01阳性人类受试者中δnpm1阳性血液恶性肿瘤的药物。
claveevslrk可以特别地为半胱氨酰化形式。
在另一方面,本发明提供了一种产生t细胞受体的方法,其包括使本发明的核酸序列与细胞在所述核酸序列被细胞整合并表达的条件下接触,以产生与选自以下的肽特异性结合的t细胞受体:seqidno:1、seqidno:26、seqidno:27、seqidno:28和seqidno:29。
所述方法可以是离体的。
如上所述,与claveevsl、aveevslrk和claveevslrk中的任一种的特异性结合可以在适当的hla的情况下发生(例如,如上所述,与肽的特异性结合仅在由适当的hla呈现时才可以发生)。
在另一方面,本发明提供了肽作为人类受试者中δnpm1阳性血液恶性肿瘤的生物标志物的用途,其中所述肽选自:
(i)claveevsl(seqidno:1),其中半胱氨酸氨基酸可以是或可以不是半胱氨酰化的;
(ii)aveevslrk(seqidno:26);
(iii)claveevslrk(seqidno:27);其中半胱氨酸氨基酸可以是或可以不是半胱氨酰化的;
(iv)veevslrk(seqidno:28);和
(v)aveevslr(seqidno:29)。
在一个具体的实施方案中,seqidno:1的半胱氨酸氨基酸是半胱氨酰化的。
在一个具体的实施方案中,seqidno:27的半胱氨酸氨基酸是半胱氨酰化的。
在另一方面,本发明提供了诊断人类受试者中δnpm1阳性血液恶性肿瘤的方法,其包括:
确定从受试者分离的样品中肽的存在,其中所述肽选自:(i)claveevsl(seqidno:1),其中半胱氨酸氨基酸可以是或可以不是半胱氨酰化的;(ii)aveevslrk(seqidno:26);(iii)claveevslrk(seqidno:27),其中半胱氨酸氨基酸可以是或可以不是半胱氨酰化的;(iv)veevslrk(seqidno:28);和aveevslr(seqidno:29)。
其中样品中肽的存在将受试者鉴定为具有δnpm1阳性血液恶性肿瘤,并且其中样品中肽的不存在将受试者鉴定为不具有δnpm1阳性血液恶性肿瘤。
在一个具体的实施方案中,seqidno:1的半胱氨酸氨基酸是半胱氨酰化的。
在一个具体的实施方案中,seqidno:27的半胱氨酸氨基酸是半胱氨酰化的。
在另一方面,本发明提供了一种在人类受试者中治疗或预防δnpm1阳性血液恶性肿瘤的方法,该方法包括:
(i)确定从受试者分离的样品中肽的存在,其中该肽选自:claveevsl(seqidno:1)其中半胱氨酸氨基酸可以是或可以不是半胱氨酰化的、aveevslrk(seqidno:26)、claveevslrk(seqidno:27)其中半胱氨酸氨基酸可以是或可以不是半胱氨酰化的、veevslrk(seqidno:28);和aveevslr(seqidno:29);以及(ii)向受试者施用治疗有效量的本发明的药物组合物。
在一个具体的实施方案中,seqidno:1的半胱氨酸氨基酸是半胱氨酰化的。
在一个具体的实施方案中,seqidno:27的半胱氨酸氨基酸是半胱氨酰化的。
先前提供的有关每种肽及其hla限制特性的声明(特别是在用于治疗或预防具有所述hla状况的受试者的δnpm1阳性血液恶性肿瘤的方法中使用的合适药物组合物的情况)在此同样适用。
在另一方面,本发明提供了用于治疗或预防人类受试者中的δnpm1阳性血液恶性肿瘤的本发明的药物组合物,其中受试者通过从受试者分离出的样品中肽的存在被鉴定为具有δnpm1阳性血液学恶性肿瘤,其中所述肽选自:
(i)claveevsl(seqidno:1),其中半胱氨酸残基可以是或可以不是半胱氨酰化的;
(ii)aveevslrk(seqidno:26);
(iii)claveevslrk(seqidno:27);其中半胱氨酸残基可以是或可以不是半胱氨酰化的;
(iv)veevslrk(seqidno:28);和
(v)aveevslr(seqidno:29)。
在这个方面,被鉴定为具有δnpm1阳性血液学恶性肿瘤的受试者是由于从该受试者分离的样品中存在肽而在治疗前已经被诊断为具有δnpm1阳性血液学恶性肿瘤的受试者,其中所述肽选自:
(i)claveevsl(seqidno:1),其中半胱氨酸氨基酸可以是或可以不是半胱氨酰化的;
(ii)aveevslrk(seqidno:26);
(iii)claveevslrk(seqidno:27);其中半胱氨酸残基可以是或可以不是半胱氨酰化的;
(iv)veevslrk(seqidno:28);和
(v)aveevslr(seqidno:29)。
在一个具体的实施方案中,seqidno:1的半胱氨酸氨基酸是半胱氨酰化的。
在一个具体的实施方案中,seqidno:27的半胱氨酸氨基酸是半胱氨酰化的。
先前提供的关于每种肽及其hla限制特性的声明(特别是在治疗或预防具有所述hla状况的受试者中δnpm1阳性血液恶性肿瘤时使用的合适药物组合物的情况)在此同样适用。
在本说明书的整个描述和权利要求书中,词语“包括”和“包含”及其变体表示“包括但不限于”,并且它们并不旨在(并且不)排除其他部分、添加剂、组分、整数或步骤。
在本说明书的整个描述和权利要求书中,单数形式包括复数形式,除非上下文另有要求。特别地,在使用不定冠词的地方,本发明应被理解为既包含复数也包含单数,除非上下文有其他要求。
结合本发明的特定方面、实施方案或实施例描述的特征、整数、特性、化合物、化学部分或基团应理解为适用于本文所述的任何其他方面、实施方案或实施例,除非与其不相容。
本文所参考的专利、科学和技术文献建立了本领域技术人员在申请时可获得的知识。本文引用的已发布专利,已公开和待审的专利申请以及其他出版物的全部公开内容通过引用的方式并入本文,其程度与分别具体地和单独地指出通过引用并入的程度相同。如果存在不一致,以本发明为准。
下面更详细地描述本发明的各个方面。
附图说明
在下文中,将参考附图进一步描述本发明的实施方案,其中:
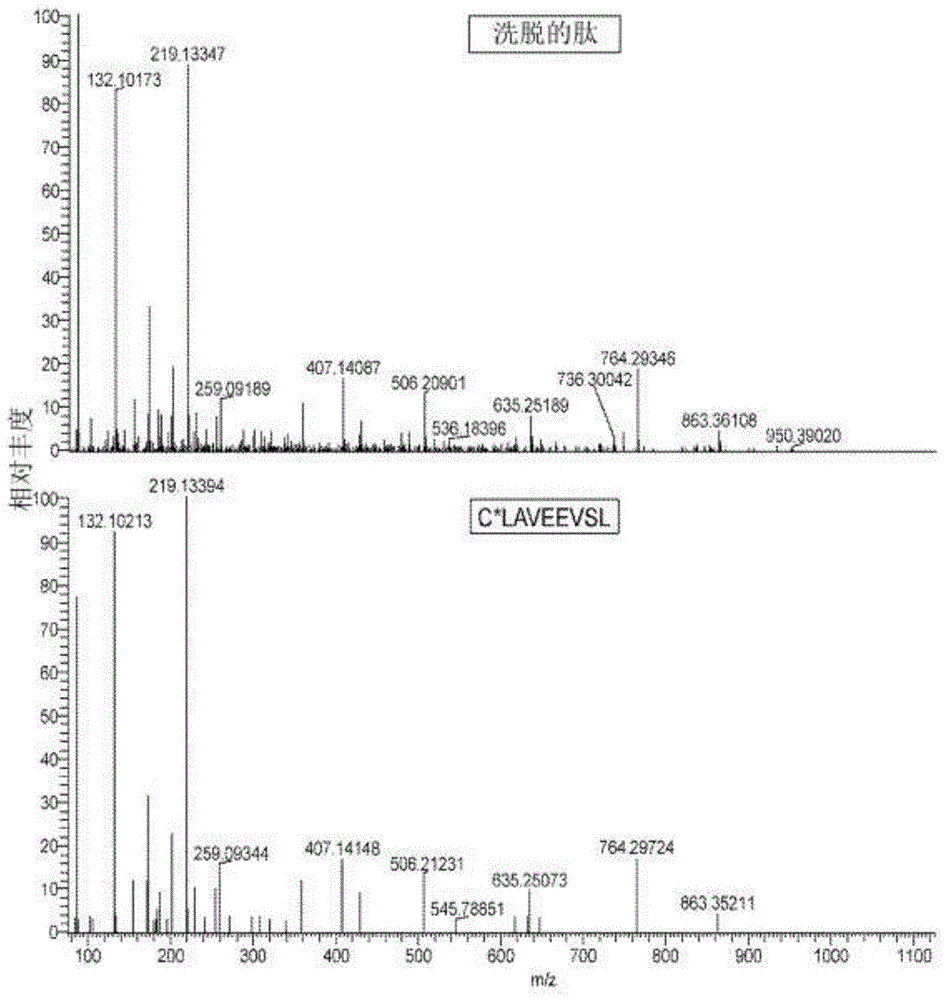
图1提供了c*laveevsl作为从具有δnpm1的hla-a*02:01阳性aml洗脱的肽的验证。显示了从具有δnpm1的hla-a*02:01阳性aml10197的洗脱肽(顶部),和第一残基半胱氨酰化之后的合成肽c*laveevsl(底部)的质谱。数据显示两种肽的质谱完全匹配。
图2提供了从原发性aml洗脱的δnpm1肽的验证。显示了从aml洗脱的肽(顶部)和合成肽(底部)的串联质谱。c*=cys残基的半胱氨酰化。(a)从aml10197(上)和aml3361(中)洗脱的肽和合成肽c*laveevsl,以及从aml3361洗脱的肽和合成肽aveevslrk(下)的串联质谱。(b)从aml9448(上)、aml5444(中)和aml5518(下)洗脱的肽和合成肽aveevslrk的串联质谱。(c)从aml6498(上)和aml4443(中)洗脱的肽和合成肽aveevslrk,以及从aml9448洗脱的肽和合成肽c*lverslrk(下)的串联质谱。(d)从aml6498洗脱的肽和合成肽c*laverslrk(上),从aml3361洗脱的肽和合成肽veevslrk(中),以及从aml5518洗脱的肽和合成肽aveevslr(下)的串联质谱。
图3示出了δnpm1的cd8细胞是使用δnpm1-cla和δnpm1-c*lapmhc四聚体的混合物从hla-a*02:01阳性健康个体的pbmc中分离的单个细胞。a.用pmhc四聚体染色测试生长t细胞克隆。t细胞克隆1a2(顶部)和4a8(底部)对于δnpm1-cla四聚体均为阳性,而只有克隆1a2用δnpm1-c*la染色。b.通过ifn-γelisa测试了四聚体阳性t细胞克隆1a2(顶部)和4a8(底部)对hla-a*02:01阳性t2细胞的反应性,所述hla-a*02:01阳性t2细胞外源性装载有滴定浓度的非半胱氨酰化的δnpm1肽claveevsl(圆圈)、半胱氨酰化的δnpm1肽c*laveevsl(正方形)或不相关的hla-a*02:01-限制性cmv肽nlvpmvatv(三角形)。仅克隆1a2显示出对半胱氨酰化和非半胱氨酰化的δnpm1肽的识别。没有观察到针对无关的nlvpmvatv肽的反应性。显示了重复孔中ifn-γ的平均释放(ng/ml)。c.通过ifn-γelisa测试了克隆1a2(上)和4a8(中)对5hla-a*02:01阳性原发性aml的反应性。该组包括3种具有δnpm1的aml和2种具有wtnpm1的aml。t细胞克隆1a2对所有3种具有δnpm1的aml的反应程度不同,而克隆4a8仅识别3种aml中的2种。两种t细胞克隆均无法识别具有wtnpm1的aml。包括hla-a*02:01特异性同种异体反应性t细胞克隆(allo-a2克隆;底部)作为阳性对照。显示了重复孔中ifn-γ的平均释放(ng/ml)。
图4显示了tcr基因转导后对δnpm1的特异性。将克隆1a2的δnpm1特异性tcrα和β链基因克隆到修饰的mp71-tcr-flex反转录病毒载体中以进行tcr基因转导。从hla-a*02:01阳性健康个体中分离出的cd8和cd4细胞用δnpm1的tcr进行逆转录病毒转导,hla-a*02:01限制性cmv肽nlvpmvatv的tcr作为对照。转导后第6天,使用抗小鼠tcr-cβ和抗apc磁珠的apc偶联抗体纯化tcr转导的t细胞。a.转导后第7天,使用抗cd8或cd4抗体和claveevsl(δnpm1-cla;左)或nlvpmvatv(cmv-nlv;右)的pmhc四聚体,通过流式细胞术分析tcr转导的t细胞。用δnpm1的tcr转导的cd8
图5显示了tcr基因转移后在原发性aml上对δnpm1的识别。通过ifn-γelisa测试了tcr转导的cd8和cd4细胞对一组13个hla-a*02:01阳性原发性aml的反应性,其中包括9个具有δnpm1的样品和4个具有wtnpm1的样品。用δnpm1的tcr转导的cd8(
图6显示了通过ifn-γelisa在单核细胞衍生的成熟dc上测试的tcr转导的t细胞。测试了δnpm1(
图7显示了在51cr释放试验中tcr基因转导后,具有δnpm1的原发性aml的裂解。在一组6个hla-a*02:01阳性原发性aml中,其中包括4个带有δnpm1的样品和2个带有wtnpm1的样品,通过9小时51cr释放试验测试了tcr转导的cd8和cd4细胞的溶细胞能力。用δnpm1的tcr转导的cd8(
图8显示了seqidno:1的免疫原性肽氨基酸序列。值得注意的是,seqidno:1的半胱氨酸氨基酸可以或可以不被半胱氨酰化。
图9显示了cdr3(tcrα链)的氨基酸序列(seqidno:2)。
图10显示了非优化的编码cdr3(tcrα链)的核酸序列(seqidno:3)。
图11显示了优化的编码cdr3(tcrα链)的核酸序列(seqidno:4)。
图12显示了cdr3(tcrβ链)的氨基酸序列(seqidno:5)。
图13显示了非优化的编码cdr3(tcrβ链)的核酸序列(seqidno:6)。
图14显示了优化的编码cdr3(tcrβ链)的核酸序列(seqidno:7)。
图15显示了α链可变区的氨基酸序列(seqidno:8)(cdr3加下划线)。
图16显示了非优化的编码α链可变区的核酸序列(seqidno:9)(cdr3加下划线)。
图17显示了优化的编码α链可变区的核酸序列(seqidno:10)(cdr3加下划线)。
图18显示了β链可变区(seqidno:11的氨基酸序列)(cdr3加下划线)。
图19显示了非优化的编码β链可变区的核酸序列(seqidno:12)(cdr3加下划线)。
图20显示了优化的编码β链可变区的核酸序列(seqidno:13)(cdr3加下划线)。
图21显示了cdr1(tcrα链)的氨基酸序列(seqidno:14)。
图22显示了cdr2(tcrα链)的氨基酸序列(seqidno:15)。
图23显示了cdr1(tcrβ链)的氨基酸序列(seqidno:16)。
图24显示了cdr2(tcrβ链)的氨基酸序列(seqidno:17)。
图25显示了非优化的编码cdr1(tcrα链)的核酸序列(seqidno:18)。
图26显示了优化的编码cdr1(tcrα链)的核酸序列(seqidno:19)。
图27显示了非优化的编码cdr2(tcrα链)的核酸序列(seqidno:20)。
图28显示了优化的编码cdr2(tcrα链)的核酸序列(seqidno:21)。
图29显示了非优化的编码cdr1(tcrβ链)的核酸序列(seqidno:22)。
图30显示了优化的编码cdr1(tcrβ链)的核酸序列(seqidno:23)。
图31显示了非优化的编码cdr2(tcrβ链)的核酸序列(seqidno:24)。
图32显示了优化的编码cdr2(tcrβ链)的核酸序列(seqidno:25)。
图33显示了seqidno:26的免疫原性肽氨基酸序列。
图34显示了seqidno:27的免疫原性肽氨基酸序列。值得注意的是,seqidno:27的半胱氨酸氨基酸可以是或可以不是半胱氨酰化的。
图35显示了seqidno:28的免疫原性肽氨基酸序列。
图36显示了seqidno:29的免疫原性肽氨基酸序列。
图37至图39显示了a*03:01和a*11:01中的δnpm1肽的t细胞。具有δnpm1肽aveevslrk(ave)、claveevslrk(cla)和c*laveevslrk(c*la;第一个残基半胱氨酰化)的pe偶联的hla-a*03:01四聚体的混合物或具有aveevslrk的单个hla-a*11:01四聚体分别被用于将特异性t细胞与hla-a*03:01和/或hla-a*11:01阳性健康个体分离。通过uv交换(分别为uv-c*la和uv-cla)制备具有c*laveevslrk的hla-a*03:01四聚体,claveevslrk作为对照。
图37显示了与pe偶联的hla-a*03:01结合的t细胞克隆,显示了uv-c*la(克隆1f2;左)、a*03:01ave(克隆3b3;中)和a*11:01ave(克隆6f11;右)四聚体。
图38显示测试了t细胞克隆3b3(左)对用hla-a*03:01转导的t2细胞的反应性,所述t2细胞以滴定浓度的δnpm1肽aveevslrk(三角形)、claveevslrk(圆圈)或c*laveevslrk(正方形)进行外源性脉冲。指示了在不同肽浓度(nm)下gm-csf的释放(ng/ml)。测试了t细胞克隆6f11(右)对用hla-a*11:01转导的t2细胞的反应性,所述t2细胞以滴定浓度的δnpm1肽aveevslrk(三角形)进行外源性脉冲。示出了在不同肽浓度(nm)下ifn-γ(ng/ml)的释放。
图39显示测试了t细胞克隆3b3(左)和6f11(右)对下列细胞的反应性:k562细胞、用hla-a*03:01或a*11:01转导的k562、用hla-a*03:01或a*11:01以及编码全长野生型或δnpm1的基因转导的k562、以及分别以a*03:01或a*11:01转导的内源性表达野生型和δnpm1的oci-aml2和oci-aml3细胞系。示出了以ng/ml表示的gm-csf(克隆3b3)或ifn-γ(克隆6f11)的释放。
具体实施方式
先前已经研究了来源于突变体npm1(δnpm1)的肽的免疫原性14,其中使用对δnpm1整个氨基酸序列的计算机筛选预测了hla-a*02:01可以呈现哪些肽。具有预测的hla-a*02:01结合的肽是合成产生的,包括claveevsl。用该肽刺激从健康个体和δnpm1aml患者中分离出的cd8+t细胞,并测量t细胞反应。发现仅两种测试的肽(aiqdlclav和aiqdlcvav)在体外引发免疫应答。因此,这些肽被认为是δnpm1的最重要表位,因此被用于进一步的研究。
发明人现已鉴定出存在于δnpm1阳性原发性aml的hlai类配体组中的五种不同的肽(即claveevsl(seqidno:1)、aveevslrk(seqidno:26)、claveevslrk(seqidno:27)、veevslrk(seqidno:28)和aveevslr(seqidno:29))。
现在,发明人还令人惊讶地表明,在δnpm1内的所有可能的肽中,存在于从hla-a*02:01癌症患者分离的原发性δnpm1aml细胞表面上的是claveevsl肽,而且该肽以半胱氨酰化形式存在于分离的原发性aml细胞表面。
本发明人现在还令人惊讶地发现,δnpm1衍生的肽aveevslrk和claveevslrk分别由hla-a*03:01和hla-a*11:01呈现,并且aveevslrk也由hla-a*01:01呈现。
本发明人已经从健康的hla-a*02:01阳性个体的t细胞库中分离并克隆了与claveevsl反应的t细胞受体。他们已证明这些t细胞受体可用于外周血淋巴细胞的基因工程,而转基因的淋巴细胞有效地杀死具有δnpm1的hla-a*02:01阳性aml。有利地,这些tcr可以用作治疗具有δnpm1阳性aml的hla-a*02:01阳性患者的有效免疫疗法。
本发明人还从健康的hla-a*03:01阳性个体的t细胞库中分离出了与claveevslrk(特别是该肽的半胱氨酰化的变体)具有反应性的t细胞克隆。有利地,来自该克隆的tcr可以用作治疗具有δnpm1阳性aml的hla-a*03:01阳性患者的有效免疫疗法。
发明人还分别从健康的hla-a*03:01和hla-a*11:01阳性个体的t细胞库中分离了两个与aveevslrk具有反应性的t细胞克隆。有利地,来自这些克隆的tcr可以用作治疗具有δnpm1阳性aml的hla-a*03:01和hla-a*11:01阳性患者的有效免疫疗法。
编码tcr多肽组分的核酸序列
本发明提供了编码t细胞受体组分的核酸序列,所述t细胞受体组分特异性结合选自以下的肽:claveevsl(seqidno:1)、aveevslrk(seqidno:26)、claveevslrk(seqidno:27)、veevslrk(seqidno:28)和aveevslr(seqidno:29)。所述核酸序列可以形成较大的核酸序列的部分,该较大核酸序列的部分编码t细胞受体的较大的组分部分(例如tcrα链可变区、tcrβ链可变区、tcrα链、tcrβ链等)。所述核酸序列也可以形成编码功能性t细胞受体的较大的核酸序列的部分(即编码功能性tcrα链和功能性tcrβ链,其任选地由连接子序列隔开,该连接子序列可通过同一载体协调表达两种蛋白质或多肽)。下面提供了有关此内容的更多详细信息。
所述核酸序列可以编码t细胞受体的小组分,例如tcrα链多肽的cdr3结构域,或tcrβ链多肽的cdr3结构域。因此,所述核酸序列可以被认为是提供肽特异性必不可少的组分的“构件”。可将本发明的核酸序列掺入编码tcr可变链的其他元件的独特核酸序列(例如载体)中,使得当掺入本发明的核酸序列时,产生编码tcrα链可变区和/或tcrβ链可变区的新的核酸序列,该tcrα链可变区和/或tcrβ链可变区特异性结合选自以下的肽:claveevsl(seqidno:1)、aveevslrk(seqidno:26)、claveevslrk(seqidno:27)、veevslrk(seqidno:28)和aveevslr(seqidno:29)。因此,本发明的核酸序列可用作所选的δnpm1肽的tcr特异性的重要组分,并因此可以用于产生编码tcr可变区的核酸序列,该tcr可变区具有所需的对靶标δnpm1阳性aml的抗原结合活性和特异性。
t细胞受体(tcr)是在t细胞(t淋巴细胞)表面上发现的一种分子,其负责识别结合靶细胞上主要组织相容性复合体(mhc)分子(由其呈现)的肽。本发明涉及编码在适当的mhc血清型的情况下与特定肽相互作用的tcr的核酸序列,例如在hla-a*02:01的情况下为claveevsl;或分别在hla-a*03:01和hla-a*11:01之一的情况下为aveevslrk或claveevslrk之一,或在hla-a*01:01的情况下为aveevslrk。
hla-a*02:01是hla-a血清型组中的全球常见人类白细胞抗原血清型。由hla-a*02:01呈现给tcr的肽被描述为“hla-a*02:01限制性的”。
hla-a*03:01、hla-a*11:01和hla-a*01:01也是hla-a血清型组中常见的人类白细胞抗原血清型。由hla-a*03:01呈现给tcr的肽被描述为“hla-a*03:01限制性的”。类似地,由hla-a*11:01呈现给tcr的肽被描述为“hla-a*11:01限制性的”。类似地,由hla-a*01:01呈现给tcr的肽被描述为“hla-a*01:01限制性的”。
所述tcr由两条不同的多肽链组成。在人类中,95%的tcr由一条alpha(α)链和一条beta(β)链组成(分别由tra和trb编码)。当tcr在hla的情况下(例如,在hla-a*02:01、hla-a*03:01或hla-a*11:01的情况下)与肽结合时,所述t细胞通过信号转导被激活。
tcr的α链和β链在序列上是高度可变的。每条链由两个胞外域组成,一个可变区(v)和一个恒定区(c)。恒定区靠近t细胞膜,随后是跨膜区和短的细胞质尾,而可变区则与肽/hla-a复合物结合。
每条链的可变区具有三个高变区(也称为互补决定区(cdr))。因此,tcrα链包含cdr1、cdr2和cdr3,并且tcrβ链也包含(不同的)cdr1、cdr2和cdr3。在每个α和β链中,主要是cdr3负责识别由hla-a呈现的肽。
在一个方面,本发明提供了分离的核酸序列,其编码:(a)包含tcrα链多肽的cdr3的多肽,该cdr3与选自以下的肽特异性结合:claveevsl(seqidno:1)、aveevslrk(seqidno:26)、claveevslrk(seqidno:27)、veevslrk(seqidno:28)和aveevslr(seqidno:29);和/或(b)包含tcrβ链多肽的cdr3的多肽,该cdr3与选自以下的肽特异性结合:claveevsl(seqidno:1)、aveevslrk(seqidno:26)、claveevslrk(seqidno:27)、veevslrk(seqidno:28)和aveevslr(seqidno:29)。
在一个具体的实施方案中,所述编码的多肽与claveevsl(seqidno:1)特异性结合。claveevsl可以是半胱氨酸形式。所述编码的多肽可以仅特异性地结合半胱氨酰化形式。
在一个具体的实施方案中,所述编码的多肽与aveevslrk(seqidno:26)特异性结合。
在一个具体的实施方案中,所述编码的多肽与claveevslrk(seqidno:27)特异性结合。claveevslrk可以是半胱氨酸形式。所述编码的多肽可以仅特异性地结合半胱氨酰化形式。
所述核酸序列可以编码(a)、(b)、或者(a)和(b)。因此,所述核酸序列编码至少一种包含t细胞受体多肽的cdr3的多肽,其中所述cdr3与以下肽之一特异性结合:claveevsl(seqidno:1)、aveevslrk(seqidno:26)、claveevslrk(seqidno:27)、veevslrk(seqidno:28)和aveevslr(seqidno:29)。
所述核酸序列可包括α链cdr3和β链cdr3,其中所述α链cdr3和β链cdr3一起特异性结合所选肽。
因此,所述核酸序列编码“tcrα链多肽的cdr3”(在本文中也称为alpha链cdr3或α链cdr3)和/或“tcrβ链多肽的cdr3”(在本文中也称为beta链cdr3或β链cdr3)。
α链cdr3可以是seqidno:2或以下所述的变体之一。类似地,β链cdr3可以是seqidno:5或以下所述的变体之一。注意,发明人已经发现这些特异性cdr3与seqidno:1的肽特异性结合。
以下针对(a)所述的任意排列可以与以下针对(b)所述的排列进行组合,例如,以形成编码功能性t细胞受体的合适核酸序列(即编码功能性tcrα链和功能性tcrβ链,其任选地由连接子序列隔开,该连接子序列可通过同一载体协调表达两种蛋白质或多肽)。
多肽(a)-tcrα链的组分
在一个实施方案中,(a)的cdr3可以具有seqidno:2的氨基酸序列,或其功能性变体(即,其中所述变体保留了特异性结合seqidno:1的肽的能力)。这样的功能性变体可以是天然存在的、合成的或合成地改进的seqidno:2的功能性变体。术语“变体”也包括同源物。功能性变体通常将仅包含seqidno:2的一个或多个氨基酸的保守取代,或蛋白质的非关键区域中非关键氨基酸的取代、缺失或插入。
非功能性变体是不与seqidno:1特异性结合的seqidno:2的氨基酸序列变体。非功能性变体通常将含有seqidno:2的氨基酸序列的非保守取代、缺失或插入或过早截断或在关键氨基酸或关键区域中的取代、插入或缺失。用于鉴定功能性和非功能性变体的方法是本领域普通技术人员众所周知的。
在一个实施方案中,(a)的cdr3可具有与seqidno:2的氨基酸序列具有至少90%序列同一性的氨基酸序列,同时保留特异性结合seqidno:1的肽的能力。换句话说,还涵盖与seqidno:2的序列相比具有一个氨基酸取代的功能性cdr3。如前所述,氨基酸取代可以是保守的氨基酸取代。适当地,同一性百分比可以计算为同一性相对于参考序列(例如seqidno:2)的整个长度的百分比。
在(a)的cdr3具有seqidno:2的氨基酸序列的实例中,cdr3可以由seqidno:3或seqidno:4的核酸序列或其遗传简并序列编码(即由于遗传密码的简并性编码相同蛋白质的其他核酸序列)。注意,seqidno:4是克隆1a2的cdr3的核酸序列的密码子优化版本(未优化的序列是seqidno:3)。因此,(a)的多肽由seqidno:3或seqidno:4的核酸序列或其遗传简并序列编码(即由于遗传密码的简并性编码相同蛋白质的其他核酸序列)。
在一个实施方案中,(a)的多肽在与seqidno:1的肽特异性结合的tcrα链可变区内包含cdr3(例如seqidno:2的cdr3或如上定义的变体)。换句话说,(a)的多肽可以含有包括所述的cdr3的tcrα链可变区,其中所述tcrα链可变区(和其中的cdr3)特异性结合seqidno:1的肽。如本领域技术人员将清楚的,短语“互补tcrα链可变区”是指tcrα链的可变(v)区(胞外结构域),并且因此包括三个高变区(cdr1、cdr2和所述cdr3)以及间隔序列,但不包括α链的恒定(c)区,其不形成可变链的部分。
除了所述的cdr3外,编码的tcrα链可变区还可以包含具有seqidno:14的氨基酸序列的cdr1或其功能性变体(即,其中变体保留了特异性结合seqidno:1的肽的n-末端的能力)。这样的功能性变体可以是天然存在的、合成的或合成改进的seqidno:14的功能性变体.术语“变体”也包括同源物。功能性变体通常将仅包含seqidno:14的一个或多个氨基酸的保守取代,或蛋白质的非关键区域中非关键氨基酸的取代、缺失或插入。
非功能性变体是不与seqidno:1肽的n-末端特异性结合的seqidno:14的氨基酸序列变体。非功能性变体通常将含有seqidno:14的氨基酸序列的非保守取代、缺失或插入或过早截断或在关键氨基酸或关键区域中的取代、插入或缺失。用于鉴定功能性和非功能性变体的方法是本领域普通技术人员众所周知的。
在一个实施方案中,(a)的cdr1(例如在α链可变区内)可具有与seqidno:14的氨基酸序列具有至少85%序列同一性的氨基酸序列,同时保留特异性结合seqidno:1的肽的n-末端的能力。换句话说,还涵盖与seqidno:14的序列相比具有一个氨基酸取代的功能性cdr1。如前所述,氨基酸取代可以是保守的氨基酸取代。适当地,同一性百分比可以计算为同一性相对于参考序列(例如seqidno:14)的整个长度的百分比。
在(a)的cdr1(例如在α链可变区内)具有seqidno:14的氨基酸序列的实例中,cdr1可以由seqidno:18或seqidno:19的核酸序列或其遗传简并序列编码(即由于遗传密码的简并性编码相同蛋白质的其他核酸序列)。注意,seqidno:19是克隆1a2的cdr1的核酸序列的密码子优化版本(非优化序列是seqidno:18)。因此,(a)的多肽由seqidno:18或seqidno:19的核酸序列或其遗传简并序列编码(即由于遗传密码的简并性编码相同蛋白质的其他核酸序列)。
除了所述的cdr3之外,编码的tcrα链可变区(和任选的上述的cdr1)还可以包含具有seqidno:15的氨基酸序列的cdr2或其功能性变体(即其中变体保留特异性结合hla-a*02:01的能力)。这样的功能性变体可以是天然存在的、合成的或合成改进的seqidno:15的功能性变体。术语“变体”也包括同源物。功能性变体通常将仅包含seqidno:15的一个或多个氨基酸的保守取代,或蛋白质的非关键区域中非关键氨基酸的取代、缺失或插入。
非功能性变体是不与hla-a*02:01特异性结合的seqidno:15的氨基酸序列变体。非功能性变体通常将含有seqidno:15的氨基酸序列的非保守取代、缺失或插入或过早截断或在关键氨基酸或关键区域中的取代、插入或缺失。用于鉴定功能性和非功能性变体的方法是本领域普通技术人员众所周知的。
在一个实施方案中,(a)的cdr2(例如在α链可变区内)可具有与seqidno:15的氨基酸序列具有至少85%序列同一性的氨基酸序列,同时保留结合hla-a*02:01的能力。换句话说,还涵盖与seqidno:15的序列相比具有一个氨基酸取代的功能性cdr2。如前所述,氨基酸取代可以是保守的氨基酸取代。适当地,同一性百分比可以计算为同一性相对于参考序列(例如seqidno:15)的整个长度的百分比。
在(a)的cdr2(例如在α链可变区内)具有seqidno:15的氨基酸序列的实例中,cdr2可以由seqidno:20或seqidno:21的核酸序列或其遗传简并序列编码(即由于遗传密码的简并性编码相同蛋白质的其他核酸序列)。注意,seqidno:21是克隆1a2的cdr2的核酸序列的密码子优化版本(非优化序列是seqidno:20)。因此,(a)的多肽由seqidno:20或seqidno:21的核酸序列或其遗传简并序列编码(即由于遗传密码的简并性编码相同蛋白质的其他核酸序列)。
因此,(a)的多肽可以包含tcrα链可变区,该tcrα链可变区包含上文详细提及的cdr(具体地通过seqid,或其变体),并且在cdr之间具有适当的插入序列。
(a)的tcrα链可变区可以具有seqidno:8的氨基酸序列或其功能性变体(即,其中所述变体保留特异性结合seqidno:1的肽的能力)。这样的功能性变体可以是天然存在的、合成的或合成改进的seqidno:8的功能性变体。术语“变体”也包括同源物。功能性变体通常将仅包含seqidno:8的一个或多个氨基酸的保守取代,或蛋白质的非关键区域中非关键氨基酸的取代、缺失或插入。
非功能性变体是不与seqidno:1特异性结合的seqidno:8的氨基酸序列变体。非功能性变体通常将含有seqidno:8的氨基酸序列的非保守取代、缺失或插入或过早截断或在关键氨基酸或关键区域中的取代、插入或缺失。用于鉴定功能性和非功能性变体的方法是本领域普通技术人员众所周知的。
在一个实施方案中,(a)的tcrα链可变区可具有与seqidno:8的氨基酸序列具有至少75%、至少80%、至少85%或至少90%(或至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%)的序列同一性的氨基酸序列,同时保留与seqidno:1的肽特异性结合的能力。换句话说,还涵盖与seqidno:8的序列相比具有一个或多个氨基酸取代的功能性tcrα链可变区。如前所述,氨基酸取代可以是保守的氨基酸取代。与seqidno:8相比的序列可变性可以全部在不形成cdr的tcrα链可变区的区域中(即,变体可以具有seqidno:2、seqidno:14和/或seqidno:15的cdr,并且与seqidno:8相比仍具有25%(或更少)的序列变异性)。换句话说,可以保留seqidno:8的cdr的序列而其余序列是变化的,如以上所述的适当地在“至少75%同一性”参数内。适当地,同一性百分比可以计算为同一性相对于参考序列(例如seqidno:8)的整个长度的百分比。
作为一个实例,(a)的多肽可在tcrα链可变区内包含cdr3,所述tcrα链可变区与seqidno:8的氨基酸序列具有至少75%(例如,至少75%、至少80%、至少85%、至少90%、至少95%等)的序列同一性,其中所述cdr3具有seqidno:2的氨基酸序列。在该实例中,tcrα链可变区cdr1可以具有seqidno:14的氨基酸序列,而tcrα链可变区cdr2可以具有seqidno:15的氨基酸序列。
在(a)的tcrα链可变区具有seqidno:8的氨基酸序列的实例中,所述tcrα链可变区可以由seqidno:9或seqidno:10的核酸序列或其遗传简并序列编码(即由于遗传密码的简并性编码相同蛋白质的其他核酸序列)。注意,seqidno:10是克隆1a2的tcrα链可变区的核酸序列的密码子优化版本(非优化序列是seqidno:9)。因此,(a)的多肽由seqidno:9或seqidno:10的核酸序列或其遗传简并序列编码(即由于遗传密码的简并性编码相同蛋白质的其他核酸序列)。
为了避免疑问,(a)的多肽可以包含tcrα链可变区(如上文所述)和tcrα链恒定区。合适的恒定区的实例由genscript在本文使用的mp71-tcr-flex逆转录病毒载体中编码。然而,本发明不限于该特定的恒定区,而是包括任何合适的tcrα链恒定区。恒定区可以是鼠源的,人源的或人源化的。识别或产生合适的恒定区的方法是本领域技术人员众所周知的,并且在其常规能力之内。
仅作为示例,恒定区可以由载体编码或衍生自载体,例如慢病毒、逆转录病毒或质粒载体,还可以是腺病毒、腺相关病毒、牛痘病毒、金丝雀痘病毒或疱疹病毒载体,其中鼠或人恒定区是预先克隆的。近来,还已经描述了用于tcr基因转导的微环(来自微环载体的非病毒性睡美人转座,如rmonjezi,cmiskey,tgogishvili,mschleef,mschmeer,heinsele,zivicsandmhudecekinleukemia2016所公开的)。此外,也可以使用裸露的(合成的)dna/rna引入tcr。例如,如lvcoren等人,biotechniques2015中所述,具有预克隆的tcr-ca和cb基因的pmsgv逆转录病毒载体可用于提供合适的恒定区。
多肽(b)-tcrβ链的组分
在一个实施方案中,(b)的cdr3可以具有seqidno:5的氨基酸序列,或其功能性变体(即,其中所述变体保留了特异性结合seqidno:1的肽的能力)。这样的功能性变体可以是天然存在的、合成的或合成改进的seqidno:5的功能性变体。术语“变体”也包括同源物。功能性变体通常将仅包含seqidno:5的一个或多个氨基酸的保守取代,或蛋白质的非关键区域中非关键氨基酸的取代、缺失或插入。
非功能性变体是不与seqidno:1特异性结合的seqidno:5的氨基酸序列变体。非功能性变体通常将含有seqidno:5的氨基酸序列的非保守取代、缺失或插入或过早截断或在关键氨基酸或关键区域中的取代、插入或缺失。用于鉴定功能性和非功能性变体的方法是本领域普通技术人员众所周知的。
在一个实施方案中,(b)的cdr3可具有与seqidno:5的氨基酸序列具有至少90%序列同一性的氨基酸序列,同时保留特异性结合seqidno:1的肽的能力。换句话说,还涵盖与seqidno:5的序列相比具有一个氨基酸取代的功能性cdr3。如前所述,氨基酸取代可以是保守的氨基酸取代。适当地,同一性百分比可以计算为同一性相对于参考序列(例如seqidno:5)的整个长度的百分比。
在(b)的cdr3具有seqidno:5的氨基酸序列的实例中,cdr3可以由seqidno:6或seqidno:7的核酸序列或其遗传简并序列编码(即由于遗传密码的简并性编码相同蛋白质的其他核酸序列)。注意,seqidno:7是克隆1a2的cdr3的核酸序列的密码子优化版本(未优化的序列是seqidno:6)。因此,(b)的多肽由seqidno:6或seqidno:7的核酸序列或其遗传简并序列编码(即由于遗传密码的简并性编码相同蛋白质的其他核酸序列)。
在一个实施方案中,(b)的多肽在与seqidno:1的肽特异性结合的tcrβ链可变区内包含cdr3(例如seqidno:5的cdr3或如上定义的变体)。换句话说,(b)的多肽包含tcrβ链可变区,其包括所述的cdr3,其中tcrβ链可变区(和其内的cdr3)特异性结合seqidno:1的肽。如本领域技术人员将清楚的,短语“互补tcrβ链可变区”是指tcrβ链的可变(v)区(胞外结构域),并且因此包括三个高变区(cdr1、cdr2和所述cdr3)以及间隔序列,但不包括β链的恒定(c)区,其不形成可变链的部分。
除了所述的cdr3外,编码的tcrβ链可变区还可以包含具有seqidno:16的氨基酸序列的cdr1或其功能性变体(即,其中变体保留了特异性结合seqidno:1的c-末端的能力)。这样的功能性变体可以是天然存在的、合成的或合成改进的seqidno:16的功能性变体。术语“变体”也包括同源物。功能性变体通常将仅包含seqidno:16的一个或多个氨基酸的保守取代,或蛋白质的非关键区域中非关键氨基酸的取代、缺失或插入。
非功能性变体是不与seqidno:1肽的c-末端特异性结合的seqidno:16的氨基酸序列变体。非功能性变体通常将含有seqidno:16的氨基酸序列的非保守取代、缺失或插入或过早截断或在关键氨基酸或关键区域中的取代、插入或缺失。用于鉴定功能性和非功能性变体的方法是本领域普通技术人员众所周知的。
在一个实施方案中,(b)的cdr1(例如在β链可变区内)可具有与seqidno:16的氨基酸序列具有至少80%序列同一性的氨基酸序列,同时保留特异性结合seqidno:1的肽的c-末端的能力。换句话说,还涵盖与seqidno:16的序列相比具有一个氨基酸取代的功能性cdr1。如前所述,氨基酸取代可以是保守的氨基酸取代。适当地,同一性百分比可以计算为同一性相对于参考序列(例如seqidno:16)的整个长度的百分比。
在(b)的cdr1(例如在β链可变区内)具有seqidno:16的氨基酸序列的实例中,cdr1可以由seqidno:22或seqidno:23的核酸序列或其遗传简并序列编码(即由于遗传密码的简并性编码相同蛋白质的其他核酸序列)。注意,seqidno:23是克隆1a2的cdr1的核酸序列的密码子优化版本(非优化序列是seqidno:22)。因此,(b)的多肽由seqidno:22或seqidno:23的核酸序列或其遗传简并序列编码(即由于遗传密码的简并性编码相同蛋白质的其他核酸序列)。
除了所述的cdr3之外,编码的tcrβ链可变区(和任选的上述的cdr1)还可以包含具有seqidno:17的氨基酸序列的cdr2或其功能性变体(即其中变体保留特异性结合hla-a*02:01的能力)。这样的功能性变体可以是天然存在的、合成的或合成改进的seqidno:17的功能性变体。术语“变体”也包括同源物。功能性变体通常将仅包含seqidno:17的一个或多个氨基酸的保守取代,或蛋白质的非关键区域中非关键氨基酸的取代、缺失或插入。
非功能性变体是不与hla-a*02:01特异性结合的seqidno:17的氨基酸序列变体。非功能性变体通常将含有seqidno:17的氨基酸序列的非保守取代、缺失或插入或过早截断或在关键氨基酸或关键区域中的取代、插入或缺失。用于鉴定功能性和非功能性变体的方法是本领域普通技术人员众所周知的。
在一个实施方案中,(b)的cdr2(例如在β链可变区内)可具有与seqidno:17的氨基酸序列具有至少90%序列同一性的氨基酸序列,同时保留结合hla-a*02:01的能力。换句话说,还涵盖与seqidno:17的序列相比具有一个氨基酸取代的功能性cdr2。如前所述,氨基酸取代可以是保守的氨基酸取代。适当地,同一性百分比可以计算为同一性相对于参考序列(例如seqidno:17)的整个长度的百分比。
在(b)的cdr2(例如在β链可变区内)具有seqidno:17的氨基酸序列的实例中,cdr2可以由seqidno:24或seqidno:25的核酸序列或其遗传简并序列编码(即由于遗传密码的简并性编码相同蛋白质的其他核酸序列)。注意,seqidno:25是克隆1a2的cdr2的核酸序列的密码子优化版本(非优化序列是seqidno:24)。因此,(b)的多肽由seqidno:24或seqidno:25的核酸序列或其遗传简并序列编码(即由于遗传密码的简并性编码相同蛋白质的其他核酸序列)。
因此,(b)的多肽可以包含tcrβ链可变区,该tcrβ链可变区包含上文详细提及的cdr(具体地通过seqid,或其变体),并且在cdr之间具有适当的插入序列。
(b)的tcrβ链可变区可以具有seqidno:11的氨基酸序列或其功能性变体(即,其中所述变体保留特异性结合seqidno:1的肽的能力)。这样的功能性变体可以是天然存在的、合成的或合成改进的seqidno:11的功能性变体。术语“变体”也包括同源物。功能性变体通常将仅包含seqidno:11的一个或多个氨基酸的保守取代,或蛋白质的非关键区域中非关键氨基酸的取代、缺失或插入。
非功能性变体是不与seqidno:1特异性结合的seqidno:11的氨基酸序列变体。非功能性变体通常将含有seqidno:11的氨基酸序列的非保守取代、缺失或插入或过早截断或在关键氨基酸或关键区域中的取代、插入或缺失。用于鉴定功能性和非功能性变体的方法是本领域普通技术人员众所周知的。
在一个实施方案中,(b)的tcrβ链可变区可具有与seqidno:11的氨基酸序列具有至少75%、至少80%、至少85%或至少90%(或至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%)的序列同一性的氨基酸序列,同时保留与seqidno:1的肽特异性结合的能力。换句话说,还涵盖与seqidno:11的序列相比具有一个或多个氨基酸取代的功能性tcrβ链可变区。如前所述,氨基酸取代可以是保守的氨基酸取代。与seqidno:11相比的序列可变性可以全部在不形成cdr的tcrβ链可变区的区域中(即,变体可以具有seqidno:5、seqidno:16和/或seqidno:17的cdr,并且与seqidno:11相比仍具有25%(或更少)的序列变异性)。换句话说,可以保留seqidno:11的cdr的序列而其余序列是变化的,如以上所述的适当地在“至少75%同一性”参数内。适当地,同一性百分比可以计算为同一性相对于参考序列(例如seqidno:11)的整个长度的百分比。
作为一个实例,(b)可以在tcrβ链可变区内包括cdr3,所述tcrβ链可变区与seqidno:11的氨基酸序列具有至少75%(例如,至少75%、至少80%、至少85%、至少90%、至少95%等)的序列同一性,其中所述cdr3具有seqidno:5的氨基酸序列。在该实例中,tcrβ链可变区cdr1可以具有seqidno:16的氨基酸序列,而tcrβ链可变区cdr2可以具有seqidno:17的氨基酸序列。
在(b)的tcrβ链可变区具有seqidno:11的氨基酸序列的实例中,所述tcrβ链可变区可以由seqidno:12或seqidno:13的核酸序列或其遗传简并序列编码(即由于遗传密码的简并性编码相同蛋白质的其他核酸序列)。注意,seqidno:13是克隆1a2的tcrβ链可变区的核酸序列的密码子优化版本(非优化序列是seqidno:12)。因此,(b)的多肽由seqidno:12或seqidno:13的核酸序列或其遗传简并序列编码(即由于遗传密码的简并性编码相同蛋白质的其他核酸序列)。
为了避免疑问,(b)可以包括tcrβ链可变区(如上所述)和tcrβ链恒定区。合适的恒定区的实例由genscript在本文使用的mp71-tcr-flex逆转录病毒载体中编码。然而,本发明不限于该特定的恒定区,并且包括任何适当的tcrβ链恒定区。恒定区可以是鼠源的,人源的或人源化的。识别或产生合适的恒定区的方法是本领域技术人员众所周知的,并且在其常规能力之内。
仅作为示例,恒定区可以由载体编码或衍生自载体,例如慢病毒、逆转录病毒或质粒载体,还可以是腺病毒、腺相关病毒、牛痘病毒、金丝雀痘病毒或疱疹病毒载体,其中鼠或人恒定区是预先克隆的。近来,还已经描述了用于tcr基因转导的微环(来自微环载体的非病毒性睡美人转座,如rmonjezi,cmiskey,tgogishvili,mschleef,mschmeer,heinsele,zivicsandmhudecekinleukemia2016所公开的)。此外,也可以使用裸露的(合成的)dna/rna引入tcr。例如,发明人使用的具有预克隆的tcr-ca和cb基因的mp71-tcr-flex逆转录病毒载体,或使用如lvcoren等人,biotechniques2015中所述的具有预克隆的tcr-ca和cb基因的pmsgv逆转录病毒载体来提供合适的恒定区。
在本发明的核酸分子编码(a)和(b)两者的实例中,(a)的多肽可以通过接头(例如能够通过同一载体表达两种蛋白质或多肽的接头)与(b)的多肽连接。举例来说,可以使用包含猪捷申病毒-12a(p2a)序列的接头,例如,如a.l.szymczak等人,naturebiotechnology22,589-594(2004)所公开的来自手足口病毒(f2a)、马鼻炎a病毒(e2a)或明脉扁刺蛾病毒(thoseaasignavirus)(t2a)的2a序列或2a样序列。2a和2a样序列是一旦核酸分子被转录和翻译后就可裂解的接头。接头的另一个例子是内部核糖体进入位点(ires),其能够通过相同的转录物翻译两种蛋白质或多肽。也可以使用任何其它合适的接头。合适的接头的鉴定完全在本领域技术人员的常规能力范围内。作为另一个例子,可以将编码(a)的核酸序列和编码(b)的核酸序列克隆到具有双重内部启动子的载体中(参见例如sjones等人,humangenether2009)。
其他合适的多肽结构域也可以由本发明的核酸序列编码。仅作为示例,核酸序列可以包含膜靶向序列,其提供了所编码的多肽向修饰细胞的细胞表面膜的转运。其它合适的附加结构域是众所周知的,并且例如在wo2016/071758中描述。
在一个实施方案中,本发明的核酸序列可以编码可溶性tcr。例如,核酸序列可以编码(a)和(b),其中(a)和(b)分别包含tcrα和β链的可变区,以及任选地免疫调节分子,例如cd3激动剂(例如抗cd3scfv)。cd3抗原存在于成熟的人类t细胞、胸腺细胞和部分自然杀伤细胞上。它与tcr相关并且涉及tcr的信号转导。对人cd3抗原特异的抗体是众所周知的。一种这样的抗体是鼠单克隆抗体okt3,它是fda批准的首个单克隆抗体。还已经报道了对cd3具有特异性的其他抗体(参见例如wo2004/106380;美国专利申请公开号2004/0202657;美国专利号6,750,325)。对抗癌症的免疫动员mtcr(immtac;immunocorelimited,miltonpartk,abington,oxon,英国)是双功能蛋白,其结合了靶向治疗作用机制(即抗cd3scfv)的亲和性t细胞受体(mtcr)。在另一实例中,本发明的可溶性tcr可与放射性同位素或毒性药物组合。适当的放射性同位素和/或毒性药物在本领域中是众所周知的,并且本领域普通技术人员可以容易地识别。
在一个实施方案中,本发明的核酸序列可以编码嵌合单链tcr,其中(a)的多肽(例如tcrα链可变区)与(b)的多肽(例如tcrβ链可变区)以及恒定区连接,所述恒定区例如融合到cd3δ信号结构域。在该实例中,接头是不可裂解的。在另一个实施方案中,本发明的核酸序列可以编码嵌合双链tcr,其中(a)的多肽(例如tcrα链可变区)和(b)的多肽(例如tcrβ链可变区)分别链接到cd3δ信号结构域。制备这种单链tcr和双链tcr的方法在本领域中是众所周知的;参见例如rawillemsen等人,genetherapy2000。
本发明还提供了编码本发明的肽(和相应的载体)的分离的核酸序列。本文中与核酸序列和载体有关的所有一般性表述都同样适用。基于本文提供的肽序列,本领域技术人员将容易地鉴定合适的核酸序列和载体。
载体和修饰的细胞
在一个方面,本发明提供了包含本文所述的核酸序列的载体。可以使用任何适当的载体。仅以举例的方式,载体可以是质粒或病毒载体,例如逆转录病毒载体或慢病毒载体。还可以使用腺病毒、腺相关病毒、牛痘病毒、金丝雀痘病毒、疱疹病毒、微环载体和裸(合成)dna/rna(有关微环载体的详细信息,请参见例如微环载体的非病毒“睡美人”转座,如rmonjezi,cmiskey,tgogishvili,mschleef,mschmeer,heinsele,zivicsandmhudecekinleukemia2016所公开的)。
任选地,载体包含可操作地连接至启动子的核酸序列。
如本文所用,术语“载体”是指能够转运已经与其可操作地连接的另一核酸序列的核酸序列。载体可以自主复制或整合入宿主dna。载体可以包括用于插入重组dna的限制性酶切位点,并且可以包括一种或多种选择标记或自杀基因。载体可以是质粒、噬菌体或粘粒形式的核酸序列。优选地,载体适合用于在细胞中表达(即,载体是“表达载体”)。优选地,载体适合用于在人t细胞如cd8+t细胞或cd4+t细胞中表达。在某些方面,载体是病毒载体,例如逆转录病毒载体、慢病毒载体或腺相关载体。任选地,所述载体选自腺病毒、牛痘病毒、金丝雀痘病毒、疱疹病毒、微环载体和合成dna或合成rna。
优选地,所述(表达)载体能够在宿主细胞中繁殖并稳定地传递至后代。
如本文所用,“可操作地连接”是指单个下述控制元件或其与编码序列一起以功能关系形成的彼此之间的组合,例如以连接关系以便指导编码的表达。
所述载体可以包含调控序列。如本文所用,“调控序列”是指能够控制基因表达的dna或rna元件。表达控制序列的实例包括启动子、增强子、沉默子、tata盒、内部核糖体进入位点(ires),转录因子的附着位点、转录终止子、聚腺苷酸化位点等。任选地,所述载体包括与要表达的核酸序列有效连接的一个或多个调控序列。调控序列包括指导组成性表达的序列以及组织特异性调控和/或诱导序列。
所述载体可以包含启动子。如本文所用,“启动子”是指rna聚合酶与其结合以开始转录的dna中的核苷酸序列。所述启动子可以是诱导型或组成性表达的。或者,所述启动子受阻遏蛋白或刺激蛋白的控制。所述启动子可以是宿主细胞中非天然存在的启动子(例如,它可以是外源启动子)。本领域技术人员充分了解用于表达靶蛋白的合适启动子,其中选择的启动子将取决于宿主细胞。
所述载体可以包含转录终止子。如本文所用,“转录终止子”是指dna元件,其终止负责将dna转录成rna的rna聚合酶的功能。优选的转录终止子的特征在于一系列t残基,然后是富含gc的二重对称区域。
所述载体可以包含翻译控制元件。如本文所用,“翻译控制元件”是指控制mrna翻译的dna或rna元件。优选的翻译控制元件是核糖体结合位点。优选地,所述翻译控制元件来自启动子的同源系统,例如启动子及其相关的核酶结合位点。优选的核糖体结合位点是已知的,并且将取决于所选择的宿主细胞。
所述载体可包含限制性酶识别位点。如本文所用,“限制性酶识别位点”是指dna上被限制性酶识别的基序。
所述载体可以包含可选择标记。如本文所用,“可选择标记”是指当在宿主细胞中表达时将表型赋予细胞的蛋白质,其允许选择表达所述选择标记基因的细胞。通常,这可以是赋予宿主细胞新的有益特性的蛋白质(例如抗生素抗性),也可以是在细胞表面表达并因此可与抗体结合的蛋白质。合适的可选择标记物是本领域众所周知的。
任选地,所述载体还可以包含自杀基因。如本文所用,“自杀基因”是指在用特定药物治疗时诱导修饰的细胞死亡的蛋白质。举例来说,在用包括更昔洛韦(ganciclovir)在内的特定核苷类似物处理后,可以诱导由单纯疱疹病毒胸苷激酶基因修饰的细胞自杀,在用抗cd20单克隆抗体处理后可以诱导由人cd20修饰的细胞自杀,和用ap1903处理后可以诱导用诱导型胱天蛋白酶9(icasp9)修饰的细胞自杀(综述见于bsjones,lslamb,fgoldman,adistasi;improvingthesafetyofcelltherapyproductsbysuicidegenetransfer.frontpharmacol.(2014)5:254.)。合适的自杀基因在本领域是众所周知的。
优选地,所述载体包含由宿主细胞表达本文所述多肽所必需的那些遗传元件。宿主细胞中转录和翻译所需的元件包括启动子、目的蛋白的编码区和转录终止子。
本领域技术人员将充分了解可用于制备(表达)载体的分子技术,以及如何将(表达)载体转导或转染到合适的宿主细胞中(从而产生本发明的修饰的细胞)。本发明的(表达)载体可以通过例如转化、转染或转导的常规技术引入细胞。“转化”、“转染”和“转导”通常是指用于将外来(外源)核酸序列引入宿主细胞的技术,因此包括诸如电穿孔、显微注射、基因枪递送、用逆转录病毒、慢病毒或腺相关载体转导、脂质体转染、superfection等方法。通常使用的具体方法取决于载体的类型和细胞。将核酸序列和载体引入如人细胞的宿主细胞中的合适方法是本领域众所周知的;参见,例如,sambrook等人(1989)molecularcloning,alaboratorymanual,coldspringharborlaboratory,coldspringharbor,纽约;ausubel等人(1987)currentprotocolsinmolecularbiology,johnwileyandsons,inc.,纽约;cohen等人(1972)proc.natl.acad.sci.usa69,2110;luchansky等人(1988)mol.microbiol.2,637-646。适合于制备表达载体并将其引入合适的宿主细胞的其他常规方法在例如wo2016/071758中有详细描述。
应当理解,在一些实施方案中,宿主细胞在体外、离体与载体(例如病毒载体)接触,而在一些实施方案中,宿主细胞在体内与载体(例如病毒载体)接触。
术语“宿主细胞”包括可以将本发明细胞的核酸序列或载体引入(例如转导)其中的任何细胞。一旦将核酸分子或载体引入细胞,其在本文中可称为“修饰的细胞”。一旦将核酸分子或载体引入宿主细胞,所得修饰的细胞应能够表达编码的多肽(并且例如对于其预期功能正确地定位编码的多肽,例如将编码的tcr转运至细胞表面)。
术语“修饰的细胞”是指遗传改变的(例如,转化或转染的)细胞。该术语指特定的对象细胞,也指该细胞的后代或潜在后代。由于突变或环境影响,某些修饰可能会在后代中发生,因此此类后代实际上可能与亲本细胞不同,但仍包含在本文所用术语的范围内。
所述宿主细胞(因此是修饰的细胞)通常是真核细胞,特别是人细胞(例如t细胞,例如cd8+t细胞或cd4+t细胞,或其混合物)。所述宿主细胞(并因此是修饰的细胞)可以是自体细胞(例如,如cd8+t细胞或cd4+t细胞的自体t细胞,或其混合物),其是指源自稍后对其施用的相同个体的细胞。换句话说,所述宿主细胞(以及因此修饰的细胞)可以是从待治疗的受试者分离的t细胞。适当地,所述宿主细胞(因此修饰的细胞)可以例如通过白细胞分离术从血液样品中分离。
所述宿主细胞(以及因此修饰的细胞)可以是能够在tcr基因转导之后赋予抗肿瘤免疫的任何细胞。合适细胞的非限制性实例包括自体或同种异体自然杀伤(nk)细胞、nkt细胞、γ-δt细胞、造血干细胞或其他祖细胞以及任何其他自体或同种异体细胞或细胞系(例如,nk-92或t细胞系),其能够在tcr基因转导后赋予抗肿瘤免疫力。
有利地,所述修饰的细胞能够表达由本发明的核酸序列或载体编码的多肽(例如tcr或tcr组分),使得修饰的细胞提供特异性靶向δnpm1恶性细胞的免疫疗法,并且因此可以用于治疗或预防具有δnpm1的血液恶性肿瘤。下面给出关于该用途的更多细节。
免疫原性肽
发明人已经鉴定出存在于δnpm1阳性原发性aml患者的hlai类配体组中的五种肽。即claveevsl(seqidno:1)、aveevslrk(seqidno:26)、claveevslrk(seqidno:27)、veevslrk(seqidno:28)和aveevslr(seqidno:29)。
为了避免疑问,除非另有明确说明,否则本文中对“seqidno:1”的一般提及包括肽claveevsl的半胱氨酸和非半胱氨酰化形式两者。
在分离的肽的背景中,本发明具体地提供了包含氨基酸序列claveevsl(seqidno:1)的分离的肽,其中claveevsl(seqidno:1)中的半胱氨酸氨基酸可以是或可以不是半胱氨酰化的。
在一个具体的实施方案中,claveevsl中的半胱氨酸氨基酸是半胱氨酰化的。
为了避免疑问,除非另有明确说明,否则本文中对“seqidno:27”的一般提及包括肽claveevslrk的半胱氨酸和非半胱氨酰化形式两者。
在分离的肽的背景中,本发明具体地提供了包含氨基酸序列claveevslrk(seqidno:27)的分离的肽,其中claveevslrk(seqidno:27)中的半胱氨酸氨基酸可以是或可以不是半胱氨酰化的。
在一个具体的实施方案中,claveevslrk中的半胱氨酸氨基酸是半胱氨酰化的。
因此,本发明提供了一种分离的肽,其包含选自以下的氨基酸序列:(i)claveevsl(seqidno:1),其中半胱氨酸氨基酸可以是或可以不是半胱氨酰化的;(ii)aveevslrk(seqidno:26);(iii)claveevslrk(seqidno:27),其中半胱氨酸氨基酸可以是或可以不是半胱氨酰化的;(iv)veevslrk(seqidno:28);(v)和aveevslr(seqidno:29)。
在一个具体的实施方案中,claveevsl或claveevslrk中的半胱氨酸氨基酸是半胱氨酰化的。
如本文所用,“分离的肽”是指不在其天然环境中的肽。因此,肽可以是合成来源的(或者,天然原始的,但与其天然环境分离)。
所述分离的肽可以是相对短的(即不超过20个氨基酸;例如不超过19、18、17、16、15、14、13、12、11或10个氨基酸)。所述肽可以仅由seqidno:1(其中半胱氨酸氨基酸可能是或可能不是半胱氨酰化的)、seqidno:26、seqidno:27(其中半胱氨酸氨基酸可能是或可能不是半胱氨酰化的)、seqidno:28或seqidno:29的氨基酸序列组成。
在一个具体的实施方案中,claveevsl或claveevslrk中的半胱氨酸氨基酸是半胱氨酰化的。
可以将所述分离的肽施用于人受试者,以治疗或预防δnpm1阳性血液恶性肿瘤。例如,可以将所述分离的肽施用于受试者以诱导或增强其免疫应答。因此,可以将所述肽施用于受试者以诱导受试者中的t细胞激活(例如体内t细胞激活),其中活化的t细胞对肽具有特异性(因此将特异性地靶向δnpm1阳性恶性细胞)。
所述分离的肽可以作为用于治疗或预防δnpm1阳性aml的肽疫苗施用。可以施用所述分离的肽以诱导或增强对δnpm1阳性恶性细胞特异的t细胞的激活。
发明人已经表明:(i)claveevsl(seqidno:1)、(ii)aveevslrk(seqidno:26);和(iii)claveevslrk(seqidno:27)是与t细胞结合的δnpm1肽。这些肽在体内呈现给δnpm1阳性受试者的t细胞库。本文已经证明了这些肽与t细胞的结合。因此,这些肽代表了可以在个体化疫苗的开发中进一步利用的bonafide免疫原性δnpm1-特异性抗原,其可以特别有用地作为其他疗法的辅助剂(例如本文所述的act)。这些免疫原性肽因此可以以肽、rna、dna、基于树突细胞的疗法和基于过继的tcr转基因t细胞的疗法的形式用作免疫疗法(有关适当的综述,请参见参考文献23)。
本发明人还表明,(iv)veevslrk(seqidno:28)和(v)aveevslr(seqidno:29)是存在于原发性aml表面上的hla结合肽。
分离的肽,其包含选自以下的氨基酸序列:(i)claveevsl(seqidno:1),其中半胱氨酸氨基酸可以是或可以不是半胱氨酰化的;(ii)aveevslrk(seqidno:26);(iii)claveevslrk(seqidno:27),其中半胱氨酸氨基酸可以是或可以不是半胱氨酰化的;(iv)veevslrk(seqidno:28);(v)和aveevslr(seqidno:29)可以因此用作免疫疗法。例如,此类分离的肽可用作患有、有风险患有或被怀疑患有δnpm1阳性aml的受试者的免疫疗法。编码这些肽的核酸序列和载体也可用于此目的。
可以基于受试者的hla-a状态来选择用于施用的所述的肽。如本文其他地方所解释的,包含seqidno:1的序列的肽可能特别适合用于对hla-a*02:01阳性的受试者施用,而包含seqidno:26或seqidno:27的序列的肽可能特别适合用于对hla-a*03:01或hla-a*11:01呈阳性的受试者施用。
本发明的分离的肽也可以以包含多于一种上述肽的组合物的形式提供。举例来说,分离的肽可以作为包含以下成分的混合物的组合物提供(和/或施用):(a)包含氨基酸序列claveevsl(seqidno:1)的分离的肽,其中claveevsl(seqidno:1)中的半胱氨酸氨基酸是半胱氨酰化的;和(b)包含氨基酸序列claveevsl(seqidno:1)的分离的肽,其中claveevsl(seqidno:1)中的半胱氨酸氨基酸不是半胱氨酰化的。所述组合物对于在hla-a*02:01呈阳性的受试者中治疗或预防δnpm1阳性血液恶性肿瘤特别有用,因为它可用于诱导t细胞激活(例如受试者体内的t细胞激活),其中激活的t细胞具有特异于seqidno:1的肽的半胱氨酰化和/或非半胱氨酰化形式之一(或两者)的tcr。
作为替代实例,可以提供一种包含以下混合物的肽组合物:(a)包含seqidno:26的氨基酸序列的分离的肽;(b)包含seqidno:27的氨基酸序列的分离的肽。所述组合物在对于治疗或预防hla-a*03:01或hla-a*11:01呈阳性的受试者中δnpm1阳性血液恶性肿瘤特别有用,因为这些肽均由这些hla-a血清型中的任何一种呈现。
与肽claveevsl相似,seqidno:27的肽也可以其半胱氨酰化和非半胱氨酰化的形式用于疫苗接种。因此,作为替代实例,分离的肽可以作为包含以下混合物的组合物提供(和/或施用):(a)包含seqidno:27的氨基酸序列的分离的肽,其中半胱氨酸氨基酸是半胱氨酰化的;(b)包含seqidno:27的氨基酸序列的分离的肽,其中半胱氨酸氨基酸不是半胱氨酰化的;所述组合物对于在hla-a*03:01或hla-a*11:01呈阳性的受试者中治疗或预防δnpm1阳性血液恶性肿瘤特别有用,因为它可用于诱导t细胞激活(例如受试者体内的t细胞激活),其中激活的t细胞具有特异于seqidno:27的肽的半胱氨酰化和/或非半胱氨酰化形式之一(或两者)的tcr。
药物组合物
本文所述的核酸序列、载体、修饰的细胞、分离的蛋白质或肽可以作为药物组合物的部分提供。有利地,可以将此类组合物施用于具有δnpm1阳性血液恶性肿瘤的人类受试者,以治疗或预防δnpm1阳性血液恶性肿瘤(例如,通过诱导或增强δnpm1-靶向特异性免疫应答)。如本文其他地方详细描述的,可以基于人类受试者的hla-a血清型选择特别合适的组合物。
药物组合物可包含本文所述的核酸序列、载体、修饰的细胞或分离的蛋白质或肽以及药学上可接受的赋形剂、佐剂、稀释剂和/或载体。
组合物通常可以包含药学上可接受浓度的盐、缓冲剂、防腐剂、相容性载体、补充免疫增强剂(例如佐剂和细胞因子),以及任选地其他治疗剂或化合物。
如本文所用,“药学上可接受的”是指不在生物学上或以其他方式不期望的材料,即,该材料可以与所选择的核酸序列、载体、修饰的细胞或分离的肽一起施用于个体,而不引起任何不期望的生物学效应或以有害的方式与其中包含它的药物组合物的任何其他组分相互作用。
赋形剂是与活性成分(例如,本文提供的核酸序列、载体、修饰的细胞或分离的肽)一起配制的天然或合成物质,其目的是为了扩大配方或在最终剂型中赋予活性成分以治疗上的增强作用,例如促进药物吸收或溶解性。赋形剂还可以用于制造过程中,例如通过促进粉末的流动性或不粘特性来帮助处理有关的活性物质,此外还可以辅助体外稳定性,例如防止在预期的保质期内变性。药学上可接受的赋形剂是本领域众所周知的。因此,本领域普通技术人员可以容易地确定合适的赋形剂。举例来说,合适的药学上可接受的赋形剂包括水、盐水、含水葡萄糖、甘油、乙醇等。
佐剂是改变制剂中其他试剂作用的药理和/或免疫学试剂。药学上可接受的佐剂是本领域众所周知的。因此,本领域普通技术人员可以容易地确定合适的佐剂。
稀释剂是稀释的剂。药学上可接受的稀释剂是本领域众所周知的。因此,本领域普通技术人员可以容易地确定合适的稀释剂。
载体在使用的剂量和浓度下对受体无毒,并且与制剂中的其他成分相容。术语“载体”表示天然或合成的有机或无机成分,活性成分与其结合以促进应用。药学上可接受的载体是本领域众所周知的。因此,本领域普通技术人员可以容易地识别合适的载体。
受试者的治疗
本发明的组合物可有利地用于治疗或预防人类受试者中的δnpm1阳性血液恶性肿瘤。如本文其他地方详细讨论的,可以基于人类受试者的hla-a血清型选择合适的组合物。
在一个实施方案中,本文所述的治疗或预防δnpm1阳性血液恶性肿瘤的方法导致受试者中诱导或增强的免疫应答(例如细胞介导的应答)(例如对呈现hla-a限制性肽的恶性细胞的靶向免疫应答)。
短语“诱导的或增强的免疫应答”是指与治疗前的受试者的免疫应答相比,在治疗期间或之后受试者的免疫应答(例如细胞介导的免疫应答,例如t细胞介导的免疫应答)增加。因此,“诱导的或增强的”免疫应答包含免疫应答的任何可测量的增加,所述免疫应答直接或间接地靶向被治疗的δnpm1阳性血液恶性肿瘤。
本发明的组合物可用于治疗或预防人类受试者中的δnpm1阳性血液恶性肿瘤,特别是δnpm1阳性骨髓性恶性肿瘤,更特别是δnpm1阳性aml。
本领域技术人员将充分意识到血液恶性肿瘤可能是δnpm1阳性的,并且因此可以根据本发明进行治疗。类似地,本领域技术人员将充分意识到骨髓性恶性肿瘤可能是δnpm1阳性的,并且因此可以根据本发明进行治疗。
如本文所用,术语“治疗(treat)”、“治疗(treating)”和“治疗(treated)”被认为包括旨在防止病况、病症或症状(即,在此情况下是血液恶性肿瘤)的病理状态的发展或改变而进行的干预。因此,“治疗”是指治疗性治疗和预防或防止性措施,其中所述目的是防止或减慢(减轻)目标病况、病症或症状。因此,“治疗”包括,与治疗前的恶性细胞的量或浓度相比,降低、减慢或抑制恶性细胞的量或浓度至少5%、10%、20%、30%、40%、50%、60%、70%、80%、90%或100%,例如从受试者获得的样品中所测量的。测量恶性细胞的量或浓度的方法包括,例如,qrt-pcr,和定量δnpm1阳性血液恶性肿瘤特异性生物标记物,例如从受试者获得的样品中的claveevsl、aveevslrk、claveevslrk、veevslrk、和/或aveevslr。
如本文所用,术语“受试者”是指患有或有风险患有特定病况、病症或症状的个体,例如人。所述受试者可以是患者,即需要根据本发明的治疗的受试者。所述受试者可能已经接受了针对病况、病症或症状的治疗。或者,在根据本发明的治疗之前未对受试者进行治疗。
本文所述的组合物可以通过任何常规途径施用给受试者,包括注射或随时间逐渐输注。施用可以例如通过输注或通过肌内、血管内、腔内、大脑内、病灶内、直肠、皮下、皮内、硬膜外、鞘内、经皮施用。
本文所述的组合物可以是适合于上述施用方式的任何形式。例如,包含修饰细胞的组合物可以适合输注的任何形式。作为另外的实例,用于肠胃外注射的合适形式(包括皮下、肌内、血管内或输注)包括无菌的溶液、悬浮剂或乳剂;局部施用的合适形式包括软膏剂或乳膏剂;直肠施用的合适形式包括栓剂。或者,施用途径可通过直接注射到目标区域中,或通过区域递送或通过局部递送。本发明组合物的合适剂量的鉴定完全在本领域技术人员的常规能力范围内。
有利地,可以配制本发明的组合物以用于t细胞受体(tcr)基因转导,该方法快速、可靠并且能够产生对δnpm1-特异性肽(例如claveevsl(seqidno:1)、aveevslrk(seqidno:26)、claveevslrk(seqidno:27)、veevslrk(seqidno:28)或aveevslr(seqidno:29))具有特异性的大量t细胞,而不管患者先前已有的免疫组库如何。使用tcr基因转导,可能会在几天内产生适合输注的修饰自体细胞。
有利地,本发明的组合物可以配制成用作疫苗,例如包含选自claveevsl(seqidno:1)、aveevslrk(seqidno:26)、claveevslrk(seqidno:27)、veevslrk(seqidno:28)或aveevslr(seqidno:29)的一种或多种的肽的组合物)可以配制成适合用作肽疫苗的药物组合物。合适的肽疫苗制剂是本领域众所周知的。
优选地,本发明的药物组合物是疫苗,优选基于肽的疫苗。这样的基于肽的疫苗可用于预防或治疗诸如aml的δnpm1阳性血液恶性肿瘤。所述药物组合物优选用于并因此配制成适合于施用于受试者,优选人或动物受试者。优选地,所述施用是肠胃外的,例如静脉内、皮下、肌内、皮内、皮内注射和/或肿瘤内施用,即通过注射。
优选地,所述药物组合物包含一定量的构成药物剂量单位的肽,或由其组成。本文将药物剂量单位定义为在给定时间点施用于受试者的活性成分的量(即,基于肽的疫苗中的肽的总量)。药物剂量单位可以以单次体积(即单次注射),或者可以以2、3、4、5或更多次分开的体积或注射施用于受试者,优选地在身体的不同位置施用,例如在右肢和左肢。本文中应理解,药物剂量的分开的体积可以在组成上不同,即可以包括不同种类或组成的活性成分和/或佐剂。
包含总药物剂量的单次注射体积或注射量(即在某个时间点在一个位置上施加的体积),或其部分(在基本相同的时间点进行多次注射的情况下),可以在100-2ml之间或在100-1ml之间。单次注射体积可为100μl、200μl、300μl、400μl、500μl、600μl、700μl、800μl、900μl、1ml、1.1ml、1.2ml、1.3ml、1.4ml、1.5ml、1.6ml、1.7ml、1.8ml、1.9ml、2ml、3ml或其间的任何值。
优选地,在给定时间点施用于受试者(在某个时间点单次或多次注射)的药物剂量单位或肽的总量在0.1μg-20mg的范围内,例如约0.1μg、0.5μg、1μg、5μg、10μg、15μg、20μg、30μg、40μg、50μg、60μg、70μg、80μg、90μg、100μg、150μg、200μg、250μg、300μg、350μg、400μg、450μg、500μg、650μg、700μg、750μg、800μg、850μg、900μg、1mg、1,5mg、2mg、2.5mg、3mg、3.5mg、4mg、4.5mg、5mg、5.5mg、6mg、6.5mg、7mg、7.5mg、8mg、8.5mg、9mg、9.5mg、10mg、15mg或约20mg或其间的任何值。药物剂量单位的优选范围是0.1μg-20mg、1μg-10mg、10μg-5mg、0.5mg-2mg、0.5mg-10mg或1mg-5mg或2-4mg。
本文所述的组合物以有效量施用。“有效量”是指单独或与其他剂量一起产生所需(治疗或非治疗)反应的量。要使用的有效量将取决于例如治疗(或非治疗)目标、施用途径和患者/受试者的状况。例如,用于给定的患者/受试者的本发明的组合物的合适剂量将由主治医师(或施用该组合物的人)考虑已知的各种影响本发明的组合物作用的因素来确定,例如血液恶性肿瘤的严重程度和类型、体重、性别、饮食、施用时间和途径、其他药物和其他相关的临床因素。剂量和时间表可以根据患者/受试者的整体病况的特定病况、病症或症状而变化。有效剂量可以通过体外或体内方法确定。
本发明的组合物有利地以单位剂型存在。
产生tcr的方法
在一个方面,本发明提供了产生t细胞受体的方法,所述t细胞受体特异性结合选自以下的肽:claveevsl(seqidno:1)、aveevslrk(seqidno:26)、claveevslrk(seqidno:27)、veevslrk(seqidno:28)和aveevslr(seqidno:29),该方法包括将本发明的核酸序列(或载体)与宿主细胞在本发明核酸序列(或载体)被细胞整合并表达的情况下接触,以产生t细胞受体。
该方法可以离体或体外在宿主细胞上进行。或者,该方法可以在体内进行,其中将核酸序列(或载体)施用于受试者并在体内与宿主细胞在核酸序列被宿主细胞整合并表达的情况下接触,以产生t细胞受体在一个实施方案中,所述方法不是治疗人体或动物体的方法。
如本文其他地方所述,用于使核酸序列(或载体)与宿主细胞在核酸序列(或载体)被细胞整合并表达的情况下接触的合适的体内、体外和离体方法是众所周知的。
一般定义
如本文所用,“核酸序列”、“多核苷酸”、“核酸”和“核酸分子”可互换地用于指寡核苷酸序列或多核苷酸序列。核苷酸序列可以是基因组,合成或重组来源,并且可以是双链或单链(代表有义或反义链)。术语“核苷酸序列”包括基因组dna、cdna、合成dna和rna(例如mrna)以及例如通过使用核苷酸类似物产生的dna或rna的类似物。
如本文所用,“分离的核酸序列”是指当其与也在天然环境中的其天然相关序列连接时不在天然环境中的核酸序列。换句话说,分离的核酸序列不是天然核苷酸序列,其中“天然核苷酸序列”是指在其天然环境中的完整核苷酸序列,并且当与天然与其相关的整个启动子可操作地连接时,该启动子也处于其天然环境中。
如本文所用,“特异性结合claveevsl”是指claveevsl肽的选择性结合。在某些条件下,例如在本文所述的免疫测定中,“特异性结合claveevsl”的多肽将选择性地结合至该肽,而不会大量结合至其他肽。因此,所述多肽与claveevsl结合的亲和力比与对照抗原肽结合的亲和力高至少10、20、30、40、50或100倍。选择性结合也可以在表达本发明核酸或载体的修饰细胞的背景下间接确定。在测定中,例如本文讨论的测定中,修饰的细胞在hla-a*02:01(例如原代δnpm1hla-a*02:01阳性aml细胞或任何引入δnpm1基因的hla-a*02:01阳性细胞系)的背景下与呈现claveevsl的细胞具有特异性反应性。因此,所述修饰的细胞在hla-a*02:01的下情况与呈现claveevsl的细胞结合的反应性,与在hla-a*02:01的情况下不呈现claveevsl的细胞系的反应性相比,高至少10、20、30、40、50或100倍。
选择性结合可以在由hla-a*02:01呈现claveevsl的情况下。换句话说,在某些实施方案中,“特异性结合claveevsl”的多肽可以仅当其被hla-a*02:01呈现(即被其结合)时才这样做,或是与被hla-a*02:01呈现时等价的结构形式。
除非有相反的说明,否则“特异性结合claveevsl”的多肽可以结合(i)claveevsl的半胱氨酰化形式,(ii)claveevsl的非半胱氨酰化形式,或(iii)claveevsl的半胱氨酰化形式和claveevsl的非半胱氨酰化形式两者。同样地,除非另有特别说明,否则本文中对“seqidno:1”或“claveevsl”的一般指代涵盖了claveevsl肽的半胱氨酰化和非半胱氨酰化形式两者。
如本文所用,“特异性结合aveevslrk”是指对aveevslrk肽的选择性结合。在某些条件下,例如在本文所述的免疫测定中,“特异性结合aveevslrk”的多肽将选择性地结合至该肽,而不会大量结合至其他肽。因此,所述多肽与aveevslrk结合的亲和力比与对照抗原肽结合的亲和力高至少10、20、30、40、50或100倍。选择性结合也可以在表达本发明核酸或载体的修饰细胞的情况下间接确定。在测定中,例如本文讨论的测定中,修饰的细胞在hla-a*03:01、hla-a*11:01或hla-a*01:01(例如原代δnpm1hla-a*03:01、hla-a*11:01或hla-a*01:01阳性aml细胞或任何引入δnpm1基因的hla-a*03:01、hla-a*11:01或hla-a*01:01阳性细胞系)的情况下与呈现aveevslrk的细胞具有特异性反应性。因此,所述修饰的细胞在hla-a*03:01、hla-a*11:01或hla-a*01:01的情况下与呈现aveevslrk的细胞结合的反应性,与在hla-a*03:01、hla-a*11:01或hla-a*01:01的背景中不呈现aveevslrk的细胞系的反应性相比,高至少10、20、30、40、50或100倍。
选择性结合可以仅在由hla-a*03:01、hla-a*11:01或hla-a*01:01呈现aveevslrk的情况下。换句话说,在某些实施方案中,“特异性结合aveevslrk”的多肽可以仅当其被hla-a*03:01、hla-a*11:01或hla-a*01:01呈现(即被其结合)时才这样做,或是与被hla-a*03:01、hla-a*11:01或hla-a*01:01呈现时等价的结构形式。
类似地,如本文所用,“特异性结合aveevslrk”是指aveevslrk肽的选择性结合。在某些条件下,例如在本文所述的免疫测定中,“特异性结合claveevslrk”的多肽将选择性地结合至该肽,而不会大量结合至其他肽。因此,所述多肽与claveevslrk结合的亲和力比与对照抗原肽结合的亲和力高至少10、20、30、40、50或100倍。选择性结合也可以在表达本发明核酸或载体的修饰细胞的情况下间接确定。在测定中,例如本文讨论的测定中,修饰的细胞在hla-a*03:01或hla-a*11:01(例如原代δnpm1hla-a*03:01或hla-a*11:01阳性aml细胞或任何引入δnpm1基因的hla-a*03:01或hla-a*11:01阳性细胞系)的情况下与呈现claveevslrk的细胞具有特异性反应性。因此,所述修饰的细胞在hla-a*03:01或hla-a*11:01的情况中与呈现claveevslrk的细胞结合的反应性,与在hla-a*03:01或hla-a*11:01的背景中不呈现claveevslrk的细胞系的反应性相比,高至少10、20、30、40、50或100倍。
选择性结合可以仅在由hla-a*03:01或hla-a*11:01呈现aveevslrk的情况下。换句话说,在某些实施方案中,“特异性结合claveevslrk”的多肽可以仅当其被hla-a*03:01或hla-a*11:01呈现(即被其结合)时才这样做,或是与被hla-a*03:01或hla-a*11:01呈现时等价的结构形式。
除非有相反的说明,否则“特异性结合claveevslrk”的多肽可以结合(i)claveevslrk的半胱氨酰化形式,(ii)claveevslrk的非半胱氨酰化形式,或(iii)claveevslrk的半胱氨酰化形式和claveevslrk的非半胱氨酰化形式两者。同样地,除非另有特别说明,否则本文中对“seqidno:27”或“claveevslrk”的一般指代涵盖了claveevslrk肽的半胱氨酰化和非半胱氨酰化形式两者。
如本文所用,“特异性结合veevslrk”是指veevslrk肽的选择性结合。在某些条件下,例如在本文所述的免疫测定中,“特异性结合veevslrk”的多肽将选择性地结合至该肽,而不会大量结合至其他肽。因此,所述多肽与veevslrk结合的亲和力比与对照抗原肽结合的亲和力高至少10、20、30、40、50或100倍。选择性结合也可以在表达本发明核酸或载体的修饰细胞的情况下间接确定。在测定中,例如本文讨论的测定中,修饰的细胞在hla-a(例如原代δnpm1hla-a阳性aml细胞或任何引入δnpm1基因的hla-a阳性细胞系)的情况下与呈现veevslrk的细胞具有特异性反应性。因此,所述修饰的细胞在合适的hla-a的情况下与呈现veevslrk的细胞结合的反应性,与在适当的hla-a的情况下不呈现veevslrk的细胞系的反应性相比,高至少10、20、30、40、50或100倍。
选择性结合可以仅在由合适的hla-a呈现veevslrk的情况下。换句话说,在某些实施方案中,“特异性结合veevslrk”的多肽可以仅当其被hla-a呈现(即被其结合)时才这样做,或是与被hla-a呈现时等价的结构形式。
如本文所用,“特异性结合aveevslr”是指aveevslr肽的选择性结合。在某些条件下,例如在本文所述的免疫测定中,“特异性结合aveevslr”的多肽将选择性地结合至该肽,而不会大量结合至其他肽。因此,所述多肽与aveevslr结合的亲和力比与对照抗原肽结合的亲和力高至少10、20、30、40、50或100倍。选择性结合也可以在表达本发明核酸或载体的修饰细胞的情况下间接确定。在测定中,例如本文讨论的测定中,修饰的细胞在hla-a(例如原代δnpm1hla-a阳性aml细胞或任何引入δnpm1基因的hla-a阳性细胞系)的情况下与呈现aveevslr的细胞具有特异性反应性。因此,所述修饰的细胞在合适的hla-a的情况下与呈现aveevslr的细胞结合的反应性,与在适当的hla-a的情况下不呈现aveevslr的细胞系的反应性相比,高至少10、20、30、40、50或100倍。
选择性结合可以仅在由合适的hla-a呈现veevslrk的情况下。换句话说,在某些实施方案中,“特异性结合vaeevslr”的多肽可以仅当其被hla-a呈现(即被其结合)时才这样做,或是与被hla-a呈现时等价的结构形式。
非必需的(或非关键的)氨基酸残基是可从野生型序列(例如,本文中由seqidno识别的序列)改变而不消除,或更优选地,不本质上改变生物活性的残基,而必需的(或关键的)氨基酸残基导致这样的改变。例如,保守的氨基酸残基被预测特别不适于改变,除了结构域的疏水核心内的氨基酸残基通常可以被具有近似等效疏水性的其他残基代替而不显着改变活性。
“保守氨基酸取代”是其中所述氨基酸残基被具有相似侧链的氨基酸残基取代。具有相似侧链的氨基酸残基家族已在本领域中定义。这些家族包括,具有碱性侧链的氨基酸(如赖氨酸、精氨酸、组氨酸)、具有酸性侧链的氨基酸(如天冬氨酸、谷氨酸)、具有不带电的极性侧链的氨基酸(如甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸)、具有非极性侧链的氨基酸(如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸)、具有β-支链的氨基酸(如苏氨酸、缬氨酸、异亮氨酸)和具有芳族侧链的氨基酸(如酪氨酸、苯丙氨酸、色氨酸、组氨酸)。因此,优选用来自相同侧链家族的另一氨基酸残基替换蛋白质中的非必需(或非关键)氨基酸残基。或者,在另一个实施方案中,可以随机引入突变,并且可以筛选所得突变体的活性以鉴定保留活性的突变体。
序列之间的序列同源性或同一性(该术语在本文中可互换使用)的计算如下进行。
为了确定两个氨基酸序列或两个核酸序列的同一性百分比,为了最佳比较目的,对序列进行比对(例如,可以在第一和第二氨基酸或核酸序列之一或两者中引入缺口以实现最佳比对,并且出于比较目的,可以忽略非同源序列)。在一个优选的实施方案中,为了比较目的而比对的参考序列的长度是该参考序列的长度的至少30%,优选至少40%,更优选至少50%,甚至更优选至少60%,并且甚至更优选至少70%、75%、80%、82%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%。然后比较相应氨基酸位置或核苷酸位置的氨基酸残基或核苷酸。当第一序列中的位置被与第二序列中相应位置相同的氨基酸残基或核苷酸占据时,则所述分子在该位置是相同的(如本文所用,氨基酸或核酸的“同一性”等同于氨基酸或核酸“同源性”)。两个序列之间的同一性百分比是考虑需要引入以实现两个序列的最佳比对的缺口的数目和每个缺口的长度的序列共有的相同位置的数目的函数。
序列的比较和两个序列之间同一性百分比的确定可以使用数学算法来完成。在一个优选的实施方案中,使用needman等人,(1970)j.mol.biol.48:444-453的算法确定两个氨基酸序列之间的同一性百分比,所述算法已经被整合到gcg软件包中的gap程序中(在http://www.gcg.com可用),其使用blosum62矩阵或pam250矩阵以及16、14、12、10、8、6或4的缺口权重和1、2、3、4、5或6的长度权重。在又一个优选的实施方案中,使用gcg软件包中的gap程序(在http://www.gcg.com可用)确定两个核苷酸序列之间的同一性百分比,其使用nwsgapdna.cmp矩阵和40、50、60、70或80的缺口权重和1、2、3、4、5或6的长度权重。一组特别优选的参数(以及如果从业者不确定应使用哪些参数来确定分子是否在本发明的序列同一性或同源性限制内,则应使用的参数)是blosum62评分矩阵,其空位罚分为12,空位延伸罚分为4,移码空位罚分为5。
或者,可使用meyers等人,(1989)cabios4:11-17的算法测定两个氨基酸或核苷酸序列之间的同一性百分比,所述算法已经被整合到align程序(2.0版)中,其使用pam120权重残基表,空位长度罚分为12并且空位罚分为4。
本文所述的核酸和蛋白质序列可以用作“查询序列”以对公共数据库进行搜索,以例如鉴定其他家族成员或相关序列。可以使用altschul,等人(1990)j.mol.biol.215:403-410的nblast和xblast程序(2.0版)执行此类搜索。可以用nblast程序(得分=100,字长=12)进行blast核苷酸搜索,以获得与本发明的核酸分子同源的核苷酸序列。可以用xblast程序(得分=50,字长=3)进行blast蛋白质搜索,以获得与本发明的蛋白质分子同源的氨基酸序列。为了获得用于比较目的的缺口比对,可以如altschul等人(1997,nucl.acidsres.25:3389-3402)所述利用缺口blast。当使用blast和缺口blast程序时,可以使用各个程序的默认参数(例如xblast和nblast)。参见<http://www.ncbi.nlm.nih.gov>。
本文所述的多肽和核酸分子可具有与seqidno所识别的序列充分或基本相同的氨基酸序列或核酸序列。本文使用的术语“充分相同”或“基本上相同”是指第一氨基酸或核苷酸序列包含足够或最少数目的与第二氨基酸或核苷酸序列相同或等同(例如具有相似的侧链)的氨基酸残基或核苷酸,使得第一和第二氨基酸或核苷酸序列具有共同的结构域或共同的功能活性。例如,含有具有至少约60%、或65%同一性,可能地75%同一性,更可能地85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的共同结构域的氨基酸或核苷酸序列在本文中被定义为充分或基本上相同。
除非本文另外定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常所理解的相同含义。例如,singleton和sainsbury,《微生物学和分子生物学词典》,第二版,johnwileyandsons,纽约(1944);以及hale和marham,《哈珀·柯林斯生物学辞典》,harperperennial,纽约(1991)为本领域技术人员提供了本发明中许多术语的通用词典。尽管与本文描述的那些方法或材料相似或等同的任何方法和材料均可用于本发明的实践中,但是本文描述了优选的方法和材料。因此,下面紧接者限定的术语通过将说明书作为整体参考而更全面地描述。同样,如本文所应用,除非上下文中另外明确指明,单数术语“一(a)”、“一个(an)”和“该(the)”包括复数指代。除非另有说明,否则核酸以5'至3'方向从左至右书写;氨基酸序列以氨基至羧基的方向从左至右书写。应理解,本发明不限于所描述的特定方法、方案和试剂,因为这些可以根据本领域技术人员所使用的情况而变化。
本发明的方面通过以下非限制性实施例说明。
实施例
材料和方法
研究设计:
这项研究的目的是(1)从原发性aml的δnpm1鉴定hlai类配体,(2)分离具有对来自δnpm1的hlai类配体特异的tcr的cd8细胞,(3)鉴定来自δnpm1的hlai类配体的tcr,其能够介导基因转导后原发性aml的特异性识别和裂解。使用串联质谱法针对12种原发性aml生成hlai类配体组数据,并搜索与δnpm1的可变阅读框相匹配的肽。对于一种已鉴定的肽产生hla-a*02:01pmhc四聚体,并将其用于从6名hla-a*02:01阳性aml患者和6名健康hla-a*02:01阳性个体中分离特异性cd8细胞。筛选从健康个体分离的t细胞克隆用于pmhc四聚体染色,并通过ifn-γelisa检测四聚体阳性t细胞克隆对肽加载的t2细胞和具有δnpm1或wtnpm1的原发性aml的反应性。从一个强反应性t细胞克隆中,对tcr进行测序并克隆到逆转录病毒mp71-tcr-flex载体中。该载体用于将tcr引入来自两个健康hla-a*02:01阳性个体的cd8和cd4细胞中,并通过流式细胞术评估tcr转导的t细胞的纯度。通过ifn-γelisa测试了tcr转导的t细胞对hla-a*02:01阳性aml细胞系和具有δnpm1或wtnpm1的原发性aml的识别,并通过51cr释放测定法测量了特异性裂解。
样品收集和细胞培养
在获得莱顿大学医学中心机构审查委员会批准并根据赫尔辛基宣言征得知情同意后,从aml患者和健康个体中采集外周血和骨髓样本。通过ficoll-isopaque分离法分离并冷冻保存外周血和骨髓单核细胞。为了从hla-a*02:01型健康个体中分离pbmc,从sanquin(阿姆斯特丹,荷兰)订购了血沉棕黄层。在t细胞培养基(tcm)中培养t细胞,该培养基由iscove'smodifieddulbecco's培养基(imdm;lonza,basel,瑞士)组成,其中添加了5%热灭活的胎牛血清(fbs;gibco,thermofisherscientific,waltham,massachusetts,美国)、5%人体血清、1.5%l-谷氨酰胺(lonza)、1%青霉素/链霉素(lonza)和100iu/mlil-2(novartis,basel,瑞士)。从dsmz(braunschweig,德国)订购表达野生型npm1(oci-aml2)和δnpm1(oci-aml3)的aml细胞系,并在含有20%fbs和1%青霉素/链霉素的最低必需培养基α(memα;gibco)中培养。在含有10%fbs、1.5%l-谷氨酰胺和1%青霉素/链霉素的imdm中培养原代aml和t2细胞。通过用clinimacscd14磁珠(miltenyibiotec)进行磁激活细胞分选(macs;miltenyibiotec,bergischgladbach,德国),从pbmc中分离出单核细胞。将分离的单核细胞在含有100ng/mlgm-csf(novartis,basel,瑞士)和500iu/mlil-4(schering-plough,kenilworth,nj)的培养基中培养至未成熟树突细胞(dc)7天。在最后两天中,加入100ng/mlgm-csf、10ng/mltnf-α(cellgenix,freiburg、德国)、10ng/mlil-1β(cellgenix)、10ng/mlil-6(cellgenix)、1μg/ml前列腺素e2(sigma-aldrich,st.louis,mo)和500iu/mlifn-γ(boehringer-ingelheim,ingelheim,德国)以诱导成熟。
原代aml的hlai类配体组
将12个原代aml样品的细胞沉淀在补充有完全蛋白酶抑制剂(sigma-aldrich,st.louis,missouri,美国)的50mmtris-hcl、150mmnacl、5mm乙二胺四乙酸盐和0.5%zwittergent3-12(ph8.0)中裂解。在4℃下将细胞在裂解缓冲液中翻滚孵育2小时后,将制剂在4℃下以1000g离心10分钟。将上清液转移至新试管中,并在4℃下以13000g离心35分钟。将所述上清液用蛋白asepharosecl-4b珠(gehealthcarelifesciences,芝加哥,伊利诺伊州,美国)预先清除,并以1ml/min的流速经过免疫亲和柱,其具有庚二酸二甲酯(dmp)固定的蛋白asepharosecl-4b珠上的w6/32抗体(3mg/ml树脂)。用裂解缓冲液和10mmtris-hcl(ph8.0)缓冲液(含1m、120mm和无nacl)洗涤5-10倍柱体积后,结合的hlai类肽复合体从柱上被洗脱并用3-4柱体积的10%乙酸解离。通过穿过10kda膜(带有supor膜的macrosep先进离心装置,pallcorporation,portwashington,纽约,美国)从hlai类分子中分离出肽。将滤液冷冻干燥。
用scx色谱柱(内径320μm,15cm,聚磺乙基a3μm,polylc)通过强阳离子交换色谱(scx)对洗脱的肽库进行分级分离,流速为4μl/min。梯度在100%溶剂a(100/0.1水/三氟乙酸v/v)运行10分钟,之后线性梯度在15分钟内开始达到100%溶剂b(65/35/0.1250mmkcl/乙腈/三氟乙酸)v/v/v),然后在接下来的15分钟内使用100%溶剂c(65/35/0.1500mmkcl/乙腈/三氟乙酸v/v/v)。梯度在100%溶剂c保持5分钟,然后再次切换为100%溶剂a。在预装有20μl95/3/0.1水/乙腈/fav/v/v的小瓶中收集二十份4μl的级分。将肽级分冻干,溶解在95/3/0.1水/乙腈/甲酸v/v/v中,随后在配备有纳流液相色谱1100hplc系统的ltq-ftultra(如前所述)或配备了easy-nlc1000的q-exactive上通过数据依赖的串联质谱(ms)分析。将肽以6-10μl/min流速捕获在1.5cm色谱柱(内径100μm;reprosil-purc18-aq,3μm,dr.maischhplcgmbh,ammerbuch-entringen,德国)上,并以150nl/min流速洗脱至20cm色谱柱(内径50μm;reprosil-purc18-aq,3μm)。用0至40%乙腈的0.1%甲酸溶液在120分钟的梯度下展开色谱柱。将柱的末端拉至尖端(内径约5μm),从中将洗脱液喷洒到质谱仪中。在具有25,000的分辨率的ft-icr中在目标值3,000,000处获取全扫描ms光谱。通过在具有50,000的分辨率的ft-icr中的所选择的离子监测扫描在50,000的目标积累值分离两种最强的离子以用于准确的质量测量。然后在线性离子阱中使用在10,000的目标值处的碰撞诱导解离将所选择的离子分段(fragmented)。q-exactive质谱仪以top10模式运行。对于强度阈值为17,000的ms/ms,参数分别是:在agc目标值为3,000,000/最大填充时间为20毫秒(全扫描)时的分辨率为70,000,在agc目标值为100,000/最大填充时间为60ms时的分辨率为17,500。apex触发设置为1到10s,允许的电荷为2-6。proteomediscoverer2.1版(thermofisherscientific)用于肽和蛋白质鉴定,使用具有uniprothomosapiens数据库的mascot2.2.04版(up000005640;2015年1月;67911条目)使用mascotnode用于鉴定。将蛋氨酸的氧化和半胱氨酸的半胱氨酰化设置为可变修饰。进行肽分配时,q-exactive数据的前体耐受度为10ppm,ms/ms片段耐受度为20mmu,ltq-ftultra数据为2ppm和0.5da。δnpm1衍生肽的鉴定得到了其合成对应物的确认。
肽合成和pmhc四聚体产生
通过标准的fmoc化学合成肽并将其溶解在二甲基亚砜中。肽的半胱氨酰化是通过在50℃下于50mm碳酸氢铵中用2mm1,4-二硫苏糖醇将1mm肽处理15分钟,然后在室温下添加10mm游离半胱氨酸和15mmh2o2进行的。如前所述(7、8)制备了pmhc四聚体。简而言之,通过凝胶过滤hplc纯化由重组hla-a*02:01重链和人β2-微球蛋白组成的单体并将其生物素化。用合适的肽折叠后,通过加入pe-缀合的链霉亲和素(invitrogen,thermofisherscientific)产生pmhc四聚体。在半胱氨酰化的δnpm1肽存在下,通过将含有紫外线敏感肽的生物素化hla-a*02:01单体暴露在366nm紫外线下,从而制得紫外线交换pmhc四聚体。肽交换1小时后,将单体在4℃下孵育1小时,然后在15℃下以4000g离心10分钟。通过向上清液加入链霉亲和素缀合的pe来生产四聚体。pmhc四聚体储存在4℃。
抗体和facs分析
将t细胞用以下染色:针对cd3、cd4、cd8(bdbiosciences,sanjose,california,美国)的fitc偶联抗体和tcr-vβ5.1(beckmancoulter,brea,california,美国)、针对cd3、cd4、cd8的apc偶联抗体和小鼠tcr-cβ以及pmhc四聚体和针对cd3、cd4、cd8的抗体(bdbiosciences)。使用bdcellquestpro软件(bdbiosciences)在bdfacscaliburii(bdbiosciences)上测量细胞,并使用flowjo软件(flowjo,llc,ashland,oregon,美国)进行分析。
t细胞分离和培养
如先前所述(9),从aml患者和健康个体的pbmc中分离出pmhc四聚体阳性cd8t细胞。简而言之,将来自hla-*02:01阳性aml患者和健康个体的pbmc在4℃下用含有δnpm1肽的pe偶联的pmhc四聚体染色1小时,然后使用抗pe微珠(miltenyibiotec)进行macs分离。将分离的细胞用cd8-alexafluor700(invitrogen)、cd4-fitc、cd14-fitc和cd19-fitc(bdbiosciences)抗体染色,并且pmhc四聚体阳性cd8t细胞是通过bdfacsariaiii细胞分选仪(bdbiosciences)使用bdfacsdivav6软件(bdbiosciences)分选的单个细胞。在96孔u型底培养板(costar,sigma-aldrich)中的每孔100μltcm中,用50,000辐照的同种异体pbmc、5000辐照的同种异体ebv-lcl和0.8μg/mlpha(oxoidmicrobiologyproducts,thermofisherscientific)刺激单个t细胞。每隔10-14天用辐射的饲养细胞和pha重新刺激生长中的t细胞克隆。
t细胞反应性测定
通过ifn-γelisa(sanquin)测量t细胞识别。将刺激细胞(30,000个细胞)与t细胞(2000个细胞)在384孔平底板(greinerbioone,kremsmünster,奥地利)中的每孔40μltcm中共同孵育。共孵育过夜后,收获培养上清液以测量ifn-γ的释放。在肽识别测定中,将t2细胞(15,000个细胞)在37℃下与滴定的肽浓度预孵育30分钟,并洗涤两次,然后与t细胞共孵育。在阻断测定中,在将靶细胞(10,000个细胞)与饱和浓度的阻断hlai类(w6/32)或hlaii类(pdv5.2)的抗体在室温下预孵育60分钟,然后加入t细胞。t细胞介导的细胞毒性在51铬释放试验中进行了测量。将原代aml细胞用100μcina251cro4于37℃标记1小时,洗涤后与t细胞以多种e:t比率在96孔u型底培养板(costar)中的每孔100μltcm中共孵育。在含有每孔100μltcm或具有1%triton-x100(sigma-aldrich)的100μltcm的单独平板中分别测量自发和最大51cr释放量。共孵育9小时后,收获25μl培养上清液,并转移至96孔lumaplates(perkinelmer,waltham,massachusetts,美国)。在2450microbeta2平板计数器(perkinelmer)上测量了每分钟计数(cpm)的51cr释放量。
tcr克隆和逆转录病毒上清液的产生
如先前所述(9)确定克隆1a2的tcrα和β链的使用,加以微小的修改。简而言之,裂解t细胞,并通过dynabeadsmrnadirect试剂盒(invitrogen)分离mrna。使用两个tcr-cβ特异性引物、tcr-cα特异性引物、sa.rt锚定模板转换寡核苷酸(tso)和smartscribe逆转录酶(takara,clontech,mountainview,california,美国)生成tcr特异性cdna。在第一链cdna合成过程中,smartscribe逆转录酶添加了一个3'非模板化多胞嘧啶末端,从而可对tso和第二链cdna合成进行退火。tcr扩增使用phusionflash(thermofisherscientific)、锚定特异性引物和对tcr-cα或–cβ区退火的嵌套引物通过pcr进行。通过sanger测序(macrogen,阿姆斯特丹,荷兰)和immunogenetics(imgt)数据库(10)将克隆1a2的tcr序列鉴定为trav12-2和trbv5-1。合成密码子优化的trav12-2和trbv5-1序列,并在mp71-tcr-flex逆转录病毒载体(11)中通过genscript(piscataway,newjersey,美国)克隆。在mp71-tcr-flex中,鼠类tcr-cα和-cβ区域含有其他半胱氨酸残基,以促进tcr的优先配对和表达,所述tcr通过猪破伤风病毒衍生的p2a序列进行连接。将构建体转染入包装细胞φ-nx-a(atcc,马纳萨斯,弗吉尼亚州,美国),并在转染后48和72小时收集逆转录病毒上清液并将其冷冻在-80℃下。编码cmv衍生的hla-a*02:01限制性肽nlvpmvatv的tcr的mp71-tcr-flex由t.n.schumacher教授和博士(荷兰阿姆斯特丹荷兰癌症研究所免疫学系)友情提供。
tcr基因转导
将来自两个hla-a*02:01阳性健康个体(供体1和2)的pbmc解冻,并使用抗cd4微珠(miltenyibiotec)随后通过cd8t细胞分离试剂盒(miltenyibiotec)通过macs分离cd4和cd8细胞。在24孔平底培养板(costar)中,用辐照的自体饲养细胞和0.8μg/mlpha刺激cd8和cd4细胞。如前所述(9,12),刺激后两天,将t细胞转移至24孔平底悬浮液培养板(greinerbio-one)中,以进行逆转录病毒转导。在添加t细胞之前,将板用30mg/ml逆转录连接蛋白(takara,clontech)包被,并用2%人血清白蛋白(sanquin)封闭。加入逆转录病毒上清液,并将板在4℃下以3000g离心20分钟。将t细胞以每孔300,000个细胞的量加入具有病毒上清液的板中。过夜孵育后,将t细胞转移至24孔平底培养板中。转导后第6天,将tcr转导的t细胞用抗小鼠tcr-cβ的apc偶联的抗体在4℃染色15分钟,然后使用抗apc微珠(miltenyibiotec)进行macs分离。每隔10-14天用辐照的同种异体pbmc和ebv-lcl和0.8μg/mlpha再次刺激tcr转导的t细胞。在分析之前,如上所述,使用抗小鼠tcr-cβ-apc和抗apc微珠通过macs富集重新刺激的tcr转导的t细胞。
结果
原代amlhlai类配体组中存在δnpm1
为了研究δnpm1肽是否在hlai类中被加工和呈现,发明人从12个原代aml样品中免疫沉淀了hlai类表面分子,从结合槽中洗脱了该肽,并通过质谱分析了肽组。表i显示了12个aml样品的hlai类分型以及npm1的突变状态npm1基因的外显子12中的4-bp移码插入是在30%的原代aml中发生的复发性突变。在12个原发性aml中,有8个通过pcr片段分析证实了δnpm1的存在。除一种携带已知的染色体重排inv(16)(p13q22)aml外,所有患者均通过细胞遗传学检查出正常的核型。在外周血或骨髓样品中测量的未成熟细胞百分比在55-98%之间。
表1:原代amlhlai类配体组中δnpm1的存在
aδnpm1患者在npm1基因的外显子12处插入4bp,导致该蛋白c端移码。
b在aml患者的外周血和骨髓样本中测得的未成熟细胞百分比。
*使用抗hla-a*02:01抗体bb7.2进行肽洗脱的aml样品。
在外显子12中重复性4bp插入会产生δnpm1蛋白,所述蛋白比其野生型对应物长4aa,所述野生型对应物在选择阅读框翻译的c端带有11aa(claveevslrk)。如从12种原代aml分析的,从该可变δnpm1蛋白,搜索跨越正常阅读框中10个n末端残基,然后是选择阅读框中的11个c末端aa(mtdqeaiqdlclaveevslrk)的蛋白区域,以匹配hlai类配体组中的肽。这表明在具有δnpm1的aml中存在两种8-mer肽(veevslrk和aveevslr)、两种9-mer肽(claveevsl和aveevslrk)和一种11-mer肽(claveevslrk),但在具有wtnpm1的aml中不存在(表1)。通过质谱图用合成肽验证了从7种原发性aml中洗脱的所有5种配体(图1和2)。在体外第一个残基半胱氨酰化后,用合成肽验证了claveevsl和claveevslrk的串联质谱。netmhcpan3.0对hlai类结合亲和力的预测表明表位claveevsl与hla-a*02:01的结合,而表位aveevslrk和claveevslrk最有可能与hla-a*03:01以及hla-a*11:01结合,并且可能地aveevslrk与hla-a*01:01结合(表2)。通过单体重折叠确认了claveevsl与hla-a*02:01的结合以及aveevslrk和claveevslrk与hla-a*03:01和a*11:01的结合。由于hla-a*02:01在50%的高加索人群中表达,因此发明人将研究重点放在了claveevsl上,其在3种具有δnpm1的hla-a*02:01阳性aml(aml10197和aml3361)中被检测出2个。
表2:如netmhcp3.0预测的对hlai类等位基因的肽结合亲和力。
a肽从中被洗脱的原代aml样品表达的所有其他hlai类等位基因的预测结合亲和力(nm)的下限。
n.a.不适用。
原代aml上δnpm1的t细胞识别
为了检查hla-a*02:01限制性表位claveevsl是否是可以通过免疫疗法靶向的新抗原,发明人搜索了患有aml的患者中的特异性t细胞。针对claveevsl(δnpm1-cla)及其半胱氨酰化变体c*laveevsl(δnpm1-c*la)生产了pe缀合的pmhc四聚体,并用这些四聚体的混合物从pbmc中分离了特异性t细胞,该pmbc来自6例化疗后缓解的具有△npm1aml的hla-a*02:01阳性患者。通过磁性抗pe珠富集与一种或全部两种pmhc四聚体结合的t细胞,并通过流式细胞术分离单个四聚体阳性cd8细胞(表3)。表3:来自患有hla-a*02:01阳性δnpm1aml患者的t细胞分离。
a诊断后的天数。
bpbmc,外周血单个核细胞。指示的是用于t细胞分离的来自患有δnpm1aml的hla-a*02:01阳性患者的pbmc数量。
c将pbmc用抗cd8-alx700和用于claveevsl及其半胱氨酰化变体c*laveevsl的pe缀合的pmhc四聚体的混合物染色。指示的是已分选的四聚体阳性cd8细胞的数量。
d对δnpm1-cla或δnpm1-c*la四聚体呈阳性的t细胞克隆数。
从4例患者的42*106个pbmc中分离出41个四聚体阳性cd8细胞,其中3例患者的5个t细胞克隆扩增。但是,这5个t细胞克隆均不能被δnpm1-cla四聚体或δnpm1-c*la四聚体染色,这表明claveevsl的t细胞不存在或频率低于检测阈值。因此,遵循相同的策略从6个hla-a*02:01阳性健康个体的中大量pbmc中搜索特异性t细胞(表4)。从每个健康个体的460-1970x106的总pbmc中分离出可变数量的8-55四聚体阳性cd8细胞。在这些细胞中,来自5个个体的31个t细胞克隆扩增,来自4个个体的13个t细胞克隆对δnpm1-cla四聚体呈阳性。在这13个克隆中,有3个t细胞克隆也可以被δnpm1-c*la四聚体染色(表4和图3a)。
表4:来自健康个体的δnpm1的t细胞分离
apbmc,外周血单个核细胞。所指示的是用于t细胞分离的来自hla-a*02:01阳性健康个体的pbmc的数目。
b将pbmc用抗cd8-alx700和用于claveevsl及其半胱氨酰化变体c*laveevsl的pe缀合的pmhc四聚体的混合物染色。指示的是已分选的四聚体阳性cd8细胞的数量。
c对δnpm1-cla四聚体呈阳性的生长的t细胞克隆数目。
d对δnpm1-c*la四聚体呈阳性的生长的t细胞克隆数目。
n.d.未完成。
为了确定13个四聚体阳性cd8克隆是否对其靶肽具有反应性,测试了克隆对外源负载claveevsl、半胱氨酰化变体c*laveevsl或无关的hla-a*02:01限制性的cmv肽nlvpmvatv的hla-a*02:01阳性t2细胞的识别。在13个δnpm1-cla四聚体阳性克隆中,有2个t细胞克隆(1a2和4a8)对负载claveevsl的t2细胞显示特异性反应,但对对照肽nlvpmvatv没有反应(图3b)。克隆1a2还显示了对负载c*laveevsl的t2细胞的识别。这些结果与四聚体数据一致,并证明第一个残基的半胱氨酰化消除了克隆4a8对t细胞的识别。但是,克隆1a2对肽的识别不依赖于半胱氨酰化,如对claveevsl和c*laveevsl的特异性反应所说明的。
为了研究克隆1a2和4a8的抗肿瘤潜力,针对一组5个hla-a*02:01阳性原代aml(包括3个具有δnpm1的样品和2个具有wtnpm1的样品)测量了t细胞反应性。t细胞克隆1a2对具有δnpm1的所有3种aml表现出不同程度的反应性,而克隆4a8对具有δnpm1的3个样品中的2个表现出相对较低的反应性(图3c)。克隆1a2对aml具有较强的t细胞反应性,可以通过其识别从原代aml细胞表面洗脱的半胱氨酰化的δnpm1和非半胱氨酰化的δnpm1的能力来解释。没有观察到t细胞对具有wtnpm1的hla-a*02:01阳性aml(图3c)或对具有δnpm1的hla-a*02:01阴性aml(数据未显示)的反应性。这些数据表明,具有对δnpm1特异的tcr的t细胞存在于健康个体的t细胞库中,并且这些t细胞可以特异性识别作为在具有δnpm1的原代aml上由hla-a*02:01呈现的内源性新抗原的claveevsl。
tcr基因转导至原代aml上的靶δnpm1
由于δnpm1是在30%的原代aml中发生的重复性4-bp插入,而hla-a*02:01是在50%的高加索人群中表达的,因此发明人认为claveevsl是tcr基因转导的理想靶标。由于原代aml最能被克隆1a2识别,因此从该克隆中分离出mrna,并生成cdna对δnpm1的tcrα和β链可变区进行测序。合成用于由t细胞克隆1a2表达的trav12-2和trbv5-1的密码子优化基因序列,并将其克隆到修饰的mp71-tcr-flex逆转录病毒载体中。为了促进tcrα和β链的优先结合和表达,将tcr的可变区与通过p2a序列连接的鼠类恒定区框内克隆。将δnpm1的tcr和作为对照的hla-a*02:01限制性cmv肽nlvpmvatv的tcr引入从健康hla-a*02:01阳性个体的pbmc分离的cd8和cd4细胞中(供体1和2)。转导后第6天,使用抗小鼠tcr-cβ和抗apc磁珠的apc偶联抗体纯化tcr转导的cd8和cd4细胞。流式细胞术分析表明,δnpm1-cla四聚体与δnpm1的tcr转导的cd8细胞
然后,本发明人分析了用δnpm1的tcr转导的cd8和cd4细胞的功能,并证明了与负载claveevsl的hla-a*02:01阳性t2细胞共孵育后ifn-γ的特异性释放,而与cmv肽nlvpmvatv共孵育则没有(图4b)。与具有δnpm1的aml细胞系oci-aml3共孵育时,也观察到ifn-γ的特异性释放,但用具有wtnpm1的aml细胞系oci-aml2刺激时未观察到(图4c)。
随后测试了tcr转导的cd8和cd4细胞对一组13种hla-a*02:01阳性原发性aml的反应性,其中包括9种具有δnpm1的样品和4种具有wtnpm1的样品。用δnpm1的tcr转导后,cd8和cd4细胞均显示出对具有δnpm1的所有9种原发性aml的识别,而未观察到对具有wtnpm1的aml的特异性识别(图5)。用δnpm1的tcr转导的cd8和cd4细胞也缺乏对具有δnpm1的hla-a*02:01阴性aml以及对具有wtnpm1的成熟dc的反应性(图6)。接着,测试转导的t细胞对来自供体1和2的单核细胞衍生的成熟dc的反应性以及对一组40种hla-a*02:01阳性第三方ebv-lcl的反应性,其作为具有强抗原处理和呈现能力的非恶性细胞类型。用δnpm1的tcr的转导的cd8和cd4细胞无法识别成熟的dc或ebv-lcl,这表明wtnpm1基因的可变翻译没有发生,并且该基因不会产生类似于claveevsl的肽。总之,数据显示,基因转导至cd8和cd4细胞后,δnpm1的tcr导致作为由hla-a*02:01在具有δnpm1的原代aml上呈现的内源性新抗原的claveevsl的特异性识别
最后,发明人测试了tcr转导的cd8和cd4细胞对原代aml的溶细胞能力。在9小时的51铬释放试验中,针对一组6个hla-a*02:01阳性原代aml(包括4个具有δnpm1的样品和2个具有wtnpm1的样品)测试了tcr转导的t细胞。δnpm1的tcr的转导的cd8和cd4细胞均显示具有δnpm1的aml的特异性裂解,而具有wtnpm1的aml没有特异性裂解(图7)。总之,结果表明,claveevsl是在具有δnpm1的原代aml上表达的治疗性新抗原,其可通过tcr基因转导以共受体独立的方式有效靶向。
讨论
发明人已经在原代aml的hlai类配体组中鉴定了由δnpm1(claveevsl)编码的hla-a*02:01限制性9-mer肽。从健康个体中分离出具有对该肽特异的tcr的t细胞克隆,并且显示这些克隆之一的tcr在逆转录病毒引入cd8和cd4细胞后介导具有δnpm1的原代aml的特异性识别和裂解,表明claveevsl是可以通过tcr基因转导以共受体独立的方式靶向的aml治疗性新抗原。
使用12种原代aml的hlai类配体组数据,发明人将c*laveevsl鉴定为在具有δnpm1的aml上内源加工并呈现的肽。尽管在不存在半胱氨酰化的情况下,洗脱肽和合成肽之间没有发现匹配,但数据提供了有力的证据,表明未半胱氨酰化的claveevsl肽也存在于aml上。已选择克隆1a2用于tcr克隆和基因转导,它可以识别合成的c*laveevsl和claveevsl肽。该克隆也可以被两种pmhc四聚体染色,尽管与具有半胱氨酰化的肽的四聚体的结合较弱。测试具有丝氨酸取代的合成肽的实验证实,表位的第一个残基对于克隆1a2的反应性不是必需的。然而,对于克隆4a8,结果是不同的。克隆4a8识别claveevsl,但不识别c*laveevsl,只有具有未半胱氨酰化肽的pmhc四聚体可以与t细胞克隆结合。通过克隆4a8对其中第一残基被丝氨酸取代的合成肽缺乏反应性,证实了该肽的第一残基对于t细胞识别的重要性。令人惊讶的是,尽管克隆4a8未能识别出半胱氨酰化的肽,但它却显示出对3种具有δnpm1的aml中的2种具有反应性。基于克隆1a2和4a8的反应性模式,发明人建议在细胞表面上呈现半胱氨酰化和非半胱氨酰化的δnpm1肽变体,但是表位的表达水平可能在aml之间变化。hlai类配体组中不存在claveevsl的原因尚不清楚,但可以用洗脱肽的表面表达低或质谱质量差来解释。
有趣的是,在fms相关酪氨酸激酶3基因(flt3-itd)中不伴有内部串联重复的情况下,携带δnpm1的患者在化疗后显示出更高的生存率,从而通常消除了异基因干细胞移植的需要。1,2,5,13对源自δnpm1的肽的体内免疫应答可能是这种有利的预后的基础,特别是因为δnpm1蛋白从核仁转移到细胞质,在此处它容易发生蛋白酶体降解和随后通过hlai类抗原呈递途径进行加工。6greiner等人14在健康志愿者和aml患者中体外搜索了针对9种源自δnpm1的hla-a*02:01限制性肽(包括claveevsl)的t细胞应答。将cd8细胞与载有肽的pbmc共培养后,在健康志愿者和患者中均显示出针对9种肽中的2种的t细胞应答,但未检测到针对claveevsl的免疫应答。随后,他们筛选了25例δnpm1aml患者,并发现具有针对这2种δnpm1衍生肽的免疫应答的患者的总体存活率显著高于无免疫应答的患者。15但是,这项研究中筛查的患者人数少,并且未确定flt3突变状态。最近的数据显示,具有flt3-itd的患者,尤其是突变型比野生型flt3基因的等位基因表达比率高的患者,与无flt3-itd的患者相比,预后较差,与npm1突变状态无关。13该观察结果可能反对体内诱导针对δnpm1的免疫反应是预后良好的基础,但强调了内在因素对aml肿瘤生长的重要性以及δnpm1tcr基因疗法与治疗预后不良的aml的相关性。
aml源自单个基础克隆,该克隆具有数百个体细胞突变,仅有少数驱动突变。亚克隆可通过积累赋予细胞存活优势的其他突变而从创始克隆中出现。结果,亚克隆中的大多数突变与创始克隆共享,而少数是克隆特异性的。aml的这种异质组成增加了诱导或巩固疗法后持续性或复发性疾病中克隆进化的机会。靶向由共同突变产生的新抗原是一种消除基础克隆和亚克隆的诱人的免疫治疗策略。t细胞对肿瘤的免疫编辑可导致乘客突变产生的新抗原容易丢失,从而导致肿瘤免疫逃避。当靶向由驱动突变产生的新抗原时,免疫逃逸的可能性较小,因为这些对于恶性转化至关重要,并且存在于所有肿瘤细胞中。迄今为止,仅鉴定出了由驱动突变引起的少数新抗原,其突变kras导致了在45%的胰腺癌和13%的大肠癌中表达的抗原。17尽管对驱动突变产生的新抗原的免疫逃避可能性较小,但tran等人证明了在转移性结直肠癌患者中,通过丢失hla-c*08:02而逃避突变kras的tcr基因疗法。尽管如此,δnpm1作为在白血病发生早期发生的克隆驱动突变仍然是免疫疗法的诱人靶标。基于其在30%的原代aml中的高突变频率,δnpm1也是理想的靶标。6特征性4bp移码插入发生在编码序列的有限位置(859、860和861),尽管确切的4bp序列可以不同,但大多数突变编码相同的11个氨基酸的选择阅读框(claveevslrk)。发明人已经在hla-a*02:01中鉴定了靶向该选择阅读框的前9个残基的tcr。该tcr可用于将来的基因疗法,以治疗具有δnpm1的aml患者。临床研究将显示δnpm1tcr基因疗法的功效和潜在毒性,以及因丢失hla-a*02:01而引起的免疫逃逸是否对阻止aml的长期缓解具有重要意义。
从克隆1a2分离的tcr已显示在转导至cd8和cd4细胞后介导具有δnpm1的hla-a*02:01阳性aml细胞的特异性识别和裂解,表明tcr能够以共同受体独立的方式将免疫反应性重定向至aml。在最近的几十年中,cd4细胞在抗肿瘤免疫中的关键作用变得更加明显。传统上,已知cd4细胞可为cd8细胞提供帮助,从而改善肿瘤清除率并诱导免疫记忆。但是,越来越多的证据表明,在没有cd8细胞的情况下,cd4细胞也可以介导肿瘤排斥。接受cd8耗尽同种异体骨髓移植或供体淋巴细胞输注的血液系统恶性肿瘤患者与接受未经修饰的干细胞移植或供体淋巴细胞的患者发生相似的移植抗白血病反应,但是移植抗宿主病的发生率和严重性降低。在自体情况下,针对hlaii类限制性肿瘤相关抗原或新抗原的cd4细胞的过继转移分别导致转移性黑素瘤和胆管癌患者的肿瘤消退。但是,由于肿瘤通常不表达hlaii类,因此最好施用表达独立于hlaii类抗原受体的cd8和cd4细胞的混合物,并产生优异的抗肿瘤免疫力。实际上,turtle等人19,20证明,施用一定比例的表达相同cd19特异性嵌合抗原受体的cd8和cd4细胞,可导致相当多的复发或难治性b细胞非霍奇金淋巴瘤患者和b细胞急性淋巴细胞白血病的完全缓解。同样,如先前在小鼠中证实的,表达针对hlai类限制性表位(如claveevsl)的相同tcr的cd8和cd4细胞的过继转移可能导致有效的抗肿瘤免疫力。
最近,δnpm1被描述为用于测量aml患者的最小残留疾病的可靠标记物。21定量rt-pcr检测患者化疗后外周血中δnpm1转录物的持续存在与随访3年内疾病复发相关。结果表明,δnpm1的预后价值与其他风险因素无关,例如flt3-itd或突变的dna甲基转移酶3α(dnmt3a)的存在。重要的是,作者报告,在诊断后具有良好分子特征(无flt3-itd或突变的dnmt3a)的患者中,在第二个化疗周期后存在δnpm1转录物标志着一组相对较差的患者,而在具有不良分子特征(flt3-itd、突变的dnmt3a或两者均有)的患者中,在第二个化疗周期后没有δnpm1转录物显示了预后相对较好的患者。21因此,δnpm1作为疾病状态的标记物可用于选择适合allosct的患者,并可对患者提供δnpm1tcr基因疗法的最佳时机和选择以治疗化疗后的持续性或复发性疾病。最终,当临床研究显示aml可通过具有低治疗相关死亡率的npm1tcr基因转导有效治疗时,它可以取代allosct作为标准疗法,用于基于诊断时的不良分子异常或化疗后可检测到的持续性或复发性疾病而具有不良预后的δnpm1aml患者,从而改善aml患者的总体存活率。
参考文献
1.
2.
3.schumachertn,schreiberrd.neoantigensincancerimmunotherapy.science.2015apr3;348(6230):69-74.
4.trane,robbinspf,rosenbergsa.'finalcommonpathway'ofhumancancerimmunotherapy:targetingrandomsomaticmutations.natimmunol.2017feb15;18(3):255-262.
5.papaemmanuile,gerstungm,bullingerl,gaidzikvi,paschkap,robertsnd等人.genomicclassificationandprognosisinacutemyeloidleukemia.nengljmed.2016jun9;374(23):2209-21.
6.falinib,mecuccic,tiaccie,alcalaym,rosatir,pasqualuccil等人.cytoplasmicnucleophosmininacutemyelogenousleukemiawithanormalkaryotype.nengljmed.2005jan20;352(3):254-66.
7.burrowssr,kienzlen,winterhaltera,bharadwajm,altmanjd,brooksa.peptide-mhcclassitetramericcomplexesdisplayexquisiteligandspecificity.jimmunol.2000dec1;165(11):6229-34.
8.rodenkob,toebesm,hadrupsr,vaneschwj,molenaaram,schumachertn,ovaah.generationofpeptide-mhcclassicomplexesthroughuv-mediatedligandexchange.natprotoc.2006;1(3):1120-32.
9.jahnl,hombrinkp,hagedoornrs,kestermg,vandersteendm,rodriguezt等人.tcr-basedtherapyformultiplemyelomaandotherb-cellmalignanciestargetingintracellulartranscriptionfactorbob1.blood.2017jan4.
10.lefrancmp,giudicelliv,ginestouxc,bodmerj,müllerw,bontropr等人.imgt,theinternationalimmunogeneticsdatabase.nucleicacidsres.1999jan1;27(1):209-12.
11.linnemannc,heemskerkb,kvistborgp,kluinrj,bolotinda,chenx等人.high-throughputidentificationofantigen-specifictcrsbytcrgenecapture.natmed.2013nov;19(11):1534-41.
12.heemskerkmh,hoogeboomm,depausra,kestermg,vanderhoornma,goulmye等人.redirectionofantileukemicreactivityofperipheraltlymphocytesusinggenetransferofminorhistocompatibilityantigenha-2-specifict-cellreceptorcomplexesexpressingaconservedalphajoiningregion.blood.2003nov15;102(10):3530-40.
13.versluisj,in'thoutfe,devillierr,vanputtenwl,manzmg,vekemansmc等人.comparativevalueofpost-remissiontreatmentincytogeneticallynormalamlsubclassifiedbynpm1andflt3-itdallelicratio.leukemia.2017jan;31(1):26-33.
14.greinerj,onoy,hofmanns,schmitta,mehringe,
15.greinerj,schneiderv,schmittm,
16.blankensteint,leisegangm,uckertw,schreiberh.targetingcancer-specificmutationsbytcellreceptorgenetherapy.curropinimmunol.2015apr;33:112-9.
17.trane,robbinspf,luyc,pricketttd,gartnerjj,jial等人.t-celltransfertherapytargetingmutantkrasincancer.nengljmed.2016dec8;375(23):2255-2262.
18.trane,turcottes,grosa,robbinspf,luyc,dudleyme等人.cancerimmunotherapybasedonmutation-specificcd4+tcellsinapatientwithepithelialcancer.science.2014may9;344(6184):641-5.
19.turtlecj,hanafila,bergerc,hudecekm,penderb,robinsone等人.immunotherapyofnon-hodgkin'slymphomawithadefinedratioofcd8+andcd4+cd19-specificchimericantigenreceptor-modifiedtcells.scitranslmed.2016sep7;8(355):355ra116.
20.turtlecj,hanafila,bergerc,gooleyta,cherians,hudecekm等人.cd19car-tcellsofdefinedcd4+:cd8+compositioninadultbcellallpatients.jclininvest.2016jun1;126(6):2123-38.
21.iveya,hillsrk,simpsonma,jovanovicjv,gilkesa,grecha等人;uknationalcancerresearchinstituteamlworkinggroup.assessmentofminimalresidualdiseaseinstandard-riskaml.nengljmed.2016feb4;374(5):422-33.
22.h.d.meiring,e.vanderheeft,g.j.tenhove,a.p.j.m.dejong,nanoscalelcms(n):technicaldesignandapplicationstopeptideandproteinanalysis.jsepsci25,557-568(2002).
23.michalbassani-sternberg和georgecoukos:massspectrometry-basedantigendiscoveryforcancerimmunotherapy.currentopinioninimmunology(2016)41:9–17.
- 还没有人留言评论。精彩留言会获得点赞!