CD1D限制性NKT细胞作为即用型癌症免疫治疗的平台的制作方法
本申请要求2017年8月11日提交的申请号为17185992.9的ep申请的优先权,其通过引用整体并入本文。
本公开至少涉及细胞生物学、分子生物学、免疫学和医学领域。
背景技术:
使用自体肿瘤特异性t细胞的癌症免疫疗法。分离和扩增肿瘤特异性t细胞然后输注(过继转移)回到患者的策略是癌症治疗中具有前景的方式。这种治疗在一些黑素瘤患者中已经是成功的,黑素瘤患者在输注自体黑素瘤特异性t细胞后可以具有完全和持续的肿瘤消退(1)。然而,作为其他免疫原性较低的恶性肿瘤的治疗,t细胞治疗受限于缺乏能够引发强烈t细胞反应的分子定义的肿瘤抗原,以及难以从肿瘤宿主中分离这些t细胞。
使用car重定向的自体t细胞的癌症免疫疗法。用嵌合抗原受体(car)对t细胞进行重定向抗原特异性的遗传修饰是产生用于过继治疗的效应细胞的一种策略,其不依赖于预先存在的抗肿瘤t细胞免疫。最近的临床试验表明,重定向到cd19抗原的t细胞可以诱导b细胞白血病和淋巴瘤患者的持续完全反应(2-7)。然而,由于疾病和化疗的影响,从淋巴瘤患者获得的t细胞的增殖能力降低。产品制造过程中t细胞扩增的减少意味着只有25%的新诊断和少至12.5%的治疗的小儿淋巴瘤患者可以输注自体cd19cart细胞(8)。与淋巴瘤患者相似,t细胞数量和功能的不足在许多种癌症患者中是常见的(9-12)。克服该限制的一种方法是使用从用肿瘤特异性car修饰的健康个体获得并离体扩增的t细胞给癌症患者输注。然而,除一小部分患者适于同种异体干细胞移植外,hla不匹配的t细胞不能使用,因为它们会引起移植物抗宿主病(gvhd)和/或被患者的免疫系统排斥。
t细胞中tcr的基因缺失用以避免gvhd。qasim等使用基因编辑同时向t细胞引入car并破坏tcr,证明了从一种不匹配的健康供体产生gvhd不能的cart细胞的方法(13)。在该研究中,使用转录激活因子样效应物核酸酶(talen)技术引入脱靶基因改变,从t细胞基因组中删除了tcr基因(13)。
自然杀伤t细胞(nkt)具有抗肿瘤效应物功能并且天然地避免gvhd。nkt是先天性淋巴细胞的进化保守亚群,其特征在于不变的tcrα链vα24-jα18的表达以及对由单态类hlai类分子cd1d呈递的糖脂的反应性(14-17)。nkt具有许多抗肿瘤特性,据报道它们的数量与几种癌症的良好预后相关(18)。heczeya.等和giant.等证明nkt可以从外周血中分离,用car转导并扩增到临床规模用于过继细胞治疗应用(19,20)。一些研究已经表明,供体来源的nkt不介导gvhd,甚至可能抑制gvhd(21,22)。因此,同种异体的健康供体来源的carnkt可用于治疗癌症患者,而没有gvhd风险,与t细胞相比,不需要额外的遗传操作。
通过宿主免疫系统消除同种异体治疗细胞。所有正常有核细胞均表达hlai类,因此宿主免疫系统将消除来自hla不匹配供体的过继转移的治疗细胞。t和nkt细胞在活化时也可以瞬时表达hlaii类,并且hlaii类的不匹配通过宿主cd4t细胞触发供体细胞消除。延迟这种排斥的常用方法是使用免疫抑制宿主调节以允许效应细胞在宿主免疫系统恢复之前介导抗肿瘤活性的治疗窗口。然而,这种方法对患者有毒,并且由于治疗效应细胞的持久性不足而可能不允许完全的肿瘤控制。
hlai类分子在细胞表面上的表达取决于β2-微球蛋白(b2m)。已经确定,为了在细胞表面上表达,hlai类分子需要b2m(23)。因此,靶向供体衍生的效应细胞中的b2m将阻断hlai类表达并阻止它们被宿主cd8t细胞识别。然而,hlai类分子也可作为nk细胞的抑制性配体,并且预期b2m表达的丧失会使供体细胞易被宿主nk细胞杀死(24)。尚不清楚在供体细胞中b2m/hlai类的表达是否可以达到特定水平,足以阻止宿主cd8t细胞的活化而不引发宿主nk细胞的细胞毒性。在nkt中发现这样的b2m表达范围将使癌症患者能够延长对来自hla不匹配的健康供体的治疗性nkt或carnkt的耐受性,其将带来持久的抗肿瘤活性而没有gvhd的风险。
hlaii类分子在细胞表面上的表达取决于hla-dr抗原相关的恒定链(ii,也称为cd74)。恒定链有助于从er输出mhcii类,并且是适当抗原加载和mhcii类/抗原复合物的表面表达所需的。已知t细胞在激活例如抗原识别时在其细胞表面上瞬时表达mhcii类。本公开描述了发现nkt细胞在tcr刺激后也上调细胞表面的mhcii类表达(图3a)。因此,本发明人试图通过靶向ii表达以下调mhcii类从而减弱宿主cd4t细胞对nkt细胞的排斥。此外,表征了联合靶向nkt中的b2m和ii是否将进一步延长癌症患者对来自hla不匹配的健康供体的治疗性nkt或carnkt的耐受性,并且使其抗肿瘤活性最大化而没有gvhd风险。
技术实现要素:
本公开的实施方案包括细胞(例如来自供体),其被操作以被宿主耐受,例如避免不期望的宿主免疫应答;本公开也包括该细胞的使用方法,包括作为免疫疗法。在具体的实施方案中,细胞用于免疫疗法并且可被考虑即用型的利用。在特定的实施方案中,细胞适合于过继治疗。在特定的实施方案中,细胞避免受试者中的gvhd。细胞可用于一种或多种宿主中,包括来自相同多种工程细胞的细胞,用于一种或多种宿主。在特定情况下,待提供给受试者的细胞具有一种操作以实现逃避宿主免疫细胞的能力,并且在一些情况下,还提供对细胞破坏的肿瘤特异性。在一些情况下,本公开包括来自健康供体的具有肿瘤特异性和普遍耐受性的nkt细胞一次成功产生,用于即用型免疫疗法,包括用于癌症。在特定情况下,本公开包含的细胞能够防止同种异体cd8t细胞或cd4t细胞的活化,包括不引发被同种异体nk细胞的杀伤。在这种情况下,细胞是经过工程改造以表达很少或不表达hlai类分子的nkt细胞,并且令人惊讶的是,这些细胞仍然对宿主nk细胞的杀伤具有抗性。本文使用的nkt细胞可包括例如inkt、utnkt或天然杀伤t细胞。在一些情况下,供体细胞能够用于hla不匹配受试者的免疫治疗,包括患有癌症的受试者。在特定情况下,使用b2m特异性shrna进行rna干扰,并且可以在nkt细胞中发现一系列b2m和hlai类表达,其将阻止同种异体cd8t细胞的激活而不引发被同种异体nk细胞杀伤。在特定情况下,使用ii特异性shrna进行rna干扰,并且可以在nkt细胞中发现ii和hlaii类表达的下调,其将阻止同种异体cd4t细胞的活化。在一些特定情况下,b2m特异性shrna、ii特异性shrna或两者以及肿瘤特异性car可以被工程化以表达在单个逆转录病毒构建体内,用于具有肿瘤特异性和普遍耐受性的健康供体来源的nkt细胞的一次成功产生,用于hla不匹配癌症患者的免疫治疗。在特定的实施方案中,细胞不是衍生自诱导的多能干细胞。在特定方面,细胞可以抵抗被nk细胞的消除。
在本公开的一个实施方案中,存在分离的nkt细胞或其多个细胞,其具有降低的内源性β-2-微球蛋白(b2m)和/或mhcii类相关恒定链(ii)的表达,或二者。借助于人手操作,细胞具有降低的b2m和/或ii的表达,并且不位于自然界中或与自然界中的细胞相似。降低的表达可以进一步定义为细胞中的敲除或敲低。在具体的实施方案中,所述细胞或多个细胞包含一种或多种靶向b2m基因和/或ii基因的试剂,例如靶向b2m基因或ii基因(如b2m或ii基因的3’端)的一种或多种合成的dna或rna。在某些情况下,所述合成的rna是shrna或crispr向导rna。
在本公开的特定实施方案中,具有降低的内源性b2m和/或ii表达的所述细胞或多个细胞包含一种或多种工程化受体,例如嵌合抗原受体或t细胞受体。在一些情况下,所述nkt细胞或多个nkt细胞重组表达一种或多种细胞因子和/或一种或多种细胞因子受体,例如il-15、il-15ra、il-7、il-12、il-18、il-21、il-27、il-33,或它们的组合。在一些情况下,所述nkt细胞或多个nkt细胞具有降低的第二内源基因的表达。在特定情况下,所述细胞或多个细胞相对于受试者是自体同源的或同种异体的。
在一个实施方案中,存在通过将nkt细胞暴露于一种或多种减少所述细胞或多个细胞中内源性b2m和/或mhcii类相关恒定链(ii)的表达的试剂而产生本文所涵盖的所述nkt细胞或多个nkt细胞的方法。所述试剂可以是任何种类,包括但不限于dna载体、吗啉代、反义rna、antigomerrna、sirna、s-dna、talen、锌指核酸酶(zfn)或crispr向导rna。所述dna载体编码使一种或多种靶基因失活或降低其表达的试剂。在一些情况下,除操作以降低内源性b2m的表达外,还操作nkt细胞以表达一种或多种实体,例如操作以具有一种或多种工程化受体和/或一种或多种细胞因子。在一些情况下,使用除nkt细胞之外的细胞。
在一些实施方案中,存在如本文所涵盖的细胞或多个细胞,其用于治疗受试者的医学病症,例如癌症。在一些情况下,所述癌症是脑、肺、乳腺、前列腺、胰腺、皮肤、肾脏、肝脏、睾丸、卵巢、胆囊、脾脏、子宫内膜、子宫颈、食道、甲状腺、脑垂体、胃、结肠、肛门、血液、骨、膀胱、胆管、头颈、口腔、唾液腺、小肠和/或尿道、或恶化前病症(如骨髓增生异常综合征(mds))。
在具体的实施方案中,存在包含本文所涵盖的同种异体细胞或多个同种异体细胞的组合物,其用于治疗受试者的医学病症,优选癌症或恶化前病症。
在一些实施方案中,存在通过向受试者提供有效量的本文所涵盖的一种或多种细胞来治疗受试者的医学病症的方法。所述医学病症可以是或不是癌症。在一些情况下,细胞对于所述受试者是同种异体的,尽管在替代情况下它们对所述受试者是自体同源的。在特定实施方案中,它们是nkt细胞。
前面已经相当广泛地概述了本发明的特征和技术优点,以便可以更好地理解随后的本发明的详细描述。在下文中将描述本发明的附加特征和优点,其形成本发明权利要求的主题。本领域技术人员应该理解,所公开的概念和具体实施方案可以容易地用作修改或设计用于实现本发明相同目的的其他结构的基础。本领域技术人员还应该认识到这种等同构建不脱离所附权利要求所示的本发明的精神和范围。被认为是本发明特点的新颖特征,关于其组织和操作方法,以及其他目的和优点,将在以下描述中在结合附图考虑时更好的理解。然而,应该清楚地理解,提供每个附图仅仅是为了说明和描述的目的,而不是作为对本发明的限制性定义。
附图说明
为了更完整地理解本发明,现在参考以下结合附图的描述,其中:
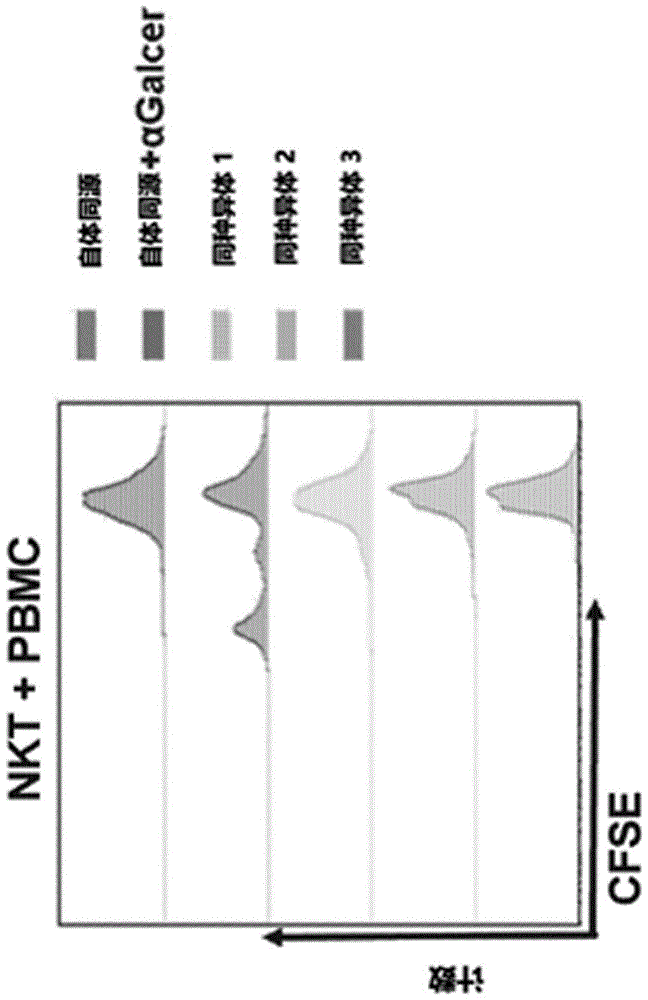
图1.在同种异体pbmc存在下,nkt细胞不增殖。将羧基荧光素琥珀酰亚胺酯(cfse)标记的nkt细胞与作为刺激细胞的经辐射的同种异体pbmc以5:1的比例共培养。自体同源pbmc单独或用αgalcer脉冲分别用作阴性或阳性对照。在第6天通过流式细胞术测量cfse稀释来评估nkt细胞增殖。结果来自4个实验的代表。
图2a、2b和2c。crispr/cas9敲除和shrna敲低β2-微球蛋白(b2m)表达。(2a)仅用cas9(绿色)或cas9/hb2m-sgrna(红色)电穿孔后96小时,nkt细胞中b2m表达(左)和hlaabc表达(右)的代表性流式细胞术分析。(2b)在仅用cas9(绿色)或cas9/hb2m–sgrna(红色)电穿孔后通过使用anti-apc磁珠(miltenyibiotec)去除b2m阳性细胞进一步纯化后nkt细胞中b2m和hlaabc表达的代表性流式细胞术分析。(2c)慢病毒介导的b2mshrna导致nkt细胞中b2m(上)和hlaabc(下)表达的下调的代表性流式细胞术分析。结果来自5个检测供体的代表。
图3a和3b。使用靶向ii(cd74)的shrna敲低hlaii类表达。(3a)使用pacificblue-偶联的抗-hladp-dq-drmab,在静息nkt细胞(刺激后第15天)和激活的nkt细胞(刺激后第2天)中hladp-dq-dr表达的代表性流式细胞术分析。(3b)慢病毒介导的iishrna导致转导的nkt细胞表面hladp-dq-dr的下调的代表性流式细胞术分析。结果来自5个检测供体的代表。
图4a和4b。在同种异体混合淋巴细胞反应(mlr)测定中,用crispr和shrna靶向b2m在减少nkt细胞对cd4+和cd8+t细胞的刺激上同样有效。(4a)cfse标记的t细胞与wtnkt、b2mnu11(crispr)nkt、b2mlow(shrna)nkt或iilow(shrna)nkt以5:1的比例共培养。如通过cfse稀释测量的,在刺激后第5天评估cd8+和cd4+t细胞的增殖。(4b)结果来自3个检测供体的代表。与wtnkt相比,*p<0.05,**p<0.01。
图5a和5b。b2mnull/lownkt最低限度地受allonk细胞的细胞毒性影响。(5a)健康供体来源的wtnkt、b2mnu11(crispr)nkt或b2mlow(shrna)nkt细胞用钙黄绿素-am标记,并与来自无关健康供体的同种异体nk细胞孵育4小时,效应物与靶标之比为10:1、5:1和1:1。天然缺乏抑制性hlai类配体的nk敏感性k562细胞用作阳性对照。(5b)显示了特异性裂解的平均百分比的定量。数据代表平均+sd。n=3;与对照wt细胞相比,*p<0.05,**p<0.01。
图6a和6b。产生表达car和shrna的逆转录病毒载体。(6a)car/shrna构建体的示意图:u6启动子和shrna以相反(1)或相同(2)的方向置于car的下游。另外,u6启动子和shrna以相同(3)或相反(4)的方向被置于ef1启动子驱动的car的上游。(6b)nkt细胞中car和b2m表达的流式细胞术分析。结果来自5个检测供体的代表。
图7.产生cd19car构建体,其表达cd28或41bb共刺激结构域,具有或不具有il15。基于两个域架构生成八个构建体。第一组(39和84构建体)编码igg4铰链、igg1ch3间隔区、cd28tm,以及cd28或4-1bb共刺激结构域,全部具有或不具有il15。第二组(28和41构建体)编码cd8α铰链和tm以及cd28或4-1bb共刺激结构域,全部具有或不具有il15。将含有cd28或41bb共刺激结构域的片段分别与fmc63scfv连接产生28和41构建体。使用gibson组装方法(newenglandbiosciences)将2a和il15序列添加到所有构建体中。ltr=长末端重复,scfv=单链可变片段,tm=跨膜,2a=来自马鼻炎a病毒的2a序列。
图8.注射cd19carnkt的小鼠中萤火虫荧光素酶(ffluc)标记的daudi淋巴瘤细胞的系列生物发光成像。nsg小鼠静脉内注射2x105ffluc+daudi淋巴瘤细胞,三天后静脉注射5x106用指定构建体转导的或无构建体(未转导,nt)的nkt。就在成像之前,小鼠通过腹膜内注射接受100μl的30mg/ml的荧光素,并在生物发光通道下成像5分钟。生物发光计数范围150-5000。
图9.图8中用cd19carnkt处理的daudi淋巴瘤小鼠的存活曲线。通过kaplan-meier方法(每组8只小鼠)分析存活概率,并使用log-rank(mantel-cox)测试计算比较。39vs.39.15p=0.0033,28vs.28.15p=0.0003,39.15vs28.15p=0.0011,84vs.84.15p=0.0039,41vs.41.15p=0.1410。
图10.产生具有和不具有b2m和iishrna的表达cd19car的逆转录病毒载体。如图7中所述产生28.15构建体。对于含有shrna的构建体,通过gibson组装将与单个u6启动子(sigma-aldrich)连接的b2m和iishrna序列单独或一起以相反转录方向连接到28.15car下游。ltr=长末端重复,scfv=单链可变片段,tm=跨膜,2a=来自马鼻炎a病毒的2a序列。
图11a-11f.b2m和ii表达的shrna敲低。(11a)cd19car表达的代表性流式细胞术分析。在抗原刺激后4天用指定的构建体转导nkt,并用alexa647-偶联的抗fmc63mab染色。未转导的(nt)nkt用作对照。用指定的构建体转导的nkt细胞或ntnkt中(11b)b2m、(11c)hlaabc、(11d)ii和(11e)hladp-dq-dr表达的代表性流式细胞术分析。细胞用抗fmc63mab和1)pe偶联的抗b2m抗体与fitc偶联的抗hlaabc抗体染色或2)pe偶联的抗ii抗体与fitc偶联的抗hladp-dq-dr抗体染色。样品在car阳性细胞上门控(gated)。结果来自3-5个检测供体的代表。(11f)car-shrnankt与carnkt中指定基因敲低的定量。
图12.b2m/iishrna不影响carutnkt细胞的指向car的体外细胞毒性。用指定的cd19car-shrna构建体转导的nkt或未转导的(nt)nkt与荧光素酶阳性daudi(cd19阳性)靶细胞以特定的效应物-靶标比例共培养6小时。在共培养后,nkt细胞毒性被作为靶细胞生物发光的函数确定。
图13a、13b和13c。在同种异体mlr测定中,不匹配的cd8+和cd4+t细胞显示对carutnkt细胞的同种异体反应性减弱。(13a)同种异体mlr测定中t细胞的预期结果示意图。同种异体cd8+或cd4+t细胞分别在亲本nkt上对mhci类和mhcii类识别将导致t细胞增殖。utnkt中通过b2m的敲低下调mhci类或通过ii的敲低下调mhcii类将导致同种异体t细胞增殖的相对减少。(13b)cfse标记的cd8+或(13c)cd4+t细胞与表达指定构建体的carutnkt细胞或未转导(nt)nkt细胞共培养,比例为1:5(t:nkt)。如通过cfse稀释测量的,在刺激后5天评估t细胞增殖。结果来自3个检测供体的代表。
图14a和14b。与亲本nkt相比,utnkt细胞对同种异体t细胞的细胞毒性较不敏感。(14a)t细胞细胞毒性测定中nkt和utnkt细胞的预期结果的示意图。同种异体t细胞将亲本nkt上的mhc分子识别为外来的,导致这些nkt细胞死亡。utnkt上mhc分子的下调将使这些细胞比亲本nkt更好地逃避t细胞的细胞毒性。(14b)将同种异体t细胞与carutnkt或未转导(nt)nkt以1:1的比例孵育4天。使用计数珠(invitrogen)通过流式细胞术测定nkt细胞数量。与ntnkt相比,*p<0.05,**p<0.01。
图15a和15b.utnkt细胞最低限度地受nk细胞的细胞毒性影响。(15a)nk细胞细胞毒性测定的预期结果示意图。nk细胞不杀死表达mhci类的亲本nkt,但通常杀死缺乏mhci的靶细胞。utnkt将表达足够的mhci以逃避nk细胞的杀伤。(15b)将来自健康供体的nk细胞与钙黄绿素am标记的utnkt以5:1的比例共培养4小时。靶细胞裂解显示为通过流式细胞术测定的保留的钙黄绿素-am荧光的函数,平均±sd,n=3;**p<0.01,ns:不显著。
图16a和16b。注射car.cd19utnkt的小鼠中ffluc标记的daudi淋巴瘤细胞的系列生物发光成像。(16a)nsg小鼠静脉内注射2x105ffluc+daudi淋巴瘤细胞,3天后静脉注射5x106用指定的构建体转导的car.cd19utnkt或没有构建体的(未转导的,nt)car.cd19utnkt。就在成像之前,小鼠通过腹膜内注射以接受100μl30mg/ml的荧光素,并在生物发光通道下成像5分钟(16b)。生物发光计数范围150-5000。
图17.用图16的car.cd19utnkt处理的daudi淋巴瘤小鼠的存活曲线。通过kaplan-meier方法(每组10只小鼠)分析存活概率,并使用log-rank(mantel-cox)测试计算比较。****p<0.0001。
发明详述
如本文在说明书中所使用的,“一个”或“一种”可以表示一个(种)或多个(种)。如本文在权利要求中所使用的,当与单词“包含”结合使用时,单词“一个(a)”或“一种(an)”可以表示一个(种)或多于一个(种)。如本文所用,“另一个”可以表示至少第二个或更多。在具体的实施方案中,本发明的方面可以“基本上由……组成”或“由……组成”,例如本发明的一个或多个序列。本发明的一些实施方案可以由本发明的一种或多种要素、方法步骤和/或方法组成或基本上由其组成。预期本文所述的任何方法或组合物可与本文所述的任何其他方法或组合物一起实施。本申请的范围不旨在限于说明书中描述的工艺、设备、制造、物质组成、装置、方法和步骤的特定实施方案。
本文所用的术语“治疗有效量”或“有效量”是指当施用给受试者或患者治疗疾病时足以对疾病的治疗产生作用的量,包括改善疾病的至少一种症状。
具有降低的内源性β-2-微球蛋白(b2m)和/或内源性mhcii类相关恒定链(ii)表达的nkt细胞是指其中内源性β-2-微球蛋白(b2m)和/或内源性mhcii类相关恒定链(ii)的表达水平与未修饰的nkt细胞相比降低的细胞。在一个实施方案中,内源性β-2-微球蛋白(b2m)和/或内源性mhcii类相关恒定链(ii)的表达水平降低至少50%、55%、60%、65%、70%、75%、80%、85%、90%、95%,更优选100%。
术语“下调”是指一种或多种基因的基因表达的降低、减少、消除和/或抑制。同样的,该术语涵盖术语“敲低”和“敲除”二者。
如本文所用,术语“敲低”是指减少或消除一种或多种基因的基因表达。
如本文所用的术语“敲除”是指消除一种或多种基因的基因表达。
如本文所用,术语“内源的”是指来自细胞内或在细胞内产生的任何材料,而术语“外源的”是指从细胞外引入或在细胞外产生的任何材料。
如本文所用,术语“重组工程化受体”是指借助于人使用用于遗传重组的标准技术产生的细胞表面受体。
i.根据本公开的修饰的nkt对allo-nk细胞的细胞毒性具有抗性
本公开证明nkt细胞可以从健康供体分离并离体扩增至大量,同时保留高功能细胞的表型,为生产用于治疗应用(例如过继性癌症免疫疗法)的基于nkt细胞的同种异体治疗产品提供基础。
由于nkttcr受单型cd1d的限制(这在所有人类中都相同),本公开实验性证明了nkt细胞不与来自无关供体的pbmc反应。这些结果表明,与常规t细胞不同,同种异体nkt在转移至不相关的受体时不会介导gvhd。
与任何其他细胞一样,nkt表达hlai类分子,并且受到hla不匹配受体的免疫系统的消除,主要是被hlai类限制性cd8t细胞消除。本领域的现有知识教导了可以通过靶向b2m表达来消除或减少hlai类表达。但是,也已知hlai类分子用作nk细胞的抑制性配体,因此预期靶向b2m表达会引发nk细胞介导的杀伤。因此,本领域现有技术水平表明,nkt中的b2m消除或下调或癌症免疫疗法中使用的任何其他类型的效应淋巴细胞将使细胞遭受allo-nk细胞的细胞毒性。在本公开中,首次证明完全消除b2m表达(例如通过crispr介导的基因缺失)或b2m表达的分级下调(例如通过shrna介导的rna干扰)在降低nkt细胞被同种异体cd8和cd4t细胞的刺激方面同样有效。
出乎意料的是,如本文所示,大多数nkt在crispr介导的b2m敲除后仍然对allo-nk细胞的细胞毒性具有抗性,并且在shrna介导的b2m敲低后更是如此。考虑到与crispr介导的b2m基因敲除相比,nkt中shrna介导的b2m基因敲低在降低t细胞同种异体反应性方面同样有效,但其使得nkt对allo-nk细胞的细胞毒性更不敏感,在一些实施方案中,shrna用于靶向nkt和类似的其他效应淋巴细胞(例如t、nk、γ/δt、mait、ilc等)中的b2m表达,以用于同种异体环境中的过继细胞治疗应用。此外,与crispr和类似的基因组编辑方法(例如,talen、zfn)相反,shrna不会在靶细胞中引起永久性遗传改变,在至少一些情况下提供临床上更安全的选择。
最后,本文首次证明b2m特异性shrna和肿瘤特异性car可以被工程化的表达于单个逆转录病毒构建体内,用于肿瘤特异性和普遍耐受的健康供体来源的nkt细胞的一次成功产生,用于hla不匹配癌症患者的免疫治疗。
ii.本公开的细胞
在特定的实施方案中,本公开的细胞是具有抗肿瘤效应子功能和/或能够避免移植物抗宿主病的细胞。尽管在特定的实施方案中,所述细胞是nkt细胞,但在其他实施方案中,所述细胞是t、nk、γ/δt、mait或ilc。在至少一些情况下,所述细胞不是衍生自诱导的多能干细胞。在具体的实施方案中,所述细胞具有降低表达的或不表达的hlai类和/或ii类分子和/或一种或多种hlaii类分子。在具体的实施方案中,所述细胞不能被某些宿主t细胞识别,例如宿主cd8t细胞和/或宿主cd4t细胞。在特定的实施方案中,操作所述细胞以降低或消除例如b2m的表达,使得所述细胞中hlai类分子的表达降低或消除。另外或可替代地,操作所述细胞以降低或消除例如ii的表达,使得所述细胞中hlaii类分子的表达降低或消除。在特定的实施方案中,设计本公开的细胞使得宿主nk细胞不能杀死本公开涵盖的细胞。在一些实施方案中,当过继转移至同种异体宿主时,本发明的细胞不与宿主刺激细胞(例如宿主pbmc)发生同种异体反应并且缺乏介导gvhd的能力。在具体的实施方案中,所述细胞对nk细胞的消除具有抗性。
在某些实施方案中,本公开涉及具有降低的b2m表达的细胞。具有降低的b2m表达的细胞可能具有通过本领域的标准方法检测不到的b2m表达,或者是可检测的但是与未经人工操作以降低内源表达的细胞相比表达水平降低的b2m表达。所述细胞可以定义为具有b2m表达的敲除或敲低。在这样做时,在特定的实施方案中,所述细胞是hlai类阴性的。在一些实施方案中,本公开涉及具有降低的ii表达的细胞。具有降低的ii表达的细胞可以具有通过本领域的标准方法检测不到的ii表达,或者是可检测的但是与未经人工操作以降低内源表达的细胞相比表达水平降低的ii表达。所述细胞可以定义为具有ii表达的敲除或敲低。在这样做时,在特定的实施方案中,所述细胞是hlaii类阴性。
在替代情况下,代替b2m或ii的表达水平的部分或完全降低,可以将细胞工程化以表达相应的非功能性形式。例如,可以操作细胞以表达b2m和/或ii,其是全长的非功能片段或全长但具有一个或多个导致其标准功能受损的突变(点突变、倒位、缺失等)。b2m突变体的实例是具有mhc1α1α2结构域相互作用缺陷的突变体(hill等,2003)。
在特定的实施方案中,存在一种或多种分离的人nkt细胞,包括其多个细胞,其具有降低的或不可检测的以下表达:(a)内源性β-2-微球蛋白(b2m);(b)内源性mhcii类相关恒定链(ii);或(c)二者,其中所述细胞不是来源于诱导的多能干细胞,并且其中所述细胞适合过继治疗。在特定的实施方案中,这些特征是所述细胞抵抗nk细胞消除的直接或间接原因。
在一些情况下,从供体(包括健康供体)分离所述细胞,其中针对一种或多种特定性状选择所述细胞。例如,可以针对一种或多种特定标志物(例如表面标志物)的表达选择所述细胞。在具体的实施方案中,此类标志物可以与特定的有益功能相关联,例如与缺少该标志物的细胞相比,增加的细胞扩增能力,在过继转移后在体内持续存在,和/或在反复的肿瘤细胞杀伤后抵抗耗尽。在具体的实施方案中,选择表达选自cd62l、cd4及其组合,和/或缺乏表达或低表达pd1、lag3、tim3、tigit等生物标志物的细胞。
在具体的实施方案中,除了具有降低的b2m和/或ii表达的细胞之外,可以将细胞工程化以表达一种或多种其他非天然实体,例如一种或多种受体。所述受体可以是任何类型,并且除了具有b2m和/或ii的降低表达之外,一种细胞可以具有一种以上的受体。在特定情况下,所述受体是重组工程受体。例如,所述受体可以是嵌合抗原受体(car)、嵌合细胞因子受体、t细胞受体等。在细胞被修饰以表达一种或多种car的情况下,单个或多个car可靶向一种或多种抗原,包括一种或多种肿瘤抗原。受体靶向的肿瘤抗原可包括例如5t4、8h9、ανβ6整联蛋白、bcma、b7-h3、b7-h6、caix、ca9、cd19、cd20、cd22、cd30、cd33、cd38、cd44、cd44v6、cd44v7/8、cd70、cd123、cd138、cd171、cea、cspg4、egfr、egfr家族包括erbb2(her2)、egfrviii、egp2、egp40、erbb3、erbb4、erbb3/4、epcam、epha2、epcam、fap、fbp、胎儿achr、frα、gd2、gd3、磷脂酰肌醇蛋白聚糖-3(gpc3)、hla-a1+mage1、hla-al+ny-eso-1、il-11ra、il-13rα2、lambda、lewis-y、kappa、kdr、mcsp、间皮素、mucl、mucl6、ncam、nkg2d配体、ny-eso-1、prame、psc1、psca、psma、ror1、sp17、生存素、tag72、tems、癌胚抗原、hmw-maa或vegfr2。car可以是第一代(包括cd3ζ链)、第二代(包含cd3ζ链和一个细胞内信号共刺激内部结构域)、第三代(包含cd3ζ链和两个或更多个细胞内信号共刺激内部结构域),第四代(诱导释放重组免疫调节剂),等等。在具体的实施方案中,car包括选自cd28、ox40、4-1bb、icos、cd40、cd30、cd27或其组合的共刺激内部结构域。另外或可替代地,所述细胞可以表达一种或多种重组t细胞受体(tcr)。在一些实施方案中,这种tcr可以被修饰以实现高水平的细胞表面抑制,例如wo2016170320a1中所描述。在一些实施方案中,此类tcr包含细胞外恒定结构域残基之间的重组链间二硫键,例如wo2006000830a2中所描述。在具体的实施方案中,表达重组tcr的细胞可以进一步工程化以诱导性释放重组免疫调节剂。示例性的重组免疫调节剂是抗体、其片段(例如scfv)或抗体衍生物,其可以例如靶向tnfα和/或pd-l1。
在一些实施方案中,操作细胞以重组表达一种或多种基因产物,所述基因产物将有益于细胞的抗肿瘤活性、扩增和/或生长。此类基因产物包括一种或多种细胞因子(至少包括il-15、il-7、il-12、il-18、il-21、il-27、il-33、抗体片段或衍生物,如scfv或双特异性抗体)(例如,靶向癌抗原和/或检查点抑制剂),或其组合)和/或促存活细胞因子受体,例如il-7ra或il-15ra。所选择的表达某一种或多种基因产物的nkt细胞也可以修饰或不修饰以重组表达基因产物。在一些实施方案中,操作细胞以下调靶向细胞中抑制性受体的一种或多种基因产物的表达(例如,pd1、lag3、tim3、tigit、tgfbr1、il-10r等)。
在除了被操作以具有降低表达的b2m和/或ii之外还操作细胞以表达实体的情况下,所述实体可以通过或不通过载体引入细胞。在一些情况下,将降低b2m和/或ii表达的试剂和试剂之外的实体(例如工程化受体)在同一载体上引入细胞,尽管在其他情况下它们在不同载体上。在一些情况下,可以在操作细胞表达额外实体之前操作细胞以具有降低表达的b2m和/或ii,尽管在一些情况下操作细胞以具有降低表达的b2m和/或ii在操作细胞表达额外的实体之后。在它们位于相同载体上的情况下,用于降低b2m和/或ii表达的试剂和额外的实体可以在相同的表达构建体上并且由相同或不同的基因调控序列调节,或在不同的表达构建体上被不同的基因调控序列调节。在使用单一载体的情况下,用于降低b2m表达的试剂相对于额外的实体在5'至3'方向上可以为5'或3',反之亦然。
在细胞为非nkt细胞的淋巴细胞亚群的情况下,可以评估shrna对b2m下调的水平是否足以减少异基因性(allogenecity)而不触发allo-nk细胞杀伤,其可用于癌症的免疫疗法:t细胞(其也可能具有tcr缺失)、γ/δt细胞、mait细胞、nk细胞和ilc是实例。在使用非nkt细胞的情况下,可能需要对非nkt细胞进行操作,而该操作无需对nkt细胞进行。
在一些实施方案中,在所述细胞中,用试剂靶向以下调mhcii类相关恒定链(ii)(例如shrna或其他标准方法),从而提供细胞中hlaii类表达的下调和进一步降低cd4t细胞介导的同种异体反应。在这种情况下,还可以操作细胞以重组表达另一种实体,例如工程化受体和/或一种或多种细胞因子等等。在具体的实施方案中,所述细胞包含编码car和iishrna的病毒(例如,逆转录病毒)构建体,尽管在某些情况下car和iishrna在分开的构建体或载体上。在一些情况下,所述细胞具有下调的ii表达但不被操作以具有下调的b2m表达。
在一些实施方案中,提供nkt细胞系,其稳定表达降低水平的b2m和/或ii,或其中b2m和/或ii的表达被稳定失活。
在特定实施方案中,所述细胞表达具有b2m和ii二者都下调的构建体(例如,逆转录病毒构建体)。在这样的细胞中,也可能存在car和/或其他基因产物的表达。在具体的实施方案中,所述细胞表达car并且具有b2m和ii二者的下调(例如,具有b2mshrna和iishrna二者)。在其他具体实施方案中,所述细胞表达重组tcr并且具有b2m和ii二者的下调(例如,具有b2mshrna和iishrna二者)。
在一些实施方案中,所述细胞表达复合car,例如car构建体,并另外表达一种或多种细胞因子(例如,il-15、il-7、il-12、il-18、il-21、il-27、il-33,其组合等)和/或细胞因子受体(il-15、il-7、il-12、il-18、il-21、il-27、il-33的受体,其组合)。在其优选的实施方案中,所述细胞还表达b2m、ii或二者的shrna(或一种或多种靶向b2m、ii或二者的除shrna之外的其他试剂)。
在一些实施方案中,所述细胞表达一种或多种重组工程化受体、b2mshrna和/或iishrna,以及靶向另一种基因的第二shrna。在具体的实施方案中,所述细胞表达car、b2mshrna和/或iishrna,以及另一种靶向编码细胞中抑制性受体的基因(例如,pd1、lag3、tim3、tigit、tgfbr1、il-10r等)的shrna。
在具体的实施方案中,所述细胞包含诱导型自杀基因(例如caspase-9或胸苷激酶)。
在另一个方面,提供了用于免疫疗法的肿瘤特异性和allo-nk细胞抗性的nkt细胞的一次成功产生的载体。用于操作本公开的细胞的载体可以是任何种类,包括病毒载体或非病毒载体。非病毒载体包括质粒,病毒载体包括慢病毒载体、逆转录病毒载体、腺病毒载体、腺相关病毒载体、单纯疱疹病毒等。这种载体编码如上定义的一种或多种工程化受体以及降低b2m和/或ii表达的试剂。此类试剂可选自由shrna、crispr系统(例如crispr向导rna)、吗啉代、sirna、反义rna、antigomerrna、s-dna、zfns和talens组成的组。
特定的实施方案包括同时编码nkt中的car和shrna的病毒构建体(例如逆转录病毒或慢病毒)。
经修饰以下调b2m和/或ii的同种异体细胞可商购获得。同种异体细胞可以从供体获得并立即加工以具有b2m和/或ii的下调,或者同种异体细胞可以从储存库获得,包括以新鲜或冷冻状态。
iii.产生细胞的方法
在特定的实施方案中,存在产生本公开所涵盖的细胞的方法,包括b2m、ii或二者的下调的细胞。此类细胞还可以表达一种或多种类型的工程化受体。
在一些情况下,产生所述细胞的方法包括获得待操作的细胞的步骤,尽管在其他情况下,获得步骤不包括在该方法中。供体细胞可以从健康受试者获得,包括例如没有癌症的受试者。在重组操作以下调b2m和/或ii之前,细胞可以扩增或不扩增。在一些方法中,可以选择细胞以表达或缺乏表达标志物,例如,这样的选择可以增强细胞的扩增。例如,产生所述细胞的方法的一部分可包括选择表达cd62l、表达cd4和/或降低表达或不表达pd1的步骤。
可以使用任何一种或多种试剂以下调b2m、ii或二者的表达进行细胞生产。此类试剂可以是任何种类,但在具体实施方案中,试剂是shrna、crispr系统(例如crispr向导rna)、吗啉代、sirna、反义rna、antigomerrna、s-dna、talens、zfns等。用于设计靶向b2m的核酸的b2m多核苷酸序列的一个实例是
在特定的实施方案中,操作本公开的细胞以表达除下调b2m和/或ii的试剂之外的实体,并且该实体可以是工程化受体(特别是如上定义的)、细胞因子或另一种基因产物。在具体的实施方案中,该实体是嵌合抗原受体(car)。在一些情况下,使细胞下调b2m和/或ii的步骤是使细胞能够表达另一个实体的伴随步骤,尽管在替代情况下这些是不同的步骤。在具体的实施方案中,当同时改造细胞以下调b2m和/或ii并表达car(例如)时,这是因为下调b2m和/或ii的试剂和car在同一载体上表达。然而,在其他情况下,下调b2m和/或ii的试剂和car由不同的载体表达。
本公开的方法可以包括或不包括产生待引入供体细胞(或其扩增后代)的载体的步骤。重组载体的产生在本领域中是公知的,并且可以使用多种载体,包括病毒载体或非病毒载体。在单个载体包含下调b2m和/或ii的试剂和工程化受体如car(例如)的情况下,本领域技术人员认识到,载体的设计将考虑细胞的尺寸限制(例如)。
在待操作的细胞是t细胞的情况下,细胞的内源性t细胞受体可以被下调或敲除,例如使用本领域的常规方法。
iv.使用细胞的方法
本公开的实施方案包括本公开所涵盖的一种或多种细胞,其用于治疗受试者的医学病症,例如癌症或恶化前病症。所述细胞可用于任何类型的癌症,包括神经母细胞瘤、乳腺癌、宫颈癌、卵巢癌、子宫内膜癌、黑素瘤、膀胱癌、肺癌、胰腺癌、结肠癌、前列腺癌、淋巴谱系的造血系统肿瘤、白血病、急性淋巴细胞白血病、慢性淋巴细胞白血病、b细胞淋巴瘤、伯基特淋巴瘤、多发性骨髓瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、骨髓性白血病、急性髓性白血病(aml)、慢性髓性白血病、甲状腺癌、甲状腺滤泡癌、间充质起源肿瘤、纤维肉瘤、横纹肌肉瘤、黑色素瘤、葡萄膜黑色素瘤、畸胎癌、神经母细胞瘤、胶质瘤、胶质母细胞瘤、皮肤良性肿瘤、肾癌、间变性大细胞淋巴瘤、食管鳞状细胞癌、肝细胞癌、滤泡树突状细胞癌、肠癌、肌肉浸润癌、精囊肿瘤、表皮癌、脾癌、膀胱癌、头颈癌、胃癌、肝癌、骨癌、脑癌、视网膜癌、胆管癌、小肠癌、唾液腺癌、子宫癌、睾丸癌、结缔组织癌、前列腺肥大、脊髓发育不良、瓦尔登斯特伦巨球蛋白血症、鼻咽癌、神经内分泌癌骨髓增生异常综合征、间皮瘤、血管肉瘤、卡波西肉瘤、类癌、食管胃、输卵管癌、腹膜癌、乳头状浆液性苗勒氏癌、恶性腹水、胃肠道间质瘤(gist)或选自li-fraumeni综合征和vonhippel-lindau综合征(vhl)的遗传性癌症综合征。在具体的实施方案中,所述恶化前病症是骨髓增生异常综合征(mds)。
在本公开的特定的实施方案中,存在用本公开所涵盖的细胞治疗疾病的方法。尽管所述疾病可以是任何种类,但在具体的实施方案中,所述疾病是癌症。可以治疗任何类型的癌症,包括神经母细胞瘤、乳腺癌、宫颈癌、卵巢癌、子宫内膜癌、黑色素瘤、膀胱癌、肺癌、胰腺癌、结肠癌、前列腺癌、淋巴谱系造血系统肿瘤、白血病、急性淋巴细胞白血病、慢性淋巴细胞白血病、b细胞淋巴瘤、伯基特淋巴瘤、多发性骨髓瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、骨髓性白血病、急性髓性白血病(aml),慢性髓性白血病、甲状腺癌、甲状腺滤泡癌、骨髓增生异常综合征(mds)、间充质起源肿瘤、纤维肉瘤、横纹肌肉瘤、黑色素瘤、葡萄膜黑色素瘤、畸胎瘤、神经母细胞瘤、胶质瘤、胶质母细胞瘤、皮肤良性肿瘤、肾癌、间变性大细胞淋巴瘤、食管鳞状细胞癌、肝细胞癌、滤泡树突状细胞癌、肠癌、肌肉浸润性癌、精液囊泡肿瘤、表皮癌、脾癌、膀胱癌、头颈癌、胃癌、肝癌、骨癌、脑癌、视网膜癌、胆管癌、小肠癌、唾液腺癌、子宫癌、睾丸癌、结缔组织癌、前列腺肥大、脊髓发育不良、瓦尔登斯特伦巨球蛋白血症、鼻咽癌、神经内分泌癌骨髓增生异常综合征、间皮瘤、血管肉瘤、卡波西氏肉瘤、类癌、食管胃、输卵管癌、腹膜癌、乳头状浆液性毛细血管癌、恶性腹水、胃肠道间质瘤(gist)或选自li-fraumeni综合征和vonhippel-lindau综合征(vhl)的遗传性癌症综合征。在具体的实施方案中,所述疾病是骨髓增生异常综合征(mds)。
将有效量的具有b2m、ii或二者表达降低的本公开的细胞提供给需要用该细胞治疗的受试者。所述量可以是任何量,只要该疾病的至少一种症状得到改善即可。在具体的实施方案中,所述细胞的提供范围为至少约1×106到约1×109个细胞,更优选约1×107到约1×109个细胞,尽管可以使用任何合适的量,要么更高,例如,大于1×109个细胞,或者更低,例如,小于1×107个细胞。在具体的实施方案中,向受试者提供一个或多个剂量的细胞,随后的剂量可以数分钟、数小时、数天、数周、数月或数年的顺序分开。在一些情况下,细胞的单独递送具有不同量的细胞。例如,细胞的初始剂量可以高于或低于一个或多个后续剂量。
被治疗的个体可以是成人、青少年、儿童、婴儿或动物。所述个体可以是哺乳动物,包括人、狗、猫、马、牛、羊、猪等。所述个体可以是任何性别、种族、遗传背景等。所述个体可能有也可能没有癌症的个人和/或家族史。待操作下调b2m和/或ii表达的细胞可以或可以不从家庭成员获得。在所述个体患有癌症的情况下,癌症可以是任何阶段或等级,并且癌症可以是原发性、转移性、复发性、敏感性、难治性等。
在一些情况下,除了本公开的免疫疗法之外,可以向受试者提供一种或多种疗法,例如手术、放射、激素疗法,另一种,非同一性免疫疗法、化学疗法或其组合。
在一些情况下,所述细胞用于预防受试者的癌症,包括例如具有个人和/或家族癌症史的受试者。
可以以任何合适的方式将细胞递送至受试者,包括例如通过注射。尤其设想通过输注或注射将细胞施用于受试者。合适组合物的给药可以通过不同方式进行,例如通过静脉内、皮下、腹膜内、肌肉内、,局部、肠胃外、透皮、腔内、动脉内、鞘内或皮内给药。可以通过直接注射到恶性肿瘤中来提供细胞。细胞的施用可以是全身性的或局部的。
所述细胞可以或可以不靶向与癌症相关的缺氧环境。在这种情况下,作用于从细胞中的表达构建体的表达的任何调节元件在低氧环境中可能是有效的。
在一些实施方案中,提供了包含本文所述的同种异体nkt的组合物,用于治疗个体的医学病症,例如癌症或恶化前病症。这种组合物是即用型产品,无论hla是否匹配,都可以施用给任何个体。就立即可用性、安全性和治疗潜力而言,这种组合物对于患者具有显著优势。除了本文所述的细胞,所述组合物可包含但不限于悬浮剂、抗氧化剂、缓冲剂、抑菌剂和溶质。
v.试剂盒
任何本文所述的细胞组合物和/或生产和/或使用细胞组合物的试剂可包含在试剂盒中。在非限制性实例中,细胞或操作细胞的试剂可包含在试剂盒中。在某些实施方案中,具有b2m和/或ii表达降低的细胞或包含具有b2m和/或ii表达降低的nkt细胞的细胞群可包含在试剂盒中。这种试剂盒可以具有或不具有一种或多种用于操作细胞的试剂。这种试剂包括例如小分子、蛋白质、核酸、抗体、缓冲液、引物、核苷酸、盐和/或其组合。核酸(dna或rna)或能够直接或间接降低b2m和/或ii表达的其他试剂可以包括在试剂盒中,例如shrna或crispr向导rna。编码一种或多种细胞因子的核酸或细胞因子本身可包括在试剂盒中。试剂盒中可包括蛋白质,例如细胞因子或抗体,包括激动性单克隆抗体。试剂盒中可包括包含抗体的底物或裸底物本身。包含抗原呈递细胞活性的细胞或产生其的试剂可包括在试剂盒中。编码工程化受体(例如嵌合抗原受体或嵌合细胞因子受体或工程化t细胞受体)的核苷酸可包括在试剂盒中,包括一种或多种产生它的试剂。
在特定方面,所述试剂盒包含本公开的细胞治疗以及针对特定医学病症(例如癌症治疗)的另一种治疗。在一些情况下,除了细胞治疗实施方案之外,该试剂盒还包括第二癌症治疗,例如化疗、激素治疗和/或免疫治疗。所述试剂盒可针对受试者的特定癌症定制,并包含针对受试者的相应第二癌症治疗。
所述试剂盒可包含适当的等分的本公开的组合物。试剂盒的组分可以以水性介质或冻干形式包装。试剂盒的容器装置通常包括至少一个小瓶、试管、烧瓶、瓶子、注射器或其他容器装置,组分可以放置于其中并且优选适当地等分。在试剂盒中存在多于一种组分的情况下,试剂盒通常还可以包含第二、第三或其他额外的容器,额外的组分可以单独放置于其中。然而,组分的各种组合可包含在一个小瓶中。本公开的试剂盒通常还会包括用于容纳商业销售上有密闭限制的组合物和任何其他试剂容器的装置。这种容器可包括注射或吹塑塑料容器,所需的小瓶保留在其中。
具体实施方式
包括以下实施例以说明本发明的优选实施方案。本领域技术人员应该理解,以下实施例中公开的技术代表发明人发现的在本发明实践中作用良好的技术,因此可以认为是构成其实践的优选模式。然而,根据本公开,本领域技术人员应当理解,在不脱离本发明的精神和范围的情况下,可以在所公开的具体实施方案中进行许多改变并仍然获得相似或类似的结果。
实施例1
从健康供体中产生肿瘤特异性和普遍耐受性nkt细胞用于即用型癌症免疫治疗
筛选健康供体以选择具有高功能性nkt的候选物。
由于人pbmc中的nkt细胞频率从小于0.01%至大于1%不等,我们首先根据我们的irb批准方案分析从预期健康供体分离的pbmc中的nkt细胞频率。接下来,我们使用我们实验室开发的方案在培养基中扩增nkt12天,并定量其扩增速率和与功能潜力相关的关键表面标志物的表达:cd62l、cd4和pd1。我们表征了12名健康供体。至少3个供体(#6、7、8)具有非常高的nkt细胞扩增潜力,具有良好的cd62l保留和低pd1表达(表1)。
测试同种异体反应性nkt细胞。
由于nkt受单型cd1d限制,因此预期它们不会对同种异体细胞起反应。为了检验这一假设,我们使用经辐射的pbmc作为刺激细胞和来自无关供体的nkt作为应答细胞进行单向allo-mlr培养。自体同源pbmc用作阴性对照,用nkt细胞配体agalcer脉冲的自体同源pbmc用作阳性对照。通过评估cfse稀释来分析应答细胞的增殖。从血沉棕黄层中新鲜分离nkt细胞,洗涤两次,以1×107细胞/ml重悬于pbs中,并与2.5μm羧基荧光素琥珀酰亚胺酯(cfse;celltracetmcfse细胞增殖试剂盒,thermofisherscientific)一起孵育5分钟。将标记的细胞旋转,以106细胞/ml重悬于培养基中,并在经辐射的pbmc存在下培养。通过使用流式细胞术测量cfse稀释度在第6天检查细胞增殖。图1显示nkt仅可响应其特异性配体agalcer而增殖,但不能响应来自3个不匹配供体的自体同源或同种异体pbmc。这些结果表明nkt细胞不是同种异体反应性的。
靶向nkt中的b2m表达。
为了在nkt中实现完整的b2m基因敲除,我们使用crispr/cas9技术(25)。用crispr扫描算法(http://www.crisprscan.org)鉴定b2m的单一向导(sg)rna序列。将sgrna(10μg)与cas9蛋白10μg(pnabio)在室温下孵育10-15分钟,并电穿孔到3×106个nkt细胞中。使用neon转染系统(thermofisherscientific),nkt细胞的优化电穿孔条件是1600v、10ms和3个脉冲。该实验的sgrna序列是ggccacggagcgagacatct(seqidno:1)。图2a显示88%的nkt细胞中b2m表达丧失。为了进一步富集b2m阴性细胞,我们通过使用apc偶联的抗b2mmab和抗apc磁珠(microbeads)通过macs分选耗尽b2m阳性细胞来进行阴性选择。获得的阴性部分含有>95%的b2m-和hlai类(abc)-阴性nkt细胞(图2b)。
接下来,我们测试了实现不同水平的b2m基因下调(敲低)的五种靶向b2m的短发夹(sh)rna构建体。使用来自sigma
测试了以下5种shrna序列:
1.gtaccggaggtttgaagatgccgcatttctcgagaaatgcggcatcttcaaacctttttttg(seqidno:2);
2.ccggctggtctttctatctcttgtactcgagtacaagagatagaaagaccagtttttg(seqidno:3);
3.ccggcagcagagaatggaaagtcaactcgagttgactttccattctctgctgtttttg(seqidno:4);
4.cggtccgacattgaagttgacttactcgagtaagtcaacttcaatgtcggatttttg(seqidno:5);和
5.ccggcccaagatagttaagtgggatctcgagatcccacttaactatcttgggtttttg(seqidno:6)。
通过与包装载体共转染hek-293t细胞来制备病毒上清液。用8μg/ml溴化己二甲铵(polybrene,h9268,sigma-aldrich,圣路易,密苏里州,美国)将这些shrna病毒颗粒转导入nkt细胞。通过facs确认b2m敲低。我们能够用测试的最有效的构建体(seqidno:2)将b2m敲低至60%至90%的不同程度,如图2c中所示。该shrna靶向人b2m编码序列中的外显子-2。
靶向nkt中的ii表达。
虽然已知t细胞在激活后上调hlaii类表达,但就我们所知,尚未检查人nkt中hlaii类表达的状态。为回答这个问题,我们对静息nkt细胞上的hlaii类表达进行了流式细胞术分析,然后在用α-半乳糖神经酰胺激活后2天检查。图3a表明,与t细胞相似,nkt在没有刺激的情况下不表达hlaii类并且在抗原刺激后容易上调这些分子的表面表达。接下来,我们显示了使用ii特异性shrna可以有效地下调活化的nkt中的hlaii类表达(图3b)。
我们测试了五种实现不同水平的ii基因下调(敲低)的靶向ii的短发夹(sh)rna构建体。使用来自sigma
测试了以下5个iishrna序列,作为实例:
1.ccgggaccatagactggaaggtcttctcgagaagaccttccagtctatggtcttttt(seqidno:7);
2.ccggccaccaagtatggcaacatgactcgagtcatgttgccatacttggtggttttt(seqidno:8);
3.ccggcgcgaccttatctccaacaatctcgagattgttggagataaggtcgcgttttt(seqidno:9);
4.ccggccacacagctacagctttcttctcgagaagaaagctgtagctgtgtggttttt(seqidno:10);和
5.ccgggagaacctgagacaccttaagctcgagcttaaggtgtctcaggttctcttttttg(seqidno:11)。
通过与包装载体共转染hek-293t细胞来制备病毒上清液。用8μg/ml溴化己二甲铵(polybrene,h9268,sigma-aldrich,圣路易,密苏里州,美国)将这些shrna病毒颗粒转导入nkt细胞。通过facs确认ii敲低。我们能够使用测试的最有效构建体(seqidno:7)将ii敲低至51.2%至75.6%的不同程度。该shrna靶向人ii编码序列中的cds。
测试b2mnullnkt,b2mlownkt和iilownkt的同种异体性。
为了确定nkt中crispr介导的b2m敲除和shrna介导的b2m敲低对其刺激同种异体反应性的反应能力的影响,我们使用经辐射的nkt作为刺激细胞并以由无关供体进行磁分选的cd8和cd4t细胞作为应答细胞,进行单向allo-mlr测定。将不存在同种异体nkt的t细胞用作阴性对照。具有野生型(wt)b2m的同种异体nkt用作阳性对照。在实验条件下,wtnkt被crispr诱导的b2mnu11nkt或shrna(seqidno:2)诱导的b2mlownkt替换为刺激细胞。我们还使用ii-shrna(seqidno:7)产生iilownkt。通过在培养的第5天通过流式细胞术评估cfse稀释来分析应答细胞的增殖。我们还对细胞的cd8和cd4标志物进行染色以定量相应t细胞亚群的增殖。图4a和4b表明,与wtb2m相比,b2mnu11nkt将cd8t细胞增殖从74.1%降低至38.5%(p<0.01)。如所预期的,b2m和hlai类表达不显著影响受hlaii类分子限制的cd4t细胞的增殖。相应地,iilownkt使cd4t细胞增殖从68.1%降低至31.6%(p<0.01),但不影响cd8t细胞的增殖。
令人惊讶的是,nkt中shrna介导的b2m/hla-abc表达的减少实现了对同种异体反应性cd8t细胞应答的同等有效抑制,如通过crispr介导的b2m/hla-abc表达完全丧失所实现的那样。这些结果首次表明nkt中存在可被同种异体t细胞耐受的b2m/hla-abc表达范围。该认识具有直接的实际意义,因为它证明使用更安全的shrna技术代替crispr或其他基因组编辑方法进行nkt和其他来自无关供体的用于过继细胞治疗应用的效应细胞中的b2m的分级下调。
测试b2mnull和b2mlow对allo-nk细胞的敏感性。
hlai类分子充当nk细胞的主要抑制配体,并且预期b2m表达的缺失使供体细胞易受宿主nk细胞的杀伤(24)。然而,不知道是否可以在供体细胞特别是在nkt细胞中达到一定水平的b2m/hlai类,足以阻止宿主cd8t细胞的活化而不引发宿主nk细胞的细胞毒性。因此,我们测试了b2mnu11nkt和b2mlownkt对同种异体nk细胞杀伤的敏感性,使用野生型(wt)nkt细胞作为阴性对照和天然缺乏抑制性hlai类配体的nk敏感的k562细胞作为阳性对照。用活力染料钙黄绿素-am标记靶细胞nkt或k562细胞,然后与来自无关供体的负磁分选获得的作为效应细胞的同种异体nk细胞共培养4小时。自体同源nk细胞用作阴性对照。通过流式细胞术测量靶细胞中钙黄绿素-am荧光的丧失来定量nk细胞的细胞毒活性。图5表明,与k562细胞不同,即使在完全丧失b2m表达后,nkt仍然对nk细胞的细胞毒性具有很大的抵抗力。实际上,只有21.3%的b2mnu11nkt被allo-nk细胞以10:1的效应物与靶标比率杀死,而在相同条件下近100%的k562细胞被杀死。b2mlownkt比b2mnu11细胞更具抗性,因为只有18.8%的前者被allo-nk细胞以10:1效应物与靶标比率杀死。因此,与预期相反,结果首次证明,即使在完全遗传丧失b2m表达后,约80%的nkt仍然对allo-nk细胞的细胞毒性具有抗性。此外,与crispr介导的b2m敲除相比,shrna介导的nkt中b2m表达下调使其对allo-nk细胞的细胞毒性更具抗性。
设计编码car构建体和b2mshrna和/或iishrna的逆转录病毒载体
为了测试car和shrna是否可以在同一逆转录病毒载体内有效表达,我们构建了编码gd2特异性car和b2mshrna(seqidno:2)和/或iishrna(seqidno:7)的逆转录病毒载体,如图6a所示。为了将shrna克隆到逆转录病毒载体中,我们在正义shrna序列之前添加一个g作为转录起始位点,并且在反义shrna序列之后添加五个t作为转录终止位点。得到的shrna序列如下:
ctggtctttctatctcttgtactcgagtacaagagatagaaagaccag(seqidno:12)
gaccatagactggaaggtcttctcgagaagaccttccagtctatggtc(seqidno:13)
将b2mshrna置于u6启动子的控制下,并将u6-shrna以正向或反向方向连接到sphi位点,同时通过内源性逆转录病毒ltr或ef1启动子驱动car表达(图6a)。用car.gd2/b2mshrna转导nkt细胞产生有效的car表达。所有4种构建体成功在nkt中同时表达car和b2m下调,其中构建体#1是最有效的(图6b)。
本公开的某些实施方案的重要性
1)可以分离nkt细胞并从健康供体中离体扩增至大量,同时保留高功能细胞的表型。这些供体来源的nkt可用作过继性癌症免疫疗法的治疗产品的来源。
2)nkt细胞不响应来自无关供体的pbmc而增殖,与nkttcr无法识别hla分子一致。
3)用crispr和shrna靶向b2m在减少cd8t细胞对nkt细胞的刺激方面同样有效。
4)用shrna靶向ii有效减少cd4t细胞对nkt细胞的刺激。
5)在crispr介导的b2m敲除后,大多数nkt仍然对allo-nk细胞的细胞毒性具有抗性,并且在shrna介导的b2m敲低后甚至更是如此。
6)在单个逆转录病毒载体中实现了car和b2mshrna和/或iishrna在nkt中的有效表达,提供了产生用于癌症免疫治疗的car-重定向的和普遍耐受的同种异体nkt细胞产品的手段。
实施例2
从健康供体产生除nkt细胞以外的肿瘤特异性和普遍耐受性细胞用于即用型癌症免疫疗法
在某些实施方案中,操作除nkt细胞之外的细胞以具有降低的内源性b2m和/或ii的表达。此类细胞可以是nkt细胞以外的任何免疫细胞,如t细胞、γ/δt细胞、粘膜相关不变t(mait)细胞、nk细胞、先天性淋巴细胞(ilc)或其混合物。在一些实施方案中,nkt细胞和除nkt细胞之外的一种或多种免疫细胞的混合物用于本公开所涵盖的组合物和方法。
可以通过本领域的标准方法操作非nkt细胞以具有降低的内源性b2m和/或ii表达,例如使用一种或多种试剂靶向b2m基因的表达,包括核酸,如shrna或crispr向导rna。其他方法至少包括吗啉代、sirna、s-dna、talens、zfns等。
在特定的实施方案中,在操作细胞之前和/或之后扩增本公开的组合物和方法中使用的非nkt细胞,以具有降低的内源性b2m和/或ii表达。本领域的用于扩增的常规方法是已知的,并且可包括特定培养基和一种或多种特定试剂,例如一种或多种细胞因子。
在特定的实施方案中,用于本公开的组合物或方法的一种或多种类型的非nkt细胞可能需要除有效使用nkt细胞所需的操作以外的操作。例如,可以修饰t细胞以防止受体组织因排斥的损伤。在特定情况下,操作t细胞以缺失t细胞受体的元件。
实施例3
通过靶向mhcii类相关恒定链(ii)从健康供体中产生肿瘤特异性和耐受性nkt和其他细胞用于即用型癌症免疫治疗
在一些实施方案中,替代(或除此之外)用于降低b2m表达的细胞和使用其的方法和/或细胞具有降低的mhcii类相关恒定链(ii)的表达。这些细胞可以用来代替具有降低的内源性b2m表达的细胞。在一些情况下,同一细胞具有降低的b2m和ii的表达,并且在一些情况下,使用分别具有降低的内源性b2m表达或降低的内源性ii表达的细胞的混合物。在同一细胞具有降低的内源性b2m和内源性ii表达的情况下,可以使用相同类型的试剂来靶向它们各自的表达降低。例如,在某些情况下,b2m和ii都被shrna靶向以降低其表达,或者在其他情况下,b2m和ii都被crispr向导rna靶向以降低其表达。在一些情况下,不同的试剂靶向b2m和ii,例如用shrna靶向b2m和用crispr向导rna靶向ii。
在特定实施方案中,包含ii表达降低的细胞还可以包含对细胞而言非天然的另一个实体的表达,例如细胞因子或car。这些另外的实体可以由或不由与靶向ii表达的试剂相同的构建体表达。在同一细胞既靶向ii表达又提供另一个实体用于在细胞中表达的情况下,它们可以以任何合适的排列配置在相同的构建体中,例如相对于另一个是5'或3';它们可以由或不由相同的调控元件所调节。
细胞可以是nkt或可以不是nkt细胞,例如t细胞、γ/δt细胞、mait细胞、nk细胞、ilc或其混合物,并且可以将t细胞工程化以缺乏tcr。
实施例4
通过靶向mhcii类相关恒定链(ii)或b2m产生表达嵌合抗原受体的肿瘤特异性和耐受性nkt用于即用型癌症免疫治疗
产生cd19car构建体,表达cd28或41bb共刺激结构域,具有或不具有il15(图6)。该构建体基于两个域架构产生:(1)第一组(39和84构建体),编码igg4铰链、igg1ch3间隔区、cd28tm和cd28或4-1bb共刺激结构域,全部具有或不具有il15;(2)第二组(28和41构建体),编码cd8α铰链和tm,具有cd28或4-1bb共刺激结构域,全部具有或不具有il15(图6a)。在这种构建体中可以使用替代的或另外的共刺激结构域。相应的流式细胞术分析显示在图6b中。cd19car构建体实例示于图7。
如图8所示,对nsg小鼠进行连续成像,其静脉内注射2x105ffluc+daudi淋巴瘤细胞,然后静脉注射用所述构建体转导的或无构建体转导(未转导的,nt)的5x106nkt。就在成像之前,小鼠腹膜内注射100μl的30mg/ml的荧光素;将它们在生物发光通道下成像5分钟。作为一个例子,3到25周的过程中成像。图9显示了小鼠的存活曲线。
图10说明了具有或不具有b2m和iishrna的表达cd19car的逆转录病毒载体的实例。对于那些包含shrna的构建体,将b2m和iishrna序列与单个u6启动子连接,并在相反的转录方向上单独或一起连接至28.15car下游。
图11显示了相应构建体的b2m和ii表达的shrna敲低。在图11a中,在转导nkt并用alexa647-偶联的抗-fmc63mab染色后提供cd19car表达的代表性流式细胞术分析。提供了用所示构建体转导的nkt细胞中(11b)b2m,(11c)hlaabc,(11d)ii和(11e)hladp-dq-dr表达的代表性流式细胞术分析。细胞用抗fmc63mab和1)pe偶联的抗b2m抗体与fitc偶联的抗hlaabc抗体,或2)pe偶联的抗ii抗体与fitc偶联的抗hladp-dq-dr抗体染色。图11f显示了car-shrnankt与carnkt中所示基因敲低的定量。
图12表明b2μ/iishrna不影响carutnkt细胞的car导向的体外细胞毒性。用指定的cd19car-shrna构建体转导或未转导的(nt)nkt与荧光素酶阳性daudi(cd19-阳性)靶细胞以特定的效应物-靶标比例共培养。在共培养后,nkt细胞毒性作为靶细胞生物发光的函数确定。
在图13中测定了对carutnkt细胞的同种异体反应性水平,在该情况下,不匹配的cd8+和cd4+t细胞在同种异体混合淋巴细胞反应(mlr)测定中显示出对carutnkt细胞的同种异体反应性减弱。在图13a中,显示了同种异体mlr测定中t细胞的预期结果的示意图。在特定实施方案中,同种异体cd8+或cd4+t细胞分别在亲本nkt上的mhci类和mhcii类的识别将导致t细胞增殖。此外,utnkt中通过b2m敲低下调mhci类或通过ii敲低来下调mhcii类将导致同种异体t细胞增殖的相对减少。cfse标记的cd8+(图13b)或cd4+t细胞(图13c)与表达指定构建体的carutnkt细胞共培养,如通过cfse稀释测量的,在刺激后5天评估t细胞的增殖。
与亲本nkt相比,utnkt细胞对同种异体t细胞的细胞毒性较不敏感。图14a提供了t细胞细胞毒性测定中nkt和utnkt细胞的预测结果的示意图。同种异体t细胞将亲本nkt上的mhc分子识别为外来的,导致这些nkt细胞死亡。在utnkt中下调mhc分子将使这些细胞比亲本nkt更好地逃避t细胞的细胞毒性。在图14b中,在同种异体t细胞与carutnkt或未转导(nt)nkt以1:1的比例孵育4天后,通过流式细胞术测定nkt细胞计数。
如图15所示,utnkt细胞最低限度地受nk细胞的细胞毒性影响。图15a说明了nk细胞细胞毒性测定的预测结果。如所示的,nk细胞不杀死表达mhci类的亲本nkt,但通常杀死缺乏mhci的靶细胞。在特定实施方案中,utnkt表达足够的mhci以逃避nk细胞的杀伤。图15b显示了在来自健康供体的nkt细胞与钙黄绿素am标记的utnkt以5:1的比例的共培养后,靶细胞裂解。
注射car.cd19utnkt的小鼠中ffluc标记的daudi淋巴瘤细胞的连续生物发光成像示于图16中。对nsg小鼠静脉注射2x105ffluc+daudi淋巴瘤细胞,然后静脉注射5x106用指定构建体转导或无构建体(未转导的,nt)的car.cd19utnkt。图17提供了小鼠相应的存活曲线。
参考文献
本说明书中提及的所有专利和出版物表示本发明所属领域的技术人员的水平。本文中的所有专利和出版物通过引用并入,其程度如同每个单独的出版物被具体和单独地指出而通过引用整体并入。
1.atkinsmb,etal.high-doserecombinantinterleukin2therapyforpatientswithmetastaticmelanoma:analysisof270patientstreatedbetween1985and1993.jclinoncol1999;17(7):2105-2116.
2.porterdl,levinebl,kalosm,bagga,junech.chimericantigenreceptor-modifiedtcellsinchroniclymphoidleukemia.n.engl.j.med.2011;365(8):725-733.
3.gruppsa,etal.chimericantigenreceptor-modifiedtcellsforacutelymphoidleukemia.n.engl.j.med.2013;368(16):1509-1518.
4.brentjensrj,etal.cd19-targetedtcellsrapidlyinducemolecularremissionsinadultswithchemotherapy-refractoryacutelymphoblasticleukemia.
sci.transl.med.2013;5(177):177ral38.
5.kochenderferjn,etal.b-celldepletionandremissionsofmalignancyalongwithcytokine-associatedtoxicityinaclinicaltrialofanti-cd19chimeric-antigen-receptor-transducedtcells.blood2012;119(12):2709-2720.
6.ramosca,heslophe,brennermk.car-tcelltherapyforlymphoma.annu.rev.med.2015.
7.turtlecj,maloneydg.clinicaltrialsofcd19-targetedcar-modifiedtcelltherapy;acomplexandvariedlandscape.expertrevhematol2016;9(8):719-721.
8.singhn,perazzellij,gruppsa,barrettdm.earlymemoryphenotypesdrivetcellproliferationinpatientswithpediatricmalignancies.scitranslmed2016;8(320):320ra323.
9.dudleyme,etal.cancerregressionandautoimmunityinpatientsafterclonalrepopulationwithantitumorlymphocytes.science2002;298(5594):850-854.
10.tahirsm,etal.lossofifn-gammaproductionbyinvariantnktcellsinadvancedcancer.j.immunol.2001;167(7):4046-4050.
11.yanagisawak,exleyma,jiangx,ohkochin,taniguchim,seinok.hyporesponsivenesstonaturalkillert-cellligandalpha-galactosylceramideincancer-bearingstatemediatedbycdllb+gr-1+cellsproducingnitricoxide.cancerres.2006;66(23):11441-11446.
12.dhodapkarmv,etal.areversibledefectinnaturalkillertcellfunctioncharacterizestheprogressionofpremalignanttomalignantmultiplemyeloma.
j.exp.med.2003.
13.qasimw,etal.molecularremissionofinfantb-allafterinfusionofuniversaltalengene-editedcartcells.scitranslmed2017;9(374).
14.porcellis,yockeyce,brennermb,balksp.analysisoftcellantigenreceptor(tcr)expressionbyhumanperipheralbloodcd4-8-alpha/betatcellsdemonstratespreferentialuseofseveralvbetagenesandaninvarianttcralphachain.j.exp.med.
1993;178(1):1-16.
15.lantzo,bendelaca.aninvarianttcellreceptoralphachainisusedbyauniquesubsetofmajorhistocompatibilitycomplexclassi-specificcd4+andcd4-8-tcellsinmiceandhumans.j.exp.med.1994;180(3):1097-1106.
16.bendelaca,lantzo,quimbyme,yewdelljw,benninkjr,
brutkiewiczrr.cd1recognitionbymousenk1+tlymphocytes.science
1995;268(5212):863-865.
17.kimey,lynchl,brennanpj,cohennr,brennermb.thetranscriptionalprogramsofinktcells.semin.immunol.2015;27(l):26-32.
18.metelitsals.anti-tumorpotentialoftype-inktcellsagainstcdld-positiveandcdld-negativetumorsinhumans.clin.immunol.2011;140(2):119-129.
19.heczeya,etal.invariantnktcellswithchimericantigenreceptorprovideanovelplatformforsafeandeffectivecancerimmunotherapy.blood2014;124(18):2824-2833.
20.tiang,etal.cd62l+nktcellshaveprolongedpersistenceandantitumoractivityinvivo.jclininvest2016;126(6):2341-2355.
21.pillaiab,georgeti,dutts,teop,strobers.hostnktcellscanpreventgraft-versus-hostdiseaseandpermitgraftantitumoractivityafterbonemarrowtransplantation.j.immunol.2007;178(10):6242-6251.
22.morrises,etal.nktcell-dependentleukemiaeradicationfollowingstemcellmobilizationwithpotentg-csfanalogs.j.clin.invest2005;15(11):3093-3103.
23.krangelms,orrht,stromingerjl.assemblyandmaturationofhla-aandhla-bantigensinvivo.cell1979;18(4):979-991.
24.lanierll.nkcellrecognition.annurevimmunol2005;23:225-274.
25.gundrymc,etal.highlyefficientgenomeeditingofmurineandhumanhematopoieticprogenitorcellsbycrispr/cas9.cellrep2016;17(5):1453-1461.
尽管已经详细描述了本发明及其优点,但应该理解,在不脱离由所附权利要求限定的本发明的精神和范围的情况下,可以进行各种改变、替换和变更。此外,本申请的范围不旨在限于说明书中描述的工艺、设备、制造、物质组成、装置、方法和步骤的特定实施方案。由于本领域普通技术人员从本发明的公开将容易理解,目前存在或稍后开发的与本文描述的相应实施方案那样执行基本相同功能或达到基本相同的结果的工艺、设备、制造、物质组成、装置、方法或步骤,可以根据本发明进行利用。因此,所附权利要求旨在在其范围内包括这样的工艺、设备、制造、物质组成、装置、方法或步骤。
序列表
<110>贝勒医学院
<120>cd1d限制性nkt细胞作为即用型癌症免疫治疗的平台
<130>baym.p0236wo
<140>
<141>
<150>ep17185992.9
<151>2017-08-11
<160>13
<170>patentinversion3.5
<210>1
<211>20
<212>dna
<213>人工序列
<220>
<223>人工序列的描述:合成的寡核苷酸
<400>1
ggccacggagcgagacatct20
<210>2
<211>62
<212>dna
<213>人工序列
<220>
<223>人工序列的描述:合成的寡核苷酸
<400>2
gtaccggaggtttgaagatgccgcatttctcgagaaatgcggcatcttcaaacctttttt60
tg62
<210>3
<211>58
<212>dna
<213>人工序列
<220>
<223>人工序列的描述:合成的寡核苷酸
<400>3
ccggctggtctttctatctcttgtactcgagtacaagagatagaaagaccagtttttg58
<210>4
<211>58
<212>dna
<213>人工序列
<220>
<223>人工序列的描述:合成的寡核苷酸
<400>4
ccggcagcagagaatggaaagtcaactcgagttgactttccattctctgctgtttttg58
<210>5
<211>57
<212>dna
<213>人工序列
<220>
<223>人工序列的描述:合成的寡核苷酸
<400>5
cggtccgacattgaagttgacttactcgagtaagtcaacttcaatgtcggatttttg57
<210>6
<211>58
<212>dna
<213>人工序列
<220>
<223>人工序列的描述:合成的寡核苷酸
<400>6
ccggcccaagatagttaagtgggatctcgagatcccacttaactatcttgggtttttg58
<210>7
<211>57
<212>dna
<213>人工序列
<220>
<223>人工序列的描述:合成的寡核苷酸
<400>7
ccgggaccatagactggaaggtcttctcgagaagaccttccagtctatggtcttttt57
<210>8
<211>57
<212>dna
<213>人工序列
<220>
<223>人工序列的描述:合成的寡核苷酸
<400>8
ccggccaccaagtatggcaacatgactcgagtcatgttgccatacttggtggttttt57
<210>9
<211>57
<212>dna
<213>人工序列
<220>
<223>人工序列的描述:合成的寡核苷酸
<400>9
ccggcgcgaccttatctccaacaatctcgagattgttggagataaggtcgcgttttt57
<210>10
<211>57
<212>dna
<213>人工序列
<220>
<223>人工序列的描述:合成的寡核苷酸
<400>10
ccggccacacagctacagctttcttctcgagaagaaagctgtagctgtgtggttttt57
<210>11
<211>59
<212>dna
<213>人工序列
<220>
<223>人工序列的描述:合成的寡核苷酸
<400>11
ccgggagaacctgagacaccttaagctcgagcttaaggtgtctcaggttctcttttttg59
<210>12
<211>48
<212>dna
<213>人工序列
<220>
<223>人工序列的描述:合成的寡核苷酸
<400>12
ctggtctttctatctcttgtactcgagtacaagagatagaaagaccag48
<210>13
<211>48
<212>dna
<213>人工序列
<220>
<223>人工序列的描述:合成的寡核苷酸
<400>13
gaccatagactggaaggtcttctcgagaagaccttccagtctatggtc48
- 还没有人留言评论。精彩留言会获得点赞!