具有对FcRn的亲和力提高以及对至少一个Fc片段受体的亲和力提高的Fc片段的变体的制作方法
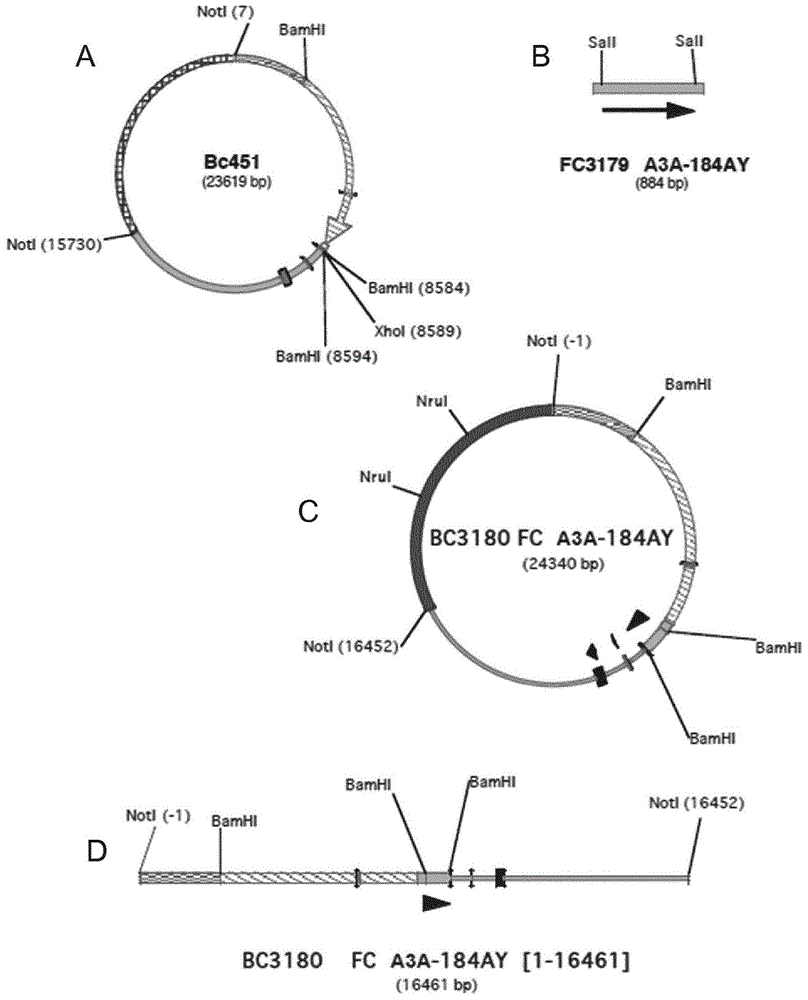
本发明涉及包含突变的fc区并相对于亲本多肽对fcrn受体亲和力提高以及对至少一个fc受体(fcr)的亲和力提高的多肽(也称为变体)。抗体由重链和轻链的四聚体组成。两条轻链彼此相同,同时两条重链相同并且由二硫键连接。存在五种类型的重链(α、γ、δ、ε、μ),其决定了免疫球蛋白类型(iga、igg、igd、ige、igm)。轻链组包括两个亚组,λ和κ。igg是可以在血液和其他体液中发现的可溶性抗体。igg是y-形糖蛋白,具有大约150kda的分子量,由两条重链和两条轻链组成。每条链由恒定区和可变区组成。重链的两个羧基末端结构域形成fc片段,而重链和轻链的氨基末端结构域识别抗原并且被称为fab片段。通过抗体fc片段与提供对给定的治疗靶标的特异性的蛋白质结构域的结合形成fc融合蛋白。实例是fc片段与任何类型的治疗性蛋白或其片段的结合。fc多肽,特别是fc片段,治疗性抗体和fc融合蛋白,目前用于治疗各种疾病,如类风湿性关节炎、牛皮癣、多发性硬化和许多形式的癌症。治疗性抗体可以是单克隆或多克隆抗体。单克隆抗体获自单个抗体产生细胞系,其显示出对单个抗原的相同特异性。作为对抗自身免疫疾病和/或炎性组分的药物来使用或研发治疗性fc融合蛋白,所述药物如依那西普(etanercept)(amgen'senbrel,其是结合fc的tnf受体)或阿列法西普(alefacept)(biogenidec'samevive,其是结合人igg1的fc部分的lfa-3)。fc多肽,如fc片段,fc抗体和融合蛋白特别地具有取决于fc部分与其受体的结合的活性,即,fcrn和fc片段受体(fcr),如fccγri(cd64)、fcγriiia(cd16a)和fcγrila(cd32a)受体。在涉及fc多肽与fc片段受体(fcr)相互作用的疗法中,期望的作用之一是通过结合效应细胞表面上的fc受体来抑制免疫系统激活。特别是在涉及自身抗体和/或细胞因子的炎性和/或自身免疫性疾病的治疗中,基于fc的疗法可以通过阻断fc受体从而与自身抗体竞争进入这些受体来起作用。这导致通常由自身抗体介导的直接活性(例如抗体依赖性细胞毒性、补体依赖性细胞毒性或抗体依赖性细胞吞噬作用)的抑制,以及免疫系统的激活降低,包括细胞因子释放。另外,由于fcrn受体参与抗体的再循环,因此用fc多肽阻断它们可以更快地消除自身抗体,从而降低其半衰期。这就是为什么基于fc片段的治疗特别适合由免疫系统细胞不受控制的刺激(尤其是自身抗体和/或细胞因子)触发的自身免疫和/或炎性疾病的原因。提议用于这些疾病治疗的基本疗法是静脉内免疫球蛋白(ivig或ivig)疗法,该疗法包括向患者静脉内施用来自人血浆捐赠池的免疫球蛋白(最常见是igg)。通常认为这些igg特别是通过阻断fc受体并因此与自身抗体竞争进入这些受体而起作用。最近,已研发出fc片段,用于修饰其fc受体结合特性的目的。然而,它们的有效性仍有待证明。仍然需要优化这些fc片段,特别是提高其半衰期和/或其治疗功效。申请人现在已研发出呈现提高的活性的特定fc片段,特别是通过提高的fcrn结合亲和力。这些fc片段可用于治疗,并且特别适合炎性和/或自身免疫疾病的治疗,以便为包含它们的产品带来更大的功效。特别地,这些片段可以呈现出更有效的对免疫系统细胞上存在的fc受体的阻断,然后其较少的或不再可用于自身抗体的结合,然后其活性被抑制。另外,fc片段使得有可能更有效地阻断fcrn受体,从而更快地消除自身抗体。另外,如在实施例中所证实的,这些特定的fc片段中的一些具有比ivig更好的补体依赖性细胞毒性(cdc)的抑制。因此,它们有可能降低病原性自身抗体的毒性,如炎性和/或自身免疫疾病中涉及的那些。本发明因此提供了关于由fc区介导的功能活性具有优化特性的亲本多肽的变体。本发明因此涉及包含fc片段的亲本多肽的变体,所述变体相对于亲本多肽对fcrn受体的亲和力提高以及对选自fcγri受体(cd64)、fcγriiia(cd16a)和fcγrila(cd32a)的至少一个fc受体(fcr)的亲和力提高,特征在于所述变体包含:(i)四个突变334n、352s、378v和397m;和(ii)至少一个选自434y、434s、226g、p228l、p228r、230s、230t、230l、241l、264e、307p、315d、330v、362r、389t和389k的突变;其中编号是eu索引或kabat等价的编号。根据一个实施方案,根据本发明的变体进一步在fc片段中包含至少一个选自以下的突变(iii):y296w、k290g、v240h、v240i、v240m、v240n、v240s、f241h、f241y、l242a、l242f、l242g、l242h、l242i、l242k、l242p、l242s、l242t、l242v、f243l、f243s、e258g、e258i、e258r、e258m、e258q、e258y、v259c、v259i、v259l、t260a、t260h、t260i、t260m、t260n、t260r、t260s、t260w、v262s、v263t、v264l、v264s、v264t、v266l、s267a、s267q、s267v、k290d、k290e、k290h、k290l、k290n、k290q、k290r、k290s、k290y、p291g、p291q、p291r、r292i、r292l、e293a、e293d、e293g、e293m、e293q、e293s、e293t、e294a、e294g、e294p、e294q、e294r、e294t、e294v、q295i、q295m、y296h、s298a、s298r、y300i、y300v、y300w、r301a、r301m、r301p、r301s、v302f、v302l、v302m、v302r、v302s、v303s、v303y、s304t、v305a、v305f、v305i、v305l、v305r和v305s,其中编号是eu索引或kabat等价的编号。将这样的变体称为“根据本发明的变体”、“根据本发明的突变体”或“根据本发明的多肽”。优选,根据本发明的变体具有对fcrn受体提高的亲和力以及对所有fcγri(cd64)、fcγriiia(cd16a)和fcγriia(cd32a)受体提高的亲和力。优选,此外,根据本发明的变体能够抑制补体依赖性细胞毒性(cdc),这归因于结合补体蛋白(特别是c1q)的修饰。与ivig给予的相比,这种抑制显著提高。优选,根据本发明的变体不同于由fc片段(特别是igg1的)组成的变体,其具有五个突变n434y、k334n、p352s、v397m和a378v,并且在hek293细胞中产生,其中编号是eu索引或kabat等价的。因此,优选,根据本发明的变体不同于在hek293细胞中产生的fc片段(特别是igg1)的n434y/k334n/p352s/v397m/a378v,其中编号是eu索引或kabat等价的。在整个申请中,fc区中的残基编号是根据eu索引或kabat等人的等价的免疫球蛋白重链的的编号(sequencesofproteinsofimmunologicalinterest,第5版,publichealthservice,nationalinstitutesofhealth,bethesda,maryland,1991)。术语“eu索引或kabat等价的”是指人igg1、igg2、igg3或igg4抗体的残基的us编号。这在imgt网站上有说明(http://www.imat.ora/imgtscientificchart/numberina/huighgnber.html)。“多肽”或“蛋白质”表示包含至少100个共价连接的氨基酸的序列。“氨基酸”表示20个天然产生的氨基酸或非天然类似物中的一个。术语“位置”表示多肽的序列中的位置。对于fc区,位置根据eu索引或kabat等价来编号。术语“抗体”以通常的含义来使用。其对应于包含至少一个fc区和两个可变区的四聚体。抗体包含,但不限于,全长免疫球蛋白、单克隆抗体、多特异性抗体、嵌合抗体、人源化抗体和完全人抗体。每条重链的氨基末端部分包含约100至110个氨基酸的可变区,其负责抗原识别。在每个可变区中,三个环集合形成抗原结合位点。每个环称为互补决定区(在下文称为“cdr”)。每条重链的羧基末端部分限定了主要负责效应子功能的恒定区。igg具有几个亚类,特别是igg1、igg2、igg3和igg4。igm的亚类特别是igm1和igm2。因此,“同种型”表示由其恒定区的化学和抗原特征限定的免疫球蛋白亚类中的一种。已知的人免疫球蛋白同种型为ig1、igg2、igg3、igg4、iga1、iga2、igm1、igm2、igd和ige。全长igg是四聚体,并由两条免疫球蛋白链的两个相同对组成,每对具有轻链和重链,其中每条轻链包含vl和cl结构域,并且每条重链包含结构域vh、cγ1(也称为ch1)、cγ2(也称为ch2)和cγ3(也称为ch3)。在人igg1的内容中,根据eu索引或kabat等价的,“ch1”是指位置118至215,“ch2”是指位置231至340和“ch3”是指位置341至447。igg重链还包括n-末端柔性铰链结构域,在igg1的情况中,是指位置216-230。根据eu索引或kabat等价的,下铰链区是指位置226至230。“可变区”表示包含一个或多个基本上由vk、vλ和/或vh基因中的任一个编码的分别构成κ、λ和免疫球蛋白重链的ig结构域的免疫球蛋白区域。可变区包括互补决定区(cdr)和框架区(fr)。术语“fc”或“fc区”是指除了免疫球蛋白恒定区的第一个结构域(ch1)以外的抗体恒定区。因此,fc是指igg1恒定区的后两个结构域(ch2和ch3),以及这些结构域的柔性n-末端铰链。对于人igg1,fc区对应于其羧基末端的c226,即,位置226至447的残基,其中编号是根据eu索引或kabat等价的。所用的fc区可以进一步包含位于根据eu索引或kabat等价的位置216-226之间的上铰链区的一部分;在这种情况中,所用的fc区对应于位置216至447,217至447,218至447,219至447,220至447,221至447,222至447,223至447,224至447或225至447的残基,其中编号是根据eu索引或kabat等价的。优选,在这种情况中,所用的fc区对应于位置216至447的残基,其中编号是根据eu索引或kabat等价的。优选,所用的fc区选自序列seqidno:1至10和14。“亲本多肽”表示参照多肽。所述亲本多肽可以是天然或合成来源的。在本发明的内容中,亲本多肽包含fc区,称为“亲本fc区”。这个fc区可以选自野生型fc区、其片段和突变体。优选,亲本多肽包含人fc片段,优选人igg1或人igg2的fc片段。亲本多肽可以在fc区中相对于野生型fc区包括先前存在的氨基酸修饰(例如,fc突变体)。有利地,亲本多肽可以是分离的fc区(即,照原样的fc片段)、源自分离的fc区的序列、抗体、包含fc区的抗体片段、包含fc区的融合蛋白或缀合fc,其中这个列表不是限制性的。“源自分离的fc区的序列”表示包含至少两个连接在一起的分离的fc区的序列,如scfc(单链fc)或多聚fc。“包含fc区的融合蛋白”表示与fc区融合的多肽序列,所述多肽序列优选选自任何抗体的可变区、将受体结合其配体的序列、粘附分子、配体、酶、细胞因子和趋化因子。“fc缀合物”表示其是fc区与缀合伴侣化学偶合结果的化合物。缀合伴侣可以是蛋白质或非蛋白质。偶合反应通常利用fc区和缀合伴侣上的官能团。各种适用于缀合物合成的结合基团是现有技术已知的;例如,同型-或杂双功能结合剂是公知的(参见,piercechemicalcompanycatalog,2005-2006,technicalsectiononcrosslinkingagents,第321-350页)。合适的缀合伴侣包括治疗性蛋白、标记、细胞毒性剂,如化疗剂、毒素及其活性片段。合适的毒素及其片段包括白喉毒素、外毒素a、蓖麻毒素、相思豆毒素、皂草素(saporin)、gelonin、calicheolyin、auristatine和f以及mertansin。有利地,亲本多肽-并且因此根据本发明的多肽-包含fc区。有利地,亲本多肽-并且因此根据本发明的多肽-是抗体。“突变”表示多肽序列的至少一个氨基酸的改变,包括亲本多肽的fc区的至少一个氨基酸的改变。由此获得的突变多肽是变体多肽;其是根据本发明的多肽。这样的多肽相对于亲本多肽包含突变的fc区。优选,突变是至少一个氨基酸的置换、插入或删除。“置换”表示亲本多肽序列中特定位置的氨基酸被另一个氨基酸替代。例如,n434s置换是指变体多肽,在这种情况中,位置434的天冬酰胺被丝氨酸替代。“氨基酸插入”或“插入”表示在亲本多肽序列的特定位置的氨基酸的添加。例如,插入g>235-236是指位置235和236之间的甘氨酸插入。“氨基酸删除”或“删除”表示亲本多肽序列中特定位置的氨基酸的删除。例如,e294del是指去除位置294的谷氨酸。优选,使用以下突变标记:“434s”或“n434s”,其表示亲本多肽在位置434包含天冬酰胺,其在变体中被丝氨酸替代。在置换组合的情况中,优选格式是“259i/315d/434y”或“v259i/n315d/n434y”。这表示在变体中的位置259、315和434存在三个置换,并且亲本多肽的位置259的氨基酸(即缬氨酸)被异亮氨酸替代,亲本多肽的位置315的氨基酸天冬酰胺被天冬氨酸替代,并且亲本多肽位置434的氨基酸天冬酰胺被酪氨酸替代。如本文使用的“fcrn”或“新生儿fc受体”表示结合igg的fc区的蛋白质并且至少部分由fcrn基因编码。如现有技术已知的,功能性fcrn蛋白包含两个多肽,常常称为重链和轻链。轻链是β-2-微球蛋白,而重链由fcrn基因编码。除非本文另外指出,fcrn或fcrn蛋白是指α-链与β-2-微球蛋白的复合物。在人类中,将编码fcrn的基因称为fcgrt。优选,根据本发明的变体相对亲本多肽对fcrn受体的亲和力提高至少等于2,优选高于5,更优选高于10,甚至更优选高于15,特别优选高于20,甚至更特别地优选高于25,最优选高于30的比例。优选,根据本发明的变体与亲本多肽相比具有延长的半衰期。优选,根据本发明的变体相对于亲本多肽半衰期延长至少等于2,优选高于5,更优选高于10,甚至更优选高于15,特别优选高于20,甚至更特别地优选高于25,最优选高于30的比例。fcrn的主要功能之一称为igg再循环。它包括从血浆蛋白的内皮分解代谢途径中提取igg,以使它们完整地返回到循环中。这种再循环解释了它们在正常生理条件下的半衰期(igg为三周),同时保持了高的血浆浓度。igg从上皮或内皮的一个极到另一个极的胞吞转运是fcrn的第二个主要功能,以确保它们在体内的生物分布。优选,根据本发明的变体相对于亲本多肽对至少一个fc片段受体(fcr)的亲和力提高至少等于2,优选高于5,更优选高于10,甚至更优选高于15,特别优选高于20,甚至更特别地优选高于25,最优选高于30的比例,所述受体选自受体fcγri(cd64)、fcγriiia(cd16α)和fcγrila(cd32α)。fcγri受体(cd64)参与吞噬作用和细胞激活。fcγriiia受体(cd16a)也参与fc依赖性活性,包括adcc和吞噬作用;它在158位具有v/f多态性。fcγriia受体(cd32a)继而参与血小板激活和吞噬作用;它在位置131具有h/r多态性。优选,根据本发明的变体对fcrn受体的亲和力提高并且对所有fcγri(cd64)、fcγriiia(cd16α)和fcγrila(cd32α)受体的亲和力提高。可以通过现有技术中公知的方法评估包含fc区的多肽对fcr的亲和力。例如,本领域技术人员可以使用表面等离子体共振(spr)确定亲和力(kd)。或者,本领域技术人员可以进行适当的elisa测试。适当的elisa分析比较亲本fc和突变fc的结合力。比较针对突变的fc和亲本fc特异性检测的信号。可以通过评估整个多肽或评估其分离的fc区平常地确定结合亲和力。或者,本领域技术人员可以进行适当的竞争测定。将这些与表达这些受体的细胞同时孵育时,可以使用适当的竞争测定法来确定突变的fc抑制标记的fcr配体结合的能力。标记的配体与fcr的结合可以例如通过流式细胞术来评估。然后通过评估与fcr结合的标记配体发出的平均荧光强度的改变来确定在fcr处突变的fc的结合亲和力。优选,根据本发明的多肽的突变fc区相对于亲本多肽包含3至20个突变,优选4至20个突变。“3至20个氨基酸修饰”表示3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19和20个氨基酸突变。优选,相对于亲本多肽,其包含4至15个突变,更优选4至10个突变。甚至更优选,根据本发明的多肽的突变fc区可以包含至少一个5个突变的组合,所述组合物包含四个如以上(i)所述的突变和至少一个如以上(ii)所述的突变,其中编号是eu索引或kabat等价的。甚至更优选,根据本发明的多肽的突变fc区包含6个突变的组合,所述组合包含四个如以上(i)所述的突变、至少一个如以上(ii)所述的突变和至少一个如以上(iii)所述的突变,其中编号是eu索引或kabat等价的。优选,根据本发明的多肽的突变fc区包含以下突变:(i)四个突变334n、352s、378v和397m;(ii)选自434y、434s、226g、p228l、p228r、230s、230t、230l、241l、264e、307p、315d、330v、362r、389t和389k的至少一个突变;和当存在突变(iii)时,其选自k290g和y296w,其中编号是eu索引或kabat等价的。优选,根据本发明的多肽的突变fc区包含以下突变:(i)四个突变334n、352s、378v和397m;(ii)选自434y、434s、226g、p228l、p228r、230s、230t、230l、241l、264e、307p、315d、330v、362r、389t和389k的至少一个突变;和(iii)至少一个选自k290g和y296w的突变,其中编号是eu索引或kabat等价的。优选,根据本发明的多肽的突变fc区包含选自以下组合的突变组合:n434y/k334n/p352s/v397m/a378v和n434y/k334n/p352s/v397m/a378v/y296w优选,在转基因非人哺乳动物的乳腺上皮细胞中产生根据本发明的多肽。优选,在非人转基因动物中,优选在转基因非人哺乳动物中,更优选在其乳腺上皮细胞中产生根据本发明的多肽。“转基因非人哺乳动物”表示特别是选自牛、猪、山羊、绵羊和啮齿动物的哺乳动物,优选选自山羊、小鼠、母猪、兔子、母羊和母牛。优选地,转基因非人动物或转基因非人哺乳动物是转基因山羊。优选,根据本发明的变体在其fc片段中包含五个突变n434y、k334n、p352s、v397m和a378v,并且在转基因非人哺乳动物的,或在转基因非人动物的,优选在转基因非人哺乳动物的,如山羊的乳腺上皮细胞中产生。这样的变体对fcrn受体的亲和力提高,并且对所有fcγri(cd64)、fcγriiia(cd16α)和fcγrila(cd32α)受体的亲和力提高。因此,优选,根据本发明的变体是在转基因非人哺乳动物的乳腺上皮细胞中产生的fcn434y/k334n/p352s/v397m/a378v变体。或者,优选,根据本发明的变体是在转基因非人动物,优选在转基因非人哺乳动物,如山羊中产生的fcn434y/k334n/p352s/v397m/a378v变体。这样的变体对fcrn受体的亲和力提高,并且对所有fcγri(cd64)、fcγriiia(cd16α)和fcγrila(cd32α)受体的亲和力提高。优选,根据本发明的变体包含序列seqidno:11或序列seqidno:15。或者,优选,根据本发明的变体是在转基因非人哺乳动物的乳腺上皮细胞中产生的变体fcn434y/k334n/p352s/v397m/a378v/y296w。或者,优选,根据本发明的变体是在转基因非人动物中,优选在转基因非人哺乳动物中,如山羊中产生的fcn434y/k334n/p352s/v397m/a378v/y296w变体。这样的变体对fcrn受体的亲和力提高,并且对所有fcγri(cd64)、fcγriiia(cd16α)和fcγrila(cd32α)受体的亲和力提高。优选,用于产生根据本发明的变体的方法包括在转基因非人哺乳动物的乳腺上皮细胞中表达所述变体。因此,本发明还涉及用于生产包含fc片段的亲本多肽变体的方法,所述变体相对于亲本多肽,对fcrn受体的亲和力提高,并且对选自fcγri(cd64)、fcγriiia(cd16α)和fcγrila(cd32α)受体的至少一个fc受体(fcr)的亲和力提高,所述变体包含:(i)四个突变334n、352s、378v和397m;和(ii)选自434y、434s、226g、p228l、p228r、230s、230t、230l、241l、264e、307p、315d、330v、362r、389t和389k的至少一个突变;和其中编号是eu索引或kabat等价的,所述方法包括在转基因非人哺乳动物的乳腺上皮细胞中表达所述变体。优选,所述变体进一步在fc片段中包含至少一个选自以下的突变(iii):y296w、k290g、v240h、v240i、v240m、v240n、v240s、f241h、f241y、l242a、l242f、l242g、l242h、l242i、l242k、l242p、l242s、l242t、l242v、f243l、f243s、e258g、e258i、e258r、e258m、e258q、e258y、v259c、v259i、v259l、t260a、t260h、t260i、t260m、t260n、t260r、t260s、t260w、v262s、v263t、v264l、v264s、v264t、v266l、s267a、s267q、s267v、k290d、k290e、k290h、k290l、k290n、k290q、k290r、k290s、k290y、p291g、p291q、p291r、r292i、r292l、e293a、e293d、e293g、e293m、e293q、e293s、e293t、e294a、e294g、e294p、e294q、e294r、e294t、e294v、q295i、q295m、y296h、s298a、s298r、y300i、y300v、y300w、r301a、r301m、r301p、r301s、v302f、v302l、v302m、v302r、v302s、v303s、v303y、s304t、v305a、v305f、v305i、v305l、v305r和v305s,其中编号是eu索引或kabat等价的。特别地,这样的方法包括以下步骤:a)制备包含编码变体的序列、编码哺乳动物酪蛋白启动子或哺乳动物乳清启动子的序列和编码允许所述变体分泌的信号肽的序列的dna序列;b)将a)中获得的dna序列引入非人哺乳动物胚胎中,以获得在乳腺中表达由a)中获得的所述dna序列编码的变体的转基因非人哺乳动物;和c)在由b)获得的转基因非人哺乳动物产生的奶中收集变体。步骤a)因此包括制备包含编码变体的序列、编码哺乳动物酪蛋白启动子或哺乳动物乳清启动子的序列和编码允许所述变体分泌的信号肽的序列的dna序列。这样的步骤说明于图1中。编码变体的序列是编码根据本发明的变体的dna序列。例如,这个变体具有seqidno:11的序列。含有信号肽的相应序列是seqidno:13的序列。在另一个实例中,这个变体具有序列seqidno:15。含有信号肽的相应序列是seqidno:16的序列。针对哺乳动物酪蛋白启动子或哺乳动物乳清启动子的编码序列使其可以在奶中表达变体。本领域技术人员知道如何选择这样的启动子。在本申请的内容中,信号肽是氨基酸序列,优选2至30个氨基酸,位于fc多肽变体的n-末端,起定位到哺乳动物奶中的作用。优选,信号肽的编码序列介于变体和启动子的编码序列之间。没有这样的序列,变体将保留在哺乳动物组织中,其中将难以纯化并且将需要牺牲宿主动物。信号肽在分泌时可以被切割。信号肽的编码序列可以是与根据本发明的亲本多肽天然相连的序列。或者,信号肽的编码序列可以是从其衍生启动子的奶蛋白的序列,即,消化奶蛋白基因以分离启动子时,选择包含启动子和启动子直接下游的信号肽编码序列的dna片段。另一个替换方案是使用源自另一个分泌蛋白的信号序列,所述另一个分泌蛋白既不是通常从启动子表达的奶蛋白,也不是根据本发明的多肽。优选,信号肽具有序列seqidno:12。所用的dna序列可以包含优化的密码子。密码子优化的目的在于用携带所研究细胞类型中氨基酸的转移rna(trna)的最常见密码子替代天然密码子。频繁遇到的trna的固定化具有提高信使rna(mrna)翻译速度并且因此提高最终滴度的主要优势(carton,j.m.等,proteinexprpurif,2007)、序列优化还作用于可以减缓核糖体复合物阅读的mrna二级结构的预测。序列优化还对与mrna的半衰期直接相关的g/c百分比并且因此对其被翻译的潜力具有影响(chechetkin,j.oftheoreticalbiology242,2006922-934)。密码子优化可以通过使用针对哺乳动物且更具体地针对智人的密码子频率表(密码子使用表)替代天然密码子来实现。在网上有可用的算法,且由合成基因的供应商(dna2.0,geneart,mwg,genscript)形成,使得可以进行这个序列优化。优选,步骤a)包括以下步骤:(a1)制备包含编码根据本发明的变体的序列的dna序列,在其n-末端与编码允许所述变体分泌的信号肽的序列直接融合;(a2)将(a1)中获得的dna序列引入载体中,所述载体包含编码哺乳动物酪蛋白启动子或哺乳动物乳清启动子的序列;(a3)消化(a2)中获得的所述载体,以获得包含编码哺乳动物酪蛋白启动子或哺乳动物乳清启动子的序列的dna序列,和包含在其n-末端与信号肽的编码序列直接融合的编码本发明的变体的序列的dna序列。换句话说,优选,在步骤a)结束时,我们获得了dna序列,其从n-至c-末端包含与信号肽编码序列融合的哺乳动物酪蛋白启动子或哺乳动物乳清启动子的编码序列,信号肽编码序列自身与根据本发明的变体的编码序列融合。接着,根据本发明的方法包括步骤b),将a)中获得的dna序列引入非人哺乳动物胚胎中,以获得在乳腺中表达a)中获得的所述dna序列编码的变体的转基因非人哺乳动物。最后,根据本发明的方法包括步骤c),在b)中获得的转基因非人哺乳动物产生的奶中收集变体。步骤b)和c)是现有技术已知的,特别是专利ep0264166。优选,这样的方法在步骤c)后包括收集的奶的纯化步骤d)。纯化步骤d)可以通过现有技术的任何已知方法来进行,特别是通过蛋白a上的纯化。再一次,这样的步骤特别地描述于专利ep0264166中。本发明还涉及包含编码包含fc片段的亲本多肽的变体的基因的dna序列,所述变体相对于亲本多肽,对fcrn受体的亲和力提高,并且对选自fcγri(cd64)、fcγriiia(cd16α)和fcγrila(cd32α)受体的至少一个片段受体fc(fcr)的亲和力提高,所述变体包含:(i)四个突变334n、352s、378v和397m;和(ii)选自434y、434s、226g、p228l、p228r、230s、230t、230l、241l、264e、307p、315d、330v、362r、389t和389k的至少一个突变;其中编号是eu索引或kabat等价的,所述基因在哺乳动物酪蛋白或乳清的转录启动子的控制下,所述启动子不是天然控制所述基因的转录,所述dna序列进一步包含编码允许所述变体分泌的信号肽的序列,其插入编码变体和启动子的序列之间。在特别的实施方案中,所述变体在fc片段进一步中包含至少一个选自以下的突变(iii):y296w、k290g、v240h、v240i、v240m、v240n、v240s、f241h、f241y、l242a、l242f、l242g、l242h、l242i、l242k、l242p、l242s、l242t、l242v、f243l、f243s、e258g、e258i、e258r、e258m、e258q、e258y、v259c、v259i、v259l、t260a、t260h、t260i、t260m、t260n、t260r、t260s、t260w、v262s、v263t、v264l、v264s、v264t、v266l、s267a、s267q、s267v、k290d、k290e、k290h、k290l、k290n、k290q、k290r、k290s、k290y、p291g、p291q、p291r、r292i、r292l、e293a、e293d、e293g、e293m、e293q、e293s、e293t、e294a、e294g、e294p、e294q、e294r、e294t、e294v、q295i、q295m、y296h、s298a、s298r、y300i、y300v、y300w、r301a、r301m、r301p、r301s、v302f、v302l、v302m、v302r、v302s、v303s、v303y、s304t、v305a、v305f、v305i、v305l、v305r和v305s,其中编号是eu索引或kabat等价的。本发明还涉及包含编码包含fc片段的亲本多肽的变体的基因的dna序列,所述变体相对于亲本多肽对fcrn受体的亲和力提高,并且对选自fcγri(cd64)、fcγriiia(cd16α)和fcγrila(cd32α)受体的至少一个片段受体fc(fcr)的亲和力提高,所述变体包含:(i)四个突变334n、352s、378v和397m;和(ii)选自434y、434s、226g、p228l、p228r、230s、230t、230l、241l、264e、307p、315d、330v、362r、389t和389k的至少一个突变;其中编号是eu索引或kabat等价的,所述dna序列任选包含编码允许所述变体分泌的信号肽的序列。在特别的实施方案中,所述变体在fc片段中进一步包含至少一个选自以下的突变(iii):y296w、k290g、v240h、v240i、v240m、v240n、v240s、f241h、f241y、l242a、l242f、l242g、l242h、l242i、l242k、l242p、l242s、l242t、l242v、f243l、f243s、e258g、e258i、e258r、e258m、e258q、e258y、v259c、v259i、v259l、t260a、t260h、t260i、t260m、t260n、t260r、t260s、t260w、v262s、v263t、v264l、v264s、v264t、v266l、s267a、s267q、s267v、k290d、k290e、k290h、k290l、k290n、k290q、k290r、k290s、k290y、p291g、p291q、p291r、r292i、r292l、e293a、e293d、e293g、e293m、e293q、e293s、e293t、e294a、e294g、e294p、e294q、e294r、e294t、e294v、q295i、q295m、y296h、s298a、s298r、y300i、y300v、y300w、r301a、r301m、r301p、r301s、v302f、v302l、v302m、v302r、v302s、v303s、v303y、s304t、v305a、v305f、v305i、v305l、v305r和v305s,其中编号是eu索引或kabat等价的。或者,可以在培养的哺乳动物细胞中产生根据本发明的多肽。优选的细胞是yb2/0大鼠系、cho仓鼠系,特别是chodhfr-和cholec13系、perc6tm细胞(crucell)、nso、sp2/0、hela、bhk或cos细胞、hek293细胞。优选,使用cho仓鼠系。因此,本发明还涉及用于生产包含fc片段的亲本多肽的变体的方法,所述变体相对于亲本多肽对fcrn受体的亲和力提高,并且对选自fcγri(cd64)、fcγriiia(cd16α)和fcγrila(cd32α)受体的至少一个fc受体(fcr)的亲和力提高,所述变体包含:(i)四个突变334n、352s、378v和397m;和(ii)选自434y、434s、226g、p228l、p228r、230s、230t、230l、241l、264e、307p、315d、330v、362r、389t和389k的至少一个突变;和其中编号是eu索引或kabat等价的,所述方法包括在培养物中的哺乳动物细胞中表达所述变体。在特别的实施方案中,所述变体在fc片段中进一步包含至少一个选自以下的突变(iii):y296w、k290g、v240h、v240i、v240m、v240n、v240s、f241h、f241y、l242a、l242f、l242g、l242h、l242i、l242k、l242p、l242s、l242t、l242v、f243l、f243s、e258g、e258i、e258r、e258m、e258q、e258y、v259c、v259i、v259l、t260a、t260h、t260i、t260m、t260n、t260r、t260s、t260w、v262s、v263t、v264l、v264s、v264t、v266l、s267a、s267q、s267v、k290d、k290e、k290h、k290l、k290n、k290q、k290r、k290s、k290y、p291g、p291q、p291r、r292i、r292l、e293a、e293d、e293g、e293m、e293q、e293s、e293t、e294a、e294g、e294p、e294q、e294r、e294t、e294v、q295i、q295m、y296h、s298a、s298r、y300i、y300v、y300w、r301a、r301m、r301p、r301s、v302f、v302l、v302m、v302r、v302s、v303s、v303y、s304t、v305a、v305f、v305i、v305l、v305r和v305s,其中编号是eu索引或kabat等价的。特别地,这样的方法包括以下步骤:a)制备编码变体的dna序列;b)将a)中获得的dna序列引入培养物中的哺乳动物细胞中。可以瞬时或稳定地进行引入(即,a)中获得的dna序列整合至细胞基因组中);和c)从b)中获得的细胞表达变体,随后d)任选,收集培养基中的变体。本发明还涉及药物组合物,其包含(i)根据本发明的多肽,和(ii)至少一种药物学上可接受的赋形剂。本发明的目的还在于药物组合物,其包含(i)由fc片段组成的变体,特别是igg1的fc片段,其呈现出五个突变n434y、k334n、p352s、v397m和a378v,其中编号是eu索引或kabat等价的,和(ii)至少一种药物学上可接受的赋形剂。优选,本发明的组合物包含(i)由fc片段组成的变体,特别是igg1的fc片段,其呈现出六个突变n434y、k334n、p352s、v397m和a378v、y296w,其中编号是eu索引或kabat等价的,和(ii)至少一种药物学上可接受的赋形剂。本发明的目的还在于根据本发明的多肽或如上所述的组合物,用作药物。本发明的目的还在于由fc片段组成的变体作为药物的用途,特别是igg1的fc片段作为药物的用途,其呈现出五个突变n434y、k334n、p352s、v397m和a378v,其中编号是eu索引或kabat等价的(即变体n434y/k334n/p352s/v397m/a378v)。在特别的实施方案中,本发明的目的还在于由fc片段组成的变体作为药物的用途,特别是igg1的fc片段作为药物的用途,其呈现出六个突变n434y、y296w、k334n、p352s、v397m、a378v和y296w,其中编号是eu索引或kabat等价的(即变体n434y/k334n/p352s/v397m/a378v/y296w)。如上所示,有利地,亲本多肽-并且因此根据本发明的多肽-是抗体。在这种情况中,抗体可以针对选自肿瘤抗原、病毒抗原、细菌抗原、真菌抗原、毒素、膜或循环细胞因子和膜受体的抗原。抗体针对肿瘤抗原时,它的使用特别适用于癌症的治疗中。“癌症”表示特征在于细胞异常增殖的任何生理状况。癌症的实例包括癌、淋巴瘤、母细胞瘤、肉瘤(包括脂肪肉瘤)、神经内分泌肿瘤、间皮瘤、脑膜瘤、腺癌、黑素瘤、白血病和淋巴样恶性肿瘤,其中这个列表不是穷举的。抗体针对病毒抗原时,它的使用在病毒感染的治疗中特别有用。病毒感染包括由hiv、逆转录病毒、柯萨奇病毒、天花病毒、流感、黄热病、西尼罗河、巨细胞病毒、轮状病毒或乙肝或丙肝引起的感染,其中这个列表不是穷举的。抗体针对毒素时,它的使用在细菌感染的治疗中特别有用,例如,破伤风毒素、白喉毒素、炭疽毒素炭疽杆菌的感染,或在肉毒杆菌毒素、蓖麻毒素、志贺毒素感染的治疗中特别有用,其中这个列表不是穷举的。抗体针对细胞因子时,它的使用特别适用于炎性和/或自身免疫疾病的治疗中。炎性和/或自身免疫疾病包括血栓性血小板减少性紫癜(ttp)、移植物和器官排异、移植物抗宿主疾病、类风湿性多关节炎、全身性红斑狼疮、不同类型的硬化症、原发性氏综合症(或氏综合症)、自身免疫多发性神经病(如多发性硬化)、i型糖尿病、自身免疫性肝炎、强直性脊柱炎、reiter氏综合症、痛风性关节炎、乳糜泻、克罗恩病、hashimoto慢性甲状腺炎(甲状腺机能减退)、addison’s病、自身免疫性肝炎、basedow’s病(甲状腺机能亢进)、溃疡性结肠炎、脉管炎和anca-相关的全身性脉管炎(抗中性粒细胞胞浆自身抗体)、自身免疫性血细胞减少以及成人和儿童中的其他血液学并发症(如自身免疫性急性或慢性血小板减少、自身免疫性溶血性贫血、新生儿的溶血性疾病(mhn)、冷凝集素病、自身免疫性获得性血友病;goodpasture综合症、外膜性肾病、自身免疫性大疱性皮肤病、难治性肌无力、混合型冷球蛋白血症、牛皮癣、青少年慢性关节炎、炎性肌炎、皮肌炎和儿童中的全身性自身免疫疾病,包括抗磷脂综合症、结缔组织病、自身免疫性肺炎、guillain-barré综合症、慢性炎性脱髓鞘性多发性神经病(pdci)、自身免疫性甲状腺炎、糖尿病、重症肌无力、自身免疫性眼部炎性疾病、视神经脊髓炎(devic’s病)、硬皮病、天疱疮、胰岛素抗性糖尿病、多肌炎、biermer’s贫血、肾小球性肾炎、wegener’s病、horton病、结节性多动脉炎和churg-strauss综合症、still’s病、萎缩性多软骨炎、不适、单克隆丙种球蛋白病、韦格纳肉芽肿、狼疮、出血性直肠结肠炎、牛皮癣关节炎、肉样瘤病、胶原性结肠炎、疱疹样皮炎、家族性地中海热、iga肾小球肾炎、lambert-eaton肌无力综合症、交感性眼炎、fiessinger-leroy-reiter综合症和葡萄膜-脑膜-脑炎综合症。还包括其他炎性疾病,如急性呼吸窘迫综合症(ards)、急性脓毒性关节炎、佐剂性关节炎、过敏性脑脊髓炎、过敏性鼻炎、过敏性脉管炎、过敏、哮喘、动脉粥样硬化、由于慢性细菌或病毒感染引起的慢性炎症、慢性梗阻性肺病(copd)、冠心病、脑炎、肠炎性疾病、炎性骨溶解、与急性和迟发性超敏反应相关的炎症、与肿瘤相关的炎症、外周神经损伤或脱髓鞘疾病、与组织创伤(如烧伤和缺血)相关的炎症、由于脑膜炎引起的炎症、多器官衰竭综合症(多器官功能障碍综合症,mods)、肺纤维化、败血病和脓毒性休克、stevens-johnson综合症、未分化的关节炎和未分化的脊柱关节病。在本发明特别的实施方案中,自身免疫疾病是特发性血小板减少性紫癜(itp)和慢性炎性脱髓鞘性多发性神经病(cidp)。优选,自身免疫或炎性病理选自免疫性血小板减少性紫癜(也称为特发性血小板减少性紫癜或itp)、视神经脊髓炎或畸形病(nmo)和多发性硬化症。归功于模型,研究了多发性硬化症,尤其是实验性自身免疫性脑脊髓炎(eae)。本申请中描述的序列概括如下:在阅读以下实施例时将更好地理解本发明。附图标题如下:图1:使用载体bc451在山羊奶和小鼠中生产变体a3a-184aya)用xhoi消化β酪蛋白载体,bc451。在载体bc451中,noti-noti片段是原核生物片段。noti片段(15370)-xhoi是含有polya信号的3’基因组序列。bamhi-xhoi片段是β酪蛋白的启动子区。b)将含有fca3a-184ay变体编码区(即,fc3179a3a-184ay884bp)的sali片段插入载体中,以生成bc3180fca3a-184ay(c)基因构建体。c)随后从原核生物载体分离用于微注射的dna片段。为此,用noti和nrui消化bc3180。随后通过凝胶洗脱纯化在β酪蛋白启动子控制下的含有fc基因(编码a3a-184ay变体)的16.4kb片段。图2:由k/bxn小鼠血清转移诱发的关节炎的orentive模型中的测试结果通过在d0将10mlk/bxn小鼠血清静脉内转移至c57/bi/6j小鼠中来诱发疾病。在d0,注射k/bxn小鼠血清前2h,腹膜内给药测试分子一次。通过四腿(four-leg)指数求和获得临床评分:0=正常,1=关节肿胀,2=超过一个关节肿胀和3=整个关节严重肿胀(任意单位)。图3:由k/bxn小鼠血清转移诱发的关节炎的治疗模型中的测试结果通过在d0将10mlk/bxn小鼠血清静脉内转移至c57/bi/6j小鼠中来诱发疾病。在d0,注射k/bxn小鼠血清后72h,腹膜内给药测试分子一次(由虚线表示)。通过四腿指数求和获得临床评分:0=正常,1=关节肿胀,2=超过一个关节肿胀和3=整个关节严重肿胀(任意单位)。图4:fc和iqlv与卫生细胞结合的测试结果将用alexa标记的igiv或根据本发明的fc变体在65nm下(对于fc,2%csfpbs中10μg/ml)用靶细胞在冰上孵育20分钟。在2%csf中洗涤2次后,将细胞悬浮于500mlisoflow中,接着进行流式细胞术分析。结果如下:a)用抗-cd19标记的b细胞(“%阳性b细胞”);b)用抗cd56标记的nk细胞(“%阳性nk细胞”);c)在igiv存在下,用抗cd14标记的单核细胞(“%阳性细胞+igiv”);d)在igiv存在下,cd16+用抗cd14以及用抗cd163g8抗体标记的单核细胞(“%阳性细胞+igiv”);e)在igiv存在下,用抗cd15标记的嗜中性粒细胞(“%阳性细胞+igiv”);f)在igg或fcwt存在下,用抗cd56标记的nk细胞(“%细胞阳性”)。图5:adcc测试、jurkatcd64和cdc细胞激活的结果a)jurkatcd64细胞激活的抑制:将raji细胞(5×106细胞/ml,50ml)与利妥昔单抗(rituxan)(50ml至2m9/ml)、表达人cd64的jurkat细胞(jurkat-h-cd64)(5×106细胞/ml,25ml)、pma(50ml至40ng/ml)混合,随后用1950nm的igiv或根据本发明的变体(rfca3a-184ay)孵育。在孵育一夜后,将平板离心(125g,1分钟),并通过elisa评价上清液中含有的il2。根据以下等式:(il-2iglv/样品的il-2)×100,将结果表示为相对于igiv的百分比。b)adcc的抑制用不同浓度(0至75ng/ml)的抗-rh-抗体d孵育效应细胞(单核细胞)(25ml,8×107细胞/ml)和rh-阳性rbc(25ml,最终4×107细胞/ml),效应子/靶比例为2/1。孵育16小时后,使用特异性底物(daf),通过定量释放至上清液中的血红蛋白来估算裂解。将结果表示为作为抗体含量函数的特异性裂解百分比。通过以33nm添加的igg或根据本发明的fc变体(rfca3a-184ay)诱导adcc的抑制。结果以百分比表示,其中100%和0%是分别用650nm和0nm的igiv根据以下等式获得值:[(使用33nm样品的adcc-未用ivig的adcc)/(使用33nmig1v的adcc-未用ivig的adcc)×100]。c)cdc的抑制活性:用50ng/ml终浓度的利妥昔单抗孵育raji细胞30分钟。添加1/10稀释的并且之前用根据本发明的变体fc(rfca3a-184ay)或igiv(vol/vol)在37℃下孵育1h的幼兔血清溶液。在37℃下孵育1h后,将平板离心(125g,1分钟),并通过测量培养基中释放的胞内ldh估算cdc。将结果表示为百分比抑制并与igg和阴性对照(不具fc功能的fc,即,rfcneg)进行比较,100%对应于裂解活性的完全抑制,而0%对应于未用fc或igiv获得的对照值。图6:细胞结合测试的结果将用标记的igiv、fc-rec(野生型fc)、fcmst-hn或根据本发明的fc变体(a3a-184aycho,a3a-184eycho)65nm针对fc(10μg/ml)在2%csf(集落刺激因子)pbs中与靶细胞在冰上孵育20分钟。在2%csfpbs中洗涤2次后,将细胞悬浮于500μlisoflow中,接着进行流式细胞术分析。对以下靶细胞进行测试:-用抗-cd56标记的自然杀伤(nk)细胞;-用抗cd14标记的单核细胞;-用抗cd14和抗cd163g8抗体标记的cd16+单核细胞;-用抗cd15标记的嗜中性粒细胞。图7:特发性血细胞减少性紫癜(itp)体内模型中的测试结果通过静脉内注射抗血小板抗体6a6-higg1(0.3pg/g体重),从小鼠耗尽血小板(也称为凝血细胞),在表达人源化fcrn的小鼠中诱发疾病。在血小板耗尽前2小时,腹膜内给药阴性对照(“ctlpbs”)、igiv(1000mg/kg)、fc-rec(fc-野生型)片段(380和750m/kg)、fcmst-hn片段(190mg/kg)和本发明的变体fca3a-184aycho(190mg/kg和380mg/kg)。用adviahematology系统(bayer)测定血小板数。将注射抗体前的血小板数设定为100%。实施例实施例1:在转基因动物奶中产生的根据本发明的变体(突变的fc片段)的制备和所述变体的表征i.材料和方法原理通过在奶特异性表达载体中放置fc片段的编码序列,可以在转基因动物奶中产生根据本发明的fc片段。可以通过微注射将载体引入转基因小鼠或山羊的基因组中。筛选和鉴定具有转基因的动物后,使雌性繁殖。分娩后,给雌性挤奶,使得可以收集奶,其中奶的特异性启动子表达后可以分泌fc。fc变体a3a-184ay(k334n/p352s/a378v/v397m/n434y)的蛋白质序列:dkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapientiskakgqprepqvytlspsrdeltknqvsltclvkgfypsdivvewesngqpennykttppmldsdgsfflyskltvdksrwqqgnvfscsvmhealhyhytqkslslspgk(seqidno:11)信号肽(mrwswifllllsitsana,seqidno:12)结合蛋白质序列的n-末端,因此获得seqidno:13的序列。使得一旦表达就允许在奶中分泌蛋白质。核苷酸序列的优化针对在山羊乳腺中的表达优化核苷酸序列。为此,通过合成基因供应商(如geneart)的算法,针对牛(bostaurus)物种优化序列。表达载体:将山羊β酪蛋白表达载体(bc451)用于在小鼠和山羊奶中生产a3a-184ay变体(参见图1)。用xhoi消化β酪蛋白载体bc451(图1a)。插入含有fca3a-184ay变体编码区的sali片段,以生成bc1380fca3a-184ay基因构建体(图1b和1c)。随后从原核生物载体分离用于微注射的dna片段。用noti和nrui消化bc1380(图1d)。随后通过凝胶洗脱纯化释放的含有在β酪蛋白启动子控制下的fc基因的16.4kb片段。随后将这个dna用于微注射阶段中。在小鼠中的产生:通过微注射至植入前小鼠胚胎中来插入dna片段。随后将胚胎植入假孕雌性中。通过pcr分析,针对转基因的存在来筛选出生的后代。在山羊中的表达:还可以将针对微注射制备的dna片段用于山羊奶中的fc变体a3a-184ay的生产。实施例2:在hek细胞中产生的根据本发明的变体(突变的fc片段)的制备和所述变体的表征i.材料和生产方法使用适用于将靶向的突变与编码所需氨基酸的密码子整合的两组引物,通过重叠pcr,插入序列seqidno:14的fc片段中的每个目标突变。有利地,待插入的突变接近fc序列时,通过相同的寡核苷酸来添加它们。将由此通过pcr获得的片段组合,并使用标准试验方案通过pcr扩增所得到的片段。将pcr产物在1%(w/v)琼脂糖凝胶上纯化,用合适的限制酶消化并克隆。使用pcep4载体,在补充了l-谷氨酰胺的f17培养基中的hek293细胞(293-f细胞,invitrogenfreestyle)中,通过瞬时转染(通过脂转染)产生重组fc片段。培养8天后,通过离心澄清上清液并通过0.2μm滤器过滤。随后在hi-trap蛋白a上纯化片段fc,并用25mm柠檬酸盐缓冲液ph=3.0进行洗脱,中和并在pbs中渗析,接着过滤灭菌(0.2pm)。ii.结合测试(blitechnology"bio-layerinterferometry",设备:bytered96,fortebio,pall)实验方案:人fcrn结合(hfcrn):将生物素化的hfcrn报告子固定于链霉抗生物素生物传感器上,在运行缓冲液(0.1m磷酸盐缓冲液,150mmnacl,0.05%tween20,ph6)中稀释至0.7μg/ml。在运行缓冲液中的200、100、50、25、12.5、6.25、3.125和0nm(对于fc,200nm=10μg/ml)下测试根据本发明的变体、wt和igiv。-测试的设计:运行缓冲液中基线1×120s加载300s:将接收器加载在生物反应器上运行缓冲液中基线1×60s缔合60s:将样品(fc或ivig)添加至hfcrn加载的生物反应器中在运行缓冲液中解离30s在再生缓冲液(0.1m磷酸盐缓冲液,150mmnacl,0.05%tween20,ph7.8)中再生120s-结果解释使用1/1关联模型,将缔合和解离曲线(头10s)用于计算缔合(kon)和解离(koff)的动力学常数。然后计算kd(nm)(kon/koff)。连接hcd16av和hcd32ah接收器:将hcd16av(r&dsystem)或hcd32ah(pxtherapeutics)histag受体固定于抗penta-his生物传感器(his1k)上,并在动力学缓冲液(pall)中稀释至1μg/ml。在动力学缓冲液中以1000、500、250、125、62.5、31.25、15和0nm测试了根据本发明的fc变体、wt和igiv。-每次样品前的加载-测试的设计:所有阶段在动力学缓冲液(pall)中进行基线1×60s加载400s基线2×60s缔合60s解离30s在再生缓冲液(甘氨酸10mmph1.5/中和:pbs)中再生5s-结果解释:使用1/1关联模型,将缔合和解离曲线(头5s)用于计算缔合(kon)和解离(koff)的动力学常数。然后计算kd(nm)(kon/koff)。结果:结果显示于以下的表1中:表1sd=标准偏差结果表明根据本发明的变体fca3a184ay(hek)呈现出对hfcrn受体的亲和力提高以及对fcγriiia(cd16a)和fcγrila(cd32a)受体的亲和力提高,并且将这与未突变的fc亲本(fc-wt)进行比较,还与ivig进行了比较。iii.由k/bxn小鼠血清转移诱发的基于模型的关节炎分析实验方案:通过将用于krnt细胞受体的转基因小鼠与nod小鼠品系杂交来生成k/bxn模型。k/bxnf1小鼠在3至5周龄时自发患上疾病,并与人类类风湿关节炎共享许多临床特征。通过在d0将10mlk/bxn小鼠血清静脉内转移至c57/bi/6j小鼠来诱发疾病。在d0,注射k/bxn小鼠血清之前2小时或之后72小时,腹膜内给药一次测试的分子。每日监测小鼠的关节炎体征和症状,以通过添加四腿指数评估发病率和严重性:0=正常,1=关节肿胀,2=超过一个关节肿胀和3=整个关节严重肿胀。结果:给予k/bxn血清的小鼠在关节中产生了关节炎。该疾病的特征在于关节尺寸的增大,导致临床评分的增加。这些小鼠与用盐水处理的对照小鼠相比显示出临床评分和关节厚度的明显增加。1-预防性模型:在k/bxn小鼠血清注射前2h给药,与k/bxn小鼠的血清组相比,使用750mg/kg野生型fc(fcwt)片段的治疗显著降低了临床评分。用根据本发明的fc变体a3a-184ay(hek)的治疗以与fcwt片段相似的方式显著降低了临床评分,但剂量低15倍(50mg/kg)(图2)。2-治疗性模型:k/bxn小鼠血清注射后72小时,与用k/bxn小鼠血清处理的组相比,以2g/kg给药的igg没有显著降低临床评分。然而,与用k/bxn小鼠血清处理的组相比,用750mg/kg的fcwt片段(分子剂量等于2g/kgivig)的治疗显著降低了临床评分。此外,使用根据本发明的变体fca3a-184ay(hek)的治疗与fc-wt片段相似地显著降低了临床评分,但剂量低4倍(190mg/kg)(图3)。iv.体外细胞测试实验方案:fc和igiv片段与血液细胞结合的评价:将用alexa标记的igiv或根据本发明的fc变体在65nm(对于fc,2%csfpbs中10μg/ml)下与靶细胞在冰上孵育20分钟。在2%csf中洗涤2次后,将细胞悬浮于500mlisoflow中,之后进行流式细胞术分析。分别用抗cd19、抗cd56、抗cd14和抗cd15特异性地标记b细胞、nk细胞、单核细胞和嗜中性粒细胞。使用抗cd163g8抗体证明了fcγriii受体(cd16)。adcc的抑制:为了模拟在特发性血小板减少性紫癜(itp)中观察到的红细胞裂解,涉及itp患者的自身抗体,在存在抗rhesusd(rhd)单克隆抗体的情况下,进行了效应细胞介导的红细胞裂解,并且通过例如与抗rhd竞争效应细胞表面上的fc受体的固定,评估了不同数量的多价免疫球蛋白(ivig)或突变或未突变的重组fc片段抑制这种裂解的能力。已经通过adcc技术研究了抗rhd抗体的细胞毒性。简而言之,将效应细胞(单核细胞)(25至8×107细胞/ml)和rh阳性红细胞(最终25至4×107细胞/ml)与不同浓度(0至75ng/ml)的抗-rhd抗体孵育,效应子/靶比率为2/1。孵育16小时后,使用特异性底物(daf),通过定量释放至上清液中的血红蛋白来估计裂解。作为抗体含量的函数,将结果表示为特异性裂解的百分比。评估了通过以33nm添加的iglv或根据本发明的fc变体(rfca3a-184ay)诱导的adcc的抑制。结果以百分比表示,其中100%和0%是分别用650nm和0nm的igiv根据以下等式获得值:[(使用33nm样品的adcc-未用ivig的adcc)/(使用33nmig1v的adcc-未用ivig的adcc)×100]。jurkatcd64细胞激活的抑制:这个测试评估了根据本发明的fc变体或ivig(总igg)抑制用利妥昔单抗由raji细胞系诱导的表达人cd64的jurkat细胞(jurkat-h-cd64)分泌il2的能力。简而言之,将raji细胞(50ml,5×106细胞/ml)与利妥昔单抗(50ml,2mg/ml)、jurkath-cd64细胞(25ml,5×106细胞/ml)、佛波醇酯(pma,50ml,40ng/ml)混合,随后用1950nm的igiv或根据本发明的fc变体孵育。在孵育一夜后,将平板离心(125g,1分钟),并通过elisa评价上清液中含有的il2。根据以下等式:(il-2iglv/样品的il-2)×100,将结果表示为相对于igiv的百分比。cdc的抑制活性:该测定法评估了在作为补体来源的兔血清存在的情况下,根据本发明的fc变体或ivig抑制raji细胞系上利妥昔单抗介导的cdc活性的能力。简而言之,将raji细胞用终浓度为50ng/ml的利妥昔单抗孵育30分钟。加入1/10稀释的并之前用根据本发明的变体或igiv(vol/vol)在37℃下孵育1小时的幼兔血清溶液。在37℃下孵育1小时后,将平板离心(125g,1分钟),并通过测量培养基中释放的细胞内ldh来评估cdc。结果表示为百分比抑制并且与ivig和阴性对照(无fc功能的fc)相比,100%对应于裂解活性的完全抑制,而0%对应于无fc或ivig获得的对照值。结果:结果显示于图4和5。如图5中所示,根据本发明的fc变体(a3a-184ay(hek))与ivig比较,更好地抑制表达cd64的jurkat细胞的活性、adcc和cdc。这些结果表明根据本发明的变体,如a3a-184ay,可以有效地用于涉及患者自身抗体的病理的治疗,特别是通过阻断患者效应细胞上的fc受体(参见图4)。实施例3:制备根据本发明的变体(突变的fc片段),在cho细胞中产生可以以实施例2中所述的相同方式,从seqidno:14获得重组fc片段。可以使用针对在这个细胞系中表达优化的载体,通过借助脂转染,如freestylemax试剂(thermofisher),通过转染至cho-s细胞中,来产生这个突变的fc片段。在37℃下,在受控气氛(8%co2)中,在135rpm摇动条件下,在cdforticho培养基+8mm谷氨酰胺中培养cho-s细胞。在转染的前一天,将细胞以6.105细胞/ml的密度接种。在转染当天,将线性化的dna(50μg)和50μl转染试剂(ta)在opti-prosfm培养基中分开预先孵育,并随后混合,并孵育20分钟,以允许dna/at复合物的形成。随后整个加入30ml体积的1.106细胞/ml的细胞制备物中。孵育48小时后,将转染试剂(新霉素1g/l和甲氨蝶呤200nm)加入细胞中。每3-4天测定细胞密度和生活力,并调节培养物体积,以维持高于6.105细胞/ml的细胞密度。生活力高于90%时,通过低温凝结(cryostaticcongelation)保存所获得的稳定库,并以“补料-分批”模式在搅拌条件下生产10天,生产过程中添加4g/l或6g/l葡萄糖。生产结束时,通过离心分离细胞和上清液。除去细胞并收集上清液,浓缩并在0.22μm下过滤。随后通过蛋白a树脂(hitrapproteina,gehealthcare)上的亲和色谱纯化fc片段。在pbs缓冲液平衡的树脂上捕获后,用25mm柠檬酸盐缓冲液ph=3.0洗脱fc片段,接着用1mtris快速中和ph,并随后在pbs缓冲液中透析,接着通过过滤灭菌(0.2pm)。实施例4:在cho细胞和转基因山羊奶中产生的变体的fcrn、cd16ah、cd16av、cd64和cd32a的结合测试使用以下分子进行fc受体结合:-根据实施例3中给出的方法,在cho细胞中产生的本发明的变体a3a-184aycho(k334n/p352s/a378v/v397m/n434y)、a3a-184ey_cho(y296w/k334n/p352s/a378v/v397m/n434y),根据实施例1中描述的方法在转基因山羊中产生的a3a-184ay_tgg;-在hek-293细胞(293-f细胞,invitrogenfreestyle)中产生了含有突变m252y/s254t/t256e/h433k/n434f的fcmst-hn片段,在文献中描述为具有优化的结合,只结合fcrn受体(ulrichts等,jci,2018);-通过用木瓜蛋白酶消化转基因山羊奶中产生的igg1获得的野生型fcfc-wt或fc-rec片段;-ivig人fcrn结合(hfcrn):使用a488标记的利妥昔单抗(利妥昔单抗-a488)和表达fcrn受体的jurkat细胞(jurkat-fcrn),通过竞争试验研究了fcrn结合。将jurkat-fcrn细胞以2.105细胞/孔的浓度接种于96孔平板(v底)中。随后将细胞用缓冲液中稀释的以下终浓度的测试分子在4℃下孵育20分钟:167μg/ml;83μg/ml;42μg/ml;21μg/ml;10μg/ml;5μg/ml;3μg/ml;1μg/ml;0μg/ml,并同时用25μg/ml利妥昔单抗-a488孵育。随后通过添加100μlph6的pbs并在4℃下在1700rpm下离心3分钟来洗涤细胞。随后除去上清液,并加入300μlph6的冷pbs。通过流式细胞术评价利妥昔单抗-a488与jurkat-fcrn细胞表达的fcrn的结合。将观察到的平均荧光强度(mfi)表示为百分比,其中100%是用单独的利妥昔单抗-a488获得的值,而0%是不存在利妥昔单抗-a488的值。使用“prism软件”计算诱导50%抑制利妥昔单抗-a488与jurkat-fcrn细胞的fcrn结合所需要的分子浓度。结果显示于以下的表2中。表2结果表明fca3a-184aycho、fca3a-184eycho和a3a-184ay-tgg变体显示出提高的利妥昔单抗-a488结合抑制(与ivig相比,×100)。本发明的变体显示出等于用fcmst-hn片段观察到的fcrn结合亲和力,fcmst-hn片段在文献中描述为只针对fcrn进行了优化(ulrichts等,jci,2018)。结合hcd64和hcd16ah、hcd16av、hcd32ah、hcd32ar受体:·结合人cd64(hcd64)使用利妥昔单抗-a488和表达cd64受体的jurkat细胞(jurkat-cd64),通过竞争试验研究了人cd64结合。将jurkat-cd64细胞以2.105细胞/孔的浓度接种于96孔平板(v底)中。随后将细胞与用缓冲液中稀释的以下终浓度的测试分子在4℃下孵育20分钟:167μg/ml;83μg/ml;42μg/ml;21μg/ml;10μg/ml;5μg/ml;3μg/ml;1μg/ml;0μg/ml,并同时用25μg/ml利妥昔单抗-a488孵育。随后通过添加1μlph6的pbs并在4℃下在1700rpm下离心3分钟来洗涤细胞。随后除去上清液,并加入300μlph6的冷pbs。通过流式细胞术评价利妥昔单抗-a488与jurkat-cd64细胞表达的cd64的结合。将观察到的平均荧光强度(mfi)表示为百分比,其中100%是用单独的利妥昔单抗-a488获得的值,而0%是不存在利妥昔单抗-a488的值。使用“prism软件”计算诱导利妥昔单抗-a488与jurkat-cd64细胞的cd64结合的50%抑制需要的分子浓度。·结合cd32ah和cd32ar使用利妥昔单抗-a488以及用cd32ah和cd32ar(hek-cd32)受体转染的hek细胞,通过竞争试验研究了人cd32受体结合。将hek-cd32细胞以2.105细胞/孔的浓度接种于96孔平板(v底)中。随后将细胞与用缓冲液中稀释的以下终浓度的测试分子在4℃下孵育20分钟:333μg/ml;167μg/ml;83μg/ml;42μg/ml;21μg/ml;10μg/ml;5μg/ml;3μg/ml;1μg/ml;0μg/ml,并同时用30μg/ml利妥昔单抗-a488孵育。随后通过添加100μlph6的pbs并在4℃下在1700rpm下离心3分钟来洗涤细胞。随后除去上清液,并加入300μlph6的冷pbs。通过流式细胞术评价利妥昔单抗-a488与hek-cd32细胞表达的cd32ah和cd32ar的结合。将观察到的平均荧光强度(mfi)表示为百分比,其中100%是用单独的利妥昔单抗-a488获得的值,而0%是不存在利妥昔单抗-a488的值。使用“prism软件”计算诱导利妥昔单抗-a488与hek-cd32细胞的cd32ah和cd32ar结合的50%抑制需要的分子浓度。·结合hcd16ah使用用藻红蛋白标记的鼠抗cd163g8(3g8-pe)和用人cd16ah受体转染的jurkat细胞(jurkat-cd16ah),通过竞争试验研究了与人cd16ah的结合。将jurkat-cd16ah细胞以2.105细胞/孔的浓度接种于96孔平板(v底)中。随后将细胞与用缓冲液中稀释的以下终浓度的测试分子在4℃下孵育20分钟:83μg/ml;42μg/ml;21μg/ml;10μg/ml;5μg/ml;3μg/ml;1μg/ml;0μg/ml,并同时用0.5μg/mlmab3g8-pe孵育。随后通过添加1μlph6的pbs并在4℃下在1700rpm下离心3分钟来洗涤细胞。随后除去上清液,并加入300μlph6的冷pbs。通过流式细胞术评价mab3g8-pe与jurkat-cd16ah细胞表达的cd16ah的结合。将观察到的平均荧光强度(mfi)表示为百分比,其中100%是用单独的mab3g8-pe获得的值,而0%是不存在mab3g8-pe的值。使用“prism软件”计算诱导mab3g8-pe与jurkat-cd16ah细胞的cd16ah结合的50%抑制需要的分子浓度。结果显示于以下的表3中。表3结果表明了与未突变的fc(fc-wt)相比,而且还与ivig相比,a3a-184aychofc、a3a-184eychofc和a3a-184ay_tgg变体对fcγriiia(cd16a)、fcγri(cd64)和fcγrila(cd32a)受体的亲和力提高。与mst-hn相比,本发明的突变体显示出对fcγriiia(cd16a)、fcγri(cd64)和fcγrila(cd32a)受体的亲和力显著提高。·结合人cd16av:将histaghcd16av(r&dsystem)受体固定于抗penta-his生物传感器(his1k)上,在动力学缓冲液(pall)中稀释至1μg/ml。在动力学缓冲液中的1000、500、250、125、62.5、31、25、15和0nm下测试了分子。-每个样品前加载-测试的设计:所有步骤在动力学缓冲液(pall)中进行基线1×60s加载400s基线2×60s缔合60s解离30s在再生缓冲液(甘氨酸10mmph1.5/中和:pbs)中再生5s-结果解释:使用1/1关联模型,将缔合和解离曲线(头5s)用于计算缔合(kon)和解离(koff)的动力学常数。然后计算kd(nm)(kon/koff)。结果显示于以下表4中。表4分子kdhcd16av(nm)sda3a-184ay_cho80.318.1a3a-184ey_cho59.37.7a3a-184ay_tgg51.210.7mst-hn268.283.6fc-wt314.172.7ivig339.0103.9sd:标准偏差结果表明fca3a-184aycho、fca3a-184eycho和a3a-184ay_tgg变体显示出对人fcγriiia-v受体(cd16a-v)的结合提高,并且将这与未突变的fc(fc-wt)进行比较,而且还与igm和含有m252y/s254t/t256e/h433k/n434f突变的fc片段mst-hn进行了比较。实施例5:在cho细胞和转基因山羊奶中产生的变体的adcc抑制和jurkat细胞激活测试使用以下分子进行了adcc抑制和jurkat细胞激活测试:-根据实施例3中给出的方法在cho细胞中产生的本发明的变体a3a-184aycho(k334n/p352s/a378v/v397m/n434y)、a3a-184ey_cho(y296w/k334n/p352s/a378v/v397m/n434y),-在hek-293细胞(293-f细胞,freestyleinvitrogen)中产生的含有m252y/s254t/t256e/h433k/n434f突变的fcmst-hn片段,在文献中描述为具有优化的结合,只结合fcrn受体(ulrichts等,jci,2018),-用木瓜蛋白酶消化转基因山羊奶中产生的igg1获得的野生型fc“fc-rec”或“fc-wt”片段,-igiv·adcc抑制测试:为了模拟在特发性血小板减少性紫癜(itp)中观察到的涉及itp患者自身抗体的红细胞裂解,在rhesusd(rhd)抗人单克隆抗体存在下,进行了效应细胞介导的红细胞裂解。并且例如通过与抗rhd竞争将fc受体固定在效应细胞表面上,评价了不同量的多价免疫球蛋白(igmv)或突变或未突变的重组fc片段抑制这种裂解的能力。通过adcc技术研究了抗rhd抗体的细胞毒性。简而言之,将效应细胞(单核细胞)(25至8×107细胞/ml)和rh阳性红细胞(最终25至4×107细胞/ml)与不同浓度(0至75ng/ml)的抗-rhd抗体孵育,效应子/靶比率为2/1。孵育16小时后,通过使用特异性底物(daf)定量释放至上清液中的血红蛋白来评估裂解。将结果表示为作为抗体量函数的特异性裂解百分比。对于mst-hn、fc-wta3a-184ay_cho、a3a-184ey_cho,在500、50、5、0.5μg/ml浓度下,对于igiv,在1500、150、15、1.5μg/ml浓度下,测试由分子(igm、mst-hn、fc-wta3a-184aycho、a3a-184eycho)诱导的adcc抑制。用“prism软件”计算诱导25%或50%抑制的分子浓度。结果显示于以下表5中。表5结果表明fc变体a3a-184aycho和a3a-184eycho与未突变的fc(fc-wt)以及与ivig相比,显示出对由抗rhesusd抗体引起的红细胞裂解的提高的抑制。此外,与含有m252y/s254t/t256e/h433k/n434f突变的fc片段mst-hn相比,a3a-184aycho或a3a-184eycho的抑制显著提高。·jurkatcd64细胞激活的抑制:这个测试评估了根据本发明的fc变体或ivig(总igg)抑制由raji细胞系与利妥昔单抗诱导的表达人cd64的jurkat细胞(jurkat-h-cd64)的il2分泌的能力。简而言之,将raji细胞(50ml,5×106细胞/ml)与利妥昔单抗(50ml,2mg/ml)、jurkath-cd64细胞(25ml,5×106细胞/ml)、佛波醇酯(pma,50ml,40ng/ml)混合,随后用1950nm的igiv或根据本发明的fc变体孵育。在孵育一夜后,将平板离心(125g,1分钟),并通过elisa评价上清液中含有的il2。通过ivig、fc-wt、mst-hn或根据本发明的fc变体(a3a-184aycho或a3a-184eycho)诱导了il2分泌的抑制,对于fc-wt、mst-hn片段或根据本发明的fc变体(a3a-184aycho或a3a-184eycho),以50和100μg/ml添加,对于igvi,以150和300μg/ml添加。用“prism软件”计算了诱导25%或50%抑制的分子浓度。结果显示于以下的表6中。表6结果表明与未突变的fc(fc-wt)相比以及与ivig相比,a3a-184ay-cho和a3a-184ey-chofc变体显示出提高的il2分泌抑制。此外,与含有m252y/s254t/t256e/h433k/n434f突变的mst-hnfc片段相比,a3a-184aycho或a3a-184eycho的抑制显著提高。实施例6:fc变体与血细胞结合的测试用以下分子进行血细胞结合测试:-根据实施例3中给出的方法在cho细胞中产生本发明的变体a3a-184aycho(k334n/p352s/a378v/v397m/n434y)、a3a-184ey_cho(y296w/k334n/p352s/a378v/v397m/n434y),在根据实施例1中所述的方法中在转基因山羊中产生a3a-184ay_tgg,-在hek-293细胞(293-f细胞,freestyleinvitrogen)中产生了含有突变m252y/s254t/t256e/h433k/n434f的片段fcmst-hn,在文献中描述为具有优化的结合,只结合fcrn受体(ulrichts等,jci,2018);-通过用木瓜蛋白酶消化转基因山羊奶中产生的igg1获得的野生型fc“fc-rec”或“fc-wt”片段;-igiv将用alexa标志物(高荧光蛋白标志物)标记的分子在65nm下(对于2%csfpbs中的fc,10μg/ml)与靶细胞在冰上孵育20分钟。在2%csf中洗涤2次后,将细胞悬浮于500mlisoflow中,接着进行流式细胞术分子。对以下细胞进行测试:-用抗cd56标记的自然杀伤(nk)细胞(“%阳性nk细胞”);-用抗cd14标记的单核细胞(“%阳性细胞”);-用抗cd14和抗cd163g8抗体标记的cd16+单核细胞(“%阳性细胞”);-用抗cd15标记的嗜中性粒细胞(“%阳性细胞”)使用抗cd163g8抗体证明了fcγriii受体(cd16)。结果表明变体fca3a-184aycho、a3a-184eycho和a3a-184ay_tgg,无论生产方式,与非突变fc(fc-rec)相比以及与igiv相比,都给予了提高的结合。此外,针对nk细胞、cd16+单核细胞和嗜中性粒细胞,与mst-hn片段相比,a3a-184ay或a3a-184ey的结合显著提高(参见图6)。实施例7:特发性血小板减少性紫癜(itp)的体内模型测试通过静脉内注射抗血小板抗体6a6-higg1(0.3pg/g体重)以耗尽小鼠的血小板,在表达人源化fcrn(mfcrn-/-hfcrntg276异源b6基因背景的小鼠(thejacksonlaboratory)中诱发疾病。在注射6a6-higg1前24小时,诱发疾病后4h,进行了血液测试(凝血细胞的数量)。在血小板耗尽前2小时,腹膜内给药了igiv(1000mg/kg)、fc-rec(380和750mg/kg)、fcmst-hn(190mg/kg)和fca3a-184aycho(190mg/kg和380mg/kg)。用adviahematology系统(bayer)测定了血小板数。将注射抗体前的血小板数量设定为100%。抗血小板抗体6a6-higg1(0.3μg/g)使得可以耗尽90%的血小板。耗尽血小板前2小时施用药物候选物可以恢复(图7):·380mg/kg剂量的a3a184aycho,100%血小板·190mg/kg剂量的a3a-184aycho,106%血小板;·1000mg/kg剂量的igiv,90%血小板;·750mg/kg剂量的fc-wt,64%血小板;·380mg/kg剂量的fc-wt,75%血小板;·190mg/kg剂量的mst-hn变体,61%的血小板。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1