新型爱德华氏菌减毒靶点及其应用的制作方法
本发明属于减毒活疫苗研发领域;更具体地,本发明涉及一种新的爱德华氏菌减毒靶点的鉴定及应用。
背景技术:
随着人民群众生活水平的提高,人们对海产品的需求量越来越大,中国水产业的养捕比逐年提高。据统计,2016年中国水产养殖面积达到8346千公顷,养殖水产品总量为5142万吨,水产养殖产量占渔业总产量的75%,约占世界养殖总产量的60%。规模化、集约化、高密度的养殖模式逐渐成为中国鱼类养殖业的发展主流。然而,随着渔业养殖的不断稳步发展,产生的潜在问题就是水产养殖病害问题的日益严重。病害一旦出现,会造成大面积的水体污染,不仅对水产养殖动物有极高的致死率,也严重威胁着人们的身体健康。据统计,水产养殖业每年病害发生率高达50%,损失近20%。养殖产量及成长造成严重影响,已成为制约中国水产养殖业发展的重要因素之一。
针对各种病害的发生,以抗生素为代表的化学疗法对病害的控制和防治曾发挥了积极作用。但是,这种病害控制措施造成的环境污染、抗药病原的大量出现、水产品的药物残留等负面影响日趋严重。在欧盟、美国和加拿大,以抗生素为主的化学药物在水产养殖业中已逐渐被禁用。其中,根据欧盟食品安全白皮书的规定,欧盟国家禁止使用抗生素药物的养殖水产品进入贸易市场。日本也开始限制使用多种抗生素药物用于养殖鱼类和虾类病害的防治。
在中国,人们对水产品安全越来越关注,对环境保护的呼声日益高涨,采用各种化学药物防治水产养殖动物病害的方式也越来越多地受到了质疑。因此疫苗在提高动物体特异性免疫水平的同时亦能增强机体抗应激的能力,且符合不污染环境、水产食品无药物残留的要求,已成为当今世界水生动物疾病防治界研究与开发的主流产品。为了满足消费者对绿色水产品的需求,同时保护养殖环境达到可持续利用的目的,近年来,世界各国都在积极开展水产用疫苗的研制。
疫苗具有针对性强、抗病周期长、可终身免疫、效果显著和防治主动的特点。以病原菌细胞灭活体为基础形式的灭活疫苗(killvaccine)为水产养殖病害防治提供了有效手段。如弧菌疫苗,hitra病毒苗和红嘴病菌苗等革兰氏阴性菌的带病原的菌苗,已可以通过液体发酵和福尔马林灭活进行生产。这些疫苗可以通过注射或浸泡的方法使用。用于疫苗制备的血清型涵盖了所有菌株,并且疫苗使用方法正确,这类疫苗是很有效的。近年来,灭活疫苗中如用于抗大麻哈鱼传染性胰腺坏死病的ipnv疫苗、抗鲑鱼传染性造血器官坏死症的ihnv疫苗和抗草鱼出血症感染的gcrv疫苗等已得到成功应用。
水产养殖业的产业特点要求病害防治技术必须经济、应用实施方便。因此,疫苗产品的开发除高效价的技术要求外,免疫成本必须低廉,不能超出养殖业的承受能力。减毒活疫苗因具有给药方便(可浸泡给药)、免疫效价高(可减少给药剂量)、成本低廉、可开发广谱疫苗(活菌疫苗往往具有交叉保护性)的新技术优势,已成为当前国际上水产养殖用疫苗研究和开发的热点和前沿领域。并且构建的减毒株具有表达异源抗原以开发多效价疫苗(特别是针对病毒病害)的潜在价值,也成为疫苗开发的国际前沿和热点领域。
爱德华氏菌属是导致淡水、海水养殖鱼类细菌性疾病的一类常见的病原体,具体分为迟钝爱德华氏菌(edwardsiellatarda),鲶鱼爱德华氏菌(edwardsiellaictaluri)和保科爱德华氏菌(edwardsiellahoshinae)。由其引起的鱼类出血性败血症统称为爱德华氏菌病(edwardsiellosis)。该病传播面积广,无明显季节性,感染率及死亡率高,危害的种类多,有鲤鱼,罗非鱼,鳗鲡,鲻鱼,鲑鱼,鳟鱼,鲆鲽等大多数具有较高经济价值的鱼种。此外,迟钝爱德华氏菌还感染贝类、爬行类、两栖类、鸟类、哺乳类。值得注意,迟钝爱德华氏菌还是一种重要的人畜共患病原菌,它是爱德华氏菌属中唯一感染人类的成员。目前,中国养殖鱼类爱德华氏菌病病害比较严重的病原体主要为迟钝爱德华氏菌,并有存在病原体向人体转移的巨大威胁。
因此,筛选有效的减毒突变株,并将其开发为针对爱德华氏菌的减毒活疫苗,对水产养殖病害防治具有重要意义。
技术实现要素:
本发明的目的在于提供新型爱德华氏菌减毒靶点及其应用。
在本发明的第一方面,提供一种爱德华氏菌减毒株,所述的减毒株中etae_0023基因基本上不表达。
在一个优选例中,所述的减毒株中etae_0023基因或基因片段被下调;较佳地,所述的下调包括:敲除或沉默etae_0023基因,或抑制etae_0023蛋白的活性。
在另一优选例中,所述的下调包括:以同源重组方法敲除etae_0023基因,以特异性干扰etae_0023基因表达的干扰分子来沉默etae_0023,以基因编辑方法敲除etae_0023基因。
在另一优选例中,所述的同源重组方法包括无标记框内缺失突变法。
在另一优选例中,etae_0023基因中第4~573位被删除
在另一优选例中,所述的爱德华氏菌包括(但不限于):杀鱼爱德华氏菌(edwardsiellapiscicida),迟钝爱德华氏菌(edwardsiellatarda),鮰爱德华氏菌(edwardsiellaictaluri),保科爱德华氏菌(edwardsiellahoshinae)。
在另一优选例中,所述的etae_0023蛋白为具有seqidno:2所示的氨基酸序列的蛋白。
在另一优选例中,所述的etae_0023基因为具有seqidno:1所示的核苷酸序列的基因。
在另一优选例中,所述的减毒株与野生型菌株相比,具有显著降低的定殖能力,以及对细胞的粘附能力。
在另一优选例中,所述的爱德华氏菌为一种通过无标记框内缺失突变法获得的菌株,在中国典型培养物中心的保藏号为:cctccno.m2019019。
在本发明的另一方面,提供所述的爱德华氏菌减毒株的用途,用于制备抑制爱德华氏菌的组合物;或用于诱导爱德华氏菌宿主产生对抗爱德华氏菌的免疫保护力;较佳地所述组合物为疫苗。
在一个优选例中,所述的减毒株诱导鱼类产生对抗爱德华氏菌的免疫保护力。
在另一优选例中,所述的鱼类包括(但不限于):鲽形目的鱼,鲤形目的鱼,鲈形目的鱼。
在另一优选例中,所述的鱼类包括(但不限于):鲽形目鲆科的鱼(如大菱鲆),鲤形目鲤科的鱼(如斑马鱼,鲇鱼,鳗鲡,比目鱼,大马哈鱼,罗非鱼等)。
在本发明的另一方面,提供一种组合物,其含有所述的爱德华氏菌减毒株和药学上可接受的载体;较佳地,所述的组合物为疫苗。
在本发明的另一方面,提供一种降低爱德华氏菌的毒性的方法,包括:下调其基因组中etae_0023基因的表达或下调etae_0023蛋白的活性。
在本发明的另一方面,提供一种爱德华氏菌etae_0023基因或etae_0023蛋白的下调剂的用途,用于制备抑制爱德华氏菌毒性的组合物。
在另一优选例中,所述的下调剂包括:敲除或沉默etae_0023基因、或抑制etae_0023蛋白的活性的试剂。
在另一优选例中,所述的下调剂包括:以同源重组方法敲除etae_0023基因、以特异性干扰etae_0023基因表达的干扰分子来沉默etae_0023、或以基因编辑方法敲除etae_0023基因的试剂。
在本发明的另一方面,提供一种etae_0023基因或etae_0023蛋白的用途,用于鉴定待测爱德华氏菌的毒性。
在本发明的另一方面,提供一种鉴定待测爱德华氏菌毒性的方法,包括:检测待测爱德华氏菌中etae_0023基因的表达或etae_0023蛋白的活性,
若相对于野生型爱德华氏菌,待测爱德华氏菌etae_0023基因表达或etae_0023蛋白活性提高,则该爱德华氏菌具有一般毒性或高的毒性;
若相对于野生型爱德华氏菌,待测爱德华氏菌etae_0023基因表达或etae_0023蛋白活性降低,则该爱德华氏菌具有低的毒性或无毒性(为减毒株)。
本发明的其它方面由于本文的公开内容,对本领域的技术人员而言是显而易见的。
附图说明
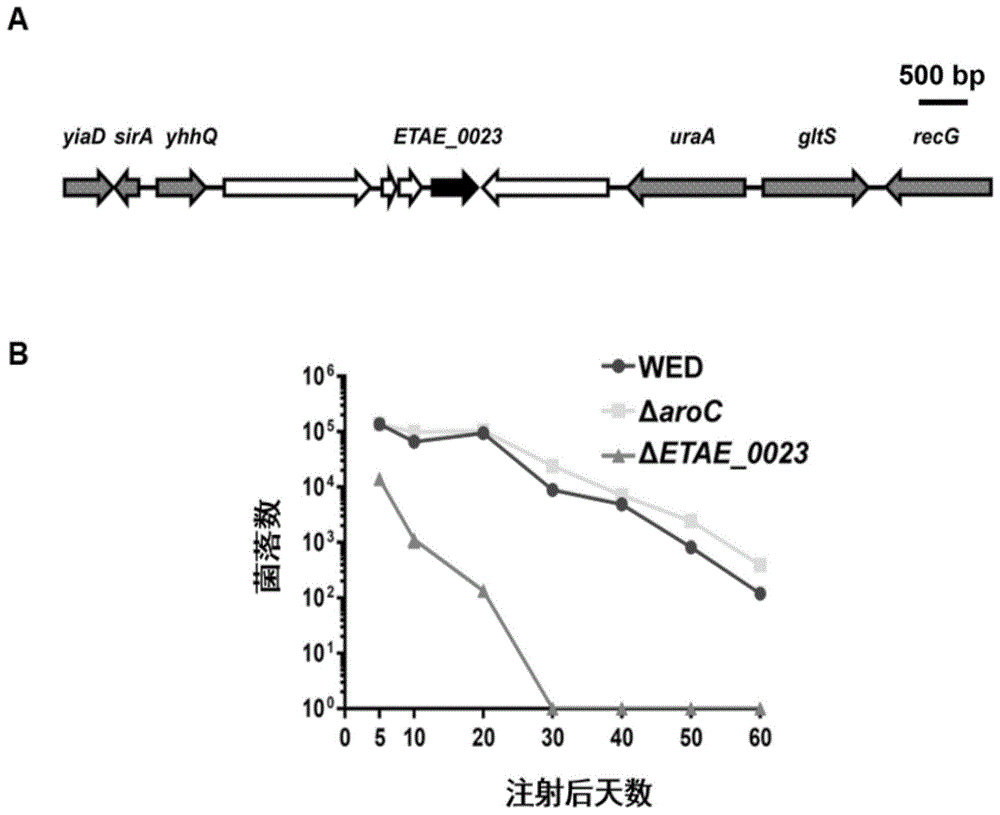
图1、减毒基因靶点。
a、减毒基因靶点在基因组中的位置,疫苗株的缺失位置同样如此。
b、疫苗株的安全性。wed为已报道的减毒活疫苗菌株,aroc为已报道的减毒基因靶点。
图2、减毒疫苗株免疫原性。
a、注射不同疫苗菌株后,宿主的血清对爱德华氏菌的杀菌能力。pbs为无菌的磷酸盐缓冲液,fkc为福尔马林浸泡过的野生型爱德华氏菌。疫苗株都溶于pbs后注射。
b、注射不同疫苗菌株后,宿主体内免疫因子的表达水平。
图3、免疫攻毒。
a、宿主接种不同疫苗后,野生型爱德华氏菌在宿主体内的存活状态。
b、接种不同疫苗后,宿主对野生型爱德华氏菌的免疫能力。
具体实施方式
本发明人经过深入的研究,首次在爱德华氏菌中鉴定获得一种毒性相关的基因――etae_0023基因。通过在爱德华氏菌中构建了etae_0023基因缺失株,证明etae_0023基因的表达与爱德华氏菌的毒性表现密切相关。因此,可以以该etae_0023基因为靶点,开发爱德华氏菌减毒株以及减毒疫苗,用于爱德华氏菌病的免疫预防。
本发明提供一种爱德华氏菌减毒株,该减毒株中etae_0023基因不表达或基本上不表达。
本发明中,所述的“基本上不表达”是指爱德华氏菌减毒株中etae_0023基因不表达或低表达。其中,etae_0023基因低表达是指该减毒株中etae_0023基因的表达量低于野生型爱德华氏菌的20%;较佳地低于野生型爱德华氏菌的10%;更佳地于野生型爱德华氏菌的5%或更低,最佳地低于野生型爱德华氏菌的2%或更低。etae_0023基因基本上不表达的菌株可以通过各种基因敲除、基因抑制、基因沉默、基因编辑等技术来构建。
etae_0023基因为爱德华氏菌保守的未知功能的基因,其在ncbi数据库中编号为wp_012846906.1。etae_0023基因存在于几乎所有爱德华氏菌种属中,其突变可导致爱德华氏菌在宿主体内生存能力的显著下降。鉴于该基因在所有爱德华氏菌种属中的保守性,针对该基因的调控适用于所有中枢的爱德华氏菌,具有普适性。
所述的etae_0023基因具有seqidno:1所示的核苷酸序列,也包含其部分碱基被替换的变体,也包含其同源物(也即来源于不同种属的爱德华氏菌但是高度同源的基因(如同源性高于80%,85%,90%,95%,98%,99%));所述的etae_0023基因编码etae_0023蛋白,etae_0023蛋白具有seqidno:2所示的氨基酸序列,也包含其部分氨基酸被替换的变体,也包含与其发挥相同功能的同源物(也即来源于不同种属的爱德华氏菌但是高度同源的蛋白(如同源性高于80%,85%,90%,95%,98%,99%))。所述的etae_0023的基因也包括截短形式的etae_0023的基因或蛋白,只要该基因片段在被下调(如敲除)后可导致etae_0023蛋白不表达或表达异常,或其表达的etae_0023蛋白片段活性降低或没有活性。根据本发明的揭示,本领域人员非常容易获得所述的etae_0023的基因或蛋白片段。
在得知了所述的etae_0023与爱德华氏菌的毒性表现的相关性后,可以采用本领域人员熟知的多种方法来调节(下调)etae_0023的基因表达或蛋白活性。包括但不限于:(a)在爱德华氏菌中敲除或沉默etae_0023基因;(b)将下调etae_0023基因或蛋白的下调剂转入爱德华氏菌中;或(c)调节爱德华氏菌中etae_0023的上游信号通路或上游基因,以下调爱德华氏菌中etae_0023基因表达或蛋白活性。
可以采用多种本领域已知的方法在爱德华氏菌株中下调etae_0023基因表达或蛋白活性,包括但不限于:基因沉默、基因阻断、基因敲除、基因抑制等。这些方法均被包含在本发明中。
一种优选的下调etae_0023基因的方法是基因阻断技术,在本发明的优选实施方式中,体外构建etae_0023基因阻断质粒,基于同源重组的原理,通过无标记框内缺失突变法实施改造,从而使得染色体上的无标记框内缺失突变法不再能够编码活性的蛋白质。此外,也可通过在该基因中删除部分区域,或者插入无关序列来实施进行基因阻断时。无关序列的选择是本领域技术人员易于选择到的,例如应用一些抗性基因,此类基因可能有利于后续选择出发生基因被阻断或敲除的菌株。
在本发明的优选方式中,提供一株减毒疫苗株,为基因etae_0023的无标记框内缺失株,本发明人将其命名为eibeva0023,其保藏号为:cctccm2019019。相对于野生株,具有显著降低的定殖能力,以及对细胞的粘附能力。经验证,其免疫原性显著,体内清除率高,具有非常理想的安全性及免疫应答效果。
此外,作为本发明的一种可选择的操作方式,可采用crispr/cas9系统进行基因编辑,从而敲除etae_0023基因。合适的sgrna靶位点,会带来更高的基因编辑效率,所以在着手进行基因编辑前,先设计并找到合适的靶位点。在设计特异性靶位点后,还需要进行体外细胞活性筛选,以获得有效的靶位点用于后续实验。
本发明还涉及etae_0023基因或蛋白的其它下调剂(如反义的核酸,sirna,mirna,shrna,反义核苷酸等)或下调方式。任何可抑制etae_0023蛋白的活性、下调etae_0023蛋白的稳定性、抑制etae_0023基因的表达、减少etae_0023蛋白有效作用时间、或降低etae_0023基因的转录和翻译的物质均可用于本发明,作为可用于使得爱德华氏菌减毒的试剂。
所述的爱德华氏菌减毒株可以用于研究etae_0023基因基本上不表达后对于爱德华氏菌中其它基因表达情况的影响。更为重要的,所述的爱德华氏菌减毒株可以用于制备疫苗,来免疫生物体如鱼类,从而在不对生物体造成危害的情况下使得动物对爱德华氏菌感染产生免疫力。
本发明还提供了一种组合物,其含有有效量(如0.0001-10wt%;较佳的0.001-5wt%)的所述的爱德华氏菌减毒株以及药学上可接受的载体。优选的,所述的组合物是疫苗,其可用于免疫生物体,使生物体内产生抗体,从而抵御爱德华氏菌的感染。所述的组合物对于生物体没有可见的毒性和副作用。所述的生物体是爱德华氏菌宿主,特别是一些鱼类。较佳地,所述的鱼类包括(但不限于):鲽形目的鱼,鲤形目的鱼,鲈形目的鱼;更佳地,包括(但不限于):鲽形目鲆科的鱼(如大菱鲆),鲤形目鲤科的鱼(如斑马鱼,鲇鱼,鳗鲡,比目鱼,大马哈鱼,罗非鱼等)。
如本文所用,所述的“含有”,“具有”或“包括”包括了“包含”、“主要由……构成”、“基本上由……构成”、和“由……构成”;“主要由……构成”、“基本上由……构成”和“由……构成”属于“含有”、“具有”或“包括”的下位概念。
所述“有效量”是指可对人和/或动物产生功能或活性的且可被生物体(如鱼类)所接受的量。所述“药学上可接受的载体”指用于治疗剂给药的载体,包括各种赋形剂和稀释剂。该术语指这样一些药剂载体:它们本身并不是必要的活性成分,且施用后没有过分的毒性。合适的载体是本领域普通技术人员所熟知的。在组合物中药学上可接受的载体可含有液体,如水、盐水、缓冲液。另外,这些载体中还可能存在辅助性的物质,如填充剂、润滑剂、助流剂、润湿剂或乳化剂、ph缓冲物质等。所述的载体中还可以含有细胞转染试剂。对于疫苗,所述的药学上可接受的载体例如包括佐剂。所述组合物在用于给药时,通常1×103-1×109个细胞/kg体重,较佳的1×104-1×108个细胞/kg体重是适合的;优选的可进行多次给药,以产生良好的免疫效果,例如可间隔1-3周进行重复给药。
所述的etae_0023的基因还可以作为一种爱德华氏菌毒性鉴定的标志物。例如可通过检测待测爱德华氏菌中etae_0023基因的表达情况来确定爱德华氏菌的毒性;若相对于野生型爱德华氏菌,待测爱德华氏菌etae_0023基因正常表达或过表达(即相对于野生型爱德华氏菌,待测爱德华氏菌中etae_0023基因的表达高20%或更高,更佳的高50%或更高),则该爱德华氏菌具有一般毒性或高的毒性;若相对于野生型爱德华氏菌,待测爱德华氏菌etae_0023基因低表达(如低20%或更低;更佳地低50%或更低)或不表达,则该爱德华氏菌具有低的毒性或无毒性。或例如可通过检测待测爱德华氏菌中etae_0023蛋白的活性来确定爱德华氏菌的毒性;若相对于野生型爱德华氏菌,待测爱德华氏菌etae_0023蛋白活性正常或过于激活(即相对于野生型爱德华氏菌,待测爱德华氏菌中etae_0023蛋白的活性高20%或更高,更佳的高50%或更高),则该爱德华氏菌具有一般毒性或高的毒性;若相对于野生型爱德华氏菌,待测爱德华氏菌etae_0023蛋白的活性降低(即相对于野生型爱德华氏菌,待测爱德华氏菌中etae_0023蛋白的活性低20%或更低,更佳的低50%或更低),则该爱德华氏菌具有低的毒性或无毒性。
本发明还提供了一种筛选抑制爱德华氏菌的毒性的潜在物质的方法,所述方法包括:向表达etae_0023蛋白的体系中添加待筛选的候选物,并检测etae_0023蛋白的表达情况;如果etae_0023蛋白的表达情况在统计学上减弱,就表明该候选物是抑制爱德华氏菌的毒性的潜在物质。作为本发明的优选方式,所述的方法还包括:对获得的潜在物质进行进一步的爱德华氏菌毒性抑制或菌丝生长抑制试验,以进一步选择和确定对于抑制爱德华氏菌毒性有用的物质。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如j.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社,2002中所述的条件,或按照制造厂商所建议的条件。
材料和方法
1、生物材料
pdm4质粒:参见xiaoj,wangq,liuq,etal.characterizationofedwardsiellatardarpos:effectonserumresistance,chondroitinaseactivity,biofilmformation,andautoinducersynthetasesexpression.applmicrobiolbiotechnol2009;83(1):151-160中的记载。
大肠杆菌e.colidh5αλpir和e.colism10λpir:均来自中国疾病控制中心流行病研究所。
杀鱼爱德华氏菌毒株eib202:已于2008年5月1日提交武汉大学的中国典型培养物保藏中心(cctcc)保藏,保藏号为cctccno:m208068。该菌株的相关记载另可见于“isolationandidentificationoffishpathogenedwardsiellatardafrommaricultureinchina”,肖婧凡等,《aquacultureresearch》,vol.40,2009。
杀鱼爱德华氏菌减毒株wed:已于2010年10月24日提交武汉大学的中国典型培养物保藏中心(cctcc)保藏,保藏号为cctccno:m2010278。该菌株的相关记载另可见于中国专利申请公开cn101974472a。
杀鱼爱德华氏菌eibav0023:已于2019年1月7日提交武汉大学的中国典型培养物保藏中心(cctcc)保藏,保藏号为cctccm2019019。
所有菌株-80℃保存于含20%甘油的lb培养基中。杀鱼爱德华氏菌的培养温度为30℃,大肠杆菌的培养温度为37℃,无特殊说明时液体培养所采用摇床转速为200rpm。当需要时,在培养基中添加抗生素:多粘菌素(polymyxin,col,16μg/ml)、氯霉素(chloramphenicol,cm,34μg/ml)。注射鱼体前,用pbs洗细菌2次并稀释。
lb液体培养基:按酵母粉5g/l,胰蛋白胨10g/l,nacl10gll称取各组分,加入去离子水后用10mol/lnaoh调ph至7.0,并用去离子水定容。混匀后121℃高压蒸气灭菌25min。
lb固体琼脂培养基:按酵母粉5g/l,胰蛋白胨10g/l,nacl10g/l,琼脂15g/l称取各组分,加入去离子水后用10mol/lnaoh调ph至7.0,并用去离子水定容。混匀后121℃高压蒸气灭菌25min。
10×tae缓冲液:将242gtris碱溶于600ml双蒸水中,加入57.1ml冰乙酸和37.2g的na2edta·2h2o,定容至1000ml。使用前稀释10倍。
1%琼脂糖凝胶:称取1.0g琼脂糖溶于100ml1×tae缓冲液中,在微波炉中加热2min左右,待琼脂糖完全溶解后迅速倒入制胶台,冷却15分钟后即可点样电泳。
pbs(1l):8.0gnacl,0.2gkcl,1.44gna2hpo4,0.24gkh2po4,加1l去离子水混匀。
生理盐水:nacl9g/l,ph7.2,121℃灭菌20分钟。
大菱鲆:购自山东烟台天源渔场,体重25g±5g,所有实验前预先在实验室适应养殖一周,保持水温16℃,上下波动2℃。一周后,取组织研磨,涂板,检测是否有其它病原菌。
2、组织rna抽提、消化、逆转录
1)将需要抽提rna的样品取出解冻,然后用移液枪移除样品保存液,取一小块组织,约50mg,加入200μltrizol试剂,在冰上用组织研磨器和研磨棒研磨至匀浆状态。
2)匀浆完成后,加入800μltrizol试剂,然后在室温放置5min。
3)将匀浆样品在4℃12000r/m(约13000g)下离心10min,取上清。
4)每加入500μltrizol试剂需要加入100μl氯仿,在上述匀浆样品中加入200μl氯仿,充分震荡混合30s,然后室温放置3min。
5)4℃12000r/m下离心15min后,用移液器将水相层尽量多的取出放于新的1.5ml离心管。
6)加入等体积的异丙醇,上下颠倒充分混匀,室温静置半小时后,4℃12000r/m下离心10min,去除上清。
7)用rnase-free级的双蒸水配制75%的乙醇,将得到的rna洗涤2次,每次500μl,每次洗涤完,在4℃7500r/m下离心3min。
8)用rnase-free级的双蒸水配制75%的乙醇,将得到的rna洗涤2次,每次500μl,每次洗涤完,在4℃7500r/m下离心3min。洗涤完,离心后,倒出液体,室温敞口晾干,加入30-100μlrnase-free级的双蒸水,反复吹打,直到rna完全溶解。用核酸定量仪nanodrop2000测定rna浓度以及od260/280的比值。将rna放置于-80℃冰箱长期保存或者冰浴待用。
9)对抽提的rna进行消化去除残留的dna,消化反应体系如下:
37℃水浴消化30min,然后加入1μlstopsolution,65℃水浴10min终止反应。将反应后的产物按照逆转录试剂盒说明书流程进行逆转录,形成cdna,冰浴待用或者放入-20℃冰箱备用。逆转录反应体系如下:
37℃逆转录反应15min后,85℃终止反应5s,得到的cdna可作为后续rt-qpcr的模板。
荧光定量pcr:用sybrgreen染料法进行组织中抗原识别与递呈相关基因转录水平检测,荧光定量pcr过程首先进行特异性引物设计,引物设计遵循设计引物的原则,并通过软件检测引物的扩增效率以及熔解曲线,确定引物的特异性,对于特异性不好的引物,要重新设计。具体步骤如下:
1)通过ncbi上斑马鱼和大菱鲆基因信息用beacondesigner引物设计软件设计并合成引物。
2)用对照组斑马鱼以及大菱鲆肝脏rna逆转录成的cdna,分别用无菌ddh2o梯度稀释4倍、16倍、64倍、256倍。
3)斑马鱼肝脏模板对应斑马鱼上各基因的引物进行rt-qpcr,大菱鲆肝脏cdna模板对应大菱鲆上各基因的引物进行荧光定量pcr,定量pcr反应体系如下:
反应过程:95℃7min(热启动);(95℃30s;60℃60s)循环40次(荧光信号采集);以1℃/min的速率升温从60℃升至95℃,荧光信号在每个温度点下采集。每个反应三个复孔。
4)以β-actin为内参基因,免疫组各免疫基因相对对照组的相对表达量(relativeexpression)=2-δδct,其中δδct=(目的基因ct值-内参基因ct值)免疫组-(目的基因ct值-内参基因ct)对照组。对于每个样品每个时间点每组三个复孔平行实验即为技术重复,进行三批重复实验,即为生物重复。
3、疫苗安全性测试
用健康的大菱鲆考察疫苗株的安全性,将疫苗株通过腹腔注射的方式给药至鱼体内。在选定的时间点,将鱼从鱼缸中捞出,使用间氨基苯甲酸乙酯甲磺酸盐(ms-222)(0.02%,v/v)对鱼麻醉10min后进行解剖,取出肝脏、脾脏和肾脏分别放入无菌的1.5ml离心管中,加入200μl灭菌的冰冷生理盐水,使用电动研磨器进行组织匀浆化。对组织匀浆液进行梯度稀释,涂布在含有col的lb平板上,在30℃过夜培养后进行计数。
5、血清杀菌计数
将eib202野生株过夜培养,取30μl稀释至2×106cfu/ml,与270μl免疫鱼的血清混合后,在30℃培养箱中保温培养,8h后,梯度稀释混合液,涂布在含有col的lb平板上,过夜培养后计数。实验取三次重复。
ld50测定:以105~108cfu/尾4个梯度的剂量对大菱鲆作腹腔注射,每个剂量注射10条鱼。将注射后的大菱鲆分在相同条件的不同鱼缸中,观察并记录28天中鱼的死亡数量。用reed-muench法计算各菌株的半致死剂量(ld50),根据实验动物体重换算成cfu/g体重。其计算公式如下:
ld50=10[xm–i(∑p–0.5)]
其中:
xm:最大剂量的对数值
i:相邻两组剂量对数值之差
p:各组动物死亡率,用小数表示(如:死亡率为80%则写成0.8)
∑p:各组动物死亡率之总和
免疫保护实验:以3×105cfu/g剂量腹腔注射免疫健康大菱鲆,试验所用大菱鲆随机分为5组,每组3个平行水槽,30尾/槽。将制备的减毒活疫苗采用尾部腹腔注射方式免疫。实验组注射疫苗株,对照组注射等体积pbs。免疫期为一个月,每天观察实验动物健康状况。在免疫1个月后,对照组注射无菌生理盐水没有出现死亡情况,以野生型杀鱼爱德华氏菌eib202(3×105cfu/g)对其进行攻毒,连续考察4周,检测肾脏中病原菌的数量,同时统计累计死亡率并计算相对免疫保护力(图3b)。
其中,按下列公式计算免疫保护率:相对免疫保护率(rps)%=(对照组死亡率%–免疫组死亡率%)/对照组死亡率%×100%。
实施例1、无标记框内缺失株构建
etae_0023的基因序列(seqidno:1)为:
atgggtaatttagtgaagttgatcggcgtcgggctgttggttaccggactggccgcctgcgatggcagctccaccgcggagaccaacgcaccggcgcagggtgcgagcgcgactcagcccagcgtgccggcgggtgccaaagtcagcctgttagacggtaagattggctttacgctgcctgcgggactgagcgatcagaccagcaagctgggctcacagaccaacaatatgtccgtgtatgccaataaaaccgggcagcaggcggtgatcgtcatcttggcgccgatgccgcaggataacctgaataccctgtcgacccgcctgattgaccagcagaaatcacgcgacgccagcctgcagctggtctcgtctgagagcgttaagctgggtggaaaggacgttgagaaggtcgtgagtatgcagcaggcgaacggtcacgccatctactccagcattatcttagcccaggtcggcgatcagctgatgaccatgcagatctccctgccgggcgataatcgccaagaagcggccaatatcgccaacggcgtgctcaataccctctcctttgcccaataa
etae_0023的氨基酸序列(seqidno:2)(191aa)为:
mgnlvkligvgllvtglaacdgsstaetnapaqgasatqpsvpagakvslldgkigftlpaglsdqtsklgsqtnnmsvyanktgqqavivilapmpqdnlntlstrlidqqksrdaslqlvssesvklggkdvekvvsmqqanghaiyssiilaqvgdqlmtmqislpgdnrqeaaniangvlntlsfaq
本实验中,采用pdm4质粒构建框内无标记缺失株。
1)抽提pdm4质粒,用sali/xbai于37℃水浴中进行酶切1~1.5小时。酶切后的质粒进行dna琼脂凝胶电泳分离,选取9000bp大小条带,割胶回收,回收后的线性dna放置于-20℃备用。
1)以eib202基因组为模板,用0023-p1/0023-p2引物对和0023-p3/0023-p4引物(表1)对扩增目的基因上下游片段,经琼脂糖凝胶电泳,纯化回收。
2)将上下游片段和酶切后的pdm4按照摩尔数3:1:1混合后加入itamix,于50℃水浴1小时,热激转入dh5αλpir,活化1小时候,涂氯霉素lb琼脂板。平板放入37℃培养箱过夜培养。
3)挑选单克隆,用通用引物pdm4-f/pdm4-r验证阳性质粒。
4)阳性克隆接种到新鲜lb中,37℃,200rpm,过夜后抽质粒,测序。将测序正确的质粒转入sm10λpir,并保种。
5)将sm10λpir和eib202进行接合实验,接合后的菌液涂至氯霉素和多粘菌素lb琼脂平板,37℃培养过夜。挑选单克隆,用pdmk-f/0023-out-r或pdmk-r/0023-out-f验证单交换,挑选阳性,接至氯霉素和多粘菌素lb,并保种。同时接至12%蔗糖lb液体培养基中,诱导14h。
6)取诱导后的菌液划线于12%蔗糖lb琼脂板上,37℃培养过夜。挑取周围没有雾圈的单克隆,用0023-out-f/0023-out-r引物验证。阳性克隆再次用0023-in-f/0023-in-r引物验证。阳性克隆称为δetae_0023,其etae_0023基因的第4~573位被删除(seqidno:1中第4~573位),其直接用作疫苗进行后续的实验。
表1、引物序列
实施例1、疫苗株安全性测试
选择已报道的减毒活疫苗菌株wed和δaroc做对比,将疫苗株δetae_0023、wed和δaroc分别以3×105cfu/尾的剂量腹腔注射至鱼体内,分别在第5、10、20、30、40和50天(图1b)取鱼肾脏研磨涂板,进行疫苗株安全性测试。
结果显示,与wed和δaroc等疫苗株相比,eibva0023(δetae_0023)具有更高的安全性,在30天便已从体内被完全清除。
实施例2、免疫原性测试
选择已报道的减毒活疫苗菌株wed和δaroc作为阳性对照,pbs和fkc作为阴性对照,将疫苗株δetae_0023、wed和δaroc分别以3×105cfu/尾的剂量腹腔注射至鱼体内,接种疫苗。在免疫后28天,对每一种菌株所免疫的鱼取5条做实验。使用一次性针筒从尾部静脉中抽取外周血,放入1.5ml灭菌ep管中,在4℃下放置1h,4000g、4℃离心5min,取出血清,用于检测血清杀菌能力(图2a)。同时取大菱鲆免疫器官头肾,放于组织保存液中,用于抽取组织rna,并检测il-1β、igm、mhc-i和mhc-ii等免疫因子表达水平(图2b),判断疫苗株是否可以有效激活宿主免疫反应。
结果显示,经疫苗株eibva0023(δetae_0023)免疫后的大菱鲆,可以产生对杀鱼爱德华氏的有效免疫能力,同时可以明显激活自身免疫水平。此外,与其它疫苗株相比,减毒活疫苗株eibva0023可以显著地激活免疫因子mhc-i的表达。
实施例3、疫苗株半致死剂量ld50
分别测定野生株、wed、δaroc和减毒活疫苗株eibva0023(δetae_0023)的ld50。
杀鱼爱德华氏菌野生株和活疫苗株对大菱鲆的半致死剂量ld50如表1所示。
表1
结果显示,eibva0023候选活疫苗株的毒力低于杀鱼爱德华氏菌野生毒株eib202,并且可以达到已报道的减毒活疫苗菌株wed的减毒效果。减毒效果非常明显,符合疫苗株的要求。
实施例4、以大菱鲆为试验动物的免疫保护试验
选择已报道的减毒活疫苗菌株wed和δaroc作为阳性对照,pbs和fkc作为阴性对照,检测疫苗株eibva0023的免疫保护力。以由图3a的结果可知,经疫苗株免疫后的大菱鲆,都可以产生对野生型eib202的免疫力,逐渐清除病原菌。同时,疫苗株eibva0023的相对免疫保护率(rps)高达73.7%(图3b),可以有效地抵抗eib202的感染,具有显著的免疫保护效果。
生物材料保藏
本发明提供的eibav0023菌株(edwardsiellapiscicida),保藏在中国典型培养物保藏中心(cctcc,中国武汉,武汉大学),保藏号为cctccno:m2019019,保藏日为2019年1月7日。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
序列表
<110>华东理工大学
<120>新型爱德华氏菌减毒靶点及其应用
<130>190685
<160>12
<170>siposequencelisting1.0
<210>1
<211>576
<212>dna
<213>杀鱼爱德华氏菌(edwardsiellapiscicida)
<400>1
atgggtaatttagtgaagttgatcggcgtcgggctgttggttaccggactggccgcctgc60
gatggcagctccaccgcggagaccaacgcaccggcgcagggtgcgagcgcgactcagccc120
agcgtgccggcgggtgccaaagtcagcctgttagacggtaagattggctttacgctgcct180
gcgggactgagcgatcagaccagcaagctgggctcacagaccaacaatatgtccgtgtat240
gccaataaaaccgggcagcaggcggtgatcgtcatcttggcgccgatgccgcaggataac300
ctgaataccctgtcgacccgcctgattgaccagcagaaatcacgcgacgccagcctgcag360
ctggtctcgtctgagagcgttaagctgggtggaaaggacgttgagaaggtcgtgagtatg420
cagcaggcgaacggtcacgccatctactccagcattatcttagcccaggtcggcgatcag480
ctgatgaccatgcagatctccctgccgggcgataatcgccaagaagcggccaatatcgcc540
aacggcgtgctcaataccctctcctttgcccaataa576
<210>2
<211>191
<212>prt
<213>杀鱼爱德华氏菌(edwardsiellapiscicida)
<400>2
metglyasnleuvallysleuileglyvalglyleuleuvalthrgly
151015
leualaalacysaspglyserserthralagluthrasnalaproala
202530
glnglyalaseralathrglnproservalproalaglyalalysval
354045
serleuleuaspglylysileglyphethrleuproalaglyleuser
505560
aspglnthrserlysleuglyserglnthrasnasnmetservaltyr
65707580
alaasnlysthrglyglnglnalavalilevalileleualapromet
859095
proglnaspasnleuasnthrleuserthrargleuileaspglngln
100105110
lysserargaspalaserleuglnleuvalsersergluservallys
115120125
leuglyglylysaspvalglulysvalvalsermetglnglnalaasn
130135140
glyhisalailetyrserserileileleualaglnvalglyaspgln
145150155160
leumetthrmetglnileserleuproglyaspasnargglngluala
165170175
alaasnilealaasnglyvalleuasnthrleuserphealagln
180185190
<210>3
<211>48
<212>dna
<213>引物(primer)
<400>3
gagctcaggttacccggatctattgcccgtcgcacagggtattttttc48
<210>4
<211>34
<212>dna
<213>引物(primer)
<400>4
cgacgcttacatggaaattccttatgttgtccga34
<210>5
<211>34
<212>dna
<213>引物(primer)
<400>5
atttccatgtaagcgtcgcggggggccgacagac34
<210>6
<211>55
<212>dna
<213>引物(primer)
<400>6
ccctcgagtacgcgtcactagtggggcccttgcagttcaatgccagcgaggctac55
<210>7
<211>25
<212>dna
<213>引物(primer)
<400>7
cagtggaatggatcgcgccggagcc25
<210>8
<211>25
<212>dna
<213>引物(primer)
<400>8
tattaaccccgactttccatttcag25
<210>9
<211>25
<212>dna
<213>引物(primer)
<400>9
atgggtaatttagtgaagttgatcg25
<210>10
<211>25
<212>dna
<213>引物(primer)
<400>10
ggcaaaggagagggtattgagcacg25
<210>11
<211>25
<212>dna
<213>引物(primer)
<400>11
cagcaacttaaatagcctctaaggt25
<210>12
<211>25
<212>dna
<213>引物(primer)
<400>12
ggtgctccagtggcttctgtttcta25
- 还没有人留言评论。精彩留言会获得点赞!