抗PD-L1抗体及其作为治疗剂及诊断剂的用途的制作方法
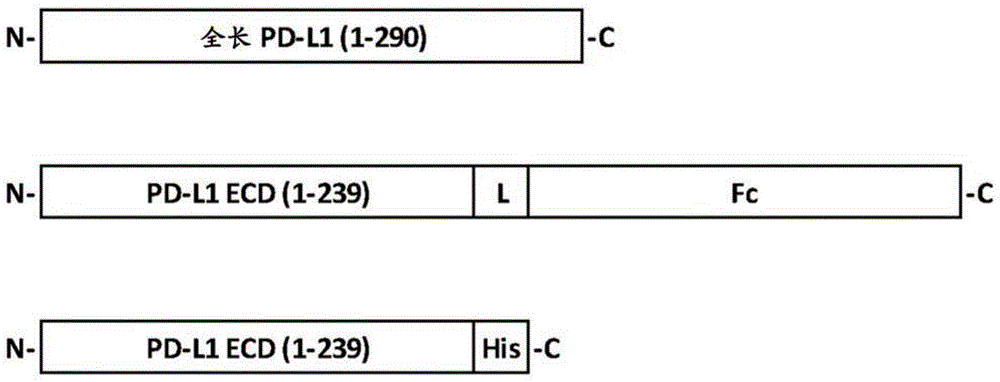
发明背景pd-l1最初是作为b7蛋白家族中的成员(称为b7-h1)克隆(dong等人,1999naturemed5:1365)。pd-l1结合至编程性死亡-1(programmeddeath-1;pd-1)受体及活化负调节信号传导途径,从而抑制t细胞增殖及活性(freeman等人,2000jexpmed192:1027)。因此,pd-l1也被称为pd-1配体1(pd-l1或cd274)。迄今为止,两种序列相关配体pd-l1(b7-h1)与pd-l2(b7-dc)经鉴定为与pd-1相互作用,诱导负信号转导,且抑制tcr及cd28介导的t细胞活化、细胞增殖及生长因子与细胞因子(诸如il-2与ifn-γ)的分泌(riley等人,2009immunolrev229:114)。人类pd-l1基因编码具有前导肽的290个氨基酸残基(ncbi登录号np_054862.1)的全长蛋白,而在细胞表面上作为成熟蛋白表达pd-l1之后移除该前导肽。全长pd-l1的计算分子量为33kd。然而,基于来自我们及其他人的western印迹数据,由于糖基化,观察分子量为约50kd。发现pd-l1被组成性表达在人类心、肺、胸腺及血管内皮细胞中,并在许多其它人类组织及细胞类型中以低水平表达,这些细胞类型包括抗原呈递细胞、外周血单核细胞及其它免疫细胞(freeman等人,2000jexpmed192:1027;eppihimer等人,2002microcirculation9:133)。当受到ifn-γ、il-12及i型干扰素刺激时,发现那些细胞类型中的许多类型表达出升高水平的pd-l1(bald等人,2014cancerdiscov4:674-687;planes等人,2014jvirol88:6672-6689)。在各种涉及不同类型组织及器官的癌症方面,报告了肿瘤细胞中pd-l1表达的异常上调,这些组织及器官诸如肺(konishi等人,2004clincancerres10:5094)、肝(shi等人,2008intjcancer128:887;gao等人,2009clincancerres15:971)、胃(wu等人,2006actahistochem108:19)、肾(thompson等人,2004procnatlacadsci101:17174;thompson等人,2007clincancerres13:1757)、乳腺(ghebeh等人,2006neoplasia8:190)、卵巢(hamanishi等人,2007procnatlacadsci104:3360)、胰腺(nomi等人,2007clincancerres13:2151)、黑色素细胞(hino等人,2010cancer116:1757)及食道(ohigashi等人,2005clincancerres11:2947)。更经常地,那些癌症中的pd-l1表达升高与患者存活结局的不良预后关联。通过b7-h1ig或抗pd-l1抗体阻断pd-l1接合pd-1受体刺激了t细胞增殖及功能活性(dong等人,1999naturemed5:1365;freeman等人,2000jexpmed192:1027;tamura等人,2001blood97:1809;iwai等人,2002pnas99:12293),增强了对抗肿瘤生长及病毒感染的免疫应答(iwai等人,2002pnas99:12293)。那些观察结果提示,pd-l1/pd-1信号传导的抑制可活化免疫应答,这些免疫应答不仅对抗癌细胞生长,而且对抗人体内的病毒感染及扩增。流行性肝细胞感染病毒hbv及hcv诱导肝细胞中pd-1配体的过表达且活化t效应细胞中的pd-1信号传导,从而引起t细胞耗竭及对病毒感染的耐受性(boni等人,2007jvirol81:4215;golden-mason等人,2008jimmunol180:3637)。同样地,流行hiv感染常常通过类似机制避开人类免疫系统。通过拮抗剂分子对pd-l1诱导的信号传导的治疗性调控可自耐受反转免疫细胞,并经再活化以根治癌症及慢性病毒感染(blank等人,2005cancerimmunolimmunother54:307;okazaki等人,2007intimmunol19:813)。近期发现,除了结合至pd-1之外,pd-l1也与b7-1(另一个b7家族成员,也称为cd80)特异性相互作用(butte等人,2007immunity27:111)。初步证据提示,pd-l1与cd80的相互作用施加负调节至t细胞功能及活性,并且小鼠体内pd-l1与cd80相互作用的阻断引起对ova抗原攻击更加强烈的免疫应答(park等人,2010blood116:1291)。因此,同时阻断pd-l1结合至pd-1及cd80可施加对抗癌症及病毒感染的叠加或协同效应。发明概述本发明提供通过抑制pd-l1介导的信号传导及功能达成免疫活化的方法及组合物。在一个方面中,本发明提供一种抗体抗原结合域,该抗体抗原结合域特异性结合人类pd-l1,且包含本文所描述的互补决定区(complementaritydeterminingregion;cdr)序列。cdr可经历重组成为重链可变区(vh)及轻链可变区(vk),这些区分别包含(cdr-h1、cdr-h2及cdr-h3)及(cdr-l1、cdr-l2及cdr-l3)序列,且保留特异于pd-l1的结合及/或功能性。在特定实施方案中,域包含cdr1、cdr2及cdr3,处于选自如下(a)-(r)的组合中,其中在第一列中显示抗体(ab)、重链(hc)或轻链(lc)及衍生cdr组合的cdr命名系统(kabat、imgt或复合),且粗体字的残基为kabat系统,而加下划线的残基为imgt系统:在特定实施方案中,域包含重链可变区(vh)及轻链可变区(vk),该重链可变区包含选自(a)-(o)的cdr1、cdr2及cdr3组合,该轻链可变区包含选自(p)-(r)的cdr1、cdr2及cdr3组合。在特定实施方案中,域包含cdr1、cdr2及cdr3,处于选自(c)、(f)、(i)、(l)、(o)及(r)的组合中,如下:ab,链cdr1cdr2cdr3mu333vh(c)seqidno:9seqidno:10seqidno:11hu3332b/3a2vh(f)seqidno:9seqidno:24seqidno:11hu3333c2/3h2vh(i)seqidno:9seqidno:25seqidno:11hu3334a2vh(l)seqidno:9seqidno:24seqidno:26hu3334b2vh(o)seqidno:9seqidno:25seqidno:26mu333vk(r)seqidno:12seqidno:13seqidno:14在特定实施方案中,域包含重链可变区(vh)或轻链可变区(vk),可变区包含以下序列:mu333vh(seqidno:6);mu333vk(seqidno:8);hu333-1avh(seqidno:15);hu333-1avk(seqidno:16);hu333-2bvh(seqidno:17);hu333-3a2vh(seqidno:18);hu333-3c2vh(seqidno:19);hu333-3h2vh(seqidno:20);hu333-4a2vh(seqidno:21);hu333-4b2vh(seqidno:22);或hu333-4b2vk(seqidno:23)。在特定实施方案中,域包含重链可变区(vh)及轻链可变区(vk),可变区包含以下序列:mu333vh及vk(seqidno:6及8);hu333-1avh及vk(seqidno:15及16);hu333-2bvh及vk(seqidno:17及16);hu333-3a2vh及vk(seqidno:18及23);hu333-3c2vh及vk(seqidno:19及23);hu333-3h2vh及vk(seqidno:20及23);hu333-4a2vh及vk(seqidno:21及23);或hu333-4b2vh及vk(seqidno:22及23)。在特定实施方案中,域包含重链可变区(vh)或轻链可变区(vk),可变区包含:hu333-4b2vh(seqidno:22);或hu333-4b2vk(seqidno:23)。在特定实施方案中,域包含重链可变区(vh)及轻链可变区(vk),可变区包含:hu333-4a2vh及vk(seqidno:21及23);或hu333-4b2vh及vk(seqidno:22及23)。在特定实施方案中,域特异性结合pd-l1残基:d26及r113。本发明也提供包含主题pd-l1结合域的抗体(尤其是单克隆抗体)及f(ab)或f(ab)2。本发明也提供编码主题pd-l1抗原结合域的新颖多核苷酸(诸如cdna及表达载体),及包含此类多核苷酸的细胞,及包含此类细胞的非人类动物。可将多核苷酸可操作地连接至用于表达的异源转录调节序列,且可并入此类载体、细胞等中。本发明提供使用主题域的方法,该方法通过向测定为患有癌症或病毒感染或其它方面需要pd-l1拮抗作用的个人施用该域。本发明的组合物可用于治疗癌症、神经退化性疾病及传染性疾病(尤其是病毒性疾病)及其它病状,在这些病状中存在人类pd-1的不适宜或有害表达及/或是该病状的病因学或病理学的组分。因此,本发明提供用主题抗pd-l1蛋白在有需要的受试者中治疗癌症或抑制肿瘤进程的方法,并将人源化抗pd-1单抗用作治疗剂来治疗涉及由pd-1介导的细胞内信号传导抑制免疫细胞而导致病情恶化的人类疾病,尤其是癌症及病毒感染。本发明进一步提供主题多核苷酸用于制造在受试者中治疗癌症或抑制肿瘤进程的药物的用途。本发明包括所述特定实施方案的所有组合。本发明的进一步实施方案及可应用性的完整范围会自下文所提供的详细描述变得显而易见。然而,应理解,尽管详细描述及特定实施例指示本发明的较佳实施方案,但仅以说明的方式提供这些详细描述及特定实施例,因为本发明的精神及范围内的各种变化及修改会自此详细描述对本领域技术人员变得显而易见。出于所有目的,包括引文在内的本文所引用的所出版物、专利及专利申请会以引用的方式全部并入本文。附图简述图1:全长pd-l1(上图)、pd-l1/fc(中图)及pd-l1/his(下图)的示意性呈现。ecd:胞外域。l:接头。fc:来自人类igg4的γ4fc片段。h:his标签。n:n末端。c:c末端。图2:鼠类单抗在elisa(a)中对纯化的人类pd-l1/his的剂量依赖性结合或在facs(b)中对细胞表面表达的pd-l1的剂量依赖性结合。各图的左上角指示鼠类单抗与小鼠igg作为阴性对照。(a)通过pd-l1/his以每孔100ng包被elisa板。由y轴上的直接od450读数指示结合信号强度。由x轴指示单抗或小鼠igg的浓度。(b)用连续稀释的鼠类抗pd-l1单抗或对照小鼠igg染色hek293/pd-l1细胞。由facs分析中的mfi(均值荧光强度)指示结合信号强度。由x轴指示单抗或小鼠igg的浓度。图3:在与hek293/os8/pd-l1细胞共同培养之后hut78/pd-1细胞中的鼠类抗pd-l1单抗诱导的il-2分泌的剂量依赖性响应曲线。基线:在所有测试浓度下由小鼠igg(migg)所诱导的平均il-2释放。每个表示双数据点的平均值。顶线:基于prizm的回归计算的最高il-2释放。图4:在与hek293/pd-l1细胞共同培养之后hut78/p3z细胞中的鼠类抗pd-l1单抗抑制的il-2分泌的剂量依赖性响应曲线。pd-l1及p3z嵌合受体的接合导致p3z嵌合受体及il-2分泌的活化。图5:鼠类抗pd-l1单抗对抗生物素缀合的pd-1/fc的剂量依赖性竞争曲线。将固定量的生物素-pd-1-ecd/fc与x轴指示的渐增浓度的抗pd-l1单抗混合。y轴显示通过facs所分析的均值荧光强度(mfi)。将小鼠gig(mug)用作阴性对照。图6:鼠类抗pd-l1单抗对抗生物素缀合的cd80/fc的剂量依赖性竞争曲线。将固定量的生物素-cd80-ecd/fc与x轴指示的渐增量的抗pd-l1单抗混合。y轴显示通过facs所分析的均值荧光强度(mfi)。将小鼠igg(muigg)用作阴性对照。图7:来自不同健康供体(供体3(a)及供体17(b))的原代人类pbmc中人源化抗pd-l1fab所诱导的ifn-γ分泌。使pbmc与hek293/os8/pd-l1细胞共同培养过夜。通过elisa检定条件化培养基中的ifn-γ。将bsa用作阴性对照。图8:野生型人源化抗pd-l1单抗(igg1wt)或突变体人类igg1格式(igg1mc及igg1mf)的c1q结合。在maxisorpelisa板上包被50微升连续稀释(x轴)的人源化抗pd-l1单抗。使用对人类c1q特异性的单克隆抗体通过elisaod450读数评估人类c1q结合(y轴)。图9:野生型人源化抗pd-l1单抗(igg1wt)或突变体人类igg1格式(igg1mc及igg1mf)所诱导的抗体依赖性细胞的细胞毒性(adcc)。将用fcγriiia转染的人类nk92mi细胞用作效应细胞且将hek293/pd-l1细胞用作靶细胞。基于实施例5中所描述的乳酸脱氢酶(ldh)释放检定法计算细胞毒性百分比(y轴)。图10:野生型人源化抗pd-l1单抗(igg1wt)或突变体人类igg1格式(igg1mc及igg1mf)的补体依赖性细胞毒性(cdc)活性。将daudi/pd-l1细胞用作靶细胞且将来自健康供体的人类血清用作补体组分来源。将利妥昔单抗(rituximab,roche)用作经典cdc检定法中的阳性对照。基于实施例5中所描述的细胞滴度辉光检定法计算cdc百分比(y轴)。图11:来自不同健康供体(供体3(a)及供体17(b))的原代人类pbmc中人源化抗pd-l1单抗所诱导的ifn-γ分泌。使pbmc与hek293/os8/pd-l1细胞共同培养过夜。通过elisa检定条件化培养基中的ifn-γ。人类igg充当阴性对照。图12:在elisa中抗pd-l1单抗对纯化的人类pd-l1/his(a)、食蟹猴pd-l1/his(b)及小鼠pd-l1/his(c)的剂量依赖性结合。分别用50微升的人类、猴及小鼠pd-l1/his包被maxisorpelisa板。由x轴指示抗pd-l1单抗的浓度。由直接od450读数(y轴)指示结合信号强度。图13:通过elisa(上图)及western印迹(下图)定位抗pd-l1单抗的结合表位。(a)hu333-4b2-igg1对突变体pd-l1的结合活性。(b)y1-igg1对突变体pd-l1的结合活性。(c)抗pd-l1单抗对d26a突变体pd-l1的结合活性。使用含有野生型或突变体pd-l1/his蛋白的条件化培养基通过elisa及western印迹评估结合活性。**指示单抗结合活性降低至野生型pd-l1的25%-50%的pd-l1突变体。***指示单抗结合活性降低至野生型pd-l1的25%以下的pd-l1突变体。图14:通过elisa进行抗pd-l1单抗对人类血清蛋白与pd-l1抗原的混合物的结合检定法。(a)鼠类单抗或鼠类嵌合单抗结合至人类血清与pd-l1/his蛋白的混合物的剂量依赖性反应曲线。如所指示的,将pbs中的连续稀释pd-l1/his蛋白包被至96孔maxisorpelisa板上,并以5%的固定最终浓度添加人类血清合并物(来自三个健康供体)。将3μg/ml所指示的单抗添加至每一孔,并在室温下温育1小时。(b)直方图图示左侧每种单抗及阴性对照(无单抗)的曲线三个数据点(主要用人类血清蛋白质及用很少的pd-l1/his包被)的平均od450读数。图15:用hu333-4b2-igg1mf或媒介处理后的均值肿瘤生长曲线。在10mg/kg且每周两次的剂量方案下用hu333-4b2-igg1mf处理植入有人类癌细胞a431及来自健康供体的pbmc的nod/scid小鼠。发明详述当被pd-l1的配体pd-l1或pd-l2接合时,pd-l1引发免疫细胞中的抑制性信号传导。在癌症长出及病毒感染的情况下,pd-1信号传导的活化促进了免疫耐受性,导致癌症或病毒感染细胞逃避免疫监督及癌症转移或病毒负荷增长。通过治疗剂抑制pd-l1介导的细胞信号传导可活化包括t细胞、b细胞及nk细胞的免疫细胞,并因此增强抑制癌细胞生长或病毒感染的免疫细胞功能,且恢复免疫监督及免疫记忆功能以治疗此类人类疾病。本发明提供抗体,这些抗体的功能拮抗免疫细胞中pd-l1诱导的细胞信号传导。鼠类抗pd-l1抗体经人源化为在框架区内高度类似人类抗体。以经修饰人类igg变异体格式产生的全抗体在效应器功能及物理化学性质的方面中具有一组独特特征。所公开抗pd-l1抗体适合于癌症治疗、控制病毒感染及机制上涉及加剧免疫耐受性的其它人类疾病中的治疗性用途。除非上下文另有指示,否则术语“抗体”是用于广义上,且具体覆盖抗体(包括全长单克隆抗体)及抗体片段,只要它们识别pd-l1即可。抗体分子通常为单特异性,但也可描述为独特特异性的、异种特异性的或多特异性的。抗体分子经由特异性结合位点结合至抗原上的特定抗原决定簇或表位。“抗体片段”包含全长抗体的一部分,大体而言为全长抗体的抗原结合或可变区。抗体片段的实例包括fab、fab'、f(ab')2及fv片段;双抗体;线性抗体;单链抗体分子;及由抗体片段形成的多特异性抗体。天然及经工程改造的抗体结构为本领域所公知,例如strohl等人,therapeuticantibodyengineering:currentandfutureadvancesdrivingthestrongestgrowthareainthepharmaceuticalindustry,woodheadpublishingseriesinbiomedicine,第11期,2012年10月;holliger等人,naturebiotechnol23,1126-1136(2005);chames等人,brjpharmacol.,2009年5月;157(2):220-233。可通过本领域技术人员已知的方法获得单克隆抗体(单抗)。参看例如,kohler等人(1975);美国专利第4,376,110号;ausubel等人(1987-1999);harlow等人(1988);及colligan等人(1993)。本发明的单抗可以是任何免疫球蛋白类别的,包括igg、igm、ige、iga及其任何亚类。可在体外或体内培养产生单抗的杂交瘤。在体内生产中可获得高滴度的单抗,其中将来自个别杂交瘤的细胞腹膜内注射至小鼠(诸如pristine引发的balb/c小鼠)体内以产生含有高浓度期望单抗的腹水液。可使用本领域技术人员所熟知的柱层析法自此类腹水液或自培养物上清液纯化同种型igm或igg的单抗。“分离的多核苷酸”是指已与天然产生状态下位于侧面的序列分开的多核苷酸区段或片段,例如已自正常邻接于片段的序列(例如在天然产生片段的基因组中邻接于片段的序列)移除的dna片段。因此,该术语包括(例如)并入载体中、并入自主复制质粒或病毒中或并入原核生物或真核生物的基因组dna中的重组dna,或作为独立于其它序列的单独分子存在(例如,作为通过pcr或限制酶消化产生的cdna或基因组或cdna片段)的重组dna。它也包括一种重组dna,该重组dna为混合基因中编码额外多肽序列的部分。“构建体”意谓任何重组多核苷酸分子(诸如质粒、粘粒、病毒、自主复制多核苷酸分子、噬菌体或线性或环状单链或双链dna或rna多核苷酸分子),其衍生自任何来源,能够基因组整合或自主复制,包含多核苷酸分子,其中已经以功能性可操作方式连接(即,可操作连接)一或多个多核苷酸分子。重组构建体会通常包含可操作连接至转录起始调节序列的本发明的多核苷酸,这些序列会导引预定宿主细胞中多核苷酸的转录。可使用异源及非异源(即内源)启动子两者导引本发明的核酸的表达。“载体”是指任何重组多核苷酸构建体,其可用于转化的目的,即,将异源dna引入到宿主细胞中。一种类型的载体为“质粒”,是指环状双链dna环,可将额外dna区段连接至其中。另一类型的载体为病毒载体,其中可将额外dna区段连接至病毒基因组中。某些载体能够在被引入到的宿主细胞中自主复制(例如,具有细菌复制起点的细菌载体及附加体哺乳动物载体)。其它载体(例如,非附加体哺乳动物载体)在引入到宿主细胞中后整合至宿主细胞的基因组中,且由此与宿主基因组一起复制。此外,某些载体能够导引与之可操作连接的基因的表达。本文中将此类载体称为“表达载体”。本文所使用的“表达载体”是指在转化、转染或转导至宿主细胞中时能够复制及表达感兴趣基因的核酸分子。表达载体包含一或多个表型选择标志及复制起点,以确保维持载体及以在需要的情况下于宿主内提供扩增。表达载体进一步包含启动子,以驱动细胞内多肽的表达。适宜表达载体可为例如衍生自pbr322的质粒或各种puc质粒,它们是市售的。其它表达载体可衍生自噬菌体、噬菌粒或粘粒表达载体。序列表描述实施例实施例1:抗pd-l1单克隆抗体的产生使用杂交瘤融合技术(kohler与milstein1975nature256:495-497;mechetner2007methodsmolbiol378:1-13)及修改产生鼠类抗人类pd-l1单克隆抗体(单抗)。选择在酶联免疫吸附检定法(elisa)及荧光活化细胞分选(facs)检定法中具有高结合活性的单抗以便在基于细胞的功能检定法中进一步表征。pd-l1及cd80重组蛋白基于已公开序列(ncbi参考序列nm_014143.3)(seqidno.1及2)通过genescript(南京,中国)合成全长人类pd-l1cdna。将由人类pd-l1的氨基酸(aa)1-239组成的胞外域(seqidno.3及4)pcr扩增并亚克隆至基于pcdna3.1的表达载体(invitrogen,卡尔斯巴德,ca,美国)中,其中c末端融合至人类igg4的fc区或者his标签,从而产生两个重组pd-l1融合构建体pd-l1-ecd/fc与pd-l1-ecd/his(缩写为pd-l1/fc与pd-l1/his)。图1显示pd-l1融合蛋白的示意图。根据制造商(invitrogen)的使用说明,通过瞬时转染在293-f细胞(产品目录编号r79007,invitrogen)中表达重组pd-l1融合蛋白。收集含有分泌重组蛋白的条件化培养基,且在15000g下离心30分钟使该条件化培养基清澈。使用蛋白gsepharosefastflow柱(产品目录编号17061805,gelifesciences,上海,中国)纯化pd-l1/fc。经由ni-sepharosefastflow亲和层析法(产品目录编号17531801,gelifesciences),然后使用hiload16/60superdex200柱(产品目录编号17106901,gelifesciences)执行大小排阻层析法纯化pd-l1/his。用磷酸盐缓冲盐水(pbs)透析pd-l1/fc与pd-l1/his蛋白两者,并以小等分试样储存于-80℃冰箱中。含有全长人类pd-1cdna的表达质粒是从origene(产品目录编号sc117011,ncbi登录号:nm_005018.1,北京,中国)处获得。将由pd-1的氨基酸(aa)1-168组成的胞外域pcr扩增并亚克隆至基于pcdna3.1的表达载体(invitrogen,卡尔斯巴德,ca,美国)中,其中c末端融合至人类igg4重链的fc域,缩写为pd-1/fc。根据已公开序列(ncbi登录号:nm_005191.3)通过genescript合成人类cd80(b7-1)cdna。类似于先前所描述的方法(专利us8735553),在c末端处使cd80的胞外域(aa1-242)与人类fc融合并亚克隆至哺乳动物表达载体中。融合蛋白经命名为cd80-ecd/fc或cd80/fc。表达pd-l1的稳定细胞系通过将含有pd-l1的pcdna3.1质粒转染至hek293(atcc,马纳萨斯,va,美国)中,且然后用含有每毫升600微克潮霉素(产品目录编号10687-010,invitrogen)的培养基选择来建立表达人类pd-l1的稳定细胞系。通过自培养皿表面挑取单菌落来分离单克隆。使用pd-l1抗体(产品目录编号17-5983,ebioscience,圣地亚哥,美国)通过facs分析及western印迹筛选所有克隆,且顶级表达克隆用于facs结合分析与功能检定法。免疫与杂交瘤克隆产生使用杂交瘤融合技术产生鼠类抗人类pd-l1单克隆抗体。通过beigene动物护理及使用程序检查所有动物规程,并遵循该程序执行所有动物规程。使10至12周大balb/c小鼠(北京华阜康生物科技股份有限公司,北京,中国)皮下及/或腹膜内免疫三次(注射之间间隔3周),每次免疫利用含有5-10微克的pd-l1/fc的100μl佐剂(产品目录编号kx0210041,康碧泉公司,北京,中国)执行。在第二次免疫后2周,收集小鼠血清及通过elisa及facs评估pd-l1结合。在表1及表2中显示此类检定结果的实例。选择血清中具有高抗pd-l1结合滴度的小鼠且腹膜内强化pbs中的50微克pd-l1/fc。在强化后3天,使用标准技术(mechetner等人,2007methodsmolbiol378:1-13)及一些修改使脾细胞分离及与鼠类骨髓瘤细胞系sp2/0(atcc)融合。表1:elisa检定法中连续稀释小鼠血清对pd-l1/his蛋白的结合活性表2:facs检定法中连续稀释小鼠血清对hek293/pd-l1细胞的结合活性通过elisa及facs评估鼠类单抗的pd-l1结合活性最初通过经修改的elisa检定对杂交瘤克隆的上清液筛选pd-l1结合活性(flanagan2007methodsmolbiol378:33-52)。简而言之,在50微升pbs中稀释50-200纳克的pd-l1/his及在96孔elisa板(金灿华实业有限公司,深圳,中国)的每个孔内包被该pd-l1/his。在用tbst(20mmtris,150mmnacl,0.05%tween20,ph7.5)中3%的牛血清清蛋白封闭并与杂交瘤克隆的培养物上清液一起温育后,使用hrp缀合的马抗小鼠igg抗体(产品目录编号7076s,cellsignalingtechnology)及四甲基联苯胺(tmb)(产品目录编号pa107-01,天根,北京,中国)检测结合信号,该信号由读板仪(phreastar,bmglabtech,德国)以450nm处的吸光度读出。通过荧光活化细胞分选(facs)进一步验证elisa阳性克隆。在v形底96孔板(产品目录编号3897,corning)中与来自杂交瘤克隆的上清液一起温育pd-l1表达细胞hek293/pd-l1(105个细胞/孔)。用dylight649缀合的山羊抗小鼠igg抗体(产品目录编号405312,biolegend,圣地亚哥,ca,美国)检测细胞表面结合的pd-l1抗体及在guavaeasycyte8ht流式细胞仪(millipore,美国)中监测细胞荧光。随后在基于人类免疫细胞的功能检定法中测试在elisa与facs检定法两者中显示阳性的杂交瘤克隆以鉴定具有良好功能活性的抗体。进一步亚克隆及表征具有阳性功能活性的杂交瘤克隆。亚克隆及杂交瘤细胞对无血清或低血清培养基的适应通过受限稀释亚克隆经由elisa、facs及功能检定法初步筛选的阳性杂交瘤克隆。选择每个原始克隆中的三个亚克隆并在facs及功能检定法中确认这些亚克隆。将经由功能检定法所选择的亚克隆定义为单克隆抗体。顶级亚克隆经适应在具有0-3%胎牛血清的cdm4mab培养基(产品目录编号sh30801.02,hyclone)中生长以便纯化及进一步表征。纯化的抗体的结合活性的评估在cdm4mab培养基(产品目录编号sh30801.02,hyclone)或者freestyletm293表达培养基(产品目录编号12338018,invitrogen)内培养杂交瘤细胞或用抗体表达质粒瞬时转染的293-f细胞(产品目录编号r79007,invitrogen),并在37℃的co2温箱中温育5至7天。经由在10,000g下离心30分钟移除所有细胞及细胞碎片来收集条件化培养基,并经由0.22μm薄膜过滤,然后纯化。遵循制造商规则,将含有鼠类或重组抗体的上清液应用并结合至蛋白a柱(产品目录编号17127901,gelifesciences),用pbs洗涤,在含有20mm柠檬酸盐、150mmnacl的酸性缓冲液(ph3.5)中洗脱。用1mtrisph8.0中和所洗脱物质。该程序通常产生具有90%以上纯度的抗体。用pbs透析或使用hiload16/60superdex200柱(产品目录编号17531801,gelifesciences)进一步纯化(以移除凝聚体)蛋白a亲和纯化的抗体。通过在280nm处测量吸光度或通过使用牛igg参考标准(产品目录编号23212,thermoscientific)的bradford检定法(产品目录编号1856210,thermoscientific,罗克福德,il,美国)测定蛋白浓度。在-80℃冰箱中以等分试样储存最终抗体制剂。如前文部分中所描述,在elisa及facs检定法中评估纯化的单克隆抗体的结合活性。使用elisa及facs中的剂量依赖性结合曲线比较单抗效能。图2及表3显示了两种代表性鼠类单抗的结果。鼠类单抗333(mu333)具有剂量依赖性结合活性,在elisa及facs检定法中分别具有0.036μg/ml及0.099μg/ml的ec50(50%活性时的有效浓度)。mu277在elisa(ec50=0.031μg/ml)中具有与mu333类似的结合活性,但在facs(ec50=0.371μg/ml)中具有较低结合活性。相比之下,在两个检定法中对照小鼠igg(muigg)皆不具有至pd-l1的结合。表3:elisa及facs检定法中抗pd-l1单抗的剂量依赖性结合实施例2:抗pd-l1抗体的功能活性稳定细胞系的产生用于基于人类t细胞的功能检定法的稳定细胞系与专利us8735553中所描述的基本上相同。简而言之,融合蛋白表达质粒os8经产生含有抗人类cd3单抗okt3的scfv及小鼠cd8α的c末端域,该小鼠cd8α的c末端域包括跨膜及胞质域。os8可用作膜锚定t细胞接合物,其直接活化t细胞受体(tcr)。通过两种表达构建体共同转染至hek293细胞中继之以潮霉素或g418选择10-14天来产生共同表达os8与pd-l1两者的稳定细胞系。此细胞系被命名为hek293/os8/pd-l1。类似地,产生表达人类pd-1的人类t细胞系hut78/pd-1。此外,通过稳定转染嵌合pd-1表达构建体产生反向信号传导人类t细胞系hut78/p3z,其中通过将人类pd-1的胞外域及跨膜域融合至人类cd3ζ链的胞质区来产生嵌合pd-1表达构建体(命名为p3z)。以此方式,p3z编码会在与pd-1配体(pd-l1或pd-l2)结合后活化t细胞的膜结合受体。如先前所描述的,通过受限稀释克隆细胞系(fuller2001currprotocmolbiol,第11章,第11.8单元)。通过hut78/pd-1细胞中的il-2释放测定pd-l1抗体功能为了测定抗pd-l1抗体是否可阻断pd-l1诱导的pd-1信号传导,与抗pd-l1单抗一起预温育hek293/os8/pd-l1细胞15分钟,之后在37℃于平底板中与hut78/pd-1细胞(每孔1×104至3×104)共同培养,每孔以200μl的rpmi1640生长培养基供给营养。在16-18小时的共同培养后,收集上清液。通过elisa使用人类il-2ready-set-go!elisa试剂盒(产品目录编号88-7025,ebiosciences,圣地亚哥,ca)检定il-2。在此检定法中,用抗pd-l1抗体阻断pd-l1-pd-1信号传导导致了增强的tcr信号传导及il-2产生。如表4所示,在此功能检定法中筛选elisa及facs结合阳性杂交瘤克隆的上清液。尽管在elisa及facs检定中所有测试克隆皆结合至pd-l1,但仅少数克隆可阻断pd-l1-pd-1信号传导及导致il-2产生增加。与仅具有新鲜培养基的阴性对照相比,剩余克隆并未导致il-2产生增加或导致il-2产生很少增加。在此实验中,将od450读数截止设置为2.5,也即刺激il-2产生超过此水平的克隆被视为具有拮抗剂功能(表4)。基于已公开数据(us2010/0203056a1)的可变区合成参考抗pd-l1单抗(命名为y1),且通过融合y1可变区与小鼠或人类igg1κ恒定区以分别产生y1-muigg1或y1-huigg1(统称为y1-higg1)来产生人类及小鼠格式的y1抗体。也在此检定法中确认y1-muigg1的功能。表4:与hut78/pd-1共同培养的hek293/os8/pd-l1中抗pd-l1杂交瘤克隆的功能筛选**用粗体显示功能性克隆为了阻断活性的定量评估,在相同检定法中比较纯化的鼠类抗pd-l1单抗。图3显示代表性鼠类抗pd-l1单抗的剂量响应曲线。表5汇总ec50及这些单抗可诱导的最大il-2浓度。mu333为pd-l1-pd-1信号传导的强效拮抗剂,且在很低的ec50诱导显著的il-2产生。相比之下,由剂量依赖性响应曲线及顶线信号读数与ec50的参数判断,单抗之一的mu277具有比mu333弱得多的阻断活性。作为阴性对照,muigg不可阻断pd-l1/pd-1信号传导及刺激il-2产生。表5:与hek293/os8/pd-l1细胞共同培养的hut78/pd-1细胞中由抗pd-l1单抗所诱导的il-2释放通过hut78/p3z细胞中il-2释放的反转信号传导测定pd-l1抗体功能在hut78/p3z细胞中,通过如前文部分中所描述的设计反转pd-1介导的tcr信号传导。在此检定法中,与纯化的pd-l1抗体一起预温育hek293/pd-l1细胞15分钟,之后在37℃于96孔平底板中与hut78/p3z细胞共同培养。在16-18小时的共同培养后,收集上清液并通过如上文所描述的elisa检定il-2产生。鼠类抗pd-l1单抗的抑制活性经检测直接以剂量依赖性方式与il-2释放的减少关联。与上文所示结构相一致,通过防止hut78细胞上的p3z嵌合受体上的pd-l1接合使mu333对抑制il-2分泌具有强效活性。如表6及图6所示,就ic50(最大活性的50%抑制时的单抗浓度)而言,mu333比mu277更加强效,此与t细胞中的常规信号传导所得的上述结果相一致。阴性对照muigg不可抑制pd-l1/p3z诱导的il-2产生。表6:在与hek293/pd-l1细胞共同培养的hut78/p3z细胞中抗pd-l1单抗对il-2分泌的抑制pd-1结合至细胞表面表达的pd-l1的竞争性抑制为了测定抗pd-l1抗体是否可与pd-1结合至pd-l1竞争,在v形底96孔板中与pd-l1抗体及生物素缀合的pd-1/fc融合蛋白的混合物一起温育hek293/pd-l1细胞(每孔1×105个细胞)。根据制造商的使用说明使用ez-linksulfo-nhs-lc-生物素试剂(产品目录编号21327,thermosci)实行pd-1/fc的生物素化。通过利用链霉亲合素-apc探测均值荧光强度(mfi)读数来检定抗体对pd-l1及pd-1/fc相互作用的抑制(guavaeasycyte8ht流式细胞仪,millipore,美国)。使用此方法,发明人评估抗pd-l1单抗的功能强度。如图5及表7中所示,鼠类单抗竞争性结合至pd-l1,从而抑制facs检定法中由生物素-pd-1/fc结合至细胞表面pd-l1所引起的mfi读数。与mu277的2.172μg/ml的ic50相比,mu333显示出0.463μg/ml的ic50的更佳抑制效果。相比之下,对照抗体鼠类igg不具有此类抑制效果(图5)。表7:hek293细胞上pd-1结合至pd-l1的抑制cd80结合至细胞表面pd-l1的竞争性抑制除了与pd-1相互作用之外,pd-l1也结合至另一b7家族蛋白,b7-1或者命名为cd80(buttem.j.2007immunity27:111-122)。为了测定抗pd-l1抗体是否竞争对抗cd80(ncbi登录号:np_005182.1)至pd-l1的结合,与pd-l1抗体与生物素缀合的cd80/fc融合蛋白的混合物一起温育hek293/pd-l1细胞。在此检定法中,通过抗pd-l1抗体阻断生物素-cd80/fc结合至pd-l1导致了结合信号(mfi读数)减少。如图6及表8中所示,mu333竞争掉cd80至pd-l1的结合,其中具有100%的最大抑制及很低的ic50(0.052μg/ml),与mu277的0.162μg/ml的ic50相比较。相比之下,鼠类igg不具有此类竞争效果(图6)。表8:对cd80结合至hek293细胞上细胞表面表达的pd-l1的抑制实施例3:鼠类抗pd-l1抗体的序列分析基于常用方法及一些修改实行自选定鼠类杂交瘤克隆的可变区的克隆及测序(kontermann与dubel,2010antibodyengineering,第1卷:3-14)。简而言之,收获杂交瘤细胞,用pbs洗涤,并在摆斗式转子中以1500rpm离心来收集。遵循制造商规程,使用ultrapurerna试剂盒(产品目录编号cw0581,cwbiotech,北京,中国)分离总细胞rna。使用逆转录酶(产品目录编号ah301-02,全式金,北京,中国)合成第1链cdna。使用pcr试剂盒(产品目录编号ap221-12,全式金,北京,中国)及特异于所描述的鼠类vh及vκ的克隆的一组引物(brocks2001molmed7:461-469)执行鼠类单抗的重链(vh)及轻链可变区(vκ)的pcr扩增。将pcr产物亚克隆至peasy-blunt克隆载体中(产品目录编号cb101-02,全式金)及随后通过genewiz(北京,中国)测序。自dna测序结果推导出vh及vk的氨基酸序列。通过比较序列同源性分析鼠类单抗,并基于序列同源性及表位定位结果二者对鼠类单抗分组(参看实施例7)。基于由序列批注及由基于因特网的序列分析(http://www.imgt.org/imgt_vquest/share/textes/index.html)的kabat(wu与kabat,1970j.exp.med.132:211-250)及imgt(lefranc1999nucleicacidsresearch27:209-212)系统界定互补决定区(cdr)。表9基于kabat及imgt系统的定义列出mu333(seqidno.5-14)的cdr。表9:mu333的cdr序列实施例4:鼠类抗人类pd-l1单抗的人源化鼠类单抗的3d结构的模拟针对mu333的可变域模拟三维结构,以便鉴定对于支持cdr环结构可能是重要的框架残基。在第一轮抗体人源化中将潜在重要的框架残基保持为原始鼠类残基。采用针对抗体的先前建立的结构建模方法(morea等人,methods200020:267-279)以基于抗体的已知规范结构模拟抗pd-l1单抗mu333的3d结构(al-lazikani等人,1997journalofmolecularbiology273:927-948)。简而言之,在pdb数据库(蛋白质数据库,http://blast.ncbi.nlm.nih.gov/)中对mu333的每个可变域(vk及vh)的序列进行blast以鉴定具有已知高分辨率结构(分辨率小于2.5埃)的最同源抗体序列。用于mu333建模的选定结构模板(表10中列出)在l-cdr1、l-cdr2、l-cdr3、h-cdr1及h-cdr2中具有与待建模的mu333相同类别的规范环结构。由于vκ及vh的模板来自不同的免疫球蛋白,通过主链原子的最小平方拟合将这些模板封装在一起,以形成vk-vh界面残基的杂合结构,该结构被swiss-model程序用作结构同源性建模的模板(kiefer等人,2009nucleicacidsresearch37,d387-d392)。在保持主链构象的同时,调整某些侧链构象。在亲代结构与建模结构具有相同残基的位点处,保持侧链构象。在残基为不同的位点处,在模板结构、旋转异构体库及封装考虑的基础上对侧链构象建模。在同源性建模后,使用plop程序(jacobson等人,2002journalofphysicalchemistry106:11673-11680)细化同源性模型以最小化所有原子能量及优化vk与vh界面。执行此步骤以改良立体化学,尤其是在来自不同抗体的结构的区段已被接合在一起的那些区域中。使用mu333可变域的建模3d结构引导基于结构的人源化及工程改造过程。表10:用于抗体结构模拟的结构模板抗体链模板结构的pdb编码序列同一性序列相似性mu333vk1h8n92%94%mu333vh3vfg88%91%单抗人源化与工程改造对于抗pd-l1单抗的人源化,通过对imgt(http://www.imgt.org/imgt_vquest/share/textes/index.html)及ncbi(http://www.ncbi.nlm.nih.gov/igblast/)网站中的人类免疫球蛋白基因数据库进行blast,在人类种系igg基因中搜寻与mu333可变区的cdna序列共享高度同源性的序列。以高频率存在于人类抗体全集中(glanville2009pnas106:20216-20221)且与mu333具有高同源性的人类igvh及igvk基因被选为人源化模板。使用内部开发的表达载体,通过cdr嫁接实施人源化(methodsinmolecularbiology,第248卷:antibodyengineering,methodsandprotocols,humanapress),且人源化抗体(hu333)经工程改造为人类fab格式。在初轮人源化中,通过模拟3d结构引导框架区中的自鼠类至人类氨基酸残基的突变,且在第1版本的人源化抗体333(hu333-1a,seqidno.15-16)中保留对于支持cdr的规范结构有结构重要性的鼠类框架残基。具体而言,将mu333vk的cdr嫁接至人类种系可变基因igvk1-5的框架中,且未保留鼠类框架残基(seqidno.16)。将mu333vh的cdr嫁接至人类种系可变基因igvh3-7的框架中,其中保留4个鼠类框架残基v24、l67、k71及v78(seqidno.15)。所有嫁接cdr基于hu333-1a中的kabat的cdr定义(表9及seqidno.15-16)。在以下hu333变异体中,仅嫁接kabath-cdr2的n末端半部分,因为根据模拟3d结构认为仅n末端半部分对于抗原结合非常重要(表14)。使用内部开发的表达载体将hu333-1a构建为人类fab格式,这些表达载体分别含有人类iggch-1及κ链的恒定区,具有易于适应的亚克隆位点。在c末端处用8xhis肽标记hu333-1a接合的igg2a-ch1以促进纯化。在igg2重链中引入c232s及c233s(kabat残基编号方式,kabat等人,sequenceofproteinsofimmunologicinterest,第5版,bethesda,md,nih1991)突变以防止二硫键交换且稳定igg2a构象中的人类igg2(lightle等人,2010proteinsci19(4):753-762)。两个构建体均含有fab成熟序列上游的信号肽。通过上述两个构建体共同转染至293-f细胞实现hu333-1afab的分泌表达及培养6-7天后收获。使用ni-sepharosefastflow柱(产品目录编号17531801,gelifesciences),然后使用hiload16/60superdex200柱(产品目录编号17106901,gelifesciences)执行大小排阻层析法从表达培养物上清液中纯化his8标记的fab。将纯化的fab浓缩至pbs中0.5-5mg/ml并以等份试样储存于-80℃冰箱中。对于抗pd-l1fab的亲和力测定,使用biacoretmt-200(gelifesciences)执行spr检定法。简而言之,将人类pd-l1/his偶联至已活化的cm5生物传感器芯片(产品目录编号br100530,gelifesciences)以实现大约100-200个响应单位(ru),然后用1m乙醇胺封闭未反应基团。以30μl/分钟注射在spr运行缓冲液(10mmhepes,150mmnacl,0.05%tween20,ph7.4)中混合的连续稀释的0.12nm至90nmfab样品,且通过减去来自空白流动室的ru来计算人类pd-l1/his上的结合响应。使用一对一langmuir结合模型(biaevaluationsoftware,gelifesciences)计算结合速率(kon)及解离速率(koff)。以比率koff/kon计算平衡解离常数(kd)。在前文部分中所描述的pd-1竞争检定法中确认hu333fab的功能活性。在表11中汇总来自spr测量及功能检定法的数据。hu333-1afab对pd-l1具有很高的亲和力(kd=9.88pm),由快kon(1.61×106m-1s-1)及很慢的koff(1.59×10-5s-1)指示。据观察,在此实验中在5-15分钟的解离时间期间,存在非常缓慢的或实际上不存在hu333-1afab自包被的pd-l1解离。显而易见的是,hu333-1afab对pd-l1的亲和力接近于spr技术的检测极限。hu333-1afab的此类高亲和力与所测试的所有功能检定法中的高效能相一致(表11)。在hu333-1a之后,发明人产生个别突变,这些突变将vh的框架区中的四个鼠类残基分别转换成对应的人类种系残基。同时,为了进一步提高人源化水平,发明人也将h-cdr2(kabat的定义)的c末端部分自鼠类序列变至对应的人类种系残基(表14,hu333-2b)。四个人源化fab的规格为hu333-2a(vh中的v24a)、hu333-2b(vh中的l67f)、hu333-2c(vh中的k71r)及hu333-2d(vh中的v78l),这些规格随h-cdr2变化显示于表13中。使用在特定位置处含有突变的引物及定点诱变试剂盒(产品目录编号fm111-02,全式金,北京,中国)产生所有人源化突变。通过测序分析验证期望突变。如先前所描述,表达、纯化及在结合与功能检定法中测试这些hu333fab。与hu333-1a相比,hu333-2a、hu333-2c及hu333-2d具有显著减小的结合亲和力及功能。仅hu333-2b(seqidno.16及17)具有与hu333-1a类似的结合及功能活性(表11)。合起来,hu333-2b(seqidno.16及17)达到框架区中的高水平人源化,同时维持强效结合亲和力及功能活性。表11:通过spr及功能检定法比较hu333-1a与hu333-2bfab为了探索hu333的最佳可能vh及vk序列组成,该组成可用作人类中的治疗性抗体,发明人通过在考虑抗体的分子性质诸如物理化学稳定性、氨基酸组成、投射等电点(pis)、表达水平、抗体依赖性细胞介导的细胞毒性(adcc)及补体依赖性细胞毒性(cdc)的情况下在cdr及框架区内引入突变来进一步工程改造hu333,同时维持功能活性。使hu333-1a的vh中的脱氨基位点ns76-77突变至nt76-77以产生hu333-3a2(seqidno.18及23)。使hu333-3a2-vh的v60突变至v60a,它与大多数人类igvh3基因的共有序列相一致,其中疏水性的表面暴露减少。给予此突变构建体代码名称hu333-3c2(seqidno.19及23)。使hu333-3c2的模板上的另一脱酰胺位点ns73-74突变至ts73-74,它也与大多数人类igvh3基因的共有序列相一致。后者被命名为hu333-3h2(seqidno.20及23)。如表12中所汇总的,hu333-3a2、hu333-3c2及hu333-3h2皆保留强效功能活性,仅在结合亲和力方面具有略微变化。另一方面,这些经工程改造的hu333变异体具有更佳的投射物理化学性质。表12:通过spr及功能检定法比较hu333-3a2与hu333-3c2与hu333-3h2fab为了消除vh的cdr3中的最后脱酰胺位点,发明人使hu333-3a2及hu333-3h2的模板上的ns101-102分别突变至ts101-102。以命名为hu333-4a2(seqidno.21及23)及hu333-4b2(seqidno.22及23)的人类igg1fab格式构建所得人源化单抗。来自结合与功能检定法的结果指示,hu333-4a2与hu333-4b2两者在亲和力及功能活性方面非常类似,诸如阻断pd-l1结合至其靶(pd-1及cd80)并抑制pd-l1及pd-1介导的下游信号传导(表13及表14)。出于多种考虑,自进一步开发除去过程中所产生的若干突变,这些突变包括hu333-3b2、hu333-3d2、hu333-3e2、hu333-3g2及hu333-3i2。表14中将上述单抗的cdr与mu333的cdr相比较。表13:通过spr及功能检定法比较hu333-4a2与hu333-4b2表14:选定333单抗间的cdr的比较也确认上文所示的所有人源化单抗对原代人类免疫细胞外周血单个核细胞(pbmc)的功能效果,根据制造商的使用说明,通过使用ficoll淋巴细胞分离介质(histopaque-1077;产品目录编号10771,sigma,圣路易斯,美国)的密度梯度离心而从健康供体中分离这些pbmc。随后用抗cd3单抗okt3(产品目录编号16-0037,ebioscience,圣地亚哥,ca,美国)刺激pbmc达3天,之后进行检定法。活化的pbmc群体主要由t细胞(50%-70%)、b细胞与nk细胞(15%-30%)及单核细胞(2%-10%)组成。为了在接合tcr/cd3复合体后更好地模拟t细胞对表达pd-l1的肿瘤细胞的响应,在96孔板的每个孔中将已活化的pbmc与hek293/os8/pd-l1细胞共同培养。通过将单抗添加至培养物,共同培养15-18小时,之后收获培养物上清液以使用ready-set-go!elisa试剂盒(产品目录编号88-7316,ebiosciences)评估ifn-γ水平来测试抗pd-l1单抗的功能效果。如图7所示,hu333-2b、hu333-3a2、hu333-3c2、hu333-4a2及hu333-4b2皆以剂量依赖性方式导致ifn-γ分泌增加。相比之下,阴性对照牛血清清蛋白(bsa)不具有此类效果。使用来自两个不同供体的pbmc重复这些结果。尽管ifn-γ分泌的基础水平(不具有单抗)及在单抗处理下的量值变化在不同供体间变化,但ifn-γ分泌的增加倍数仍类似地取决于所有hu333的剂量浓度。实施例5:通过融合至经修饰人类igg1恒定区产生不具有效应器功能的重组抗pd-l1单抗经修饰人类igg1恒定区的设计pd-l1在广泛范围的正常人类细胞上表达,包括造血细胞,诸如t细胞、b细胞、树突细胞、巨噬细胞、间充质干细胞及骨髓衍生肥大细胞;及非造血细胞及组织,诸如肺、肝细胞、胰岛、胎盘合体滋养细胞(synctiotrophoblasts)及血管内皮(keir等人,2006jexpmed203:883-895;keir等人,2008annrevimmunol26:677-704;mu等人,2011medicaloncology28:682-688)。预期连接至人类野生型igg-γfc部分的pd-l1阻断性抗体会诱导γfc介导的效应器功能,例如抗体依赖性细胞介导的细胞毒性(adcc)及补体依赖性细胞毒性(cdc),它们可导致不想要的对重要器官的毒性。为了消除与抗pd-l1单抗关联的效应器功能,同时维持最佳物理化学性质,发明人通过将vh序列连接至突变的igg1恒定区来构建hu333-4a2及hu333-4b2全抗体,并经筛选找出降低或零fcγ受体(fcγr)结合或c1q结合活性,从而衰减或消除adcc及cdc效应器功能。已在文献中广泛研究igg1fc中涉及与fcγr及c1q相互作用的区域(tao等人,1993jexpmed178:661-7;cole等人,1997jimmunol159:3613-21;armour等人,1999eurjimmunol29:2613-2624;idusogie等人,2000jofimmunol164:4178-4184;shields等人,2001jofbiolchem276:6591-6604;lund等人,2002immunolletters82:57-65;综述strohl等人,2009currentopinioninbiotechnology20:685-691)。合起来,这些数据已指向较低铰链区(基于eu命名法的aa232-238)用于结合至fcγr及ch2域的结构群集区(基于eu命名法的d270、k322、p329及p331)用于结合至c1q的基本作用。另一方面,igg2在铰链区中具有相对于igg1的一些序列变化,这归于对除了fcγriiah131之外的大多数fcγr的较弱结合或无结合。实际上,大部分igg1铰链序列合并一些igg2序列的igg1/igg2杂合(igg1δb)经论证具有明显降低的对大多数fcγr的结合活性及衰减的adcc与cdc效应器功能(armour等人,1999eurjimmunol29:2613-2624)。在考虑到良好医药及物理化学性质的情况下通过诱变的合理设计,发明人在上文所描述的铰链及fc区中产生了众多突变体igg1,这些突变体分别被融合至hu333-4a2及hu333-4b2的可变区作为全抗体。与野生型igg相比,表15显示功能检定法中有利特征下的两种igg1突变体igg1mc及igg1mf。igg1mc(seqidno.28)相对于上文所描述的igg1/igg2杂合物含有额外突变v234a、g237a及p239a的组合。v234a及g237a的突变设计成减少γfc/fcγr结合界面处的表面疏水性侧链,以进一步降低对fcγriia及fcγriib的结合(lund等人,1992molimmunol29:53-59;lund等人,1996jimmunol157:4963-4969;wines等人,2000jimmunol164:5313-5318)。p239a突变设计成进一步降低c1q结合及cdc(idusogie等人,2000jofimmunol164:4178-4184)。igg1mf(seqidno.29)类似于igg1mc,不同的处在于氨基酸残基g237并非突变的。如前文部分中所描述的,在hek293-f细胞中表达重组全长抗pd-l1抗体hu333-4a2-igg1mc(seqidno.30及32)、hu333-4b2-igg1mc(seqidno.31及32)及hu333-4b2-igg1mf(seqidno.32及33),并纯化这些抗体。表15:igg1变体的序列修饰基于elisa的fcγr及c1q结合检定法据记载,在抗体-抗原复合体结合至fcγr或至补体组分c1q之后触发igg介导的效应器功能(nimmerjahn等人,2008naturerevimmunol8:34-47)。举例而言,当抗体结合至细胞表面靶蛋白,然后连接至效应器细胞上所表达的fcγriiia时,启动adcc。当通过结合至c1q蛋白使抗体交联细胞表面靶,从而导致补体复合体形成及活化以及靶细胞裂解的级联反应时,活化cdc。作为adcc、cdc及其它抗体介导的效应器功能的代理,抗体结合至fcγr及c1q的生物化学检定法可充当adcc及cdc的基本指标。发明人系统地评估具有经修饰恒定区的抗pd-l1抗体对所有主要fcγr及所有已知多态性变体,包括fcγri、fcγriiah131、fcγriiar131、fcγriiiaf158、fcγriiiav158、fcγriib及fcγriiib的结合。如前文部分中所描述的,将fcγr的胞外域融合至c末端his标签。如所描述的,通过瞬时转染在293-f细胞中表达重组蛋白及使用ni-sepharose柱继之以凝胶过滤柱纯化。除了fcγriib及fcγriiib使用ni-螯合物板(产品目录编号15242,pierce,thermofisher)之外,在nuncmaxisorpelisa板(产品目录编号442404,nunc,thermofisher)上包被2-5μg/mlfcγr。在洗涤及封闭孔后,将预形成的免疫复合体添加至每个孔,并在室温温育1-2小时。预形成的免疫复合体在封闭缓冲液中包含60ng/ml链霉亲合素-hrp、60ng/ml生物素化f(ab')2山羊抗人类igg(产品目录编号109-066-097,jacksonimmunores,westgrove,pa,美国)及1-5μg/ml指示的融合至人源化抗pd-l1(hu333-4a2或hu333-4b2)的igg1fc变体。在洗涤板四次后,使用immobilon化学发光底物a/b(产品目录编号wbkls0500,millipore)通过化学发光检测结合信号。表16汇总hu333-4a2-igg1mc(seqidno.30及32)、hu333-4b2-igg1mc(seqidno.31及32)及hu333-4b2-igg1mf(seqidno.32及33)结合至各种fcγr的结果。与hu333-4a2-igg1wt相比,所有三种igg1突变体hu333单抗皆具有很低的对fcγr的结合活性,指示上述所有三种hu333单抗会具有明显降低的fcγr介导的效应期功能。表16:基于elisa的igg1变体对fcγr的结合基于facs的fcγr结合检定法也通过流式细胞术测定各种igg1格式(wt,igg1mc、igg1mf,seqidno.27-29)中的人源化抗pd-l1对fcγr的结合。简言之,建立表达人类fcγr的一系列稳定hek293转染子。这些稳定细胞系分别表达fcγri、fcγriiah131、fcγriiar131、fcγriib、fcγriiiaf158或fcγriiiav158。多亚基fcγr(即fcγri及fcγriiia)与fcrγ亚基共同表达。使用二抗(山羊抗人类iggf(ab)'2-alexafluor488,产品目录编号109-546-097,jacksonimmunoresearch,westgrove,pa,美国)检测具有igg1变体的单体抗pd-l1单抗(表17)对表达fcγr的hek293细胞的结合。如预期,igg1wt格式的hu333-4a2(hu333-4a2-igg1wt)具有对fcγri、fcγriiah131及fcγriiiav158的强结合信号(mfi),且具有对fcγriiar131、fcγriib及fcγriiiaf158的弱但明显的结合信号(表17)。经修饰的igg1变体(hu333-4a2-igg1mc、hu333-4b2-igg1mc及hu333-4b2-igg1mf,seqidno.30-33)具有明显降低的结合信号,接近于背景。表17:通过facs测定单体igg1变体对fcγr的结合强度(mfi*)已显示,抗体结合至fcγr,在免疫复合体形式中具有大得多的强度,此归因于多价效应(bruhns等人,2009blood113:3716-3725)。此类结合被认为在生理条件下更为相关,因为单体γfc与大多数fcγr之间的结合强度很弱。人类免疫系统也利用此机制避开血清中高水平存在的单体igg非特异性活化fcγr。为了评估免疫复合体形式的对fcγr的结合,在facs缓冲液中将10μg/ml人源化333单抗作为多种igg1突变体形式与3μg/ml生物素-pd-l1/his及1.5μg/ml中性亲合素(产品目录编号a-2666,invitrogen)预混合,以形成多价免疫复合体,随后与表达fcγr的hek293细胞一起温育。使用山羊抗人类iggf(ab')2-alexafluor488(产品目录编号109-546-097,jacksonimmunoresearch)检测结合。如表18中所示,预形成的免疫复合体中的hu333-4a2-igg1wt在比单体igg1所为好得多的强度下结合至低亲和力fcγr(fcγriia、fcγriib及fcγriiia)(表18数据对比表17数据)。此外,再次,选定igg1突变体中的抗pd-l1单抗(hu333-4a2-igg1mc、hu333-4b2-igg1mc及hu333-4b2-igg1mf,seqidno.30-33)具有明显降低的结合信号,接近于背景。合起来,经修饰igg1格式的人源化333具有很少的对fcγr的结合,因此它们在生理条件下应具有很少fcγr介导的效应器功能。表18:通过facs测定igg1变体作为免疫复合体对fcγr的结合强度(mfi*)通过常规elisa方法及少量修改实行基于elisa的c1q结合检定法。简而言之,将指示量的融合至野生型或者经修饰igg1恒定区的人源化333抗体包被至maxisorpelisa板上。在封闭及洗涤后,用2μg/ml人类c1q(产品目录编号a400,quidel,圣地亚哥,美国)在室温温育这些孔2小时。在洗涤后,使用针对人类c1q的鼠类单克隆抗体(产品目录编号a201,quidel)及hrp缀合的抗鼠类igg(产品目录编号a0168,sigma,上海,中国)检测结合的c1q。如图8所示,与hu333-4a2-igg1wt形成对比,三种具有经修饰igg1fc变体的单抗不存在可检测的c1q结合,包括hu333-4a2-igg1mc(seqidno.30及32)、hu333-4b2-igg1mc(seqidno.31及32)及hu333-4b2-igg1mf(seqidno.32及33)。数据指示,igg1mc(seqidno.28)或igg1mf(seqidno.29)格式的人源化333抗体会具有很低或零cdc效应器功能。adcc经典抗体依赖性细胞的细胞毒性(adcc)涉及通过抗体接合至fcγriiia(cd16)来活化nk细胞。为了测试融合至选定人类igg1变体的人源化抗pd-l1抗体是否诱导adcc,将nk92mi/cd16v细胞用作效应细胞,nk92mi/cd16v细胞是通过共同转导含有cd16(v158等位基因)与fcrγ基因的表达质粒自nk92mi细胞(产品目录编号crl-2408,atcc)产生的,且将表达pd-l1的hek293细胞系hek293/pd-l1用作靶细胞。在96孔v形底板中在hu333-igg1变体(0.0001-1μg/ml)存在下将效应细胞(105个细胞/孔)与靶细胞(104个细胞/孔,e:t=10)共同培养5小时。使用cytotox96非放射性细胞毒性检定试剂盒(promega,madison,wi)通过乳酸脱氢酶(ldh)释放检定法测定nk92mi/cd16细胞对hek293/pd-l1细胞施加的细胞毒性。通过以下方程测定特异性裂解。与igg1mc及igg1mf格式的hu333不具有或具有明显降低的对fcgriiia的结合的事实(参看上文部分)一致,adcc检定法显示出hu333-4b2-igg1mc(seqidno.31及32)与hu333-4b2-igg1mf(seqidno.32及33)两者仅具有基础水平的adcc。相比之下,具有野生型igg1fc的333-4a2-igg1wt在1μg/ml的浓度诱导20%的特异性细胞裂解(图9)。cdc大体而言,人类igg1抗体经由经典途径诱导明显的补体依赖性细胞毒性(cdc)。使用表达pd-l1的b细胞系daudi/pd-l1及来自健康供体的新鲜人类血清评估选定igg1突变体格式(igg1mc及igg1mf)的人源化抗pd-l1抗体是否触发cdc,该新鲜人类血清含有cdc的所有必需组分。通过celltiterglo检定试剂盒(promega)测定cdc的细胞裂解。简言之,在96孔平底板中在37℃在具有抗pd-l1抗体(0.001-10μg/ml)的无血清rpmi1640(invitrogen)中温育daudi/pd-l1细胞(2×104个细胞/孔)15分钟,随后添加正常人类血清至16.6%的终浓度,总体积为120μl。在37℃过夜温育后,细胞裂解及检定atp浓度。由于daudi细胞组成性表达cd20,所以将抗cd20单抗利妥昔单抗(roche)用作阳性对照。atp量与培养物中存在的细胞数成正比。使用96孔荧光计(pherastarfs,bmglabtech)读取荧光。以与活细胞数成比例的相对荧光单位(rfu)表示结果。百分比cdc活性计算如下:%cdc活性=[(rfu测试-rfu背景)/(完全细胞裂解下的rfu-背景rfu)]×100。如图10所示,利妥昔单抗诱导cd20+daudi/pd-l1细胞中的强cdc。相比之下,hu333-4b2-igg1mc(seqidno.31及32)与hu333-4b2-igg1mf(seqidno.32及33)两者显示出无cdc。具有野生型igg1fc的抗体333-4a2-igg1wt展现低但处于基础水平以上的cdc活性,尤其是在0.3μg/ml以上的浓度。这些数据与igg1mc及igg1mffc格式具有很少或明显降低的对补体组分c1q的结合的事实(参看前文部分)一致。实施例6:经修饰igg1格式的人源化单抗333的功能活性在基于细胞的结合检定法及功能评估中表征上文所描述的经修饰igg1格式的三种人源化单抗。表19汇总关于hu333-4a2-igg1mc、hu333-4b2-igg1mc及hu333-4b2-igg1mf(seqidno.30-33)的研究结果。如前文部分中所描述地执行facs结合分析。与hek293/pd-l1细胞一起温育抗体的连续稀释液并使用山羊抗人类iggf(ab')2-alexafluor488(产品目录编号109-546-097,jacksonimmunoresearch)检测结合。对于选定单抗观察到对表达于hek293细胞的表面上的天然pd-l1蛋白的剂量依赖性结合活性。如表19所示,hu333-4a2-igg1mc、hu333-4b2-igg1mc及hu333-4b2-igg1mf显示出类似的对hek293/pd-l1细胞的剂量依赖性结合活性,其中ec50(50%活性时的有效浓度)为约0.1μg/ml。如早前所描述地执行基于facs的竞争检定法。表19中所显示的结果论证了hu333-4a2-igg1mc、hu333-4b2-igg1mc及hu333-4b2-igg1mf几乎同样好地竞争掉了对hek293/pd-l1细胞的pd-1/fc结合(0.167-0.174μg/ml的ic50)及cd80/fc结合(0.078-0.118μg/ml的ic50)两者。如前文部分中所描述,在hut78/pd-1与hek293/os8/pd-l1共同培养系统中评估经过纯化的抗pd-l1单抗的功能。如表19所示,人源化333单抗为此共同培养系统中的pd-l1/pd-1信号传导的有力拮抗剂,并诱导升高的il-2分泌。与基于facs的竞争检定法的结果一致,hu333-4a2-igg1mc、hu333-4b2-igg1mc及hu333-4b2-igg1mf在此检定法中显示出类似效力,其中具有非常接近的ec50(0.075-0.087μg/ml)及最大il-2诱导水平(287-300pg/ml)。也在反转信号传导系统中评估经过纯化的抗pd-l1单抗的功能,其中如所描述共同培养hut78/p3z及hek293/pd-l1。一致地,人源化333单抗为此共同培养系统中pd-l1/p3z信号传导的有力抑制剂,并抑制由pd-l1/p3z接合所诱导的il-2分泌。此外,再次,hu333-4a2-igg1mc、hu333-4b2-igg1mc及hu333-4b2-igg1mf在检定法中显示出类似效力,如类似ic50(0.037-0.045μg/ml)及最大抑制水平(99%)所示(表19)。表19:基于细胞的检定法中hu333-4a2-igg1mc、hu333-4b2-igg1mc及hu333-4b2-igg1mf的活性为了验证人源化333抗体是否也对原代人类免疫细胞施加功能性影响,发明人使用新鲜分离的外周血单个核细胞(pbmc)检定抗体功能,所述外周血单个核细胞主要由t细胞(50-70%)、b细胞及nk细胞(15-30%)以及单核细胞(2-10%)组成。根据制造商的使用说明,通过使用ficoll淋巴细胞分离介质(histopaque-1077;产品目录编号10771,sigma)的密度梯度离心而从健康供体中分离人类pbmc。人类血液采集遵循beigene的内部程序进行。随后用40ng/ml的抗cd3单抗okt3(产品目录编号16-0037,ebioscience,ca)刺激pbmc达3天,之后进行检定法。为了模拟在接合tcr/cd3复合物后预活化的t细胞对表达pd-l1的肿瘤细胞的响应,在96孔平底板的每个孔中将pbmc(1×104个细胞)与hek293/os8/pd-l1细胞(3×104个细胞)共同培养。向培养物添加指示浓度的抗pd-l1抗体。在共同培养15-18小时之后,通过elisa使用ready-set-go!elisa试剂盒(产品目录编号88-7316,ebiosciences)对培养物上清液检定ifn-γ水平,此ifn-γ水平为t细胞活化以及其它免疫细胞活化的最突出指标(thakura.等人,2012vaccine,30:4907-4920)。如图11所示,预活化的pbmc及hek293/os8/pd-l1细胞的共同培养物中单抗hu333-4a2-igg1mc或hu333-4b2-igg1mf的存在导致ifn-γ产生以剂量依赖性方式增加。作为对照,huigg不具有刺激ifn-γ分泌的此效果。hu333-4a2-igg1mc及hu333-4b2-igg1mf的效力与亲本鼠类抗体mu333-igg相当。尽管无抗体处理的ifn-γ基础水平在不同供体间变化,但在0.1至10μg/ml的抗体处理(取决于供体在10μg/ml处约5-8倍诱导)的范围内由hu333-4a2-igg1mc、hu333-4b2-igg1mf及mu333-igg处理的pbmc中的ifn-γ分泌增加在统计学上为明显的。合起来,这些数据论证了在所有基于细胞系及原代免疫细胞的检定法中,hu333-4a2-igg1mc、hu333-4b2-igg1mc及hu333-4b2-igg1mf是阻断pd-l1/pd-1相互作用及下游信号传导的有力拮抗剂。由于它们在序列上非常类似(仅在框架区内存在少数差异),共享相同的结合表位,且具有非常类似的结合亲和力及特异性(参阅下文部分),因此它们在功能活性及效力上非常类似。实施例7:人源化抗pd-l1单抗的结合亲和力及特异性抗pd-l1单抗对来自不同物种的pd-l1蛋白的结合特异性使用人类、食蟹猴(macacafascicularis)及小鼠(musmusculus)pd-l1作为靶蛋白研究单抗hu333(hu333-4a2-igg1mc、hu333-4b2-igg1mc及hu333-4b2-igg1mf)的结合特异性。以与早前所描述的人类pd-l1/his类似的方式表达及纯化猴pd-l1/his及鼠类pd-l1/his。y1为参照功能性抗pd-l1单抗,依照已公开专利(us2010/0203056a1)合成及融合至人类igg1mc变体。合成的全长单抗命名为y1-igg1mc。基本上以前文部分中所描述的相同方式执行elisa检定法。简而言之,在nuncmaxisorpelisa板(产品目录编号442404,nunc,thermofisher)的每个孔上包被200ngpd-l1蛋白。在洗涤及封闭后,添加指示浓度的抗pd-l1单抗,并在室温温育1小时。在洗涤后,使用hrp缀合的山羊抗人类fc抗体(产品目录编号a0170,sigma)检测结合的抗pd-l1单抗。如图12所示,hu333-4a2-igg1mc(seqidno.30及32)、hu333-4b2-igg1mc(seqidno.31及32)及hu333-4b2-igg1mf(seqidno.32及33)以剂量依赖性方式结合至人类及猴pd-l1,但不结合至鼠类pd-l1,与原始mu333是由利用人类pd-l1/fc所免疫的小鼠产生及人类与猴pd-1共享高度的序列同源性(96%)的事实一致。相比之下,y1-igg1mc结合至来自人类、猴及小鼠的所有pd-l1蛋白。通过spr进行人源化抗pd-l1fab的亲和力测定将hu333-4a2(seqidno.21及23)、hu333-4b2(seqidno.22及23)及参照抗体y1构建为人类igg1fab格式,其中将vh及vk分别融合至人类igg1-ch1及κ链恒定区的n末端。将igg1-ch1融合至c末端his6标签以促进纯化。如前文部分中所描述执行重组fab的表达及纯化。为了抗pd-l1fab的亲和力测定,如早前所描述使用biacoretmt-200仪器(gelifesciences,上海,中国)实施spr检定法。使用一对一langmuir结合模型(biaevaluationsoftware,gelifesciences)计算结合速率(kon)及解离速率(koff)。以比率koff/kon计算平衡解离常数(kd)。表20中列出spr测定的抗pd-l1fab的结合亲和力。hu333-4a2及hu333-4b2fab以比y1fab所为更高的亲和力结合至人类pd-l1,该更高亲和力由更快kon、更慢koff及小得多的kd值指示。hu333-4a2及hu333-4b2fab以与结合至人类pd-l1几乎相同的方式结合至猴pd-l1。相比之下,y1fab以比结合至人类pd-l1低约100倍的亲和力结合至猴pd-l1(对人类pd-l1为0.18nm的kd及对猴pd-l1为16.2nm的kd)。表20:通过spr所测定的抗pd-l1fab对人类及猴pd-l1的亲和力抗pd-l1单抗的表位定位关于pd-1/pd-l1复合物的晶体结构的先前报告阐明与受体pd-1直接相互作用的pd-l1的关键氨基酸(aa)残基(zhang等人,2004immunity20:337-347;lin等人,2008pnas105:3011-3016;lazar-molnar等人,2008pnas105:10483-10488)。经由点突变分析,pd-l1序列中的八个aa残基鉴定为它结合至pd-1所需要的。基于来自结构指导的突变分析的信息,发明人假设,功能性单抗阻断pd-l1介导的信号传导的最有效方式为通过结合至八个关键aa残基,从而占据它结合至pd-1受体所需的结合表位来与pd-1竞争。为了探索该假设及为了理解功能性pd-l1单抗的作用机制,发明人通过将八个关键aa的每一个个别替换成ala(即,f19a、i54a、r113a、m115a、d122a、y123a、k124a及r125a)产生pd-l1的八个突变体(基于lin等人,2008pnas105:3011-3016的aa残基编号方式)。将野生型pd-l1/his(图1)用作使用快速诱变试剂盒(产品目录编号fm111,全式金生物,北京,中国)的滚环诱变的模板。在发明人的基于pcdna的表达载体中亚克隆所有突变体,并通过测序验证。通过如前文部分中所描述的瞬时转染表达突变体及野生型pd-l1/his蛋白。在培养4-6天后收集条件化培养基(cm),且通过western印迹分析该条件化培养基,以就质量与数量而言验证pd-l1/his蛋白表达。在清除细胞碎片后,在elisa分析或western印迹中直接使用上清液(cm)以用于表位定位。执行使用野生型及突变体pd-l1/his的elisa检定法以研究抗pd-l1单抗的结合表位。为了比较抗体结合表位,在研究中包括来自发明人的若干鼠类单抗及一个参照抗体y1-igg1(调整自us2010/0203056a1及融合至人类igg1κ恒定区)。在相同elisa检定法中,在针对所有单抗的96孔板中包被相等体积的含有野生型或突变体pd-l1/his的cm。使用野生型pd-l1结合信号的均值elisa读数作为标准标准化elisa结果。将对特定突变体pd-l1的elisa结合信号针对对该特定突变体pd-l1的最高抗体结合读数(设定为100%)进一步标准化以均匀化pd-l1突变体之间的表达变化。为了便于数据分析,当单抗针对特定pd-l1突变体的elisa结合信号相对于野生型pd-l1下降到50%以下时,定义结合功能因对应氨基酸突变而明显受损。同样地,若单抗针对特定突变体的elisa结合信号下降到25%以下,则定义为非常明显。如图13a所示,pd-l1中的氨基酸残基r113对于hu333-4b2-igg1结合至pd-l1为关键的,其突变明显减弱了hu333-4b2-igg1结合至pd-l1。另一方面,参照抗体y1-igg1具有区别性结合表位。除了r113之外,f19、i54、d122及y123也皆为结合的重要表位(图13b)。也在来自发明人的研究的其它抗pd-l1单抗中观察到结合表位的不同标志。尽管抗原蛋白为变性的,但来自western印迹的hu333-4b2-igg1及y1-igg1抗体两者的数据确认了这些结果。除了上述关键结合表位突变之外,发明人也产生突变d26a。elisa及western印迹结果显示出pd-l1中的突变d26a明显抑制了包括单抗mu333、hu333-4b2-igg1及y1-igg1的所有功能性抗pd-l1单抗的结合活性,但并未抑制非功能性抗体(诸如mu260)的结合(图13c)。如表21中所汇总,类似于mu333及其衍生人源化单抗,hu333-4b2结合至人类pd-l1的两个关键氨基酸残基(表位)d26及r113;相比之下,单抗y1结合至至少六个氨基酸残基。表21:表位定位结果汇总单抗f19ad26ai54ar113am115ad122ay123ak124ar125ahu333-4b2-igg1*****y1-igg1***************与野生型pd-l1相比突变抑制>50%结合。***与野生型pd-l1相比突变抑制>75%结合。经由表位定位研究,发明人已论证,抗pd-l1单抗能够经由分子识别结合至不同表位标志,此可能对结合亲和力、结合特异性及功能活性具有深远的影响,例如hu333-4a2及hu333-4b2仅可结合至人类pd-l1(图12a),而不可结合至小鼠pd-l1(图12c);相比之下,尽管人类及小鼠pd-l1具有26%的序列分歧度,但y1结合至人类及小鼠pd-l1两者(图12a及图12c)。对人类血清蛋白质的非特异性结合为了检查单抗mu333是否具有对人类血清蛋白质的非特异性结合,使用包被有5%人类血清(来自健康供体)及如图14ax轴所指示的各种浓度的pd-l1/his抗原的96孔nuncmaxisorpelisa板执行elisa研究。在elisa反应中添加相同量的鼠类pd-l1抗体或嵌合y1(命名为y1-muigg1,由y1可变域融合至鼠类igg1κ恒定区制成),且用抗小鼠fc-hrp(产品目录编号a9309,sigma)检测结合。包括无任何抗体的pbs缓冲液作为阴性对照(图14)。如图14所示,mu333的基线o.d.读数(很低抗原浓度时的读数)与阴性对照几乎相同,而y1-muigg1的基线o.d.读数比阴性对照(pbs)高4倍,此指示在结合选择性方面mu333与y1-migg1之间的差异特性。对于非特异性结合,也在类似检定方法中使用胎牛血清(fbs)代替人类血清评估人源化单抗hu333-4b2-igg1mc及hu333-4b2-igg1mf。联想到它的亲本小鼠杂交瘤单抗,hu333-4b2-igg1mc及hu333-4b2-igg1mf不具有对fbs的结合。实施例8:药动学小鼠体内hu333-4b2-igg1mf的药动学遵循beigene动物护理及使用程序执行所有动物研究。使用10至12周大雌性balb/c裸小鼠(18-25g)研究人源化单抗hu333-4b2-igg1mf(seqidno.32及33)的药动学。作为单次静脉内(i.v.)或者皮下(s.c.)注射向小鼠给药10mg/kg单抗hu333-4b2-igg1mf。经由尾静脉施用静脉内注射,且在体侧中施用皮下注射。在每个注射组中,将小鼠分成不同亚组,且在每个亚组中,在某些时间点收集血清。对于静脉内注射组,在给药前2天,及给药后15分钟、30分钟、60分钟、90分钟、6小时、24小时,及在第2天、第3天、第4天、第5天、第7天、第10天、第14天、第21天及第28天一次采集血清。对于皮下注射组,在给药前2天,及给药后1.5小时、6小时、24小时,及在第2天、第3天、第4天、第5天、第7天、第10天、第14天、第21天及第28天一次采集血清。通过elisa使用人类pd-l1/his蛋白质测定hu333-4b2-igg1mf的血清水平。简而言之,在4℃用每孔100μl3μg/ml人类pd-l1/his蛋白质包被nuncmaxisorpelisa板(产品目录编号442404,nunc,thermofisher)过夜。用pbs中的3%牛血清清蛋白、0.05%tween20(封闭缓冲液)在室温封闭板1小时。在洗涤后,添加连续稀释血清样品及经过纯化的hu333-4b2-igg1mf标准品,并在室温温育1小时。在洗涤后,使用hrp缀合的山羊抗人类fc抗体(产品目录编号a0170,sigma)检测结合的hu333-4b2-igg1mf及使用tmb底物(产品目录编号t0440,sigma)显色。使用非线性回归拟合标准曲线,且从标准曲线及稀释因子中推导出hu333-4b2-igg1mf的血清浓度。使用静脉内及皮下给药的非隔室模型(winnonlin,pharsight)分析hu333-4b2-igg1mf的血清浓度对时间数据。从winnonlin数据拟合中推导出清除率、分布体积、半衰期、均值驻留时间及生物利用度。在表22中汇总小鼠体内hu333-4b2-igg1mf的药动学。在静脉内给药后,hu333-4b2-igg1mf(seqidno.32及33)浓度以两阶段方式自血清清除。终末半衰期为约10-14天。在10mg/kg静脉内给药后,清除率为小鼠体内7.9ml/日/kg。在皮下施用后,血清中的hu333-4b2-igg1mf的峰浓度为相同剂量的静脉内施用后所记录的约30-50%。在10mg/kg皮下及静脉内给药后的auc的比较指示90%的生物利用度。所有这些pk参数接近于典型人源化单克隆抗体的那些pk参数,从而指示hu333-4b2-igg1mf(seqidno.32及33)在小鼠体内具有较好的体内稳定性。食蟹猴体内hu333-4b2-igg1mc的药动学在食蟹猴体内研究hu333-4b2-igg1mc(seqidno.31及32)的药动学。由于人源化333结合至人类及猴pd-l1具有几乎相同的亲和力,食蟹猴体内的药动学概况应非常具有信息性及可扩展性以预测人类体内的药动学概况。在3dbiooptimaco.ltd(苏州,中国)处遵循3dbiooptima的动物护理及使用程序实行药物施用及血清收集。简而言之,作为静脉内(i.v.)单剂向两只3-5岁大雄性猴给药10mg/kg单抗hu333-4b2-igg1mc。在给药前2天,给药后5分钟、30分钟、2小时、6小时、12小时、24小时、36小时及2天、3天、5天、7天、10天、15天、22天、30天经由头静脉将血液样品(约1ml)收集至管中。基本上如上文所描述地执行基于elisa的生物分析及药动学分析。除了给药后22天及30天的时间点以外,在每个时间点,将来自2只猴的平均血清浓度用于拟合,而在给药后22天及30天的时间点,仅使用来自一只猴的数据,因为另一只猴在这两个时间点显示出加速的清除率及不可检测的hu333-4b2-igg1mc血清水平,推测原因为猴抗药物免疫应答。使用静脉内给药的非隔室模型分析hu333-4b2-igg1mc的血清浓度对时间数据。表22:在皮下/静脉内施用后裸小鼠体内hu333-4b2-igg1mc的药动学表23:在静脉内施用后食蟹猴体内hu333-4b2-igg1mc的药动学在表23中汇总食蟹猴体内hu333-4b2-igg1mc的药动学。在静脉内施用后,hu333-4b2-igg1mc浓度以双阶段方式自血清清除。终末半衰期为约9天。在10mg/kg静脉内给药后,清除率为食蟹猴体内6.4ml/日/kg。在静脉内施用后,hu333-4b2-igg1mc的峰浓度为给药后5分钟时的283μg/ml。这些pk参数指示hu333-4b2-igg1mc在食蟹猴体内具有正常药动学概况,此预测人类体内的正常药动学行为(deng等人,2011mabs3:61-66)。实施例9:人源化抗pd-l1单抗在体内在小鼠异种移植物癌症模型中抑制肿瘤生长基于t细胞系及pbmc的实验指示,抗pd-l1单抗可能在小鼠癌症模型中起作用,该小鼠癌症模型使用免疫受损小鼠,异种移植人类癌细胞,随后植入人类pbmc且应用单抗治疗以抑制体内癌细胞生长。同种异基因小鼠癌症模型设计如下。用环磷酰胺预处理雌性nod/scid小鼠(6-7周)。从健康人类志愿者的血液中分离人类外周血单个核细胞(pbmc),与a431表皮样癌细胞(产品目录编号crl-1555atcc)及基质凝胶混合,并皮下注射至动物的右前体侧中。从细胞接种后的第0天开始,将动物随机指派给3个组,其中每组有8只小鼠。每周两次(biwi.p.)用媒介(pbs)或10mg/kghu333-4b2-igg1mf(seqidno.32及33)处理小鼠,持续4周。每周两次记录动物个体体重及肿瘤体积,在研究持续期间每日对小鼠监测毒性的临床征象。使用以下公式计算肿瘤体积:[d×(d2)]/2,其中d表示肿瘤的大直径,且d表示小直径。如图15所示,在抗pd-l1单抗(hu333-4b2-igg1mf)处理组中,a431肿瘤生长与pbs处理组中的肿瘤生长相比更慢。结果指示,所描述的抗pd-l1单抗可活化人类免疫细胞来抑制小鼠体内癌症模型中的肿瘤细胞生长,与前文部分中所描述的体外实验结果一致。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1