一种透明质酸钠/海藻酸钠注射型复合水凝胶的制备方法与流程
本发明涉及一种注射型水凝胶的制备方法,尤其是涉及透明质酸钠/海藻酸钠复合水凝胶的制备方法。
背景技术:
水凝胶材料在长效缓释给药、组织修复和细胞移植中所展现出的广阔应用前景,使其迅速成为生物材料领域最热门的研究方向之一。注射型水凝胶作为一种新型材料可以弥补传统水凝胶的不足,它可以通过注射器直接植入到组织内部,避免了开创性手术对机体组织的破坏性,降低了临床应用的难度[toddr.hoare,daniels.kohane.hydrogelsindrugdelivery:progressandchallenges.polymer.2008;49:1993-2007.]。但是,目前研究和应用的大多数注射型水凝胶都是通过物理缔合作用,利用机体组织内部环境(温度、ph值和离子强度等)的改变来引发水凝胶网络的形成。温敏型聚氧乙烯–聚氧丙烯嵌段共聚物[chenpc,kohaneds,parkyj,bartlettrh,langerr,yangvc.journalofbiomedicalmaterialsresearchparta2004;70(3):459e66.;paavolaa,yliruusij,kajimotoy,kalsoe,wahlstromt,rosenbergp.pharmaceuticalresearch1995;12:1997-2002.]、聚乙二醇-聚(乳酸-羟基乙酸)[singhs,websterdc,singhj.internationaljournalofpharmaceutics2007;341:68-77.]、聚异丙基丙烯酰胺-聚磷酸胆碱[licm,tangyq,armessp,morriscj,rosesf,lloydaw,etal.biomacromolecules2005;6(2):994-9.],ph敏化型多肽[limdw,nettlesdl,settonla,chilkotia.biomacromolecules2007;8(5):1463-70.]和离子强度敏化型藻朊酸盐[westhause,messersmithpb.biomaterials2001;22(5):453-462.]高分子材料的合成为注射型水凝胶的研究和应用打下了良好的基础。然而,此类物理缔合凝胶在人体组织内部的交联固化周期较长,并且其缔合作用较弱,大大限制了其临床的应用范围[toddr.hoare,daniels.kohane.hydrogelsindrugdelivery:progressandchallenges.polymer.2008;49:1993-2007.]。
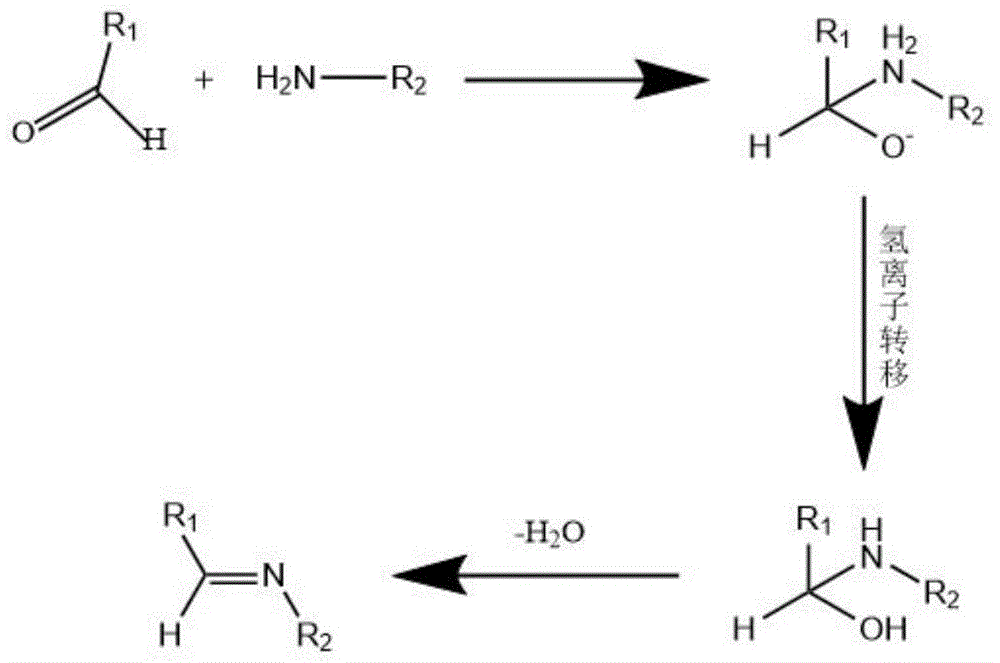
与物理缔合凝胶相比,化学凝胶展现出了交联速度快,稳定性和机械性能优良的优势。但是,大多数化学凝胶的交联过程需要额外加入引发剂,这些引发剂往往都具有较高的毒性和特定的引发条件,不适合在生物体内原位使用[toddr.hoare,daniels.kohane.hydrogelsindrugdelivery:progressandchallenges.polymer.2008;49:1993-2007.]。另一方面,目前大部分化学凝胶通常由人工合成或半合成的高分子组成,其主要存在的问题是材料的合成过程复杂,生物相容性差,生物可降解效率低,并且存在一定的免疫原性,使其在生物医学的应用上存在较多的局限性和安全隐患。席夫碱反应是通过将带醛基的化合物与带氨基的化合物通过醛基与亚氨基缩合成席夫碱而进行共价交联的过程(反应过程如图1所示),如胶原合成过程中,肽链中赖氨酸残基的ε氨基氧化为醛基,可与另一肽链中赖氨酸的ε氨基进行的缩合反应,以形成肽链间的交联键,以稳定胶原结构,交联周期可以控制在2-6min。
技术实现要素:
本发明要解决的第一个问题是提供一种透明质酸钠/海藻酸钠注射型复合水凝胶的制备方法,该方法基于透明质酸钠(以后简称:ha)以及海藻酸钠(以后简称:alg)和席夫碱交联反应构建出一种新型注射型,力学性能及生物降解时间可控水凝胶材料。
本发明要解决的第二个技术问题是提供一种透明质酸钠/海藻酸钠注射型复合水凝胶的体内安全性表征;上述新型注射型生物可降解水凝胶材料可以作为药物载体、组织修复及支架材料,并能够以溶液的形式注射入人体组织、器官、身体空腔内,在生理环境下交联固化。
为解决上述第一个技术问题,本发明制备的一种透明质酸钠/海藻酸钠注射型复合水凝胶,通过1-乙基-3-(3-二甲氨基)碳二亚胺盐酸盐引发己二酸二酰肼(以下简称:adh)的氨基与ha的主链羧基的缩合反应,制备主链具有氨基的透明质酸-己二酸二酰肼衍生物(以下简称:ha-adh);然后利用高碘酸钠将海藻酸钠氧化成带有醛基的海藻酸钠衍生物(以下简称:alg-cho);再将ha-adh与alg-cho分别溶解后按一定比例混合,固化形成透明质酸钠/海藻酸钠注射型复合水凝胶。合成及交联过程如图2所示。
本发明涉及的一种透明质酸钠/海藻酸钠注射型复合水凝胶的制备方法,包括如下具体步骤:
1)透明质酸-己二酸二酰肼衍生物(以下简称:ha-adh)的制备;
将一定量的ha溶解在去离子水中配置成0.3%-2wt%的水溶液,然后在水溶液中加入8-25倍ha重量的己二酸二酰肼(以后简称:adh)并通过naoh和/或hcl调整溶液ph值到5.0-7.4,再加入1-4倍ha重量的1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(以后简称:edc),引发反应≥12小时;反应溶液经过透析提纯后冻干保存;完成ha-adh的制备。
2)海藻酸钠衍生物(以后简称:alg-cho)的制备;
取一定量的海藻酸钠溶解在去离子水中配置成0.3%-2%的水溶液,另取0.5-1倍海藻酸钠重量的高碘酸钠溶解于超纯水中配成10%的溶液;然后将高碘酸钠溶液逐滴加入海藻酸钠溶液中,室温搅拌≥2小时;后加入一定量的乙二醇终止氧化反应,最后将反应溶液透析提纯,再进一步冻干得到产物alg-cho粉末。
3)水凝胶的制备;
将步骤1)制备的ha-adh溶于缓冲溶液中,将步骤2)制备的alg-cho冻干粉末溶于缓冲溶液中,ha-adh和alg-cho分别按一定浓度溶解,混合后得到混合溶液,将混合溶液放置在37℃条件下形成透明质酸钠/海藻酸钠注射型复合水凝胶。
优选地,步骤1)中,所述透析提纯使用截留分子量8-10kda的透析袋。
优选地,步骤1)中,ha水溶液的重量百分浓度为0.5-1%。更优选地,ha水溶液的重量百分浓度为0.5%。
优选地,步骤1)中,所述己二酸二酰肼与ha的重量比为10-15:1;更优选地,所述己二酸二酰肼与ha的重量比为10:1。
优选地,步骤1)中,所述1-乙基-(3-二甲基氨基丙基)碳酰二亚胺与ha的重量比为1-3:1。更优选地,所述1-乙基-(3-二甲基氨基丙基)碳酰二亚胺与ha的重量比为2:1。
优选地,步骤1)中,所述ha的分子量为60-200kda。
优选地,步骤2)中,所述海藻酸钠与高碘酸钠的重量比为1:0.5-1;更优选地,所述海藻酸钠与高碘酸钠的重量比为1:0.55;
优选地,步骤2)中,所述透析提纯使用截留分子量8-10kda的透析袋;
优选地,步骤3)中,所述缓冲溶液为磷酸溶液;
优选地,步骤3)中,所述混合溶液中ha-adh的质量百分比溶度为1-5%;混合溶液中alg-cho的质量百分比浓度为1-5%;
优选地,步骤3)中,ha-adh与alg-cho的质量比为1:0.5-5;
优选地,步骤3)中,混合溶液在37℃、ph=7.4的生理条件下能够在3-10min内迅速交联形成透明质酸钠/海藻酸钠注射型复合水凝胶。
为解决上述第二个技术问题,本发明新型注射型生物可降解水凝胶材料的应用:将新型注射型生物可降解水凝胶材料与药物、蛋白、细胞、无机颗粒等混合均匀,再将混合溶液倒入容器、模型或注射植入到动物或人体组织、器官、身体空腔内,使溶液在37℃交联固化。
本发明具有如下有益效果:
1)透明质酸钠/海藻酸钠复合水凝胶主体材料中的透明质酸钠ha是一种广泛分布于人体各部位的黏性多糖,由于其具有优良的生物相容性和生物可降解性而被广泛地应用在化妆品、保健和医药领域。复合水凝胶中的海藻酸钠是从褐藻类的海带或马尾藻中提取碘和甘露醇之后的副产物,其形成凝胶的条件温和,可以避免敏感性药物、蛋白质、细胞和酶等活性物质的失活,在医药领域得到广泛应用。
2)透明质酸钠/海藻酸钠复合水凝胶制备方法简单,应用前景良好,能通过改变ha-adh和alg-cho的组成配比,调控水凝胶材料的机械性能和降解周期。
3)透明质酸钠/海藻酸钠复合水凝胶的席夫碱交联反应具有环境友好性和反应速度可控性,为其在体内注射型生物医用水凝胶的应用中奠定了良好的基础。
4)与传统的物理缔合注射型凝胶相比,ha-adh/alg-cho共价交联复合水凝胶具有优良的稳定性和机械性能。
附图说明:
图1为席夫碱反应机理图。
图2为ha-adh和alg-cho水凝胶前体材料的合成及水凝胶交联反应机理图。
图3为实施例1中ha-adh/alg-cho水凝胶的共混注射及固化照片。
图4为实施例1中ha-adh/alg-cho水凝胶冻干样品的扫描电镜(sem)照片。水凝胶断面sem呈现出清晰孔道,呈三维网络状结构。
图5为不同质量含量的ha-adh/alg-cho水凝胶的体外降解曲线。其中降解程度最高的水凝胶两组分比例为1%/5%,21天降解剩余13.03%;降解程度最低的水凝胶两组分比例为3%/3%,21天降解剩余43.51%。
图6为不同质量含量的ha-adh/alg-cho水凝胶体外降解后水凝胶内部结构的sem照片。选用两组降解率差别较大的水凝胶进行对比实验,随着降解时间的延长,水凝胶内部孔道结构逐渐塌陷,至最终无法清晰观察三维网络状结构。1%/5%组水凝胶与同降解周期的3%/3%组水凝胶相比,其结构破坏程度大很多。
图7为不同质量含量的ha-adh/alg-cho水凝胶在大鼠体内的降解照片。图组直观的显示水凝胶降解过程的体积变化,其结果与体外降解实验对应。
图8为ha-adh/alg-cho水凝胶在大鼠体内降解60天后水凝胶大小比较照片。
图9为ha-adh/alg-cho水凝胶在大鼠注射后水凝胶周边组织切片的he染色图组。图组说明了我们制备的该类透明质酸钠/海藻酸钠注射型复合水凝胶的生物安全性,其在体内不会诱发炎症。
图10为ha-adh/alg-cho水凝胶在大鼠注射后大鼠脏器组织切片的he染色图组。图组同样说明了我们制备的该类透明质酸钠/海藻酸钠注射型复合水凝胶的生物安全性,其不会对大鼠体内脏器产生影响。
图11为不同质量含量的ha-adh/alg-cho水凝胶的力学性能表征。力学性能测试结果显示,其弹性模量的变化趋势与降解曲线呈现一致性,降解越缓慢的力学强度越高。
具体实施方式
实施例1
一种利用席夫碱交联反应构建的透明质酸钠/海藻酸钠注射型复合水凝胶的制备方法,其具体步骤如下:
1)透明质酸-己二酸二酰肼衍生物(ha-adh)的制备
将2gha(分子量40kda)溶液在400ml去离子水中,然后加入20g己二酸二酰肼并用盐酸调整溶液ph值到5.0-7.4,进一步加入4.0g1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(edc)后,反应过夜。最后,产物ha-adh溶液经过透析提纯(截留分子量8-10kda透析袋)后冻干保存。
2)海藻酸钠衍生物(alg-cho)的制备
取2g海藻酸钠溶解于100ml超纯水中配置成2%的水溶液,另取1.1g高碘酸钠溶解于10ml超纯水中配成溶液;然后将高碘酸钠溶液逐滴加入海藻酸钠溶液中,室温搅拌2小时;后加入0.6ml乙二醇终止氧化反应,1h后将反应溶液透析提纯,再进一步冻干得到产物alg-cho;
3)ha-adh/alg-cho水凝胶的制备
将实施例1步骤1)中所制ha-adh12mg溶解于200ul缓冲液(pbs,ph=7.4-8.5,150mm)中;将步骤2)中所制alg-cho12mg溶解于200ul缓冲液(pbs,ph=7.4-8.5,150mm)中;待两相完全溶解后混合得到ha-adh/alg-cho质量含量分别为3%/3%的水凝胶前体溶液,再将水凝胶前体溶液放入37℃烘箱交联固化1-3min得到水凝胶材料。
实施例2
一种利用席夫碱交联反应构建的透明质酸钠/海藻酸钠注射型复合水凝胶的制备方法,其具体步骤如下:
1)透明质酸-己二酸二酰肼衍生物(ha-adh)的制备
将2gha(分子量50kda)溶液在400ml去离子水中,然后加入30g己二酸二酰肼并用盐酸调整溶液ph值到5.0-7.4,进一步加入6g1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(edc)后,反应过夜。最后,产物ha-adh溶液经过透析提纯(截留分子量8-10kda透析袋)后冻干保存。
2)海藻酸钠衍生物(alg-cho)的制备
取2g海藻酸钠溶解于200ml超纯水中配置成1%的水溶液,另取2g高碘酸钠溶解于20ml超纯水中配成溶液;然后将高碘酸钠溶液逐滴加入海藻酸钠溶液中,室温搅拌2小时;后加入0.6ml乙二醇终止氧化反应,1h后将反应溶液透析提纯,再进一步冻干得到产物alg-cho;
3)ha-adh/alg-cho水凝胶的制备
将实施例2步骤1)中所制ha-adh4mg溶解于200ul缓冲液(pbs,ph=7.4-8.5,150mm)中;将步骤2)中所制alg-cho20mg溶解于200ul缓冲液(pbs,ph=7.4-8.5,150mm)中;待两相完全溶解后混合得到ha-adh/alg-cho质量含量分别为1%/5%的水凝胶前体溶液,再将水凝胶前体溶液放入37℃烘箱交联固化1-3min得到水凝胶材料。
实施例3
一种利用席夫碱交联反应构建的透明质酸钠/海藻酸钠注射型复合水凝胶的制备方法,其具体步骤如下:
1)透明质酸-己二酸二酰肼衍生物(ha-adh)的制备
将4gha(分子量50kda)溶液在400ml去离子水中,然后加入40g己二酸二酰肼并用盐酸调整溶液ph值到5.0-7.4,进一步加入4.0g1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(edc)后,反应过夜。最后,产物ha-adh溶液经过透析提纯(截留分子量8-10kda透析袋)后冻干保存。
2)海藻酸钠衍生物(alg-cho)的制备取2g海藻酸钠溶解于100ml超纯水中配置成2%的水溶液,另取1.1g高碘酸钠溶解于10ml超纯水中配成溶液;然后将高碘酸钠溶液逐滴加入海藻酸钠溶液中,室温搅拌2小时;后加入0.6ml乙二醇终止氧化反应,1h后将反应溶液透析提纯,再进一步冻干得到产物alg-cho。
3)ha-adh/alg-cho水凝胶的制备
将实施例2步骤1)中所制ha-adh8mg溶解于200ul缓冲液(pbs,ph=7.4-8.5,150mm)中;将步骤2)中所制alg-cho16mg溶解于200ul缓冲液(pbs,ph=7.4-8.5,150mm)中;待两相完全溶解后混合得到ha-adh/alg-cho质量含量分别为2%/4%的水凝胶前体溶液,再将水凝胶前体溶液放入37℃烘箱交联固化1-3min得到水凝胶材料。
实施例4
注射型生物可降解水凝胶材料的应用:将实施例1制得的注射型生物可降解水凝胶材料与药物、蛋白、细胞、无机颗粒等混合均匀,再将混合溶液倒入容器、模型或注射植入到动物或人体组织、器官、身体空腔内,使溶液在37℃交联固化。
显然,本发明的上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无法对所有的实施方式予以穷举。凡是属于本发明的技术方案所引伸出的显而易见的变化或变动仍处于本发明的保护范围之列。
- 还没有人留言评论。精彩留言会获得点赞!