含氮杂环的有机化合物及有机电致发光器件的制作方法
本发明属于电致发光材料技术领域,特别涉及一种含氮杂环的有机化合物及有机电致发光器件。
背景技术:
近年来,有机电致发光二极管(oleds)因其具有自发光、宽视角、广色域、低能耗、高效率、响应速度快、超轻超薄及易于柔性化等特点,在全色显示和固态照明领域展示出巨大的应用前景。目前制约有机电致发光器件发展的最关键因素为有机电致发光材料的性能。因此开发稳定高效的有机电致发光材料为当前的研究重点。
有机小分子光电材料因其结构明确、易于修饰、提纯加工简单等优点而用来作为高性能材料被大量开发。根据量子自旋统计规则,传统荧光材料电致激发产生单重态激子和三重态激子的比例为1:3,传统荧光材料只能利用其中25%的单重态激子发光,器件外量子效率不高(低于5%)。有机磷光材料通过重金属原子自旋轨道耦合既可以利用单重态激子发光,也可以利用三重态激子发光,理论上内量子效率可以达到100%。但有机磷光材料采用铱、铂等贵金属的化合物资源有限、价格昂贵,且目前蓝光磷光材料稳定性较差。
热激活延迟荧光(tadf)材料具有电子给体(d)和电子受体(a)相结合的分子结构,为具有较小单重态-三重态能级差(δest)的不含贵重金属的纯有机小分子材料,因此其三重态激子在环境热能下可通过反向系间窜越(risc)这一过程转化为单重态激子而发光,因此理论上其器件内量子效率能达到100%。
tadf材料由于兼具量子产率高和生产成本低的优点,成为一种极具前景的新型有机电致发光材料。但目前tadf材料种类较少,性能有待提高,急需开发更多种类和更高性能的tadf材料。
技术实现要素:
本发明的目的在于提供一种含氮杂环的有机化合物,为新型的给受体(d-a)型有机电致发光化合物,其最高占有轨道(homo)和最低空轨道(lumo)分别分布在给体基团和受体基团上,homo和lumo之间具有较小的重叠特性,因此具有热激活延迟荧光特性,可应用于有机电致发光器件,作为发光材料。
本发明另一目的在于提供一种有机电致发光器件,有机功能层包含上述含氮杂环的有机化合物,具有优良的发光性能。
为实现上述发明目的,本发明提供一种含氮杂环的有机化合物,具有如下式(i)所示的化学结构:
其中,
x为n或ch;
y为单键、o、s、亚氨基、亚甲基、亚甲硅烷基、取代的亚氨基、取代的亚甲基或取代的亚甲硅烷基,所述取代的亚氨基、取代的亚甲基及取代的亚甲硅烷基中的取代基分别独立地选自氢、氘、c1-c30的烷基、c1-c30含杂原子取代的烷基、c6-c30的芳基及c3-c30的杂芳基中的一种;
l、ar1和ar2分别独立地选自c6-c30的芳基、c3-c30的杂芳基、c6-c30取代的芳基及c3-c30取代的杂芳基中的一种;
n取值0-3中的整数;
r1-r8分别独立地选自氢、氘、卤素、c1-c30的烷基、c1-c30含杂原子取代的烷基、c6-c30的芳基及c3-c30的杂芳基中的一种。
所述的含氮杂环的有机化合物具有如下式(ii)所示的化学结构:
其中,
y为单键、o、s、亚氨基、亚甲基、亚甲硅烷基、取代的亚氨基、取代的亚甲基或取代的亚甲硅烷基,所述取代的亚氨基、取代的亚甲基及取代的亚甲硅烷基中的取代基分别独立地选自氢、氘、c1-c30的烷基、c1-c30含杂原子取代的烷基、c6-c30的芳基及c3-c30的杂芳基中的一种;
l、ar1和ar2分别独立地选自c6-c30的芳基、c3-c30的杂芳基、c6-c30取代的芳基及c3-c30取代的杂芳基中的一种;
n取值0-3中的整数;
r1-r8分别独立地选自氢、氘、卤素、c1-c30的烷基、c1-c30含杂原子取代的烷基、c6-c30的芳基及c3-c30的杂芳基中的一种。
所述的含氮杂环的有机化合物具有如下式(iii)所示的化学结构:
其中,
y为单键、o、s、亚氨基、亚甲基、亚甲硅烷基、取代的亚氨基、取代的亚甲基或取代的亚甲硅烷基,所述取代的亚氨基、取代的亚甲基及取代的亚甲硅烷基中的取代基分别独立地选自氢、氘、c1-c30的烷基、c1-c30含杂原子取代的烷基、c6-c30的芳基及c3-c30的杂芳基中的一种;
l、ar1和ar2分别独立地选自c6-c30的芳基、c3-c30的杂芳基、c6-c30取代的芳基及c3-c30取代的杂芳基中的一种;
n取值0-3中的整数;
r1-r8分别独立地选自氢、氘、卤素、c1-c30的烷基、c1-c30含杂原子取代的烷基、c6-c30的芳基及c3-c30的杂芳基中的一种。
所述c6-c30的芳基为苯基、萘基或联苯基。
所述c3-c30的杂芳基为吡啶基、嘧啶基、咪唑基、噁唑基、三嗪基、咔唑基或二苯胺基。
所述的含氮杂环的有机化合物选自化合物1-156,所述化合物1-156的结构式分别如下所示:
本发明还提供一种有机电致发光器件,包括相对设置的阳极和阴极以及位于所述阳极和阴极之间的有机功能层,所述有机功能层包括数层有机膜层,至少一层有机膜层含有一种或多种如上所述的含氮杂环的有机化合物。
所述数层有机膜层包括空穴注入层、空穴传输层、电子阻挡层、发光层、空穴阻挡层、电子传输层及电子注入层中的至少一层。
所述有机功能层中的有机膜层通过真空蒸镀法、分子束蒸镀法、旋涂法、浸涂法、棒涂法或喷墨打印法制作形成,所述阳极和阴极均通过蒸镀法或溅射法制作形成。
所述数层有机膜层包括发光层;所述发光层含有主体发光材料及如权利要求1所述的含氮杂环的有机化合物。
如上所述的含氮杂环的有机化合物在所述有机膜层中单独使用,或和其他化合物在所述有机膜层中混合使用。
相比于已有材料和技术,本发明具有如下优点和有益效果:
本发明提供的含氮杂环的有机化合物具有良好的热稳定性,高发光效率,且无需使用贵重金属配合物,制造成本低,应用前景广阔;基于本发明含氮杂环的有机化合物的有机电致发光器件具有较高的发光效率。
附图说明
下面结合附图,通过对本发明的具体实施方式详细描述,将使本发明的技术方案及其它有益效果显而易见。
附图中,
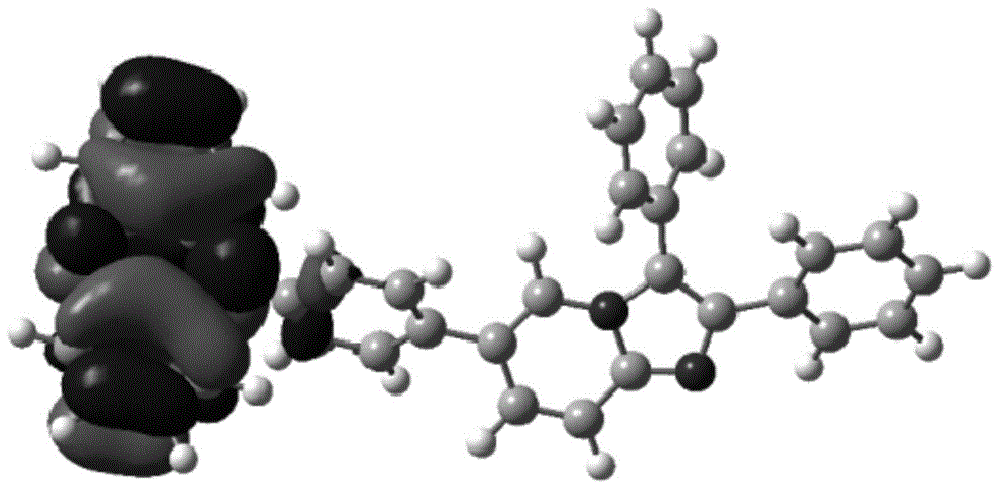
图1为本发明实施例中化合物35的最高占有分子轨道示意图;
图2为本发明实施例中化合物35的最低空分子轨道示意图;
图3为本发明有机电致发光器件的结构示意图。
具体实施方式
本发明中所用的未注明的一些原料均为市售商品。一些化合物的制备方法将在实施案例中描述。下面结合具体实施例对本发明作进一步具体详细描述,但本发明的实施方式不限于此。
实施例1:
化合物1的合成路线如下:
化合物1a的合成:
将5-溴-2-氨基吡啶(8.60g,50.0mmol),2-溴-2-苯基乙酰苯(16.5g,60.0mmol),nahco3(5.04g,60.0mmol)溶解于异丙醇(100ml)中,回流并搅拌12h。真空旋蒸除去异丙醇,然后向固体残留物中加入二氯甲烷(60ml)和水(30ml)。有机相分离后,用饱和食盐水洗2次。真空旋蒸除去溶剂,通过硅胶色谱柱提纯,获得固体化合物1a(11.8g,34.0mmol),产率68%。通过气质联用分析得到esi-ms(m/z):349.1。
化合物1的合成:
将化合物1a(3.48g,10.0mmol),咔唑(1.84g,11.0mmol),醋酸钯(0.23g,1.0mmol),叔丁醇钠(3.36g,35.0mmol)和三叔丁基膦(0.20g,1.0mmol)溶解于甲苯(60ml)中,在氮气氛围下加热回流10小时。真空旋蒸除去溶剂,残留物加入二氯甲烷搅拌、过滤,通过硅胶色谱柱提纯,获得固体化合物1(3.26g,7.5mmol),产率75%。通过气质联用分析得到esi-ms(m/z):435.2。
化合物14的合成方法与化合物1类似,只是在第二步反应中将原料咔唑替换成吩噁嗪。
实施例2:
化合物35的合成路线如下:
化合物2a的合成:
将5-溴-2-氨基吡啶(8.60g,50.0mmol),4-溴-苯硼酸(11.0g,55.0mmol),四三苯基膦钯(2.89g,2.5mmol),碳酸铯(10.8g,33.0mmol)溶解于甲醇/水(200ml,1/1)中,回流并搅拌12h。加入乙酸乙酯和水。有机相分离后,用饱和食盐水洗2次。真空旋蒸除去溶剂,通过硅胶色谱柱提纯,获得固体化合物2a(7.84g,31.5mmol),产率63%。通过气质联用分析得到esi-ms(m/z):248.7。
化合物2b的合成:
将化合物2a(12.5g,50.0mmol),2-溴-2-苯基乙酰苯(16.5g,60.0mmol),nahco3(5.04g,60.0mmol)溶解于异丙醇(100ml)中,回流并搅拌12h。真空旋蒸除去异丙醇,然后向固体残留物中加入二氯甲烷(60ml)和水(30ml)。有机相分离后,用饱和食盐水洗2次。真空旋蒸除去溶剂,通过硅胶色谱柱提纯,获得固体化合物2b(13.8g,32.5mmol),产率65%。通过气质联用分析得到esi-ms(m/z):425.1。
化合物35的合成:
将化合物2b(4.25g,10.0mmol),吩噁嗪(1.84g,11.0mmol),醋酸钯(0.23g,1.0mmol),叔丁醇钠(3.36g,35.0mmol)和三叔丁基膦(0.20g,1.0mmol)溶解于甲苯(60ml)中,在氮气氛围下加热回流10小时。真空旋蒸除去溶剂,残留物加入二氯甲烷搅拌、过滤,通过硅胶色谱柱提纯,获得固体化合物35(3.80g,7.2mmol),产率72%。通过气质联用分析得到esi-ms(m/z):527.3。
化合物28的合成方法与化合物35类似,只是在第三步反应中将原料吩噁嗪替换成9,3':6',9”-三咔唑。
实施例3:
化合物53的合成路线如下:
化合物3a的合成:
将4-溴-2-氨基吡啶(8.60g,50.0mmol),2-溴-2-苯基乙酰苯(16.5g,60.0mmol),nahco3(5.04g,60.0mmol)溶解于异丙醇(100ml)中,回流并搅拌12h。真空旋蒸除去异丙醇,然后向固体残留物中加入二氯甲烷(60ml)和水(30ml)。有机相分离后,用饱和食盐水洗2次。真空旋蒸除去溶剂,通过硅胶色谱柱提纯,获得固体化合物3a(12.2g,35.0mmol),产率70%。通过气质联用分析得到esi-ms(m/z):349.3。
化合物53的合成:
将化合物3a(3.48g,10.0mmol),吩噁嗪(2.01g,11.0mmol),醋酸钯(0.23g,1.0mmol),叔丁醇钠(3.36g,35.0mmol)和三叔丁基膦(0.20g,1.0mmol)溶解于甲苯(60ml)中,在氮气氛围下加热回流10小时。真空旋蒸除去溶剂,残留物加入二氯甲烷搅拌、过滤,通过硅胶色谱柱提纯,获得固体化合物53(3.20g,7.1mmol),产率71%。通过气质联用分析得到esi-ms(m/z):451.2。
化合物55的合成方法与化合物53类似,只是在第二步反应中将原料吩噁嗪替换成10h-螺[吖啶-9,9’-芴]。
实施例4:
化合物74的合成路线如下:
化合物4a的合成:
将4-溴-2-氨基吡啶(8.60g,50.0mmol),4-溴-苯硼酸(11.0g,55.0mmol),四三苯基膦钯(2.89g,2.5mmol),碳酸铯(10.8g,33.0mmol)溶解于甲醇/水(200ml,1/1)中,回流并搅拌12h。加入乙酸乙酯和水。有机相分离后,用饱和食盐水洗2次。真空旋蒸除去溶剂,通过硅胶色谱柱提纯,获得固体化合物4a(8.08g,32.5mmol),产率65%。通过气质联用分析得到esi-ms(m/z):248.5。
化合物4b的合成:
将化合物4a(12.5g,50.0mmol),2-溴-2-苯基乙酰苯(16.5g,60.0mmol),nahco3(5.04g,60.0mmol)溶解于异丙醇(100ml)中,回流并搅拌12h。真空旋蒸除去异丙醇,然后向固体残留物中加入二氯甲烷(60ml)和水(30ml)。有机相分离后,用饱和食盐水洗2次。真空旋蒸除去溶剂,通过硅胶色谱柱提纯,获得固体化合物4b(12.8g,30.0mmol),产率60%。通过气质联用分析得到esi-ms(m/z):425.3。
化合物74的合成:
将化合物4b(4.25g,10.0mmol),吩噁嗪(1.84g,11.0mmol),醋酸钯(0.23g,1.0mmol),叔丁醇钠(3.36g,35.0mmol)和三叔丁基膦(0.20g,1.0mmol)溶解于甲苯(60ml)中,在氮气氛围下加热回流10小时。真空旋蒸除去溶剂,残留物加入二氯甲烷搅拌、过滤,通过硅胶色谱柱提纯,获得固体化合物74(3.95g,7.5mmol),产率75%。通过气质联用分析得到esi-ms(m/z):527.3。
化合物67的合成方法与化合物74类似,只是在第三步反应中将原料吩噁嗪替换成9,3':6',9”-三咔唑。
实施例5:
化合物92的合成路线如下:
化合物5a的合成:
将5-溴-2-氨基嘧啶(8.70g,50.0mmol),2-溴-2-苯基乙酰苯(16.5g,60.0mmol),nahco3(5.04g,60.0mmol)溶解于异丙醇(100ml)中,回流并搅拌12h。真空旋蒸除去异丙醇,然后向固体残留物中加入二氯甲烷(60ml)和水(30ml)。有机相分离后,用饱和食盐水洗2次。真空旋蒸除去溶剂,通过硅胶色谱柱提纯,获得固体化合物5a(13.1g,37.5mmol),产率75%。通过气质联用分析得到esi-ms(m/z):350.1。
化合物92的合成:
将化合物5a(3.5g,10.0mmol),吩噁嗪(2.01g,11.0mmol),醋酸钯(0.23g,1.0mmol),叔丁醇钠(3.36g,35.0mmol)和三叔丁基膦(0.20g,1.0mmol)溶解于甲苯(60ml)中,在氮气氛围下加热回流10小时。真空旋蒸除去溶剂,残留物加入二氯甲烷搅拌、过滤,通过硅胶色谱柱提纯,获得固体化合物92(3.07g,6.8mmol),产率68%。通过气质联用分析得到esi-ms(m/z):452.2。
化合物94的合成方法与化合物92类似,只是在第二步反应中将原料吩噁嗪替换成10h-螺[吖啶-9,9’-芴]。
实施例6:
化合物113的合成路线如下:
化合物6a的合成:
将5-溴-2-氨基嘧啶(8.70g,50.0mmol),4-溴-苯硼酸(11.0g,55.0mmol),四三苯基膦钯(2.89g,2.5mmol),碳酸铯(10.8g,33.0mmol)溶解于甲醇/水(200ml,1/1)中,回流并搅拌12h。加入乙酸乙酯和水。有机相分离后,用饱和食盐水洗2次。真空旋蒸除去溶剂,通过硅胶色谱柱提纯,获得固体化合物6a(7.75g,31.0mmol),产率62%。通过气质联用分析得到esi-ms(m/z):249.5。
化合物6b的合成:
将化合物6a(12.5g,50.0mmol),2-溴-2-苯基乙酰苯(16.5g,60.0mmol),nahco3(5.04g,60.0mmol)溶解于异丙醇(100ml)中,回流并搅拌12h。真空旋蒸除去异丙醇,然后向固体残留物中加入二氯甲烷(60ml)和水(30ml)。有机相分离后,用饱和食盐水洗2次。真空旋蒸除去溶剂,通过硅胶色谱柱提纯,获得固体化合物6b(13.8g,32.5mmol),产率65%。通过气质联用分析得到esi-ms(m/z):426.3。
化合物113的合成:
将化合物6b(4.26g,10.0mmol),吩噁嗪(1.84g,11.0mmol),醋酸钯(0.23g,1.0mmol),叔丁醇钠(3.36g,35.0mmol)和三叔丁基膦(0.20g,1.0mmol)溶解于甲苯(60ml)中,在氮气氛围下加热回流10小时。真空旋蒸除去溶剂,残留物加入二氯甲烷搅拌、过滤,通过硅胶色谱柱提纯,获得固体化合物113(3.75g,7.1mmol),产率71%。通过气质联用分析得到esi-ms(m/z):528.3。
化合物106的合成方法与化合物113类似,只是在第三步反应中将原料吩噁嗪替换成9,3':6',9”-三咔唑。
实施例7:
化合物131的合成路线如下:
化合物7a的合成:
将4-溴-2-氨基嘧啶(8.70g,50.0mmol),2-溴-2-苯基乙酰苯(16.5g,60.0mmol),nahco3(5.04g,60.0mmol)溶解于异丙醇(100ml)中,回流并搅拌12h。真空旋蒸除去异丙醇,然后向固体残留物中加入二氯甲烷(60ml)和水(30ml)。有机相分离后,用饱和食盐水洗2次。真空旋蒸除去溶剂,通过硅胶色谱柱提纯,获得固体化合物7a(13.3g,38.0mmol),产率76%。通过气质联用分析得到esi-ms(m/z):350.2。
化合物131的合成:
将化合物7a(3.5g,10.0mmol),吩噁嗪(2.01g,11.0mmol),醋酸钯(0.23g,1.0mmol),叔丁醇钠(3.36g,35.0mmol)和三叔丁基膦(0.20g,1.0mmol)溶解于甲苯(60ml)中,在氮气氛围下加热回流10小时。真空旋蒸除去溶剂,残留物加入二氯甲烷搅拌、过滤,通过硅胶色谱柱提纯,获得固体化合物131(3.26g,7.2mmol),产率72%。通过气质联用分析得到esi-ms(m/z):452.1。
化合物133的合成方法与化合物131类似,只是在第二步反应中将原料吩噁嗪替换成10h-螺[吖啶-9,9’-芴]。
实施例8:
化合物152的合成路线如下:
化合物8a的合成:
将4-溴-2-氨基嘧啶(8.70g,50.0mmol),4-溴-苯硼酸(11.0g,55.0mmol),四三苯基膦钯(2.89g,2.5mmol),碳酸铯(10.8g,33.0mmol)溶解于甲醇/水(200ml,1/1)中,回流并搅拌12h。加入乙酸乙酯和水。有机相分离后,用饱和食盐水洗2次。真空旋蒸除去溶剂,通过硅胶色谱柱提纯,获得固体化合物8a(7.50g,30.0mmol),产率60%。通过气质联用分析得到esi-ms(m/z):249.8。
化合物8b的合成:
将化合物8a(12.5g,50.0mmol),2-溴-2-苯基乙酰苯(16.5g,60.0mmol),nahco3(5.04g,60.0mmol)溶解于异丙醇(100ml)中,回流并搅拌12h。真空旋蒸除去异丙醇,然后向固体残留物中加入二氯甲烷(60ml)和水(30ml)。有机相分离后,用饱和食盐水洗2次。真空旋蒸除去溶剂,通过硅胶色谱柱提纯,获得固体化合物8b(13.2g,31.0mmol),产率62%。通过气质联用分析得到esi-ms(m/z):426.1。
化合物152的合成:
将化合物8b(4.26g,10.0mmol),吩噁嗪(1.84g,11.0mmol),醋酸钯(0.23g,1.0mmol),叔丁醇钠(3.36g,35.0mmol)和三叔丁基膦(0.20g,1.0mmol)溶解于甲苯(60ml)中,在氮气氛围下加热回流10小时。真空旋蒸除去溶剂,残留物加入二氯甲烷搅拌、过滤,通过硅胶色谱柱提纯,获得固体化合物152(3.85g,7.3mmol),产率73%。通过气质联用分析得到esi-ms(m/z):528.2。
化合物145的合成方法与化合物152类似,只是在第三步反应中将原料吩噁嗪替换成9,3':6',9”-三咔唑。
实施例9-14
使用以上实施例制备的化合物制作有机电致发光器件。
将带有阳极110的基板100,其中阳极110为透明导电的氧化铟锡(ito),基板100为玻璃基板,用蒸馏水、丙酮、异丙醇超声清洗并放入烘箱干燥,通过uv处理20min,然后转移至真空蒸镀腔中。在真空度2*10-5pa的条件下,开始蒸镀各层薄膜。首先蒸镀10nm厚的2,3,6,7,10,11-六氰基-1,4,5,8,9,12-六氮杂苯并菲(hatcn)形成空穴注入层120,然后蒸镀60nm厚的二苯基萘基二胺(npb)形成空穴传输层130,然后蒸镀10nm厚的4,4’,4”-三(n-咔唑基)三苯胺(tcta)形成电子阻挡层140。在电子阻挡层140上,用94wt%的cbp作为主体材料,用6wt%的本发明含氮杂环的有机化合物作为掺杂材料,同时蒸镀该主体材料和掺杂材料,形成30nm厚的发光层150。然后在发光层150上蒸镀40nm厚的1,3,5-三(1-苯基-1h-苯并咪唑-2-基)苯(tpbi)作为电子传输层160。最后蒸镀1nmlif为电子注入层170和100nm的铝(al)作为器件阴极180。从而用该方法制得如图3所示的有机电致发光器件,具体器件结构如下:
ito(100nm)/hatcn(10nm)/npb(60nm)/tcta(10nm)/cbp:本发明含氮杂环的有机化合物(94wt%:6wt%,30nm)/tpbi(40nm)/lif(1nm)/al(100nm)。
比较例1-2
比较例1-2制备的有机电致发光器件,除了分别用绿色荧光掺杂物c-545mt和绿色磷光掺杂物ir(ppy)3代替本发明含氮杂环的有机化合物作为掺杂材料外,其他跟实施例9-14的器件制备方法一样。
以上实施例及比较例中,所涉及到的部分化合物的结构式如下:
有机电致发光器件的性能评价:用keithley2400数字纳伏表测试有机电致发光器件在不同电压下的电流,然后用电流除以发光面积得到电流密度。用photoresearchpr655测试有机电致发光器件在不同电压下的亮度和辐射能量密度。根据有机电致发光器件在不同电压下的电流密度和亮度,得到有机电致发光器件的电流效率(cd/a)和外量子效率(eqe)。所制备的有机电致发光器件在1000cd/m2的亮度下的电流效率和外量子效率如表1所示。
表1、实施例及比较例所制备的有机电致发光器件的性能结果
从表1中可以看出,本发明的含氮杂环的有机化合物作为新型有机发光材料用于有机电致发光器件,可以实现高的发光效率,是具有优良性能的tadf发光材料。
综上所述,包含本发明含氮杂环的有机化合物的有机电致发光器件具有优良的发光性能。
上述实施例为本发明的较佳实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所做的改变,修饰,替代,组合,简化均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!