一种Ube3a基因在Iso诱导的心肌肥大中的作用机制的研究方法与流程
本发明涉及心脏医学技术领域,具体为一种be3a基因在iso诱导的心肌肥大中的作用机制的研究方法。
背景技术:
20世纪80年代泛素蛋白酶体途径(theubiquitinproteasomepathway,upp)的发现是阐明细胞内蛋白质降解作用里程碑的事件,upp在细胞的周期调控、dna修复、凋亡、免疫应答、抗原加工、神经发育、突触可塑性、肌肉萎缩、激素调节、应激反应和老化等方面都起到一定的功能。e3泛素连接酶决定着upp反应的高效性和精确的选择性。e3连接酶参与着细胞内绝大多数蛋白的正常降解,调控着细胞核和细胞质内蛋白质的合成和降解的平衡,一旦受到阻碍,机体会产生一系列的应激反应,甚至导致组织和器官的损伤。
e3泛素连接酶分为三大类:hect(homologoustoe6apcarboxylterminus)结构域家族、ring结构域家族和u-box结构域家族。仅人类的hect结构域家族有超过100种连接酶,ube3a是其中的一员。关于ube3a,研究最广泛、最深入的是在天使人综合症领域。其实ube3a与其他疾病的关系也屡见报道,早在1999年jveenstra-vanderweele就报道称ube3a基因的突变能够导致自闭症的发生,随后ube3a与许多组织和器官疾病的研究不断被证实,这些组织包括脑、乳腺、子宫颈、淋巴等,但是ube3a与心脏疾病方面的研究很少。ube3a编码区序列全长约为2.6kb,位于染色体15q11–q13,分为三个转录本,可编码三种压型蛋白,分别为98.9kda、101.1kda和101.7kda蛋白,而且这三种蛋白均具有蛋白降解的作用。经过对geneexpressionomnibus(geo)数据库中的心血管疾病相关的基因表达谱数据进行信息学方法的分析和筛选,确认ube3a与心肌肥大和心力衰竭极有可能存在关系。
已有报道显示某些e3连接酶在心脏组织中存在差异表达,甚至是与ube3a同属一个家族的其他e3连接酶成员都已被证实参与调控心肌肥大的发生。最早发现e3家族中的atrogin-1蛋白在心肌和横纹肌组织中选择性表达,在饥饿或者肌肉收缩时的代谢状态下,atrogin-1的表达量显著增加,这从侧面印证了atrogin-1在肌肉组织中存在某些作用。在心肌细胞中表达的murf-1蛋白能够导致肌联蛋白m区分解,并使肌丝增粗。基于上述的研究,科研人员把目光转移到心肌肥大机制研究领域。心肌细胞的体积是有蛋白合成和蛋白降解的关系来决定的,而机体正常的蛋白降解作用主要由泛素化降解途径来完成。心肌细胞中钙调神经磷酸酶作为对病原性刺激的响应,会通过与心肌z-区的α-辅肌动蛋白结合来促进心肌肥大,li等人最早证实了泛素化连接酶e3在心肌蛋白代谢中起重要的调控作用,该论文通过胸部主动脉结扎构建心肌肥大模型,发现atrogin-1过表达的转基因鼠能够减缓心肌肥大,atrogin-1通过与skp1,cull和rucl联合装配成一种具有泛素化链激酶活性的scfatrogin-1活复合体。实验通过sirna对atrogin-1的下调能够加强钙调神经磷酸酶的活性,促进心肌肥大;转基因小鼠中atrogin-1的过表达降低了钙调神经磷酸酶的水平,减缓了心肌肥大;通过泛素化反应证明了atrogin-1是通过对钙调神经磷酸酶的泛素化作用来降低其水平,表明scfatrogin-1介导的泛素化水解能够抑制病变刺激引起的心肌肥大。e3家族的鼠双微基因2(mdm2)对于心脏发育过程中的心内膜垫形态发生至关重要,也有研究显示mdm2能够通过e3泛素连接酶作用缓解心肌细胞肥大,mdm2在心血管疾病的发生过程中具有举足轻重的作用。另外,e3连接酶家族中的murf-1在初生大鼠心肌细胞中过表达能抑制pkcε介导的细胞蛋白合成,缓解心肌肥大,而且murf-1在不同的信号通路中都起着一定的作用,例如akt/mtor通路,说明泛素化蛋白调控心肌肥大的信号通路可能是相互交叉、协同作用的。
综合目前的研究报道,我们可以推测ube3a很有可能参与了心肌肥大的发生过程,而心肌肥大细胞内蛋白质的积累、体积的增大,有可能与ube3a泛素化蛋白降解功能受阻有关,这种受阻作用可能体现在ube3a蛋白表达水平受抑制,也可能是通过某些甲基化、糖基化、磷酸化等修饰作用的抑制或者激活导致酶催化活力下降。因此通过观察ube3a在iso诱导心肌肥大的过程中表达量的变化情况,判断ube3a是否与心肌肥大的发生有关连作用,然后通过ube3a基因的敲除,确定ube3a在心肌肥大发生过程中的特异性以及ube3a对心肌肥大是促进还是阻止作用;通过ube3a基因的过表达作用,进一步明确ube3a的促进或者阻止作用,并结合ube3a敲除和过表达后细胞的发展状况,确定ube3a的作用和心肌细胞肥大之间的因果关系。为发现参与心肌肥大发生的新基因,给治疗和预防心肌肥大提供新的药物作用靶点,为此需要一种ube3a基因在iso诱导的心肌肥大中的作用机制的研究方法。
技术实现要素:
(一)解决的技术问题
针对现有技术的不足,本发明提供了一种ube3a基因在iso诱导的心肌肥大中的作用机制的研究方法,具备严谨准确等优点,解决了确定ube3a基因在iso诱导的心肌肥大中的作用机制问题。
(二)技术方案
为实现上述目的,本发明提供如下技术方案:一种ube3a基因在iso诱导的心肌肥大中的作用机制的研究方法,包括以下步骤:
(1)细胞分组:细胞分组分为iso诱导分组以及基因敲除和过表达分组。iso诱导分组将细胞培养采用六孔板铺盘,每孔加入2ml细胞培养基。向对照组细胞培养基中加入2μlpbs作为安慰剂;iso药物诱导组均加入2μl10mm的iso溶液,制成iso终浓度为10μm的细胞培养基,按照时间梯度依次培养12h、24h、48h。基因敲除和过表达分组将细胞培养采用六孔板铺盘,每孔加入2ml细胞培养基。向阴性对照组加入2μlpbs作为安慰剂,敲除和过表达组中的对照组加入2μlpbs作为安慰剂,其他iso诱导组制成iso终浓度为10μm的细胞培养基,按照时间梯度依次培养12h、24h和48h。
(2)ube3a基因的获取:实验准备后,取出-80℃冰箱中保存的大肠杆菌感受态细胞及ube3a质粒置于冰上融化,再取一干净的ep管依次加入30ul感受态细胞和3ul质粒,用移液器反复吹打混匀后冰浴15min,将冰浴15min后的ep管插入水浴浮板并迅速放入提前预热至42℃的水浴锅中热激45s,再迅速放回冰上2min,向ep管中加入900μllb液体培养基,放入37℃摇床,180rpm培养1h,查看培养物的浑浊度,在超净台中,根据培养的大肠杆菌细胞浑浊度,取一定量均匀地滴加在事先已经倒好板的含氨苄霉素lb固体培养基上,用涂布棒将菌液均匀地涂布开,置于生化培养箱中培养,待培养14-18h后,查看菌落生长情况,如果菌落密度达到60%-80%,终止生长,取数支干净的15ml试管,向试管中分别加入4mllb液体培养基,分别挑取不同的单克隆菌落接种于不同试管中,于37℃摇床,180rpm培养12-16h左右,小量质粒抽提。
(3)ube3a腺病毒的包装:实验先通过pcr扩增获得含有限制性内切酶酶切位点的ube3a目的基因模板片段,然后通过内切酶将病毒载体双酶切,通过t4连接酶将目的片段组装到腺病毒载体中,构建重组ube3a过表达腺病毒质粒。通过与骨架质粒的共转染,包装ube3a过表达腺病。
(4)转染:转染包含sirna的转染以及腺病毒感染。sirna的转染步骤为合成的sirna粉末用depc处理过的无菌水溶解,配制成20μm的溶液,然后根据转染的细胞孔数计算需要配制的转染液,一般对于3.5cm直径的孔加入约7μlrnaimax和6μl合成的sirna(3μlrnai#1和3μlrnai#2)溶液。腺病毒感染取5μl包装好的1010滴度以上的腺病毒溶液直接加入到2ml细胞培养基中,腺病毒将自行侵染细胞。
(5)数据分析:数据通过使用spss16.0分析,组间的比较使用独立样本t检验分析,多组间的比较采用单因素dunnett’st检验(anovadunnett’sposthoc),数据结果以mean±sd表示,p<0.05表示有统计学上显著性差异。
优选的,所述腺病毒载体先进行腺病毒载体构建,再进行腺病毒载体的扩增。
优选的,所述腺病毒感染,先进行ube3a过表达腺病毒的包装,步骤包括重组腺病毒质粒的大量制备,再进行细胞培养和质粒转染,收毒(p1),冻融以及病毒扩增和二次收毒(p2)。
优选的,所述sirna的转染首先在生物安全柜中分别向流式管中加入250μlopti-mem无血清培养基,然后一半分别加入7μlrnaimax转染试剂,另一半分别加入6μlsirna溶液,再将混合好的sirna溶液加入到含转染试剂的opti-mem培养基中,混合均匀后,在生物安全柜中放置15min左右。最后更换3.5cm直径培养孔中的培养基,加入约1.5mldmem细胞培养基。将混合好的转染试剂加入到细胞培养孔中,置于细胞培养箱中培养。必要的时候可以再次转入sirna进行二次敲除。
(三)有益效果
与现有技术相比,本发明提供了一种ube3a基因在iso诱导的心肌肥大中的作用机制的研究方法,具备以下有益效果:通过细胞分组、ube3a基因的获取、ube3a腺病毒的包装、转染以及数据分析等步骤来观察ube3a在iso诱导心肌肥大的过程中表达量的变化情况,判断ube3a是否与心肌肥大的发生有关连作用,然后通过ube3a基因的敲除,确定ube3a在心肌肥大发生过程中的特异性以及ube3a对心肌肥大是促进还是阻止作用;通过ube3a基因的过表达作用,进一步明确ube3a的促进或者阻止作用,并结合ube3a敲除和过表达后细胞的发展状况,确定ube3a的作用和心肌细胞肥大之间的因果关系。
附图说明
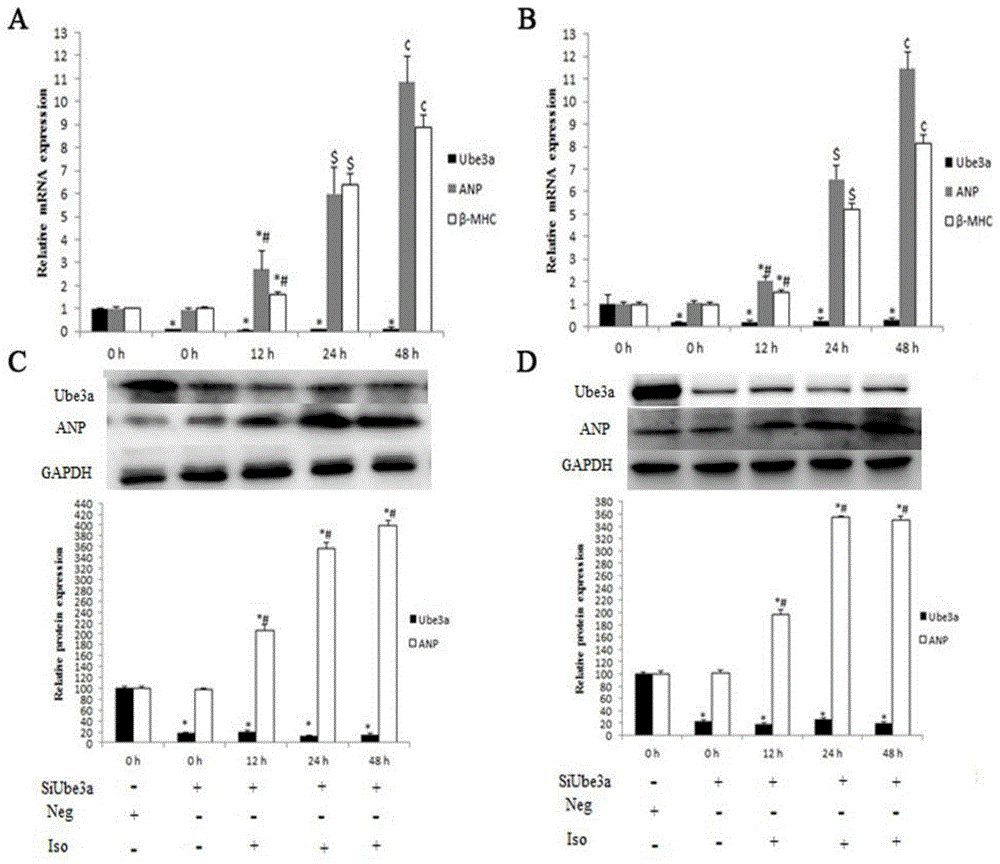
图1为本发明ube3a敲除的心肌细胞中心肌肥大标记物分子的表达随iso不同诱导时间的变化图。
具体实施方式
下面将结合本发明的实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
一种ube3a基因在iso诱导的心肌肥大中的作用机制的研究方法,包括以下步骤:
(1)细胞分组:细胞分组分为iso诱导分组以及基因敲除和过表达分组。iso诱导分组将细胞培养采用六孔板铺盘,每孔加入2ml细胞培养基。向对照组细胞培养基中加入2μlpbs作为安慰剂;iso药物诱导组均加入2μl10mm的iso溶液,制成iso终浓度为10μm的细胞培养基,按照时间梯度依次培养12h、24h、48h。基因敲除和过表达分组将细胞培养采用六孔板铺盘,每孔加入2ml细胞培养基。向阴性对照组加入2μlpbs作为安慰剂,敲除和过表达组中的对照组加入2μlpbs作为安慰剂,其他iso诱导组制成iso终浓度为10μm的细胞培养基,按照时间梯度依次培养12h、24h和48h。
(2)ube3a基因的获取:实验准备在三角瓶中加入适量的双蒸水配制预混的lb液体和固体培养基,将lb液体培养基、lb固体培养基、ep管和移液吸头放入高温高压灭菌锅中湿热灭菌。将灭过菌的lb液体和固体培养基放入超净台中,待温度降低后,加入氨苄霉素,混成千分之一氨苄的lb培养基,然后将固体培养基倒入培养皿中,每皿15ml左右,置于超净台中使其凝固。其他灭过菌的物品放入恒温干燥箱中干燥,过夜干燥后用75%酒精喷洒后放入细菌操作超净台中紫外线照射30min实验准备后,取出-80℃冰箱中保存的大肠杆菌感受态细胞及ube3a质粒置于冰上融化,再取一干净的ep管依次加入30ul感受态细胞和3ul质粒,用移液器反复吹打混匀后冰浴15min,将冰浴15min后的ep管插入水浴浮板并迅速放入提前预热至42℃的水浴锅中热激45s,再迅速放回冰上2min,向ep管中加入900μllb液体培养基,放入37℃摇床,180rpm培养1h,查看培养物的浑浊度,在超净台中,根据培养的大肠杆菌细胞浑浊度,取一定量均匀地滴加在事先已经倒好板的含氨苄霉素lb固体培养基上,用涂布棒将菌液均匀地涂布开,置于生化培养箱中培养,待培养14-18h后,查看菌落生长情况,如果菌落密度达到60%-80%,终止生长,取数支干净的15ml试管,向试管中分别加入4mllb液体培养基,分别挑取不同的单克隆菌落接种于不同试管中,于37℃摇床,180rpm培养12-16h左右,小量质粒抽提。
(3)ube3a腺病毒的包装:实验先通过pcr扩增获得含有限制性内切酶酶切位点的ube3a目的基因模板片段,然后通过内切酶将病毒载体双酶切,通过t4连接酶将目的片段组装到腺病毒载体中,腺病毒载体要先进行腺病毒载体构建,再进行腺病毒载体的扩增,其中腺病毒载体的扩增先将所获腺病毒载体质粒转化到大肠杆菌感受态细胞dh5α,采用含有氨苄霉素的lb液体培养基小摇扩增,转化后的病毒载体涂平板,对氨苄筛选后的菌落挑单克隆,进行单克隆菌株扩增,经过37℃、200rpm摇菌14h,对菌液进行菌落pcr鉴定,引物序列采用载体通用引物,条带大小会比基因片段大200bp左右。
(4)构建重组ube3a过表达腺病毒质粒。通过与骨架质粒的共转染,包装ube3a过表达腺病。其中sirna的转染步骤,首先在生物安全柜中分别向流式管中加入250μlopti-mem无血清培养基,然后一半分别加入7μlrnaimax转染试剂,另一半分别加入6μlsirna溶液,再将混合好的sirna溶液加入到含转染试剂的opti-mem培养基中,混合均匀后,在生物安全柜中放置15min左右。最后更换3.5cm直径培养孔中的培养基,加入约1.5mldmem细胞培养基。将混合好的转染试剂加入到细胞培养孔中,置于细胞培养箱中培养,必要的时候可以再次转入sirna进行二次敲除。
(5)转染:转染包含sirna的转染以及腺病毒感染。sirna的转染步骤为合成的sirna粉末用depc处理过的无菌水溶解,配制成20μm的溶液,然后根据转染的细胞孔数计算需要配制的转染液,一般对于3.5cm直径的孔加入约7μlrnaimax和6μl合成的sirna(3μlrnai#1和3μlrnai#2)溶液。腺病毒感染取5μl包装好的1010滴度以上的腺病毒溶液直接加入到2ml细胞培养基中,腺病毒将自行侵染细胞。
(6)数据分析:数据通过使用spss16.0分析,组间的比较使用独立样本t检验分析,多组间的比较采用单因素dunnett’st检验(anovadunnett’sposthoc),数据结果以mean±sd表示,p<0.05表示有统计学上显著性差异。
(7)ube3a敲低的心肌细胞随iso诱导的肥大程度变化分析:通过rnaimax转染试剂将ube3asirna#1和sirna#2分别转入h9c2细胞和原代心肌细胞,对ube3a进行敲低。然后更换细胞培养基,加入终浓度为10μm的iso溶液进行心肌肥大诱导。使用qpcr法和westernblot法分别对h9c2细胞和原代心肌细胞内ube3a和心肌肥大标记物分子进行检测,gapdh为内参基因和蛋白,a图和b图分别为h9c2细胞和原代心肌细胞经过sirna敲除,细胞内ube3a和心肌肥大标记物分子的mrna随iso诱导作用的变化;c图和d图分别为h9c2细胞和原代心肌细胞经过sirna敲除后细胞内ube3a和心肌肥大标记物分子anp的蛋白质表达水平随iso诱导作用的变化。siube3a表示转染序列为ube3asirna序列,neg表示转入序列为乱码多聚核苷酸序列的阴性对照sirna。*表示与阴性对照组的存在统计学上的显著性差异,#表示与没有iso诱导的ube3a敲除组存在显著性差异,s表示与12h组有显著性差异,¢表示与24h组有显著性差异,p<0.05。c图和d图的柱状图蛋白质条带经quantityone分析后的平均值,设置对照组为100,其他组为对照组的比值。
尽管已经示出和经过ube3asirna的敲除,h9c2细胞和原代心肌细胞中的ube3a表达量都降低了80%以上,随着iso对ube3a敲除的心肌细胞的诱导,anp和β-mhc的转录水平急剧升高,当iso诱导48h时,心肌细胞中anp的转录水平均达到了对照组的10倍以上,β-mhc的转录水平也都超过了8倍;同时ube3a敲除的心肌细胞中anp的蛋白表达量也随iso的诱导迅速增加,当iso诱导时间为48h时,anp的蛋白表达量也都超过了3.5倍。ube3a敲除的心肌细胞中,心肌肥大标志物分子不论在转录还是在翻译水平上,其表达量都远远高于同时间段iso诱导的正常心肌细胞。这些结果暗示了心肌细胞内的ube3a基因可能有抑制iso诱导的心肌肥大作用。
描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
- 还没有人留言评论。精彩留言会获得点赞!