一种化合物及其制备方法与应用与流程
本发明涉及一种化合物及其制备方法与应用,具体涉及一种用于治疗癌症的化合物及其制备方法与应用。
背景技术:
乳腺癌是最常见的癌症形式,也是全世界女性癌症相关死亡的第二大原因。全世界每年有大约100万至130万例乳腺癌病例被诊断出来。乳腺癌是一类异质性疾病,在形态学、分子生物学、临床表现以及对治疗的反应性上均有所不同(huiy,heg,yans,etal.triple-negativebreastcancer:isthereatreatmentonthehorizon?[j].oncotarget,2016,8(1):1913.)。三阴性乳腺癌(triplenegativebreastcancer,tnbc)是指癌组织免疫组织化学检查结果为雌激素受体(er)、孕激素受体(pr)和人类表皮生长因子受体(her-2)均为阴性的乳腺癌。这类乳腺癌具有特殊的生物学行为和临床病理特征,具有恶性程度高、易复发、较早发生转移、生存率低的特点,预后较其他类型差(duffymj,mcgowanpm,crownj.targetedtherapyfortriple-negativebreastcancer:wherearewe?[j].internationaljournalofcancer,2012,131(11):2471-2477.)。
三阴性乳腺癌在西方人群乳腺癌中占所有乳腺癌的12%-17%(foulkeswd,smithie,reis-filhojs.triple-negativebreastcancer[j].wienermedizinischewochenschrift,2010,160(7-8):174-181.),非洲裔美国人和非洲女性发病率较高,可高达50%,亚洲女性发病率与白人女性相似(kumarp,aggarwalr.anoverviewoftriple-negativebreastcancer.[j].archivesofgynecology&obstetrics,2016,293(2):1-23.)。确诊为早期三阴性乳腺癌的患者1-3年内早期复发风险高,并且绝大多数死亡发生于治疗后的第1个5年内(dentr,trudeaum,pritchardki,etal.triple-negativebreastcancer:clinicalfeaturesandpatternsofrecurrence[j].clinicalcancerresearch,2007,13(15):4429-4434.)。
三阴性乳腺癌作为乳腺癌的一种特殊亚型,对内分泌治疗及抗her-2治疗无效,化疗是其唯一可用的药物治疗,但目前仍没有统一标准的化疗方案。早期三阴性乳腺癌的主要药物是蒽环类和紫杉类(wuj,lis,jiaw,etal.responseandprognosisoftaxanesandanthracyclinesneoadjuvantchemotherapyinpatientswithtriple-negativebreastcancer[j].journalofcancerresearch&clinicaloncology,2011,137(10):1505-1510.),其他化疗药物的循证医学的证据尚不足。在转移性三阴性乳腺癌治疗中,为了寻找更合适的化疗药物联合方案,我国正在进行ⅲ期随机临床研究,有望为此提供更多的循证医学依据。以紫杉类药物为基础的方案和吉西他滨联合卡铂方案已经收录到nccn指南推荐方案中,其他临床常用的药物有卡培他滨、长春瑞滨等(datkofm,dicklermn.ribbon-2:arandomized,double-blind,placebo-controlled,phaseiiitrialevaluatingtheefficacyandsafetyofbevacizumabincombinationwithchemotherapyforsecond-linetreatmentofhumanepidermalgrowthfactorreceptor2–negativemetastaticbreastcancer[j].breastdiseases:ayearbookquarterly,2012,23(4):375-376.)。目前,随着对tnbc研究的开展,dna损伤型化疗药物如铂类,egfr拮抗剂、血管生成抑制剂、src抑制剂、雄激素受体阻断剂、trail激动剂等都显示对它有一定的抑制作用(lium,moqg,weicy,etal.platinum-basedchemotherapyintriple-negativebreastcancer:ameta-analysis.[j].oncologyletters,2013,5(3):983-991.)。
技术实现要素:
本发明的目的在于克服现有技术的不足之处而提供一种用于治疗乳腺癌、肺癌、结直肠癌等癌症的化合物及其制备方法与应用。
为实现上述目的,本发明采取的技术方案为:
第一方面,本发明提供了一种化合物,其结构如式(ⅰ)所示:其中,所述r1和r2为卤元素、氢原子(h)或乙炔基(≡);x的结构如式(x1)或式(x2)所示;y为甲基或如式(x1)所示结构;
本发明所涉及的化合物是利用饱和二元酸分子做桥链,将式(ⅵ)和羟喜树碱(式(ⅶ))拼合形成的孪药(twindrug)。孪药是指将两个相同的或不同的先导化合物,经共价键链接缀合成一个新的分子,经体内代谢后产生以上两种具有协同作用的化合物,结果是增强活性或产生新的药理活性,或提高作用的选择性。羟喜树碱是dna合成抑制剂,实验研究表明主要作用于dna合成期(即s期),对g0期细胞没有作用,对g1、g2与m期细胞有轻微杀伤力,对多种动物肿瘤有抑制作用,作用机制为抑制dna拓扑异构酶ⅰ,与常用抗肿瘤药物无交叉耐药、动物实验显示其抗瘤谱广,对核酸特别是dna的合成有明显抑制作用。式(ⅵ)是一类表皮生长因子受体酪氨酸激酶(egfr-tk)抑制剂(属小分子化合物)。对egfr-tk的抑制可阻碍肿瘤的生长、转移和血管生成,并增加肿瘤细胞的凋亡。
研究表明,本发明提供的式(ⅰ)所示化合物能抑制人源乳腺癌肿瘤细胞、肺癌细胞和结直肠癌细胞的生长,该化合物可用来治疗乳腺癌、肺癌、结直肠癌等癌症,其中,在乳腺癌中尤其适用于治疗三阴性乳腺癌。
作为本发明所述化合物的优选实施方式,所述n为整数,且1≤n≤5。
作为本发明所述化合物的优选实施方式,所述r1为f元素或氢元素,r2为cl元素或乙炔基。。
第二方面,本发明提供了上述化合物的制备方法,其包括以下步骤:
(a)如下式(ⅱ)所示化合物发生取代反应,生成式(ⅲ)所示化合物;
(b)如下式(ⅲ)所示化合物与式(ⅳ)所示化合物反应生成式(ⅴ)所示化合物;
(c)如下式(ⅴ)所示化合物发生水解反应生成式(ⅵ)所示化合物;
(d)如下式(ⅵ)所示化合物与式(ⅶ)所示化合物反应生成权利要求1所述化合物;
作为本发明所述化合物的制备方法的优选实施方式,所述式(ⅳ)为egfr抑制剂;所述式(ⅰ)、式(ⅱ)、式(ⅲ)、式(ⅴ)和式(ⅵ)中,n为整数,且1≤n≤5;优选地,所述egfr抑制剂为吉非替尼或厄洛替尼。当然,n包括但不限于1~5,egfr抑制剂包括但不限于吉非替尼或厄洛替尼。
作为本发明所述化合物的制备方法的优选实施方式,所述步骤(a)中,式(ⅱ)所示化合物与(co)2cl2发生取代反应,生成式(ⅲ)所示化合物。
作为本发明所述化合物的制备方法的优选实施方式,所述式(ⅱ)所示化合物与(co)2cl2的摩尔比为1:1.8~1:2.0;式(ⅲ)所示化合物与式(ⅳ)所示化合物的摩尔比为1:1;式(ⅵ)所示化合物与式(ⅶ)所示化合物的摩尔比为1:1~1:1.1。
第三方面,本发明提供了上述化合物在制备治疗癌症的药物中的应用。
作为本发明所述应用的优选实施方式,所述癌症为乳腺癌、肺癌或结直肠癌。
作为本发明所述应用的优选实施方式,所述乳腺癌为三阴性乳腺癌。
第四方面,本发明提供了一种用于治疗癌症的药物,所述药物包括上述化合物。
作为本发明所述用于治疗癌症的药物的优选实施方式,所述癌症为乳腺癌、肺癌或结直肠癌。
作为本发明所述用于治疗癌症的药物的优选实施方式,所述乳腺癌为三阴性乳腺癌。
作为本发明所述用于治疗癌症的药物的优选实施方式,所述药物还包括药学上可接受的辅料。本领域的技术人员可以根据药物的剂型以及药物的综合性能,按照常规选择合适的辅料。
与现有技术相比,本发明的有益效果为:本发明提供了一种新的化合物,该化合物能抑制人源乳腺癌、肺癌和结直肠癌肿瘤细胞的生长,可用来治疗乳腺癌、肺癌和结直肠癌,对于乳腺癌,尤其适用于治疗三阴性乳腺癌。
附图说明
图1为本发明实施例1中采用lc-ms检测步骤(b)反应所得产物的结果图;
图2为本发明式(a4)所示化合物的lc-ms检测结果图;
图3为本发明实施例1中采用lc-ms检测步骤(c)反应所得产物的结果图;
图4为本发明实施例1中采用hplc检测步骤(c)反应所得产物的结果图;
图5为本发明式(a5)所示化合物的lc-ms检测结果图;
图6为本发明实施例1中采用lc-ms检测步骤(d)反应所得产物的结果图;
图7为本发明式(a)所示化合物的lc-ms检测结果图;
图8为本发明式(a)所示化合物的hplc检测结果图;
图9为本发明式(a)所示化合物的hnmr图;
图10为本发明式(a)所示化合物的sfc检测结果图;
图11为本发明式(a)所示化合物的制备原理图。
图12为本发明实施例2中采用lc-ms检测步骤(b)反应所得产物的结果图;
图13为本发明式(b4)所示化合物的lc-ms检测结果图;
图14为本发明实施例2中采用lc-ms检测步骤(c)反应所得产物的结果图;
图15为本发明式(a5)所示化合物的lc-ms检测结果图;
图16为本发明实施例2中采用lc-ms检测步骤(d)反应所得产物的结果图;
图17为本发明式(b)所示化合物的lc-ms检测结果图;
图18为本发明式(b)所示化合物的hplc检测结果图;
图19为本发明式(b)所示化合物的hnmr图;
图20为本发明式(b)所示化合物的sfc检测结果图;
图21为本发明式(b)所示化合物的制备原理图。
图22为本发明式(c4)所示化合物的lc-ms检测结果图;
图23为本发明式(c5)所示化合物的lc-ms检测结果图;
图24为本发明实施例3中采用lc-ms检测步骤(d)反应所得产物的结果图;
图25为本发明式(c)所示化合物的lc-ms检测结果图;
图26为本发明式(c)所示化合物的hplc检测结果图;
图27为本发明式(c)所示化合物的hnmr图;
图28为本发明式(c)所示化合物的sfc检测结果图;
图29为本发明式(c)所示化合物的制备原理图。
图30为本发明实施例4中不同时间小鼠体重的测试结果图;
图31为本发明实施例4中不同时间小鼠皮下肿瘤体积的测试结果图;
图32为本发明实施例4中终末肿瘤大小的测试结果图;
图33为本发明实施例4中小鼠皮下肿瘤病理切片后he染色结果图;
图34为本发明实施例5中不同时间小鼠体重的测试结果图;
图35为本发明实施例5中不同时间小鼠皮下肿瘤体积的测试结果图;
图36为本发明实施例5中终末瘤重结果图;
图37为本发明实施例5中终末肿瘤大小的结果图;
图38为本发明实施例6中不同时间小鼠体重的测试结果图;
图39为本发明实施例6中不同时间小鼠皮下肿瘤体积的测试结果图;
图40为本发明实施例6中终末瘤重结果图;
图41为本发明实施例6中终末肿瘤大小的结果图;
图42为本发明实施例7中不同时间小鼠体重的测试结果图;
图43为本发明实施例7中不同时间小鼠皮下肿瘤体积的测试结果图;
图44为本发明实施例7中终末瘤重结果图;
图45为本发明实施例7中终末肿瘤大小的结果图。
具体实施方式
为更好地说明本发明的目的、技术方案和优点,下面将结合附图和具体实施例对本发明作进一步说明。
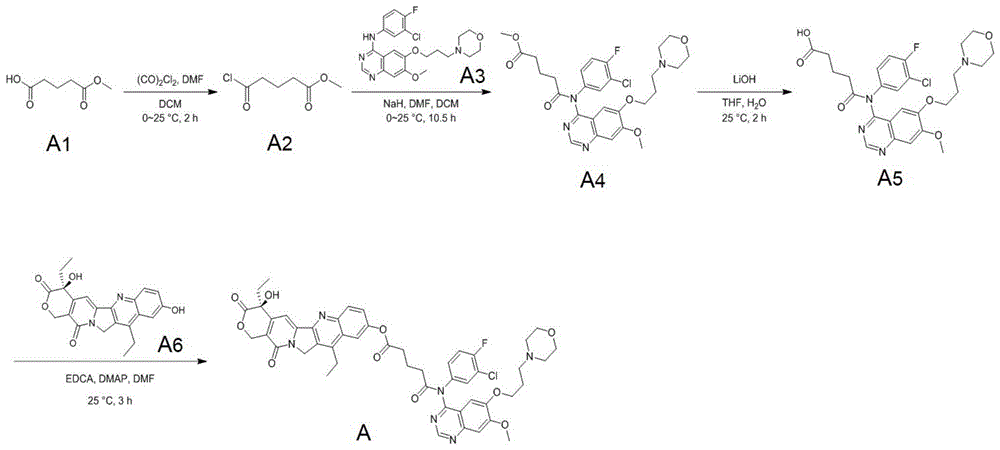
实施例1
本发明化合物的一种实施例,本实施例所述化合物bl-0001的结构如式(a)所示:
本实施例所述化合物的制备方法为:
(a)将式(a1)所示化合物(1.00g,6.84mmol,862.1ul,1.00eq)和n,n-二甲基甲酰胺(dmf,5.00mg,68.4umol,5.26ul,0.01eq)溶于10ml二氯甲烷(dcm),在0℃将(co)2cl2(1.56g,12.3mmol,1.08ml,1.80eq)缓慢滴加入反应体系,完毕后,将混合物于25℃下搅拌2h,取少许反应液滴入甲醇中进行tlc(薄层层析),展开剂(石油醚:乙酸乙酯=5:1,式(a1)所示化合物rf=0.3,式(a2)所示化合物rf=0.5,pma),显示大部分式(a1)所示化合物被消耗并形成新斑点。将混合物真空浓缩,得到粗式(a2)所示化合物(1.14g,粗产物),为黄色油状物,其不经纯化直接使用。
(b)在0℃搅拌下,向式(a3)所示化合物(3.10g,6.93mmol,1.00eq)的n,n-二甲基甲酰胺(dmf,30.0ml)溶液中分批加入nah(290.9mg,7.27mmol,纯度:60%,1.05eq),然后将混合物在25℃下搅拌30min。将二氯甲烷(dcm,5.00ml)溶解的式(a2)所示化合物(1.14g,6.93mmol,958.0μl,1.00eq)于0℃搅拌下滴加入反应体系,完毕后,将形成的混合物在25℃下搅拌10h。采用lc-ms检测步骤(b)反应所得产物,检测结果如图1所示。由图1可见,反应物rt=0.816min,m/z=575.1(m+1)+,显示大部分式(a2)所示化合物被消耗并且形成所需的ms。将混合物用nh4cl(50.0ml)淬灭,用水(150ml)稀释,用乙酸乙酯(200ml)萃取三次,有机相用硫酸钠干燥,过滤并真空浓缩,得到粗式(a4)所示化合物(不经lcms纯化得到黄色油状物,5.40g),式(a4)所示化合物的lc-ms检测结果图如图2所示,其rt=0.817min,m/z=575.1(m+1)+。
(c)将式(a4)所示化合物(3.98g,6.92mmol,1.00eq)溶于thf(四氢呋喃,12ml),并加入lioh·h2o(290.5mg,6.92mmol,1.00eq)的h2o(4.0ml)溶液,将混合物于25℃反应2h。采用lc-ms和hplc检测步骤(c)反应所得产物,lc-ms检测结果如图3所示,hplc检测结果如图4所示。lcms的检测结果表明,式(a4)所示化合物rt=0.795min,m/z=561.0(m+1)+,hplc的检测结果表明,式(a5)所示化合物rt=1.597,显示大部分式(a4)所示化合物被消耗并且形成所需的ms产物。用hcl(1m)将混合物调节至ph≈7,用水(150ml)稀释,用乙酸乙酯(200ml×3)萃取,有机相用硫酸钠干燥,过滤并真空浓缩,通过制备型hplc纯化粗式(a5)所示化合物(柱:phenomenexlunac18250*50mm*10μm;流动相:[水(0.1%三氟乙酸(tfa))-乙腈(acn)];b%:13%-43%,30min,50%在真空下浓缩除去ch3cn,残余物用乙酸乙酯(400ml)萃取三次,有机相用硫酸钠干燥,过滤并真空浓缩,得到式(a5)所示化合物(0.70g,1.24mmol,产率:17.9%,纯度:99.3%,黄色胶装物)。纯化后的式(a5)所示化合物的lc-ms图如图5所示。由图5可见,式(a5)所示化合物的rt=0.787min,m/z=561.1(m+1)+)。
(d)将式(a6)所示化合物(461.7mg,1.18mmol,1.10eq)溶入n,n-二甲基甲酰胺(dmf,10.0ml),并加入式(a5)所示化合物(600.0mg,1.07mmol,1.00eq),edci(615.1mg,3.21mmol,3.00eq)和dmap(261.3mg,2.14mmol,2.00eq),混合物在25℃下搅拌3h。采用lc-ms检测步骤(d)反应所得产物,检测结果如图6所示,lcms的检测结果表明:目标产物rt=0.862,m/z=934.1(m+1)+,可见大部分式(a6)所示化合物被消耗并且形成所需的ms。将混合物用冰水(60.0ml)稀释,并用hcl(1m)调节至ph≈7。用乙酸乙酯(100ml×3)萃取混合物。有机相经硫酸钠干燥,过滤并在真空下浓缩,得到粗产物,将其通过预hplc纯化(柱:phenomenexlunac18250*50mm*10μm;流动相:[水(0.05%hcl)-乙腈(acn))];b%:20%-50%,30分钟,80%min和柱:phenomenexsynergic18150*25*10um;流动相:[水(0.05%hcl)-乙腈(acn)];b%:20%-40%用hcl(1m)将液体调节至ph≈7,真空浓缩除去乙腈,剩余液体用乙酸乙酯(300ml)萃取三次。有机相经硫酸钠干燥,过滤并在真空下浓缩,通过lcms得到化合物式(a)所示目标化合物(120.91mg,127.6μmol,产率:11.9%,纯度:98.8%,浅黄色固体)。采用lc-ms、hplc、hnmr和sfc检测纯化后的式(a)所示目标化合物,lc-ms的检测结果如图7所示,hplc的检测结果如图8所示,hnmr的检测结果如图9所示,sfc的检测结果如图10所示。由图7可见,化合物目标rt=0.849分钟,m/z=935.1(m+1)+。式(a)所示目标化合物的hnmr解析如下:δ=9.10(s,1h),8.22(d,j=9.2hz,1h),7.82(d,j=2.4hz,1h),7.66(s,1h),7.50(dd,j=2.4,9.0hz,2h),7.35(s,1h),7.15-7.05(m,2h),5.77(d,j=16.4hz,1h),5.37-5.23(m,3h),4.04(brs,5h),3.84-3.65(m,4h),3.09(q,j=7.6hz,2h),2.76(brt,j=6.8hz,2h),2.60-2.39(m,6h),2.22(quin,j=6.8hz,2h),2.04-1.76(m,4h),1.35(t,j=7.6hz,3h),1.05(t,j=7.2hz,3h)。
本实施例式(a)所示化合物的制备原理如图11所示。
实施例2
本发明化合物的一种实施例,本实施例所述化合物bl-0002的结构如式(b)所示:
(a)将式(b1)所示化合物(2.00g,9.89mmol,1.00eq))和n,n-二甲基甲酰胺(7.23mg,98.9umol,7.61ul,0.01eq)溶于15ml二氯甲烷(dcm),在0℃将(co)2cl2(2.51g,19.8mmol,1.73ml,2.00eq)缓慢滴加入反应体系,完毕后,将混合物于25℃下搅拌3h。将混合物真空浓缩,得到粗式(b2)所示化合物,为黄色固体。
(b)在0℃搅拌下,向式(b3)所示化合物(4.42g,9.89mmol,1.00eq)的n,n-二甲基甲酰胺(dmf,10.0ml)溶液中分批加入nah(474.7mg,11.9mmol,纯度:60%,1.20eq),然后将混合物在25℃下搅拌1h。将式(b2)所示化合物(1.14g,6.93mmol,958.0μl,1.00eq)用二氯甲烷(dcm,15.00ml)溶解,于-10℃搅拌下滴加入反应体系,完毕后,将形成的混合物在25℃下搅拌11h。采用lc-ms检测步骤(b)反应所得产物,检测结果如图12所示。由图12可见,反应物rt=0.832min,m/z=631.2(m+1)+,显示大部分式(b3)所示化合物被消耗并且形成所需的ms。将混合物用hcl(1m)调至ph≈7,用水(200ml)稀释,用乙酸乙酯(500ml)萃取三次。有机相用水清洗(100.0ml*5)并用硫酸钠干燥,过滤并真空浓缩,得到粗式(b4)所示化合物(不经lcms纯化得到黄色油状物,5.00g),式(b4)所示化合物的lc-ms检测结果图如图13所示,其rt=0.856min,m/z=631.0(m+1)+。
(c)将式(b4)所示化合物(5.00g,7.92mmol,1.00eq)溶于thf(四氢呋喃,150ml),并加入naoh(1.11g,27.7mmol,3.50eq)的h2o(120.0ml)溶液,将混合物于15~20℃反应5h。采用lc-ms检测步骤(c)反应所得产物,lc-ms检测结果如图14所示。lcms的检测结果表明,式(b5)所示化合物形成所需ms(rt=0.675min,m/z=617.1(m+1)+),tlc检测(乙酸乙酯/乙醇=5/1)结果显示式(b4)所示化合物rf=0.6,式(b5)所示化合物rf=0.2,说明式(b4)所示化合物大被消耗并且形成式(b5)所示化合物。用hcl(1m)将混合物调节至ph≈7,真空浓缩去除thf,用乙酸乙酯(150ml×2)萃取,有机相用硫酸钠干燥,过滤并真空浓缩得到式(b5)粗品。黄色油状式(b5)粗品(3.00g)lcms如图15所示(rt=0.792min,m/z=618.0(m+1)+)。
(d)将式(b6)所示化合物(1.91g,4.86mmol,1.00eq)溶入n,n-二甲基甲酰胺(dmf,30.0ml),并加入式(b5)所示化合物(3.00g,4.86mmol,1.00eq),edci(2.80g,14.58mmol,3.00eq)和dmap(1.19g,9.72mmol,2.00eq),混合物在25℃下搅拌3h。采用lc-ms检测步骤(d)反应所得产物,检测结果如图16所示,lcms的检测结果表明:目标产物式(b)rt=0.768min,m/z=991.3(m+1)+,可见大部分式(b5)所示化合物被消耗并且形成所需的ms。将混合物用水(100.0ml)稀释,用乙酸乙酯(150ml×3)萃取。有机相经硫酸钠干燥,过滤并在真空下浓缩,得到粗产物,将其通过预hplc纯化(柱:phenomenexlunac18250*50mm*10μm;流动相:[水(0.05%hcl)-乙腈(acn))];b%:18%-48%,24min和柱:phenomenexsynergic18150*30mm*4um;流动相:[水(0.05%hcl)-乙腈(acn)];b%:30%-50%,11min)用nahco3(1m)将液体调节至ph≈7,真空浓缩除去乙腈,剩余液体用乙酸乙酯(300ml)萃取三次。有机相经硫酸钠干燥,过滤并在真空下浓缩,通过lcms得到化合物式(b)所示目标化合物(308.6mg,309.4μmol,产率:6.36%,纯度:99.4%,浅黄色固体)。采用lc-ms、hplc、hnmr和sfc检测纯化后的式(b)所示目标化合物,lc-ms的检测结果如图17所示,hplc的检测结果如图18所示,hnmr的检测(400mhz,cdcl3)结果如图19所示,sfc的检测结果如图20所示。由图17可见,目标化合物rt=0.905min,m/z=991.4.1(m+1)+。式(b)所示目标化合物的hnmr解析如下:δ13.53-13.00(m,1h),9.08(s,1h),8.24(d,j=9.2hz,1h),7.83(d,j=2.4hz,1h),7.65(s,1h),7.56(dd,j=2.4,9.2hz,1h),7.53-7.45(m,1h),7.37(s,2h),7.19(t,j=8.4hz,1h),7.09(s,1h),5.77(d,j=16.4hz,1h),5.37-5.25(m,3h),4.38-4.17(m,4h),4.03(s,5h),3.77(s,1h),3.53(brd,j=10.0hz,2h),3.31-3.21(m,2h),3.16(q,j=7.6hz,2h),3.00-2.85(m,2h),2.65(t,j=7.6hz,2h),2.60-2.46(m,2h),2.39(brt,j=7.6hz,2h),1.87-1.86(m,1h),2.05-1.68(m,7h),1.50-1.18(m,11h),1.05(t,j=7.2hz,3h).
本实施例式(b)所示化合物的制备原理如图21所示。
实施例3
本发明化合物的一种实施例,本实施例所述化合物bl-0003的结构如式(c)所示:
(a)将式(c1)所示化合物(2.00g,9.89mmol,1.00eq))和n,n-二甲基甲酰胺(dmf,72.3mg,988.9umol,76.1ul,0.10eq)溶于20ml二氯甲烷(dcm),在0℃将(co)2cl2(2.51g,19.8mmol,1.73ml,2.00eq)缓慢搅拌滴加入反应体系,完毕后,将混合物于20℃下搅拌1h。将混合物真空浓缩,得到粗式(c2)所示化合物,为黄色固体。
(b)在0℃搅拌下,向式(c3)所示化合物(3.89g,9.89mmol,1.00eq)的n,n-二甲基甲酰胺(dmf,30.0ml)溶液中分批加入nah(415.3mg,10.4mmol,60.0%purity,1.05eq),然后将混合物在25℃下搅拌2h。将(a)过程得到的粗式(c2)所示化合物用二氯甲烷(dcm,20.00ml)溶解,于0℃搅拌下滴加入反应体系,完毕后,将形成的混合物在0℃下搅拌2h。tlc检测(石油醚/乙酸乙酯=0/1)结果显示式(c3)所示化合物rf=0.2,式(c4)所示化合物rf=0.5,说明式(c3)所示化合物大被消耗并且形成式(3)所示化合物。将混合物用水(100ml)稀释,用hcl(1m)调至ph≈7,用乙酸乙酯(150ml)萃取三次。有机相用盐水清洗(20ml*2)并用硫酸钠干燥,过滤并真空浓缩,得到粗式(c4)所示化合物。通过反相hplc纯化(25%~60%乙腈,中性条件)真空浓缩除去乙腈,余液用乙酸乙酯(100.0ml*2)萃取。并用硫酸钠干燥,过滤并真空浓缩,通过lcmc(图22,反应物rt=0.989,m/z=578.2(m+1)+)纯化得到式(c4)所示化合物(2.08g,3.55mmol,产率35.9%,纯度98.7%),为无色油状物
(c)将式(c4)所示化合物(2.08g,3.60mmol,1.00eq)溶于thf(四氢呋喃,30ml),并加入naoh(720.1mg,18.0mmol,5.00eq)的h2o(40.0ml)溶液,将混合物于15~20℃反应8h。tlc检测(石油醚/乙酸乙酯=0/1)结果显示式(c4)所示化合物rf=0.5,式(c5)所示化合物rf=0.3,说明式(c4)所示化合物大被消耗并且形成式(c5)所示化合物。用hcl(1m)将混合物调节至ph≈7,真空浓缩去除thf,用乙酸乙酯(100ml×2)萃取,过滤并真空浓缩得到粗产物,通过反相hplc纯化(25%~60%乙腈+0.1%hcl),用nahco3(1m)将液体调节至ph≈7,并在真空下浓缩以除去乙腈。剩余液用乙酸乙酯萃取(100.0ml*3),有机相用硫酸钠干燥,过滤并真空浓缩,通过lcmc(图23,rt=0.939,m/s=564.4(m+1)+)纯化得到式(c5)所示化合物(1.10g,1.94mmol,产率54.0,纯度99.6%),为黄色油状物。
(d)将式(c5)所示化合物(500.0mg,887.1umol,1.00eq)溶入n,n-二甲基甲酰胺(dmf,5.0ml),并在20℃下依次加入式(c6)所示化合物(348.1mg,887.1umol,1.00eq),edci(510.2mg,2.66mmol,3.00eq)和dmap(216.7mg,1.77mmol,2.00eq),混合物在25℃下搅拌3h。采用lc-ms检测步骤(d)反应所得产物,检测结果如图6所示,lcms的检测结果如图24所示,rt=1.047min,m/z=937.6(m+1)+,可见大部分式(c5)所示化合物被消耗并且形成所需的ms。将混合物用水(20.0ml)稀释,用乙酸乙酯(30ml×3)萃取。有机相经硫酸钠干燥,过滤并真空浓缩,得到粗产物,通过预hplc纯化(柱:phenomenexlunac18250*50mm*10μm;流动相:[水(0.05%hcl)-乙腈(acn))];b%:47%-67%,15min)。nahco3(1m)将液体调节至ph≈7,真空浓缩除去乙腈,剩余液体用乙酸乙酯(100ml)萃取三次。有机相经硫酸钠干燥,过滤并在真空下浓缩,通过lcms得到化合物式(c)所示目标化合物(403.7mg,427.79μmol,产率:48.22%,纯度:99.4%,浅黄色固体)。采用lc-ms、hplc、hnmr和sfc检测纯化后的式(c)所示目标化合物,lc-ms的检测结果如图25所示,hplc的检测结果如图26所示,hnmr的检测(400mhz,cdcl3)结果如图27所示,sfc的检测、结果如图28所示。由图26可见,目标化合物式(c)rt=1.000min,m/z=938.3(m+1)+。式(c)所示目标化合物的hnmr解析如下:δ=9.08(s,1h),8.32-8.31(m,1h),8.24(d,j=9.2hz,1h),7.83(d,j=2.4hz,1h),7.65(s,1h),7.55(dd,j=2.4,9.2hz,1h),7.46(s,1h),7.40-7.30(m,4h),7.15(s,1h),5.77(d,j=16.4hz,1h),5.36-5.21(m,3h),4.36-4.29(m,2h),4.20-4.13(m,2h),3.90-3.83(m,2h),3.82-3.73(m,3h),3.47(d,j=6.0hz,6h),3.16(q,j=7.6hz,2h),3.07(s,1h),2.64(t,j=7.6hz,2h),2.35(t,j=7.2hz,2h),2.00-1.84(m,2h),1.83-1.71(m,4h),1.45-1.31(m,9h),1.05(t,j=7.2hz,3h)。
本实施例式(c)所示化合物的制备原理如图29所示。
实施例4bl-0001人源性乳腺癌细胞异种移植模型实验
本实施例考察了本发明式(a)所示化合物bl-0001对移植于balb/c-nudemice人源乳腺癌肿瘤的生长抑制作用。本实施例考察的具体方法如下。
1、受试物
名称:paclitaxel(紫杉醇)、gemcitabine(吉西他滨)、bl-0001(本发明式(a)所示化合物)、l-carnitine(左旋肉碱)。
储存条件:-20℃
准备方法:假设小鼠体重为24g
(1)paclitaxel
腹腔注射剂量:0.2-0.8ml
20mg/kgpaclitaxel:20mg/kg*24*10-3kg=6mg/ml*0.08ml
(2)gemcitabine
腹腔注射剂量:0.2-0.8ml
溶剂:生理盐水混悬
(3)bl-0001
腹腔注射剂量:0.2-0.8ml
溶剂:ph3-4的山梨糖醇水溶液(混悬)
(4)l-carnitine
腹腔注射剂量:0.2-0.8ml
溶剂:5%葡萄糖(混悬)
2、肿瘤细胞
名称:人源三阴性乳腺癌细胞(er-、pr-、her2-、egfr+)(mda-mb-231)
提供者:普健生物(武汉)科技有限公司
3、实验动物品系、等级、使用数量、性别、体重范围及来源
品系:balb/c-nudemice
等级:spf级别
数量:35只
性别:雌性
周龄:5周
4、实验方法
将人源乳腺癌细胞mda-mb-231细胞以1×107的细胞量接种到5只小鼠皮下,瘤体直径达2-3cm时,选择生长状态良好的肿瘤,在无菌条件下取出,切成1.5mm×1.5mm大小均匀的瘤块并分别接种到另外30只小鼠肩胛间的脂肪垫下接种,瘤体积达到100-300mm3范围时,将荷瘤裸鼠按瘤体积随机分组给药实验动物分为3组,每组10只,分组见表1。
5、考察指标
5.1瘤体积
测量方法:肿瘤体积v=1/2×a×b2,a为肿瘤的长径,b为肿瘤的短径
测量周期:给药第2天开始,每天上午测量小鼠皮下肿瘤体积
5.2体重
测量周期:从给药开始,每隔一天测量小鼠体重及瘤体积(14天的试验周期,按照表格日期给药)。
6、动物编号、组别、干预措施及频率(如表1所示)
表1
注:a组的两种溶剂是同一天给予,分别为ip、po方式;
c组的两种药物是同一天给予;
14天的试验周期,每天上午称量小鼠体重,按照表格日期给药。
7、药物活性评价指标
7.1肿瘤体积及重量测量
自给药起,每隔一天检测一次小鼠皮下肿瘤的体积及小鼠体重。给药治疗14天。第14天,检测小鼠皮下肿瘤的体积及小鼠体重,拍照记录肿瘤大小(拍照记录游标卡尺数值)随后,将小鼠处死,按组排列再次拍照。最后,取皮下肿瘤,测量其重量及体积,分别按组别排列拍照。(拍照背景光线充足,无阴影,背景为白色或淡蓝色卡纸,卡纸剪裁为矩形)
肿瘤体积v=1/2×a×b2,a为肿瘤的长径,b为肿瘤的短径。
不同时间小鼠体重的测试结果如图30所示,小鼠皮下肿瘤体积的测试结果如图31所示,小鼠肿瘤大小的检测结果如图32所示。阳性对照组(activecontrl)在给药5天后显示出了较大的毒性,导致四只小鼠死亡,因此在给药第六天后停止了吉西他滨的使用,紫杉醇仍继续使用。小鼠体重测试结果和皮下瘤体积测试结果显示,在14天的给药阶段中本发明所涉及的化合物bl-0001显示了比阳性对照组更好的活性和更低的毒性。此结果在小鼠肿瘤大小检测结果中可以得到直观验证。
备注:取材取皮下肿瘤,每组选3个样本的肿瘤做he染色。
7.2he染色(肿瘤组织)
取小鼠皮下肿瘤,进行固定后,石蜡包埋,切片,做he染色,观察肿瘤组织的病理变化,结果如图33所示。由图33可见,对照组肿瘤细胞较大,核大且分布均匀,呈蓝紫色,核分裂像明显;紫杉醇联合吉西他滨组、吉非替尼组肿瘤细胞同对照组相似,肿瘤细胞亦处于核分裂状态,但吉非替尼组存在部分肿瘤细胞死亡的状态;吉非替尼联合伊利替康组存在大部分肿瘤细胞坏死,细胞核浓缩变形;伊利替康组、bl-0001组可见较大的肿瘤细胞,细胞核较小且着色较浅,质核比稍大,细胞没有处于增殖状态。
实施例5bl-0001、bl-0002和bl-0003的人源性乳腺癌细胞异种移植模型实验
本实施例考察了本发明式(a)所示化合物bl-0001、式(b)所示化合物bl-0002式(c)所示化合物bl-0003对移植于balb/c-nudemice人源乳腺癌肿瘤的生长抑制作用。本实施例考察的具体方法如下。
1、受试物
名称:paclitaxel(紫杉醇)、gemcitabine(吉西他滨)、bl-0001(本发明式(a)所示化合物)、bl-0002(本发明式(b)所示化合物)、bl-0003(本发明式(c)所示化合物)、l-carnitine(左旋肉碱)。
储存条件:-20℃
准备方法:假设小鼠体重为24g
(1)paclitaxel
腹腔注射剂量:0.2-0.8ml
20mg/kgpaclitaxel:20mg/kg*24*10-3kg=6mg/ml*0.08ml
(2)gemcitabine
腹腔注射剂量:0.2-0.8ml
溶剂:生理盐水混悬
(3)bl-0001
腹腔注射剂量:0.2-0.8ml
溶剂:ph3-4的山梨糖醇水溶液(混悬)
(4)bl-0002
腹腔注射剂量:0.2-0.8ml
溶剂:ph3-4的山梨糖醇水溶液(混悬)
(4)bl-0003
腹腔注射剂量:0.2-0.8ml
溶剂:ph3-4的山梨糖醇水溶液(混悬)
(5)l-carnitine
腹腔注射剂量:0.2-0.8ml
溶剂:5%葡萄糖(混悬)
2、肿瘤细胞
名称:人源三阴性乳腺癌细胞(er-、pr-、her2-、egfr+)(mda-mb-231)
提供者:普健生物(武汉)科技有限公司
3、实验动物品系、等级、使用数量、性别、体重范围及来源
品系:balb/c-nudemice
等级:spf级别
数量:30只
性别:雌性
周龄:5周
4、实验方法
将人源乳腺癌细胞mda-mb-231细胞以1×107的细胞量接种到5只小鼠皮下,瘤体直径达2-3cm时,选择生长状态良好的肿瘤,在无菌条件下取出,切成1.5mm×1.5mm大小均匀的瘤块并分别接种到另外25只小鼠肩胛间的脂肪垫下接种,瘤体积达到100-300mm3范围时,将荷瘤裸鼠按瘤体积随机分组给药实验动物分为5组,每组5只,分组见表2。
5、考察指标
5.1瘤体积
测量方法:肿瘤体积v=1/2×a×b2,a为肿瘤的长径,b为肿瘤的短径
测量周期:给药第2天开始,每天上午测量小鼠皮下肿瘤体积
5.2体重
测量周期:从给药开始,每隔一天测量小鼠体重及瘤体积(14天的试验周期,按照表格日期给药)。
6、动物编号、组别、干预措施及频率(如表2所示)
表2
注:a组的两种溶剂是同一天给予,分别为ip、po方式;
14天的试验周期,每天上午称量小鼠体重,按照表格日期给药。
7、药物活性评价指标(肿瘤体积及重量测量)
自给药起,每隔一天检测一次小鼠皮下肿瘤的体积及小鼠体重。给药治疗14天。第14天,检测小鼠皮下肿瘤的体积及小鼠体重,拍照记录肿瘤大小(拍照记录游标卡尺数值)随后,将小鼠处死,按组排列再次拍照。最后,取皮下肿瘤,测量其重量及体积,分别按组别排列拍照。(拍照背景光线充足,无阴影,背景为白色或淡蓝色卡纸,卡纸剪裁为矩形)
肿瘤体积v=1/2×a×b2,a为肿瘤的长径,b为肿瘤的短径。
不同时间小鼠体重的测试结果如图34所示,小鼠皮下肿瘤体积的测试结果如图35所示,终末瘤重检测结果如图36所示,终末肿瘤大小的检测结果如图37所示。阳性组在给药5天后显示出了较大的毒性,导致四只小鼠死亡,因此在给药第六天后停止了吉西他滨的使用,紫杉醇仍继续使用。bl-0002组虽然由于药物毒性原因,导致小鼠死亡,但是由图35所示,bl-0002与bl-0001和bl-0003显示了相似的比阳性对照组更好的活性,其中,bl-0001和bl-0003显示了更低的毒性。此结果在终末瘤重和终末肿瘤大小检测结果中可以得到直观验证。
实施例6bl-0001人源性结直肠癌细胞异种移植模型实验
本实施例考察了本发明式(a)所示化合物bl-0001对移植于balb/c-nudemice人源性结直肠肿瘤的生长抑制作用。本实施例考察的具体方法如下。
1、受试物
名称:paclitaxel(紫杉醇)、bl-0001(本发明式(a)所示化合物)、l-carnitine(左旋肉碱)。
储存条件:-20℃
准备方法:假设小鼠体重为24g
(1)paclitaxel
腹腔注射剂量:0.2-0.8ml
20mg/kgpaclitaxel:20mg/kg*24*10-3kg=6mg/ml*0.08ml
(2)bl-0001
腹腔注射剂量:0.2-0.8ml
溶剂:ph3-4的山梨糖醇水溶液(混悬)
(3)l-carnitine
腹腔注射剂量:0.2-0.8ml
溶剂:5%葡萄糖(混悬)
2、肿瘤细胞
名称:人源结直肠癌细胞(hct116)
提供者:普健生物(武汉)科技有限公司
3、实验动物品系、等级、使用数量、性别、体重范围及来源
品系:balb/c-nudemice
等级:spf级别
数量:22只
性别:雌性
周龄:5周
4、实验方法
将人源结直肠癌细胞hct116细胞以1×107的细胞量接种到4只小鼠皮下,瘤体直径达2-3cm时,选择生长状态良好的肿瘤,在无菌条件下取出,切成1.5mm×1.5mm大小均匀的瘤块并分别接种到另外18只小鼠肩胛间的脂肪垫下接种,瘤体积达到100-300mm3范围时,将荷瘤裸鼠按瘤体积随机分组给药实验动物分为3组,每组6只,分组见表3。
5、考察指标
5.1瘤体积
测量方法:肿瘤体积v=1/2×a×b2,a为肿瘤的长径,b为肿瘤的短径
测量周期:给药第2天开始,每天上午测量小鼠皮下肿瘤体积
5.2体重
测量周期:从给药开始,每隔一天测量小鼠体重及瘤体积(14天的试验周期,按照表格日期给药)。
6、动物编号、组别、干预措施及频率(如表3所示)
表3
注:c组的两种药物是同一天给予;
14天的试验周期,每天上午称量小鼠体重,按照表格日期给药。
7、药物活性评价指标(肿瘤体积及重量测量)
自给药起,每隔一天检测一次小鼠皮下肿瘤的体积及小鼠体重。给药治疗14天。第14天,检测小鼠皮下肿瘤的体积及小鼠体重,拍照记录肿瘤大小(拍照记录游标卡尺数值)随后,将小鼠处死,按组排列再次拍照。最后,取皮下肿瘤,测量其重量及体积,分别按组别排列拍照。(拍照背景光线充足,无阴影,背景为白色或淡蓝色卡纸,卡纸剪裁为矩形)
肿瘤体积v=1/2×a×b2,a为肿瘤的长径,b为肿瘤的短径。
不同时间小鼠体重的测试结果如图38所示,小鼠皮下肿瘤体积的测试结果如图39所示,终末瘤重检测结果如图40所示,终末肿瘤大小的检测结果如图41所示。小鼠体重测试结果和皮下瘤体积测试结果显示,在14天的给药阶段中本发明所涉及的化合物bl-0001显示了比阳性对照组(pac组)更高的活性和相似的毒性。此结果在终末瘤重和终末肿瘤大小检测结果中可以得到直观验证。
实施例7bl-0001人源性肺癌细胞异种移植模型实验
本实施例考察了本发明式(a)所示化合物bl-0001对移植于balb/c-nudemice人源性肺肿瘤的生长抑制作用。本实施例考察的具体方法如下。
1、受试物
名称:paclitaxel(紫杉醇)、carboplatin(卡铂)、bl-0001(本发明式(a)所示化合物)、l-carnitine(左旋肉碱)。
储存条件:-20℃
准备方法:假设小鼠体重为24g
(1)paclitaxel
腹腔注射剂量:0.2-0.8ml
20mg/kgpaclitaxel:20mg/kg*24*10-3kg=6mg/ml*0.08ml
(2)carboplatin
腹腔注射剂量:0.2-0.8ml
溶剂:生理盐水混悬
(3)bl-0001
腹腔注射剂量:0.2-0.8ml
溶剂:ph3-4的山梨糖醇水溶液(混悬)
(4)l-carnitine
腹腔注射剂量:0.2-0.8ml
溶剂:5%葡萄糖(混悬)
2、肿瘤细胞
名称:人源肺癌细胞(h1299)
提供者:普健生物(武汉)科技有限公司
3、实验动物品系、等级、使用数量、性别、体重范围及来源
品系:balb/c-nudemice
等级:spf级别
数量:22只
性别:雌性
周龄:5周
4、实验方法
将人源肺癌细胞h1299细胞以1×107的细胞量接种到4只小鼠皮下,瘤体直径达2-3cm时,选择生长状态良好的肿瘤,在无菌条件下取出,切成1.5mm×1.5mm大小均匀的瘤块并分别接种到另外18只小鼠肩胛间的脂肪垫下接种,瘤体积达到100-300mm3范围时,将荷瘤裸鼠按瘤体积随机分组给药,实验动物分为3组,每组6只,分组见表1。
5、考察指标
5.1瘤体积
测量方法:肿瘤体积v=1/2×a×b2,a为肿瘤的长径,b为肿瘤的短径
测量周期:给药第2天开始,每天上午测量小鼠皮下肿瘤体积
5.2体重
测量周期:从给药开始,每隔一天测量小鼠体重及瘤体积(14天的试验周期,按照表格日期给药)。
6、动物编号、组别、干预措施及频率(如表4所示)
表4
注:a组的两种溶剂是同一天给予,分别为ip、po方式;
c组的两种药物是同一天给予;
14天的试验周期,每天上午称量小鼠体重,按照表格日期给药。
7、药物活性评价指标(肿瘤体积及重量测量)
自给药起,每隔一天检测一次小鼠皮下肿瘤的体积及小鼠体重。给药治疗14天。第14天,检测小鼠皮下肿瘤的体积及小鼠体重,拍照记录肿瘤大小(拍照记录游标卡尺数值)随后,将小鼠处死,按组排列再次拍照。最后,取皮下肿瘤,测量其重量及体积,分别按组别排列拍照。(拍照背景光线充足,无阴影,背景为白色或淡蓝色卡纸,卡纸剪裁为矩形)
肿瘤体积v=1/2×a×b2,a为肿瘤的长径,b为肿瘤的短径。
不同时间小鼠体重的测试结果如图42所示,小鼠皮下肿瘤体积的测试结果如图43所示,终末瘤重检测结果如图44所示,终末肿瘤大小的检测结果如图45所示。小鼠体重测试结果和皮下瘤体积测试结果显示,在14天的给药阶段中本发明所涉及的化合物bl-0001显示了比阳性对照组(pac+carb组)更高的活性和相似的毒性。此结果在终末瘤重和终末肿瘤大小检测结果中可以得到直观验证。
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
- 还没有人留言评论。精彩留言会获得点赞!