一种提高酿酒酵母合成角鲨烯能力的方法与流程
本发明涉及生物技术领域,具体地,本发明涉及酿酒酵母及其应用,更具体地,本发明涉及酿酒酵母及其应用,更具体地,本发明涉及酿酒酵母、提高酿酒酵母合成角鲨烯能力的方法以及获得角鲨烯的方法。
背景技术:
角鲨烯(squalene)是一种开链三萜类化合物,其化学名为:全反-2,6,10,15,19,23-六甲基-2,6,10,14,18,22-廿四碳六烯,可作为润滑剂、杀虫剂、衣物护理剂、药物载体、疫苗佐剂、皮肤保湿剂、抗氧化剂等。
天然角鲨烯的来源主要包括动物来源和植物来源。动物来源主要是从鲨鱼肝中提取,但此法破坏生态且产品中可能会携带动物致病因子;植物提取主要从橄榄油、大豆油、山茶油和米糠油中进行分离,但其产量低下,成本过高。微生物发酵是一直获取角鲨烯的新方法,一般的微生物发酵产角鲨烯的含量都较低,因此近年来有多个通过基因工程手段改造微生物的案例。
酿酒酵母作为生物安全性高的宿主菌,被很多研究用于进行改造生产角鲨烯。例如通过过表达hmg1的催化区域,可以将酿酒酵母中的角鲨烯含量提高大约40倍,达到大约到9mg/g干细胞(含量0.9%)《polakowski,t.,u.stahl,andc.lang,overexpressionofacytosolichydroxymethylglutaryl-coareductaseleadstosqualeneaccumulationinyeast.applmicrobiolbiotechnol,1998.49(1):p.66-71.》。rasool等人通过在酿酒酵母中多基因的过表达及基因的下调,其改造过后的酵母角鲨烯含量比野生型提高了76.16倍,但角鲨烯含量也仅有7.6mg/g干细胞(含量0.76%)。《rasool,a.,m.s.ahmed,andc.li,overproductionofsqualenesynergisticallydownregulatesethanolproductioninsaccharomycescerevisiae.chemicalengineeringscience,2016.152:p.370-380.》。
因此,尽管研究者在不断努力提高微生物发酵产角鲨烯的含量,但这些产量离工业规模生产差距甚远。
技术实现要素:
本发明旨在至少在一定程度上解决相关技术中的技术问题之一。
为了研发出一种比现存技术更有效和更廉宜的角鲨烯发酵方法,本发明通过遗传改造方法,对hmg1催化区域(thmg1)及erg9两个关键限速步骤进行过表达,同时进行erg1基因的下调表达,得到高产角鲨烯的工程菌。高产的角鲨烯菌可用于发酵提取角鲨烯,替代动物源角鲨烯,用于医药、化妆品领域。
为此,在本发明的第一方面,本发明提出了一种酿酒酵母。根据本发明的实施例,所述酿酒酵母包括:hmg-coa还原酶和角鲨烯合酶erg9基因上调;以及gal80和角鲨烯单加氧酶erg1基因下调。根据本发明实施例的酿酒酵母,其中合成角鲨烯的合成酶erg9上调,角鲨烯转为下游产物的角鲨烯单加氧酶erg1下调,实现了代谢产物角鲨烯的有效累积,同时,hmg-coa还原酶是甲羟戊酸途径中的限速步骤,它的上调也可实现萜类化合物角鲨烯产量的增加,gal80的下调改变了酿酒酵母中的gal调控系统,使得原本受到gal80抑制的gal1,gal10,gal7,gal2启动子的转录活性不再受到抑制,从而使gal1,gal10,gal7,gal2启动子控制的基因强表达。根据本发明实施例的酿酒酵母具有高产角鲨烯的特点。
根据本发明的实施例,上述酿酒酵母还可以进一步具有如下附加技术特征至少之一:
根据本发明的实施例,所述hmg-coa还原酶和erg9基因上调以及gal80基因下调是通过hmg-coa还原酶和erg9基因表达盒原位替换gal80基因实现的。采用hmg-coa还原酶和erg9基因表达盒原位替换gal80基因,可一步实现hmg-coa还原酶和erg9基因的过表达以及gal80基因的敲除,操作更加简便;且发明人发现,同时进行hmg-coa还原酶和erg9基因的过表达以及gal80基因的敲除,可显著提高角鲨烯的产量。
根据本发明的实施例,所述hmg-coa还原酶和erg9基因表达盒中的hmg-coa还原酶和erg9基因来自于黑曲霉、里氏木霉、南极假丝酵母、毕赤酵母、乳酸克鲁维酵母、解脂耶氏酵母或酿酒酵母,优选来自酿酒酵母。发明人发现,通过过表达来自于酿酒酵母中的hmg-coa还原酶和erg9基因,其在提高角鲨烯的产量方面表现更为优异。
根据本发明的实施例,所述hmg-coa还原酶基因来自酿酒酵母hmg-coa还原酶基因的催化区thmg。发明人发现,过表达hmg-coa还原酶基因的催化区thmg,在提高角鲨烯的产量方面表现更为优异。
根据本发明的实施例,所述hmg-coa还原酶和erg9基因表达盒进一步包括酿酒酵母启动子,所述酿酒酵母启动子与所述hmg-coa还原酶和erg9基因可操作地连接。酿酒酵母启动子可在酿酒酵母细胞中,强启动hmg-coa还原酶和erg9基因的表达。
根据本发明的实施例,所述酿酒酵母启动子包括选自组成型的tef1基因启动子、act1基因启动子、hxt7基因启动子或tdh3基因启动子,诱导型的gal1基因启动子、gal10基因启动子、gal7基因启动子和gal2基因启动子的至少之一。
根据本发明的实施例,所述酿酒酵母启动子为诱导型的gal1基因启动子pgal1和gal10基因启动子pgal10。gal80的敲除使得原本受到gal80抑制的pgal1和pgal10的转录活性不再受到抑制,因此,选用pgal1和pgal10,可以实现pgal1和pgal10控制的hmg-coa还原酶和erg9基因的强表达。
根据本发明的实施例,所述hmg-coa还原酶基因与所述pgal1可操作地连接,所述erg9基因与所述pgal10可操作地连接。
根据本发明的实施例,所述erg1基因下调是通过替换erg1基因的原有启动子perg1为组成型的cyc1基因启动子pcyc1、甲硫氨酸抑制型的met3基因启动子pmet3、cu离子抑制型的ctr3基因启动子pctr3或葡萄糖诱导型的hxt1基因启动子phxt1实现的。发明人发现,如果采用erg1基因的敲除,会使得酿酒酵母死亡,而采用替换erg1基因的原有启动子perg1为上述启动子来实现erg1基因的下调,不仅可以保持酿酒酵母菌株的活性,还可以抑制erg1基因的表达,实现代谢产物角鲨烯的有效累积。
根据本发明的实施例,所述下调erg1基因是通过替换erg1基因的原有启动子perg1为phxt1实现的。发明人通过实验意外而惊喜地发现,替换erg1基因的原有启动子perg1为phxt1相比于替换为其他启动子,能够更加显著地提高角鲨烯的产量。
根据本发明的实施例,酿酒酵母菌株为选自by4743,by4742,by4743,invsc1、hec-ylk的至少之一,所述hec-ylk于2018年1月29日保藏于中国典型培养物保藏中心,保藏编号为cctccno:m2018062,分类命名为:saccharomycescerevisiaehec-ylk,保藏地址为:湖北省武汉市武昌区八一路299号武汉大学,中国典型培养物保藏中心。
根据本发明的实施例,所述酿酒酵母菌株为hec-ylk。发明人发现,在hec-ylk为出发菌株,获得上述的工程菌株,其工程菌株角鲨烯的产量是普通菌株为出发菌株的角鲨烯产量的10倍左右。根据本发明实施例的酿酒酵母经过简单发酵,角鲨烯的含量即可达到细胞干重的10%以上。
在本发明的第二方面,本发明提出了一种提高酿酒酵母合成角鲨烯能力的方法。根据本发明的实施例,所述方法包括使hmg-coa还原酶和角鲨烯合酶erg9基因上调;以及使gal80和角鲨烯单加氧酶erg1基因下调。根据本发明实施例的方法,可显著提高酿酒酵母角鲨烯的合成产量。
根据本发明的实施例,上述方法的还可以具有的附加技术特征与前面所描述的酿酒酵母的附加技术特征类似,其附加技术特征所带来的优势和效果也与前面所描述的优势和效果类似,在此不再赘述。
在本发明的第三方面,本发明提出了一种获得角鲨烯的方法。根据本发明的实施例,所述方法包括将前面所述的酿酒酵母在液体培养基中进行发酵培养,以便获得含有角鲨烯的培养物。根据本发明的方法,可显著提高角鲨烯的产量。
根据本发明的实施例,上述方法还可以进一步包括如下附加技术特征至少之一:
根据本发明的实施例,所述液体培养基包括28~32g/l葡萄糖,5~9g/l硫酸铵,1~4g/l酵母粉,1~4g/l蛋白胨,8~12g/l玉米浆,3~7g/l磷酸二氢钾,1~4g/l硫酸镁,0.5~3g/l硫酸锌,180~220mg/l维生素b1,180~220mg/l维生素b3,180~220mg/l维生素b6。将所述酿酒酵母在上述液体培养基中进行发酵培养,可在保证发酵产量的前提下,节省生产成本,有利于后续的工业放大。
根据本发明的实施例,发酵过程中,采用分阶段补充不同碳源的方式进行发酵培养。发明人发现,前期采用葡萄糖作为碳源可以促使菌体快速生长,提高生物量,后期采用乙醇作为碳源可以诱导菌体大量产生目标产物,从而采用分阶段补充不同碳源的方式进行发酵培养可显著提升角鲨烯的产量。
根据本发明的实施例,所述分阶段补充不同碳源通过如下方式实现:在发酵开始后的40小时内,采用葡萄糖作为基础碳源,并采用流加葡萄糖的方式补充碳源;发酵开始后的40小时后,采用乙醇作为基础碳源,并采用流加乙醇的方式补充碳源,发酵系统中乙醇的浓度控制在不超过3g/l。发明人发现,在发酵开始后的40小时内补充葡萄糖碳源,可显著促进菌体生长,提高生物量;40小时后补充乙醇作为碳源,可以诱导菌体产生大量的目标产物-角鲨烯。而控制发酵系统中乙醇的浓度不超过3g/l,是由于发明人发现,乙醇浓度过高反而会抑制菌体的生长,甚至导致菌体的自溶,因此,控制发酵系统中乙醇的浓度不超过3g/l,可在促进菌体生长的前提下,诱导菌体产生大量的目标产物。
根据本发明的实施例,所述发酵是在温度为30~32℃、ph为5~6的条件下进行3~5天。
根据本发明的实施例,所述酿酒酵母预先经过活化处理。进而可进一步提高酿酒酵母的活性,提高代谢产物角鲨烯的产量。
根据本发明的实施例,所述活化处理是通过如下方式实现的:将-80℃保存的酿酒酵母接种至50mlypd培养基中,并在30℃,250rpm的条件下培养12h进行第一活化处理,以便获得一级种子;将所述一级种子以5%接种量转接至另一新的50mlypd培养基中,并在30℃,250rpm的条件下培养7h进行第二活化处理,以便获得二级种子。
另外,根据本发明的实施例,所述获得角鲨烯的方法进一步包括:从获得的含有所述角鲨烯的培养物中分离和提取角鲨烯。分离和提取角鲨烯的方法不受特别限制,本领域技术人员可根据常规技术手段,依据实验室或工业生产的需求,进行选择。
附图说明
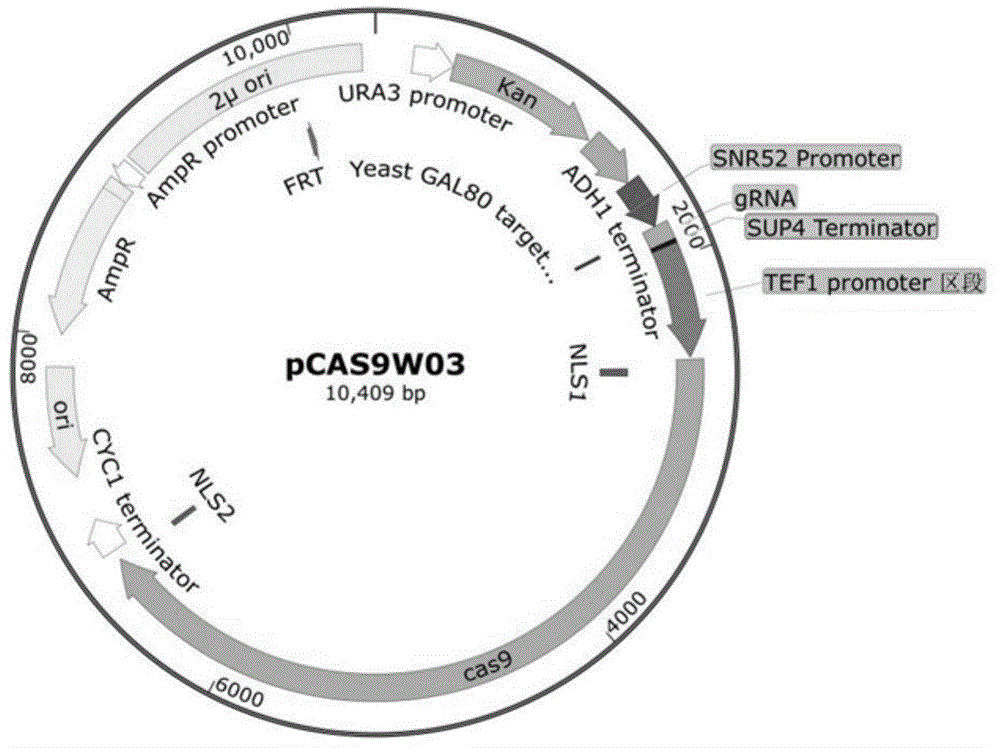
图1是根据本发明实施例的质粒pcas9w03图谱。
具体实施方式
本发明的目的是提供一种改造酿酒酵母超产角鲨烯的方法。采用未经过基因工程改造的酿酒酵母菌株,简单的基因工程操作,即可构建一株超产角鲨烯的菌株,弥补现有技术的不足。
在此,本发明人在酵母菌株中只进行hmg1催化区域(thmg1)及erg9两个关键限速步骤进行过表达,同时进行erg1基因的下调表达,经过简单发酵角鲨烯的含量即可远超过目前文献中所报道菌株的角鲨烯含量。
即本发明包含了下述内容:
1)采用基因工程手段改造酿酒酵母提高细胞进一步合成角鲨烯能力的方法。所使用的酿酒酵母菌株可以是常见的by4743,by4742,by4743,invsc1等实验室常用菌株,优选的hec-ylk酵母菌株(于2018年1月29日保藏于中国典型培养物保藏中心,保藏编号为cctccno:m2018062)。所使用的策略为在酿酒酵母中过表达hmg-coa还原酶和角鲨烯合酶,下调角鲨烯单加氧酶(erg1)的表达。基因的操作过表达或者下调表达采用以下方式:
a)其中,下调角鲨烯单加氧化酶包括但不限于采用替换原角鲨烯环氧化酶启动子的方式。优选地,采用酿酒酵母中组成型的cyc1基因启动子(pcyc1),甲硫氨酸抑制型的met3基因启动子(pmet3),cu离子抑制型的ctr3基因启动子(pctr3),葡萄糖诱导型的hxt1基因启动子(phxt1)替换原角鲨烯环氧化酶启动子;最为优选地采用phxt1启动子替换原角鲨烯环氧化酶启动子。
b)其中,过表达的hmg辅酶a还原酶和角鲨烯合酶可以来自于黑曲霉,里氏木霉,南极假丝酵母,毕赤酵母,乳酸克鲁维酵母,解脂耶氏酵母,酿酒酵母,优选为来之于酿酒酵母hmg1的催化区域(thmg1)和角鲨烯合酶erg9。
c)表达hmg辅酶a还原酶,角鲨烯合酶所选用的启动子采用来源于酿酒酵母的强启动子,优选地采用组成型的tef1基因启动子、act1基因启动子、hxt7基因启动子或tdh3基因启动子,诱导型的gal1基因启动子、gal10基因启动子、gal7基因启动子或gal2基因启动子;最优选地选用诱导型的gal1基因启动子(pgal1),gal10基因启动子(pgal10)。
d)thmg1,角鲨烯合酶使用pgal1,pgal10进行驱动表达,并替换在原酿酒酵母染色体的的gal80基因位置。由于gal80蛋白是pgal1、pgal10启动激活的抑制蛋白,将基因整合在此位置可以消除gal80的抑制作用,使pgal1和pgal10控制的基因强表达。
2)高密度发酵工程菌株生产角鲨烯的方法。将构建好的工程酵母菌株采用在液体培养基中高密度发酵,采用分阶段补不同碳源的方式促进角鲨烯的形成。在发酵前期采用葡萄糖作为基础料碳源和补料用碳源,待发酵30-40小时后改用乙醇作为碳源进行补料发酵至发酵结束。
本发明的效果
按照本发明方法构建的工程菌株进行发酵,角鲨烯产量可以达到细胞干重的10%以上,是一般报道中的10~100倍水平,具有产业化应用潜力。
下面详细描述本发明的实施例,所述实施例的示例在附图中示出。下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。
实施例1酿酒酵母基因编辑载体的构建
1)构建gal80编辑位点质粒
采用如核苷酸序列seqidno:1和seqidno:2为引物,从pesc-ura(agilenttechnologies公司产品)扩增酵母载体上的“cyc1t-大肠杆菌ori-ampr-2μori-ura3p”区域。
ggaattctaatcatgtaattagttatgtcacgcttacattcacgccctccccccacatccgctctaaccgaaaaggaagg(seqidno:1)。
agacgtttcccgttgaatatggctcatgatttatcttcgtttcctgcaggtttttgttc(seqidno:2)。
合成seqidno:3(kanorf-adh1t-snr52p-gal80n20-sup4t-tef1p)区域。
atgagccatattcaacgggaaacgtcttgctctaggccgcgattaaattccaacatggatgctgatttatatgggtataaatgggctcgcgataatgtcgggcaatcaggtgcgacaatctatcgattgtatgggaagcccgatgcgccagagttgtttctgaaacatggcaaaggtagcgttgccaatgatgttacagatgagatggtcagactaaactggctgacggaatttatgcctcttccgaccatcaagcattttatccgtactcctgatgatgcatggttactcaccactgcgatccctgggaaaacagcattccaggtattagaagaatatcctgattcaggtgaaaatattgttgatgcgctggcagtgttcctgcgccggttgcattcgattcctgtttgtaattgtccttttaacagcgatcgcgtatttcgtctcgctcaggcgcaatcacgaatgaataacggtttggttgatgcgagtgattttgatgacgagcgtaatggctggcctgttgaacaagtctggaaagaaatgcataaacttttgccattctcaccggattcagtcgtcactcatggtgatttctcacttgataaccttatttttgacgaggggaaattaataggttgtattgatgttggacgagtcggaatcgcagaccgataccaggatcttgccatcctatggaactgcctcggtgagttttctccttcattacagaaacggctttttcaaaaatatggtattgataatcctgatatgaataaattgcagtttcatttgatgctcgatgagtttttctaacaattcttcgccagaggtttggtcaagtctccaatcaaggttgtcggcttgtctaccttgccagaaatttacgaaaagatggaaaagggtcaaatcgttggtagatacgttgttgacacttctaaataagcgaatttcttatgatttatgatttttattattaaataagttataaaaaaaataagtgtatacaaattttaaagtgactcttaggttttaaaacgaaaattcttattcttgagtaactctttcctgtaggtcaggttgctttctcaggtatagcatgaggtcgctccaattcagcttctttgaaaagataatgtatgattatgctttcactcatatttatacagaaacttgatgttttctttcgagtatatacaaggtgattacatgtacgtttgaagtacaactctagattttgtagtgccctcttgggctagcggtaaaggtgcgcattttttcacaccctacaatgttctgttcaaaagattttggtcaaacgctgtagaagtgaaagttggtgcgcatgtttcggcgttcgaaacttctccgcagtgaaagataaatgatcgcgagtcccaaagacagtacgttttagagctagaaatagcaagttaaaataaggctagtccgttatcaacttgaaaaagtggcaccgagtcggtggtgctttttttgttttttatgtctctgataatagcgtataaacaatgcatactttgtacgttcaaaatacaatgcagtagatatatttatgcatattacatataatacatatcacataggaagcaacaggcgcgttggacttttaattttcgaggaccgcgaatccttacatcacacccaatcccccacaagtgatcccccacacaccatagcttcaaaatgtttctactccttttttactcttccagattttctcggactccgcgcatcgccgtaccacttcaaaacacccaagcacagcatactaaatttcccctctttcttcctctagggtgtcgttaattacccgtactaaaggtttggaaaagaaaaaagagaccgcctcgtttctttttcttcgtcgaaaaaggcaataaaaatttttatcacgtttctttttcttgaaaatttttttttttgatttttttctctttcgatgacctcccattgatatttaagttaataaacggtcttcaatttctcaagtttcagtttcatttttcttgttctattacaactttttttacttcttgctcattagaaagaaagcatagcaatctaatctaagttttaattacaaagcggccgccaccatggg(seqidno:3)。
其中n20序列通过crisprdirect在线软件进行设计(http://crispr.dbcls.jp/),n20序列为:gcgagtcccaaagacagtac(seqidno:4),靶向酿酒酵母gal80基因的orf区域(编码区755-775bp区域)。
采用如核苷酸序列seqidno:5和seqidno:6为引物从商业化载体geneartcrisprnucleasevector-ofp(thermofisher公司产品)扩增出cas9区域。
ttttaattacaaagcggccgccaccatgggcaagcccatccctaac(seqidno:5)。
gtaagcgtgacataactaattacatgattagaattccaccttccttttct(seqidno:6)。
上述涉及pcr的操作都按照takara高保真酶primestarmaxdnapolymerase的说明书进行操作。上述分别得到的3个片段相互之间具有>20bp的同源区域。将三个片段采用in-fusionhdcloningkits(clontech公司)进行体外重组,转化到大肠杆菌dh5α,涂布于含有100mg/ml的氨苄霉素抗性平板,筛选到的阳性克隆,所构建成功的质粒命名为pcas9w03。pcas9w03的图谱如图1所示。
2)构建perg1启动子区域编辑质粒
为了构建靶向perg1启动子的基因编辑质粒,通过融合pcr的方式替换pcas9w03上的n20区域。上述以pcas9w03为模板,采用分别采用如核苷酸序列seqidno.7和seqidno.8为引物,seqidno.9和seqidno.10为引物分别扩增出相应dna片段,然后采用dna凝胶回收。以回收产物混合为模板,seqidno.7和seqidno.10为引物,进行融合pcr扩增。nhei+noti分别酶切融合pcr产物和pcas9w03载体,将酶切后的pcr产物和pcas9w03载体骨架进行连接,转化到大肠杆菌dh5α,涂布于含有100mg/ml的氨苄霉素抗性平板,筛选到的阳性克隆,所构建成功的质粒命名为pcas9w14。该载体上表达sgrna的n20区域为tgtccagtattgaacaatac(seqidno:11),靶向erg1基因启动子区域。
gccctcttgggctagcggtaaaggtgcgcat(seqidno:7)。
gctctaaaacgtattgttcaatactggacagatcatttatctttcactgcg(seqidno:8)。
aatgatctgtccagtattgaacaatacgttttagagctagaaatagcaagt(seqidno:9)。
tatcaaggccgatgctgtac(seqidno.10)。
实施例2donor整合片段的构建
以by4743基因组为模板,seqidno:12和seqidno:13为引物,扩增出erg9基因片段,noti+bglii酶切,凝胶电泳回收,连接到同样酶回收的pesc-ura载体上,转化大肠杆菌dh5a,筛选克隆,得到pesc-ura-erg9。以by4743基因组为模板,seqidno:14和seqidno:15为引物,扩增出hmg1的催化区域thmg1,bamhi+sali酶切,凝胶电泳回收,连接到同样酶回收的pesc-ura-erg9载体上,转化大肠杆菌dh5a,筛选克隆,得到pesc-ura-erg9-thmg1,由于pesc-ura上的启动子为pgal1-pgal10双向启动子,erg9和thmg1基因处于pgal1-pgal10的控制下表达。
ataagaatgcggccgcatgggaaagctattacaattgg(seqidno:12)。
gaagatcttcacgctctgtgtaaagtgtat(seqidno:13)。
cccggatccaaaaatggaccaattggtgaaaactgaag(seqidno:14)。
cccgtcgacttaggatttaatgcaggtgacg(seqidno:15)。
以seqidno:16和seqidno:17为引物,引物上下游包含50bpgal80基因的同源区域,pesc-ura-erg9-thmg1质粒为模板,扩增出包括了erg9和thmg1表达盒的区域,。该dna片段为gal80位点整合用的donordna片段,命名为gal80donor。
ttttttttttgaacctgaatatatatacatcacatatcactgctggtcctccagctgaattggagcga(seqidno:16)。
tgagggtaattcaggaattttctttgtattgaagtggaagtcagagataggcagctggatcttcgagcg(seqidno:17)。
以hec-ylk基因组为模板,seqidno:18和seqidno:19为引物,扩增phxt1启动子,上下游引物各携带与erg1启动子区和起始密码子后50bp同源区,扩增的donordna用于erg1启动子区域的替换,命名为phxt1-erg1donor。
ccatcggcgaatttgcgtcgctttaatgcgatactgccgtagcgggccttttgcaggtctcatctggaatataattcc(seqidno:18)。
attgtgttgtcggcattaatcaattcaggtgcaacgttaacagcagacatgattttacgtatatcaactagttgacgattatg(seqidno:19)。
以hec-ylk基因组为模板,seqidno:20和seqidno:21为引物,扩增pctr3启动子,上下游引物各携带与erg1启动子区和起始密码子后50bp同源区,扩增的donordna用于erg1启动子区域的替换,命名为pctr3-erg1donor。
ccatcggcgaatttgcgtcgctttaatgcgatactgccgtagcgggccttacgtagtggtataaggtgagg(seqidno:20)。
attgtgttgtcggcattaatcaattcaggtgcaacgttaacagcagacatgttaattatactttattcttgttattattatac(seqidno:21)。
以hec-ylk基因组为模板seqidno:22和seqidno:23为引物,扩增pmet3启动子,上下游引物各携带与erg1启动子区和起始密码子后50bp同源区,扩增的donordna用于erg1启动子区域的替换,命名为pmet3-erg1donor。
ccatcggcgaatttgcgtcgctttaatgcgatactgccgtagcgggccttctcaggaaaagttggcgatag(seqidno:22)。
attgtgttgtcggcattaatcaattcaggtgcaacgttaacagcagacatattgcgatgtggttgtagtag(seqidno:23)。
实施例3gal80位点的整合
按照gietz,r.d.andr.h.schiestl(2007)."high-efficiencyyeasttransformationusingtheliac/sscarrierdna/pegmethod."natureprotocols2(1):31-34.所述方法制备hec-ylk酵母感受态,并进行转化,在含有100μl酵母细胞的离心管中加入以下物质:peg3350(50%(w/v))240μl,liac(1.0m)36μl,单链鲑鱼精dna(2mg/ml)50μl,pcas9w03编辑载体加入500ng、gal80donor500ng,加无菌水到总体积360μl。将上述混合体系放入到42℃保温40min进行热击。然后加入1mlypd液体培养基,30℃摇床复苏培养3h,复苏后取100μl转化液涂布在含有200μg/ml的ypd固体平板上,30℃进行培养,3天后挑取平板上所长出的克隆,进行基因型验证,得到发生了预期整合的hec-ylk-10菌株。
实施例4phxt1启动子的替换
按照gietz,r.d.andr.h.schiestl(2007)."high-efficiencyyeasttransformationusingtheliac/sscarrierdna/pegmethod."natureprotocols2(1):31-34.所述方法制备hec-ylk-10酵母感受态,并进行转化,在含有100μl酵母细胞的离心管仲加入以下物质:peg3350(50%(w/v))240μl,liac(1.0m)36μl,单链鲑鱼精dna(2mg/ml)50μl,pcas9w14编辑载体加入500ng、phxt1-erg1donor500ng,加无菌水到总体积360μl。将上述混合体系放入到42℃保温40min进行热击。然后加入1mlypd液体培养基,30℃摇床复苏培养3h,复苏后取100μl转化液涂布在含有200μg/ml的ypd固体平板上,30℃进行培养,3天后挑取平板上所长出的克隆,进行基因型验证,得到发生了预期整合的hec-ylk-11菌株。
实施例5对比菌株的构建
通过替换所使用的donordna,参照实施例4和实施例5构建对应的对比菌株。如表1所示。
表1:
通过替换宿主,参照实施例4和实施例5构建对应的对比菌株,如表2所示。
表2:
实施例6工程菌株的摇瓶发酵实验
分别将hec-ylk-10,hec-ylk-11,hec-ylk-12,hec-ylk-13,by4743-s2,invsc1-s2从-80℃冰箱取甘油种子接种至50mlypd培养基(包括20g/l葡萄糖,20g/l大豆蛋白胨,10g/l酵母浸粉)中30℃,250rpm培养12-16h活化,获得一级种子;再按1%接种量转接至新的50mlypd培养基中按上述条件培养发酵72h;其中hec-ylk-12在转接后加入cuso4母液至铜离子终浓度为50μm,其中hec-ylk-13在转接后加入甲硫氨酸母液至甲硫氨酸浓度为1mm。发酵结束后各取培养物1ml到15ml离心管中,离心去上清收集菌体;然后加入1ml的3m浓度盐酸,在沸水浴中处理3min,破坏酵母细胞壁;将处理过后的细胞在冰水浴中冷却1min,离心去上清,并用纯水水洗2遍去除残余的盐酸;再加入1ml丙酮,上下震荡萃取其中的角鲨烯。
hplc检测:采用welch-xb-c30(4.6*250mm)色谱柱,210nm,甲基叔丁基醚:乙腈=5:95,等度洗脱。采用外标法计算提取物中角鲨烯的总量。菌体中角鲨烯含量计算:1ml培养物角鲨烯总量/1ml细胞干重。酵母的细胞干重符合以下规律:1l发酵液中每1个od细胞的干重为0.27g。上述实验每组设计三个平行实验。最终得到的角鲨烯产量如表3所示。
表3:
从发酵数据可以得到以下结论:
1)在对gal80位点敲除的同时,在该位点整合过表达thmg1和erg9可以显著提高酵母中角鲨烯的积累量。
2)对erg1基因的下调,可以进一步提升酿酒酵母中角鲨烯的积累。
3)通过上述两种操作,常规实验室菌株的角鲨烯含量可以12.2-13.7mg/g细胞干重,高于文献中做了多基因改造的案例《rasool,a.,m.s.ahmed,andc.li,overproductionofsqualenesynergisticallydownregulatesethanolproductioninsaccharomycescerevisiae.chemicalengineeringscience,2016.152:p.370-380.》
4)对比hec-ylk-11,hec-ylk-12和hec-ylk-13,说明在采用不同启动子替换erg1启动子时,促进角鲨烯积累的效果为:phxt1>pctr3>pmet3。
5)对比hec-ylk-11,by4743-s2和invsc1-s2,说明即使通过同样的改造,以hec-ylk作为出发宿主菌得到的工程菌株角鲨烯含量具有绝对优势,是以常规菌株为出发宿主产量的10倍左右。
实施例7hec-ylk-11菌株的罐上高密度发酵
将-80℃保存的hec-ylk-11甘油种子接种至50mlypd培养基中,30℃,250rpm培养12h活化,获得一级种子;再按5%接种量转接至新的50mlypd培养基中按上述条件培养7h后,获得二级种子;接着向装有3l无机盐发酵培养基(葡萄糖30g/l,硫酸铵7g/l,酵母粉2g/l,蛋白胨2g/l,玉米浆10g/l,磷酸二氢钾5g/l,硫酸镁2g/l,硫酸锌1g/l,维生素b1200mg/l,维生素b3200mg/l,维生素b6200mg/l)的5l发酵罐中接入已活化的二级种子。发酵过程中,前期采用葡萄糖作为基础料碳源和补料用碳源,待发酵40小时后改用乙醇作为碳源进行补料,发酵罐中乙醇浓度控制在3g/l以下,中途采用氨水将ph控制在5-6之间,发酵3天,最终生物量(od600)达到248od,角鲨烯产量11.7g/l,酵母细胞中角鲨烯含量达到175mg/g(即细胞干重的17.5%)。
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
sequencelisting
<110>东莞东阳光药物研发有限公司
<120>一种提高酿酒酵母合成角鲨烯能力的方法
<130>pidc4190117
<160>23
<170>patentinversion3.3
<210>1
<211>80
<212>dna
<213>artificial
<220>
<223>扩增引物
<400>1
ggaattctaatcatgtaattagttatgtcacgcttacattcacgccctccccccacatcc60
gctctaaccgaaaaggaagg80
<210>2
<211>59
<212>dna
<213>artificial
<220>
<223>扩增引物
<400>2
agacgtttcccgttgaatatggctcatgatttatcttcgtttcctgcaggtttttgttc59
<210>3
<211>2122
<212>dna
<213>artificial
<220>
<223>kanorf-adh1t-snr52p-gal80n20-sup4t-tef1p区域序列
<400>3
atgagccatattcaacgggaaacgtcttgctctaggccgcgattaaattccaacatggat60
gctgatttatatgggtataaatgggctcgcgataatgtcgggcaatcaggtgcgacaatc120
tatcgattgtatgggaagcccgatgcgccagagttgtttctgaaacatggcaaaggtagc180
gttgccaatgatgttacagatgagatggtcagactaaactggctgacggaatttatgcct240
cttccgaccatcaagcattttatccgtactcctgatgatgcatggttactcaccactgcg300
atccctgggaaaacagcattccaggtattagaagaatatcctgattcaggtgaaaatatt360
gttgatgcgctggcagtgttcctgcgccggttgcattcgattcctgtttgtaattgtcct420
tttaacagcgatcgcgtatttcgtctcgctcaggcgcaatcacgaatgaataacggtttg480
gttgatgcgagtgattttgatgacgagcgtaatggctggcctgttgaacaagtctggaaa540
gaaatgcataaacttttgccattctcaccggattcagtcgtcactcatggtgatttctca600
cttgataaccttatttttgacgaggggaaattaataggttgtattgatgttggacgagtc660
ggaatcgcagaccgataccaggatcttgccatcctatggaactgcctcggtgagttttct720
ccttcattacagaaacggctttttcaaaaatatggtattgataatcctgatatgaataaa780
ttgcagtttcatttgatgctcgatgagtttttctaacaattcttcgccagaggtttggtc840
aagtctccaatcaaggttgtcggcttgtctaccttgccagaaatttacgaaaagatggaa900
aagggtcaaatcgttggtagatacgttgttgacacttctaaataagcgaatttcttatga960
tttatgatttttattattaaataagttataaaaaaaataagtgtatacaaattttaaagt1020
gactcttaggttttaaaacgaaaattcttattcttgagtaactctttcctgtaggtcagg1080
ttgctttctcaggtatagcatgaggtcgctccaattcagcttctttgaaaagataatgta1140
tgattatgctttcactcatatttatacagaaacttgatgttttctttcgagtatatacaa1200
ggtgattacatgtacgtttgaagtacaactctagattttgtagtgccctcttgggctagc1260
ggtaaaggtgcgcattttttcacaccctacaatgttctgttcaaaagattttggtcaaac1320
gctgtagaagtgaaagttggtgcgcatgtttcggcgttcgaaacttctccgcagtgaaag1380
ataaatgatcgcgagtcccaaagacagtacgttttagagctagaaatagcaagttaaaat1440
aaggctagtccgttatcaacttgaaaaagtggcaccgagtcggtggtgctttttttgttt1500
tttatgtctctgataatagcgtataaacaatgcatactttgtacgttcaaaatacaatgc1560
agtagatatatttatgcatattacatataatacatatcacataggaagcaacaggcgcgt1620
tggacttttaattttcgaggaccgcgaatccttacatcacacccaatcccccacaagtga1680
tcccccacacaccatagcttcaaaatgtttctactccttttttactcttccagattttct1740
cggactccgcgcatcgccgtaccacttcaaaacacccaagcacagcatactaaatttccc1800
ctctttcttcctctagggtgtcgttaattacccgtactaaaggtttggaaaagaaaaaag1860
agaccgcctcgtttctttttcttcgtcgaaaaaggcaataaaaatttttatcacgtttct1920
ttttcttgaaaatttttttttttgatttttttctctttcgatgacctcccattgatattt1980
aagttaataaacggtcttcaatttctcaagtttcagtttcatttttcttgttctattaca2040
actttttttacttcttgctcattagaaagaaagcatagcaatctaatctaagttttaatt2100
acaaagcggccgccaccatggg2122
<210>4
<211>20
<212>dna
<213>artificial
<220>
<223>n20序列
<400>4
gcgagtcccaaagacagtac20
<210>5
<211>46
<212>dna
<213>artificial
<220>
<223>扩增引物
<400>5
ttttaattacaaagcggccgccaccatgggcaagcccatccctaac46
<210>6
<211>50
<212>dna
<213>artificial
<220>
<223>扩增引物
<400>6
gtaagcgtgacataactaattacatgattagaattccaccttccttttct50
<210>7
<211>31
<212>dna
<213>artificial
<220>
<223>扩增引物
<400>7
gccctcttgggctagcggtaaaggtgcgcat31
<210>8
<211>51
<212>dna
<213>artificial
<220>
<223>扩增引物
<400>8
gctctaaaacgtattgttcaatactggacagatcatttatctttcactgcg51
<210>9
<211>51
<212>dna
<213>artificial
<220>
<223>扩增引物
<400>9
aatgatctgtccagtattgaacaatacgttttagagctagaaatagcaagt51
<210>10
<211>20
<212>dna
<213>artificial
<220>
<223>扩增引物
<400>10
tatcaaggccgatgctgtac20
<210>11
<211>20
<212>dna
<213>artificial
<220>
<223>表达sgrna的n20区域序列
<400>11
tgtccagtattgaacaatac20
<210>12
<211>38
<212>dna
<213>artificial
<220>
<223>扩增引物
<400>12
ataagaatgcggccgcatgggaaagctattacaattgg38
<210>13
<211>30
<212>dna
<213>artificial
<220>
<223>扩增引物
<400>13
gaagatcttcacgctctgtgtaaagtgtat30
<210>14
<211>38
<212>dna
<213>artificial
<220>
<223>扩增引物
<400>14
cccggatccaaaaatggaccaattggtgaaaactgaag38
<210>15
<211>31
<212>dna
<213>artificial
<220>
<223>扩增引物
<400>15
cccgtcgacttaggatttaatgcaggtgacg31
<210>16
<211>68
<212>dna
<213>artificial
<220>
<223>扩增引物
<400>16
ttttttttttgaacctgaatatatatacatcacatatcactgctggtcctccagctgaat60
tggagcga68
<210>17
<211>69
<212>dna
<213>artificial
<220>
<223>扩增引物
<400>17
tgagggtaattcaggaattttctttgtattgaagtggaagtcagagataggcagctggat60
cttcgagcg69
<210>18
<211>78
<212>dna
<213>artificial
<220>
<223>扩增引物
<400>18
ccatcggcgaatttgcgtcgctttaatgcgatactgccgtagcgggccttttgcaggtct60
catctggaatataattcc78
<210>19
<211>83
<212>dna
<213>artificial
<220>
<223>扩增引物
<400>19
attgtgttgtcggcattaatcaattcaggtgcaacgttaacagcagacatgattttacgt60
atatcaactagttgacgattatg83
<210>20
<211>71
<212>dna
<213>artificial
<220>
<223>扩增引物
<400>20
ccatcggcgaatttgcgtcgctttaatgcgatactgccgtagcgggccttacgtagtggt60
ataaggtgagg71
<210>21
<211>83
<212>dna
<213>artificial
<220>
<223>扩增引物
<400>21
attgtgttgtcggcattaatcaattcaggtgcaacgttaacagcagacatgttaattata60
ctttattcttgttattattatac83
<210>22
<211>71
<212>dna
<213>artificial
<220>
<223>扩增引物
<400>22
ccatcggcgaatttgcgtcgctttaatgcgatactgccgtagcgggccttctcaggaaaa60
gttggcgatag71
<210>23
<211>71
<212>dna
<213>artificial
<220>
<223>扩增引物
<400>23
attgtgttgtcggcattaatcaattcaggtgcaacgttaacagcagacatattgcgatgt60
ggttgtagtag71
- 还没有人留言评论。精彩留言会获得点赞!