一种用于多环芳烃降解的人工混菌体系及其应用方法与流程
本发明涉及一种用于多环芳烃降解的人工混菌体系及其应用方法,属于生物降解领域和人工混菌构建领域。
背景技术:
多环芳烃是指分子中含有2个或2个以上苯环的碳氢化合物,如萘、蒽、菲、芘、联苯等,是一种环境中广泛存在且难降解污染物,具有巨大危害,带来的环境污染问题日益突出。微生物可通过代谢的方法对多环芳烃进行降解,在微生物细胞内,经过脱氢、加氧、水解、脱羧等作用,将结构复杂的有机物转化为结构相对简单的物质,最终转变为短链的脂肪酸进入三羧酸循环,分解为无毒无害的co2和h2o,但降解效率不高且对于高分子量的多环芳烃很难彻底降解。随着多环芳烃带来的环境污染问题日益突出,相关研究不断深入,研究的重点已经从一般寻找降解污染物的微生物转入以基因工程技术为基础构建高效降解多环芳烃的基因工程菌株。
随着人工改造规模和复杂程度的不断增加,使得利用单菌且兼容诸多功能成为难题,因为单菌的代谢能力有限,对单细胞改造过多会给菌种带来沉重的代谢负担。构建混菌体系可拓展体系功能进而提高整个体系的代谢能力,但土著微生物没有足够的时间进化出针对人工合成有机物或特殊污染物的高效降解酶体系,有时难以有效降解特定目标。换言之,天然混菌体系的形成往往以生存为目的,难以按照人类的预期实现特定降解目标,且可控性较差。
为解决工程单菌和天然混菌在降解过程中存在的问题,合成生物学正在从设计构建基本功能元件和模块,逐步向着构建混菌体系的方向迈进,合成混菌体系是未来合成生物学研究的重要方向。结合多环芳烃降解人工混菌体系分析,以混菌体系作为研究对象构建目标途径具有三大优势:(1)多环芳烃降解过程中的多个功能基因、辅助基因在不同菌株中表达,使不同菌株功能分工,便于将功能分区、避免功能间的交叉影响,适于同时完成多项复杂工作;(2)人工混菌体系细胞间作用关系动态平衡,对环境波动具有更强适应性和稳定性;(3)不同来源、不同功能的元件和模块可以在不同菌株中构建,既减轻对单菌底盘的代谢负荷,扩大了基因组可改造空间,而且加入新菌或导入新基因可以拓展体系功能。
技术实现要素:
本发明的目的是提供一种用于多环芳烃降解的人工混菌体系及其应用方法,使得微生物可以对多环芳烃污染物进行更高效率地降解。
为实现上述发明目的,本发明提供如下技术方案:
将表达较高多环芳烃羟基化双加氧酶活性的工程菌株大肠杆菌escherichiacolihy1和表达较高的多环芳烃环裂解双加氧酶活性的工程菌株铜绿假单胞菌pseudomonasaeruginosaph2组成人工混菌体系,实现对多环芳烃的高效降解。
本发明涉及的e.colihy1是按照天津大学于2018-6-18申请的中国专利申请号为2018——201810900749.x,发明名称为“一种降解多环芳烃污染物的大肠杆菌工程菌及其构建方法和应用”公开的降解多环芳烃基因工程菌的构建方法构建的。
本发明涉及的p.aeruginosaph2是按照天津大学于2018-6-18申请的中国专利申请号为2018——201810900746.6,发明名称为“一种多环芳烃降解工程菌及其工程改造方法和应用”公开的降解多环芳烃基因工程菌的构建方法构建的。
一种用于多环芳烃降解的人工混菌体系;其特征是由工程菌株大肠杆菌escherichiacolihy1(e.colihy1)和工程菌株铜绿假单胞菌pseudomonasaeruginosaph2(p.aeruginosaph2)组成。
本发明中用于多环芳烃降解的人工混菌体系,其特征是制备方法步骤如下:
(1)挑取工程菌株e.colihy1和工程菌株p.aeruginosaph2的单菌落分别接种至3-5mllb液体培养基中,将工程e.colihy1菌液置于37℃恒温摇床,工程p.aeruginosaph2菌液置于30℃恒温摇床,于200-220rpm条件下过夜培养以活化菌体,在5000-8000rpm条件下离心8-10min收集菌体,弃掉上清,用无菌msm无机盐培养基洗涤菌体2-3次后,用无菌msm培养基稀释菌体,分别制成od600值为3的菌液;
(2)将步骤(1)制成的工程e.colihy1和工程p.aeruginosaph2菌液按照1-4:1的比例混合,组成人工混菌体系。
利用本发明的人工混菌体系在多环芳烃污染物降解中的应用方法,其特征是包括如下步骤:
(1)将制备好的人工混菌体系按0.5%-2%的接种率接种到含有多环芳烃污染物的菲类培养基中进行降解;
(2)在接种后0-24小时,加入0.1mm的iptg(异丙基-β-d-硫代吡喃半乳糖苷)于30-35℃,200-250rpm恒温摇床中诱导培养;
(3)培养6-9天后,完成多环芳烃污染物的高效降解。
处理培养基样品,测定多环芳烃降解率和粗蛋白浓度。
菲类培养基包括:菲降解培养基、菲+正十六烷培养基、菲+石油培养基。
其中,基础msm培养基以1l的培养基计组成成分为:1gnh4no3,1gk2hpo4,1gkh2po4,0.2gmgso4·7h2o,0.02gcacl,0.05gfeso4,0.02g酵母粉,其余为水,ph值7.2。
菲降解培养基为:含有100mg/l菲的msm无机盐培养基;
菲+正十六烷培养基为:含有100mg/l菲和2%(v/v)正十六烷的msm无机盐培养基;
菲+石油培养基为:含有100mg/l菲和2%(w/v)石油的msm无机盐培养基。
上述含量均以1lmsm的培养基计。
降解完成后,在测定降解率之前,可用如下所述方法处理培养基样品:利用正己烷萃取培养基中底物,在萃取前,在每个摇瓶中加入芘作为内标,每瓶萃取2-3次,萃取液取至烧杯中,烧杯放在通风橱中等待正己烷挥发完全。待正己烷完全挥发,用色谱纯二氯甲烷稀释至1000-5000ppm,无水na2so4干燥,并通过0.22μm有机系膜过滤,之后装入进样瓶中。使用气相色谱测定人工混菌对多环芳烃菲的降解率;通过bradford法用小牛血清白蛋白作为标准蛋白质测定人工混菌体系总蛋白质的浓度。
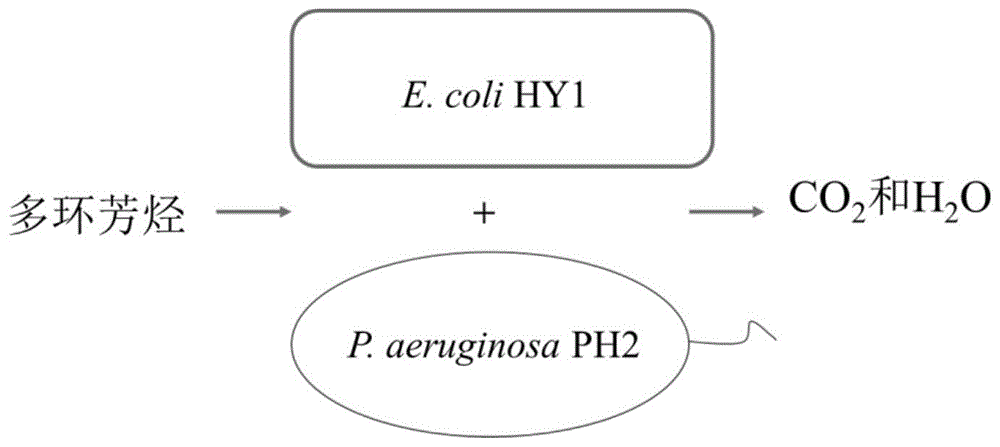
本发明还提供了所述人工混菌体系在多环芳烃污染物降解中的应用示意图(如图1所示),工程e.colihy1和工程p.aeruginosaph2组成人工混菌体系,多环芳烃可作为人工混菌体系代谢底物,分别在羟基化双加氧酶和环裂解双加氧酶作用下逐步实现羟基化和环裂解,随后,代谢物通过进一步的转化进入三羧酸循环(tricarboxylicacidcycle,tca)循环,最终转化为二氧化碳(co2)和水(h2o),完成整个降解过程。
本发明的优点表现为:由于pahs的降解过程实际上是一系列的酶促反应过程。在微生物对pahs的代谢过程中存在两个关键的限速酶,分别负责初步开环和最后一步环裂解。羟基化双加氧酶对苯环的羟基化可以实现pahs的初步开环;环裂解双加氧酶是芳环断裂的关键酶。本发明将多环芳烃降解过程中的环羟基化任务和环裂解任务分配到不同菌株中执行,解决了单一降解菌株应用的局限性,避免了单菌代谢负荷过重的问题;双菌比单菌的降解率更高,从而提高混菌体系对多环芳烃污染物的降解率;该体系为多环芳烃生物降解领域奠定了发明基础。
附图说明
图1工程e.colihy1和工程p.aeruginosaph2组成的人工混菌体系降解应用示意图
具体实施方式
下面结合具体的实施例对本发明做进一步说明:
实施例1一种用于多环芳烃降解的人工混菌体系对多环芳烃菲的降解
(1)从平板上挑取表达较高多环芳烃羟基化双加氧酶活性的工程菌株大肠杆菌escherichiacolihy1(e.colihy1)和表达较高的多环芳烃环裂解双加氧酶活性的工程菌株铜绿假单胞菌pseudomonasaeruginosaph2(p.aeruginosaph2)的单菌落,分别接种至5mllb液体培养基中,将工程e.colihy1菌液置于37℃恒温摇床,工程p.aeruginosaph2菌液置于30℃恒温摇床,设置摇床转速为200rpm,过夜培养以活化菌体。在8000rpm条件下离心8min收集菌体,弃掉上清,用无菌msm无机盐培养基洗涤菌体3次后,用无菌msm培养基稀释菌体,将工程e.colihy1和工程p.aeruginosaph2分别制成od600值为3的菌液;
(2)e.colihy1和p.aeruginosaph2按照2:1的比例制成人工混菌体系;
(3)将制备好的人工混菌体系按0.5%的接种率接种到含有100mg/l菲的100mlmsm无机盐培养基(菲降解培养基)摇瓶中;
(4)在接种24小时后加入终浓度为0.1mm的iptg,于30℃,200rpm恒温摇床中培养;
(5)培养6天后,完成降解,处理培养基样品,测定多环芳烃降解率和粗蛋白浓度。
其中,在测定降解率之前,培养基样品的处理方法如下所述:利用正己烷萃取培养基中底物,在萃取前,在每个摇瓶中加入芘作为内标,每瓶萃取2次,萃取液取至烧杯中,烧杯放在通风橱中等待正己烷挥发完全。待正己烷完全挥发,用色谱纯二氯甲烷稀释至1000ppm,无水na2so4干燥,并通过0.22μm有机系膜过滤,之后装入进样瓶中。使用气相色谱测定人工混菌对多环芳烃菲的降解率;通过bradford法用小牛血清白蛋白作为标准蛋白质测定人工混菌体系总蛋白质的浓度。
测定结果表明,在以菲为单一碳源和能源的降解实验中,由e.colihy1和p.aeruginosaph2组成的人工混菌体系的接种比例是2:1时,人工混菌体系的总蛋白浓度为154μg/ml,对菲的降解率可达到63.66%,具有良好的多环芳烃降解效果。
实施例2一种用于多环芳烃降解的人工混菌体系对多环芳烃菲的降解
(1)从平板上挑取表达较高多环芳烃羟基化双加氧酶活性的工程菌株大肠杆菌escherichiacolihy1(e.colihy1)和表达较高的多环芳烃环裂解双加氧酶活性的工程菌株铜绿假单胞菌pseudomonasaeruginosaph2(p.aeruginosaph2)的单菌落,分别接种至4mllb液体培养基中,将工程e.colihy1菌液置于37℃恒温摇床,工程p.aeruginosaph2菌液置于30℃恒温摇床,设置摇床转速为210rpm,过夜培养以活化菌体。在7000rpm条件下离心9min收集菌体,弃掉上清,用无菌msm无机盐培养基洗涤菌体3次后,用无菌msm培养基稀释菌体,将工程e.colihy1和工程p.aeruginosaph2分别制成od600值为3的菌液;
(2)e.colihy1和p.aeruginosaph2按照4:1的比例制成人工混菌体系;
(3)将制备好的人工混菌体系按1%的接种率接种到含有100mg/l菲的100mlmsm无机盐培养基(菲降解培养基)摇瓶中;
(4)在接种后立即加入终浓度为0.1mm的iptg,于32℃,220rpm恒温摇床中培养;
(6)培养7天后,完成降解,处理培养基样品,测定多环芳烃降解率和粗蛋白浓度。
其中,在测定降解率之前,培养基样品的处理方法如下所述:利用正己烷萃取培养基中底物,在萃取前,在每个摇瓶中加入芘作为内标,每瓶萃取2次,萃取液取至烧杯中,烧杯放在通风橱中等待正己烷挥发完全。待正己烷完全挥发,用色谱纯二氯甲烷稀释至3000ppm,无水na2so4干燥,并通过0.22μm有机系膜过滤,之后装入进样瓶中。使用气相色谱测定人工混菌对多环芳烃菲的降解率;通过bradford法用小牛血清白蛋白作为标准蛋白质测定人工混菌体系总蛋白质的浓度。
测定结果表明,在以菲为单一碳源和能源的降解实验中,e.colihy1和p.aeruginosaph2的接种比例是4:1时,在接种的同时添加诱导剂,6天后人工混菌体系的总蛋白浓度达124μg/ml,多环芳烃菲的降解率达53.73%,具有良好的多环芳烃降解效果。
实施例3一种用于多环芳烃降解的人工混菌体系在石油存在环境下对多环芳烃菲的降解
(1)从平板上挑取表达较高多环芳烃羟基化双加氧酶活性的工程菌株大肠杆菌escherichiacolihy1(e.colihy1)和表达较高的多环芳烃环裂解双加氧酶活性的工程菌株铜绿假单胞菌pseudomonasaeruginosaph2(p.aeruginosaph2)的单菌落,分别接种至3mllb液体培养基中,将工程e.colihy1菌液置于37℃恒温摇床,工程p.aeruginosaph2菌液置于30℃恒温摇床,设置摇床转速为220rpm,过夜培养以活化菌体。在5000rpm条件下离心10min收集菌体,弃掉上清,用无菌msm无机盐培养基洗涤菌体2次后,用无菌msm培养基稀释菌体,将工程e.colihy1和工程p.aeruginosaph2分别制成od600值为3的菌液;
(2)e.colihy1和p.aeruginosaph2按照1:1的比例制成人工混菌体系;
(3)将制备好的人工混菌体系按2%的接种率接种到含有100mg/l菲和2%(w/v)石油的100mlmsm无机盐培养基(菲+石油培养基)摇瓶中;
(4)在接种后12小时加入终浓度为0.1mm的iptg,于35℃,250rpm恒温摇床中培养;
(7)培养9天后,完成降解,处理培养基样品,测定多环芳烃降解率和粗蛋白浓度。
其中,在降解率测定之前,培养基样品的处理方法如下所述:利用正己烷萃取培养基中底物,在萃取前,在每个摇瓶中加入芘作为内标,每瓶萃取3次,萃取液取至烧杯中,烧杯放在通风橱中等待正己烷挥发完全。待正己烷完全挥发,用色谱纯二氯甲烷稀释至5000ppm,无水na2so4干燥,并通过0.22μm有机系膜过滤,之后装入进样瓶中。使用气相色谱测定人工混菌对多环芳烃菲的降解率。
测定结果表明,在以菲和石油为底物的降解实验中,e.colihy1和p.aeruginosaph2的接种比例是1:1时,在接种后12小时添加诱导剂,经过9天的诱导培养,人工混菌体系对菲的降解率达到了79.90%,对多环芳烃菲具有显著的降解效果。
实施例4一种用于多环芳烃降解的人工混菌体系在正十六烷存在环境下对多环芳烃菲的降解
(1)平板上挑取表达较高多环芳烃羟基化双加氧酶活性的工程菌株大肠杆菌escherichiacolihy1(e.colihy1)和表达较高的多环芳烃环裂解双加氧酶活性的工程菌株铜绿假单胞菌pseudomonasaeruginosaph2(p.aeruginosaph2)的单菌落,分别接种至3mllb液体培养基中,将工程e.colihy1菌液置于37℃恒温摇床,工程p.aeruginosaph2菌液置于30℃恒温摇床,设置摇床转速为220rpm,过夜培养以活化菌体。在5000rpm条件下离心10min收集菌体,弃掉上清,用无菌msm无机盐培养基洗涤菌体2次后,用无菌msm培养基稀释菌体,将工程e.colihy1和工程p.aeruginosaph2分别制成od600值为3的菌液;
(2)e.colihy1和p.aeruginosaph2按照1:1的比例制成人工混菌体系;
(3)将制备好的人工混菌体系按2%的接种率接种到含有100mg/l菲和2%(v/v)正十六烷的100mlmsm无机盐培养基(菲+正十六烷培养基)摇瓶中;
(4)在接种后12小时加入终浓度为0.1mm的iptg,于35℃,250rpm恒温摇床中培养;
(5)培养9天后,完成降解,处理培养基样品,测定多环芳烃降解率和粗蛋白浓度。
其中,在降解率测定之前,培养基样品的处理方法如下所述:利用正己烷萃取培养基中底物,在萃取前,在每个摇瓶中加入芘作为内标,每瓶萃取3次,萃取液取至烧杯中,烧杯放在通风橱中等待正己烷挥发完全。待正己烷完全挥发,用色谱纯二氯甲烷稀释至5000ppm,无水na2so4干燥,并通过0.22μm有机系膜过滤,之后装入进样瓶中。使用气相色谱测定人工混菌对多环芳烃菲的降解率。
测定结果表明,在以菲和正十六烷为底物的降解实验中,e.colihy1和p.aeruginosaph2的接种比例是1:1时,在接种后12小时添加诱导剂,经过9天的诱导培养,人工混菌体系对菲的降解率达到了87.92%。对多环芳烃菲具有极其显著的降解效果。
上述四组实施例应用试验结果表明,将表达较高多环芳烃羟基化双加氧酶活性的工程菌株大肠杆e.colihy1和表达较高的多环芳烃环裂解双加氧酶活性的工程菌株铜绿假单胞菌p.aeruginosaph2按照1-4:1的比例组成人工混菌体系,诱导表达6-9天后,不论是在以菲为单一碳源和能源的培养基中,还是在以菲+石油或菲+正十六烷的混合碳源培养基中,人工混菌体系对多环芳烃菲都有良好的降解效果,对菲的降解率最高可达87.92%,与现有技术中野生单菌及野生混菌体系对多环芳烃的降解效果相比,结果表明本发明中提供的人工混菌体系具有较高的多环芳烃降解潜力。
以上内容是结合具体的/优选的实施方式对本发明所作的进一步详细说明,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!