重组菌株及其应用的制作方法
本发明涉及生物工程领域,具体地,本发明涉及重组菌株及其应用,更具体地,本发明涉及重组菌株、构建重组菌株的方法以及获得莽草酸的方法。
背景技术:
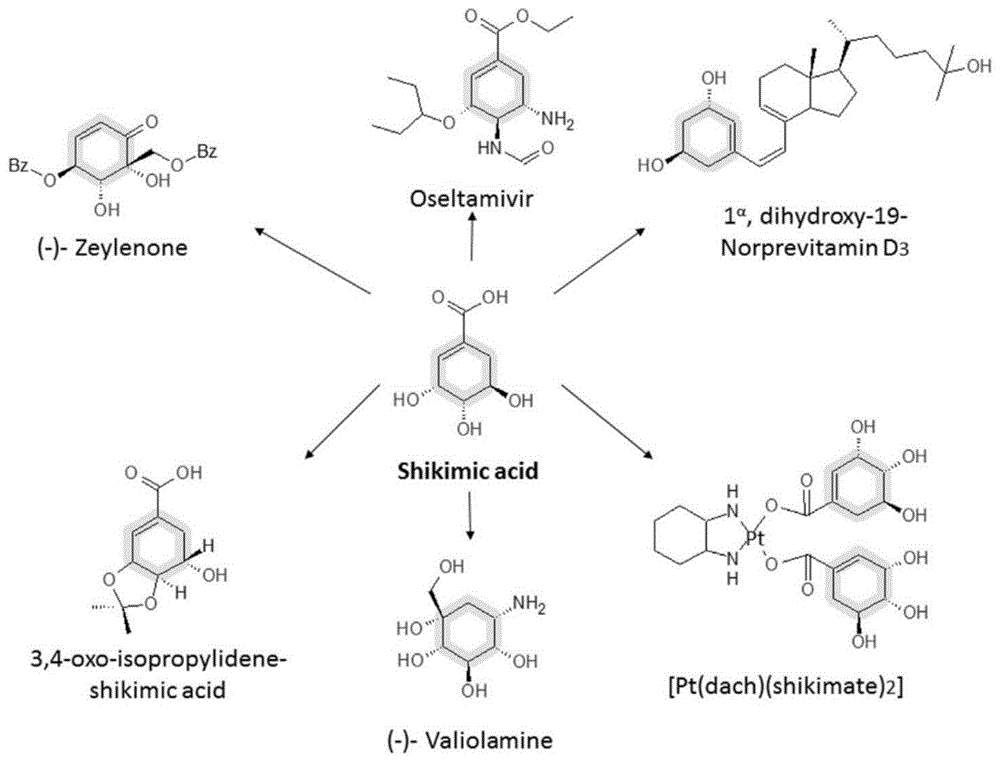
:莽草酸(3,4,5-3羟基-1-环己烯-1-羧酸),英文名称:shikimicacid(sa),是合成的抗病毒药物奥司他韦(可威)的关键中间体。莽草酸为白色针状结晶,易溶于水,难溶于石油醚等一些有机溶剂,气味辛酸,熔点为185-187℃。莽草酸是生物体内芳香族氨基酸生物合成途径中的关键中间体,也是合成吲哚衍生物、生物碱、手性药物(如抗病毒药)的重要前体,具有广泛的药用价值。莽草酸作为中间体化合物的应用可参见图1。在2005年世界禽流感大规模爆发时,以及h7n9型禽流感爆发期间,达菲对这些高致病性流感病毒均表现出了良好的治疗效果,被作为特效药身价倍增,莽草酸作为合成磷酸奥司他韦的前体,也因此备受关注。莽草酸广泛存在于多种植物中,在木兰科植物八角茴香中含量较高,可达成熟干重的10%。野生八角中莽草酸含量较高,是很好的植物提取来源,所以现多采用可食用的八角进行工业提取。植物提取生产工艺复杂,得率较低,原料易受季节气候等因素限制,产量及价格波动较大,难以满足大规模生产需求。莽草酸及其类似物也可通过化学方法合成,奎宁酸转化法则以奎宁酸衍生物和2,2-二甲基丙烷作为原初物质进行合成,其总收率最高可达62%。化学法虽然收率和纯度较高,但受原料来源限制,生产成本过高和化学废物难处理等因素的制约,并未得到广泛应用,因此,利用微生物来生产莽草酸具有极广阔的应用前景。莽草酸途径是存在于植物、真菌和微生物中的一条重要的代谢途径。因此通过基因技术改造代谢途径获得理想的莽草酸工程菌株目前成为研究的新热点。从葡萄糖到莽草酸,主要经过糖酵解途径和戊糖磷酸途径,合成莽草酸有五个重要的酶,分别是-3-脱氧-a-阿拉伯庚糖酸-7-磷酸合成酶(dahp合成酶)、3-脱氢奎尼酸合成酶,3-脱水奎尼酸合成酶和5-脱氢莽草酸脱氢酶,分别由arof,arob,arod,aroe编码,影响莽草酸的合成,而影响积累的关键酶是莽草酸激酶同工酶和5-烯醇式丙酮酸莽草酸-3-磷酸合成酶,简称epsp合成酶,由arok,arol,aroa基因进行编码,莽草酸合成途径参考图2。国内外关于莽草酸的菌种构建报道较多,涉及大肠杆菌、枯草芽孢杆菌、地衣芽孢杆菌和谷氨酸棒杆菌等多个菌种,基因改造策略的重点都是围绕增加前体物供应、减少莽草酸转化消耗、加快胞外的糖运输和转化等方面开展,具体涉及ptsghi、arof、arog、arob、aroe、tkta、ppsa、glf、glk等基因的敲除和过表达操作,但所构建的重组菌种均产量不足40g/l,难以实现大规模生产应用。2003年密歇根大学及罗氏研发人员在biotechnol.prog.杂志上发表了改造大肠杆菌生物合成莽草酸的文章。文章中所用的宿主菌为大肠杆菌rb791(escherichiacolirb791,atcc保藏中心编号53622)。其工作主要是对消耗pep的pts糖运输途径进行了缺失突变,增加莽草酸合成前体物pep的供应。改造菌株利用葡萄糖丰富的培养基(配合使用酵母抽提物)进行流加分批发酵,40小时周期可以最高实现84g/l的莽草酸积累。该方法虽然可以得到较高产量,但发酵培养基成本昂贵,限制了其大规模应用的可行性。rodriguez等2013年通过对大肠杆菌jm101宿主的pts糖运输途径、arokl编码的莽草酸激酶进行缺失,在质粒中过表达arob、tkta、arogfbr、aroe、arod、zwf等相关基因,在1l的发酵罐中获得了42g/l的莽草酸。2014年,陈等也对大肠杆菌宿主进行了改造,缺失了arokl编码的莽草酸消耗途径、ptsg编码的糖运输途径、acka-pta编码的副产物-乙酸积累途径,同时增加arogfbr、ppsa、tkta基因的表达,在7l的分批补料发酵罐培养实验中获得了14.6g/l的莽草酸积累。国内上海有机所的杨晟等也构建了过表达一系列相关基因arof、aroe、arob、ppsa、tkta的质粒psufebpt,在w3110中表达,低糖补料发酵工艺发酵128h后莽草酸产量为39.3g/l。浙江大学陶海明在50l发酵罐上对发酵配方和工艺进行了优化,最终莽草酸单位提高到42g/l。诸多学者在大肠杆菌中构建莽草酸的表达途径,部分菌株的表达需要iptg和变温诱导,增加了大规模生产的成本与难度,且都未能够突破50g/l的瓶颈,也并未进行100l以上规模的发酵实验,仅停留在实验室阶段,离工业化应用尚有较大差距。技术实现要素:而本发明旨在至少在一定程度上解决相关技术中的技术问题之一。本申请的发明人针对现有的微生物法合成莽草酸的生产过程中需添加抗生素和诱导剂,并且产量不够理想、副产物过多不利于工业生产的问题,提供了一种改进的重组莽草酸生产菌株及其制备方法。该改进的重组莽草酸生产菌株发酵后所得的莽草酸产量高,生产莽草酸时无需抗生素及诱导剂的添加,降低了生产成本,简化了生产工艺。在本发明的第一方面,本发明提出了一种重组菌株。根据本发明的实施例,所述重组菌株arok、arol与磷酸烯醇式丙酮酸-糖磷酸转移酶系统操纵子(ptshicrr)基因下调以及arob、arod、aroe、arof、tkta、ppsa基因上调。其中,ptshicrr包括ptsh基因,ptsi基因以及crr基因。根据本发明实施例的重组菌株在适宜发酵的条件下培养,50l罐的发酵体系莽草酸产量可达到90.0g/l,500l罐的发酵体系莽草酸产量可达到84.6g/l,8000l罐的发酵规模莽草酸产量可达到73.4g/l。因此,根据本发明实施例的重组菌株是一种高产莽草酸的工业重组菌株。根据本发明的实施例,上述重组菌株还可以进一步包括如下附加技术特征至少之一:根据本发明的实施例,所述arok、arol与ptshicrr基因沉默。发明人发现,采用基因沉默的方式使得arok、arol与ptshicrr基因下调,其对下游代谢的阻断效果更佳,莽草酸产量提高更加显著。需要说明的是,本申请所述的“arok、arol与ptshicrr基因沉默”既可以指arok、arol或ptshicrr基因功能区的沉默,也可指arok、arol或ptshicrr基因启动子的沉默,只要是arok、arol或ptshicrr基因不表达或表达量极低,均在本申请“arok、arol与ptshicrr基因沉默”的限定范围内。根据本发明的实施例,所述arob、arod、aroe、arof、tkta、ppsa基因过表达。根据本发明的实施例,所述重组菌株为大肠杆菌、谷氨酸棒杆菌、地衣芽孢杆菌或枯草芽孢杆菌。在本发明的第二方面,本发明提出了一种构建前面所述的重组菌株的方法。根据本发明的实施例,使待改造菌株的arok、arol与ptshicrr基因下调以及arob、arod、aroe、arof、tkta、ppsa基因上调。根据本发明实施例的方法构建的重组菌株是高产莽草酸的菌株,可突破现有技术的瓶颈,实现莽草酸产量的显著提高和莽草酸生产的工业化。根据本发明的实施例,上述方法还可以进一步包括如下附加技术特征至少之一:根据本发明的实施例,使待改造菌株的arok、arol与ptshicrr基因的至少之一的下调是通过基因沉默的方式实现的。根据本发明的实施例,所述基因沉默是通过shrna、反义核酸、核酶、显性负突变、crispr和锌指核酸酶至少之一实现的。优选地,所述基因沉默是通过crispr实现的。通过crispr实现arok、arol或ptshicrr基因的沉默,脱靶效率低,沉默效率高。根据本发明的实施例,所述arob、arod、aroe、arof、tkta、ppsa基因上调是通过如下的方式实现的:将表达载体导入待改造菌株细胞,所述表达载体携带arob、arod、aroe、arof、tkta、ppsa基因的至少之一;在适宜基因表达的条件下,对所述待改造菌株细胞进行培养。根据本发明实施例的上述基因上调方式,表达载体中所携带的arob、arod、aroe、arof、tkta、ppsa基因可整合入工程菌的基因组,随着工程菌基因组的复制而复制,表达载体也可在工程菌细胞内自由复制,这两种方式均可有效实现arob、arod、aroe、arof、tkta或ppsa基因在待改造菌株细胞内的过表达。根据本发明的实施例,所述表达载体为低拷贝表达载体。进而可有效较少菌体负担,提高菌体导入表达载体后的成活率和细胞状态,提高菌株的发酵产量。根据本发明的实施例,所述表达载体为pet-28a。根据本发明的实施例,所述pet-28a不携带lac基因。进而arob、arod、aroe、arof、tkta或ppsa基因在菌体内的表达不受诱导剂的限制,表达载体导入菌体后,即可实现上述基因的表达。根据本发明的实施例,所述表达载体不携带诱导型启动子。根据本发明的实施例,所述表达载体携带强启动子,所述强启动子与所述arob、arod、aroe、arof、tkta、ppsa基因的至少之一可操作地连接。进而arob、arod、aroe、arof、tkta、ppsa基因的表达进一步提高,菌株莽草酸产量也进一步显著提高。根据本发明的实施例,所述强启动子为t7。在本发明的第三方面,本发明提出了一种获得莽草酸的方法。根据本发明的实施例,将前面所述重组菌株进行发酵培养处理。根据本发明实施例的获得莽草酸的方法,莽草酸产量高。根据本发明的实施例,上述方法还可以进一步包括如下附加技术特征至少之一:根据本发明的实施例,所述发酵培养是在压力为200rpm,通气量为1vvm(vvm表示每分钟通入发酵液的高压空气与发酵液的体积比,1vvm是指1min通入发酵液等体积的高压空气),ph为7.0的条件下进行的。发酵过程中,一开始发酵液的ph先上升,发明人使用磷酸控7.0,发酵后期ph下降,发明人使用碱液(如氨水、氢氧化钠、氢氧化钾,或其混合液)控制在7.0。根据本发明的实施例,在发酵开始后的10-20h内,所述发酵培养是在温度为37℃,溶氧大于50%的条件下进行的;发酵10-20h以后,所述发酵培养是在温度为25-35℃,溶氧为20-50%的条件下进行的。发明人发现,在发酵10-20h以后,将发酵温度降低到25-35℃,可有效减少副产物未知色素的产生,进一步提高目标产物莽草酸的产量。根据本发明的实施例,发酵过程中,一开始发酵液的ph先上升,使用磷酸控7.0,发酵后期ph下降,使用氨水和其它碱液如氢氧化钠、氢氧化钾的混合液控制ph在7.0,相比于单独采用氨水调节ph,可有效减少副产物未知色素的产生,进一步提高目标产物莽草酸的产量。根据本发明的实施例,在发酵开始后的30h内,以5g/l/h的流速补充碳源;发酵30h以后,以3g/l/h的流速补充碳源;发酵5-15h以后,以10-30g/l/h的流速补充氮源。进而可维持发酵液中的碳源或氮源在适宜的范围内,进一步提高目标产物莽草酸的产量。根据本发明的具体实施例,所述碳源是以葡萄糖、甘油的至少之一提供的。优选地,所述碳源为葡萄糖,进而进一步提高莽草酸的发酵产量。根据本发明的具体实施例,所述氮源是以酵母浸粉、酵母蛋白胨、大豆蛋白胨、酵母抽提物的至少之一提供的。根据本发明的具体实施例,流加碳源的质量分数为50~60%。根据本发明的具体实施例,流加氮源的质量分数为5~15%。根据本发明的实施例,所述发酵培养是在发酵培养基中进行的,所述发酵培养基包括碳源10.0g/l,氮源30g/l,磷酸氢二钠1.0g/l,柠檬酸2.0g/l,硫酸镁0.4g/l,氢氧化钠3.0g/l,硫酸铵2.0g/l,磷酸二氢钾4.0g/l,微量元素溶液1ml/l,其中,所述微量元素溶液包括:五水硫酸铜0.3g/l,一水硫酸锰1.7g/l,七水硫酸锌0.3g/l,七水硫酸亚铁2.8g/l,二水钼酸钠2.0g/l,硼酸1.0g/l,六水氯化钴2.45g/l,无水氯化钙1.13g/l,浓硫酸27ml/l。根据本发明的实施例,所述重组菌株预先进行扩大培养。进而可有效提高发酵初始菌株的数量和状态,进一步有效提高重组菌株莽草酸的发酵产量。根据本发明的具体实施例,所述扩大培养是通过如下方式进行的:将重组菌株菌种以0.5-2%的体积比接种量接到一级种子培养基中,并在30-40℃,250rpm的条件下进行一级扩大培养5-10h;将一级扩大培养后的菌种以0.5-2%的体积比接种到二级摇瓶种子培养基中,并在30-40℃,250rpm的条件下进行二级扩大培养5-10h。根据本发明的具体实施例,将二级扩大培养后的菌种以5-15%的体积比接种到发酵罐进行所述发酵培养处理。综上,根据本发明实施例的技术方案的优势可总结于以下几点:1)采用cas9基因编辑技术构建莽草酸大肠杆菌宿主菌,阻断下游代谢;2)减少副产物产生,发酵生产中无需添加抗生素;3)游离质粒过表达关键基因,并敲除其lac基因,避免诱导剂的使用;4)50l罐上发酵工艺控制,产量达到90.0g/l,500l罐上发酵达到84.6g/l,8000l发酵规模达到73.4g/l;生产规模和产量均为报道最高产量;5)氢氧化钠与氨水混合调节ph和降温培养,减少发酵液中色素的产生,更利于下游纯化;6)发酵培养过程未添加任何氨基酸及其他添加剂,发酵配方只由无机盐和有机碳、氮组成,成本低廉、优势明显。附图说明图1是莽草酸作为中间体化合物的应用示意图;图2是莽草酸合成途径示意图;图3是根据本发明实施例的质粒ptargetf的质粒图谱;图4是根据本发明实施例的pet-tkta-ppsa质粒图谱;图5是根据本发明实施例的pet-arof-aroe质粒图谱;图6是根据本发明实施例的pet-arob-arod质粒图谱;图7是根据本发明实施例的pet-tkta-ppsa-arobdfe质粒图谱;图8是根据本发明实施例的载体psa-14质粒图谱;图9是根据本发明实施例的psa-04中laci基因敲除后的凝胶电泳图。具体实施方式下面详细描述本发明的实施例,所述实施例的示例在附图中示出。下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。详细技术方案本发明技术方案:一种重组大肠杆菌菌株,其自身不包含下述基因:arok(或启动子)、arol与磷酸烯醇式丙酮酸-糖磷酸转移酶系统操纵子(ptshicrr);质粒表达arob、arod、aroe、arof、tkta、ppsa,所述基因arob、arod、aroe、arof、tkta、ppsa转录表达由大肠杆菌内具有活性的启动子驱动,由大肠杆菌内具有活性的终止子终止。重组大肠杆菌菌株出发菌株为bl21(de3),利用crispr-cas9技术对arok、arol和ptshicrr进行敲除,arob、arod、aroe、arof、tkta、ppsa由bl21(de3)染色体pcr得到,并使用t7启动子进行转录表达,t7终止子终止转录。所述发酵罐培养包括下述步骤:取液氮保存的甘油菌,以(0.5-2)%(v/v)的接种量接到一级种子培养基中,(30-40)℃,250rpm,培养(5-10)h,按(0.5-2)%(v/v)接种到二级摇瓶种子培养基中,(30-40)℃,250rpm,培养(5-10)h后,以(5-15)%(v/v)接种量接到发酵罐进行发酵培养。发酵培养条件:(1)初始条件,37℃,200rpm,通气量1vvm,ph7.0,溶氧大于50%,压力45-65kpa。(2)补糖策略:0-30h5g/l/h,31-85h3g/l/h。(3)发酵(5-15)h开始流加氮源,流加速率(10-30)g/l/h;(4)发酵(10-20)h降温至(25-35)℃,目的是为了降低色素的形成,同时将溶氧降到(20-50)%之间。(5)发酵开始后ph先上升,先用磷酸控7.0,ph下降后用碱液(氨水、氢氧化钠、氢氧化钾,或其混合液)控制在7.0。种子培养基同发酵罐培养基:碳源(可以为葡萄糖、甘油其中一种,或其混合液)10.0g/l,有机氮源(可以为酵母浸粉、酵母蛋白胨、大豆蛋白胨、酵母抽提物任意一种,或其任意两种、三种或四种混合液)30g/l,磷酸氢二钠1.0g/l,柠檬酸2.0g/l,硫酸镁0.4g/l,氢氧化钠3.0g/l,硫酸铵2.0g/l,磷酸二氢钾4.0g/l,微量元素溶液1ml/l。其中,微量元素溶液:五水硫酸铜0.3g/l,一水硫酸锰1.7g/l,七水硫酸锌0.3g/l,七水硫酸亚铁2.8g/l,二水钼酸钠2.0g/l,硼酸1.0g/l,六水氯化钴2.45g/l,无水氯化钙1.13g/l,浓硫酸27ml/l。补料碳源(50%,w/w):葡萄糖、甘油其中一种或其混合液。补料氮源(15%,w/w):酵母浸粉、酵母蛋白胨、大豆蛋白胨、酵母抽提物任意一种,或其任意两种、三种或四种混合液。下面将进一步详细描述本发明的实施例,所述实施例的示例在附图中示出。下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。实施例1-6提供了一种高产莽草酸的大肠杆菌工程菌株,所述工程菌是将大肠杆菌(escherichiacolibl21(de3))的莽草酸激酶编码基因arok和arol,葡萄糖转运基因簇ptshicrr敲除,构建bl21δarolδarokδptshicrr菌株。再将大肠杆菌bl21(de3)的3-脱氢奎宁酸(3-dehydroquinicacid,dhq)合酶arob、dhq脱氢酶arod、莽草酸脱氢酶aroe、dahp合酶arof、转酮醇酶tkta和pep合成酶ppsa连接至表达载体pet-28a得到重组质粒psa-14,再将重组质粒转化esa菌株得到高产莽草酸的大肠杆菌工程菌株esa-psa-14。其中,本申请中的arok、arol与ptshicrr基因以及arob、arod、aroe、arof、tkta、ppsa基因的序列可参考下面所示,具有与以下序列同功能或具有同源或同一性的核酸序列均在本申请的基因范围内。arok基因的序列如下所示(3518543..3519064escherichiacolik-12substr.mg1655)atggcagagaaacgcaatatctttctggttgggcctatgggtgccggaaaaagcactattgggcgccagttagctcaacaactcaatatggaattttacgattccgatcaagagattgagaaacgaaccggagctgatgtgggctgggttttcgatttagaaggcgaagaaggcttccgcgatcgcgaagaaaaggtcatcaatgagttgaccgagaaacagggtattgtgctggctactggcggcggctctgtgaaatcccgtgaaacgcgtaaccgtctttccgctcgtggcgttgtcgtttatcttgaaacgaccatcgaaaagcaacttgcacgcacgcagcgtgataaaaaacgcccgttgctgcacgttgaaacaccgccgcgtgaagttctggaagcgttggccaatgaacgcaatccgctgtatgaagagattgccgacgtgaccattcgtactgatgatcaaagcgctaaagtggttgcaaaccagattattcacatgctggaaagcaactaaarol基因的序列如下所示(406405..406929escherichiacolik-12substr.mg1655):atgacacaacctctttttctgatcgggcctcggggctgtggtaaaacaacggtcggaatggcccttgccgattcgcttaaccgtcggtttgtcgataccgatcagtggttgcaatcacagctcaatatgacggtcgcggagatcgtcgaaagggaagagtgggcgggatttcgcgccagagaaacggcggcgctggaagcggtaactgcgccatccaccgttatcgctacaggcggcggcattattctgacggaatttaatcgtcacttcatgcaaaataacgggatcgtggtttatttgtgtgcgccagtatcagtcctggttaaccgactgcaagctgcaccggaagaagatttacggccaaccttaacgggaaaaccgctgagcgaagaagttcaggaagtgctggaagaacgcgatgcgctatatcgcgaagttgcgcatattatcatcgacgcaacaaacgaacccagccaggtgatttctgaaattcgcagcgccctggcacagacgatcaattgttgacrr基因的序列如下所示(2535834..2536343escherichiacolik-12substr.mg1655):atgggtttgttcgataaactgaaatctctggtttccgacgacaagaaggataccggaactattgagatcattgctccgctctctggcgagatcgtcaatatcgaagacgtgccggatgtcgtttttgcggaaaaaatcgttggtgatggtattgctatcaaaccaacgggtaacaaaatggtcgcgccagtagacggcaccattggtaaaatctttgaaaccaaccacgcattctctatcgaatctgatagcggcgttgaactgttcgtccacttcggtatcgacaccgttgaactgaaaggcgaaggcttcaagcgtattgctgaagaaggtcagcgcgtgaaagttggcgatactgtcattgaatttgatctgccgctgctggaagagaaagccaagtctaccctgactccggttgttatctccaacatggacgaaatcaaagaactgatcaaactgtccggtagcgtaaccgtgggtgaaaccccggttatccgcatcaagaagtaaptsh基因的序列如下所示(2533764..2534021escherichiacolik-12substr.mg1655)atgttccagcaagaagttaccattaccgctccgaacggtctgcacacccgccctgctgcccagtttgtaaaagaagctaagggcttcacttctgaaattactgtgacttccaacggcaaaagcgccagcgcgaaaagcctgtttaaactgcagactctgggcctgactcaaggtaccgttgtgactatctccgcagaaggcgaagacgagcagaaagcggttgaacatctggttaaactgatggcggaactcgagtaaptsi基因的序列如下所示(2534066..2535793escherichiacolik-12substr.mg1655)atgatttcaggcattttagcatccccgggtatcgctttcggtaaagctctgcttctgaaagaagacgaaattgtcattgaccggaaaaaaatttctgccgaccaggttgatcaggaagttgaacgttttctgagcggtcgtgccaaggcatcagcccagctggaaacgatcaaaacgaaagctggtgaaacgttcggtgaagaaaaagaagccatctttgaagggcatattatgctgctcgaagatgaggagctggagcaggaaatcatagccctgattaaagataagcacatgacagctgacgcagctgctcatgaagttatcgaaggtcaggcttctgccctggaagagctggatgatgaatacctgaaagaacgtgcggctgacgtacgtgatatcggtaagcgcctgctgcgcaacatcctgggcctgaagattatcgacctgagcgccattcaggatgaagtcattctggttgccgctgacctgacgccgtccgaaaccgcacagctgaacctgaagaaggtgctgggtttcatcaccgacgcgggtggccgtacttcccacacctctatcatggcgcgttctctggaactacctgctatcgtgggtaccggtagcgtcacctctcaggtgaaaaatgacgactatctgattctggatgccgtaaataatcaggtttacgtcaatccaaccaacgaagttattgataaaatgcgcgctgttcaggagcaagtggcttctgaaaaagcagagcttgctaaactgaaagatctgccagctattacgctggacggtcaccaggtagaagtatgcgctaacattggtacggttcgtgacgttgaaggtgcagagcgtaacggcgctgaaggcgttggtctgtatcgtactgagttcctgttcatggaccgcgacgcactgcccactgaagaagaacagtttgctgcttacaaagcagtggctgaagcgtgtggctcgcaagcggttatcgttcgtaccatggacatcggcggcgacaaagagctgccatacatgaacttcccgaaagaagagaacccgttcctcggctggcgcgctatccgtatcgcgatggatcgtagagagatcctgcgcgatcagctccgcgctatcctgcgtgcctcggctttcggtaaattgcgcattatgttcccgatgatcatctctgttgaagaagtgcgtgcactgcgcaaagagatcgaaatctacaaacaggaactgcgcgacgaaggtaaagcgtttgacgagtcaattgaaatcggcgtaatggtggaaacaccggctgccgcaacaattgcacgtcatttagccaaagaagttgatttctttagtatcggcaccaatgatttaacgcagtacactctggcagttgaccgtggtaatgatatgatttcacacctttaccagccaatgtcaccgtccgtgctgaacttgatcaagcaagttattgatgcttctcatgctgaaggcaaatggactggcatgtgtggtgagcttgctggcgatgaacgtgctacacttctgttgctggggatgggtctggacgaattctctatgagcgccatttctatcccgcgcattaagaagattatccgtaacacgaacttcgaagatgcgaaggtgttagcagagcaggctcttgctcaaccgacaacggacgagttaatgacgctggttaacaagttcattgaagaaaaaacaatctgctaaarob基因的序列如下所示(3517398..3518486escherichiacolik-12substr.mg1655)atggagaggattgtcgttactctcggggaacgtagttacccaattaccatcgcatctggtttgtttaatgaaccagcttcattcttaccgctgaaatcgggcgagcaggtcatgttggtcaccaacgaaaccctggctcctctgtatctcgataaggtccgcggcgtacttgaacaggcgggtgttaacgtcgatagcgttatcctccctgacggcgagcagtataaaagcctggctgtactcgataccgtctttacggcgttgttacaaaaaccgcatggtcgcgatactacgctggtggcgcttggcggcggcgtagtgggcgatctgaccggcttcgcggcggcgagttatcagcgcggtgtccgtttcattcaagtcccgacgacgttactgtcgcaggtcgattcctccgttggcggcaaaactgcggtcaaccatcccctcggtaaaaacatgattggcgcgttctaccaacctgcttcagtggtggtggatctcgactgtctgaaaacgcttcccccgcgtgagttagcgtcggggctggcagaagtcatcaaatacggcattattcttgacggtgcgttttttaactggctggaagagaatctggatgcgttgttgcgtctggacggtccggcaatggcgtactgtattcgccgttgttgtgaactgaaggcagaagttgtcgccgccgacgagcgcgaaaccgggttacgtgctttactgaatctgggacacacctttggtcatgccattgaagctgaaatggggtatggcaattggttacatggtgaagcggtcgctgcgggtatggtgatggcggcgcggacgtcggaacgtctcgggcagtttagttctgccgaaacgcagcgtattataaccctgctcaagcgggctgggttaccggtcaatgggccgcgcgaaatgtccgcgcaggcgtatttaccgcatatgctgcgtgacaagaaagtccttgcgggagagatgcgcttaattcttccgttggcaattggtaagagtgaagttcgcagcggcgtttcgcacgagcttgttcttaacgccattgccgattgtcaatcagcgtaaarod基因的序列如下所示(1774686..1775444escherichiacolik-12substr.mg1655)atgaaaaccgtaactgtaaaagatctcgtcattggtacgggcgcacctaaaatcatcgtctcgctgatggcgaaagatatcgccagcgtgaaatccgaagctctcgcctatcgtgaagcggactttgatattctggaatggcgtgtggaccactatgccgacctctccaatgtggagtctgtcatggcggcagcaaaaattctccgtgagaccatgccagaaaaaccgctgctgtttaccttccgcagtgccaaagaaggcggcgagcaggcgatttccaccgaggcttatattgcactcaatcgtgcagccatcgacagcggcctggttgatatgatcgatctggagttatttaccggtgatgatcaggttaaagaaaccgtcgcctacgcccacgcgcatgatgtgaaagtagtcatgtccaaccatgacttccataaaacgccggaagccgaagaaatcattgcccgtctgcgcaaaatgcaatccttcgacgccgatattcctaagattgcgctgatgccgcaaagtaccagcgatgtgctgacgttgcttgccgcgaccctggagatgcaggagcagtatgccgatcgtccaattatcacgatgtcgatggcaaaaactggcgtaatttctcgtctggctggtgaagtatttggctcggcggcaacttttggtgcggtaaaaaaagcgtctgcgccagggcaaatctcggtaaatgatttgcgcacggtattaactattttacaccaggcataaarof基因的序列如下所示(2740080..2741150escherichiacolik-12substr.mg1655)atgcaaaaagacgcgctgaataacgtacatattaccgacgaacaggttttaatgactccggaacaactgaaggccgcttttccattgagcctgcaacaagaagcccagattgctgactcgcgtaaaagcatttcagatattatcgccgggcgcgatcctcgtctgctggtagtatgtggtccttgttccattcatgatccggaaactgctctggaatatgctcgtcgatttaaagcccttgccgcagaggtcagcgatagcctctatctggtaatgcgcgtctattttgaaaaaccccgtaccactgtcggctggaaagggttaattaacgatccccatatggatggctcttttgatgtagaagccgggctgcagatcgcgcgtaaattgctgcttgagctggtgaatatgggactgccactggcgacggaagcgttagatccgaatagcccgcaatacctgggcgatctgtttagctggtcagcaattggtgctcgtacaacggaatcgcaaactcaccgtgaaatggcctccgggctttccatgccggttggttttaaaaacggcaccgacggcagtctggcaacagcaattaacgctatgcgcgccgccgcccagccgcaccgttttgttggcattaaccaggcagggcaggttgcgttgctacaaactcaggggaatccggacggccatgtgatcctgcgcggtggtaaagcgccgaactatagccctgcggatgttgcgcaatgtgaaaaagagatggaacaggcgggactgcgcccgtctctgatggtagattgcagccacggtaattccaataaagattatcgccgtcagcctgcggtggcagaatccgtggttgctcaaatcaaagatggcaatcgctcaattattggtctgatgatcgaaagtaatatccacgagggcaatcagtcttccgagcaaccgcgcagtgaaatgaaatacggtgtatccgtaaccgatgcctgcattagctgggaaatgaccgatgccttgctgcgtgaaattcatcaggatctgaacgggcagctgacggctcgcgtggcttaaaroe基因的序列如下所示(3430020..3430838escherichiacolik-12substr.mg1655)atggaaacctatgctgtttttggtaatccgatagcccacagcaaatcgccattcattcatcagcaatttgctcagcaactgaatattgaacatccctatgggcgcgtgttggcacccatcaatgatttcatcaacacactgaacgctttctttagtgctggtggtaaaggtgcgaatgtgacggtgccttttaaagaagaggcttttgccagagcggatgagcttactgaacgggcagcgttggctggtgctgttaataccctcatgcggttagaagatggacgcctgctgggtgacaataccgatggtgtaggcttgttaagcgatctggaacgtctgtcttttatccgccctggtttacgtattctgcttatcggcgctggtggagcatctcgcggcgtactactgccactcctttccctggactgtgcggtgacaataactaatcggacggtatcccgcgcggaagagttggctaaattgtttgcgcacactggcagtattcaggcgttgagtatggacgaactggaaggtcatgagtttgatctcattattaatgcaacatccagtggcatcagtggtgatattccggcgatcccgtcatcgctcattcatccaggcatttattgctatgacatgttctatcagaaaggaaaaactccttttctggcatggtgtgagcagcgaggctcaaagcgtaatgctgatggtttaggaatgctggtggcacaggcggctcatgcctttcttctctggcacggtgttctgcctgacgtagaaccagttataaagcaattgcaggaggaattgtccgcgtgatkta基因的序列如下所示(3079644..3081635escherichiacolik-12substr.mg1655)atgtcctcacgtaaagagcttgccaatgctattcgtgcgctgagcatggacgcagtacagaaagccaaatccggtcacccgggtgcccctatgggtatggctgacattgccgaagtcctgtggcgtgatttcctgaaacacaacccgcagaatccgtcctgggctgaccgtgaccgcttcgtgctgtccaacggccacggctccatgctgatctacagcctgctgcacctcaccggttacgatctgccgatggaagaactgaaaaacttccgtcagctgcactctaaaactccgggtcacccggaagtgggttacaccgctggtgtggaaaccaccaccggtccgctgggtcagggtattgccaacgcagtcggtatggcgattgcagaaaaaacgctggcggcgcagtttaaccgtccgggccacgacattgtcgaccactacacctacgccttcatgggcgacggctgcatgatggaaggcatctcccacgaagtttgctctctggcgggtacgctgaagctgggtaaactgattgcattctacgatgacaacggtatttctatcgatggtcacgttgaaggctggttcaccgacgacaccgcaatgcgtttcgaagcttacggctggcacgttattcgcgacatcgacggtcatgacgcggcatctatcaaacgcgcagtagaagaagcgcgcgcagtgactgacaaaccttccctgctgatgtgcaaaaccatcatcggtttcggttccccgaacaaagccggtacccacgactcccacggtgcgccgctgggcgacgctgaaattgccctgacccgcgaacaactgggctggaaatatgcgccgttcgaaatcccgtctgaaatctatgctcagtgggatgcgaaagaagcaggccaggcgaaagaatccgcatggaacgagaaattcgctgcttacgcgaaagcttatccgcaggaagccgctgaatttacccgccgtatgaaaggcgaaatgccgtctgacttcgacgctaaagcgaaagagttcatcgctaaactgcaggctaatccggcgaaaatcgccagccgtaaagcgtctcagaatgctatcgaagcgttcggtccgctgttgccggaattcctcggcggttctgctgacctggcgccgtctaacctgaccctgtggtctggttctaaagcaatcaacgaagatgctgcgggtaactacatccactacggtgttcgcgagttcggtatgaccgcgattgctaacggtatctccctgcacggtggcttcctgccgtacacctccaccttcctgatgttcgtggaatacgcacgtaacgccgtacgtatggctgcgctgatgaaacagcgtcaggtgatggtttacacccacgactccatcggtctgggcgaagacggcccgactcaccagccggttgagcaggtcgcttctctgcgcgtaaccccgaacatgtctacatggcgtccgtgtgaccaggttgaatccgcggtcgcgtggaaatacggtgttgagcgtcaggacggcccgaccgcactgatcctctcccgtcagaacctggcgcagcaggaacgaactgaagagcaactggcaaacatcgcgcgcggtggttatgtgctgaaagactgcgccggtcagccggaactgattttcatcgctaccggttcagaagttgaactggctgttgctgcctacgaaaaactgactgccgaaggcgtgaaagcgcgcgtggtgtccatgccgtctaccgacgcatttgacaagcaggatgctgcttaccgtgaatccgtactgccgaaagcggttactgcacgcgttgctgtagaagcgggtattgctgactactggtacaagtatgttggcctgaacggtgctatcgtcggtatgaccaccttcggtgaatctgctccggcagagctgctgtttgaagagttcggcttcactgttgataacgttgttgcgaaagcaaaagaactgctgtaappsa基因的序列如下所示(1784734..1787112escherichiacolik-12substr.mg1655)atgtccaacaatggctcgtcaccgctggtgctttggtataaccaactcggcatgaatgatgtagacagggttgggggcaaaaatgcctccctgggtgaaatgattactaatctttccggaatgggtgtttccgttccgaatggtttcgccacaaccgccgacgcgtttaaccagtttctggaccaaagcggcgtaaaccagcgcatttatgaactgctggataaaacggatattgacgatgttactcagcttgcgaaagcgggcgcgcaaatccgccagtggattatcgacactcccttccagcctgagctggaaaacgccatccgcgaagcctatgcacagctttccgccgatgacgaaaacgcctcttttgcggtgcgctcctccgccaccgcagaagatatgccggacgcttcttttgccggtcagcaggaaaccttcctcaacgttcagggttttgacgccgttctcgtggcagtgaaacatgtatttgcttctctgtttaacgatcgcgccatctcttatcgtgtgcaccagggttacgatcaccgtggtgtggcgctctccgccggtgttcaacggatggtgcgctctgacctcgcatcatctggcgtgatgttctccattgataccgaatccggctttgaccaggtggtgtttatcacttccgcatggggccttggtgagatggtcgtgcagggtgcggttaacccggatgagttttacgtgcataaaccgacactggcggcgaatcgcccggctatcgtgcgccgcaccatggggtcgaaaaaaatccgcatggtttacgcgccgacccaggagcacggcaagcaggttaaaatcgaagacgtaccgcaggaacagcgtgacatcttctcgctgaccaacgaagaagtgcaggaactggcaaaacaggccgtacaaattgagaaacactacggtcgcccgatggatattgagtgggcgaaagatggccacaccggtaaactgttcattgtgcaggcgcgtccggaaaccgtgcgctcacgcggtcaggtcatggagcgttatacgctgcattcacagggtaagattatcgccgaaggccgtgctatcggtcatcgcatcggtgcgggtccggtgaaagtcatccatgacatcagcgaaatgaaccgcatcgaacctggcgacgtgctggttactgacatgaccgacccggactgggaaccgatcatgaagaaagcatctgccatcgtcaccaaccgtggcggtcgtacctgtcacgcggcgatcatcgctcgtgaactgggcattccggcggtagtgggctgtggagatgcaacagaacggatgaaagacggtgagaacgtcactgtttcttgtgccgaaggtgataccggttacgtctatgcggagttgctggaatttagcgtgaaaagctccagcgtagaaacgatgccggatctgccgttgaaagtgatgatgaacgtcggtaacccggaccgtgctttcgacttcgcctgcctaccgaacgaaggcgtgggccttgcgcgtctggaatttatcatcaaccgtatgattggcgtccacccacgcgcactgcttgagtttgacgatcaggaaccgcagttgcaaaacgaaatccgcgagatgatgaaaggttttgattctccgcgtgaattttacgttggtcgtctgactgaagggatcgcgacgctgggtgccgcgttttatccgaagcgcgtcattgtccgtctctctgattttaaatcgaacgaatatgccaacctggtcggtggtgagcgttacgagccagatgaagagaacccgatgctcggcttccgtggcgcgggccgctatgtttccgacagcttccgcgactgtttcgcgctggagtgtgaagcagtgaaacgtgtgcgcaacgacatgggactgaccaacgttgagatcatgatcccgttcgtgcgtaccgtagatcaggcgaaagcggtggttgaagaactggcgcgtcaggggctgaaacgtggcgagaacgggctgaaaatcatcatgatgtgtgaaatcccgtccaacgccttgctggccgagcagttcctcgaatatttcgacggcttctcaattggctcaaacgatatgacgcagctggcgctcggtctggaccgtgactccggcgtggtgtctgaattgttcgatgagcgcaacgatgcggtgaaagcactgctgtcgatggctatccgtgccgcgaagaaacagggcaaatatgtcgggatttgcggtcagggtccgtccgaccacgaagactttgccgcatggttgatggaagaggggatcgatagcctgtctctgaacccggacaccgtggtgcaaacctggttaagcctggctgaactgaagaaataa实施例1大肠杆菌crispr-cas9系统的构建大肠杆菌crispr-cas9系统由两个基本质粒pcas-lac和ptargetf组成,两个质粒根据文献《multigeneeditingintheescherichiacoligenomeviathecrispr-cas9system》中的方法进行构建。质粒pcas-lac是大肠杆菌游离型质粒,含有l-阿拉伯糖诱导表达red重组酶元件、cas9蛋白的编码基因cas9、温敏型元件及诱导消除质粒ptargetf所使用的sgrna、卡那霉素抗性基因kanr等。含有pcas-lac衍生质粒系列均需在30℃环境中培养以保证质粒能够正常复制而不发生丢失。质粒ptargetf是大肠杆菌游离型质粒,含有壮观霉素抗性基因aada和用于转录sgrna的启动子pj23119,质粒图谱见图3。根据目标编辑位点的序列,设计引物扩增得到含有与目标位点匹配的20个碱基序列(n20)和与cas9蛋白结合的序列(蛋白酶结合部分为82个碱基序列,具体序列为gttttagagctagaaatagcaagttaaaataaggctagtccgttatcaacttgaaaaagtggcaccgagtcggtgctttttt),然后将序列克隆到ptargetf载体中获得敲除质粒;其次,将质粒pcas-lac转化到宿主细胞中,诱导λ-red重组系统表达,制备感受态细胞,然后将敲除质粒ptargetf和donordna转化到感受态细胞进行基因编辑和重组,涂布培养获得转化子测序验证基因组重组情况;最后,诱导菌株中pcas-lac质粒上的质粒修复系统工作进行剪切ptargetf敲除质粒,完成一轮基因改造。依次进行上述工作可以对宿主基因组的多个基因位点进行改造,实现基因的缺失或插入。(1)基础质粒pcas-lac转化大肠杆菌制备大肠杆菌宿主细胞(dh5a、bl21、jm109、rb791等)的感受态,将质粒pcas-lac转化到胞内获得含pcas-lac质粒的受体菌(dh5a/pcas-lac、bl21/pcas-lac菌等)。(2)受体菌电转感受态制备a、将含pcas-lac质粒的大肠杆菌接种到液体lb(含卡那霉素终浓度为50μg/ml)培养基中,30℃、250rpm/min培养至对数期生长期。b、以1%的接种量接种于装有100mllb(含卡那霉素终浓度为50μg/ml)培养基的500ml三角瓶中,30℃、200rpm/min条件培养至od600为0.2~0.3时,加入终浓度为10mmol/l的l-阿拉伯糖诱导剂,诱导pcas-lac上的λ-red重组酶充分表达,od600为0.5~0.7时停止培养(1~1.5h)。c、在超净台内将培养液转移到50ml无菌离心管中,在冰中放置10min。d、将离心管中的菌液4℃、4000r/min离心10min。e、弃上清,加入少量预冷的10%甘油温柔重悬菌体,继续添加10%甘油至离心管体积的三分之二处,4℃、4000r/min离心10min。重复一次操作。f、将菌体悬浮于1ml预冷的10%甘油中,按每管80μl感受态细胞分装于1.5ml离心管中,冰上放置备用。(3)targetf质粒和donordna的转化a、将待转化的dna加入感受态细胞中,温柔混合均匀,冰上放置30min;b、将混合物转入预冷的2mm电转杯中,放置冰上待电转;c、打开电转仪,将参数设定为2.5kv;d、从冰中取出电转杯,用纸巾吸去表面的水分,放入样品槽中电击。电击后立即加入常温lb培养基悬浮细胞,30℃复苏2h,涂布50μg/ml卡那霉素和50μg/ml壮观霉素lb平板,30℃培养过夜。e、挑取平板长出的克隆子,使用验证引物进行菌落pcr验证,获得正确得基因编辑菌株。(4)target质粒的消除a、将验证正确的基因编辑克隆子接种至5mllb培养基(含卡那霉素终浓度为50μg/ml)加入终浓度为0.5mmiptg诱导质粒pcas-lac质粒上sgrna的转录,30℃培养12-16小时,稀释涂布终浓度为50μg/ml卡那霉素lb平板;b、分离的单菌落依次在含终浓度为50μg/ml卡那霉素平板、含终浓度为50μg/ml壮观霉素及卡那霉素双抗平板上影印筛选,平板于30℃培养。挑取不在壮观霉素及卡那霉素双抗平板生长,而在卡那霉素平板生长的单菌落扩培保种,此单菌落为消除target质粒但保留了pcas-lac质粒的新菌株。c、将构建的其他基因敲除质粒转化到上述菌株,并筛选获得基因缺失菌株而后进行敲除质粒的消除,从而实现循环的基因组编辑。(5)基础质粒的消除基因组编辑完成后,将只含pcas-lac质粒的基因组编辑菌株接种至lb培养基,不加任何抗生素37℃过夜培养,稀释后涂布于lb平板,37℃培养。分离的单菌落依次在不含任何抗生素的lb平板(37℃培养)、含终浓度为50μg/ml卡那霉素lb平板(30℃培养)影印筛选。挑取不在卡那霉素lb平板生长而对应在lb平板生长的单菌落,此单菌落为消除基础质粒pcas-lac的菌株,最终获得不含任何质粒的基因编辑菌株。实施例2大肠杆菌bl21δarol(esa-1)工程菌的构建根据大肠杆菌bl21(de3)arol基因上下游序列设计引物。根据ncbi上公布的大肠杆菌bl21(de3)基因组序列,找到莽草酸激酶arol序列,在arol基因上选取切割位点n20,采用pcr的方法扩增arol敲除的上游同源臂和下游同源臂,引物如下:扩增arol上游同源臂引物sa-001:ggtatagtaaggggtgtattgagsa-002:acaaataaaccacgatcccgagggccattccgaccgttgt扩增arol下游同源臂所用引物sa-003-arol:acaacggtcggaatggccctcgggatcgtggtttatttgtsa-004-arol:gacgcagatcccttgtagtgdonordna的扩增引物退火得到切割位点n20-序列:sa-0x:tagtaaaccgacggttaagcgaatsa-0y:aaacattcgcttaaccgtcggttt以上两条引物退火得到n20-arol片段,利用限制性内切酶bsai酶切消化载体ptargetf质粒,采用gelextractionkit试剂盒(omega,america)按厂商说明纯化回收酶切消化产物。利用dnaligationkitver.2.1(takara,japan)按厂商说明将纯化回收的载体片段和n20片段连接,构建得到敲除质粒ptargetf-arol。随后将ptargetf-arol质粒、arol-3片段共转化入含pcas-lac质粒的bl21(de3)菌株中,利用crispr-cas9技术完成基因敲除,筛选得到成功敲除arol基因的工程菌,命名为esa-1。实施例3大肠杆菌bl21δptshicrrδarol(esa-2)工程菌的构建根据大肠杆菌bl21(de3)ptshicrr基因上下游序列设计引物。根据ncbi上公布的大肠杆菌bl21(de3)基因组序列,找到葡萄糖利用基因簇ptshicrr序列,在crr基因上选取切割位点n20,采用pcr的方法扩增ptshicrr敲除的上游同源臂和下游同源臂(同源臂包括了整个ptshicrr基因簇上下游,经过同源重组,可敲除ptshicrr基因簇),引物如下:sa-18:gtgccgtctactggcgcgacattgtatttccccaacttataggsa-21:gagatatgggaagataccgacgsa-19::cctataagttggggaaatacaatgtcgcgccagtagacggcacsa-22:ccagcagcatgagagcgatg引物退火得到切割位点n20-序列:sa-011:tagtagcaatgatctcaatagttcsa-012:aaacgaactattgagatcattgct以上两条引物退火得到n20-ptshicrr片段,利用限制性内切酶bsai酶切消化载体ptargetf质粒,采用gelextractionkit试剂盒(omega,america)按厂商说明纯化回收酶切消化产物。利用dnaligationkitver.2.1(takara,japan)按厂商说明将纯化回收的载体片段和n20片段连接,构建得到敲除质粒ptargetf-crr。donordna的扩增按照上表及上述引物进行pcr扩增,得到crr-3片段(donor-dna)。随后将ptargetf-crr质粒、crr-3片段共转化入含pcas-lac质粒的esa-1菌株中,利用crispr-cas9技术完成基因敲除,筛选得到成功敲除ptshicrr基因簇的工程菌,命名为esa-2。实施例4大肠杆菌bl21δptshicrrδarolδarok(esa-3)工程菌的构建根据大肠杆菌bl21(de3)arok基因上下游序列设计引物,敲除其启动子部分序列。根据ncbi上公布的大肠杆菌bl21(de3)基因组序列,找到莽草酸激酶arok及启动子序列,在arok基因启动子区域上选取切割位点n20,采用pcr的方法扩增敲除位点的上游同源臂和下游同源臂,引物如下:sa-36-arokatcttcagcctgccagcattsa-37-arokgatattgcgtttctctgccatcatatctggtcgctgcaagcsa-38-arokgcttgcagcgaccagatatgatggcagagaaacgcaatatcsa-39-arokgtcacgtcggcaatctcttc引物退火得到切割位点n20-序列:sa-034-aroktagtgactctcgcaatatcttatgsa-035-arokaaaccataagatattgcgagagtc以上两条引物退火得到n20-arok片段,利用限制性内切酶bsai酶切消化载体ptargetf质粒,采用gelextractionkit试剂盒(omega,america)按厂商说明纯化回收酶切消化产物。利用dnaligationkitver.2.1(takara,japan)按厂商说明将纯化回收的载体片段和n20片段连接,构建得到敲除质粒ptargetf-arok。按照上表及上述引物进行pcr扩增,得到arok-3片段(donor-dna)。随后将ptargetf-arok质粒、arok-3片段共转化入含pcas-lac质粒的esa-2菌株中,利用crispr-cas9技术完成基因敲除,筛选得到成功敲除arok基因启动子的工程菌,命名为esa-3。实施例5表达载体esa-psa-04的构建以bl21基因组为模板,扩增以下片段。引物编号大小(bp)扩增基因或片段063/0642031tkta基因065/0662488ppsa基因067/068479arof-1069/070687arof-2071/072857aroe基因073/0741140arob基因075/076913bparod基因以上表扩增的片段融合pcr扩增以下片段模板引物大小片段tkta基因+ppsa基因063/0664479bptkta-ppsaarof-1+arof-2+aroe067/0721928bparoffbr-aroearob+arod073/0762012bparob-arod利用限制性内切酶ncoi和bamhi酶切消化pet-28a载体,回收载体骨架后与下述片段连接,得到相应表达载体。pet-tkta-ppsa-arobd载体构建:pet-tkta-ppsa载体使用bamhi+noti酶切回收载体骨架(9692bp);pet-arob-arod使用bglii+noti酶切,回收arob-arod片段(2123bp);两片段连接后得到载体pet-tkta-ppsa-arobd。psa-04载体构建:pet-tkta-ppsa-arobd载体使用bamhi+noti酶切回收载体骨架(11783bp);pet-arof-aroe使用bglii+noti酶切,回收arof-aroe片段(2039bp);两片段连接后得到载体pet-tkta-ppsa-arobdfe,重命名为psa-04(见图7)。实施例6表达载体psa-14与esa-psa-14菌株的构建莽草酸合成途径基因均在含laci基因的pet-28a载体上表达,需要乳糖/iptg的诱导,本实验将敲除载体上的laci基因,从而避免诱导并提高基因表达水平。psa-04中laci基因敲除引物sa064、sa083,目标条带3185bp(见图9)。将验证正确的psa-14质粒转入esa-3中,得到esa-psa-14,测试在摇瓶中产莽草酸能力,表明未诱导组与诱导组相差较小,敲除laci并未影响莽草酸的合成。实施例7摇瓶发酵优化在改良soc培养基的基础上,甘油管接种于种子培养基活化12h后,接种发酵摇瓶(5%接种量),37℃,220rpm,30h后结束培养,考察碳氮源对莽草酸发酵的影响。(1)碳源考察从od和莽草酸产量来看,均为葡萄糖做碳源时发酵结果最优。(2)有机氮源考察由结果看出,酵母浸粉、酵母蛋白胨、大豆蛋白胨、酵母抽提物均有利于莽草酸发酵,表明所构建菌株具有较好的氮源适应性。实施例850l发酵罐发酵——发酵温度全程37℃,氨水控制ph取液氮保存的甘油菌esa-psa-14,以0.5%(v/v)的接种量接到一级种子培养基中,37℃,250rpm,培养7h,按1%(v/v)接种到二级摇瓶种子培养基中,37℃,250rpm,培养10h后,以5%(v/v)接种量接到发酵罐进行发酵培养。种子培养基同发酵罐培养基:葡萄糖10.0g/l,酵母蛋白胨20.0g/l,酵母浸粉10.0g/l,磷酸氢二钠1.0g/l,柠檬酸2.0g/l,硫酸镁0.4g/l,氢氧化钠3.0g/l,硫酸铵2.0g/l,磷酸二氢钾4.0g/l,微量元素溶液1ml/l。微量元素溶液:五水硫酸铜0.3g/l,一水硫酸锰1.7g/l,七水硫酸锌0.3g/l,七水硫酸亚铁2.8g/l,二水钼酸钠2.0g/l,硼酸1.0g/l,六水氯化钴2.45g/l,无水氯化钙1.13g/l,浓硫酸27ml/l。补料碳源:50%(w/w)葡萄糖溶液。补料氮源:酵母蛋白胨(10%,w/w)和酵母浸粉(5%,w/w)混合液。培养条件:(1)初始条件,37℃,200rpm,通气量1vvm,ph7.0,溶氧大于50%,压力45-65kpa。(2)补糖策略:0-30h5g/l/h,31-85h3g/l/h(3)发酵10h开始流加氮源,流加速率20g/l/h;(4)发酵14h将溶氧降到30-50%之间。(5)发酵开始ph先上升,先用磷酸控7.0,ph下降后用氨水控制在7.0。结果:发酵71h,菌体od值60,sa产量81.3g/l,dhs为9.67g/l,sa对葡萄糖的摩尔转化率为0.36mol/mol。实施例950l发酵罐发酵——发酵温度全程37℃,氢氧化钠和氨水的混合碱液控制ph,减少色素合成取液氮保存的甘油菌esa-psa-14,以1%(v/v)的接种量接到一级种子培养基中,37℃,250rpm,培养7h,按2%(v/v)接种到二级摇瓶种子培养基中,37℃,250rpm,培养7h后,以10%(v/v)接种量接到发酵罐进行发酵培养。种子培养基同发酵罐培养基:葡萄糖10.0g/l,酵母蛋白胨20.0g/l,酵母浸粉10.0g/l,磷酸氢二钠1.0g/l,柠檬酸2.0g/l,硫酸镁0.4g/l,氢氧化钠3.0g/l,硫酸铵2.0g/l,磷酸二氢钾4.0g/l,微量元素溶液1ml/l。微量元素溶液:五水硫酸铜0.3g/l,一水硫酸锰1.7g/l,七水硫酸锌0.3g/l,七水硫酸亚铁2.8g/l,二水钼酸钠2.0g/l,硼酸1.0g/l,六水氯化钴2.45g/l,无水氯化钙1.13g/l,浓硫酸27ml/l。补料碳源:60%(w/w)葡萄糖溶液。补料氮源:酵母蛋白胨(10%,w/w)和酵母浸粉(5%,w/w)混合液。培养条件:(1)初始条件,37℃,200rpm,通气量1vvm,ph7.0,溶氧大于50%,压力45-65kpa。(2)补糖策略:0-30h5g/l/h,31-85h3g/l/h;(3)发酵12h开始流加氮源,流加速率15g/l/h;(4)发酵15h将溶氧降到20-50%之间。(5)发酵开始ph先上升,先用磷酸控7.0,ph下降后用氢氧化钠和氨水(1:1)混合控制在7.0。结果:发酵71h,菌体od值54,sa产量75.0g/l,dhs为8.82g/l,sa对葡萄糖的摩尔转化率为0.38mol/mol,料液颜色明显变浅,由原来的棕褐色变为黄棕色。实施例1050l发酵罐发酵——发酵过程降温至30℃,氨水控制ph,减少色素合成同时产量提升取液氮保存的甘油菌esa-psa-14,以1%(v/v)的接种量接到一级种子培养基中,37℃,250rpm,培养7h,按2%(v/v)接种到二级摇瓶种子培养基中,37℃,250rpm,培养7h后,以10%(v/v)接种量接到发酵罐进行发酵培养。种子培养基同发酵罐培养基:葡萄糖10.0g/l,酵母蛋白胨20.0g/l,酵母浸粉10.0g/l,磷酸氢二钠1.0g/l,柠檬酸2.0g/l,硫酸镁0.4g/l,氢氧化钠3.0g/l,硫酸铵2.0g/l,磷酸二氢钾4.0g/l,微量元素溶液1ml/l。微量元素溶液:五水硫酸铜0.3g/l,一水硫酸锰1.7g/l,七水硫酸锌0.3g/l,七水硫酸亚铁2.8g/l,二水钼酸钠2.0g/l,硼酸1.0g/l,六水氯化钴2.45g/l,无水氯化钙1.13g/l,浓硫酸27ml/l。补料碳源:60%(w/w)葡萄糖溶液。补料氮源:酵母蛋白胨(10%,w/w)和酵母浸粉(5%,w/w)混合液。培养条件:(1)初始条件,37℃,200rpm,通气量1vvm,ph7.0,溶氧大于50%,压力45-65kpa。(2)补糖策略:0-30h5g/l/h,31-85h3g/l/h;(3)发酵10h开始流加氮源,流加速率20g/l/h;(4)发酵14h降温至30℃培养,同时将溶氧降到30%(20-50之间)。(5)发酵开始ph先上升,先用磷酸控7.0,之后ph下降换用氨水控制在7.0。结果:发酵79h,菌体od值65,sa产量90.0g/l,dhs为10.3g/l,sa对葡萄糖的摩尔转化率为0.35mol/mol,料液颜色为金黄色,与原棕褐色相比差异明显。实施例11500l发酵罐发酵取液氮保存的甘油菌esa-psa-14,以1%(v/v)的接种量接到一级种子培养基中,35℃,250rpm,培养7h,按1%(v/v)接种到二级摇瓶种子培养基中,37℃,250rpm,培养7h后,以10%(v/v)接种量接到装有30l培养基的种子罐进行培养,培养7h后,以10%(v/v)接种量接到装有300l培养基的发酵罐进行发酵培养。种子罐培养基同发酵罐培养基:葡萄糖10.0g/l,大豆蛋白胨20.0g/l,酵母抽提物10.0g/l,磷酸氢二钠1.0g/l,柠檬酸2.0g/l,硫酸镁0.4g/l,氢氧化钠3.0g/l,硫酸铵2.0g/l,磷酸二氢钾4.0g/l,微量元素溶液1ml/l。微量元素溶液:五水硫酸铜0.3g/l,一水硫酸锰1.7g/l,七水硫酸锌0.3g/l,七水硫酸亚铁2.8g/l,二水钼酸钠2.0g/l,硼酸1.0g/l,六水氯化钴2.45g/l,无水氯化钙1.13g/l,浓硫酸27ml/l。补料碳源:50%(w/w)葡萄糖溶液。补料氮源:大豆蛋白胨(10%,w/w)和酵母抽提物(5%,w/w)混合液。发酵培养条件:(1)初始条件,37℃,150rpm,通气量1vvm,ph7.0,溶氧大于50%,压力45-65kpa。(2)补糖策略:0-30h5g/l/h,31-85h3g/l/h;(3)发酵8h开始流加氮源,流加速率20g/l/h;(4)发酵15h降温至30℃培养,同时将溶氧降到30%(20-50之间)。(5)发酵开始ph先上升,先用磷酸控7.0,之后ph下降换用氨水控制在7.0。结果:发酵71h,菌体od值57,sa产量84.6g/l,dhs为9.95g/l,sa对葡萄糖的摩尔转化率为0.34mol/mol。实施例128000l发酵罐发酵取液氮保存的甘油菌esa-psa-14,以1%(v/v)的接种量接到摇瓶种子培养基中,37℃,250rpm,培养7h,按1%(v/v)接种到装有30l培养基的一级种子罐进行培养,7h后再以5%(v/v)接种量接到装有500l培养基的二级种子罐进行培养,培养7h最后以10%(v/v)接种量接到装有5000l培养基的发酵罐进行发酵。种子罐培养基同发酵罐培养基:葡萄糖10.0g/l,大豆蛋白胨20.0g/l,酵母抽提物10.0g/l,磷酸氢二钠1.0g/l,柠檬酸2.0g/l,硫酸镁0.4g/l,氢氧化钠3.0g/l,硫酸铵2.0g/l,磷酸二氢钾4.0g/l,微量元素溶液1ml/l。微量元素溶液:五水硫酸铜0.3g/l,一水硫酸锰1.7g/l,七水硫酸锌0.3g/l,七水硫酸亚铁2.8g/l,二水钼酸钠2.0g/l,硼酸1.0g/l,六水氯化钴2.45g/l,无水氯化钙1.13g/l,浓硫酸27ml/l。补料碳源:50%(w/w)葡萄糖溶液。补料氮源:大豆蛋白胨(10%,w/w)和酵母抽提物(5%,w/w)混合液。发酵培养条件:(1)初始条件,37℃,50rpm,通气量0.5vvm,ph7.0,溶氧大于50%,压力45-65kpa。(2)补糖策略:0-30h5g/l/h,31-85h3g/l/h;(3)发酵10h开始流加氮源,流加速率15g/l/h;(4)发酵14h降温至30℃培养,同时将溶氧降到30%(20-50之间)。(5)发酵开始ph先上升,先用磷酸控7.0,之后ph下降换用氨水控制在7.0。结果:发酵72h,菌体od值61,sa产量73.4g/l,dhs为8.34g/l,sa对葡萄糖的摩尔转化率为0.35mol/mol。实施例13利用分光光度计对发酵液上清进行测定,可以反映色素的多少。实施例发酵液上清od450值实施例87.2实施例93.8实施例104.0实施例113.5实施例123.2由结果可知,用混合碱液调节ph或者发酵过程降温均可有效降低色素的产生,有利于下游产物的提取。在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1