一种采用酶法生产高纯度(R)-(-)-3-羟基丁酸的方法与流程
本发明属于生物工程领域,涉及一种采用酶法生产高纯度(r)-(-)-3-羟基丁酸的方法,具体涉及一种通过微生物发酵生产聚-3-羟基丁酸酯解聚酶,并利用该解聚酶降解聚-3-羟基丁酸酯生产高纯度(r)-(-)-3-羟基丁酸单体的方法。
背景技术:
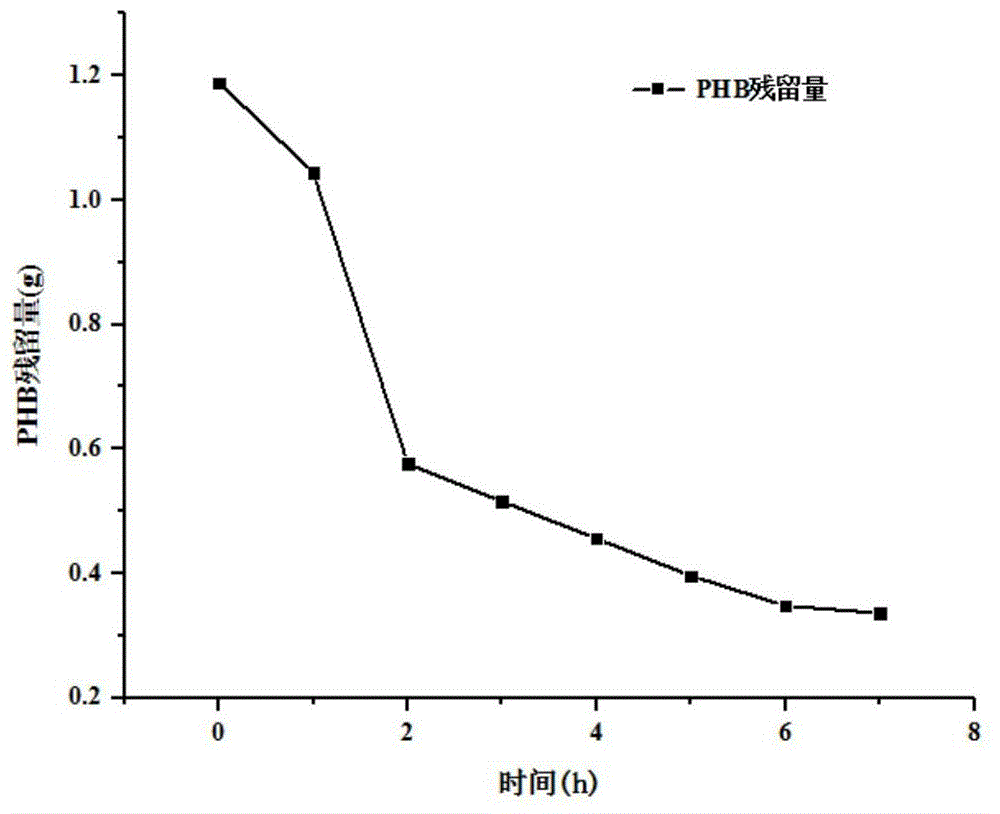
:(r)-(-)-3-羟基丁酸((r)-(-)-3-hydroxybutanoicacid)是3-羟基丁酸外消旋体中的r-构型的异构体,是一种具有光学活性的手性化合物,cas号为625-72-9。在人体中,(r)-(-)-3-羟基丁酸通常是在肝脏中合成,原料是乙酰辅酶a,此反应是由(r)-(-)-3-羟基丁酸脱氢酶催化产生。(r)-(-)-3-羟基丁酸可用作大脑在低血糖时的备用能源,此化合物在人体饥饿状态时的低血糖生理反应中,扮演重要角色。此外,(r)-(-)-3-羟基丁酸对某些疾病具有一定的治疗功能,例如:(1)能够治疗与酮体水平相关的症状,如对神经紊乱疾病或神经退化性的疾病有缓解的作用。(2)能够治疗与糖代谢的相关疾病,如ⅰ型糖尿病、ⅱ型糖尿病低酮体症。(3)(r)-(-)-3-羟基丁酸是内源性组蛋白去乙酰化酶的阻断剂,在较低浓度时可保护细胞免遭“氧化应激”损害。基于(r)-(-)-3-羟基丁酸的营养价值及药用价值,其本身及其衍生物有极大的生产保健产品及药品的潜力。目前3-羟基丁酸的生产方法主要是化学法,由3-羟基丁醛催化氧化得到(s/r)-3-羟基丁酸,该反应需在酸性条件下进行,而此条件下3-羟基丁酸容易发生分子内脱水而形成丁烯醛/酸,影响反应最终的转化率与收率;或使用3-羟基丁酸内酯的水解反应得到纯度较高的3-羟基丁酸,但需要添加剧毒的氰化物,导致废液污染环境。在(r)-3-羟基丁酸及其盐的生产方法(专利号(cn107162893a)中,采用了醇解phb得到三羟基丁酸乙酯后,再与强碱反应得到3-羟基丁酸盐的方法,醇解反应时需消耗大量醇类物质,并需要添加硫酸维持酸性条件,并不能一步直接获得3-羟基丁酸或盐,相对于生物法的一步法得到产物过程复杂且有副产物产生。在化学法合成过程中需要高温高压并添加手性金属催化剂,过程冗长且伴随副产物,产生的废液处理亦需要较高的成本。生物法合成3-羟基丁酸的方法主要是由微生物自身代谢循环,将碳源转化为乙酰辅酶a,进而转化为乙酰乙酰辅酶a,3-羟基丁酰辅酶a和(r)-3-羟基丁酸。如专利(cn2017103961413、cn2016800351607)两种使用不同菌株生产3-羟基丁酸的方法,能够直接从发酵液中提取到3-羟基丁酸钠,后经直接脱色酸化获得(r)-3-羟基丁酸。申请号200910106659.4的专利技术披露了一种采用基因工程菌发酵制备(r)-3-羟基丁酸乙酯的方法,其中涉及了采用该工程菌以淀粉为底物碳源直接合成()-3-羟基丁酸的方法,但其实施例中没有分离提纯(r)-3-羟基丁酸的方法及相关产物得率的论述。相对于化学法,生物法能耗低,流程简单,反应时间更短,但从上述专利实施例中可以看到其底物转化率非常低(葡萄糖底物浓度650克/l,产物3-羟基丁酸浓度11.5克/l,糖酸转化率只有1.77%),在生物发酵过程中需要使用多种微生物埃希氏菌属(escherichia)、假单包菌属(pseudomonas)、气单包菌属(aeromonas),过程较为复杂,且大肠杆菌作为生物工程菌有抗菌性且包含内毒素,对生产人员和环境有潜在的危害。因此,其产业化可行性较低或生产成本将非常高。此外,通过基因工程手段使生产菌株过量表达代谢通路中相关的酶,但基因工程菌目前仍有一些无法避免的问题,如质粒丢失导致的活性下降,基因操作过程中留下的多种抗生素抗性对环境来说也仍然具有威胁。同时,全细胞发酵法生产的产物不可避免地会伴生一定的副产物,这对终端产品(r)-3-羟基丁酸的质量会有一定的影响。技术实现要素:本发明的目的是为了解决现有技术无法实现高效生产高纯度(r)-(-)-3-羟基丁酸单体,且工艺简单的技术问题,提供一种采用酶法生产高纯度(r)-(-)-3-羟基丁酸的方法。本发明一种采用酶法生产高纯度(r)-(-)-3-羟基丁酸单体的方法,包括下述步骤:步骤(1)、扩增培养:将diaphorobacter菌属的diaphorobacterpolyhydroxybutyrativorans菌在lb培养基进行扩增培养,获得大量菌种。diaphorobacter菌属的diaphorobacterpolyhydroxybutyrativorans菌为现有成熟菌种,可通过购买获取得到。培养条件:温度控制在37℃,ph控制在7.2,180rpm,培养时间16h。步骤(2)、发酵产酶:将步骤(1)扩增培养得到的菌种置于发酵培养基中发酵培养,得到含phb解聚酶的发酵液;发酵液离心、过滤,获得分离纯化后的phb解聚酶粗酶液。所选发酵培养基的组成包括如下:phb0.1~10g/l、kno32g/l、kh2po41g/l、na2hpo43g/l、(nh4)2so41g/l、mgcl2·6h2o0.01~1g/l、nacl0.2g/l、酵母粉0.15g/l、cacl20.02~1g/l、柠檬酸铁铵0.01g/l,消泡剂0-0.1g/l。所述的消泡剂选用聚醚类化合物。培养条件:溶氧常数控制在15~30%,更优选控制在20~25%;温度控制在30~40℃,更优选控制在35℃;ph控制在6.5~8.0,更优选控制ph在7.2。发酵产酶过程中采取流加补料的方式,整个发酵产酶过程phb浓度控制在0.5g/l。上述通过离心的方法得到除去菌体的上清液,必要时浓缩滤液,得到phb解聚酶粗酶液。phb解聚酶粗酶液通过微滤膜过滤方法除去残余菌体和大分子物质,得到无菌滤液;必要时浓缩滤液,得到phb解聚酶粗酶液。步骤(3)、酶解:以phb作为底物,采用步骤(2)phb解聚酶粗酶液降解phb,通过碱控制ph值在6.5~8.0,最终得到含(r)-(-)-3-羟基丁酸盐的酶解液。解聚酶缓冲溶液成分:kno32g/l、kh2po41g/l、na2hpo43g/l、(nh4)2so41g/l、mgcl2·6h2o0.01~1g/l、nacl0.2g/l、酵母粉0.15g/l、cacl20.02~1g/l、柠檬酸铁铵0.01g/l。酶解条件:温度控制在30~45℃,更优选控制在37℃;ph控制在6.5~8.5,更优选控制ph在7.5。酶解过程中底物phb采用流加补料方式,底物phb浓度控制在0.1-10g/l,优选控制在1g/l。步骤(4)、单体纯化:从步骤(3)酶解液中采用无水乙醇提取高浓度的(r)-(-)-3-羟基丁酸盐,经酸化、蒸馏得到高纯度的(r)-(-)-3-羟基丁酸单体。在发酵生产phb解聚酶过程中,phb既作为碳源又作为诱导物。本发明的有益效果是:本发明方法相比于化学法和全细胞发酵法而言,具有反应条件温和、废液产生少、(r)-(-)-3-羟基丁酸的化学纯度高和旋光性单一等优点。由于酶法生产(r)-(-)-3-羟基丁酸的培养基成分远比全细胞发酵法的培养基成分简单,因此对产品分离的成本也会大幅度降低,纯度也将更高。本发明采用diaphorobacterpolyhydroxybutyrativorans菌在特定培养环境下产生phb解聚酶,同时以phb作为碳源和诱导物进行酶解,酶的催化效率极高(每克粗酶可催化解聚250克以上聚-3-羟基丁酸酯至(r)-(-)-3-羟基丁酸单体)。因此,本发明的酶法生产(r)-(-)-3-羟基丁酸的工艺更具有大规模工业化应用的前景。附图说明图1是phb解聚酶降解效率分析图。具体实施方式下面结合实施例对本发明的技术方案及效果作进一步的描述,但本发明并不局限于实施例所展示物质、配比和方法,任何基于这些实施例的所展示的材料组合和方法的一般技术人员可轻易联想到的变化,都属于本发明保护范围。本发明涉及多种物质的添加量、含量及浓度,其中所述的百分含量,除特别说明外,皆指质量百分含量。本发明中的实施例中,如果对于操作温度没有特别做出说明,则该温度通常值得是室温(15~30℃)。以下实施例中采用的酶活检测方法如下:配置浓度为3g/l的phb悬浊液,使用前经超声波处理5min后摇匀。取400μl悬浊液,与待测样品混合至4ml,此时phb终浓度为0.3g/l。于a650nm吸光度条件下用蒸馏水调零后测定混合液的为a650吸光度值记为a0。将混合液置于35℃恒温水浴中反应30min后,再于650nm波长下测定吸光度记为a1。一个酶活单位定义为:每分钟引起光吸收度降低0.001(a650),所需的酶量。计算公式:每毫升液体酶活(u/ml)=((a1-a0)/30min)/3.6ml。实施例1:活化种子液将实施例1保存在冻干管中的菌株diaphorobacterpolyhydroxybutyrativorans,接种于lb斜面培养基(酵母粉5g/l、蛋白胨10g/l、氯化钠10g/l、琼脂20g/l)中,35℃,静置培养12h。挑取emd菌单菌落,接种于lb液体培养基(酵母粉5g/l、蛋白胨10g/l、nacl10g/l)中,35℃,180rpm振荡培养12h,制备成一级种子液。按10%的接种量,将一级种子液接种于产酶培养基(phb1g/l、kno32g/l、kh2po41g/l、na2hpo43g/l、(nh4)2so41g/l、mgcl2·6h2o0.2g/l、nacl0.2g/l、酵母粉0.15g/l、cacl20.036g/l、柠檬酸铁铵0.01g/l)中,35℃,180rpm振荡培养12h,制备成二级种子液。对比例1:葡萄糖作为唯一碳源时产酶活性将实施例1二级种子液以250ml摇瓶进行菌种培养发酵,装液量100ml,培养基成分为:葡萄糖1g/l、kno32g/l、kh2po41g/l、na2hpo43g/l、(nh4)2so41g/l、mgcl2·6h2o0.01g/l、nacl0.2g/l、酵母粉0.15g/l、cacl20.02g/l、柠檬酸铁铵0.01g/l。培养温度35℃,ph值7.2左右转速180rpm,培养时间18h。发酵时间为18h,离心去除菌体取上清测酶活,总酶活68u。对比例2:葡萄糖作为唯一碳源加入phb作为诱导剂的产酶活性将实施例1二级种子液以250ml摇瓶进行菌种培养发酵,装液量100ml,培养基成分为:葡萄糖1g/l、phb0.01g/l、kno32g/l、kh2po41g/l、na2hpo43g/l、(nh4)2so41g/l、mgcl2·6h2o0.01g/l、nacl0.2g/l、酵母粉0.15g/l、cacl20.02g/l、柠檬酸铁铵0.01g/l。培养温度35℃,ph值7.2左右转速180rpm,培养时间18h。发酵时间为18h,离心去除菌体取上清测酶活,总酶活129u。实施例2-1:发酵产酶:phb作为唯一碳源及诱导物的产酶活性将实施例1二级种子液以250ml摇瓶进行菌种培养发酵,装液量100ml,培养基成分为:phb1g/l、kno32g/l、kh2po41g/l、na2hpo43g/l、(nh4)2so41g/l、mgcl2·6h2o0.01g/l、nacl0.2g/l、酵母粉0.15g/l、cacl20.02g/l、柠檬酸铁铵0.01g/l。培养温度35℃,ph值7.2左右转速180rpm,培养时间18h。发酵时间为18h,离心去除菌体取上清测酶活,总酶活210u。实施例2-2至2-4:发酵产酶将500ml的实施例1二级种子液接种于7l的发酵罐中,装液量为5l。发酵培养基各成分如表1。培养温度35℃,ph值7.2左右,溶氧常数控制在20~25%,通风量和搅拌转速根据溶氧常数灵活调节。流加补料phb,整个发酵产酶过程phb浓度控制在0.5g/l。发酵总时间为18h。表1实施例2-2至2-4采用不用含量成分的发酵培养基总酶活量实施例2-5至2-7:发酵产酶将500ml的实施例1二级种子液接种于7l的发酵罐中,装液量为5l。发酵培养基成分为:phb1g/l、kno32g/l、kh2po41g/l、na2hpo43g/l、(nh4)2so41g/l、mgcl2·6h2o0.2g/l、nacl0.2g/l、酵母粉0.15g/l、cacl20.036g/l、柠檬酸铁铵0.01g/l。消泡剂用量为0.05g/l。培养温度35℃,ph值7.2左右,溶氧常数见表2,通风量和搅拌转速根据溶氧常数灵活调节。流加补料phb,整个发酵产酶过程phb浓度控制在0.5g/l。发酵总时间为18h。表2实施例2-5至2-7采用不用溶氧常数培养环境下总酶活量溶氧常数总酶活实施例2-515~20%7.8×104u实施例2-620~25%9.5×104u实施例2-725~30%8.5×104u实施例2-8至2-9:发酵产酶将实施例2-6的培养温度更改为表3,其他条件不变。表3实施例2-6、2-8、2-9采用不用培养温度下总酶活量培养温度总酶活实施例2-635℃9.5×104u实施例2-830℃6.7×104u实施例2-940℃5.4×104u实施例2-10至2-11:发酵产酶(发酵ph为6.5)将实施例2-6的发酵ph更改为表4,其他条件不变。表4实施例2-6、2-10、2-11采用不用发酵ph下总酶活量发酵ph总酶活实施例2-67.29.5×104u实施例2-106.54.9×104u实施例2-118.07.8×104u实施例3:粗酶液制备将实施例2-6的5l发酵液在4℃、6000rcf下离心10min,除去菌体,收集上清液。将上清液通过无菌的0.22μmpes微滤膜过滤,除去未离心掉的残余菌体,收集澄清透明的滤过液。经生物法涂平板检测,滤过液中无菌。phb解聚酶降解效率:取除菌后的phb解聚酶粗酶液120ml,总蛋白质量为4.32g;添加1.2g的phb粉末,使其终浓度为10g/l。置于35℃条件下反应,维持ph在7.5左右,定时取样测定phb残留量。通过phb粉末悬浮液的od值与浓度之间的关系制作标准曲线,计算phb残留量。其数据结果见表1:表1时间(h)残留量(g)01.18911.04420.57630.51640.45650.39660.34870.336从表1以及图1分析可知,在前2h左右phb的降解速率很快,2h以后降解速率越来越缓慢,直至6h以后降解速率趋近于零,但是酶活仍然发挥作用,只是速率会越来越慢。从上述的数据计算可知0.853gphb在7h内完全降解需要4.32mg粗蛋白酶发挥作用,加上误差和继续延长反应时间,估算1gphb降解需要4mg粗蛋白酶,即1g粗蛋白酶能催化降解250gphb。实施例4-1至4-3:酶解phb生产(r)-(-)-3-羟基丁酸将实施例3中的5l无菌滤过液装入无菌发酵罐中。酶解温度见表5,ph维持在7.5左右。流加补料phb,整个酶解过程phb浓度控制在1g/l。当维持ph的碱液不再补加,表明不再产生(r)-(-)-3-羟基丁酸,酶解过程结束。采用高效液相色谱测定3-羟基丁酸纯度。色谱柱为zorbaxsb-c18柱(4.6×250mm),流动相为乙腈和hcl-水(ph3.0)(梯度洗脱条件为:0-5min,hcl-水90%,乙腈10%;5-20min,hcl-水90→10%,乙腈10→90%;20-25min,hcl-水10%,乙腈90%;25-27min,hcl-水10→90%,乙腈90→10%;27-35min,hcl-水90%,乙腈10%)紫外检测波长为210nm,进样量10μl,流速1ml/min,柱温30℃。表5实施例4-1至4-3采用不用酶解温度下生产(r)-(-)-3-羟基丁酸酶解温度(r)-(-)-3-羟基丁酸g/l实施例4-130℃12.1实施例4-237℃15.8实施例4-345℃7.2实施例4-4至4-5:酶解phb生产(r)-(-)-3-羟基丁酸将实施例4-2的发酵ph更改为表6,其他条件不变。表6实施例4-2、4-4、4-5采用不用酶解ph下生产(r)-(-)-3-羟基丁酸酶解ph(r)-(-)-3-羟基丁酸g/l实施例4-27.515.8实施例4-46.511.8实施例4-58.58.4实施例5:(r)-(-)-3-羟基丁酸提取纯化(酶解温度37℃、酶解ph7.5)将实施例4-2的5l酶解液6000rcf离心10min,除去溶液中未降解完全的phb固形物,收集酶解液经离心后的上清液。用0.1μm的中空纤维膜对上清液进行过滤处理,除去上清液中的phb解聚酶,以防止对后续纯化产生干扰。然后加入1%的活性炭,搅拌脱色30min,过滤得到浅黄或无色液体。利用正渗透装置对5l滤过液进行浓缩到250ml后,置于80℃烘箱中干燥得100g固体粉末。将100g粉末按照1:5(m/v)的比例与无水乙醇混合,搅拌2h,使其充分溶解在无水乙醇中。过滤除去不溶于无水乙醇的其他无机盐(来源于培养基中),并蒸馏除去无水乙醇后得到纯度较高的3-羟基丁酸盐。将得到的3-羟基丁酸盐溶解于过量的hcl溶液中,搅拌均匀充分酸化。然后根据水和3-羟基丁酸的沸点不同,通过减压蒸馏的方式先除掉水分后,收集到高纯度(r)-(-)-3-羟基丁酸。经检测,(r)-(-)-3-羟基丁酸的纯度为99%,比旋光度为-25°(c=6%inh2o)。上述phb解聚酶基因序列图谱,见siqidno.1:atgccattccatcgttttctgctcgctgctgcgttggcatccgccggcatggcgcaggcggcggcgccgctgggccagtacaacatcgacacgggcaagatcagcgtttcagggctgtcctcaggcggcttcatggccaaccagcttggcaatgcgtactcgtccaccttcatgggcgtgggcatctttgccgcggggccgtacatgtgcgcgggccacaacaactacacggcctgcatgtacaacgccagcatcagcgccagccagcagagcgcgatgcagggcagcatcgacagctacagcgccaacggcaccatcgatggcaagtccggcattgctgctcagaagatctacatcttcacgggcaccagcgactacaccgtggggcccaacctgaccgatgcgctgcagacccagtacctcaacaatggggtgcccgcgggcaacatcacgtacgtcaagcgcagcgggaccgcgcatgtgctgcccaccgactttgacagcacgggcaacaacgcatgcagcagcagcacctcgcccttcatcagcaactgcggttatgacggcgcgggagcggtgctctcacatttctatggcgcgctgaatgcgcgcaacaacgcccctgcggcagccaactacatcgagttcgatcaaagcgcctataccgcaggcaacccgggcatggccgccaacgcctggctgtacgtgcccgcaagctgcgccaacggcgcgcagtgcaagctgcacgtcgtgctgcacggttgccagcagagcaccgacaagatcggcgacaagttcgtcaagaacaccggctatagccgctgggccgataccaaccagatcatcctgctgttcccgcagacccggatcgacaacaccagccgcagcaccgccaagagcggatcgctggccaaccccaacgcctgctgggactggatcggctggtacggcggcaatttcgcgcaaaagagcggcgcgcagatggccgcgatcaaggccatggtggatcgcatcgcttccggtgcaggttcgggcgacggcggcggcaccccaccgcccaccgatccggtcctgccagcgcccaccggtctcagcgcgtcgggcgccaccgccacaagcatgaacctggcctggaatgccgtggctggcgccaacggctacaacgtctaccgcaacggcaacaaagccaacgcccttaccgtctacgccaccagctataccgactcggcgctgaccgcttccaccacctacagctgggcggtgcgtgcggtggatgccaacggcgcagagggtgatgcgtcgaacgccgtgaacggcaccacgctcgcgcccacgcagtcccctggcacctgcaccacagccagcaactatgcgcacacacaagcggggcgcgcctaccagcagggcggctacacctacgccaatggctccggccagagcatggggctgtggaacgtgttcgtgaccaccacgctcaagcagacagccaccaattactacgtgatcggcacctgcccctga当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1