杂交有机体的稀有产物的鉴定的制作方法
杂交有机体的稀有产物的鉴定
[0001]
本发明涉及有机体领域,特别是微生物如酵母领域。更具体地,本发明涉及杂种有机体的产生和鉴定,特别是如通过稀有交配事件产生的种间杂种的产生和鉴定。
[0002]
酵母属的酵母被广泛用于各种生物技术产业,包括啤酒酿造[krogerus等人,2017.appl microbiol biotechnol 101:65-78]、葡萄酒酿造[marsit和dequin,2015.fems yeast res 15:72]、生物药物蛋白的生产[nielsen,2013.bioengin 4:207-211]以及第一代和第二代生物燃料的合成[balat,2011.energy conv management 52:858-875;jansen等人,2017.fems yeast res 17:fox044]。狭义酵母属(saccharomyces sensu stricto)复合体涵盖9种不同的物种:酿酒酵母(saccharomyces cerevisiae)、奇异酵母(s.paradoxus)、里约酵母(s.cariocanus)、葡萄汁酵母(s.uvarum)、米卡塔酵母(s.mikatae)、库德里阿兹威酵母(s.kudriavzevii)、s.arboricola、真贝酵母(s.eubayanus)和最近发现的s.jurei[hittinger,2013.trends genet 29:309-317;naseeb等人,2017.int j syst evol microbiol 67:2046-2052]。在不同的酵母物种之间存在合子后屏障,这意味着在物种之间进行种间交配是可能的,但产生了不育的后代[greig等人,2002.proc royal society london b:biology sciences 269:1167-1171;hou等人,2014.current biol 24:1153-1159]。尽管在不同的自然环境中已经发现了一些种间杂种,如在黄蜂的肠中[stefanini等人,2016.pnas 113:2247-2251],但在驯养环境中最常见酵母杂种,并用于各种工业发酵过程[boynton和greig,2014.yeast,31:449-462;gorter de vries等人,2017.applied environm microbiol83:e03206-16]。例如,用酿酒酵母和真贝酵母之间的杂种巴斯德酵母(s.pastorianus)进行lager酿造[libkind等人,2011.pnas 108:14539-14544],其将酿酒酵母的发酵能力和糖利用与真贝酵母的耐冻性相结合[hebly等人,2015.fems yeast res 15:fov005]。已经从葡萄酒发酵中分离出酿酒酵母、库德里阿兹威酵母和葡萄汁酵母之间的各种双交种和三交种,并且其似乎在香味产生中起重要作用[gonz
á
lez等人,2006.fems yeast res 6:1221-1234]。杂交对驯化的酵母菌株的遗传变异的另一个重要贡献是基因渗入,其由种间杂交以及之后多轮的与亲本菌株之一回交引起。这种渗入在许多驯化的酵母菌株中是常见的,并且有助于例如苹果酒发酵葡萄汁酵母菌株和葡萄酒发酵酿酒酵母菌株的独特表型[naumova等人,2011.research microbiol 162:204-213;dunn等人,2012.genome res 22:908-924]。
[0003]
杂种中两种或更多种酵母基因组的组合通常导致协同效应——一种称为“杂种优势(heterosis)”或“杂种活力(hybrid vigor)”的现象,其使得杂种在特定环境中比其亲本中的任一种表现得更好[shapira等人,2014.heredity 113:316]。因此,酵母属酵母的靶向杂交通常被用于产生具有用于工业应用的新的或改进的表型的菌株。例如,相比其亲本菌株,实验室制备的酿酒酵母
×
真贝酵母杂种显示出更高的耐寒性和低聚糖消耗[hebly等人,2015.fems yeast res 15:fov005]、不同的风味特征[steensels等人,2014.applied environment microbiol 80:6965-6975]、更高的发酵速率和更高的乙醇滴度[krogerus等人,2015.j industrial microbiol&biotechnol 42:769-778]。除了天然存在的杂种之外,还产生了自然界中尚未分离的新的种间杂种,如酿酒酵母
×
奇异酵母杂种[bellon等人,
2011.appl microbiol and biotechnol 91:603-612]、酿酒酵母
×
米卡塔酵母杂种[bellon等人,2013.plos one 8:e62053;nikulin等人,2018.yeast 35:113-127]、酿酒酵母
×
s.arboricola杂种[nikulin等人,2018.yeast 35:113-127]和酿酒酵母
×
葡萄汁酵母杂种[bellon等人,2015.appl microbiol biotechnol 99:8597-8609;lopandic等人,2016.appl microbiol biotechnol 100:6331-6343]。这些杂种结合了两种亲本菌株的特性,导致了新的表型多样性,其可用于从发酵饮料工业到生物燃料生产范围的应用[peris等人,2017.biotechnol biofuels 10:78]。
[0004]
杂种优势是一种复杂的现象,尚未得到充分的理解;它最可能是由多种因素的组合引起的,包括染色体拷贝数的量[gorter de vries等人,2017.applied environm microbiol 83:e03206-16;krogerus等人,2016.appl microbiol biotechnol 100:7203-7222]、不同显性和隐性等位基因之间的相互作用,以及上位性相互作用[shapira等人,2014.heredity 113:316]。所得表型并不总是模糊的:显性表型和通常更复杂的表型如耐冻性或絮凝通常完全遗传自亲本菌株之一[hebly等人,2015.fems yeast res 15:fov005;coloretti等人,2006.food microbiol 23:672-676],而对于风味化合物和其它次生代谢物,杂种通常产生的浓度为约其亲本菌株产生的浓度的平均值[krogerus等人,2015.j industrial microbiol&biotechnol 42:769-778;bellon等人,2011.appl microbiol and biotechnol 91:603-612]。杂种优势不仅依赖于用于种间杂交的亲本物种,而且依赖于所使用的特定菌株,使得更难以预测异交的表型。例如,实验室制备的不同亲本菌株的酿酒酵母
×
真贝酵母杂种显示出独特的发酵特性和风味特征[krogerus等人,2017.microbial cell factories 16:66;mertens等人,2015.appl environm microbiol 81:8202-8214]。因此,工业上相关的杂种的产生依赖于试错过程,其中必须产生和筛选尽可能多的杂种以找到具有最佳特性的菌株[steensels等人,2014.fems microbiol reviews 38:947-995]。因此,开发新的有效的高通量筛选策略可以简化和合理化具有工业应用潜力的杂种的产生。
[0005]
可以类似于种内交配获得没有合子前屏障的物种种间杂种:通过交配相反交配类型的单倍体菌株,或者通过不具有相反交配类型的、在交配类型位点中经历了杂合性的自发损失的菌株之间的稀有交配形成杂种[steensels等人,2014.fems microbiol reviews 38:947-995]。种间杂交的发生率相对较低;据报道,杂交频率范围从孢子与孢子交配的1.5%-3.6%[krogerus等人,2016.appl microbiol biotechnol 100:7203-7222;mertens等人,2015.appl environmental microbiol 81:8202-8214]至稀有交配的低至1
×
10-6
至1
×
10-7
的频率[krogerus等人,2017.microbial cell factories 16:66;gunge和nakatomi,1972.genetics 70:41-58]。因为种间交配以如此低的频率发生,所以绝大多数的交配培养物由未交配的亲本细胞和交配的非杂种细胞组成,使得分离所需的杂种具有挑战性。种间杂交的效率可以通过各种方法,如表达可诱导的ho-核酸内切酶,增加能够进行交配的交配型转变的发生,来提高[alexander等人,2016.fungal genet biol 89:10-17]。如果在交配培养物中获得了杂种,则可以通过在相比非杂种细胞有利于杂种细胞的条件下生长而从交配培养物中分离该杂种。这可以通过利用两种亲本菌株的互补表型来实现,例如,通过将能够在37℃下生长的酿酒酵母菌株与能够在低ph下更有效地发酵某些糖或生长的其它酵母物种杂交[bizaj等人,2012.fems yeast res 12:456-465]。可以通过在可以容易地针对诸
如营养缺陷型或抗性进行选择的亲本菌株中引入可选择的表型而大大简化这样的选择。尽管可以使用遗传修饰容易地实现这种标志物的引入[hebly等人,2015.fems yeast res 15:fov005;piotrowski等人,2012.bmc evolut biol 12:46;da silva等人,2015.plos one 10:e0123834],但由于客户接受和立法问题,该方法可能是耗时的并且很少用于与食品有关的工业应用中[wunderlich和gatto,2015.advances nutrition 6:842-851]。因此,种间杂种的构建主要依赖于将菌株与预先存在的互补营养缺陷型杂交,并在选择性培养基上选择它们的杂种。营养缺陷型可以天然存在[等人,2017.j indus microbiol biotechnol 44:1203-1213;fern
á
ndez-gonz
á
lez等人,2015.current microbiol 70:441-449],或者可以在没有任何基因工程技术的情况下通过有利于营养缺陷型菌株的条件下的实验室进化获得[krogerus等人,2015.j industrial microbiol&biotechnol 42:769-778;p
é
rez-trav
é
s等人,2012.int j food microbiol 156:102-111;scannell等人,2011.genes genomes genet 1:11-25],使其成为可靠的无gmo的技术。然而,获得杂交所需的营养缺陷型突变体是时间密集型和劳动密集型的,因为必须获得每种亲本菌株的营养缺陷型,并且营养缺陷型突变的发生频率较低[alexander等人,2016.fungal genet biol 89:10-17]。此外,许多工业上相关的酵母菌株是多倍体或非整倍体,这使得营养缺陷型突变体的产生复杂化[gorter de vries等人,2017.applied environm microbiol 83:e03206-16;p
é
rez-trav
é
s等人,2012.int j food microbiol 156:102-111;bell,1998.appl environment microbiol 64:1669-1672]。
[0006]
总的来说,从任何菌株之间的杂交中选择杂种,而无需预先的遗传修饰或冗长的程序的高通量方法,通常会大大简化种间交配,且特别是工业上相关的杂种酵母菌株的产生。荧光染料在这里提供了一种精妙的解决方案,因为荧光团可以用于通过简单和较短的程序标记任何细胞,而无需进行基因工程改造。优选的染料对生存力的影响有限。当对两种亲本菌株使用不同的荧光团时,杂种细胞将被鉴定为双染色的,并且可以使用荧光激活细胞分选(facs)分离。在1994年,酿酒酵母和扣囊复膜孢酵母(saccharomycopsis fibulgera)菌株的原生质体被荧光标记,通过facs分选融合的和双染色的细胞[katsuragi等人,1994.letters appl microbiol 19:92-94]。使用这种技术,从9'800'000个原生质体的库中分选出3'600个活的潜在融合子,其中的至少一个被证实是杂种。然而,由于原生质体融合被认为是一种gmo技术[krogerus等人,2017.appl microbiol biotechnol 101:65-78],因此其在食品和饮料行业中的应用被排除在外。
[0007]
在1998年,用不同的荧光染色剂标记两种异宗配合的单倍体酿酒酵母,随后使其彼此交配,并使用facs富集双染色细胞[bell,1998.appl environment microbiol 64:1669-1672]。在连续的两轮分选中,培养物从33%交配的细胞富集到96%交配的细胞,富集少于三倍。作者应用相同的方法将二倍体工业酿酒酵母菌株与具有组氨酸和色氨酸营养缺陷型以及具有整合的lacz标志物的单倍体酿酒酵母菌株进行交配。在从含有超过2
×
106个细胞的库中进行连续两轮分选后,50个双染色细胞中有3个细胞通过其组氨酸和色氨酸的原养型、lacz活性和pcr指纹被鉴定为杂种,尽管数据未显示。此外,在显微镜下观察分选细胞表明分选群体由交配和非交配的亲本细胞的细胞簇组成。因此,不排除双染色细胞不是单细胞而是亲本细胞簇,它们一起具有与杂种一致的pcr指纹或已经在选择性培养基的压力下杂交。不能区分单个交配细胞和细胞簇可以解释在分选之前33%交配细胞的异常频
率,并且可能导致了分选细胞中的混合群体。尽管当使用具有标志物的菌株时,这些混合的群体不是问题,但当使用无标志物菌株时,鉴定杂种细胞变得不可能。由于在分选之前稀有交配事件的初始频率是未知的,因此不能确定富集因子。尽管种内交配具有比种间杂交更高的发生率[morales和dujon,2012.microbiol molec biol reviews 76:721-739],但如果可以获得足够高的富集因子,这种用于无标志物的种内交配的方法也可以产生种间杂种。
[0008]
发明简述
[0009]
本发明提供了鉴定杂种有机体的方法,其包括提供来自第一亲本有机体和第二亲本有机体的细胞,其中所述第一有机体和第二有机体是交配相容的,其中所述第一亲本有机体不同于所述第二亲本有机体,其中所述第一亲本有机体而非所述第二亲本有机体携带营养缺陷型标志物;用荧光染料标记来自所述第二亲本有机体的细胞;在比第一亲本有机体和/或第二亲本有机体的最佳生长温度低至少5℃的温度下,使来自所述第一亲本的细胞与来自所述第二亲本的标记细胞杂交;以及将杂种有机体鉴定为营养缺陷型的标记细胞。
[0010]
本发明还提供了鉴定杂种有机体的方法,其包括用染料a标记来自第一亲本有机体的细胞;用染料b标记来自第二亲本有机体的细胞;其中所述第一亲本有机体与所述第二亲本有机体相同或不同,其中所述第一有机体和第二有机体是交配相容的,其中染料a和染料b是荧光染料,并且染料a不同于染料b,并且其中可以将用染料a标记的细胞与用染料b标记的细胞区分开来;在比所述第一亲本有机体和/或所述第二亲本有机体的最佳生长温度低至少5℃的温度下,使来自所述第一亲本的标记细胞与来自所述第二亲本的标记细胞杂交;以及将杂种有机体鉴定为双标记细胞。
[0011]
来自第一和/或第二亲本有机体的所述细胞优选是配子或孢子。更具体地,来自第一和/或第二亲本有机体的细胞是萌发后被标记的配子或孢子。特别是在酵母中,配子(也称为单倍体孢子)可以在适当的条件下进入有丝分裂细胞周期。发现如果细胞在萌发后被标记,则配子,特别是单倍体孢子的标记得到极大改善。
[0012]
来自第一亲本有机体或第二亲本有机体的所述细胞优选是多倍体,如二倍体、三倍体、四倍体、五倍体或非整倍体,优选是二倍体。
[0013]
第一亲本有机体和第二亲本有机体优选是微生物,更优选是酵母,优选狭义酵母属酵母。
[0014]
在本发明的优选方法中,第一有机体和第二有机体是不同的物种,并且所得杂种是种间杂种。
[0015]
在本发明的方法中,杂种有机体的鉴定优选通过荧光激活细胞分选(facs)进行。
[0016]
在本发明的优选方法中,鉴定双标记细胞之后是将双标记细胞与单一标记的细胞分离。所述分离的双标记细胞优选进行第二轮的将杂种有机体鉴定为双标记细胞以及将双标记细胞与单一标记的细胞分离。所述第二轮可以在培养分离的双标记细胞之后进行。
[0017]
优选荧光染料a和b中的至少一种是琥珀酰亚胺酯偶联的染料,优选荧光染料a和b都是琥珀酰亚胺酯偶联的染料。
[0018]
本发明还提供了用染料a和染料b标记的杂种有机体。所述杂种有机体优选是种间杂种。所述杂种有机体优选是酵母,更优选是酿酒酵母亲本菌株和真贝酵母亲本菌株之间杂交的后代。
附图说明
[0019]
图1:cen.pk113-5a(mata ura3 his3-δ1 leu2-3,112 trp1-289)
×
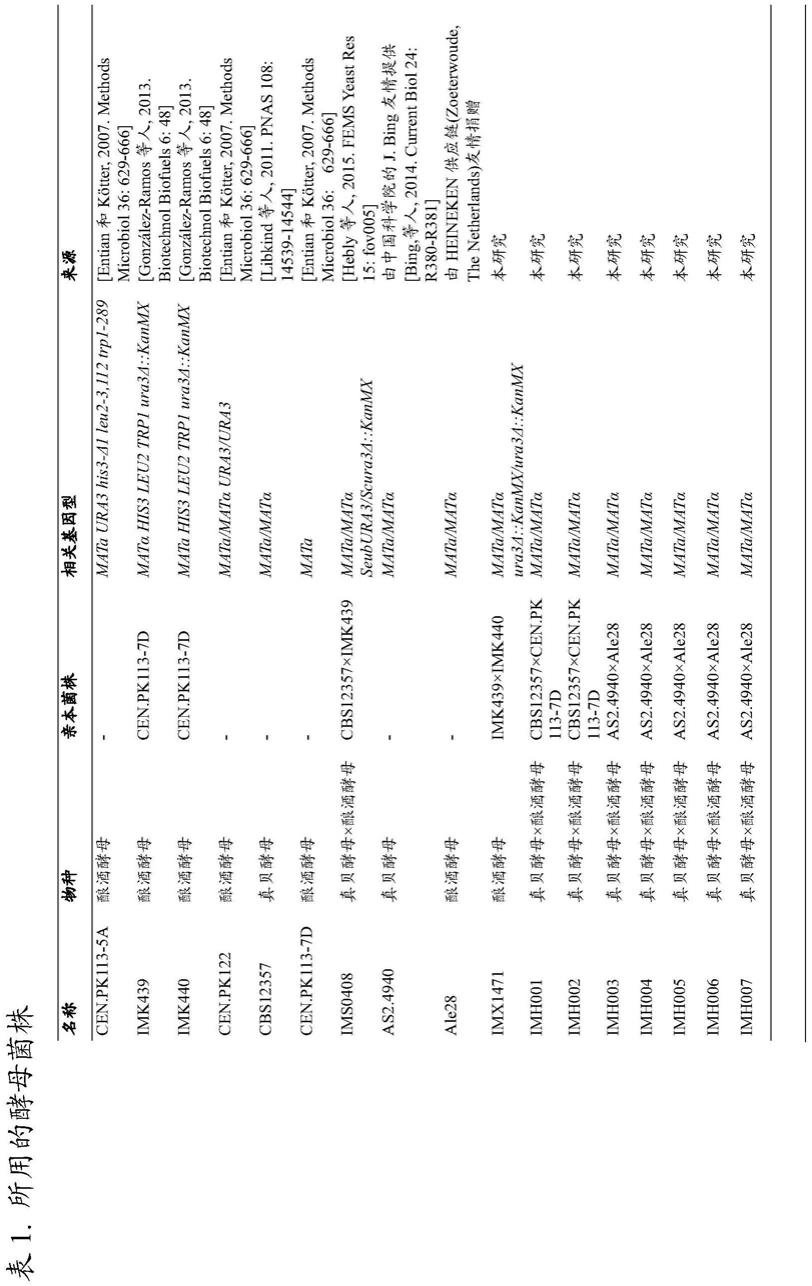
imk439(mata his3 trp1 leu2 ura3δ::kanmx)的种内交配的分析和验证。(a)在交配之前和交配18h、24h和42h后未染色的cen.pk113-5a、用cfse染色的cen.pk113-5a以及用violet染色的imk439的荧光强度的等值线图。每个图分析了100’000个细胞,显示了每个细胞的绿色和紫色荧光强度。门控区域用于分选细胞,每个门的事件率以百分比表示。(b)在通过facs分选的不同群体中能够在合成的基本培养基中生长的细胞的百分比。交配细胞的量被确定为在ypd上生长的活细胞分数,所述活细胞也能够在合成的基本(sm)培养基上生长。(c)从双染色群体(c+v+)中分选的合子细胞的显微镜图像(400
×
)。高达10%的分选的双染色细胞具有这种生理学,而其余细胞具有正常的出芽生理学。(d)cen.pk113-5a
×
imk439杂交的倍性评估。通过dna染色和流式细胞术测量cen.pk122(二倍体)、imk439(单倍体)和推定的交配细胞的dna含量。描绘了具有二倍体基因组含量、单倍体基因组含量和两者的混合的集落的三个代表性图(从左至右)。
[0020]
图2.真贝酵母和酿酒酵母之间交配的优化及推定杂种的分离。(a)在ypd和ypt上交配30h后,染色的cbs12357和imk439细胞的荧光强度的等值线图。每个图分析了100’000个细胞,显示了每个细胞的绿色和紫色荧光强度。门控区域用于分选细胞,每个门的事件率以百分比表示。(b)在ypt和ypd上孵育3.5h、7h、24h和30h后,双染色群体中存在的杂种的百分比。百分比计算为能够在sm+g418上生长的单细胞分选集落的量。(c)真贝酵母cbs12357和酿酒酵母imk439的孢子-细胞种间杂交方案中的优化参数的概述。
[0021]
图3.cbs12357(真贝酵母,孢子形成的)
×
cen.pk113-7d(mata)和as2.4940(真贝酵母,孢子形成的)
×
ale28(酿酒酵母,孢子形成的)的无标志物的种间交配的分析和验证。(a)在cbs12357(cfse染色的)
×
cen.pk113-7d(violet染色的)和as2.4940(cfse染色的)
×
ale28(violet染色的)之间的交配培养物中测量的荧光强度的等值线图。每个图分析了100’000个细胞,显示了每个群体的绿色和紫色荧光强度。门控区域用于分选细胞,每个门的事件率在图中以百分比表示。(b)构建的无标志物的杂种的倍性评估。通过dna染色和流式细胞术测量cen.pk122(二倍体,红色)、cen.pk113-7d(单倍体,绿色)和pcr证实的杂种(有色的)的dna含量。(c)用于证实来自cbs12357
×
cen.pk113-7d和as2.4940
×
ale28杂交培养物的双染色群体的单细胞分离物中存在真贝酵母和酿酒酵母标志物基因的多重集落pcr。对于cbs12357
×
cen.pk113-7d,显示了代表性实例,总共测试了22个分离物。包括亲本菌株的单细胞分离物以作为对照,以及杂种菌株ims0408(酿酒酵母
×
真贝酵母)的基因组dna。l:generuler 50bp dna ladder。箭头表示杂种,数字对应于不同的单细胞分离物。
[0022]
图4.从通过facs分析测量的双染色群体中分选的不同倍性的cfse染色的真贝酵母和远红(far red)染色的酿酒酵母细胞之间杂交的荧光显微镜图像(630
×
)。自上而下:cbs12357(真贝酵母,孢子形成的)
×
imk439(酿酒酵母,matαura3δ::kanmx)、cbs12357(孢子形成的)
×
imx1471(酿酒酵母,mata/αura3δ::kanmx/ura3δ::kanmx)、cbs12357(二倍体)
×
imk439和cbs12357(二倍体)
×
imx1471。
[0023]
图5.来自未富集的交配培养物的不同倍性的cfse染色的真贝酵母和远红染色的酿酒酵母细胞之间杂交的荧光显微镜图像(630
×
)。自上而下:cbs12357(真贝酵母,孢子形成的)
×
imk439(酿酒酵母,matαura3δ::kanmx)、cbs12357(孢子形成的)
×
imx1471(酿酒
酵母,mata/αura3δ::kanmx/ura3δ::kanmx)、cbs12357(二倍体)
×
imk439和cbs12357(二倍体)
×
imx1471。
[0024]
图6.通过使imk439(酿酒酵母,matαura3δ::kanmx)与imk440(酿酒酵母,matαura3δ::kanmx)交配构建和验证imx1471。(a)在ypd上交配30h后,染色的imk439(cfse)和imk440(远红)细胞的荧光强度的等值线图。分析了100'000个细胞,显示了每个细胞的绿色和红色荧光强度。门控区域用于分选细胞,每个门的事件率以百分比表示。(b)用于证实来自imk439
×
imk440交配培养物的双染色群体的单细胞分离物中存在mata和matα的多重集落pcr。用引物11、12和13(补充表1)确定交配类型。l:generuler 50bp dna ladder,箭头表示交配细胞,数字对应于不同的单细胞分离物。(c)通过在合成的基本培养基(sm)、sm+g418和sm+g418+尿嘧啶中接种以验证imk439和imx1471中遗传标志物的存在。(d)显示imx1471的孢子形成能力的显微镜图像(400x)。(e)交配的imk439
×
imk440细胞的倍性评估。通过dna染色和流式细胞术测量cen.pk122(二倍体)、cen.pk113-5a(单倍体)和交配细胞的dna含量。
[0025]
发明详述
[0026]
定义
[0027]
如本文所用的术语“杂种”或“杂种有机体”是指这样的有机体,其是将不同品种、物种或属的两种有机体的基因组进行组合的结果。杂种优选是有性杂交的结果,这意味着杂种有机体是不同性别的两种细胞,如不同交配类型的两种细胞,优选两个配子融合的结果。
[0028]
如本文所用的术语“种间杂种”是指这样的有机体,其是将不同物种或属的两种有机体的基因组进行组合的结果。
[0029]
如本文所用的术语“第一亲本有机体”和“第二亲本有机体”是指不同品种、物种或属的两种有机体。所述两种有机体是杂交相容的。
[0030]
如本文所用的术语“杂交相容的”是指可以杂交,优选有性杂交的两种有机体。当这两种有机体是酵母有机体时,可以使用术语“交配相容的”,其等于术语“杂交相容的”。
[0031]
术语“染料a”和“染料b”是指可用于对细胞进行染色的不同荧光染料。
[0032]
如本文所用的术语“最佳生长温度”是指来自第一亲本有机体和第二亲本有机体的细胞最佳生长的温度,这意味着细胞最快地完成完整的细胞周期。大多数植物、藻类和酵母的最佳生长温度为10-50℃,优选15-40℃,如18℃-25℃,更具体地20℃-22℃。
[0033]
如本文所用的术语“营养缺陷型标志物”是指编码指向用于生物合成的必需代谢物,特别是单体的代谢途径中的关键酶的标志物基因。一个实例是ura3基因,其编码酿酒酵母中嘧啶生物合成中的必需酶乳清苷-5'-磷酸脱羧酶。类似地,his3、leu2、trp1和met15标志物基因分别编码用于从头合成氨基酸组氨酸、亮氨酸、色氨酸和甲硫氨酸的必需酶。营养缺陷型标志物的存在允许细胞在不存在相应的必需代谢物的情况下生长。
[0034]
如本文所用的术语“配子”是指在受精过程中可与另一单倍体细胞融合的单倍体细胞。所述单倍体细胞由称为减数分裂的减少性细胞分裂过程产生。大多数有机体具有两种形态上不同类型的配子。一些有机体,包括酵母,具有形态上相同类型的配子,然而,其在称为交配型区域的一个或多个基因座中等位基因表达不同。大多数植物、藻类和酵母有机体可以在二倍体和单倍体阶段之间循环。
[0035]
如本文所用的术语“二倍体”是指包含两组染色体的细胞或有机体。一组染色体从一个亲本获得,而第二组染色体通常从第二亲本获得。术语“二倍体”用于将具有两组染色体的细胞和有机体,与称为单倍体的具有一组染色体的细胞和有机体,以及称为多倍体的具有多组染色体的细胞和有机体分开。多倍体细胞和有机体包括三倍体、四倍体、五倍体、六倍体和八倍体细胞和有机体。
[0036]
如本文所用的术语“非整倍体”是指其中不是所有染色体都以相同拷贝数存在的细胞或有机体。因此,如本领域技术人员已知的,染色体组(chromosome complement)不能表示为确定数量的完整染色体组,例如n、2n、3n或4n。术语非整倍性是指与整倍体细胞相反,在细胞或有机体中存在异常数量的染色体。非整倍体细胞可能缺失或具有额外的染色体部分,或者可能缺失一个或多个染色体或者具有额外的一个或多个染色体。
[0037]
如本文所用的术语“萌发”是指种子或配子恢复植物性(vegetatatively)生长能力,从而通过有丝分裂生长导致多细胞结构或导致细胞复制的过程。萌发的最常见实例是从种子发芽成幼苗。另外,从孢子如来自真菌孢子的菌丝孢子形成孢苗的生长,也被称为萌发。另外,真菌孢子脱落其孢子壁并恢复正常代谢活性,如在酵母中发生的过程也被称为萌发。萌发通常取决于诸如温度、湿度、氧气供应以及有时光或黑暗的条件。
[0038]
如本文所用的术语“微生物”是指单细胞或多细胞真核有机体,如真菌,包括酵母和原生生物,如藻类。大多数微生物是单细胞的。
[0039]
如本文所用的术语“酵母”是指被分类为真菌界成员的真核单细胞微生物。最优选的酵母是狭义酵母属复合体。狭义酵母属复合体目前涵盖9种不同的物种:酿酒酵母、奇异酵母、里约酵母、葡萄汁酵母、米卡塔酵母、库德里阿兹威酵母、s.arboricola、真贝酵母和最近发现的s.jurei[hittinger,2013.trends genet 29:309-317;naseeb等人,2017.int j syst evol microbiol 67:2046-2052]。
[0040]
细胞
[0041]
有机体的细胞可以在包含例如蛋白胨/酵母提取物的合适培养基中,或者在合成培养基中生长。如果需要,可以加入使得能够在特定遗传标志物存在下生长的合适的化合物,例如g418(2r,3s,4r,5r,6s)-5-氨基-6-[(1r,2s,3s,4r,6s)-4,6-二氨基-3-[(2r,3r,4r,5r)-3,5-二羟基-5-甲基-4-甲基氨基噁烷-2-基]氧基-2-羟基环己基]氧基-2-(1-羟乙基)噁烷-3,4-二醇),以特异性生长对这种化合物具有抗性的细胞。
[0042]
在染色和交配之前,优选使同宗配合的二倍体细胞,特别是同宗配合的二倍体酵母细胞形成孢子和萌发以获得单倍体配子。作为替代,可以将二倍体细胞染色并作为二倍体直接交配。
[0043]
对于孢子形成,可以例如通过过滤和/或离心分离细胞,例如用磷酸盐缓冲盐水或用无菌水洗涤,并重悬在孢子形成培养基中,例如重悬在1%(w/v)乙酸钾、0.02%(w/v)棉子糖中,其通过添加koh调节至ph=7,并补充有腺嘌呤、精氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苏氨酸、色氨酸、酪氨酸、缬氨酸和/或尿嘧啶,具体取决于具体的有机体。细胞优选在允许充分通气的板或管中孵育,因为孢子形成具有高的呼吸需求。
[0044]
孢子形成优选在15-25℃,优选约20℃下进行至少48小时,优选48-96小时,优选约72小时。优选在孢子形成过程中以约200rpm摇动细胞。
[0045]
在孢子形成之后,可以按本领域技术人员已知的那样分离孢子。用于孢子形成和
孢子分离的合适方案是已知的,包括beckman和payne,1983.phytopathol 73:286-289;e1-gholl等人,1982.can j botany 60:862-868;wang等人,2016.nature scientific reports 6:24923;alani等人,1990.cell 61:419-436。
[0046]
对于萌发,将孢子优选在合适的培养基,优选富集培养基如ypd中孵育至少1小时,例如2-10小时,优选约5小时的时间。优选在孵育期间搅拌孢子。孵育优选在最佳生长温度,例如在20-35℃,优选在约30℃下进行。
[0047]
细胞染色
[0048]
将第一有机体和第二有机体的细胞用细胞染色荧光染料染色。所述细胞染色染料优选是无毒的并且适于在体内和/或体外用荧光染料永久标记细胞。所述细胞染色或细胞标记优选不影响细胞形态和/或细胞生理。
[0049]
所述细胞标记可以通过直接或间接标记进行。间接标记包括使用例如用荧光染料标记的第二抗体和使用标记的化合物,例如标记的蛋白质,针对其使用了包含荧光标记物的染料的抗体。
[0050]
标记优选是直接的。标记优选通过标记蛋白质的伯胺(r-nh2)、胺修饰的寡核苷酸和其它含胺分子来进行。
[0051]
为此,染料优选包含琥珀酰亚胺基,优选琥珀酰亚胺酯,以将染料偶联到胞内赖氨酸残基和其它胺源上。进一步优选的染料包括硫醇反应性染料,其中荧光标记物与例如碘乙酰胺、马来酰亚胺、苄基卤化物或溴甲基酮偶联。另外,可以使用可以通过全细胞膜片钳、离子电渗、胞饮囊泡的渗透溶解引入细胞中的包含极性染料,如荧光黄ch、级联蓝酰肼、alexa fluor酰肼和生物胞素的可微注射的染料;和/或可以通过侵入性技术如显微注射、全细胞膜片钳、划痕负载(scrape loading)、微粒轰击、电穿孔或渗透休克加载到细胞中的荧光葡聚糖缀合物或荧光微球,来对本发明方法中的细胞进行染色。
[0052]
所述荧光标记物优选选自abz(邻氨基苯甲酰基(anthranilyl),2-氨基苯甲酰基)、n-me-abz(n-甲基-邻氨基苯甲酰基,n-甲基-2-氨基苯甲酰基)、fitc(异硫氰酸荧光素)、5-fam(5-羧基荧光素)、6-fam(6-羧基荧光素)、tamra(羧基四甲基罗丹明)、mca(7-甲氧基香豆素基-4-乙酰基)、amca或amc(氨基甲基香豆素乙酸酯(盐))、丹酰基(5-(二甲基氨基)萘-1-磺酰基)、edans(5-[(2-氨基乙基)氨基]萘-1-磺酸)、atto(例如atto465、atto488、atto495、atto550、atto647)、花青(cy)染料,包括cy3(1-(5-羧基戊基)-3,3-二甲基-2-((1e,3e)-3-(1,3,3-三甲基二氢吲哚-2-亚基)丙-1-烯-1-基)-3h-吲哚-1-鎓氯化物)、cy5(1-(5-羧基戊基)-3,3-二甲基-2-((1e,3e,5e)-5-(1,3,3-三甲基二氢吲哚-2-亚基)戊-1,3-二烯基)-3h-吲哚鎓氯化物),包括三磺化cy5和cy7(1-(5-羧基戊基)-2-[7-(1-乙基-5-磺基-1,3-二氢-2h-吲哚-2-亚基)庚-1,3,5-三烯-1-基]-3h-吲哚鎓-5-磺酸盐(酯))、alexa fluor(例如alexa fluor 647、alexa488、alexa532、alexa546、alexa594、alexa633、alexa647)、bodipy(例如fl)、dylight(例如dylight 488、dylight 550)、荧光黄(乙二胺或6-氨基-2-(2-氨基-乙基)-1,3-二氧代-2,3-二氢-1h-苯并[de]异喹啉-5,8-二磺酸)及以上的衍生物。
[0053]
第一有机体的细胞可以用第一染料(下文称为染料a)标记,而第二有机体的细胞可以用第二染料(下文称为染料b)标记。染料a和染料b是荧光染料,其中染料a不同于染料b。另外,用染料a标记的细胞优选可以与用染料b标记的细胞区分开;例如通过采用具有不
同激发和/或发射光谱的染料。可用于本发明方法的合适染料可以由单色光源,优选激光,更优选由紫外激光(约355nm)、紫色激光(约405nm)、蓝色激光(约488nm)或红色激光(约640nm)激发。例如,染料a可以是用约630nm的红光激光激发并在约661nm发射的染料,而染料b是用约492nm的蓝光激光激发并在约517nm发射的染料。
[0054]
本领域技术人员将清楚的是,优选的染料组合包括可以优选通过没有光谱重叠的两个发射滤光片,优选不需要荧光补偿而被清楚地测量的染料,更优选可以被两个不同的激光激发以最小化光谱重叠的染料,如用紫色激光(约405nm)、蓝色激光(约488nm)或红色激光(约640nm)。允许鉴定用染料a染色的细胞并允许将其与用染料b染色的细胞分离的优选组合是可以用紫色激光和蓝色激光;用紫色激光和红色激光,或用蓝色激光和红色激光激发的荧光染料。
[0055]
染料a和染料b优选是还允许鉴定含有染料a和染料b的细胞并将其与仅含有染料a和仅含有染料b的细胞分离的染料。为此,优选的染料包括用约630nm的红色激光激发并在约661nm处发射的染料,以及用约492nm的蓝色激光激发并在约517nm处发射的染料。
[0056]
可以通过本领域已知的方法进行细胞的染色。例如,可以将有机体的细胞与染料,优选琥珀酰亚胺酯偶联的染料一起孵育一段时间,优选0.1小时至1天,优选10分钟至过夜。优选将细胞例如通过过滤或离心浓缩,然后在平衡的电解质溶液中孵育。
[0057]
染色优选在降低的温度下进行以防止细胞增殖。因此,染色优选在低于20℃,优选5℃-15℃,更优选10℃-13℃,最优选约12℃的温度下进行。通过降低温度,细胞分裂花费更长时间。
[0058]
染色以及染色细胞的进一步交配和加工,优选在减少的光照条件下进行,优选在黑暗中进行。
[0059]
细胞杂交
[0060]
通过细胞融合产生杂种有机体被称为杂交。如果细胞是在体外条件下杂交的体细胞,则术语体细胞杂交是适用的。
[0061]
george barski组首次发现了体外体细胞杂交(barski等人,1960.c r hebd seances acad sci 251:1825-7)。自发杂交是稀有的。可以用化学方法,例如用聚乙二醇,或用灭活的病毒,例如仙台病毒诱导染色的亲本有机体的杂交。用于产生杂种(包括种间杂种)的方案是已知的。这种方案的实例存在于例如grosser等人,1996.theor appl genet 92:577-582;kisaka等人,1998.plant cell rep 17:362-367;matsumoto等人,2002.euphytica 125:317-324中。
[0062]
如果亲本有机体是酵母,则杂交或交配可以通过在富集培养基,例如1%(w/w)酵母提取物、2%(w/w)蛋白胨和2%(w/w)葡萄糖中孵育染色的亲本细胞来进行。
[0063]
对于杂交,可以使染色的细胞例如通过过滤或离心彼此密切接触,然后在适当的培养基中孵育细胞。
[0064]
杂交优选在低于亲本有机体的最佳生长温度的温度下进行,以防止过度的细胞增殖。通过降低温度,细胞分裂花费更长时间,而杂交的影响较小。因此,当与较高温度下的杂交相比时,较高比例的所得细胞是杂种细胞。发现杂交温度比亲本有机体的最佳生长温度低至少5℃可以限制染料的染色损失并导致鉴定出由第一亲本有机体和第二亲本有机体之间的杂交产生的稀有种间杂种。
[0065]
比第一和/或第二亲本有机体的最佳生长温度低至少5℃的温度优选低于18℃,优选为5℃-15℃,更优选为10℃-13℃,最优选为约12℃。本领域技术人员无疑能够确定具有异常最佳生长温度的植物、藻类和/或酵母的最佳生长温度,例如通过在不同温度下使植物、藻类和/或酵母的细胞生长。
[0066]
细胞的杂交优选在黑暗中进行以防止荧光染料的漂白,这对于本领域技术人员来说是清楚的。
[0067]
优选通过在黑暗中于比最佳生长温度低至少5℃的温度下将第一亲本有机体和第二亲本有机体的细胞静态孵育至少2小时的时间,优选2-48小时的时间,如12小时、16小时、24小时和36小时来进行杂交。优选的时间是过夜,其通常为约16小时。
[0068]
细胞的分离
[0069]
在第一亲本有机体和第二亲本有机体的细胞杂交后,鉴定杂种细胞,如种间杂种细胞,并与第一亲本有机体和第二亲本有机体分离。因为来自第一亲本有机体的细胞用荧光染料a染色,并且来自第二亲本有机体的细胞用染料b染色;所以可以基于染料a和染料b的染色分离杂种细胞,如种间杂种细胞。例如,如果第一亲本的细胞用羧基荧光素染色,并且第二亲本的细胞用远红染色,则当用约630nm的红色激光激发时,在约661nm处发射时杂种细胞是可见的,并且当用约492nm的蓝色激光激发时,在约517nm处发射时杂种细胞是可见的。
[0070]
可以通过本领域已知的任何方法从单一染色的细胞中分离这种双染色的杂种细胞。例如,装配有显微操作器的显微镜可用于鉴定和分离双标记的杂种细胞。
[0071]
分选双标记细胞的优选方法包括流式细胞术技术,如荧光激活细胞分选(facs)。facs具有另外的优点,即可以通过前向散射和侧向散射同时分析细胞的形态。基于染色模式和前向/侧向散射,可以设置分选门以确定待分选的细胞的类型。门控单细胞可以在单独的容器中分离,例如在多孔板如96孔微量滴定板的孔中分离。
[0072]
在分离单一杂种细胞后,它们可以在单独的容器中生长。在门控细胞包含含有第一亲本和第二亲本的被记为双染色的单一细胞的密切相关细胞的假阳性杂种细胞的情况下,分离的双标记细胞可以进行第二轮的将杂种有机体鉴定为双标记细胞,以及将双标记细胞与单一标记的细胞分离。用于该第二轮的染料可以与用于第一轮的染料相同或不同,只要杂种有机体可以作为双标记细胞与单一标记的细胞分离。
[0073]
在第二轮的鉴定杂种有机体之前,如本领域技术人员已知的,可以通过将细胞与例如去污剂一起孵育和/或超声或涡旋细胞来分离相关的细胞。另外,可以在螯合剂,例如乙二胺四乙酸、表面活性剂和/或酶如酵母裂解酶和/或溶壁酶存在下孵育细胞。
[0074]
作为替代或另外,可以例如通过流式细胞术或激光扫描细胞术来确定细胞的倍性。这种方法依赖于用荧光染料标记细胞,该荧光染料预期会化学计量地染色dna,从而准确地报告dna含量。为了分析的目的,细胞的一部分可以被去污剂和/或固定剂如甲醇或乙醇透化,并用dna特异性荧光染料标记。例如,可以例如使用乙醇固定细胞样品,并用核酸着色剂如绿色核酸着色剂(invitrogen s7020)染色。优选地,使用由于细胞膜的固有渗透性而能够渗入活细胞的荧光染料,如vybrant
tm dyecycle
tm
染料(thermofisher scientific)。可以在流式细胞仪上使用适于检测dna结合荧光着色剂的激光和发射滤光片测定样品的荧光。合适的条件可以是用488nm激光激发并通过带宽为30nm的533带通滤光片
检测发射。可以对具有预期倍性的细胞进行分选,所述预期倍性是第一亲本有机体和第二亲本有机体的总倍性。例如,当第一亲本有机体是单倍体(1n),且第二亲本有机体是二倍体(2n)时,可以将杂种有机体记为3n。
[0075]
为了清楚和简明描述的目的,在本文中将特征描述为相同或单独实施方案的一部分,然而,应当理解,本发明的范围可以包括具有所描述的所有或一些特征的组合的实施方案。
实施例
[0076]
实施例1
[0077]
材料和方法
[0078]
菌株、培养基和培养
[0079]
本研究中使用的酿酒酵母和真贝酵母菌株列于表1中。使菌株常规地生长在复合培养基(yp)中,该培养基含有10g l-1酵母提取物和20g l-1蛋白胨,对于ypd补充有20g l-1葡萄糖,且对于ypt补充有20g l-1海藻糖。含有20g l-1葡萄糖、3g l-1 kh2po4、5.0g l-1(nh4)2so4、0.5g l-1 mgso4
·
7h2o、1ml l-1
微量元素溶液和1ml l-1
维生素溶液的合成培养基(sm)按先前所述制备[verduyn等人,1992.yeast 8:501-517],并且使用2m koh将ph设定为6.0。在sm+g418中进行kanmx标志物的选择,sm+g418对应于补充有0.2g l-1 g418(invitrogen,carlsbad,ca,usa)的sm培养基,其中(nh4)2so4被1g l-1
谷氨酸一钠代替,因为硫酸铵阻碍g418[cheng等人,2000.nucleic acids res 28:e108-e108]。对于固体培养基,将20g l-1琼脂加入到培养基中。在含有2%乙酸钾且使用乙酸将ph设定为7.0的孢子形成培养基中进行孢子形成[bahalul等人,2010.yeast 27:999-1003]。
[0080]
在工作体积为100ml的500ml圆底摇瓶中或在工作体积为30ml的50ml greiner聚丙烯过滤器顶管(greiner polypropylene filter top tube)中,于ypd中繁殖酵母菌株。使酿酒酵母和真贝酵母培养物分别于30℃和20℃下在44孵化器摇床(eppendorf,nijmegen,the netherlands)中在200rpm下生长。通过将甘油(30%v/v)添加到指数生长的摇瓶培养物中来制备冷冻储备液,并且在-80℃下以1ml等分试样无菌储存。
[0081]
酵母培养物的染色
[0082]
为了染色,根据制造商的建议制备celltrace
tm violet、celltrace
tm cfse和celltrace
tm
远红荧光染料(thermo fisher scientific,waltham,ma,usa)。将培养物用2μl celltrace
tm
染料/ml培养物染色,并在黑暗中于12℃和200rpm下孵育过夜。将染色的培养物用yp培养基洗涤两次,以通过与酵母提取物和蛋白胨结合而去除任何残留的染料。
[0083]
种内交配
[0084]
对于种内交配实验,繁殖两种异宗配合的单倍体酿酒酵母菌株直到对数中期。将培养物洗涤,并在无菌的isoton ii(beckman coulter,woerden,nl)中稀释至最终细胞密度为约106个细胞ml-1,并按所述用celltrace
tm violet和celltrace
tm cfse染色。通过将两种染色的培养物一起移液到一个greiner管中使它们交配。将细胞沉淀并重悬于ypt中。将交配培养物转移到eppendorf管中并短暂离心(2000g,1min)以增加细胞的接近度,从而更有效地交配。随后,将交配培养物在黑暗中于12℃下静态孵育直至facs分析。
[0085]
种间交配和稀有交配
[0086]
在染色和交配之前,使同宗配合的二倍体菌株形成孢子并萌发,以获得单倍体配子,该配子可以容易地与其它物种的同宗配合的单倍体配子或异宗配合的单倍体细胞交配。对于稀有的交配,将二倍体菌株按上述处理,或者染色并直接作为二倍体交配。对于孢子形成,将10ml稳定期培养物离心,用无菌的脱矿质水洗涤,并重悬于50ml聚丙烯过滤器顶管中的9ml孢子形成培养基中,以确保充分的通气,因为孢子形成具有高的呼吸需求[sherman,1963.genetics 48:375]。将孢子形成培养物在20℃和200rpm下孵育至少72h。使用显微镜确定子囊的存在。默认情况下,按herman和rine[herman和rine,1997.embo j 16:6171-6181]所述,稍作修改来分离孢子。简言之,将孢子沉淀(1000g,5min),重悬于软化缓冲液(10mm二硫苏糖醇,100mm tris-so4,用h2so4将ph设定为9.4)中,并在30℃下孵育10分钟。使用脱矿质水洗涤细胞,重悬于具有0.8gl-1酵母裂解酶20-t(ams biotechnology ltd.,abingdon,uk)的原生质球化缓冲液(2.1m山梨醇,10mm kh2po4,用1m naoh将ph设定为7.2)中,并在30℃下孵育过夜。孵育后,使培养物沉淀(1000g,10min),使用脱矿质水洗涤并重悬于0.5%triton x-100中。在保持在冰上的同时,在50hz下以6微米的振幅将孢子超声处理约15s。在该方案的初始优化过程中,还测试了仅使用酵母裂解酶步骤的简短方案。使用显微镜证实了孢子的分离,并将分离的子囊孢子储存在4℃下或立即使用。对于萌发,默认用ypd洗涤孢子一次,随后重悬于20ml ypd中至约106个细胞ml-1的浓度。将萌发培养物在100ml圆底烧瓶中于30℃和200rpm下孵育5h。在种间杂交的初始优化期间,测试了使用2%葡萄糖代替ypd以及在ypd上萌发不同时间的方案。默认情况下,洗涤单倍体真贝酵母和酿酒酵母菌株,并在无菌的isoton ii(beckman coulter)中稀释至最终细胞密度为约106个细胞ml-1,并按所述用celltrace
tm violet和celltrace
tm cfse染色。对于稀有交配,使用约20
×
106个细胞ml-1的最终细胞密度,并按所述用celltrace
tm
远红和celltrace
tm cfse对细胞进行染色。通过将两种染色的培养物一起移液到一个greiner管中而使它们交配。将细胞沉淀并重悬于ypd中。将交配培养物转移到eppendorf管中并短暂离心(2000g,1min)以增加细胞的接近度,从而更有效地交配。将交配培养物在黑暗中于12℃下静态孵育直至facs分析。
[0087]
facs分析和分选
[0088]
将用于facs分析和分选的培养物在无菌的isoton ii中稀释并短暂涡旋以破坏细胞聚集体。对于稀有交配,加入50mm edta以破坏任何无性絮凝。在配备有355nm、445nm、488nm、561nm和640nm激光器和70μm喷嘴的bd facsaria
tm ii sorp细胞分选器(bd biosciences,franklin lakes,nj,usa)上分析培养物,并用滤过的facsflow
tm
(bd biosciences)操作。在每个实验之前,通过用相应的cs&t beads(bdbiosciences)运行cst循环来评估正确的血细胞计数器性能。通过用accudrop beads(bd biosciences)运行自动滴落延迟(auto drop delay)循环来确定用于分选的滴落延迟。celltrace
tm violet荧光由355nm激光激发并通过具有50nm带宽的450nm带通滤光片检测发射,celltrace
tm cfse由488nm激光激发并通过具有30nm带宽的545nm带通滤光片检测发射,并且celltrace
tm
远红由640nm激光激发并通过具有60nm带宽的780nm带通滤光片检测发射。在cfse对比violet或cfse对比远红图(far red plot)上分析交配培养物的荧光。通过将前向散射(fsc)对侧向散射(ssc)作图来分析细胞的形态。对于每次测量,分析至少100'000个事件。在这些图上设置分选区域(“门”)以确定待分选的细胞类型。使用对应于0的产量掩模(yield mask)、32的
纯度掩模(purity mask)和16的相位掩模(phase mask)的“单细胞”分选掩模,在含有ypd的96孔微量滴定板中分选门控单细胞。当需要时,在生长到具有选择性培养基(sm或sm+g418)的96孔板上时,使用乙醇火焰灭菌的96针复制器影印接种(replica-plated)集落。使用软件(版本3.05230,,flowjo,llc,ashland,or,usa)分析facs数据。
[0089]
活力测定
[0090]
为了确定具有低活力或交配效率的培养物中的活力比率或交配效率,使用了泊松统计。根据泊松统计,可以用数学方法确定每个孔中一定数量的分选细胞中出现活集落的机会(等式1),其中p是集落出现的机会的估计,并且λ是每个孔中活细胞的分数[dube等人,2008.plos one 3:e287650]。
[0091][0092]
等式1
[0093]
然后将杂种细胞的总百分比定义为λ乘以孔的数量(w),这产生校正的真阳性数量。将其除以分选细胞的数量以确定总群体中杂种的产率(等式2)。
[0094]
%杂种=(λ*w)/(分选的总细胞)
[0095]
等式2
[0096]
对于具有高活力的实验,在每个孔中仅分选1个细胞,因此未对一个孔中多个事件的概率应用泊松校正(等式1)。在此,通过对集落的数量进行计数并将其除以分选细胞的数量来计算活力百分比。
[0097]
成像
[0098]
使用zeiss axio成像仪z1(carl zeiss ag,oberkochen,germany)对细胞成像。对于荧光成像,用氙灯激发细胞,对于不同的荧光团使用不同的滤光片组。以使得从一个荧光团到另一个通道的渗漏最小化的方式选择滤光片组。来自celltrace
tm cfse的荧光通过gfp滤光片组(carl zeiss ag)成像,所述gfp滤光片组包含具有20nm带宽的470nm带通激发滤光片和具有25nm带宽的540nm发射滤光片。celltrace
tm
远红通过cy5滤光片组(carl zeiss ag)成像,该滤光片组包含具有30nm带宽的640nm带通激发滤光片和具有50nm带宽的690nm发射滤光片。使用axiovision se64(rel.4.9.1.carl zeiss ag,oberkochen,germany)和fiji[schindelin等人,2012.nature methods 9:676-682]处理图像。
[0099]
通过流式细胞术测定倍性
[0100]
对于倍性测定,按先前所述使用乙醇固定样品[hebly等人,2015.fems yeast res 15:fov005]。按[haase和reed,2002.cell cycle 1:117-121]所述,稍作一些小的修改进行用green核酸着色剂(invitrogen s7020)对细胞的染色。将细胞在50mm tris-cl(ph7.5)中洗涤并重悬于100μl rna酶溶液(1mg/ml rna酶a,于50mm tris-cl中)中。默认情况下,将100μl细胞添加至1mlgreen溶液中。当处理大量样品时,将于96孔微量滴定板中的高通量方案与m多通道电动移液器(gilson,middleton,wi,usa)一起使用。在该修改的方案中,通过添加150μl 70%乙醇固定100μl样品,并且在最后的步骤中,将20μl样品添加到180μlgreen溶液中。对于每个样品包括未染色的对照。在bd accuri
tm c6 csampler流式细胞仪(bd biosciences)上测量样品的荧光。用流式细胞仪的488nm激光激发荧光团,并通过具有30nm带宽的533带通滤光片检测发射。使用
软件(版本3.05230,flowjo)分析倍性数据。
[0101]
通过pcr鉴定种间杂种
[0102]
通过pcr证实了来自酿酒酵母和来自真贝酵母的遗传物质的存在。制备了含有水、引物和2x dreamtaq pcr mastermix(life technologies,carlsbad,ca,usa)的预混合物。添加酿酒酵母(8570&8571,参见表3)和真贝酵母(8572&8573,表3)特异性的引物[muir等人,2011.fems yeast res 11:552-563;pengelly和wheals,2013.fems yeast res 13:156-16153],至每种引物的最终浓度为0.25mm。通过在99℃下在2μl的naoh中煮沸2μl的液体培养物15min来分离dna。将18μl的pcr预混合物添加到模板dna中。用dreamtaq进行pcr的循环参数是:在95℃下初始变性2分钟,然后进行35个pcr循环的95℃下30s,55℃下30s和72℃下1min,以在72℃下最终延伸10min结束。交配类型使用相同的方案确定,但使用交配类型特异性的引物(表3)。使用tecan freedom液体处理器(tecan,switzerland)或用m多通道电动移液器(gilson)制备pcr反应。在100v下,在0.5
×
tbe缓冲液(45mm tris-硼酸盐,1mm edta,ph8)中,在用serva dna着色剂g(serva electrophoresis gmbh,heidelberg,germany)染色的2%(w/v)琼脂糖凝胶上分离pcr产物约30min。使用ingenius lhr凝胶成像系统(syngene,bangalore,india)对凝胶成像。
[0103]
结果
[0104]
使用facs从交配培养物中分离种内杂种
[0105]
由于种内交配比种间交配更有效地发生,因此通过交配两种异宗配合的酿酒酵母单倍体菌株开发了染色、交配和分选的功能方案。将具有互补营养缺陷型的两种菌株交配,产生了原养型交配的二倍体,其可以在合成的基本培养基(sm)上生长,从而允许容易且精确地测量样品中交配细胞的分数。菌株cen.pk113-5a(mata,his-,lys-,trp-)和imk439(matα,ura-)分别用cfse和violet染料染色,随后杂交。每个细胞的染料浓度在每个分裂期间被稀释,导致每个细胞的荧光信号强度随时间降低。为了最小化这种荧光损失,将交配培养物于12℃下在ypt中孵育,因为酿酒酵母在这些条件下生长缓慢。在facs上于不同时间点测量细胞发射的荧光:染色前、染色后但在交配前以及交配18h、24h和42h后(图1a)。在显示出对应于推定的交配细胞的双染色的事件周围设置门控区域,并且在含有ypd的96孔板上分选该门控区域内的事件,以防止本发明的营养缺陷型标志物的任何选择性压力。facs分析显示18小时后,0.90%的交配培养物是双染色的。交配24h后该数值增加到2.65%,并且交配42h后增加到5.25%(图1a)。在显微镜下,在双染色群体中观察到“shmoo”形态(图1c),其是酵母合子所特有的[herskowitz,1988.microbiol reviews 52:536],并且证实了该群体中存在交配细胞。测试了双染色细胞、单染色细胞和总培养物的单细胞分选的集落在合成的基本培养基中生长的能力。在双染色群体中,74%-82%能够在选择性培养基中生长,表明成功交配(图1b)。来自总交配培养物的细胞中仅4%在选择性培养基中生长,表明交配细胞在双染色群体中富集了20倍。通过流式细胞术对来自双染色群体的十个集落的倍性测定鉴定了三种类型的倍性:单倍体细胞、二倍体细胞和两者的混合(图1d)。根据先前的观察[bell,1998.appl environment microbiol 64:1669-1672],这些结果表明双染色事件不仅仅由交配的细胞组成,而且还由染色细胞的聚集体组成。由于交配细胞通常在交配时形成聚集体或分裂[lipke和kurjan,1992.microbiol reviews 56:180-194],因此双染色事
件的单细胞分离对于仅获得交配的细胞是必需的。尽管观察到聚集,但在双染色群体中能够在选择性培养基上生长的细胞的比例提高到约20倍,并且在交配18h后,可以通过在sm上接种并验证倍性来容易地获得交配的细胞。
[0106]
使用facs从交配培养物中分离种间杂种
[0107]
为了研究开发的染色和分选方案是否也可用于从交配培养物中分离种间杂种,将二倍体野生型真贝酵母菌株cbs12357与单倍体酿酒酵母菌株imk439(matα,ura3δ::kanmx)杂交。由于尿嘧啶原养型和对g418的抗性,这些菌株的杂种细胞将容易被鉴定。
[0108]
由于真贝酵母cbs12357是同宗配合的二倍体,在染色和交配之前孢子的孢子形成和分离是必需的。由于来自同宗配合的二倍体的孢子能够同源二倍化(homodiploidize),因此需要有效分离子囊中的孢子以最小化自交配,这将与种间交配竞争。因此,测试了消化子囊细胞壁的两种方案:(i)使用酵母裂解酶;和(ii)除了使用酵母裂解酶消化外,还使用表面活性剂triton x-100[herman和rine,1997.embo j 16:6171-6181],后者导致孢子分离的改善(数据未显示)。此外,facs分析表明约一半的真贝酵母细胞在染色完成后不发荧光(数据未显示)。在萌发过程中,孢子的细胞壁丧失。考虑到孢子细胞壁的不渗透性,在孢子染色后可能含有大量荧光染料。其在萌发过程中的损失可以解释观察到的荧光损失。因此,通过在不同的孵育持续时间的情况下,测试在2%葡萄糖和ypd中的萌发,开发了在染色之前使用的最佳萌发方法。在ypd中萌发5小时后,观察到第一次显著生长,表明经过了充足的萌发时间,而种内交配仍然是最小的(数据未显示)。最后,真贝酵母利用海藻糖作为唯一碳源生长或交配的能力是未知的。因此,将在ypd培养基中用cfse染色的真贝酵母cbs12357的萌发细胞和用violet染料染色的酿酒酵母菌株imk439的单倍体细胞的交配与在ypt培养基中交配这些菌株进行比较。通过使用facs对双染色群体进行分选(图2a)并影印接种到选择性培养基上,随时间推移评估杂种的数量。7小时后,发现在ypt和ypd上的两种交配培养物的双染色群体的1%是杂种。在杂交24小时后,在ypd上孵育的双染色群体中的杂种的数量增加到18%,并在30h后保持恒定,而在ypt上交配不会导致杂种数量的增加(图2b)。将无门控分选细胞的完整96孔微量滴定板影印接种到选择性培养基中后,未观察到生长,表明在交配培养物中存在小于0.3%的杂种。这意味着通过使用用于双染色细胞的facs分选的优化方案,对于种间杂种,培养物富集至少70倍(图2c)。这意味着使用facs对细胞进行染色和分选的方法可以适用于富集种间杂种,并且在ypd培养基上交配24
–
30h产生了双染色群体,其中5个中有1个是真正的杂种。
[0109]
无标志物的种间杂种的产生
[0110]
在先前的实验中,通过在选择性培养基上的生长来验证通过facs分选的双染色群体中杂种的存在。然而,具有互补选择性表型的亲本菌株并不总是可用的或适用的。因此,不依赖于亲本菌株中选择性表型存在的筛选方法是优选的。可以通过pcr扩增亲本菌株的物种特异性基因及细胞倍性的评估来鉴定没有选择性表型的杂种[muir等人,2011.fems yeast res 11:552-563;pengelly和wheals,2013.fems yeast res 13:156-161]。然而,这种筛选方法具有有限的通量并且仅对具有高频率杂种的样品有效,使得为了鉴定一种或多种杂种而必须筛选的细胞的数量保持合理。当交配imk439和cbs12357的孢子时,20%的获得的细胞具有对应于杂种表型的表型,因此为了发现杂种,必须筛选约5个细胞。为了测试基于使用真贝酵母和酿酒酵母特异性的引物对的多重pcr筛选推定杂种的可能性,将无标
志物的真贝酵母和酿酒酵母杂交。使用了先前开发的pcr方法,在酿酒酵母基因组dna以及引物8570和8571存在下,产生了150bp的片段,并且在真贝酵母基因组dna以及引物8572和8573存在下,产生了228bp的片段(表3)。因为该pcr不能将杂种与两种物种的混合群体区分开,所以在最初分选的双染色细胞繁殖后实施第二单细胞分选步骤,以确保测试单集落分离物。另外,用dna染色和流式细胞术确定分选细胞的倍性,因为一致倍性表明不存在在没有第二次分选的情况下观察到的混合群体(图1d)。为了确保高筛选通量,设计了多重pcr方案和倍性测定方案,使得筛选可以是自动化的并且可以在96孔微量滴定板中执行。
[0111]
为了测试所提出的产生和筛选无标志物的种间杂种的方法,进行了两次杂交。重复用孢子形成的cbs12357产生种间杂种的先前实验,但用无标志物的实验室菌株cen.pk113-7d(mata)作为酿酒酵母亲本菌株代替遗传修饰的imk439。与此同时,进行两种工业相关菌株之间的杂交,以研究所提出的方法是否也可应用于产生新的潜在工业相关的杂种。工业菌株通常具有更复杂的非整倍体基因组且孢子形成较差,导致比使用实验室菌株的种间杂种观察到的杂交率更低的杂交率[steensels等人,2014.fems microbiol reviews 38:947-995]。将真贝酵母菌株as2.4940(由j.bing友情捐赠[bing等人2014.current biol 24:r380-r381))与酿酒酵母的一种工业上的ale型菌株ale28杂交。两种菌株都是二倍体,因此使用先前讨论的优化方案使它们形成孢子并萌发以获得单倍体配子(图2c)。将cbs12357(真贝酵母,孢子形成的,cfse)与cen.pk113-7d(酿酒酵母,mata,violet)交配,将as2.4940(真贝酵母,孢子化的,cfse)与ale28(酿酒酵母,孢子形成的,violet)交配,并从两种交配培养物中分选双染色群体(图3a)。增殖分选的细胞,并再次分选每个集落的单细胞以获得单细胞分离物。对于cbs12357
×
cen.pk113-7d杂交,获得了22个单细胞分离物,并且对这些分离物的种类的评估显示2个分离物是真正的杂种(imh001&imh002,图3b)。对于as2.4940
×
ale28杂交,获得了34个单细胞分离物,其中5个被鉴定为杂种(imh003-imh007,图3b)。因此,来自cbs12357和cen.pk113-7d之间交配的9%的细胞和来自as2.4940和ale28之间交配的15%的细胞是杂种。通过流式细胞术测定dna含量表明这些杂种是二倍体,除了imh007外,其是非整倍体的(图3c)。双染色群体中的杂种的频率与使用含有遗传标志物的菌株测定的频率在相同范围内,并且通过使用pcr筛选成功地鉴定了杂种,证明了使用本研究中描述的方案鉴定通过种间交配获得的无标志物的杂种的可能性。
[0112]
通过稀有交配产生种间杂种
[0113]
在工业过程中使用的许多杂种是多倍体或非整倍体,并且这种倍性可能有助于这些菌株所表现出的工业相关表型。此类菌株可以通过交配具有较高倍性的菌株来构建。然而,只有相反交配类型的菌株可以相互交配,并且由于二倍体菌株具有交配类型a/α,所以交配只能在自发交配类型转换发生而产生纯合的a/a或α/α交配类型时发生。据报道,这种类型的交配的频率为10-6
至10-8
[gunge和nakatomi,1972.genetics 70:41-58],因此其被称为稀有交配。因为已经显示了本研究中讨论的技术成功地富集了交配细胞的培养物,所以通过在单倍体和二倍体真贝酵母和酿酒酵母菌株之间进行不同的杂交,研究了富集是否足够显著以分离这些极其稀有的交配事件。
[0114]
为了允许容易地测量稀有交配频率,使用菌株imk439作为单倍体酿酒酵母亲本菌株(matαura3δ::kanmx)。为了获得具有使用相同选择性表型的二倍体酿酒酵母染色体组的菌株,通过在用cfse染色的imk439(酿酒酵母,matα)和用新染料远红染色的imk440(酿酒
酵母,mata)之间进行如先前所述的种内交配构建二倍体菌株imx1471。分选双染色细胞,并在过夜孵育后,再次分选来自每个孔的单细胞。使用引物12、13和14(表3)进行pcr以确定分选细胞的交配类型,并测试倍性、孢子形成能力以及尿嘧啶营养缺陷型和kanmx标志物的存在(图6)。一个分离物为mata/matα,其具有二倍体基因组含量,显示出正常的孢子形成效率,并且正确的选择性表型以imx1471(mata/α,ura3δ::kanmx/ura3δ::kanmx)保存,并用作二倍体酿酒酵母亲本菌株。将cbs12357用作真贝酵母亲本菌株,或者用作二倍体,或者在孢子形成和萌发后用作单倍体。
[0115]
在先前的实验中,cfse染色的群体和violet染色的群体的分离是次优的;violet荧光强度相对较低并且与cfse发射的荧光稍微重叠。由于稀有的交配事件具有低频率,因此单染色和双染色群体的清晰分离是必要的。当通过交配cfse和远红染色的亲本菌株构建菌株imx1471时,发现远红染料具有比violet染料更强的荧光信号,导致不同群体的更清晰的分离(图6)。因此,violet染料被远红代替,远红发射光谱的红色部分中的光。用cfse对真贝酵母亲本菌株进行染色,用远红对酿酒酵母亲本菌株进行染色。进行了4种不同的杂交:cbs12357(孢子形成的,1n)
×
imk439(1n)、cbs12357(孢子形成的,1n)
×
imx1471(2n)、cbs12357(2n)
×
imk439(1n)和cbs12357(2n)
×
imx1471(2n)。在交配之前加入edta以防止cfse和远红染色细胞的任何无性聚集[johnson等人,1988.canad j microbiol 34:1105-1107]。通过将固定量的交配培养物接种在sm+g418板上并对集落进行计数来评估杂种细胞在每种交配培养物中的频率。与此同时,通过facs分析交配培养物,分选双染色群体,并将其影印接种到sm+g418上,以确定分选后杂种细胞的频率。为了能够定量杂种细胞的较低频率,用1、10或100个双染色细胞接种孔,并使用泊松统计计算频率。在未分选的单倍体
×
单倍体种间交配培养物中,4
×
105个细胞中约有1个于24h后在选择性培养基中生长,其于168h后增加至3
×
104个中的1个。在来自该培养物的分选的双染色细胞中,发生率增加到平均3
×
102中的1个,其随着时间的推移保持相对恒定,对应于700的平均富集因子(表2)。在二倍体真贝酵母和单倍体酿酒酵母之间的未分选的交配培养物中,于24h后,在选择培养基中接种的细胞未生长,然而,在168h后,杂种细胞的频率增加到4.7
×
106个中多达1个。在来自该培养物的分选的双染色细胞中,发生率增加到平均2.4
×
10-3
中的1个,对应于600的平均富集因子。在单倍体真贝酵母和二倍体酿酒酵母之间的未分选的交配培养物中,约10-7
中的1个在选择性培养基中生长。96h后,用facs分选双染色细胞使杂种细胞的比例提高约550倍,导致杂种细胞的频率为4.3
×
10-4
。对于二倍体
×
二倍体杂交,通过接种所有细胞只能从20
×
107个细胞的库中获得1个杂种,而利用facs分选25,664个细胞没有获得杂种。总之,尽管在单倍体和二倍体菌株之间稀有交配是可能的,但交配的细胞以非常低的频率存在于交配培养物中和双染色的细胞中。由于通过分选双染色细胞获得的杂种细胞的频率比正常交配低得多,因此对于二倍体cbs12357
×
单倍体imk439杂交,需要分选约400个细胞,并且对于其它杂交甚至更多。远红染料和cfse染料可以在显微镜下成像而没有任何光谱重叠,因此每种交配组合的未分选的和双染色细胞在载玻片上进行分选,并使用荧光显微镜检查。在所有四种交配培养物中都观察到双荧光细胞,也在分离很少或没有稀有交配事件的培养物中观察到双荧光细胞(图4)。cfse和远红的荧光通常定位于芽殖细胞或细胞簇的一部分,尽管也观察到一些均一的双荧光细胞,以及均一的单染色细胞。由于酵母出芽和交配不对称地发生,尚不清楚着色剂是如何被传递到子细胞的,因此不能确定这种双荧光是否由交
配时着色剂的交叉(crossover)引起还是具有另一原因。在通常含有单染色细胞的未富集的交配培养物中很少观察到这些双染色事件(图5)。这表明双染色群体的facs分选确实富集了双染色细胞,尽管并非所有这些细胞都是有活力的杂种。
[0116]
[0117]
[0118]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1