用靶向APO(A)的经缀合的反义化合物降低心血管事件的风险的方法与流程
相关申请的交叉引用
本申请要求2018年11月9日提交的美国临时申请号62/758,323和2019年7月15日提交的美国临时申请号62/874,459的权益和优先权,将其全部内容通过引用以其整体并入本文。
本披露涉及用靶向apo(a)的经缀合的反义化合物降低心血管事件的风险的方法。具体地,涉及在患有确诊的心血管疾病的患者中,用经缀合的反义化合物isis681257或其盐降低心血管事件的风险的方法。
背景技术:
反义技术背后的原理是反义化合物与靶核酸杂交并调节所述靶核酸的量、活性和/或功能。例如,在某些情况下,反义化合物导致靶转录或翻译改变。这样的表达调节可以通过例如靶rna降解或基于占有的抑制来实现。通过降解来调节rna靶功能的一个实例是与dna样反义化合物杂交后靶rna的基于rna酶h的降解。通过靶降解来调节基因表达的另一个实例是rna干扰(rnai)。rnai是指通过利用rna诱导的沉默复合物(risc)的机制进行的反义介导的基因沉默。rna靶功能调节的另一个实例是通过基于占有的机制,例如微小rna天然采用的机制。微小rna是小的非编码rna,其调节编码蛋白质的rna的表达。反义化合物与微小rna的结合阻止了微小rna与其信使rna靶的结合,从而干扰了微小rna的功能。微小rna模拟物可以增强天然微小rna功能。某些反义化合物改变前mrna的剪接。不管具体机制如何,序列特异性都使反义化合物作为靶标验证和基因功能化的工具以及选择性调节参与疾病发病机理的基因表达的治疗方法而具有吸引力。
反义技术是调节一种或多种特定基因产物表达的有效手段,并且可以因此证明在许多治疗性、诊断性和研究应用中具有独特的用途。可以将经化学修饰的核苷掺入反义化合物中以增强一种或多种性质,例如核酸酶抗性、药代动力学或对靶核酸的亲和力。在1998年,反义化合物,
新的化学修饰提高了反义化合物的效力和功效,揭示了口服递送的潜力以及增强了皮下施用,减少了产生副作用的可能性,并导致对患者的便利性的改善。增加反义化合物效力的化学修饰允许施用较低剂量,从而降低了毒性的可能性,以及减少了治疗的总成本。增强抗降解的修饰导致从体内更慢的清除,从而允许更少频繁的给药。可以将不同类型的化学修饰组合在一种化合物中,以进一步优化所述化合物的功效。
脂蛋白是球形的,微团样的颗粒,由酰基甘油和胆固醇酯的非极性核心组成,周围包裹有蛋白质、磷脂和胆固醇的两亲性涂层。脂蛋白根据其功能和物理特性被分为五大类:乳糜微粒、极低密度脂蛋白(vldl)、中等密度脂蛋白(idl)、低密度脂蛋白(ldl)和高密度脂蛋白(hdl)。乳糜微粒将饮食脂质从肠运输到组织。vldl、idl和ldl都将甘油三酯和胆固醇从肝运输到组织。hdl将内源性胆固醇从组织运输到肝。
脂蛋白颗粒经历连续的代谢过程,并具有可变的性质和组成。脂蛋白密度在不增加颗粒直径的情况下增加,因为它们的外涂层的密度小于内核心的密度。脂蛋白的蛋白质组分被称为载脂蛋白。至少九种载脂蛋白大量分布在不同的人类脂蛋白中。
脂蛋白(a)[lp(a)]颗粒是在近50年前发现的,并且由高度独特的ldl颗粒组成,其中一种载脂蛋白b(apob)蛋白经由二硫键与单个载脂蛋白(a)[apo(a)]蛋白连接。所述apo(a)蛋白共享高度的同源性,其中纤溶酶原特别地在kringleiv2型重复结构域内。循环的lp(a)的水平与分子中存在的kringleiv2型可变重复序列的数量成反比,并且由于两个等位基因在个体内共表达,因此可以显示杂合的血浆同种型谱(kraft等人,eurjhum.genet[欧洲人类遗传学杂志],1996;4(2):74-87)。据认为,apo(a)中的该kringle重复结构域可能是其血栓前期和抗纤维蛋白溶解特性的原因,潜在地增强动脉粥样硬化的进展。
apo(a)受il-6转录调控,并且在接受il-6抑制剂(托珠单抗)治疗的类风湿性关节炎患者的研究中,治疗3个月后血浆水平降低了30%(schultz等人,plosone[公共科学图书馆综合]2010;5:el4328)。
已显示apo(a)优先结合氧化的磷脂并增强血管炎症(bergmark等人,jlipidres[脂质研究杂志]2008;49:2230-2239;tsimikas等人,circulation[循环].2009;119(13):1711-1719)。
此外,研究表明lp(a)颗粒还可以刺激内皮通透性,诱导纤溶酶原激活物抑制剂i型表达,并激活巨噬细胞白细胞介素-8分泌(koschinsky和marcovina,curr.opin.lipidol[脂质学的最新观点]2004;15:167-174)。重要地,最近的基因关联研究表明lp(a)是心肌梗死、中风、外周血管疾病和腹主动脉动脉瘤的独立的风险因素(rifai等人,clin.chem.[临床化学]2004;50:1364-71;erqou等人,jama2009;302:412-23;kamstrup等人,circulation[循环]2008;1l7:176-84)。此外,在近期的早发性冠状动脉疾病(procardis)研究中,clarke等人(clarke等人,nejm(2009)361;2518-2528)描述了冠心病与血浆lp(a)浓度之间的稳固且独立的关联。另外,solfrizzi等人指出血清lp(a)的增加可能与阿尔茨海默氏病(ad)的风险增加有关(solfrizzi等人,jneuralneurosurgpsychiatry[神经外科精神病学杂志]2002,72:732-736)。当前,在临床环境下,用于治疗心血管疾病的间接apo(a)抑制剂的实例包括阿司匹林、烟酸缓释片(niaspan)、米泊美生、安塞曲匹、依必洛美和洛米他肽,所述抑制剂使血浆lp(a)水平分别降低了18%、39%、32%、36%、43%和17%。另外,lp(a)单采已在临床中使用以降低含有lp(a)颗粒的apo(a)。
迄今为止,通过直接靶向apo(a)水平来治疗心血管疾病的治疗性策略受到限制。已经开发了核糖酶寡核苷酸(美国专利5,877,022)和反义寡核苷酸(wo2005/000201;wo2003/014397;w02013/177468;us20040242516;美国专利号8,138,328、8,673,632和7,259,150;merki等人,jamcollcardiol[美国心脏病学会杂志]2011;57:1611-1621;将每个出版物通过引用以其整体并入),但没有一个被批准用于商业用途。
tsimikas等人(lancet.[柳叶刀]2015年10月10日;386:1472-83)披露了使用靶向人类apo(a)的反义化合物:isis494372(还称为isis-apo(a)rx)的随机、双盲、安慰剂对照的1期研究的结果。
在体内用于改善rna酶h依赖性(gapmer)反义化合物(包括靶向apo(a)的化合物)的活性的一种化学修饰与缀合物基团(例如galnac簇)缀合。已显示与缀合物基团的缀合可改善非人类受试者体内的效力,例如在wo2014/179620中披露的,包括使用与galnac簇缀合的rna酶h依赖性(gapmer)反义化合物。在本发明之前,尚未在人类中测试与galnac簇缀合的rna酶h依赖性(gapmer)反义化合物,以实现靶标降低。
wo2014/179625披露了与靶向apo(a)的galnac簇缀合的反义化合物(包括isis681257)。
化合物代码“isis681257”是指有以下结构的化合物,代码isis681257包括化合物及其盐:
下图是isis681257的盐的实例:
isis681257包含经修饰的寡核苷酸,所述寡核苷酸具有核碱基序列tgctccgttggtgcttgttc(seqidno.:1)、5-10-5gapmer基序和galnac缀合物。
wo2017/079739披露了按某些剂量且以某些给药方案使用isis681257的治疗方法。wo2017/079739披露了当向人类施用时,就其效力和其作用的持续时间而言,isis681257在调低apo(a)mrna和血浆lp(a)水平方面特别有效。特别地,与具有相同核碱基序列和相同5-10-5gapmer基序,但缺少galnac缀合物,即isis494372的经修饰的寡核苷酸相比,isis681257在人类中显示>30倍的增加。据披露,isis681257提供了对apo(a)mra和血浆lp(a)的有效降低,并能够按每周一次、每月一次、每两个月一次或每三个月一次有效给药。
然而,仍然存在对于使用isis681257来有效和选择性地降低人体内apo(a)水平,同时使患者在最佳施用方案下仅接受最低所需剂量的最佳治疗方法的未满足的医疗需求(包括在由于长期升高的血浆lp(a)水平而处于增强的心血管事件风险中的患者中)。这种最佳治疗的优点包括例如降低的治疗成本、改善的患者依从性、施用的药物产品量的降低和/或通过较低剂量的施用方案可能降低潜在不良事件的风险。
技术实现要素:
本披露涉及在患有确诊的心血管疾病的患者中降低心血管事件的风险的方法,所述方法包括按某种剂量以某种给药间隔向所述患者施用寡聚化合物isis681257。
使用isis681257的2b期试验(临床试验nct03070782)显示所述化合物显著地降低患有确诊的心血管疾病(cvd)的患者中的lp(a)水平和升高脂蛋白(a)水平,具有良好的安全性和耐受性特征。
2期研究被设计为用于评估isis681257的安全性和耐受性,并为计划的3期心血管结果研究确定合适的剂量。随机分配、双盲、安慰剂对照的、剂量变化的2期研究包括286名患有确诊的cvd并且具有高lp(a)水平(大约100mg/dl[250nmol/l]-正常上限三倍的基线平均值)的患者。
该试验有五个群组:20mg(每4周)、40mg(每4周)、60(每4周)、20mg(每2周)和20mg(每周)。
与安慰剂相比,主要功效终点是在主要分析时间点(6个月)处与基线相比lp(a)的百分比变化。
次要功效终点是ldl-c、apob、oxpl-apob、oxpl-apo(a)的平均百分比变化,以及达到<125nmol/l(<50mg/dl)或<75nmol/l(<30mg/dl)的预定阈值的患者数量。
所有患者被治疗持续至少六个月,其中一些患者被治疗长达一年。
该研究满足在6个月时分析的主要和次要功效终点。
研究结果显示,在lp(a)水平方面与基线相比统计学上显著的和剂量依赖性降低:
*lsmean:最小二乘均数
·20mg每周群组中大约98%的患者和60mg每4周群组中大约81%的患者实现lp(a)水平的临床上显著的降低,使它们降至建议的cvd事件风险阈值以下(<50mg/dl)。
·用isis681257进行的治疗与ldl-c、apob、oxpl-apob、oxpl-apo(a)的减少有关。
·大多数不良事件是轻微的。最频繁的不良事件是注射部位反应(isr)。isr发生在26%的患者中,并且大多数为轻度,并且一名患者因isr而停药。
·不存在对与血小板计数、肝功能或肾功能相关的安全性的担心。
·研究中没有患者经历低于100,000/mm3的确认的血小板计数。在活动组(10.5%)和安慰剂组(14.9%)之间,低于正常(140,000/mm3)的血小板水平的发病率是相当的。
·大约90%的患者完成了治疗,并且在活动组(12.1%)和安慰剂组(14.9%)之间的停药率相当。
这些数据表明,由于lp(a)水平升高,isis681257显著降低患有预先存在的心血管疾病的患者中的lp(a)。isis681257是第一种也是唯一一种显示在患有这种遗传病症的患者中在临床上显著降低lp(a)水平并具有良好的安全性和耐受性特征的药物。
基于这些结果,选择isis681257的新的75mg至85mg(例如80mg)剂量,以提供具有可接受的安全性特征的最大功效。该剂量的每月一次的方案将减少对与更频繁给药相关的患者的总负担,并将提供更好的局部耐受性。
在2b期研究中评估的最大剂量为20mg,每周一次(qw)(总月暴露为80mg)。预期80mg每月一次(qm)的剂量将提供与20mgqw方案相似的功效,因为每月的总体暴露量是相当的。这得到了在40mgq4w和20mgq2w剂量下观察到的在isis681257的功效方面的相似性的支持。这些方案之间的总暴露量和lp(a)的降低相似;因此,据信isis681257的每月总暴露量是该药物功效的原因。关于安全性,相对于安慰剂,在从20mg/月至20mg/周的剂量范围下,在人体任何安全性信号中均不存在isis681257相关的变化(相当于80mg/月;从260至1040mg的总剂量范围)。
因此,在第一方面,本披露涉及在患有确诊的心血管疾病的患者中降低心血管事件的风险的方法,所述方法包括向所述患者通过皮下注射向所述患者每月或每四周一次施用包含约75mg至约85mg化合物isis681257(所述化合物本身或其盐)的单位剂量,其中在第一次施用所述化合物的时间之前所述患者的血浆lp(a)浓度大于或等于70mg/dl。
这种新的治疗方案用每月一次或每四周一次,降低剂量的仅75mg至约85mg的化合物isis681257,已经显示提供具有可接受的安全性特征的最大功效。所述每月一次的方案还减少对与更频繁给药相关的患者的总负担,并且提供了更好的局部耐受性。
该给药时间表是令人惊讶的,因为在2b期研究中评估的最大剂量为20mg,每周一次(qw)(等于总月暴露量为80mg)。现在描述的80mg每月一次(qm)剂量提供了与20mgqw方案类似的功效。不一定可以预期每月的总暴露量是相当的,但是得到了在40mgq4w和20mgq2w剂量下观察到的在化合物功效方面的相似性的支持。2b期研究表明,这些方案之间的总暴露量和lp(a)的降低相似;因此,据信所述化合物的每月总暴露量是该药物功效的原因。然后,该每月总暴露量可将注射频率降低为每月一次,而不是每周一次。
这种新的治疗方案在治疗人类方面提供了一个或多个非常显著的改进,例如降低的治疗成本、改善的患者依从性、施用的药物产品量的降低和/或通过较低剂量的施用方案可能降低潜在不良事件的风险。
本披露提供了以下非限制性实施例:
在一些实施例中,所述心血管事件选自重大不良心血管事件(mace)、全因死亡(任何原因导致的死亡)、冠心病(chd)死亡、急性心肌梗死(ami)死亡、心力衰竭(hf)死亡、由心脏手术的直接并发症导致的死亡和因缺血而进行的紧急下肢血运重建或截肢。
在一些实施例中,所述重大不良心血管事件(mace)选自心血管(cv)死亡、非致命性心肌梗死、非致命性中风和需要住院的紧急冠状动脉血运重建。在另一个实施例中,所述重大不良心血管事件(mace)是心血管(cv)死亡。在又另一个实施例中,所述重大不良心血管事件(mace)是非致命性心肌梗死。在另一个实施例中,所述重大不良心血管事件(mace)是非致命性中风。在又另一个实施例中,所述重大不良心血管事件(mace)是需要住院的紧急冠状动脉血运重建。
在一些实施例中,所述心血管事件选自全因死亡(任何原因导致的死亡)、冠心病(chd)死亡、急性心肌梗死(ami)死亡、心力衰竭(hf)死亡、由心脏手术的直接并发症导致的死亡和因缺血而进行的紧急下肢血运重建或截肢。
在一个实施例中,所述心血管事件是全因死亡(任何原因导致的死亡)。
在另一个实施例中,所述心血管事件是冠心病(chd)死亡。在一个实施例中,所述冠心病(chd)死亡包括急性心肌梗死(ami)死亡、心力衰竭(hf)死亡和由心脏手术的直接并发症导致的死亡。
在另一个实施例中,所述心血管事件是因缺血而进行的紧急下肢血运重建或截肢。
在一些实施例中,所述患有确诊的心血管疾病的患者是具有以下至少一项的患者:(i)自发性心肌梗死病史;(i)缺血性中风病史;和(iii)临床上显著的症状性外周动脉疾病。
在一个实施例中,所述自发性心肌梗死的病史发生在第一次施用所述化合物的时间之前≥3个月和≤10年。
在一个实施例中,所述缺血性中风的病史发生在第一次施用所述化合物的时间之前≥3个月和≤10年。
在一个实施例中,所述缺血性中风的病史是由中枢神经系统组织梗塞引起的局灶性脑、脊髓或视网膜功能障碍的急性发作。
在一个实施例中,所述临床上显著的症状性外周动脉疾病由具有以下至少一项的间歇性跛行证实:(i)踝肱指数≤0.90;和(ii)归因于下肢缺血的下肢截肢或血运重建。
在一些实施例中,在第一次施用所述化合物的时间之前,所述患者的血浆lp(a)浓度≥90mg/dl。
在一些实施例中,所述单位剂量包含75mg至85mg的所述化合物。
在一个实施例中,所述单位剂量包含约80mg的所述化合物。在另一个实施例中,所述单位剂量包含不超过80mg的所述化合物。在又另一个实施例中,所述单位剂量包含80mg的所述化合物。
在一些实施例中,将所述化合物配制在无菌液体中,并且其中每个单位剂量的所述化合物不包含超过1ml的所述无菌液体。
在一个实施例中,每个单位剂量的所述化合物不包含超过0.8ml的所述无菌液体。在另一个实施例中,每个单位剂量的所述化合物不包含超过0.5ml的所述无菌液体。在又另一个实施例中,每个单位剂量的所述化合物不包含超过0.4ml的所述无菌液体。在另一个实施例中,每个单位剂量的所述化合物不包含不超过0.25ml的所述无菌液体。在又另一个实施例中,每个单位剂量的所述化合物不包含不超过0.2ml的所述无菌液体。
在一个实施例中,所述无菌液体是水。在另一个实施例中,所述无菌液体是含有磷酸钠缓冲液的水。在又另一个实施例中,所述无菌液体是含有磷酸钠缓冲液和氯化钠的水。
在一些实施例中,在用化合物对患者给药的时期(给药期)的开始和结束时测量所述患者的血浆lp(a)浓度时,所述患者的平均/中值血浆lp(a)浓度降低了至少50%。在另一个实施例中,当在所述给药期的开始和结束时测量所述患者的血浆lp(a)浓度时,所述患者的平均/中值血浆lp(a)浓度降低了至少60%。在又另一个实施例中,当在所述给药期的开始和结束时测量所述患者的血浆lp(a)浓度时,所述患者的平均/中值血浆lp(a)浓度降低了至少70%。在另一个实施例中,当在所述给药期的开始和结束时测量所述患者的血浆lp(a)浓度时,所述患者的平均/中值血浆lp(a)浓度降低了至少75%。
在一些实施例中,与未施用所述化合物的患者相比,在所述给药期结束时,所述患者经历重大不良心血管事件(mace)的总体风险降低了统计学上显著的量。
在其他实施例中,与未施用所述化合物的患者相比,在所述给药期结束时,所述患者经历以下事件之一的总体风险降低了统计学上显著的量:(i)心血管(cv)死亡、非致命性mi和非致命性中风的综合;(ii)冠心病(chd)死亡、非致命性mi和需要住院的紧急冠状动脉血运重建的综合;(iii)冠心病(chd)死亡、非致命性mi、需要住院的紧急冠状动脉血运重建和因缺血而进行的紧急下肢血运重建或截肢的综合;和(iv)全因死亡的比率。
在其他实施例中,与未施用所述化合物的患者相比,在所述给药期结束时,所述患者经历以下事件之一的总体风险降低了统计学上显著的量,并且其中在第一次施用所述化合物的时间之前所述患者的血浆lp(a)浓度≥90mg/dl:(i)全因死亡率、非致命性mi和非致命性中风的综合;(ii)总血管事件的综合:cv死亡、非致命性mi、非致命性中风、需要住院的紧急冠状动脉血运重建和因缺血而进行的紧急下肢血运重建或截肢;(iii)全因死亡率、非致命性mi、非致命性中风和需要住院的紧急冠状动脉血运重建的综合;(iv)致命性和非致命性中风的综合;(v)在有外周动脉疾病(pad)病史的患者中重大不良肢体事件(male)的比率;(vi)不稳定型心绞痛的住院率;和(vii)心力衰竭的住院率。
在一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,针对任一个事件,相对风险降低率(即,降低总体风险的统计学上显著的相对量)为至少15%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,针对任一个事件,相对风险降低率(即,降低总体风险的统计学上显著的相对量)为(i)至少15%,优选地至少20%,更优选地至少25%;(ii)对于在第一次施用所述化合物的时间之前,血浆lp(a)浓度大于或等于90mg/dl的患者,为至少20%,优选地至少25%,更优选地至少30%。
在以上实施例的一个实施例中,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)(i)对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,为至少2.0%,优选地至少2.5%;(ii)对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,为至少3.0%,优选地至少3.5%。
在其他实施例中,与未施用所述化合物的患者相比,在所述给药期结束时,所述患者在以下事件或特征中的任一项中显示出统计学上显著的量的改善,并且其中在第一次施用所述化合物的时间之前所述患者的血浆lp(a)浓度≥90mg/dl:(i)在选自治疗开始后1、2、3、4、5、6、9、12、13、15、18、21、24和27个月的指定时间点处与基线相比的lp(a)的变化(以mg/dl和nmol/l计);(ii)扩展的脂质特征参数(总胆固醇、ldl-c、apob、hdl-c、非hdl-c、甘油三酯)和hscrp的变化;(iii)新发2型糖尿病的发病率;(iv)由sf-12调查表评估的生活质量;和(v)到主动脉瓣置换术(开放或经导管)或主动脉瓣狭窄住院首次发生的时间。
在其一个实施例中,针对任一个事件或特征,相对改善率(即,改善事件或特征的统计学上显著的相对量)为至少15%。
在一些实施例中,所述给药期为至少六个月。在另一个实施例中,所述给药期为至少一年。在又另一个实施例中,所述给药期为至少两年。在另一个实施例中,所述给药期为至少三年。
在一些实施例中,所述患者接受背景疗法以达到指南定义的目标低密度脂蛋白胆固醇(ldl-胆固醇)水平。
在一些实施例中,所述背景疗法包括以下的至少一项:(i)他汀、(ii)依折麦布和(iii)pcsk9抑制剂。
在一个实施例中,所述背景疗法包括他汀,并且所述患者在第一次施用化合物之前接受最佳剂量的他汀。
在一些实施例中,所述患者具有低于180mmhg的静坐收缩压(sbp)和/或低于110mmhg的舒张bp(dbp)。
在一些实施例中,所述患者在第一次施用所述化合物的时间之前的三个月的时期内未用烟酸治疗。
在一些实施例中,在第一次施用所述化合物时,所述患者为被诊断为患有心力衰竭纽约心脏协会(nyha)iv类。
在一些实施例中,在第一次施用所述化合物的时间之前,所述患者没有出血性中风或其他大出血的病史。
在一些实施例中,在第一次施用所述化合物的时间的3个月内,所述患者未患有心肌梗死、中风、冠状动脉或下肢血运重建、重大心脏或非心脏手术、或脂蛋白单采。
在一些实施例中,所述患者未患有已知的活动性感染或重大血液学、肾、代谢性、胃肠道或内分泌功能障碍。
在一些实施例中,在第一次施用所述化合物的时间之前,所述患者具有大于30ml/min/1.73m2的估计肾小球滤过率(egfr)。
在一些实施例中,在第一次施用所述化合物的时间之前,所述患者不具有小于30ml/min/1.73m2的估计肾小球滤过率(egfr)。
在一些实施例中,所述患者未患有活动性肝病或肝功能障碍,定义为在第一次施用所述化合物的时间之前天冬氨酸氨基转移酶(ast)或丙氨酸氨基转移酶(alt)血清水平是正常上限(uln)的2倍。
在一些实施例中,在第一次施用所述化合物的时间之前,所述患者不具有正常上限(uln)1.5倍的总胆红素。
本披露提供了包括向有需要的患者施用isis681257的方法。在某些实施例中,有需要的患者是具有升高的apo(a)水平的人类,例如apo(a)水平≥30mg/dl、≥35mg/dl、≥40mg/dl、≥50mg/dl、≥60mg/dl、≥70mg/dl、≥80mg/dl、≥90mg/dl、≥100mg/dl、≥110mg/dl、≥120mg/dl、≥130mg/dl、≥140mg/dl、≥150mg/dl、≥160mg/dl、≥170mg/dl、≥175mg/dl、≥180mg/dl、≥190mg/dl或≥200mg/dl的人类。lp(a)也可以用纳摩尔/升表示。例如,具有≥75纳摩尔/升(nmol/l)或≥30mg/dl的人类受试者将被视为处于一个或多个心血管事件的风险中。
除非另外定义,否则本文所用的所有技术术语和科学术语均具有与本披露内容所属领域的普通技术人员通常所理解的相同的含义。在本说明书中,单数形式还包括复数,除非上下文另有明确地说明。虽然与本文所述的那些方法和材料类似或等同的方法和材料可以用于本披露的实践和测试,但是以下描述合适的方法和材料。本文所提到的所有出版物、专利申请、专利和其他参考文献均通过引用并入。本文引用的参考文献不被视为要求保护的披露的现有技术。在冲突的情况下,则以包括定义在内的本说明书为准。此外,材料、方法和实例仅是说明性的而不旨在限制。
本披露的其他特征和优点从以下详细说明和权利要求书将是清楚的。
附图说明
图1提供了对研究设计的总结
图2描绘了针对患者的他汀治疗方案。
图3描绘了主要和次要终点的检验过程。
具体实施方式
本披露涉及在患有确诊的心血管疾病的患者中降低心血管事件的风险的方法,所述方法包括以某些特定的限制向所述患者施用寡聚化合物isis681257。
本披露的细节陈述于下文所附的说明书中。虽然与本文所述的那些方法和材料类似或等同的方法和材料可以用于本披露的实践或测试,但是现在描述说明性方法和材料。根据说明书并且根据权利要求书,本披露的其他特征、目标和优点将是清楚的。在本说明书和所附权利要求书中,单数形式还包括复数,除非上下文另有明确地说明。除非另外定义,否则本文所用的全部技术和科学术语具有与本披露所属领域的普通技术人员通常所理解的相同的意义。在本说明书中引证的所有专利以及公开文件均通过引用以其整体并入本文。
使用的术语和惯例的定义
除非提供了具体的定义,否则与本文所述的分析化学、合成有机化学以及医学化学和药物化学结合使用的命名法及其实验室程序和技术是本领域中众所周知并且常用的那些。标准技术可用于化学合成和化学分析。某些此类技术和程序可以在例如"carbohydratemodificationsinantisenseresearch[反义研究中的碳水化合物修饰]",由sangvi和cook编辑,americanchemicalsociety[美国化学学会],华盛顿特区(washingtond.c.),1994;"remington'spharmaceuticalsciences[雷明顿制药科学],"mackpublishingco.[麦克出版社公司],伊斯顿,宾夕法尼亚州(easton,pa.),第21版,2005;和"antisensedrugtechnology,principles,strategies,andapplications[反义药物技术、原理、策略和应用]"由stanleyt.crooke编辑,crcpress[crc出版社],博卡拉顿,佛罗里达州(bocaraton,florida);和sambrook等人,"molecularcloning,alaboratorymanual[分子克隆,实验室手册],"第2版,coldspringharborlaboratorypress[冷泉港实验室出版社],1989中发现,将所述文献出于任何目的通过引用特此并入。在允许的情况下,贯穿本披露引用的所有专利、申请、公开的申请和其他出版物以及其他数据和其他数据均通过引用以其整体并入本文。
除非另有说明,否则以下术语具有以下含义:
如本文所用,“给药期”是指在人类受试者接收第一剂量与所述人类受试者接收最终剂量之间的时期。设想在给药期结束之后可以继续向所述患者给药,使得在第一个给药期之后是一个或多个另外的给药期,在此期间使用相同的或不同给药方案。例如,人类受试者可以在第一给药期中接受6个剂量,其中将第一剂量和最后剂量相隔4周给出。随后,人类受试者然后可以开始第二给药期,其中所述人类受试者以规则的间隔(例如,一个单位剂量/周、一个单位剂量/月或一个单位剂量/季度)接受剂量。
如本文所用,术语“单位剂量”是指按特定时间点向人类施用的寡聚化合物的特定量(例如,以单次皮下注射向人类施用的寡聚化合物的特定量)。如本文所述,每个单位剂量形成多剂量方案的一部分。
如本文所用,术语“单位剂型”是指其中每种单位剂量被呈现用于施用的物理形式。
如本文所用,术语“无菌液体”是指适合用于向人类受试者施用的液体。在某些实施例中,无菌液体包括基本上不含活的微生物或细菌的液体。在某些实施例中,无菌液体包含usp级水或usp级盐水。
如本文所用,“核苷”是指包含核碱基部分和糖部分的化合物。核苷包括但不限于天然存在的核苷(如在dna和rna中发现)和经修饰的核苷。可以将核苷与磷酸酯部分连接。
如本文所用,“化学修饰”是指与天然存在的对应物相比时,化合物中的化学差异。寡核苷酸的化学修饰包括核苷修饰(包括糖部分修饰和核碱基修饰)和核苷间键修饰。关于寡核苷酸,化学修饰不包括仅在核碱基序列中的差异。
如本文所用,“呋喃糖基”是指包含5元环的结构,所述5元环包含四个碳原子和一个氧原子。
如本文所用,“天然存在的糖部分”是指如在天然存在的rna中发现的核糖呋喃糖基或如在天然存在的dna中发现的脱氧核糖呋喃糖基。
如本文所用,“糖部分”是指核苷的天然存在的糖部分或经修饰的糖部分。
如本文所用,“经修饰的糖部分”是指取代的糖部分或糖替代物。
如本文所用,“取代的糖部分”是指不是天然存在的糖部分的呋喃糖基。取代的糖部分包括但不限于包含在2'-位置、3'-位置、5'-位置和/或4'-位置处的取代基的呋喃糖基。某些取代的糖部分是二环糖部分。
如本文所用,“2'-取代的糖部分”是指包含在2'-位置处除h或oh之外的取代基的呋喃糖基。除非另有说明,2'-取代的糖部分不是二环糖部分(即,2'-取代的糖部分的2'-取代基不形成与呋喃糖基环的另一个原子的桥)。
如本文所用,“moe”是指-och2ch2och3。
如本文所用,“核酸”是指由单体核苷酸组成的分子。核酸包括核糖核酸(rna)、脱氧核糖核酸(dna)、单链核酸(ssdna)、双链核酸(dsdna)、小干扰核糖核酸(sirna)和微小rna(mirna)。核酸还可以包含在单个分子中的这些元件的任何组合。
如本文所用,“核苷酸”是指进一步包含磷酸酯连接基团的核苷。如本文所用,“连接的核苷”可以通过或可以不通过磷酸酯键连接的,并因此包括但不限于“连接的核苷酸”。如本文所用,“连接的核苷”是以连续序列连接的核苷(即,在连接的核苷之间不存在另外的核苷)。
如本文所用,“核碱基”是指可以与糖部分连接以产生能够掺入寡核苷酸中的核苷的一组原子,并且其中所述一组原子能够与互补的另一寡核苷酸或核酸的天然存在的核碱基结合。核碱基可以是天然存在的或可以是修饰的。如本文所用,“核碱基序列”是指独立于任何糖、键或核碱基修饰的连续核碱基的顺序。
如本文所用,术语“未经修饰的核碱基”或“天然存在的核碱基”是指天然存在的rna或dna的杂环核碱基:嘌呤碱基腺嘌呤(a)和鸟嘌呤(g),和嘧啶碱基胸腺嘧啶(t)、胞嘧啶(c)(包括5-甲基c)和尿嘧啶(u)。
如本文所用,“经修饰的核碱基”是指非天然存在的核碱基的任何核碱基。
如本文所用,“经修饰的核苷”是指与天然存在的rna或dna核苷相比,包含至少一种化学修饰的核苷。经修饰的核苷包含经修饰的糖部分和/或经修饰的核碱基。
如本文所用,“2'-取代的核苷”是指在2'-位置处包含除h或oh之外的取代基的核苷。除非另有说明,2'-取代的核苷不是二环核苷。
如本文所用,“脱氧核苷”是指如在天然存在的脱氧核糖核苷(dna)中发现的,包含2'-h呋喃糖基糖部分的核苷。在某些实施例中,2'-脱氧核苷可以包含经修饰的核碱基或可以包含rna核碱基(例如尿嘧啶)。
如本文所用,“寡核苷酸”是指包含多个连接的核苷的化合物。在某些实施例中,寡核苷酸包含一个或多个未经修饰的核糖核苷(rna)和/或未经修饰的脱氧核糖核苷(dna)和/或一个或多个经修饰的核苷。
如本文所用,“寡核苷”是指其中核苷间键均不包含磷原子的寡核苷酸。如本文所用,寡核苷酸包括寡核苷。
如本文所用,“经修饰的寡核苷酸”是指包含至少一个经修饰的核苷和/或至少一个经修饰的核苷间键的寡核苷酸。
如本文所用,“键”或“连接基团”是指将两个或更多个组的原子连接在一起的一组原子。
如本文所用,“核苷间键”是指寡核苷酸中邻近核苷之间的共价键合。
如本文所用,“天然存在的核苷间键”是指3'到5'磷酸二酯键。
如本文所用,“经修饰的核苷间键”是指除天然存在的核苷间键之外的任何核苷间键。
如本文所用,“末端核苷间键”是指寡核苷酸或其限定区域的最后两个核苷之间的键合。
如本文所用,“磷连接基团”是指包含磷原子的连接基团。磷连接基团包括但不限于具有以下式的基因:
其中:
ra和rd各自独立地是o、s、ch2、nh或nj1,其中j1是c1-c6烷基或取代的c1-c6烷基;
rb是o或s;并且
rc是oh、sh、c1-c6烷基、取代的c1-c6烷基、c1-c6烷氧基、取代的c1-c6烷氧基、氨基或取代的氨基。
磷连接基团包括但不限于磷酸二酯、硫代磷酸酯、二硫代磷酸酯、膦酸酯、氨基磷酸、硫代氨基磷酸酯、硫代烷基膦酸酯、磷酸三酯、硫代烷基磷酸三酯和硼酸磷酸酯。
如本文所用,“核苷间磷连接基团”是指直接连接两个核苷的磷连接基团。
如本文所用,“非核苷间磷连接基团”是指不直接连接两个核苷的磷连接基团。在某些实施例中,非核苷间磷连接基团将核苷与除核苷之外的基团连接。在某些实施例中,非核苷间磷连接基团连接两个基团,所述两个基团均不是核苷。
如本文所用,“中性连接基团”是指不带电荷的连接基团。中性连接基团包括但不限于磷酸三酯、甲基膦酸酯、mmi(-ch2-n(ch3)-o-)、酰胺-3(-ch2-c(=o)-n(h)-)、酰胺-4(-ch2-n(h)-c(=o)-)、甲缩醛(-o-ch2-o-)和硫代甲缩醛(-s-ch2-o-)。另外的中性连接基团包括非离子键,所述非离子键包含硅氧烷(二烷基硅氧烷)、羧酸酯、羧酰胺、硫化物、磺酸酯和酰胺(参见,例如carbohydratemodificationsinantisenseresearch[反义研究中的碳水化合物修饰];y.s.sanghvi和p.d.cook编辑.acssymposiumseries[acs研讨会系列]580;第3章和第4章(第40-65页))。另外的中性连接基团包括非离子键,所述非离子键包含混合的n、o、s和ch2组成部分。
如本文所用,“核苷间中性连接基团”是指直接连接两个核苷的中性连接基团。
如本文所用,“寡聚化合物”是指包含两个或更多个亚结构的聚合物结构。在某些实施例中,寡聚化合物包含寡核苷酸。在某些实施例中,寡聚化合物包含一个或多个缀合物基团和/或末端的基团。在某些实施例中,寡聚化合物由寡核苷酸组成。寡聚化合物还包括天然存在的核酸。在某些实施例中,寡聚化合物包含一个或多个连接的单体亚基的骨架,其中每个连接的单体亚基直接或间接地附接至杂环碱基部分。在某些实施例中,寡聚化合物还可以包含不与杂环碱基部分连接的单体亚基,从而提供脱碱基位点。在某些实施例中,连接单体亚基、糖部分或替代物和杂环碱基部分的键可以被独立地修饰。在某些实施例中,可以包含或可以不包含杂环碱基的键-糖单元可以被模拟物(例如肽核酸中的单体)取代。
如本文所用,“末端的基团”是指附接至寡核苷酸的3'末端或5'末端中的一个或两个的一个或多个原子。在某些实施例中,末端的基团是缀合物基团。在某些实施例中,末端的基团包含一个或多个末端的基团核苷。
如本文所用,“缀合物”或“缀合物基团”是指与寡核苷酸或寡聚化合物结合的原或一组原子。通常,缀合物基团修饰它们所附接的化合物的一种或多种性质,包括但不限于药效学、药代动力学、结合、吸收、细胞分布、细胞摄取、电荷和/或清除性质。
如本文所用,在缀合物基团的上下文中“缀合物接头”或“接头”是指包含任何原子或一组原子,并且将(1)寡核苷酸与缀合物基团的另一个部分或(2)缀合物基团的两个或更多个部分共价连接的缀合物基团。
缀合物基团在本文中显示为基团,提供用于形成与寡聚化合物(例如反义寡核苷酸)的共价附接的键。在某些实施例中,寡聚化合物上的附接点是寡聚化合物3'末端核苷的3'-羟基基团的3'-氧原子。在某些实施例中,寡聚化合物上的附接点是寡聚化合物5'末端核苷的5'-羟基基团的5'-氧原子。在某些实施例中,用于形成与寡聚化合物附接的键是可切割的键。在某些这样的实施例中,这种可切割的键构成可切割部分的全部或部分。
在某些实施例中,缀合物基团包含可切割的部分(例如可切割的键或可切割的核苷)和碳水化合物簇部分(例如galnac簇部分)。这样的碳水化合物簇部分包含:靶向部分,并且任选地缀合物接头。在某些实施例中,碳水化合物簇部分通过配体的数量和身份来鉴定。例如,在某些实施例中,碳水化合物簇部分包含3个galnac基团,并被命名为“galnac3”。本文描述了特定的碳水化合物簇部分(具有特定的拴链、分支和缀合物接头基团),并且用罗马数字表示,后跟下标“a”。因此“gainac3-la”是指具有3个galnac基团和明确鉴定的拴链、分支和连接基团的缀合物基团的特定碳水化合物簇部分。这种碳水化合物簇片段经由可切割的部分(例如可切割的键或可切割的核苷)附接至寡聚化合物。
如本文所用,“可切割的部分”是指在生理学条件下,能够被切分的键或基团。在某些实施例中,可切割的部分在细胞或亚细胞区室(如溶酶体)内切割。在某些实施例中,可切割的部分被内源酶(例如核酸酶)切割。在某些实施例中,可切割的部分包含具有一个、两个、三个、四个或四个以上的可切割的键的一组原子。
如本文所用,“可切割的键”是指能够被切分的化学键。在某些实施例中,可切割的键选自以下:酰胺、聚酰胺、酯、醚、磷酸二酯的一种或两种酯、磷酸酯、氨基甲酸酯、二硫化物或肽。
如本文所用,“碳水化合物簇”是指具有附接至支架或接头基团的一种或多种碳水化合物残基的化合物。(参见,例如maier等人,"synthesisofantisenseoligonucleotidesconjugatedtoamultivalentcarbohydrateclusterforcellulartargeting[与多价碳水化合物簇缀合的用于细胞靶向的反义寡核苷酸的合成],"bioconjugatechemistry[生物缀合物化学],2003,(14):18-29,将其通过引用以其整体并入本文中;或rensen等人,"designandsynthesisofnoveln-acetylgalactosamine-terminatedglycolipidsfortargetingoflipoproteinstothehepaticasiaglycoproteinreceptor[用于将脂蛋白靶向肝脱唾液酸糖蛋白受体的新颖n-乙酰半乳糖胺封端的糖脂的设计和合成],"jmed.chem.[药物化学杂志]2004,(47):5798-5808,例如碳水化合物缀合物簇)。
如本文所用,“单链”是指不与其互补序列杂交并且缺乏足够的自身互补性以形成稳定的自身双链体的寡聚化合物。
如本文所用,“双链”是指彼此杂交的一对寡聚化合物或形成发夹结构的单个自身互补的寡聚化合物。在某些实施例中,双链寡聚化合物包含第一和第二寡聚化合物。
如本文所用,“反义化合物”是指包含寡核苷酸或由其组成的化合物,所述寡核苷酸的至少一部分与能够与其杂交的靶核酸互补,从而导致至少一种反义活性。
如本文所用,“反义活性”是指归因于反义化合物与其靶核酸的杂交的任何可检测和/或可测量的变化。在某些实施例中,反义活性包括对靶核酸转录物(例如mrna)的量或活性的调节。在某些实施例中,反义活性包括对前mrna的剪接的调节。
如本文所用,“基于rna酶h的反义化合物”是指如下反义化合物,其中所述反义化合物的至少一些反义活性可导致所述反义化合物与靶核酸的杂交以及随后被rna酶h切割靶核酸。
如本文所用,“检测”或“测量”是指进行用于检测或测量的测试或测定。这样的检测和/或测量可以导致值为零。因此,如果用于检测或测量的测试导致没有发现活性(活性为零),则仍然进行检测或测量活性的步骤。
如本文所用,“可检测的和/或可测量的活性”是指不为零的统计学上显著的活性。
如本文所用,“基本上不变”是指特定参数的变化很小或没有变化,特别是相对于变化更大的另一参数而言。在某些实施例中,当参数变化小于5%时,所述参数是基本上不变的。在某些实施例中,如果一个参数的变化小于两倍,而另一个参数的变化至少十倍,则所述参数是基本上不变的。例如,在某些实施例中,反义活性是靶核酸的量的变化。在某些此类实施例中,如果非靶核酸的量的变化远小于靶核酸的量,则所述非靶核酸是基本上不变的,但是该变化不必为零。
如本文所用,“表达”是指基因最终产生蛋白质的过程。表达包括但不限于转录、转录后修饰(例如剪接、聚腺苷酸化、添加5'-帽)和翻译。
如本文所用,“靶核酸”是指旨在与反义化合物杂交以产生所期望的反义活性的核酸分子。反义寡核苷酸与其靶核酸具有足够的互补性,以允许在生理学条件下杂交。
如本文所用,当提及核碱基时,“核碱基互补性”或“互补性”是指能够与另一个核碱基进行碱基配对的核碱基。例如,在dna中,腺嘌呤(a)与胸腺嘧啶(t)是互补的。例如,在rna中,腺嘌呤(a)与尿嘧啶(u)是互补的。在某些实施例中,互补的核碱基是指能够与其靶核酸的核碱基进行碱基配对的反义化合物的核碱基。例如,如果在反义化合物的特定位置处的核碱基能够与在靶核酸的特定位置处的核碱基进行氢键合,则认为所述寡核苷酸和所述靶核酸之间的氢键合的位置为在那个核碱基对上互补。包含某些修饰的核碱基可以保持与对应的核碱基配对的能力,并因此仍然具有核碱基互补性。
如本文所用,提及核碱基,“非互补的”是指一对彼此不形成氢键的核碱基。
如本文所用,提及寡聚化合物(例如连接的核苷、寡核苷酸或核酸)“互补的”是指此类寡聚化合物或其区域通过核碱基互补性与另一种寡聚化合物或其区域杂交的能力。互补的寡聚化合物不必在每个核苷处具有核碱基互补性。相反,可以容忍一些错配。在某些实施例中,互补的寡聚化合物或区域在70%的核碱基上是互补的(70%互补)。在某些实施例中,互补的寡聚化合物或区域是80%互补的。在某些实施例中,互补的寡聚化合物或区域是90%互补的。在某些实施例中,互补的寡聚化合物或区域是95%互补的。在某些实施例中,互补的寡聚化合物或区域是100%互补的。
如本文所用,“错配”是指当第一寡聚化合物和第二寡聚化合物进行比对时,第一寡聚化合物的核碱基不能与第二寡聚化合物的相应位置处的核碱基配对。第一和第二寡聚化合物中的任一个或两者可以是寡核苷酸。
如本文所用,“杂交”是指互补的寡聚化合物(例如,反义化合物及其靶核酸)的配对。尽管不限于特定机制,但最常见的配对机制涉及互补核碱基之间的氢键,所述氢键可以是沃森-克里克(watson-crick)、霍思汀(hoogsteen)或反向霍思汀氢键。
如本文所用,“特异性杂交”是指寡聚化合物与一个核酸位点的杂交相比与另一核酸位点的杂交具有更高亲和力的能力。
如本文所用,关于寡核苷酸或其部分,“完全互补”是指寡核苷酸或其部分的每个核碱基能够与互补的核酸或其连续部分的核碱基配对。因此,完全互补的区域在任何一条链中均不包含错配或未杂交的核碱基。
如本文所用,“百分比互补性”是指与靶核酸的等长部分互补的寡聚化合物的核碱基的百分比。将百分比互补性计算如下:将与靶核酸中相应位置处的核碱基互补的寡聚化合物的核碱基数目除以所述寡聚化合物的总长度。
如本文所用,“百分比同一性”是指与第二核酸中相应位置处的核碱基具有相同类型(独立于化学修饰)的第一核酸中的核碱基数目除以所述第一核酸中核碱基的总数目。
如本文所用,“调节”是指当与调节之前的分子的量或质量、功能或活性相比,分子的量或质量、功能或活性的变化。例如,调节包括基因表达的改变,即增加(刺激或诱导)或减少(抑制或降低)。作为进一步的实例,与没有调节的情况相比,对表达的调节可以包括在前mrna加工的剪接位点选择中改变,导致特定剪接变体的绝对或相对量的改变。
如本文所用,“化学基序”是指寡核苷酸或其区域中化学修饰的模式。基序可以通过在某些核苷处的修饰和/或在某些寡核苷酸的连接基团处的修饰来定义。
如本文所用,“核苷基序”是指在寡核苷酸或其区域中核苷修饰的模式。这种寡核苷酸的键可以是修饰的或未经修饰的。除非另有说明,否则本文仅描述核苷的基序旨在为核苷基序。因此,在这种情况下,键不受限制。
如本文所用,“糖基序”是指寡核苷酸或其区域中糖修饰的模式。
如本文所用,“键基序”是指寡核苷酸或其区域中的键修饰的模式。这样的寡核苷酸的核苷可以是修饰的或未经修饰的。除非另有说明,否则本文仅描述键的基序旨在为键基序。因此,在这种情况下,核苷是不受限制的。
如本文所用,“核碱基修饰基序”是指沿着寡核苷酸对核碱基进行修饰的模式。除非另有说明,否则核碱基修饰基序独立于核碱基序列。
如本文所用,“序列基序”是指沿寡核苷酸或其部分排列的核碱基的模式。除非另有说明,否则序列基序独立于化学修饰,并因此可以具有化学修饰的任何组合(包括无化学修饰)。
如本文所用,提及核苷或一种“类型”的核苷,“修饰的类型”是指对核苷的化学修饰,并且包括经修饰的和未经修饰的核苷。因此,除非另有说明,“具有第一类型的修饰的核苷”可以是未经修饰的核苷。
如本文所用,“不同地修饰”是指彼此不同的化学修饰或化学取代基(包括不存在修饰)。因此,例如,moe核苷和未经修饰的dna核苷被“不同地修饰”,即使所述dna核苷是未经修饰的。同样,即使dna和rna二者都是天然存在的未经修饰的核苷,它们也被“不同地修饰”。相同但包含不同核碱基的核苷没有被不同地修饰。例如,包含经2'-ome修饰的糖和未经修饰的腺嘌呤核碱基的核苷,和包含经2'-ome修饰的糖和未经修饰的胸腺嘧啶核碱基的核苷没有被不同地修饰。
如本文所用,“相同类型的修饰”是指彼此相同的修饰(包括不存在修饰)。因此,例如,即使dna核苷是未经修饰的,两个未经修饰的dna核苷也具有“相同类型的修饰”。具有相同类型修饰的此类核苷可以包含不同的核碱基。
如本文所用,“分开的区域”是指寡核苷酸的部分,其中任何相邻部分的化学修饰或化学修饰的基序包括至少一个差异以允许分开的区域彼此区分。
如本文所用,“药学上可接受的载体或稀释剂”是指适合用于在向动物施用方面使用的任何物质。在某些实施例中,药学上可接受的载体或稀释剂是无菌盐水。在某些实施例中,这样的无菌盐水是药物级盐水。
如本文所用,术语“代谢障碍”是指主要以代谢失调为特征的疾病或病症,代谢是与食物分解产生能量相关的复杂的一组化学反应。
如本文所用,术语“心血管障碍”是指主要以心脏或血管的功能受损为特征的疾病或病症。
如本文所用,“前药”是指化合物的无活性或活性较低的形式,当向受试者施用时,其被代谢以形成活性或活性更高的化合物(例如药物)。
如本文所用,“sf-12”是指被广泛使用的经验证的通用健康相关的生活质量(hrqol)仪器,其涵盖被认为与年龄组、疾病状态和治疗类型相关的通用健康概念。测量包括12个项目,并具有8个域:总体健康(1个项目)、身体机能(2个项目)、身体健康所致的角色限制(2个项目)、身体疼痛(1个项目)、活力(1个项目)、社交功能(1个项目)、情绪问题所致的角色限制(2个项目)、精神健康(2个项目)。此外,还存在两个基于sf-12个体域的综合汇总分数:
·生理健康构成总评(pcs)
·心理健康构成总评(mcs)。
如本文所用,除非另有说明或修饰的,术语“双链”是指彼此杂交的两个分开的寡聚化合物。此类双链化合物可在一条或两条链(突出端)的一端或两端处具有一个或多个或非杂交核苷和/或一个或多个内部非杂交核苷(错配),条件是存在充分的互补性以维持在生理学相关条件下的杂交。
如本文所用,“5'靶位点”是指与特定反义化合物的5'-最末端核苷酸互补的靶核酸的核苷酸。
如本文所用,“约”是指在值的±10%内。例如,如果说“标志物可以按30%增加约50%”,则意味着所述标记物可以在45%-55%之间增加。
如本文所用,“伴随施用”是指将两种药剂以任何方式共同施用,其中所述两种药剂的药理学作用同时在患者中显现。伴随施用不需要将两种药剂以单一药物组合物、以相同剂型或通过相同施用途径施用。两种药剂的作用不必在同时显现出来。作用仅需重叠一段时间,而不必共存。
如本文所用,“施用”(“administering”或“administration”)是指向个体提供药剂,并且包括但不限于由医学专业人员施用和自行施用。向个体施用药剂可以是连续的、慢性的、短暂的或间歇的。施用可以是肠胃外的或非肠胃外的。
如本文所用,“药剂”是指当向动物施用时可提供治疗性益处的活性物质。“第一药剂”是指本发明的治疗性化合物。例如,第一药剂可以是靶向apo(a)的反义寡核苷酸。“第二药剂”是指本发明的第二治疗性化合物(例如靶向apo(a)的第二反义寡核苷酸)和/或非apo(a)治疗性化合物。
如本文所用,“改善”(“amelioration”或“ameliorate”或“ameliorating”)是指减轻相关疾病、障碍或病症的至少一项指标、体征或症状。指标的严重性可以通过本领域技术人员已知的主观或客观测量来确定。
如本文所用,“apo(a)”是指编码apo(a)的任何核酸或蛋白质序列。例如,在某些实施例中,apo(a)包括编码apo(a)的dna序列、从编码apo(a)的dna(包括含有内含子和外显子的基因组dna)转录的rna序列、编码apo(a)的mrna序列或编码apo(a)的肽序列。
如本文所用,“apo(a)核酸”是指编码apo(a)的任何核酸。例如,在某些实施例中,apo(a)核酸包括编码apo(a)的dna序列、从编码apo(a)的dna(包括含有内含子和外显子的基因组dna)转录的rna序列和编码apo(a)的mrna序列。
如本文所用,“apo(a)mrna”是指编码apo(a)蛋白的mrna。
如本文所用,“apo(a)蛋白”是指编码apo(a)的任何蛋白质序列。
如本文所用,“apo(a)特异性抑制剂”是指能够特异性抑制apo(a)核酸和/或apo(a)蛋白表达的任何药剂。例如,apo(a)特异性抑制剂包括核酸(包括反义化合物)、肽、抗体、小分子和其他能够抑制apo(a)核酸和/或apo(a)蛋白表达的药剂。在某些实施例中,通过特异性地调节apo(a)核酸表达和/或apo(a)蛋白表达,apo(a)特异性抑制剂可影响脂质转运系统的其他组分(包括下游组分)。类似地,在某些实施例中,apo(a)特异性抑制剂可影响动物中的其他分子过程。
如本文所用,“他汀的最佳剂量”是指根据美国心脏病学会(acc)/美国心脏协会(aha)指南有关治疗血胆固醇从而降低成年人动脉粥样硬化性心血管疾病风险而改编的剂量。(参见stone,neilj.等人,"2013acc/ahaguidelineonthetreatmentofbloodcholesteroltoreduceatheroscleroticcardiovascularriskinadults[关于治疗血胆固醇从而降低成年人动脉粥样硬化性心血管疾病风险的2013acc/aha指南],areportoftheamericancollegeofcardiology/americanheartassociationtaskforceonpracticeguidelines[美国心脏病学会/美国心脏协会专题组对实践指南的报告],"circulation[循环],2014年6月24日,s1-s45)
如本文所用,“动脉粥样硬化”是指影响大动脉和中型动脉的动脉硬化,其特征在于存在脂肪沉积物。脂肪沉积物被称为“动脉粥样硬化”或“斑块”,主要由胆固醇和其他脂肪、钙和瘢痕组织组成,并损害了动脉壁。
如本文所用,“冠心病(chd)”是指向心脏供应血液和氧气的小血管变窄,这通常是动脉粥样硬化的结果。
如本文所用,“糖尿病”或“糖尿病”是以胰岛素水平不足或胰岛素敏感性降低引起的代谢紊乱和异常高血糖(高血糖症)为特征的综合征。特征性症状是归因于高血糖水平的尿量过多(多尿症)、过度口渴和试图补充增加的排尿而增加的液体摄入(多饮)、归因于高血糖对眼睛视力的影响的视力模糊、无法解释的体重减轻和嗜睡。
如本文所用,“糖尿病型血脂异常”或“伴随血脂异常的2型糖尿病”是指以2型糖尿病、降低的hdl-c、升高的甘油三酯(tg)和升高的小而密的ldl颗粒为特征的病症。
如本文所用,“稀释剂”是指在组合物中缺乏药理学活性但在药学上是必需或期望的成分。例如,在注射的组合物中的稀释剂可以是液体,例如盐水溶液。
如本文所用,“血脂异常”是指脂质和/或脂蛋白代谢的障碍,包括脂质和/或脂蛋白过度生产或缺乏。血脂异常可以通过脂质(例如乳糜微粒、胆固醇和甘油三酯以及脂蛋白,如低密度脂蛋白(ldl)胆固醇)的升高来体现。
如本文所用,“剂量”是指在单次施用或在指定时期内提供的指定量的药剂。在某些实施例中,可以按一次、两次或更多次推注、片剂或注射施用剂量。例如,在需要皮下施用的某些实施例中,所需剂量需要通过单次注射不容易容纳的体积,因此,可以使用两次或更多次注射来获得所需剂量。在某些实施例中,通过延长时间段或连续地输注来施用药剂。剂量可以表示为每小时、每天、每周或每月的药剂的量。剂量也可以表示为mg/kg或g/kg。
如本文所用,“有效量”或“治疗有效量”是指足以在需要药剂的个体中实现所需生理学结果的活性药剂的量。取决于待治疗的个体的健康和身体状况、待治疗的个体的分类组、组合物的配制、对个体医疗状况的评估以及其他相关因素,有效量可以在个体之间变化。
如本文所用,“完全互补”或“100%互补”是指第一核酸的核碱基序列的每个核碱基在第二核酸的第二核碱基序列中具有互补的核碱基。在某些实施例中,第一核酸是反义化合物,并且第二核酸是靶核酸。
如本文所用,“葡萄糖”是细胞用作能量和炎症性中间体的来源的单糖。“血浆葡萄糖”是指存在于血浆中的葡萄糖。
如本文所用,“高密度脂蛋白-c”或“hdl-c”是指与高密度脂蛋白颗粒相关的胆固醇。血清(或血浆)中hdl-c的浓度通常以mg/dl或nmol/l定量。“血清hdl-c”和“血浆hdl-c”表示分别在血清和血浆中的hdl-c。
如本文所用,“hmg-coa还原酶抑制剂”是指通过抑制酶hmg-coa还原酶起作用的药剂,例如阿托伐他汀、瑞舒伐他汀、氟伐他汀、洛伐他汀、普伐他汀和辛伐他汀。
如本文所用,根据针对成人高胆固醇进行检测、评估或治疗的美国国家胆固醇教育计划(ncep)的专家小组报告的指南,“高胆固醇血症”是指以升高的胆固醇或循环(血浆)胆固醇、ldl-胆固醇和vldl-胆固醇为特征的病症(参见,arch.int.med.[内科学文献](1988)148,36-39)。
如本文所用,“高脂血症”或“高脂血症”是以升高的血清脂质或循环(血浆)脂质为特征的病症。这种病症显现出异常高的脂肪浓度。循环血液中的脂质部分是胆固醇、低密度脂蛋白、极低密度脂蛋白、乳糜微粒和甘油三酯。高脂血症的弗瑞迪克森(fredrickson)分类是基于如通过电泳或超速离心测量的tg和富含胆固醇的脂蛋白颗粒的模式,并且通常用于表征高脂血症的主要原因,例如高甘油三酯血症(fredrickson和lee,circulation[循环],1965,31:321-327;fredrickson等人,newengjmed[新英格兰医学杂志],1967,276(1):34-42)。
如本文所用,“高甘油三酯血症”是指以升高的甘油三酯水平为特征的病症。其病因包括原发性(即遗传原因)因素和继发性(其他潜在原因,例如糖尿病、代谢综合征/胰岛素抵抗、肥胖症、缺乏运动、吸烟、饮酒过量和很高碳水化合物的饮食)因素,或者最常见的是二者的组合(yuan等人,cmaj,2007,176:1113-1120)。
如本文所用,“鉴定”或“选择患有代谢疾病或心血管疾病的动物”是指鉴定或选择易于或已经诊断出患有代谢疾病、心血管疾病或代谢综合征的受试者;或鉴定或选择患有代谢疾病、心血管疾病或代谢综合征中任何症状的受试者,包括但不限于高胆固醇血症、高血糖症、高脂血症、高甘油三酯血症、高血压增加的胰岛素抵抗、减少的胰岛素敏感性、超过正常体重、和/或高于正常体脂含量或其任何组合。可以通过任何方法来完成这种鉴定,包括但不限于标准临床测试或评估,例如测量血清或循环(血浆)胆固醇、测量血清或循环(血浆)血糖、测量血清或循环(血浆)甘油三酯、测量血压、测量体脂含量、测量体重等。
如本文所用,“改善的心血管结果”是指降低不良心血管事件的发生或其风险。不良心血管事件的实例包括但不限于死亡、再梗死、中风、心源性休克、肺水肿、心脏骤停和心律失常。
如本文所用,“增加hdl”或“升高hdl”是指与未施用任何化合物的动物中的hdl水平相比,在施用至少一种本发明的化合物后动物中的hdl水平增加。
如本文所用,“个体”、“患者”或“受试者”是指选择用于治疗或疗法的人。
如本文所用,“有需要的个体”是指选择用于治疗或疗法的人类或非人类动物,所述动物需要这种治疗或疗法。
如本文所用,“诱导”、“抑制”、“增强”、“升高”、“增加”、“减少”、“降低”等表示两种状态之间的定量差异。例如,“有效抑制apo(a)的活性或表达的量”是指在经处理的样品中apo(a)的活性或表达的水平将不同于未经治疗的样品中apo(a)活性或表达的水平。此类术语适用于例如表达水平和活性水平。
术语“调低”、“使降低”、“降低”、“减少”或“抑制”在本文中通常全部用来表示减少统计学上显著的量。然而,为避免疑问,“调低”、“使降低”、“降低”或“减少”或“抑制”是指与参考水平相比减少了至少10%,例如与参考水平相比,减少了至少约10%、或至少约15%、或至少约20%、或至少约25%、或至少约30%、或至少约35%、或至少约40%、或至少约50%(即,与参考样品相比缺少水平),或在10%-50%之间的任何减少。
如本文所用,“炎症性病症”是指导致炎症的疾病、疾病状态、综合征或其他病症。例如,类风湿性关节炎和肝纤维化是炎症性病症。炎症性病症的其他实例包括脓毒症、心肌缺血/再灌注损伤、成人呼吸窘迫综合征、肾炎、移植排斥、炎症性肠病、多发性硬化症、动脉硬化、动脉粥样硬化和血管炎。
如本文所用,“抑制表达或活性”是指降低或阻断rna或蛋白质的表达或活性,并且不一定表示表达或活性的完全消除。
如本文所用,“胰岛素抵抗”被定义为正常量的胰岛素不足以从脂肪、肌肉和肝细胞产生正常的胰岛素反应的情况。脂肪细胞中的胰岛素抵抗导致储存的甘油三酯水解,从而升高血液血浆中的游离脂肪酸。肌肉中的胰岛素抵抗降低了葡萄糖的摄取,而肝中的胰岛素抵抗降低了葡萄糖储存,其中这两种作用都可升高血糖。归因于胰岛素抵抗的胰岛素和葡萄糖高血浆水平通常会导致代谢综合征和2型糖尿病。
如本文所用,“胰岛素敏感性”是个体如何有效加工葡萄糖的量度。具有高胰岛素敏感性的个体有效地加工葡萄糖,而具有低胰岛素敏感性的个体不能有效地加工葡萄糖。
如本文所用,“调脂”是指受试者中一种或多种脂质(例如ldl,vldl)的降低。“脂质升高”是指受试者中脂质(例如hdl)的增加。随时间流逝,使用一个或多个剂量,可以发生降脂或升脂。
如本文所用,“调脂疗法”或“脂质调低剂”是指向受试者提供的以降低受试者中一种或多种脂质的治疗方案。在某些实施例中,提供了调脂疗法以降低受试者中的apo(a)、cetp、apob、总胆固醇、ldl-c、vldl-c、idl-c、非hdl-c、甘油三酯、小而密的ldl颗粒和lp(a)中的一种或多种。降脂疗法的实例包括但不限于apob抑制剂、他汀、贝特类和mtp抑制剂。
如本文所用,“脂蛋白”(例如vldl、ldl和hdl)是指在血清、血浆和淋巴中发现的一组蛋白质,并且对于脂质运输是重要的。每种脂蛋白的化学组成的差异在于,例如,hdl相比脂质具有更高比例的蛋白质,而vldl相比脂质具有较低比例的蛋白质。
如本文所用,“lp(a)”包含apo(a)和含有apob的ldl样颗粒。所述apo(a)通过二硫键与apob连接。
如本文所用,“低密度脂蛋白-胆固醇(ldl-c)”是指低密度脂蛋白颗粒中携带的胆固醇。血清(或血浆)中ldl-c的浓度通常以mg/dl或nmol/l进行定量。“血清ldl-c”和“血浆ldl-c”是指分别在血清和血浆中的ldl-c。
如本文所用,“重大风险因素”是指导致特定疾病或病症的高风险的因素。在某些实施例中,冠心病的重大风险因素包括但不限于吸烟、高血压、高ldl、低hdl-c、冠心病家族史、年龄以及本文披露的其他因素。
如本文所用,“代谢障碍”或“代谢疾病”是指以代谢功能的改变或紊乱为特征的病症。“代谢性”和“代谢”是本领域众所周知的术语,并且通常包括在活生物体内发生的生化过程的整个范围。代谢障碍包括但不限于高血糖症、前驱糖尿病、糖尿病(1型和2型)、肥胖症、胰岛素抵抗、代谢综合征和由2型糖尿病引起的血脂异常。
如本文所用,“代谢综合征”是指以代谢起源的脂质和非脂质心血管风险因素聚簇为特征的病症。在某些实施例中,通过以下因素中的任何3个因素的存在来鉴定代谢综合征:男性腰围大于102cm或女性腰围大于88cm;血清甘油三酯为至少150mg/dl;hdl-c在男性中少于40mg/dl或在女性中少于50mg/dl;血压为至少130/85mmhg;并且空腹血糖为至少110mg/dl。这些决定因素可以在临床实践中容易地测量(jama,2001,285:2486-2497)。
“肠胃外的施用”是指通过注射或输注的施用。肠胃外的施用包括皮下施用、静脉内施用、肌肉内施用、动脉内施用、腹膜内施用或颅内施用,例如鞘内或脑室内施用。施用可以是连续的、慢性的、短暂的或间歇的。
如本文所用,“药剂”是指当向个体施用时提供治疗性益处的物质。例如,在某些实施例中,靶向apo(a)的反义寡核苷酸是药剂。
如本文所用,“药物组合物”或“组合物”是指适合于向个体施用的物质的混合物。例如,药物组合物可以包含一种或多种活性剂和药物载体,例如无菌水性溶液。
如本文所用,“药学上可接受的衍生物”涵盖本文所述的化合物的衍生物,例如溶剂合物、水合物、酯、前药、多晶型物、异构体、同位素标记的变体、药学上可接受的盐和本领域已知的其他衍生物。
如本文所用,“药学上可接受的盐”是指反义化合物的生理学和药学上可接受的盐,即,保留母体化合物所期望的生物学活性并且不赋予其不希望的毒理作用的盐。术语“药学上可接受的盐”或“盐”包括由药学上可接受的无毒性酸或碱(包括无机或有机的酸和碱)制备的盐。本文所述的化合物的“药学上可接受的盐”可以通过本领域众所周知的方法制备。对于药学上可接受的盐的综述,参见stahl和wermuth,handbookofpharmaceuticalsalts:properties,selectionanduse[药用盐手册:特性、选择和使用](约翰威立国际出版公司(wiley-vch),魏因海姆,德国(weinheim,germany),2002)。反义寡核苷酸的钠盐是有用的,并且被广泛接受用于向人类进行治疗性施用。因此,在一个实施例中,本文所述的化合物为钠盐形式。
如本文所用,“部分”是指核酸的限定数目的连续(即,连接的)核碱基。在某些实施例中,部分是靶核酸的限定数目的连续核碱基。在某些实施例中,部分是反义化合物的限定数目的连续核碱基。
如本文所用,“预防”(“prevent”或“preventing”)是指将疾病、障碍或病症的发作或发展延迟或阻止持续几分钟至无限期的时间段。预防还指降低疾病、障碍或病症发展的风险。
如本文所用,“升高”是指在量方面的增加。例如,升高血浆hdl水平是指增加血浆中hdl的量。
如本文所用,“降低”是指降低到较小的程度、大小、量或数目。例如,降低血浆甘油三酯水平是指降低血浆中甘油三酯的量。
如本文所用,“区域”或“靶区”被定义为具有至少一种可鉴定的结构、功能或特征的靶核酸的部分。例如,靶区可以涵盖3'utr、5'utr、外显子、内含子、外显子/内含子接点、编码区、翻译起始区、翻译终止区或其他定义的核酸区。apo(a)的结构上定义的区域可通过登录号从序列数据库(如ncbi)获得,并且这种信息通过引用并入本文。在某些实施例中,靶区可以涵盖从靶区内一个靶区段的5'靶位点到靶区内另一个靶区段的3'靶位点的序列。
如本文所用,“第二药剂”或“第二治疗剂”是指可以与“第一药剂”组合使用的药剂。第二治疗剂可以包括但不限于靶向apo(a)或apob的反义寡核苷酸。第二药剂还可以包括抗apo(a)抗体、apo(a)肽抑制剂、胆固醇调低剂、脂质调低剂、葡萄糖调低剂和抗炎药剂。
如本文所用,“区段”被定义为核酸内区域的较小的亚部分。例如,“靶区段”是指一种或多种反义化合物靶向的靶核酸的核苷酸序列。“5'靶位点”是指靶区段的5'最末端核苷酸。“3'靶位点”是指靶区段的3'最末端核苷酸。可替代地,“起始位点”可以指靶区段的5'最末端核苷酸,并且“终止位点”是指靶区段的3'最末端核苷酸。靶区段还可以在一个序列的“起始位点”处开始,并在另一序列的“终止位点”处结束。
如本文所用,“他汀”是指抑制hmg-coa还原酶活性的药剂。
如本文所用,“皮下施用”是指在皮肤的正下方施用。
如本文所用,“受试者”是指选择用于治疗或疗法的人类。
如本文所用,“心血管疾病或障碍的症状”是指由心血管疾病或障碍引起的、伴随心血管疾病或障碍的现象,并作为其指示。例如,心绞痛;胸痛;呼吸浅短;心悸;虚弱;头晕;恶心;出汗;心动过速;心动过缓;心律失常;心房颤动;下肢肿胀;紫绀;疲劳;昏厥;面部麻木;四肢麻木;跛行或肌肉抽筋;腹部发胀;或发烧是心血管疾病或障碍的症状。
如本文所用,“靶向”或“靶向的”是指设计和选择将与靶核酸特异性杂交并诱导所期望作用的反义化合物的过程。
如本文所用,“治疗有效量”是指对个体提供了治疗性益处的药剂的量。
如本文所用,“治疗性生活方式的变化”是指旨在调低脂肪/脂肪组织质量和/或胆固醇的饮食和生活方式的变化。这种变化可以降低心脏疾病发展的风险,并且可以包括针对每日总卡路里、总脂肪、饱和脂肪、多不饱和脂肪、单不饱和脂肪、碳水化合物、蛋白质、胆固醇、不溶性纤维的饮食摄取的建议以及对身体活动的建议。
如本文所用,“治疗”(“treat”或“treating”)是指施用本文所述的化合物以实现疾病、障碍或病症的改变或改善。
如本文所用,“预防”(“prevent”或“preventing”)是指抑制或延迟本文所述的疾病、障碍或病症的一种或多种症状。例如,在某些实施例中,向受试者施用isis681257将预防心血管障碍的一种或多种症状,例如向受试者施用isis681257将抑制或延迟与心血管障碍相关的一种或多种症状。
如本文所用,“甘油三酯”或“tg”是指由与三个脂肪酸分子结合的甘油组成的脂质或中性脂肪。
如本文所用,“2型糖尿病”(还称为“2型糖尿病”、“糖尿病,2型”、“非胰岛素依赖型糖尿病”、“niddm”、“肥胖症相关的糖尿病”或“成人发作型糖尿病”)是一种代谢障碍,主要以胰岛素抵抗、相对胰岛素缺乏和高血糖症为特征。
化学命名法、术语和惯例
除非另有说明,否则假定术语对照的常规定义和常规的稳定原子的原子价,并在全部式和基团中体现。
如在本披露中使用的冠词“一个/种(a/an)”是指一个/种或多于一个/种(例如,至少一个/种)该冠词的语法宾语。通过举例,“一个要素”意指一个要素或多于一个要素。
除非另外指出,否则在本披露中使用的术语“和/或”是指“和”或“或”。
具体的实施例
本文描述了本发明的各种实施例。将认识到,在每个实施例中指定的特征可以与其他实施例的其他指定特征组合以提供另外的实施例。
在第一方面,本披露涉及在患有确诊的心血管疾病的患者中降低心血管事件的风险的方法,所述方法包括通过皮下注射向所述患者每月一次施用包含约75mg至约85mg化合物isis681257或其盐的单位剂量,其中在第一次施用所述化合物的时间之前,所述患者的血浆lp(a)浓度大于或等于70mg/dl。
在一些实施例中,所述心血管事件选自重大不良心血管事件(mace)、全因死亡(任何原因导致的死亡)、冠心病(chd)死亡、急性心肌梗死(ami)死亡、心力衰竭(hf)死亡、由心脏手术的直接并发症导致的死亡和因缺血而进行的紧急下肢血运重建或截肢。
在一些实施例中,所述重大不良心血管事件(mace)选自心血管(cv)死亡、非致命性心肌梗死、非致命性中风和需要住院的紧急冠状动脉血运重建。在另一个实施例中,所述重大不良心血管事件(mace)是心血管(cv)死亡。在又另一个实施例中,所述重大不良心血管事件(mace)是非致命性心肌梗死。在另一个实施例中,所述重大不良心血管事件(mace)是非致命性中风。在又另一个实施例中,所述重大不良心血管事件(mace)是需要住院的紧急冠状动脉血运重建。
在一些实施例中,所述心血管事件选自全因死亡(任何原因导致的死亡)、冠心病(chd)死亡、急性心肌梗死(ami)死亡、心力衰竭(hf)死亡、由心脏手术的直接并发症导致的死亡和因缺血而进行的紧急下肢血运重建或截肢。
在一个实施例中,所述心血管事件是全因死亡(任何原因导致的死亡)。
在另一个实施例中,所述心血管事件是冠心病(chd)死亡。在一个实施例中,所述冠心病(chd)死亡包括急性心肌梗死(ami)死亡、心力衰竭(hf)死亡和由心脏手术的直接并发症导致的死亡。
在另一个实施例中,所述心血管事件是因缺血而进行的紧急下肢血运重建或截肢。
在一些实施例中,所述患有确诊的心血管疾病的患者是具有以下至少一项的患者:(i)自发性心肌梗死病史;(i)缺血性中风病史;和(iii)临床上显著的症状性外周动脉疾病。
在一个实施例中,所述自发性心肌梗死的病史发生在第一次施用所述化合物的时间之前≥3个月和≤10年。
在一个实施例中,所述缺血性中风的病史发生在第一次施用所述化合物的时间之前≥3个月和≤10年。
在一个实施例中,所述缺血性中风的病史是由中枢神经系统组织梗塞引起的局灶性脑、脊髓或视网膜功能障碍的急性发作。
在一个实施例中,所述临床上显著的症状性外周动脉疾病由具有以下至少一项的间歇性跛行证实:(i)踝肱指数≤0.90;和(ii)归因于下肢缺血的下肢截肢或血运重建。
在一些实施例中,在第一次施用所述化合物的时间之前,所述患者的血浆lp(a)浓度≥90mg/dl。
在一些实施例中,将所述化合物配制在无菌液体中,并且其中每个单位剂量的所述化合物不包含超过1ml的所述无菌液体。
在一个实施例中,每个单位剂量的所述化合物不包含超过0.8ml的所述无菌液体。在另一个实施例中,每个单位剂量的所述化合物不包含超过0.5ml的所述无菌液体。在又另一个实施例中,每个单位剂量的所述化合物不包含超过0.4ml的所述无菌液体。在另一个实施例中,每个单位剂量的所述化合物不包含不超过0.25ml的所述无菌液体。在又另一个实施例中,每个单位剂量的所述化合物不包含不超过0.2ml的所述无菌液体。
在一个实施例中,所述无菌液体是水。在另一个实施例中,所述无菌液体是含有磷酸钠缓冲液的水。在又另一个实施例中,所述无菌液体是含有磷酸钠缓冲液和氯化钠的水。
在一些实施例中,当在所述给药期的开始和结束时测量所述患者的血浆lp(a)浓度时,所述患者的平均/中值血浆lp(a)浓度降低了至少50%。在另一个实施例中,当在所述给药期的开始和结束时测量所述患者的血浆lp(a)浓度时,所述患者的平均/中值血浆lp(a)浓度降低了至少60%。在又另一个实施例中,当在所述给药期的开始和结束时测量所述患者的血浆lp(a)浓度时,所述患者的平均/中值血浆lp(a)浓度降低了至少70%。在另一个实施例中,当在所述给药期的开始和结束时测量所述患者的血浆lp(a)浓度时,所述患者的平均/中值血浆lp(a)浓度降低了至少75%。
在一些实施例中,当在所述给药期的开始和结束时测量所述患者的血浆lp(a)浓度时,所述患者的平均/中值血浆lp(a)浓度降低了约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%或约90%。
在一些实施例中,当在所述给药期的开始和结束时测量所述患者的血浆lp(a)浓度时,所述患者的平均/中值血浆lp(a)浓度降低约40%至约50%。在另一个实施例中,当在所述给药期的开始和结束时测量所述患者的血浆lp(a)浓度时,所述患者的平均/中值血浆lp(a)浓度降低了约45%至约55%。在另一个实施例中,当在所述给药期的开始和结束时测量所述患者的血浆lp(a)浓度时,所述患者的平均/中值血浆lp(a)浓度降低了约50%至约60%。在又另一个实施例中,当在所述给药期的开始和结束时测量所述患者的血浆lp(a)浓度时,所述患者的平均/中值血浆lp(a)浓度降低了约55%至约65%。在又另一个实施例中,当在所述给药期的开始和结束时测量所述患者的血浆lp(a)浓度时,所述患者的平均/中值血浆lp(a)浓度降低了约60%至约70%。在另一个实施例中,当在所述给药期的开始和结束时测量所述患者的血浆lp(a)浓度时,所述患者的平均/中值血浆lp(a)浓度降低了约65%至约75%。在另一个实施例中,当在所述给药期的开始和结束时测量所述患者的血浆lp(a)浓度时,所述患者的平均/中值血浆lp(a)浓度降低了约70%至约85%。
在一些实施例中,与未施用所述化合物的患者相比,在所述给药期结束时,所述患者经历重大不良心血管事件(mace)的总体风险降低了统计学上显著的量。
在其他实施例中,与未施用所述化合物的患者相比,在所述给药期结束时,所述患者经历以下事件之一的总体风险降低了统计学上显著的量:(i)心血管(cv)死亡、非致命性mi和非致命性中风的综合;(ii)冠心病(chd)死亡、非致命性mi和需要住院的紧急冠状动脉血运重建的综合;(iii)冠心病(chd)死亡、非致命性mi、需要住院的紧急冠状动脉血运重建和因缺血而进行的紧急下肢血运重建或截肢的综合;和(iv)全因死亡的比率。
在其一个实施例中,与未施用所述化合物的患者相比,在所述给药期结束时,所述患者经历以下事件的总体风险降低了统计学上显著的量:心血管(cv)死亡、非致命性mi和非致命性中风的综合。
在其一个实施例中,与未施用所述化合物的患者相比,在所述给药期结束时,所述患者经历以下事件的总体风险降低了统计学上显著的量:冠心病(chd)死亡、非致命性mi和需要住院的紧急冠状动脉血运重建的综合。
在其一个实施例中,与未施用所述化合物的患者相比,在所述给药期结束时,所述患者经历以下事件的总体风险降低了统计学上显著的量:冠心病(chd)死亡、非致命性mi、需要住院的紧急冠状动脉血运重建和因缺血而进行的紧急下肢血运重建或截肢的综合。
在其一个实施例中,与未施用所述化合物的患者相比,在所述给药期结束时,所述患者经历以下事件的总体风险降低了统计学上显著的量:全因死亡的比率。
在其他实施例中,与未施用所述化合物的患者相比,在所述给药期结束时,所述患者经历以下事件之一的总体风险降低了统计学上显著的量,并且其中在第一次施用所述化合物的时间之前所述患者的血浆lp(a)浓度≥90mg/dl:(i)全因死亡率、非致命性mi和非致命性中风的综合;(ii)总血管事件的综合:cv死亡、非致命性mi、非致命性中风、需要住院的紧急冠状动脉血运重建和因缺血而进行的紧急下肢血运重建或截肢;(iii)全因死亡率、非致命性mi、非致命性中风和需要住院的紧急冠状动脉血运重建的综合;(iv)致命性和非致命性中风的综合;(v)在有外周动脉疾病(pad)病史的患者中重大不良肢体事件(male)的比率;(vi)不稳定型心绞痛的住院率;和(vii)心力衰竭的住院率。
在其一个实施例中,与未施用所述化合物的患者相比,在所述给药期结束时,在第一次施用所述化合物的时间之前血浆lp(a)浓度≥90mg/dl的患者经历以下事件的总体风险降低了统计学上显著的量:全因死亡率、非致命性mi和非致命性中风的综合。
在其一个实施例中,与未施用所述化合物的患者相比,在所述给药期结束时,在第一次施用所述化合物的时间之前血浆lp(a)浓度≥90mg/dl的患者经历以下事件的总体风险降低了统计学上显著的量:总血管事件的综合:cv死亡、非致命性mi、非致命性中风、需要住院的紧急冠状动脉血运重建和因缺血而进行的紧急下肢血运重建或截肢。
在其一个实施例中,与未施用所述化合物的患者相比,在所述给药期结束时,在第一次施用所述化合物的时间之前血浆lp(a)浓度≥90mg/dl的患者经历以下事件的总体风险降低了统计学上显著的量:全因死亡率、非致命性mi、非致命性中风和需要住院的紧急冠状动脉血运重建的综合。
在其一个实施例中,与未施用所述化合物的患者相比,在所述给药期结束时,在第一次施用所述化合物的时间之前血浆lp(a)浓度≥90mg/dl的患者经历以下事件的总体风险降低了统计学上显著的量:致命性和非致命性中风的综合。
在其一个实施例中,与未施用所述化合物的患者相比,在所述给药期结束时,在第一次施用所述化合物的时间之前血浆lp(a)浓度≥90mg/dl的患者经历以下事件的总体风险降低了统计学上显著的量:在具有外周动脉疾病(pad)病史的患者中重大不良肢体事件(male)的比率。
在其一个实施例中,与未施用所述化合物的患者相比,在所述给药期结束时,在第一次施用所述化合物的时间之前血浆lp(a)浓度≥90mg/dl的患者经历以下事件的总体风险降低了统计学上显著的量:不稳定型心绞痛的住院率。
在其一个实施例中,与未施用所述化合物的患者相比,在所述给药期结束时,在第一次施用所述化合物的时间之前血浆lp(a)浓度≥90mg/dl的患者经历以下事件的总体风险降低了统计学上显著的量:心力衰竭的住院率。
在涉及风险降低率的以上实施例中任一个的一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,针对任一个事件,相对风险降低率(即,降低总体风险的统计学上显著的相对量)为至少15%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,针对任一个事件,相对风险降低率为(i)至少15%,优选地至少20%,更优选地至少25%;(ii)对于在第一次施用所述化合物的时间之前,血浆lp(a)浓度大于或等于90mg/dl的患者,为至少20%,优选地至少25%,更优选地至少30%。
在涉及风险降低率的以上实施例中任一个的一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,针对任一个事件,相对风险降低率(即,降低总体风险的统计学上显著的相对量)为约10%、约15%、约20%、约25%、约30%、约35%或约40%。
在涉及风险降低率的以上实施例中任一个的一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,针对任一个事件,相对风险降低率(即,降低总体风险的统计学上显著的相对量)为约10%至约20%。在另一个实施例中,对于任一个事件中在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,针对任一个事件,相对风险降低率为约15%至约25%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,针对任一个事件,相对风险降低率为约20%至约30%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,针对任一个事件,相对风险降低率为约25%至约35%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,针对任一个事件,相对风险降低率为约30%至约40%。
在涉及风险降低率的以上实施例中任一个的一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,针对任一个事件,相对风险降低率(即,降低总体风险的统计学上显著的相对量)为约10%至约15%。在另一个实施例中,对于任一个事件中在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,针对任一个事件,相对风险降低率为约15%至约20%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,针对任一个事件,相对风险降低率为约20%至约25%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,针对任一个事件,相对风险降低率为约25%至约30%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,针对任一个事件,相对风险降低率为约30%至约35%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,针对任一个事件,相对风险降低率为约35%至约40%。
在涉及风险降低率的以上实施例中任一个的一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,针对任一个事件,相对风险降低率(即,降低总体风险的统计学上显著的相对量)为约10%。在另一个实施例中,对于在任一个事件中在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,针对任一个事件,相对风险降低率为约15%。在另一个实施例中,对于在任一个事件中在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,针对任一个事件,相对风险降低率为约20%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,针对任一个事件,相对风险降低率为约25%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,针对任一个事件,相对风险降低率为约30%。在另一个实施例中,对于在任一个事件中在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,针对任一个事件,相对风险降低率为约35%。
在涉及风险降低率的以上实施例中任一个的一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,针对任一个事件,相对风险降低率(即,降低总体风险的统计学上显著的相对量)为至少约10%。在另一个实施例中,对于在任一个事件中在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,针对任一个事件,相对风险降低率为约15%。在另一个实施例中,对于在任一个事件中在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,针对任一个事件,相对风险降低率为约20%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,针对任一个事件,相对风险降低率为约25%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,针对任一个事件,相对风险降低率为约30%。在另一个实施例中,对于在任一个事件中在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,针对任一个事件,相对风险降低率为约35%。
在涉及风险降低率的以上实施例中任一个的一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,针对任一个事件,相对风险降低率(即,降低总体风险的统计学上显著的相对量)为至少10%。在另一个实施例中,对于在任一个事件中在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,针对任一个事件,相对风险降低率为至少约15%。在另一个实施例中,对于在任一个事件中在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,针对任一个事件,相对风险降低率为至少20%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,针对任一个事件,相对风险降低率为至少25%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,针对任一个事件,相对风险降低率为至少30%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,针对任一个事件,相对风险降低率为至少35%。
在涉及风险降低率的以上实施例中任一个的一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,针对任一个事件,相对风险降低率为约10%、约15%、约20%、约25%、约30%、约35%或约40%。
在涉及风险降低率的以上实施例中任一个的一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,针对任一个事件,相对风险降低率(即,降低总体风险的统计学上显著的相对量)为约10%至约20%。在又另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,相对风险降低率(即,降低总体风险的统计学上显著的相对量)为约15%至约25%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,相对风险降低率(即,降低总体风险的统计学上显著的相对量)为约20%至约30%。在又另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,相对风险降低率(即,降低总体风险的统计学上显著的相对量)为约25%至约35%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,相对风险降低率(即,降低总体风险的统计学上显著的相对量)为约30%至约40%。
在涉及风险降低率的以上实施例中任一个的一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,针对任一个事件,相对风险降低率(即,降低总体风险的统计学上显著的相对量)为约10%至约15%。在又另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,相对风险降低率(即,降低总体风险的统计学上显著的相对量)为约15%至约20%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,相对风险降低率(即,降低总体风险的统计学上显著的相对量)为约20%至约25%。在又另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,相对风险降低率(即,降低总体风险的统计学上显著的相对量)为约25%至约30%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,相对风险降低率(即,降低总体风险的统计学上显著的相对量)为约30%至约35%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,相对风险降低率(即,降低总体风险的统计学上显著的相对量)为约35%至约40%。
在涉及风险降低率的以上实施例中任一个的一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,针对任一个事件,相对风险降低率(即,降低总体风险的统计学上显著的相对量)为约15%。在又另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,相对风险降低率(即,降低总体风险的统计学上显著的相对量)为约20%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,相对风险降低率(即,降低总体风险的统计学上显著的相对量)为约25%。在又另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,相对风险降低率(即,降低总体风险的统计学上显著的相对量)为约30%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,相对风险降低率(即,降低总体风险的统计学上显著的相对量)为约35%。
在涉及风险降低率的以上实施例中任一个的一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,针对任一个事件,相对风险降低率(即,降低总体风险的统计学上显著的相对量)为至少约15%。在又另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,相对风险降低率(即,降低总体风险的统计学上显著的相对量)为至少约20%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,相对风险降低率(即,降低总体风险的统计学上显著的相对量)为至少约25%。在又另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,相对风险降低率(即,降低总体风险的统计学上显著的相对量)为至少约30%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,相对风险降低率(即,降低总体风险的统计学上显著的相对量)为至少约35%。
在涉及风险降低率的以上实施例中任一个的一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,针对任一个事件,相对风险降低率(即,降低总体风险的统计学上显著的相对量)为至少15%。在又另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,相对风险降低率(即,降低总体风险的统计学上显著的相对量)为至少20%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,相对风险降低率(即,降低总体风险的统计学上显著的相对量)为至少25%。在又另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,相对风险降低率(即,降低总体风险的统计学上显著的相对量)为至少30%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,相对风险降低率(即,降低总体风险的统计学上显著的相对量)为至少35%。
在涉及风险降低率的以上实施例中任一个的一个实施例中,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)(i)对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,为至少2.0%,优选地至少2.5%;(ii)对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,为至少3.0%,优选地至少3.5%。
在涉及风险降低率的以上实施例中任一个的一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为约1.5%、约1.8%、约2.0%、约2.2%、约2.5%、约2.8%、约3.0%、约3.2%、约3.5%、约3.8%、约4.0%、约4.2%、约4.5%、约4.8%或约5.0%。
在涉及风险降低率的以上实施例中任一个的一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为至少约1.5%、约1.8%、约2.0%、约2.2%、约2.5%、约2.8%、约3.0%、约3.2%、约3.5%、约3.8%、约4.0%、约4.2%、约4.5%、约4.8%或约5.0%。
在涉及风险降低率的以上实施例中任一个的一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为约1.5%至约2.5%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为约2.0%至约3.0%。在又另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为约2.5%至约3.5%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为约3.0%至约4.0%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为约3.5%至约4.5%。在又另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为约4.0%至约5.0%。
在涉及风险降低率的以上实施例中任一个的一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为约1.5%至约2.0%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为约2.0%至约2.5%。在又另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为约2.5%至约3.0%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为约3.0%至约3.5%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为约3.5%至约4.0%。在又另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为约4.0%至约4.5%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为约4.5%至约5.0%。
在涉及风险降低率的以上实施例中任一个的一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为约1.8%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为约2.0%。在又另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为约2.5%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为约3.0%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为约3.5%。在又另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为约4.5%。
在涉及风险降低率的以上实施例中任一个的一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为至少约1.8%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为至少约2.0%。在又另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为至少约2.5%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为至少约3.0%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为至少约3.5%。在又另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为至少约4.5%。
在涉及风险降低率的以上实施例中任一个的一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为至少1.8%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为至少2.0%。在又另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为至少2.5%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为至少3.0%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为至少3.5%。在又另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为至少4.5%。
在涉及风险降低率的以上实施例中任一个的一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为至少约2.8%。在又另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为至少约3.0%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为至少约3.5%。在又另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为至少约4.0%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为至少约4.5%。
在涉及风险降低率的以上实施例中任一个的一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为至少2.8%。在又另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为至少3.0%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为至少3.5%。在又另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为至少4.0%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,任一个事件的绝对风险降低率(即,降低总体风险的统计学上显著的绝对量)为至少4.5%。
在其他实施例中,与未施用所述化合物的患者相比,在所述给药期结束时,所述患者在以下事件或特征中的任一项中显示出统计学上显著的量的改善,并且其中在第一次施用所述化合物的时间之前所述患者的血浆lp(a)浓度≥90mg/dl:(i)在选自治疗开始后1、2、3、4、5、6、9、12、13、15、18、21、24和27个月的指定时间点处与基线相比的lp(a)的变化(以mg/dl和nmol/l计);(ii)扩展的脂质特征参数(总胆固醇、ldl-c、apob、hdl-c、非hdl-c、甘油三酯)和hscrp的变化;(iii)新发2型糖尿病的发病率;(iv)由sf-12调查表评估的生活质量;和(v)到主动脉瓣置换术(开放或经导管)或主动脉瓣狭窄住院首次发生的时间。
在其一个实施例中,与未施用所述化合物的患者相比,在所述给药期结束时,在第一次施用所述化合物的时间之前血浆lp(a)浓度≥90mg/dl的患者在以下事件或特征中显示出统计学上显著的量的改善:在选自治疗开始后1、2、3、4、5、6、9、12、13、15、18、21、24和27个月的指定时间点处与基线相比的lp(a)变化(以mg/dl和nmol/l计)。
在其一个实施例中,与未施用所述化合物的患者相比,在所述给药期结束时,在第一次施用所述化合物的时间之前血浆lp(a)浓度≥90mg/dl的患者在以下事件或特征中显示出统计学上显著的量的改善:扩展的脂质特征参数(总胆固醇、ldl-c、apob、hdl-c、非hdl-c、甘油三酯)和hscrp的变化。
在其一个实施例中,与未施用所述化合物的患者相比,在所述给药期结束时,在第一次施用所述化合物的时间之前血浆lp(a)浓度≥90mg/dl的患者在以下事件或特征中显示出统计学上显著的量的改善:新发2型糖尿病的发病率。
在其一个实施例中,与未施用所述化合物的患者相比,在所述给药期结束时,在第一次施用所述化合物的时间之前血浆lp(a)浓度≥90mg/dl的患者在以下事件或特征中显示出统计学上显著的量的改善:通过sf-12调查表评估的生活质量。
在其一个实施例中,与未施用所述化合物的患者相比,在所述给药期结束时,在第一次施用所述化合物的时间之前血浆lp(a)浓度≥90mg/dl的患者在以下事件或特征中显示出统计学上显著的量的改善:到主动脉瓣置换术(开放或经导管)或主动脉瓣狭窄住院首次发生的时间。
在其一个实施例中,针对任一个事件或特征,相对改善率(即,改善事件或特征的统计学上显著的相对量)为至少15%。
在涉及相对改善率的以上实施例中任一个的一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,针对任一个事件,相对改善率(即,改善事件或特征的统计学上显著的相对量)为至少15%。在又另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,相对改善率(即,改善事件或特征的统计学上显著的相对量)为至少20%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,相对改善率(即,改善事件或特征的统计学上显著的相对量)为至少25%。在又另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,相对改善率(即,改善事件或特征的统计学上显著的相对量)为至少30%。在另一个实施例中,对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于90mg/dl的患者,相对改善率(即,改善事件或特征的统计学上显著的相对量)为至少35%。
在一些实施例中,所述给药期为至少六个月。在另一个实施例中,所述给药期为至少一年。在又另一个实施例中,所述给药期为至少两年。在另一个实施例中,所述给药期为至少三年。
在一些实施例中,所述患者接受背景疗法以达到指南定义的目标低密度脂蛋白胆固醇(ldl-胆固醇)水平。
在一些实施例中,所述背景疗法包括以下的至少一项:(i)他汀、(ii)依折麦布和(iii)pcsk9抑制剂。
在一个实施例中,所述背景疗法包括他汀,并且所述患者在第一次施用化合物之前接受最佳剂量的他汀。
在一些实施例中,所述患者具有低于180mmhg的静坐收缩压(sbp)和/或低于110mmhg的舒张bp(dbp)。
在一些实施例中,所述患者在第一次施用所述化合物的时间之前的三个月的时期内未用烟酸治疗。
在一些实施例中,在第一次施用所述化合物时,所述患者为被诊断为患有心力衰竭纽约心脏协会(nyha)iv类。
在一些实施例中,在第一次施用所述化合物的时间之前,所述患者没有出血性中风或其他大出血的病史。
在一些实施例中,在第一次施用所述化合物的时间的3个月内,所述患者未患有心肌梗死、中风、冠状动脉或下肢血运重建、重大心脏或非心脏手术、或脂蛋白单采。
在一些实施例中,所述患者未患有已知的活动性感染或重大血液学、肾、代谢性、胃肠道或内分泌功能障碍。
在一些实施例中,在第一次施用所述化合物的时间之前,所述患者具有大于30ml/min/1.73m2的估计肾小球滤过率(egfr)。
在一些实施例中,在第一次施用所述化合物的时间之前,所述患者不具有小于30ml/min/1.73m2的估计肾小球滤过率(egfr)。
在一些实施例中,所述患者未患有活动性肝病或肝功能障碍,定义为在第一次施用所述化合物的时间之前天冬氨酸氨基转移酶(ast)或丙氨酸氨基转移酶(alt)血清水平是正常上限(uln)的2倍。
在一些实施例中,在第一次施用所述化合物的时间之前,所述患者不具有正常上限(uln)1.5倍的总胆红素。
本披露还提供了用于治疗、预防或改善如本文所述的疾病、障碍或病症的试剂盒,其中所述试剂盒包含:(i)isis681257;和任选地(ii)如本文所述的第二药剂或疗法。
本发明的试剂盒可进一步包括用于使用所述试剂盒通过本文所述的组合疗法治疗、预防或改善如本文所述的疾病、障碍或病症的说明书。
apo(a)治疗性适应症
本披露提供了使用isis681257的方法,所述isis681257是靶向apo(a)核酸的缀合的反义化合物,用于调节受试者中apo(a)的表达。当向人类施用时,isis681257降低apo(a)的表达。
在某些实施例中,本发明提供了用于在药物组合物中使用isis681257治疗受试者的方法。在某些实施例中,所述个体患有apo(a)相关的疾病。在某些实施例中,所述个体患有lp(a)相关的疾病。在某些实施例中,所述个体患有炎症性、心血管和/或代谢疾病、障碍或病症。在某些实施例中,所述受试者患有炎症性、心血管和/或代谢疾病、障碍或病症。
在某些实施例中,所述心血管疾病、障碍或病症(cvd)包括但不限于升高的lp(a)相关的cvd风险、具有升高的lp(a)的复发性心血管事件、主动脉瓣狭窄(例如与高lp(a)相关的钙化性主动脉瓣狭窄)、动脉瘤(例如腹主动脉动脉瘤)、心绞痛、心律失常、动脉粥样硬化、脑血管疾病、冠状动脉疾病、冠心病(chd)、急性心肌梗死(ami)、慢性chd、动脉高血压(ht)、脑血管中风血脂异常、高胆固醇血症、高脂血症、高血压、高甘油三酯血症、心肌梗死、外周血管疾病(例如外周动脉疾病)、中风等。
在某些实施例中,所述心血管事件包括但不限于重大不良心血管事件(mace)(例如心血管死亡、非致命性心肌梗死、非致命性中风和需要住院的紧急冠状动脉血运重建等)、任何原因的死亡、冠心病(chd)死亡、急性心肌梗死(ami)死亡、心力衰竭(hf)死亡、由心脏手术的直接并发症导致的死亡和因缺血而进行的紧急下肢血运重建或截肢等。
在某些实施例中,isis681257调节所述心血管疾病、障碍或病症的生理学标志物或表型。例如,与未经治疗的受试者相比,向人类施用isis681257可以减少lp(a)、ldl和胆固醇水平。在某些实施例中,生理学标志物或表型的调节可以与isis681257对apo(a)的抑制相关。
在某些实施例中,心血管疾病、障碍或病症的生理学标志物是可以量化的。例如,可以通过例如标准的脂质测试来测量和定量lp(a)、ldl或胆固醇水平。对于此类标志物,在某些实施例中,所述标志物可以减少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或99%,或由这些值中的任何两个定义的范围。
同样地,本文提供了用于在有需要的受试者中预防、治疗或改善与所述心血管疾病、障碍或病症相关的症状的方法。在某些实施例中,提供了用于降低与所述心血管疾病、障碍或病症相关的症状的发作率的方法。在某些实施例中,提供了用于降低与所述心血管疾病、障碍或病症相关的症状的严重性的方法。在此类实施例中,所述方法包括向有需要的个体施用治疗有效量的isis681257。
所述心血管疾病、障碍或病症可以多种身体症状为特征。可以用本文所述的化合物和方法预防、治疗、改善或以其他方式调节与所述心血管疾病、障碍或病症相关的对于本领域技术人员已知的任何症状。在某些实施例中,所述症状可以是以下任何一种但不限于心绞痛、胸痛、呼吸浅短、心悸、虚弱、头晕、恶心、出汗、心动过速、心动过缓、心律失常、心房颤动、下肢肿胀、紫绀、疲乏、昏厥、面部麻木、四肢麻木、跛行或肌肉抽筋、腹部发胀或发烧。
在某些实施例中,所述代谢疾病、障碍或病症包括但不限于高血糖症、前驱糖尿病、糖尿病(i型和ii型)、肥胖症、胰岛素抵抗、代谢综合征和糖尿病型血脂异常。
在某些实施例中,isis681257调节所述代谢疾病、障碍或病症的生理学标志物或表型。例如,与未经治疗的受试者相比,向人类施用isis681257可以减少那些受试者中的葡萄糖和胰岛素抵抗水平。在某些实施例中,生理学标志物或表型的调节可以与isis681257对apo(a)的抑制相关。
在某些实施例中,所述代谢疾病、障碍或病症的生理学标志物是可以量化的。例如,可以通过本领域已知的标准测试来测量和定量化葡萄糖水平或胰岛素抵抗。对于此类标志物,在某些实施例中,所述标志物可以减少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或99%,或由这些值中的任何两个定义的范围。在另一个实例中,可以通过本领域已知的标准测试来测量和定量化胰岛素敏感性。对于此类标志物,在某些实施例中,所述标志物可以增加约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或99%,或由这些值中的任何两个定义的范围。
同样地,本文提供了用于在有需要的受试者中预防、治疗或改善与所述代谢疾病、障碍或病症相关的症状的方法。在某些实施例中,提供了用于降低与所述代谢疾病、障碍或病症相关的症状的发作率的方法。在某些实施例中,提供了用于降低与所述代谢疾病、障碍或病症相关的症状的严重性的方法。在此类实施例中,所述方法包括向有需要的个体施用治疗有效量的isis681257。
所述代谢疾病、障碍或病症可以多种身体症状为特征。可以用本文所述的化合物和方法预防、治疗、改善或以其他方式调节与所述代谢疾病、障碍或病症相关的对于本领域技术人员已知的任何症状。在某些实施例中,所述症状可以是以下任何一种但不限于尿量过多(多尿症)、过度口渴和增加的液体摄入(多饮)、视力模糊、无法解释的体重减轻和嗜睡。
在某些实施例中,所述炎症性疾病、障碍或病症包括但不限于升高的lp(a)相关的cvd风险、具有升高的lp(a)的复发性心血管事件、主动脉瓣狭窄(例如与高lp(a)相关的钙化性主动脉瓣狭窄)、冠状动脉疾病(cad)、阿尔茨海默氏病和血栓栓塞性疾病、障碍或病症。某些血栓栓塞性疾病、障碍或病症包括但不限于中风、血栓形成、心肌梗死和外周血管疾病。
在某些实施例中,isis681257调节所述炎症性疾病、障碍或病症的生理学标志物或表型。例如,与未经治疗的受试者相比,向人类施用isis681257可以减少炎症性细胞因子或其他炎症性标志物水平。在某些实施例中,生理学标志物或表型的调节可以与isis681257对apo(a)的抑制相关。
在某些实施例中,所述炎症性疾病、障碍或病症的生理学标志物是可以量化的。例如,可以通过本领域已知的标准测试来测量和定量化细胞因子水平。对于此类标志物,在某些实施例中,所述标志物可以减少至少约5%、10%,15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或99%,或由这些值中的任何两个定义的范围。
同样地,本文提供了用于在有需要的受试者中预防、治疗或改善与所述炎症性疾病、障碍或病症相关的症状的方法。在某些实施例中,提供了用于降低与所述炎症性疾病、障碍或病症相关的症状的发作率的方法。在某些实施例中,提供了用于降低与所述炎症性疾病、障碍或病症相关的症状的严重性的方法。在此类实施例中,所述方法包括向有需要的个体施用治疗有效量的isis681257。
在某些实施例中,提供了治疗患有apo(a)相关的疾病、障碍或病症的个体的方法,所述方法包括施用治疗有效量的一种或多种如本文所述的药物组合物。在某些实施例中,所述个体具有升高的apo(a)水平。在某些实施例中,提供了治疗患有lp(a)相关的疾病、障碍或病症的个体的方法,所述方法包括施用治疗有效量的一种或多种如本文所述的药物组合物。在某些实施例中,所述个体具有升高的lp(a)水平。在某些实施例中,所述个体具有炎症性、心血管和/或代谢疾病、障碍或病症。在某些实施例中,施用治疗有效量isis681257伴随对apo(a)或lp(a)水平的监测。在某些实施例中,施用治疗有效量的isis681257伴随对炎症性、心血管和/或代谢疾病或与apo(a)表达相关的其他疾病过程的标志物的监测,以确定个体对isis681257的应答。医师可以使用个体对施用isis681257的响应来确定使用isis681257的治疗性干预的量和持续时间。
在某些实施例中,施用isis681257导致apo(a)表达降低了至少约15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或99%,或由这些值中的任何两个定义的范围。在某些实施例中,apo(a)表达降低至至少≤100mg/dl、≤90mg/dl、≤80mg/dl、≤70mg/dl、≤60mg/dl、≤50mg/dl、≤40mg/dl、≤30mg/dl、≤20mg/dl或≤10mg/dl。
在某些实施例中,施用isis681257导致lp(a)表达降低了至少约15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或99%,或由这些值中的任何两个定义的范围。在某些实施例中,lp(a)表达降低至至少≤200mg/dl、≤190mg/dl、≤180mg/dl、≤175mg/dl、≤170mg/dl、≤160mg/dl、≤150mg/dl、≤140mg/dl、≤130mg/dl、≤120mg/dl、≤110mg/dl、≤100mg/dl、≤90mg/dl、≤80mg/dl、≤70mg/dl、≤60mg/dl、≤55mg/dl、≤50mg/dl、≤45mg/dl、≤40mg/dl、≤35mg/dl、≤30mg/dl、≤25mg/dl、≤20mg/dl、≤15mg/dl或≤10mg/dl。
在某些实施例中,本发明提供了在药物制备中使用isis681257的方法。在某些实施例中,将包含isis681257的药物组合物用于制备用于治疗患有或易患有炎症性、心血管和/或代谢疾病、障碍或病症的患者的药物。
apo(a)治疗群体
具有高lp(a)水平的某些受试者处于不同疾病的重大风险中(lippi等人,clinicachimicaacta[临床化学学报],2011,412:797-801;solfrizz等人)。例如,认为lp(a)水平将大于或等于75纳摩尔/升(nmol/l)或≥30mg/dl的受试者具有针对不同疾病的增加的风险。在具有高lp(a)水平的许多受试者中,当前的治疗不能将其lp(a)水平降至安全水平。apo(a)在lp(a)的形成中起重要作用,因此降低apo(a)可以降低lp(a),并预防、治疗或改善与lp(a)相关的疾病。
在某些实施例中,用本文披露的化合物和方法进行的治疗指示了具有升高的apo(a)水平和/或lp(a)水平的人类。在某些实施例中,所述人类的apo(a)水平≥10mg/dl、≥20mg/dl、≥30mg/dl、≥40mg/dl、≥50mg/dl、≥60mg/dl、≥70mg/dl、≥80mg/dl、≥90mg/dl或≥100mg/dl。
在某些实施例中,所述人类的lp(a)水平≥70mg/dl、≥80mg/dl、≥90mg/dl、≥100mg/dl、≥110mg/dl、≥120mg/dl、≥130mg/dl、≥140mg/dl、≥150mg/dl、≥160mg/dl、≥170mg/dl、≥175mg/dl、≥180mg/dl、≥190mg/dl或≥200mg/dl。
在某些实施例中,所述人类具有高于正常上限的apo(a)水平,例如其中所述人类具有apo(a)水平≥30mg/dl、≥35mg/dl、≥40mg/dl、≥50mg/dl、≥60mg/dl、≥70mg/dl、≥80mg/dl、≥90mg/dl、≥100mg/dl、≥110mg/dl、≥120mg/dl、≥130mg/dl、≥140mg/dl、≥150mg/dl、≥160mg/dl、≥170mg/dl、≥175mg/dl、≥180mg/dl、≥190mg/dl或≥200mg/dl。
在某些实施例中,在第一次施用所述化合物的时间之前(即,在治疗开始的时间之前),所述人类患者的lp(a)水平≥70mg/dl。
在某些实施例中,所述人类患者接受如下的ldl-胆固醇调低治疗:
-根据当地的实践/指南,用以满足目标ldl-c水平的最佳ldl-c调低治疗,或
-最高耐受剂量的他汀和/或伴随其他最佳ldl-调低疗法(例如依折麦布、胆固醇吸收抑制剂、贝特类、pcsk9抑制剂),或
-根据当地的实践/指南,另一种最佳ldl-调低疗法(例如依折麦布、胆固醇吸收抑制剂、贝特类、pcsk9抑制剂)。
在某些实施例中,所述人类患者患有确诊的心血管疾病。确诊的cv疾病,定义为以下三种病症的any:
1.具有在筛查访视之前≥3个月至≤10年的时期中发生的自发性心肌梗死的病史(不是由pci或cabg引起),并且记录如下:
(i)急性mi(住院记录):要求记录心脏生物标志物(优选地心肌肌钙蛋白)的上升和/或下降,其中至少一个值高于参考上限(url)的第99个百分位数,并且是以下的至少一项:
a.缺血的症状
b.ecg变化指示急性心肌缺血(新的st-t变化或新的lbbb;请参见附录2,st和t波的变化)
c.病理性q波的发展(请参见附录2,病理性q波的定义)
d.以与缺血性病因学一致的模式,新的存活心肌丧失或新的区域壁运动异常的影像学证据
e.通过血管造影(包括冠状动脉内成像)鉴定冠状动脉血栓
(ii)既往mi(无可用的急性事件的医院记录):要求记录下列任一项:
a.在没有缺血性病因的情况下,病理性q波(有或无症状),
b.在没有非缺血性原因的情况下,变薄且不能收缩的存活心肌区域缺失的影像学证据
2.在由ct扫描、mri或其他可视化方法记录的筛查访视之前≥3个月至≤10年的时期中发生的缺血性中风的病史(由中枢神经系统组织梗塞导致的局灶性脑、脊髓或视网膜功能障碍的急性发作)。短暂性缺血发作或栓塞性中风(非动脉粥样硬化起源)不是符合条件的事件。
3.临床上显著的症状性外周动脉疾病,由具有踝肱指数≤0.90和/或归因于下肢缺血的截肢或血运重建的间歇性跛行证实。血栓闭塞性血管炎不是符合条件的事件。
某些apo(a)给药方案
在某些实施例中,如本文定义的,每月一次向有需要的人类受试者施用在约75至约85mg之间的isis681257。
在某些实施例中,如本文定义的,每4周一次向有需要的人类受试者施用在约75至约85mg之间的isis681257。
在某些实施例中,如本文定义的,每月一次向有需要的人类受试者施用约80mg的isis681257。
在某些实施例中,如本文定义的,每4周一次向有需要的人类受试者施用约80mg的isis681257。
在某些实施例中,如本文定义的,在给药期间,向有需要的人类受试者施用以上量的isis681257。
在某些实施例中,所述给药期为至少六个月。在另一个实施例中,所述给药期为至少一年。在又另一个实施例中,所述给药期为至少两年。在另一个实施例中,所述给药期为三年。在另一个实施例中,所述给药期为至少四年。
在某些实施例中,如所定义的,在给药期每四周向有需要的人类受试者施用80mg的isis681257。在另一个实施例中,如所定义的,每四周向有需要的人类受试者施用80mg的isis681257,持续至少六个月。在另一个实施例中,如所定义的,每四周向有需要的人类受试者施用80mg的isis681257,持续至少一年。在另一个实施例中,如所定义的,每四周向有需要的人类受试者施用80mg的isis681257持续至少两年。在另一个实施例中,如所定义的,每四周向有需要的人类受试者施用80mg的isis681257,持续三年。在另一个实施例中,如所定义的,每四周向有需要的人类受试者施用80mg的isis681257,持续至少四年。
在某些实施例中,如所定义的,在给药期每月一次向有需要的人类受试者施用80mg的isis681257。在另一个实施例中,如所定义的,每月一次向有需要的人类受试者施用80mg的isis681257,持续至少六个月。在另一个实施例中,如所定义的,每月一次向有需要的人类受试者施用80mg的isis681257,持续至少一年。在另一个实施例中,如所定义的,每月一次向有需要的人类受试者施用80mg的isis681257,持续至少两年。在另一个实施例中,如所定义的,每月一次向有需要的人类受试者施用80mg的isis681257,持续三年。在另一个实施例中,如所定义的,每月一次向有需要的人类受试者施用80mg的isis681257,持续至少四年。
某些治疗和给药方案
在某些实施例中,本披露涉及在患有确诊的心血管疾病的患者中降低心血管事件的风险的方法,所述方法包括通过皮下注射向所述患者每月一次施用包含约75mg至约85mg化合物isis681257的单位剂量,其中在第一次施用所述化合物的时间之前,所述患者的血浆lp(a)浓度大于或等于70mg/dl,并且其中所述心血管事件选自重大不良心血管事件(mace)、全因死亡、冠心病(chd)死亡、急性心肌梗死(ami)死亡、心力衰竭(hf)死亡、由心脏手术的直接并发症导致的死亡和因缺血而进行的紧急下肢血运重建或截肢。
在另一个实施例中,本披露涉及在患有确诊的心血管疾病的患者中降低心血管事件的风险的方法,所述方法包括通过皮下注射向所述患者每月一次施用包含约75mg至约85mg化合物isis681257的单位剂量,其中在第一次施用所述化合物的时间之前,所述患者的血浆lp(a)浓度大于或等于70mg/dl,并且其中所述患有确诊的心血管疾病的患者是具有以下至少一项的患者:(i)自发性心肌梗死病史;(i)缺血性中风病史;和(iii)临床上显著的症状性外周动脉疾病。
在另一个实施例中,本披露涉及在患有确诊的心血管疾病的患者中降低心血管事件的风险的方法,所述方法包括通过皮下注射向所述患者每月一次施用包含约75mg至约85mg化合物isis681257的单位剂量,其中在第一次施用所述化合物的时间之前,所述患者的血浆lp(a)浓度大于或等于70mg/dl,并且其中所述心血管事件选自重大不良心血管事件(mace)、全因死亡、冠心病(chd)死亡、急性心肌梗死(ami)死亡、心力衰竭(hf)死亡、由心脏手术的直接并发症导致的死亡和因缺血而进行的紧急下肢血运重建或截肢;并且其中所述患有确诊的心血管疾病的患者是具有以下至少一项的患者:(i)自发性心肌梗死病史;(i)缺血性中风病史;和(iii)临床上显著的症状性外周动脉疾病。
在另一个实施例中,本披露涉及在患有确诊的心血管疾病的患者中降低心血管事件的风险的方法,所述方法包括通过皮下注射向所述患者每月一次施用包含约77mg至约82mg化合物isis681257的单位剂量,其中在第一次施用所述化合物的时间之前,所述患者的血浆lp(a)浓度大于或等于70mg/dl,其中所述心血管事件选自重大不良心血管事件(mace)、全因死亡、冠心病(chd)死亡、急性心肌梗死(ami)死亡、心力衰竭(hf)死亡、由心脏手术的直接并发症导致的死亡和因缺血而进行的紧急下肢血运重建或截肢;并且其中所述患有确诊的心血管疾病的患者是具有以下至少一项的患者:(i)自发性心肌梗死病史;(i)缺血性中风病史;和(iii)临床上显著的症状性外周动脉疾病。
在另一个实施例中,本披露涉及在患有确诊的心血管疾病的患者中降低心血管事件的风险的方法,所述方法包括通过皮下注射向所述患者每月一次施用包含约80mg化合物isis681257的单位剂量,其中在第一次施用所述化合物的时间之前,所述患者的血浆lp(a)浓度大于或等于70mg/dl,其中所述心血管事件选自重大不良心血管事件(mace)、全因死亡、冠心病(chd)死亡、急性心肌梗死(ami)死亡、心力衰竭(hf)死亡、由心脏手术的直接并发症导致的死亡和因缺血而进行的紧急下肢血运重建或截肢;并且其中所述患有确诊的心血管疾病的患者是具有以下至少一项的患者:(i)自发性心肌梗死病史;(i)缺血性中风病史;和(iii)临床上显著的症状性外周动脉疾病。
在另一个实施例中,本披露涉及在患有确诊的心血管疾病的患者中降低心血管事件的风险的方法,所述方法包括通过皮下注射向所述患者每月一次施用包含约80mg化合物isis681257的单位剂量,其中在第一次施用所述化合物的时间之前,所述患者的血浆lp(a)浓度大于或等于70mg/dl,其中所述心血管事件选自重大不良心血管事件(mace)、全因死亡、冠心病(chd)死亡、急性心肌梗死(ami)死亡、心力衰竭(hf)死亡、由心脏手术的直接并发症导致的死亡和因缺血而进行的紧急下肢血运重建或截肢;其中所述患有确诊的心血管疾病的患者是具有以下至少一项的患者:(i)自发性心肌梗死病史;(i)缺血性中风病史;和(iii)临床上显著的症状性外周动脉疾病;并且其中针对任一个事件,相对风险降低率为(i)对于在第一次施用所述化合物的时间之前血浆lp(a)浓度大于或等于70mg/dl的患者,为至少15%,优选地至少20%,更优选地至少25%;(ii)对于在第一次施用所述化合物的时间之前,血浆lp(a)浓度大于或等于90mg/dl的患者,为至少20%,优选地至少25%,更优选地至少30%。
在另一个实施例中,本披露涉及在患有确诊的心血管疾病的患者中降低心血管事件的风险的方法,所述方法包括通过皮下注射向所述患者每月一次施用包含不超过80mg化合物isis681257的单位剂量,其中在第一次施用所述化合物的时间之前,所述患者的血浆lp(a)浓度大于或等于70mg/dl,其中所述心血管事件选自重大不良心血管事件(mace)、全因死亡、冠心病(chd)死亡、急性心肌梗死(ami)死亡、心力衰竭(hf)死亡、由心脏手术的直接并发症导致的死亡和因缺血而进行的紧急下肢血运重建或截肢;并且其中所述患有确诊的心血管疾病的患者是具有以下至少一项的患者:(i)自发性心肌梗死病史;(i)缺血性中风病史;和(iii)临床上显著的症状性外周动脉疾病。
在某些实施例中,所述患者接受背景疗法,以达到指南定义的目标低密度脂蛋白胆固醇(ldl-胆固醇)水平;所述患者具有低于180mmhg的静坐收缩压(sbp)和/或低于110mmhg的舒张bp(dbp),所述患者在第一次施用所述化合物的时间之前的三个月的时期内未用烟酸治疗;在第一次施用所述化合物时,所述患者未被诊断为患有心力衰竭纽约心脏协会(nyha)iv类的心力衰竭;在第一次施用所述化合物的时间之前,所述患者没有出血性中风或其他大出血的病史;在第一次施用所述化合物的时间的3个月内,所述患者未患有心肌梗死、中风、冠状动脉或下肢血运重建、重大心脏或非心脏手术、或脂蛋白单采;所述患者未患有已知的活动性感染或重大血液学、肾、代谢性、胃肠道或内分泌功能障碍;在第一次施用所述化合物的时间之前,所述患者具有大于30ml/min/1.73m2的估计肾小球滤过率(egfr);在第一次施用所述化合物的时间之前,所述患者不具有小于30ml/min/1.73m2的估计肾小球滤过率(egfr);所述患者未患有活动性肝病或肝功能障碍,定义为在第一次施用所述化合物的时间之前天冬氨酸氨基转移酶(ast)或丙氨酸氨基转移酶(alt)血清水平是正常上限(uln)的2倍;或在第一次施用所述化合物或其组合的时间之前所述患者不具有正常上限(uln)1.5倍的总胆红素。
某些药物组合物
在某些实施例中,本披露提供了包含一种或多种反义化合物的药物组合物。在某些实施例中,这样的药物组合物包含合适的药学上可接受的稀释剂或载体。在某些实施例中,药物组合物包含无菌盐水溶液和一种或多种反义化合物。在某些实施例中,这样的药物组合物由无菌盐水溶液和一种或多种反义化合物组成。在某些实施例中,所述无菌盐水是药物级盐水。在某些实施例中,药物组合物包含一种或多种反义化合物和无菌水。在某些实施例中,药物组合物由一种或多种反义化合物和无菌水组成。在某些实施例中,所述无菌盐水是药物级水。在某些实施例中,药物组合物包含一种或多种反义化合物和磷酸盐缓冲盐水(pbs)。在某些实施例中,药物组合物由一种或多种反义化合物和无菌磷酸盐缓冲盐水(pbs)组成。在某些实施例中,所述无菌盐水是药物级pbs。
在某些实施例中,所述无菌液体是水。在另一个实施例中,所述无菌液体是含有磷酸钠缓冲液的水。在另一个实施例中,所述无菌液体是含有磷酸钠缓冲液和氯化钠的水。
在某些实施例中,将所述化合物配制在不超过1.3ml的所述无菌液体中。在另一个实施例中,将所述化合物配制在不超过1.2ml的所述无菌液体中。在另一个实施例中,将所述化合物配制在不超过1.2ml的所述无菌液体中。在另一个实施例中,将所述化合物配制在不超过1.0ml的所述无菌液体中。在另一个实施例中,将所述化合物配制在不超过0.8ml的所述无菌液体中。在另一个实施例中,将所述化合物配制在不超过0.5ml的所述无菌液体中。在又另一个实施例中,将所述化合物配制在不超过0.4ml的所述无菌液体中。在另一个实施例中,将所述化合物配制在不超过0.25ml的所述无菌液体中。在又另一个实施例中,将所述化合物配制在不超过0.2ml的所述无菌液体中。在另一个实施例中,将所述化合物配制在不超过0.1ml的所述无菌液体中。在又另一个实施例中,将所述化合物配制在不超过0.05ml的所述无菌液体中。
在某些实施例中,将所述化合物配制在约1.3ml的所述无菌液体中。在另一个实施例中,将所述化合物配制在约1.2ml的所述无菌液体中。在另一个实施例中,将所述化合物配制在约1.2ml的所述无菌液体中。在另一个实施例中,将所述化合物配制在约1.0ml的所述无菌液体中。在另一个实施例中,将所述化合物配制在约0.8ml的所述无菌液体中。在另一个实施例中,将所述化合物配制在约0.5ml的所述无菌液体中。在又另一个实施例中,将所述化合物配制在约0.4ml的所述无菌液体中。在另一个实施例中,将所述化合物配制在约0.25ml的所述无菌液体中。在又另一个实施例中,将所述化合物配制在约0.2ml的所述无菌液体中。
在某些实施例中,可以将反义化合物与药学上可接受的活性和/或惰性物质混合以制备药物组合物或配制品。药物组合物的组成和配制方法取决于许多标准,包括但不限于施用途径、疾病程度或待施用的剂量。
在某些实施例中,本文提供的药物组合物包含一个或多个经修饰的寡核苷酸和一种或多种赋形剂。在某些此类实施例中,赋形剂选自水、盐溶液、醇、聚乙二醇、明胶、乳糖、淀粉酶、硬脂酸镁、滑石、硅酸、粘性石蜡、羟甲基纤维素和聚乙烯吡咯烷酮。
在某些实施例中,本文提供的药物组合物包含递送系统。递送系统的实例包括但不限于脂质体和乳剂。某些递送系统可用于制备某些药物组合物,包括那些包含疏水性化合物的药物组合物。在某些实施例中,使用某些有机溶剂(例如二甲基亚砜)。
在某些实施例中,制备药物组合物以通过注射(例如静脉内、皮下、肌肉内等)施用。在某些此类实施例中,药物组合物包含载体,并配制在水溶液中,例如水或生理相容性缓冲液,例如汉克斯溶液、林格氏溶液或生理盐水缓冲液。在某些实施例中,其他成分(例如,有助于溶解或用作防腐剂的成分)包括在内。在某些实施例中,使用合适的液体载体,悬浮剂等制备可注射的悬浮液。某些用于注射的药物组合物以单位剂型存在,例如在安瓿或在多剂量容器中。某些用于注射的药物组合物是在油性或水性媒介物中的悬浮液、溶液或乳剂,并且可以包含配制剂(例如悬浮剂、稳定剂和/或分散剂)。适合于在用于注射的药物组合物中使用的某些溶剂包括但不限于亲脂性溶剂和脂肪油(例如芝麻油);合成脂肪酸酯(例如油酸乙酯或甘油三酸酯);以及脂质体。水性注射悬浮液可包含增加悬浮液粘度的物质(例如羧甲基纤维素钠、山梨糖醇或葡聚糖)。任选地,此类悬浮液还可包含合适的稳定剂或增加药剂的溶解度的药剂,以允许制备高度浓缩的溶液。
在某些实施例中,本披露提供了向受试者施用包含本披露寡核苷酸的药物组合物的方法。合适的施用途径包括肠胃外的(例如静脉内、肌肉内、髓内和皮下)。
用于使用的化合物
根据本发明的治疗方法的所有前述实施例均同样适用于
-如本文定义的化合物isis681257或包含如本文定义的化合物isis681257的药物组合物用于制造用于根据本发明使用的药物的用途,
-如本文定义的化合物isis681257或包含如本文定义的化合物isis681257的药物组合物根据本发明的用途,
-用于根据本发明使用的如本文定义的化合物isis681257或包含如本文定义的化合物isis681257的药物组合物。
特别地,针对在患有确诊的心血管疾病的患者中降低心血管事件的风险的方法,所述方法包括通过皮下注射每月一次或每四周一次向所述患者施用包含约75mg至约85mg化合物isis681257的单位剂量,其中在第一次施用所述化合物的时间之前,所述患者的血浆lp(a)浓度大于或等于70mg/dl的所有前述实施例同样适用于
-如本文定义的化合物isis681257或包含如本文定义的化合物isis681257的药物组合物用于在患有确诊的心血管疾病的患者中降低心血管事件的风险中使用,所述使用包括通过皮下注射每月一次或每四周一次向所述患者施用包含约75mg至约85mg化合物isis681257的单位剂量,其中在第一次施用所述化合物的时间之前,所述患者的血浆lp(a)浓度大于或等于70mg/dl。
-如本文定义的化合物isis681257或包含如本文定义的化合物isis681257的药物组合物在制造用于皮下注射的单位剂量形式的药物中的用途,所述药物包含约75mg至约85mg的化合物isis681257,其中将所述药物每月一次或每四周一次向患有确诊的心血管疾病的患者施用,用于降低心血管事件的风险,其中在第一次施用所述化合物的时间之前,所述患者的血浆lp(a)浓度大于或等于70mg/dl。
-如本文定义的化合物isis681257或包含如本文定义的化合物isis681257的药物组合物用于作为用于皮下注射的单位剂量形式的药物使用,所述药物包含约75mg至约85mg的化合物isis681257,其中将所述药物每月一次或每四周一次向患有确诊的心血管疾病的患者施用,用于降低心血管事件的风险,其中在第一次施用所述化合物的时间之前,所述患者的血浆lp(a)浓度大于或等于70mg/dl。
-如本文定义的化合物isis681257或包含如本文定义的化合物isis681257的药物组合物作为用于皮下注射的单位剂量形式的药物的用途,所述药物包含约75mg至约85mg的化合物isis681257,其中将所述药物每月一次或每四周一次向患有确诊的心血管疾病的患者施用,用于降低心血管事件的风险,其中在第一次施用所述化合物的时间之前,所述患者的血浆lp(a)浓度大于或等于70mg/dl
非限制性披露和通过引用并入
尽管已经根据某些实施例特异性地描述了本文所述的某些化合物、组合物和方法,但是以下实例仅用于举例说明本文所述的化合物,而不旨在对其进行限制。本申请中引用的每个参考文献,genbank登录号等均通过引用以其整体并入本文。
尽管随本申请所附的序列表将每个序列根据需要鉴定为“rna”或“dna”,但实际上,可以用化学修饰的任何组合来修饰那些序列。本领域技术人员将容易理解,在某些情况下,如“rna”或“dna”之类的用于描述经修饰的寡核苷酸的命名是任意的。例如,包含含有2'-oh糖部分和胸腺嘧啶碱基的核苷的寡核苷酸可以被描述为具有经修饰的糖(对于dna的天然2'-h,为2'-oh)的dna或具有经修饰的碱基的rna(对于rna的天然尿嘧啶,为胸腺嘧啶(甲基化的尿嘧啶))。
因此,本文提供的核酸序列(包括但不限于在序列表中的那些核酸序列)旨在涵盖含有天然的或经修饰的rna和/或dna的任何组合的核酸(包括但不限于具有经修饰的核碱基的此类核酸)。作为进一步的实例,并且不限于,具有核碱基序列“atcgatcg”的寡核苷酸涵盖任何具有这种核碱基序列的寡核苷酸(无论是经修饰的或未经修饰的),包括但不限于包含rna碱基的此类化合物,例如具有序列“aucgaucg”的那些寡核苷酸和具有一些dna碱基和一些rna碱基(例如“aucgatcg”)的那些寡核苷酸以及具有其他经修饰的碱基(例如“atmecgaucg”)的寡核苷酸,其中mec指示在5-位置处包含甲基基团的胞嘧啶碱基。
实例
通过以下实例进一步说明本披露,这些实例不应解释为将本披露的范围或精神限制于本文描述的具体程序。应理解的是,提供这些实例是为了说明某些实施例,并且不旨在由其限制本披露的范围。应进一步理解的是,可以采用多种其他实施例、修改及其等效物,本领域技术人员可以想到这些实施例、修改及其等效物,而不脱离本披露的精神和/或所附权利要求书的范围。
实例1:一项评估使用isis681257调低脂蛋白(a)对患有确诊的心血管疾病的患者中重大心血管事件的影响的随机分配的双盲、安慰剂-对照的、多中心研究
缩写列表
专业术语
目的所述研究是一项关键的3期研究,被设计为测试以下假设:用isis68125780mg皮下(sc)每月一次(qm)的治疗将显著降低患有确诊的cvd且具有升高的lp(a)水平的患者中mace(即,cv死亡、非致命性心肌梗死(mi)、非致命性中风和紧急冠状动脉血运重建)的风险,根据当地指南所述患者接受除lp(a)之外的针对cv风险因素的治疗,用于降低在患有确诊的cvd且具有升高的lp(a)的患者中的心血管风险。
目标和终点
概述:这项研究的主要目标是证明与安慰剂相比tqj230在降低扩展的mace(心血管死亡、非致命性mi、非致命性中风和需要住院的紧急冠状动脉血运重建)在1)患有确诊的cvd(lp(a)≥70mg/dl)的总体研究群体和/或2)患有确诊的cvd和lp(a)≥90mg/dl的亚群体中的风险方面的优越性。总体试验群体和亚群体(≥90mg/dl)中的次要目标是(i)证明与安慰剂相比tqj230在降低cv死亡、非致命性mi和非致命性中风的mace综合的风险方面的优越性;和(ii)证明与安慰剂相比tqj230在降低冠心病(chd)结果:归因于chd的死亡、非致命性mi和需要住院的紧急冠状动脉血运重建的综合的风险方面的优越性;和(iii)以评估全因死亡的比率
该研究针对相同的科学假设具有两个主要目标:一个为处于cv事件的高风险的完整研究群体,并且另一个为预期处于更高的风险(即患者的lp(a)值≥90mg/dl)的亚群体。成功实现主要目标需要满足两个主要目标之一,或同时满足两个主要目标。一个独立的临床终点委员会(cec)将裁定所有主要终点和次要终点。对所有端点的定义将包含在cec章程和终点手册中,所述章程和手册将分别提供给cec和研究人员。
一个或多个主要目标和终点:
为证明与安慰剂相比,isis681257在降低扩展的mace(心血管死亡、非致命性mi、非致命性中风和需要住院的紧急冠状动脉血运重建)在患有确诊的cvd且lp(a)≥70mg/dl的总体研究群体中的风险方面的优越性。终点:为评估在具有升高的lp(a)≥70mg/dl的患者群体中到经cec证实的扩展的mace(心血管死亡、非致命性mi、非致命性中风和需要住院的紧急冠状动脉血运重建)首次发生的时间;和/或
为证明与安慰剂相比,isis681257在降低扩展的mace(心血管死亡、非致命性mi、非致命性中风和需要住院的紧急冠状动脉血运重建)在患有确诊的cvd且lp(a)≥90mg/dl的亚群体中的风险方面的优越性。终点:为评估在具有升高的lp(a)≥90mg/dl的患者群体中到经cec证实的扩展的mace(心血管死亡、非致命性mi、非致命性中风和需要住院的紧急冠状动脉血运重建)首次发生的时间。
一个或多个次要目标和终点:
在总体试验群体和亚群体(≥90mg/dl)中:
证明与安慰剂相比,isis681257在降低cv死亡、非致命性mi和非致命性中风的mace综合的风险方面的优越性。终点:到经cec证实的mace(cv死亡、非致命性mi和非致命性中风)的综合终点首次发生的时间。
证明与安慰剂相比,isis681257在降低冠心病(chd)结果:归因于chd的死亡、非致命性mi和需要住院的紧急冠状动脉血运重建的综合的风险方面的优越性。终点:到经cec证实的chd:chd死亡、非致命性mi、需要住院的紧急冠状动脉血运重建的综合终点首次发生的时间。
以评估全因死亡的比率。
终点:经cec证实了从随机分配到研究结束的全因死亡。
探索性目的和终点:
在总体试验群体和亚群体(≥90mg/dl)中:
在降低全因死亡率、非致命性mi和非致命性中风的综合的风险方面,与安慰剂相比,对isis681257进行评估。终点:到全因死亡、非致命性mi和非致命性中风的综合首次发生的时间。
对于总血管事件:cv死亡、非致命性mi、非致命性中风、需要住院的紧急冠状动脉血运重建和归因于缺血的紧急下肢血运重建或截肢的综合,与安慰剂相比,对isis681257进行评估。终点:到总血管事件:cv死亡、非致命性mi、非致命性中风、需要住院的紧急冠状动脉血运重建和归因于缺血的紧急下肢血运重建或截肢的综合终点首次发生的时间。
针对全因死亡率、非致命性mi、非致命性中风和需要住院的紧急冠状动脉血运重建的综合终点,与安慰剂相比,对isis681257进行评估。终点:到全因死亡、非致命性mi、非致命性中风和需要住院的紧急冠状动脉血运重建的综合终点首次发生的时间。
评估与安慰剂相比,isis681257在降低致命性和非致命性中风的综合的风险。终点:到经cec证实的致命性和非致命性中风的综合首次发生的时间。
评估在具有外周动脉疾病(pad)病史的患者中重大不良肢体事件(male)的比率。终点:到急性下肢缺血、因缺血而进行的下肢截肢或紧急下肢血运重建首次发生的时间。
评估不稳定型心绞痛的住院率。终点:到不稳定型心绞痛住院首次发生的时间。
评估心力衰竭的住院率。终点:到心力衰竭住院首次发生的时间。
评估lp(a)的变化。终点:在所选时间点处与基线相比的lp(a)变化。
评估扩展的脂质特征参数和hscrp的变化。终点:与在指定时间点处的基线相比总胆固醇、ldl-c、apob、hdl-c、非hdl-c,甘油三酯和hscrp的变化。
为评估新发2型糖尿病的发病率。终点:诊断2型糖尿病的时间。
评估生活质量。终点:与在指定时间点处的基线相比,健康和舒适(sf-12调查表)的变化
探索患者子集的药代动力学和免疫原性。终点:isis681257药物暴露量和抗药物抗体形成。
评估isis681257对主动脉瓣狭窄临床终点的影响。终点:到主动脉瓣手术(经皮球囊主动脉瓣膜成形术、外科(心脏直视)主动脉瓣(av)置换术、经股动脉经导管av置换术、经心尖/经主动脉av置换术、瓣膜内瓣膜置换术(valve-in-valve)等其他手术)或因主动脉瓣狭窄住院的首次发生的时间。
研究设计
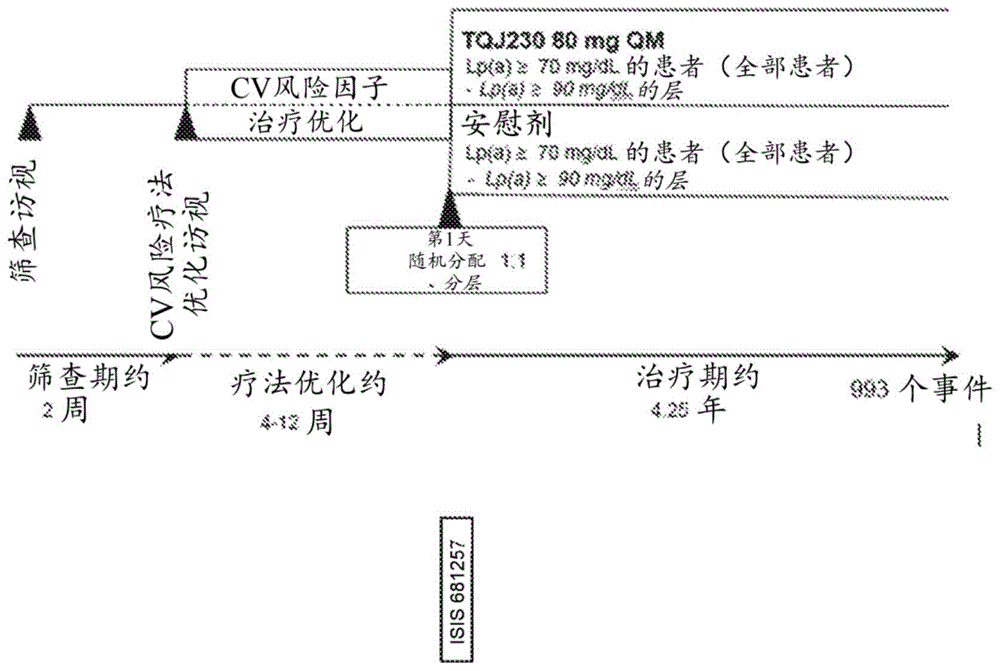
这是一项随机分配、双盲、平行组、安慰剂对照的、多中心研究,将isis68125780mgs.c.qm与安慰剂在如由心肌梗死病史、缺血性中风病史或症状性外周动脉疾病(pad)和升高的lp(a)水平证明的患有确诊的cvd的受试者中进行比较。招募将针对大约30%的随机受试者,以在随机分配之前在≥3个月和大约12个月之间患有指数性心肌梗死。该研究由以下组成:大约2周的筛查期,随后是大约4-12周的cv风险因素疗法优化期(如果需要),以及双盲治疗期。双盲期的最小随访时间要求为2.5年,预计总体试验持续时间为大约4.25年,在此期间预期将累积993个主要终点事件。当993个主要cv事件已经累积或所有受试者都接受了至少2.5年的随访时间时(无论以后如何),该研究将结束。(参见图1)
筛查期和筛查期后的随机分配
在筛查访视后的研究访视中,将确定受试者的资格以及用于优化cv风险因素(例如血压、ldl-胆固醇和2型糖尿病)的治疗的需求。满足合格标准且不需要根据当地的实践/指南进一步优化其ldl-胆固醇治疗和/或针对其他cv风险因素的治疗的受试者将被随机分配,即直接进入第1天访视。
cv风险因素疗法的优化(如果需要)和随机分配
只有需要根据当地的实践/指南进一步优化其ldl-胆固醇(ldl-c)治疗和/或其针对其他cv风险因素的治疗的受试者应该在“cv风险因素疗法优化”期间完成另外的访视。在cv风险因素疗法优化访视中,将指导他们按照国际建议或等同的当地建议来遵循生活方式的改变。他们针对cv风险因素的治疗将根据当地的实践/指南进行优化。
大约4周后,受试者将返回现场进行常规访视。研究人员将评估他们经优化的治疗的疗效和安全性/耐受性。可以根据需要调整cv风险因素的治疗或其他治疗。
·可以将不需要根据当地的实践/指南进一步优化其针对cv风险因素的治疗并满足合格标准的受试者进行随机分配(第1天访视)
·如果认为需要进一步优化针对cv风险因素的治疗,则患者将完成另外的访视
大约4周后,受试者将再次进行另一项研究访视:
·可以将不需要根据当地的实践/指南进一步优化其针对cv风险因素的治疗并满足合格标准的受试者进行随机分配(第1天访视)
·如果认为需要进一步优化针对cv风险因素的治疗,则cv疗法优化期可以再延长4周,使总疗法优化期增加长达大约12周。在完成这些另外的访视后,将对合格的受试者进行随机分配(第1天访视)。
双盲治疗期
合适的受试者将在筛查后或在‘cv风险因素治疗优化’期后被随机分配,从而以大约每30天自行施用或由护理人员或现场人员施用皮下注射isis68125780mgqm或安慰剂。将基于在筛查时的lp(a)值(≥或<90mg/dl)和地理区进行随机分配分层。将根据功效、安全性和其他与研究相关的评估的评估时间表对受试者随访。
在双盲期间,可以对ldl-c调低疗法进行以下剂量调整:
·在需要此类变化的不良事件的情况下,可以进行ldl-c调低治疗的中断、剂量降低或中止。
·剂量增加或增加另一种ldl-c调低治疗:随机访视后脂质评估将不知情,然而自随机访视(或更早,如果缺少此值)增加ldl-c≥高于预先指定的算法阈值的情况下,则中心实验室将向研究人员发出警报进行ldl疗法调整。该阈值算法将在试验的实验室手册中提供和定义。参与实施这项试验的研究人员和现场工作人员以及参与受试者的护理和管理有关的所有医务人员,应避免在随机分配(第1天)至研究完成之间的时间内获得血脂板测试。如果获得了血脂板测试,则必须采取所有合理的措施以确保研究对象不了解结果。
此外,根据当地的实践/指南,在双盲期间针对动脉粥样硬化疾病的其他风险因素(例如高血压和糖尿病)应进行最佳治疗。除非因不良事件而需要调整剂量,否则伴随cv风险减低药物和il-6抑制剂的治疗剂量应保持稳定。
群体
满足合格标准的、年龄在18至80岁的大约7,680名患者(男性和女性)将被随机分配。
入选和排除标准
关键入选标准:
·在筛查访视时,lp(a)≥70mg/dl
·最佳ldl-胆固醇调低治疗
·其他cv风险因素的最佳治疗
·心肌梗死:在筛查访视之前≥3个月至≤10年,和/或
·缺血性中风:在筛查访视之前≥3个月至≤10年,和/或
·临床上显著的症状性外周动脉疾病
关键排除标准:
·不受控制的高血压
·心力衰竭纽约心脏协会(nyha)iv类
·任何器官系统的恶性肿瘤病史
·出血性中风或其他大出血的病史
·血小板计数<140,000/μl
·活动性肝病或肝功能障碍
·重大的肾疾病
·孕妇或哺乳期妇女
详细的入选标准
符合纳入这项研究的受试者必须满足以下所有标准:
1.必须在进行任何评估之前获得书面知情同意书。
2.在18至≤80岁的男性和女性
3.在中央实验室测量的在筛查访视时lp(a)≥70mg/dl
4.在随机分配时的ldl-胆固醇调低治疗如下:
·根据当地的实践/指南,受试者必须接受最佳ldl-c调低治疗以满足目标ldl-c水平,或
·根据当地的实践/指南,如果受试者不满足目标ldl-c水平,他们应该用最高耐受剂量的他汀和/或用其他最佳ldl-调低疗法(例如依折麦布、胆固醇吸收抑制剂、贝特类、pcsk9抑制剂)进行治疗,或
·如果受试者有禁忌症或对他汀治疗不耐受,根据当地的实践/指南,他们必须接受用其他最佳ldl-调低疗法(例如依折麦布、胆固醇吸收抑制剂、贝特类、pcsk9抑制剂)进行治疗
5.根据当地的实践/指南,在随机访视时,必须针对其他cv风险因素对受试者进行最佳治疗
6.确诊的cv疾病,定义为以下三种病症的any:
1)具有在筛查访视之前≥3个月至≤10年的时期中发生的自发性心肌梗死的病史(不是由pci或cabg引起),并且记录如下(thygesen等人,“fourthuniversaldefinitionofmyocardialinfarction[心肌梗死的第四个普遍定义]”,circulation[循环],第e618-e651页,2018):
·急性mi(住院记录):要求记录心脏生物标志物(优选地心肌肌钙蛋白)的上升和/或下降,其中至少一个值高于参考上限(url)的第99个百分位数,并且是以下的至少一项:
·缺血的症状
·ecg变化指示急性心肌缺血(新的st-t变化或新的lbbb;请参见附录2,st和t波的变化)
·病理性q波的发展(请参见附录2,病理性q波的定义)
·以与缺血性病因学一致的模式,新的存活心肌丧失或新的区域壁运动异常的影像学证据
·通过血管造影(包括冠状动脉内成像)鉴定冠状动脉血栓
·既往mi(无可用的急性事件的医院记录):要求记录下列任一项:
o在没有缺血性病因的情况下,病理性q波(有或无症状)(请参见附录2,病理性q波的定义)
o在没有非缺血性原因的情况下,变薄且不能收缩的存活心肌区域缺失的影像学证据
2)在由ct扫描、mri或其他可视化方法记录的筛查访视之前≥3个月至≤10年的时期中发生的缺血性中风的病史(由中枢神经系统组织梗塞引起的局灶性脑、脊髓或视功能障碍的急性发作)。短暂性缺血发作或栓塞性中风(非动脉粥样硬化起源)不是符合条件的事件。
3)临床上显著的症状性外周动脉疾病,由具有踝肱指数≤0.90和/或归因于下肢缺血的截肢或血运重建的间歇性跛行证实。血栓闭塞性血管炎不是符合条件的事件。
详细的排除标准
符合任何以下标准的受试者不具有纳入此研究的资格。
1.不受控制的高血压,定义为在筛查访视时静坐收缩压(sbp)≥160mmhg和/或舒张期血压(dbp)≥100mmhg(对于每次sbp和dbp评估,3个测量值的平均)。
2.在筛查访视之前3个月内用烟酸进行治疗;允许使用多种维生素中的烟酸
3.在随机分配之前,用稳定剂量的pcsk9抑制剂(依洛尤单抗、阿利库单抗)治疗少于12周
4.用脂蛋白单采治疗,或已经计划在研究期间开始脂蛋白单采
5.在筛查的3个月内以及在筛查访视和随机访视(第1天)之间:心肌梗死、中风、冠状动脉或下肢血运重建、重大心脏或非心脏手术。可以在相关事件/手术后3个月对受试者进行重新筛查。
6.随机访视(第1天)后计划或预期的心脏、脑血管或外周动脉手术或冠状动脉血运重建
7.在筛查访视或随机访视(第1天)时心力衰竭纽约心脏协会(nyha)iv类
8.出血性中风或其他大出血的病史,或如果在筛查访视和随机访视之间发生
9.严重伴随非cv疾病,预期在筛查访视或随机访视(第1天)时将预期寿命降低至5年以下
10.在研究人员的判断中,在筛查访视或随机访视(第1天)时,已知活动性严重感染或重大血液学、代谢性、胃肠道或内分泌功能障碍(例如不受控制的甲状腺功能障碍或不受控制的糖尿病)
11.在过去5年内治疗的或未经治疗的,或如果在筛查访视和随机访视(第1天)之间诊断的任何器官系统的恶性肿瘤(除了局部皮肤基底细胞癌或皮肤鳞状细胞癌或原位宫颈癌)病史(无论是否存在局部复发或转移的证据)。
12.在第1次访视时,中心实验室测试得出的血小板计数<140,000/μl,在随机访视(第1天)之前通过第二次中心实验室测试确认
13.在第1次访视时,中心实验室测试得出的egfr≤30ml/min/1.73m2,在随机访视(第1天)之前通过第二次中心实验室测试确认;或进行透析的患者
14.在第1次访视时,尿蛋白-肌酐比(pcr)>500mg/g(50mg/mmol)的重大肾小球疾病(包括但不限于iga肾病、糖尿病性肾病、系统性红斑狼疮等),在随机访视(第1天)之前通过第二次中心实验室测试确认
15.活动性肝病或肝功能障碍,定义为在筛查访视时ast或alt是中心实验室测试得到的uln的≥2倍,在随机访视(第1天)之前通过第二次中心实验室测试确认
16.筛查访视时,总胆红素是中心实验室测试得到的uln的≥1.5倍,在随机访视(第1天)之前通过第二次中心实验室测试确认
17.在筛查访视时,中心实验室测试得到的hiv、丙型肝炎筛查或乙型肝炎表面抗原检测呈阳性
18.研究人员认为,在筛查访视时或在筛查访视与随机访视(第1天)之间的任何其他情况可能会使患者不适合纳入研究,或可能干扰参与或完成研究的患者
19.在筛查访视的9个月内用寡核苷酸或sirna治疗。例外是galnac寡核苷酸或galnacsirna,如果得到卫生主管部门的批准并且被赞助商允许用于研究中,则可以使用。
20.对研究药物或其赋形剂或对类似化学类别的药物具有超敏反应史
21.在登记的5个半衰期内或30天内(以较长者为准)使用其他研究药物
22.不愿或不能(例如身体或认知上的)遵守研究程序和药物施用(注射)和时间表
23.孕妇或哺乳期(泌乳)妇女
24.有生育能力的妇女,定义为所有在生理上能够怀孕的妇女,除非她们在给予研究的药物期间使用基础避孕方法。此类方法包括:
·完全禁欲(当这与受试者的优选和日常生活方式一致时)。周期禁欲(例如按日历、按排卵期、按体温、排卵期后方法)和体外射精不是可被接受的避孕法
·女性绝育(已行双侧卵巢切除术,进行或未进行子宫切除术),在服用研究药物前至少六周进行全子宫切除术或输卵管结扎术。在单独卵巢切除术的情况中,仅当女性生殖状况已通过后续的激素水平评估确认时
·男性绝育(筛查前至少6个月)。对于研究中的女性受试者,经输精管切除术的男性伴侣应为所述受试者的唯一伴侣
·使用口服(雌性激素和黄体酮)、注射或植入的荷尔蒙的避孕方法或放置宫内节育器(iud)或宫内节育系统(ius)或其他具有类似功效(失败率<1%)的激素避孕方法,例如激素阴道环或透皮激素避孕
如果使用口服避孕药,则在研究治疗之前,妇女应已在同一药上稳定至少3个月。
如果妇女有12个月自然(自发)闭经并且具有适当的临床概况(例如年龄适当的血管舒缩症状史)或在至少6周之前进行了外科双侧卵巢切除术(进行或不进行子宫切除术)、全子宫切除术或输卵管结扎时,则她们被认为是停经后且无生育潜能的。在仅进行卵巢切除术的情况下,仅当妇女的生殖状况已通过后续的激素水平评估确认时,她被认为没有生育潜能。
如果当地法规与上述避孕方法不同,以防止怀孕,则适用当地法规,并将在知情同意书(icf)中进行说明。
治疗
将受试者按1:1随机分配,以皮下注射施用化合物isis68125780mgs.c.qm或安慰剂。注射将使用注射装置化合物isis681257针头安全性装置(nsd)按每月一次自行注射或由护理人员皮下注射。下文提供了有关应如何进行注射的详细信息。处方和接受研究治疗的说明。
本研究中使用的研究性药物和对照药物如下表1所示:
表1:研究药物和对照药物
治疗持续时间
研究持续时间预期为大约4.25年,其中最短随访时间为大约2.5年(除非死亡或撤回同意);在此期间,预期将累积所需数量的已确认的主要终点事件。当993个主要cv事件已经累积或所有受试者都接受了至少2.5年的随访时间时(无论以后如何),该研究将完成。出于安全性原因和/或由研究人员或受试者判断,可将受试者从研究药物中停药。除非他们撤回知情同意书,否则他们将继续进行研究。
一种或多种其他治疗
受试者在随机分配之前3个月内使用的所有药物、程序和重要的非药物疗法必须记录在既往/伴随药物/重要的非药物疗法或程序的电子病例报告表(ecrf)页面中,如果有的话,这些页面应独立记录是否在研究期间继续进行。必须针对所有排除标准对每种伴随药物进行单独评估。
在受试者被纳入研究后所施用的所有药物、程序和重要的非药物疗法(包括物理疗法、生活方式指导和输血)也必须记录在相应的ecrf页面中。在开始使用新的伴随药物之前,必须先评估其是否含有违禁药物。在贯穿研究的整个持续时间中应记录降脂和抗血小板药物的剂量。
如有疑问,研究人员应在将患者随机分配或允许开始新药治疗之前联系医学监测员。如果受试者已经被纳入,请联系诺华公司以确定受试者是否应继续接受研究药物。
建议参加该试验的受试者或其护理人员告知未参与研究的医护专业人员血小板减少症的潜在风险,以便任何可能导致血小板减少症和/或出血的伴随疗法(例如肝素、口服抗凝药、直接凝血酶抑制剂、因子xa抑制剂和烟酸)得到适当管理,并且应密切监测受试者。在随机访视(第1天)时,将向受试者提供一张带有关于潜在出血风险信息的受试者卡片。
禁止的药物
不允许使用下表2中显示的治疗。
表2:违禁药物和程序
*例外是galnac寡核苷酸或galnacsirna,如果得到卫生主管部门的批准并且被赞助商允许用于研究中,则可以使用
**如果在研究期间根据当地的实践指示出脂蛋白单采,则必须停止研究药物的使用,并继续在研究中对患者进行随访
***允许使用在多种维生素中的烟酸
剂量递增和剂量改变
剂量递增和剂量改变-除非出于安全性原因,否则不允许中断治疗性研究。
筛查
只有在患者已经签署知情同意书(icf)之后,才可以开始筛查活动。在筛查访视后长达6个月可以进行一次再筛查(访视1)。
如果在筛查时安全性实验室评估超出了排除标准所规定的范围的情况下,则可以在按排除标准的要求之前重复一次评估。如果重复值保持在指定范围之外,则将该受试者排除在研究范围之外。
受试者人员统计/其他基线特征
在所有主题上收集的患者人员统计数据和基线特征数据包括:在签署知情同意书之前(如果可能,将记录诊断信息而不记录症状)的年龄、性别、人种、种族、患者转诊的来源、相关的家庭和个人病史/当前的医疗状况,以及筛查时的相关实验室测试。
如果他们判断测试异常发生在签署知情同意书之前,研究人员可以酌情决定将异常测试结果记录在病史ecrf上。
功效
临床终点委员会对cv死亡、非致命性心肌梗死、非致命性中风、需要住院的紧急冠状动脉血运重建进行了裁定。
疗效评估在下面指定,其中评估时间表详细说明了每次评估的执行时间。
功效评估1-对治疗分配不知情的独立cec将审查和裁定构成主要和次要综合终点的所有临床事件。
功效评估2-在研究终点,将评估功效生物标志物lp(a)、hscrp和apob以及在总胆固醇、ldl-胆固醇、非hdl-胆固醇、hdl-胆固醇和甘油三酯与基线相比的变化。随机分配(第1天)后,来自lp(a)和所有脂质(总胆固醇、ldl-胆固醇、非hdl-胆固醇、hdl-胆固醇和甘油三酯)的结果必须使受试者、研究人员、进行评估的人员以及ctt不知情。
如果ldl-c从随机分配值增加到预先指定的算法阈值以上,或者如果缺少后者,则在从中心实验室测量的随机分配之前的最新值开始,中心实验室将向研究人员发出警报。另外,参与实施这项试验的研究人员和现场工作人员以及参与受试者的护理和管理有关的所有医务人员,应避免在随机分配(第1天)至研究完成之间的时间内获得血脂板测试。如果获得了血脂板测试,则必须采取所有合理的措施以确保研究对象不了解结果。
安全性
关键的安全性评估包括不良事件监测、体格检查、实验室评估和ecg测量。
在筛查访视(访视1)时将进行一次完整的身体检查;在随后的访视中,将仅进行一次简短的身体检查;并且在其余的研究现场访视中,将仅进行简短的身体检查。
另外的评估
临床结果评估(coa)
将使用sf-12调查表,第2版(sf-12v2)评估纳入双盲治疗期的受试者的健康状况和舒适。sf-12v2涵盖了与sf-36相同的八个健康领域,其中问题却少得多,这使其成为患有慢性病症的患者的更实用的研究工具。
特定领域得分和两个汇总得分的绝对值和与基线相比的变化将通过访视和治疗进行描述性总结。在bl访视后,在两个汇总得分中,还将提供基于统计学模型的、针对与基线相比的变化的治疗间分析。
以上分析将在收集了sf-12数据的fas患者中进行。
生物标志物
在某些研究访视中将收集用于评估lp(a)的血样。用于功效评估的其他血液生物标志物是hscrp和apob。
数据分析
主要功效变量(到主要终点事件首次发生的时间)将使用具有治疗、区域、亚群体指标(基线lp(a)水平<或≥90mg/dl)的cox比例风险模型和以亚群体指标为因子的治疗的相互作用项进行分析。遵循glimm等人的原则,使用加权的邓尼特检验,将检验两个主要终点假设。
次要终点将使用与主要分析模型相同的cox-回归模型进行分析。
将分别提供这些cox回归模型中的完整群体和亚群体的估计的风险比和相应的双侧置信区间以及p值。
在完整群体和亚群体中mace综合(cv死亡、非致命性mi和非致命性中风)和冠状动脉综合(归因于chd事件的死亡、非致命性mi和需要住院的紧急冠状动脉血运重建)的主要终点和次要终点将包含在封闭式多重检验程序中,以便于控制i型错误。
将总体研究i型错误控制在2.5%(单侧)。在考虑了两次期中功效分析中使用的α后,用于最终分析的单侧α水平将为2.45%。
完整群体和亚群体中对全因死亡率的假设将分别以完整α(单侧2.5%)进行检验。将在完整分析集(fas)中进行功效分析。
细节:
主要的一个或多个终点的分析
本研究的主要目标是证明与安慰剂相比isis681257在降低扩展的重大不良心血管事件(心血管死亡、非致命性mi、非致命性中风和需要住院的紧急冠状动脉血运重建)的风险方面的优越性。除非另有说明,否则所有事件发生时间的分析都将基于在研究的双盲治疗期间发生的裁定事件。
提议的分析适用的主要患者群体是fas中的所有受试者(完整群体),以及基线lp(a)水平≥90mg/dl的fas中的受试者(亚群体)。以下定义的主要终点将与研究中止或由非cv原因导致的死亡的相应的并发事件视为随机事件,从而估计特定原因的风险比。不管是否坚持研究药物,所述估计将使用直至目的事件发生或另外地截尾时间为止的可用随访数据。分析将基于的分析集是完整分析集(fas)。
在该患者群体中,目标估计涉及在如纳入标准中定义的患有确诊的cv疾病和lp(a)≥70mg/dl(完整研究群体)和/或lp(a)≥90mg/dl(目的亚群体)的受试者中主要mace的降低比率(包括区域效应)。下文详细说明了在支持提议的估计的完整群体和目的亚群体中的目的终点和对治疗益处的提议的评估。
一个或多个主要终点的定义
主要功效变量是到扩展的重大不良心血管事件(mace)首次发生的时间,所述事件是由心血管死亡、非致命性mi、非致命性中风和需要住院的紧急冠状动脉血运重建组成的综合终点。独立的cec将在不知情的情况下审查和裁定构成主要终点综合的临床事件。
事件发生时间被计算为从随机分配到主要终点事件发生之间的天数。在研究结束日期之前未达到主要终点的受试者的数据将在已知他们处于研究风险中的最晚日期进行截尾。
统计模型、假设和分析方法
待检验的两个主要的统计学零假设是:
·h10:λ12/λ11≥1相比h1a:λ12/λ11<1(1)
·h20:λ22/λ21≥1相比h2a:λ22/λ21<1(2)
其中λ11、λ12和λ21、λ22是分别在完整群体和亚群体中针对isis681257组和安慰剂组的第一经cec证实的扩展的mace的风险。
主要功效变量将使用具有治疗、区域、亚群体指标(基线lp(a)水平<或≥90mg/dl)的cox比例风险模型和以亚群体指标为因子的治疗的相互作用项进行分析。将如在glimm等人(glimm等人,"anapproachtoconfirmatorytestingofsubpopulationsinclinicaltrials[在临床试验中用于对亚群进行验证性检验的方法],biomj.[生物分子杂志],第897-913页,2015)中描述的基于模型的邓尼特检验方法用于对两个主要假设进行检验。可以将以上cox比例风险模型表示为:
λ(t)=λ0(t)*exp(β1*x1+β2*x2+β3*x3+β4*x1*x3)(3)
其中λ(t)是在时间t处的风险,并且λ0(t)是基线风险,xi(i=1,2,3)是协变量。更具体地,x1是治疗组指标,x2是区域指标,x3是亚群体指标(lp(a)<或≥90mg/dl)的指标,并且x1*x3是由亚群体指标治疗的相互作用项。可以将模型参数化,使得β1+β4是isis681257相比安慰剂在亚群体中的log风险比,并且β1+wβ4是isis681257相比安慰剂在完整群体中的log风险比,其中w是亚群体中患者的比例(lp(a)≥90mg/dl)。
在模型(3)下,可以将两个主要假设(1)和(2)等效地表示为:
·h10:β1+wβ4≥0相比h1a:β1+wβ4<0(4)
·h20:β1+β4≥0相比h2a:β1+β4<0(5)
如在glimm等人(2015)中所示,由模型(3)得出的两个检验统计量用于两个假设(4)和(5)渐近地遵循双变量正态分布。基于这两个检验统计量,将计算针对两个主要假设的邓尼特检验临界值和调整后的1侧p值。将总体研究i型错误控制在2.5%(单侧)。根据期中分析计划,在考虑期中功效分析中使用的α后,用于最终分析的待使用的单侧显著性水平α将是2.45%。
检验过程以图形方式显示在图3中,并按以下步骤概述:
·首先,进行加权的邓尼特检验,所述检验具有分配给两个主要假设(h10和h20)中的每一个的相等加权。该检验利用了完整群体和亚群体之间主要终点的相关性,其中检验统计量从如上所述的主要分析模型中得出
·如果一个主要假设被拒绝,则其显著性水平的一小部分将传递给另一主要假设,而其余的α将根据如在图中所指示的预先指定的权重传播到相同群体中的次要终点族
·在一族次要终点(h1i或h2i)中,将使用加权的simes检验程序。
·如果在总体群体中的两个次要假设被拒绝,则α会传播到亚群体中的主要终点;反之亦然,即α从h2i传递到h10。(参见图3)
次要节点(h1i或h2i)代表与完整群体和亚群体中的前两个次要终点相关的零假设族。在完整群体和亚群体中全因死亡率的次要终点将不包括在多重检验程序中。
如果在以上检验程序中拒绝了两个主要假设中的至少一个,则可以认为该研究成功。
将分别提供在cox回归模型(3)的完整群体和亚群体中的估计的风险比和相应的未经调整的双侧置信区间。将fas用于主要分析。
次要终点的分析
次要终点
存在所定义的三个次要终点,和分别针对在完整群体和亚群体中的这三个次要终点而待检验的六个次要假设:
·到经cec证实的mace:cv死亡、非致命性mi和非致命性中风的综合终点首次发生的时间-h11和h21是完整群体和亚群体中相关的次要假设
·到经cec证实的chd结果:chd死亡、非致命性mi、需要住院的紧急冠状动脉血运重建的综合终点首次发生的时间-h12和h22是完整群体和亚群体中相关的次要假设
·从随机分配到研究结束,到全因死亡的时间-h13和h23是完整群体和亚群体中的相关次要假设。
使用与以上所述的主要分析模型相同的cox-回归模型在fas中分析所有次要终点。将分别提供这些cox回归模型中的完整群体和亚群体的估计的风险比和相应的双侧置信区间以及p值。
如上所述,次要假设h1i(包括h11和h12)和h2i(包括h21和h22)的两个族包括在如在图3中呈现的多重检验程序中。将使用加权的simes检验方法按以下步骤分别检验每个族(h1i或h2i)中的两个次要假设:
·首先,将来自针对族中两个次要终点(例如在完整群体中p11针对mace,并且p12针对冠状动脉综合终点)的以上cox-回归模型的两个标称p值与传递到如图3中指定的该族的α进行比较。如果两个标称p值<=该局部α,则拒绝该族内的两个次要假设,否则继续
·将各个标称p值分别与具有预先指定的加权0.8和0.2的加权的局部α进行比较。如果mace的p值为≤局部α的80%,则拒绝mace的零假设;如果冠状动脉综合终点的p值为≤局部α的20%,则拒绝冠状动脉综合终点的零假设。
相应于完整群体和亚群体(h13和h23)中全因死亡率的假设不包括在多重检验过程中,并将分别以完整α(1侧2.5%)进行检验。治疗kaplan-meier图将分别在完整群体和亚群体中针对每个次要终点提供。还将使用与主要分析相同的cox-回归模型,分别对综合次要终点的组成进行分析。达到次要综合终点的患者的频率和百分比将由fas中的治疗组提供。基于研究人员报告的事件,综合次要终点及其组成将进行类似的分析和介绍。
样本量计算
一个或多个主要终点
在针对计划的功效期中分析调整后,以下的样本量估计是基于在isis681257和安慰剂之间1:1随机分配,并且单侧显著性水平为0.0245。计算按两个步骤进行。首先,使用常规的log秩检验,按单侧显著性水平为0.01225,针对完整群体中的主要假设(假设在两个主要假设之间更保守的邦弗朗尼(bonferroni)α拆分),针对mace主要终点进行计算。
假设遵循分段指数分布存在有利于isis681257组的延迟的治疗效应,其中在随机分配后的前12个月中的风险比为0.90,并且然后在12个月后的恒定风险比为0.764。在此假设下,993个主要终点mace事件(即993个受试者在双盲期间发生了mace事件)将在单侧α水平为0.01225时提供大约88%的功效。
假设在安慰剂组中年度主要终点mace事件比率为4.6%,招募期为1.5年,最长随访为4.25年,并且针对归因于随访失败或非心血管死亡的主要终点事件累计截尾率为10%,将需要总样本量为7,680名受试者以获得993个主要终点mace事件。
假设针对主要综合终点事件的4.6%年度事件比率是基于来自fourier试验的数据(sabatine等人,“evolocumabandclinicaloutcomesinpatientswithcardiovasculardisease[依洛尤单抗和患有心血管疾病的患者中的临床结果]”,n.engl.j.med[新英格兰医学杂志].,第1713-1722页,2017)。假设在随机分配后前12个月中的风险比为0.90,并且然后在12个月后恒定风险比为0.764,对应于在整个双盲期的风险比为0.805(即,相比安慰剂,isis681257的19.5%风险比降低),给定纳入期为1.5年和最长随访为4.25年。
其次,使用上文所述的检验程序针对总体研究和两个主要假设评估功效。表3代表如在以上步骤1中计算的在单侧α为2.45%,给定样本量为7,680且主要终点事件的数量为993的情况下的研究的功效,以及如在前两列中假设的tqj230相比安慰剂的潜在真实效应量的各种情况。
表3:根据关于治疗效应量的假设,在给定目标事件数和样本量的情况下进行功效计算
安慰剂组中的年度主要终点事件比率假设为在完整群体中的4.6%;在lp(a)≥90mg/dl的受试者中为5.06%,并且在lp(a)<90mg/dl的受试者中为4.14%。
使用软件包r(版本3.4.3)进行计算。
为了在可接受的时间框架内达到所需的事件数量并保持研究的目标功效,将以不知情的方式监测主要终点的事件比率,以便可以根据需要对待随机分配的受试者的数目和/或随访持续时间进行调整。考虑到研究方案的目的是确保对最后的随机分配受试者进行最少2.5年的随访,可以预见的是,研究中产生的主要终点事件的数量可能多于样本量计算中得到的所需的事件数量。
等效物
本领域的技术人员仅使用常规实验就将认识到或能够确定本文特别所述的特定实施例的许多等效物。此类等效物旨在涵盖在下列权利要求的范围中。
- 还没有人留言评论。精彩留言会获得点赞!