治疗脂质代谢失调的方法与流程
相关申请的交叉引用本申请要求2018年11月26日提交的美国临时申请序列号62/771,456、2019年3月13日提交的美国临时申请序列号62/817,955以及2019年8月22日提交的美国临时申请序列号62/890,506的优先权。特此将以上引用申请的全部公开内容通过引用并入本文。
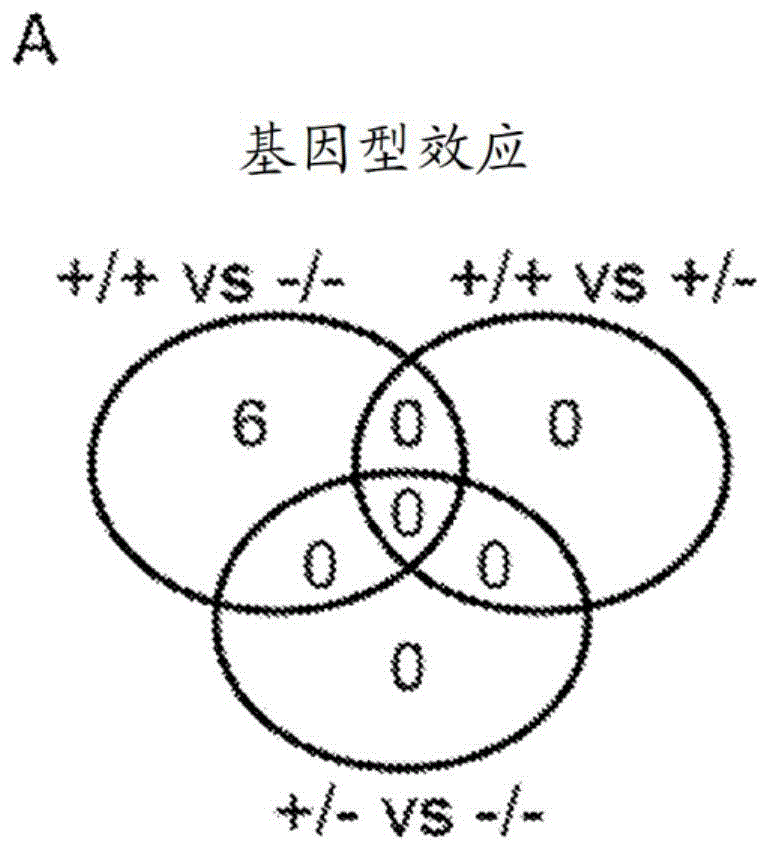
背景技术:
:脂质是一大类多样的生物分子,它们发挥多种生物化学功能,例如储存能量、信号传导以及充当细胞膜和髓鞘的结构组分。脂质代谢是指脂质的细胞内或细胞外合成和降解,包括提供能量的脂肪的分解或储存。在包括中性粒细胞、单核细胞、巨噬细胞和小胶质细胞在内的髓样细胞中的脂质失调已显示引起受影响的细胞或组织中的有害炎症反应以及脂毒性,并介导许多疾病过程。虽然已经进行了大量研究来调查脂质代谢及其与疾病的关系,但需要另外的工作来进一步阐明脂质加工、脂质相关炎症和脂毒性的潜在分子机制,以及开发新的疗法来纠正某些疾病和病症中的脂质失调和/或相关炎症反应。技术实现要素:本文所述的某些实施方案提供了治疗在有需要的哺乳动物中的脂质代谢失调的方法,所述方法包括向所述哺乳动物施用有效量的激动剂,即,抗髓样细胞上表达的触发受体2(trem2)抗体。本文所述的某些实施方案提供了用于治疗哺乳动物中的脂质代谢失调的激动剂抗trem2抗体。本文所述的某些实施方案提供了激动剂抗trem2抗体用于制备治疗哺乳动物中的脂质代谢失调的药剂的用途。本文所述的某些实施方案提供了减少细胞中一种或多种脂质的细胞内积累的方法,所述方法包括使所述细胞与有效量的激动剂抗trem2抗体接触。本文所述的某些实施方案提供了用于减少细胞中一种或多种脂质的细胞内积累的激动剂抗trem2抗体。本文所述的某些实施方案提供了激动剂抗trem2抗体用于制备减少细胞中一种或多种脂质的细胞内积累的药剂的用途。本文所述的某些实施方案提供了治疗在有需要的哺乳动物中的阿尔茨海默病的方法,所述方法包括向所述哺乳动物施用激动剂抗trem2抗体,其中所述哺乳动物患有或已经被确定患有脂质代谢失调。本文所述的某些实施方案提供了用于治疗哺乳动物中的阿尔茨海默病的激动剂抗trem2抗体,其中所述哺乳动物患有或已经被确定患有脂质代谢失调。本文所述的某些实施方案提供了激动剂抗trem2抗体用于制备治疗哺乳动物中的阿尔茨海默病的药剂的用途,其中所述哺乳动物患有或已经被确定患有脂质代谢失调。本文所述的某些实施方案提供了治疗在有需要的哺乳动物中的动脉粥样硬化的方法,所述方法包括向所述哺乳动物施用有效量的激动剂抗trem2抗体。本文所述的某些实施方案提供了用于治疗哺乳动物中的动脉粥样硬化的激动剂抗trem2抗体。本文所述的某些实施方案提供了激动剂抗trem2抗体用于制备治疗哺乳动物中的动脉粥样硬化的药剂的用途。某些实施方案提供了治疗在有需要的哺乳动物中的炎症的方法,所述方法包括向所述哺乳动物施用有效量的激动剂抗trem2抗体。某些实施方案提供了用于治疗哺乳动物中的炎症的激动剂抗trem2抗体。某些实施方案提供了激动剂抗trem2抗体用于制备治疗哺乳动物中的炎症的药剂的用途。附图说明图1a-1c.在双环己酮草酰二腙饮食诱导的慢性脱髓鞘的trem2突变小鼠中的脂质代谢相关基因的表达减弱。(图1a)从没有治疗的trem2+/+、trem2+/-和trem2-/-小鼠脑中分离的大量小胶质细胞中的差异表达基因的数目的维恩图。(图1b)从具有慢性脱髓鞘(12周双环己酮草酰二腙处理)的trem2+/+、trem2+/-和trem2-/-小鼠脑中分离的大量小胶质细胞中的差异表达基因的数目的维恩图。(图1c)在具有对照饮食(左插图)与5周或12周双环己酮草酰二腙处理(右插图,分别在顶部或底部)的trem2+/+、trem2+/-和trem2-/-大量小胶质细胞中的与脂质代谢相关的单个基因的log2倍表达变化。图2a-2b.在具有慢性脱髓鞘的trem2敲除小鼠中的脂质代谢相关基因的表达减弱。(图2a)来自单独分离的trem2+/+对照饮食小胶质细胞(trem2+/+ctrl)相比于来自具有12周双环己酮草酰二腙处理的trem2+/+、trem2+/-和trem2-/-小鼠的分离的小胶质细胞(trem2+/+cpz、trem2+/-cpz、trem2-/-cpz)的单细胞rna测序数据的小胶质细胞簇。左:在每个簇中代表的所有汇总样品的%;右:在所述簇中代表的每个单独样品的百分比的热图。(图2b)显示在簇knn5、8和10中的上调和下调的顶部差异表达基因的比例的热图聚类。图3a-3f.慢性脱髓鞘后在trem2敲除前脑中胆固醇酯和髓磷脂脂质的丰度增加。(图3a)在具有对照饮食或双环己酮草酰二腙饮食的trem2+/+、trem2+/-和trem2-/-小鼠中不变的前脑总游离胆固醇水平。在来自具有12周双环己酮草酰二腙饮食trem2-/-小鼠相比于具有对照饮食或5周双环己酮草酰二腙的trem2+/+、trem2+/-和trem2-/-小鼠、以及具有12周双环己酮草酰二腙的trem2+/+和trem2+/-的前脑中记录的(图3b)胆固醇酯、(图3c)氧化胆固醇酯、(图3d)双(单酰基甘油)磷酸酯(bmp)、(图3e)三酰基甘油酯和(图3f)神经节苷脂水平升高。*p<0.05,**p<0.01,***p<0.001;双因素anova,tukey检验;***:与+/+对照比较;+++:在具有12周cpz的基因型之间的比较。通过lc/ms将脂质定量。(图3f)对每个神经节苷脂种类从左到右显示对应于下列情况的数据:+/+对照;+/+5周cpz;+/+12周cpz;+/-对照;+/-5周cpz;+/-12周cpz;-/-对照;-/-5周cpz;和-/-12周cpz。图4a-4p.慢性脱髓鞘后在trem2敲除的分离小胶质细胞中胆固醇酯和髓鞘来源脂质的丰度增加。在从具有12周双环己酮草酰二腙饮食的trem2-/-脑分离的小胶质细胞相比于具有对照饮食或5周双环己酮草酰二腙的trem2+/+、trem2+/-和trem2-/-小胶质细胞以及具有12周双环己酮草酰二腙的trem2+/+和trem2+/-小胶质细胞中检测到的胆固醇酯(图4a)、bmp(图4b)、(图4c)己糖神经酰胺和(图4d)半乳糖神经酰胺水平升高。在从具有对照饮食或双环己酮草酰二腙饮食的trem2+/+、trem2+/-和trem2-/-脑分离的富含星形胶质细胞的细胞群中检测到(图4e)胆固醇酯、(图4f)bmp、(图4g)己糖神经酰胺和(图4h)半乳糖神经酰胺的脂质水平没有变化。在从具有12周双环己酮草酰二腙饮食的trem2-/-脑分离的小胶质细胞相比于具有对照饮食或5周双环己酮草酰二腙的trem2+/+、trem2+/-和trem2-/-小胶质细胞以及具有12周双环己酮草酰二腙的trem2+/+和trem2+/-小胶质细胞中检测到(图4i)神经酰胺、(图4j)gm3、(图4k)磷脂酰甘油和(图4l)硫苷脂水平升高。在从具有对照饮食或双环己酮草酰二腙饮食的trem2+/+、trem2+/-和trem2-/-脑分离的富含星形胶质细胞的细胞群中检测到(图4m)神经酰胺、(图4n)gm3、(图4o)磷脂酰甘油和(图4p)硫苷脂的脂质水平没有变化。通过lc/ms将脂质定量。图5a-5b.trem2kobmdm在用氧化低密度脂蛋白(oxldl)处理后显示中性脂质染色增强。(图5a)用氧化ldl(oxldl,50ug/ml)或媒介物处理48h的培养的trem2wt或ko骨髓源性巨噬细胞(bmdm)在63倍分辨率下的尼罗红染色。(图5b)总斑点面积的定量显示在媒介物条件下很小程度以及在脂质激发(oxldl)条件下较大程度的在trem2ko中的中性脂质积累。数据显示为三个技术重复的平均值和标准偏差。图6a-6e.trem2kobmdm在用氧化ldl处理后显示脂质积累增加。当用50ug/mloxldl给药时,与wtbmdm相比,在培养的trem2kobmdm中检测到(图6a)胆固醇酯、(图6b)神经节苷脂gm3、(图6c)三酰基甘油酯和(图6d)己糖神经酰胺水平升高。(图6e)与wt相比,在trem2ko中未观察到磷脂酰胆碱的变化。数据显示为三个技术重复的平均值和标准偏差,并且将所有数据归一化为每孔的平均细胞数。通过lc/ms测量脂质。图7a-7g.trem2kobmdm在用髓磷脂处理后显示脂质积累增加。当用纯化的小鼠脑髓磷脂(25ug/ml)处理时,培养的trem2kobmdm显示出更多的(图7a)胆固醇酯、(图7b)氧化胆固醇酯、(图7c)二酰基甘油酯、(图7d)三酰基甘油酯、(图7e)己糖神经酰胺、(图7f)乳糖神经酰胺和(图7g)神经节苷脂积累。数据显示为三个技术重复的平均值和s.e.m.,并且将所有数据归一化为每孔的平均细胞数。通过lc/ms测量脂质。图8a-8h.trem2ko诱导的多能干细胞(ipsc)来源的人小胶质细胞在用髓磷脂处理后显示脂质积累增加。当用髓磷脂(25ug/ml)处理时,trem2ko人ipsc来源的小胶质细胞显示出更多的(图8a)游离胆固醇、(图8b)磷脂酰丝氨酸38:4、(图8c)bmp44:12、(图8d)溶血磷脂酰胆碱16:0、(图8e)血小板活化因子、(图8f)硫酸胆固醇、(图8g)溶血磷脂酰乙醇胺和(图8h)缩醛磷脂磷脂酰乙醇胺(pep)积累。数据显示为三个技术重复的平均值和标准偏差,并且将所有数据归一化为每孔的平均细胞数。通过lc/ms分析脂质。图9.髓磷脂衍生的胆固醇通过bmdm中的acat1转化为胆固醇酯。来自野生型小鼠bmdm中的游离胆固醇和胆固醇酯(ce)水平,所述野生型小鼠予以髓磷脂给药2小时或未予髓磷脂,然后在摄取髓磷脂之后立即(t0)进行提取,或者随后洗脱髓磷脂并且进行2h(t2)或4h(t4)的驱除。在髓磷脂摄取过程中加入acat1抑制剂,并通过洗脱4h维持(t4+acat1抑制剂)。通过lc/ms测量脂质。图10.重组人apoe3改善了在髓磷脂处理后在trem2kobmdm中的中性脂质积累。当用髓磷脂碎片(25ug/ml)处理24h时,trem2kobmdm比wtbmdm积累更多的中性脂质,如通过尼罗红染色定量的。通过添加重组人apoe3(10ug/ml)改善了这种积累。图11a-11c.acat1抑制消除了在髓磷脂处理后的ipsc来源的人小胶质细胞中的胆固醇酯增加。(图11a)acat抑制阻止了在用纯化的髓磷脂处理的wt和trem2koipsc来源的人小胶质细胞中测量的所有胆固醇酯种类的积累。(图11b)显示了胆固醇酯22:6的具体实例。(图11c)作为对照,显示胆固醇水平未受acat1抑制剂存在的影响。数据显示为三个技术重复的平均值和标准偏差,并且将所有数据归一化为每孔的平均细胞数。通过lc/ms测量脂质。图12a-12e.激动剂抗trem2抗体减少了在髓磷脂处理后的ipsc来源的人小胶质细胞中的中性脂质积累。(图12a)用媒介物或髓磷脂(50ug/ml)、然后在24小时后用rsv对照或激动剂抗trem2抗体处理的ipsc来源的人小胶质细胞的尼罗红图像。三酰基甘油酯的(图12b)斑点定量和(图12c)脂质组学显示,与用同种型对照(rsv)处理相比,在用trem2抗体处理后显示出脂质积累减少。将脂质组学数据归一化为每孔的平均细胞数。通过lc/ms测量甘油三酯。图12d-12e包括展示三酰基甘油酯脂质种类(在用髓磷脂处理、然后与示例性抗trem2抗体一起孵育的ipsc小胶质细胞中)的定量水平的条形图。图12e代表ipsc小胶质细胞的数据,其中包括在与示例性抗trem2抗体一起孵育之前的髓磷脂洗脱步骤。图13a-13b.(图13a)贝沙罗汀对trem2kobmdm中髓磷脂储存的影响当用髓磷脂碎片(25ug/ml)处理48h时,trem2kobmdm比wtbmdm积累更多的中性脂质,如通过尼罗红染色定量的。用贝沙罗汀(10um)共同处理减少了这种积累。(图13b)acat1抑制剂和lxr激动剂降低了人ipsc来源的trem2ko小胶质细胞中的胆固醇酯(ce)水平。在c+++培养基中,用髓磷脂(25ug/ml)在无药物或在与acat1抑制剂k604(500nm)和lxr激动剂gw3965(10um)一起的情况下将人ipsc来源的小胶质细胞处理48小时。通过两种药物挽救了wt和trem2ko细胞中的ce水平,但通过所述药物并未挽救trem2ko细胞中所见的胆固醇升高。通过lc/ms测量裂解物中的ce和胆固醇水平。n=3个生物学重复。图14a-14f。trem2缺乏阻止了慢性脱髓鞘过程中的dam转化。(图14a)在具有对照饮食(左插图)相对于5周或12周双环己酮草酰二腙处理(右插图,分别在顶部或底部)的trem2+/+、trem2+/-和trem2-/-大量小胶质细胞中的与溶酶体功能相关的单个基因的log2倍表达变化。(图14b)在具有对照饮食(左插图)相对于5周或12周双环己酮草酰二腙处理(右插图,分别在顶部或底部)的trem2+/+、trem2+/-和trem2-/-大量小胶质细胞中的与脂质代谢相关的单个基因的log2倍表达变化。(图14c)大量小胶质细胞表达变化(log2倍变化)的热图,其来自5周和12周对照相对于cpz处理的trem2+/+、trem2+/–和trem2–/–,涉及相比于野生型小胶质细胞在5xfad中下调(顶部)或上调(底部)的前69个dam基因(keren-shaul等人(2017).cell169,1276-1290e1217)。camera,p<1x10-41。(图14d-14f)在trem2+/+、trem2+/–和trem2–/–大量小胶质细胞与对照(左插图)或cpz处理(右插图)5周(顶部)或12周(底部)中的单独的(图14d)稳态、(图14e)阶段1和(图14f)阶段2dam基因中的log2倍表达变化。图15a-15c.trem2缺乏阻止了慢性脱髓鞘过程中的dam转化。(图15a)trem2+/+12周对照相对于cpz处理的小鼠(顶部)以及trem2–/–12周对照相对于cpz处理的小鼠(底部)的基因的log2倍变化,所述基因为相对于来自5xfad小鼠的稳态小胶质细胞在dam中上调的基因(参见,keren-shaul等人,(2017)。cell169,1276-1290e1217))。(图15b-15c)从衰老的野生型脑中分离的小胶质细胞表达了损伤相关的小胶质细胞特征。(图15b)基于从衰老的相对于年轻的trem2+/+小鼠(x轴)以及衰老的相对于年轻的trem2–/–小鼠(y轴)分选的小胶质细胞的rnaseq谱计算的t统计量的比较;n=每组7只小鼠。通过感兴趣的基因集内的成员资格(membership)将基因用颜色表示。稳态、dam1和dam2基因集的定义参见(keren-shaul等人(2017).cell169,1276-1290e1217)。从12周cpz相对于对照治疗的小鼠的差异表达基因的子集中鉴定出胆固醇代谢相关基因集,已知这些差异表达基因是与胆固醇代谢有关的先验。(图15c)来自trem2双环己酮草酰二腙和衰老队列的差异表达基因或如在(15b)中定义的胆固醇代谢相关基因集的热图,所述差异表达基因在dam2小胶质细胞中被上调,其定义参见(keren-shaul等人(2017).cell169,1276-1290e1217)。将基因表达值绘制为零均值和单位方差。图16a-16c.scrnaseq证实trem2–/–小胶质细胞在脱髓鞘后表现出向损伤相关小胶质细胞状态的转变减弱。(图16a)跨数据集的选定标记基因的表达谱,其被绘制为每个细胞的归一化计数。左图例表示在指示簇中的上调(向上箭头)与下调(向下箭头)标记基因。(图16b)与所有簇中的表达相比定义一个簇的单个标记基因的唯一分子标识符(umi)读数的归一化计数。左图例表示在指示簇中的上调(向上箭头)与下调(向下箭头)标记基因。(图16c)与所有其他簇相比来自簇8的上调的标记基因的归一化表达评分。点代表在簇阴影下的单个细胞。图17a-17f.trem2缺乏引起胆固醇酯在脑中积累。(图17a)从具有对照饮食、5周或12周双环己酮草酰二腙(cpz)饮食的trem2+/+、trem2+/–和trem2–/–小鼠分离的血浆中的神经丝轻链(nf-l)水平。***p<0.001,相互作用p值=0.06;双因素anova,tukey检验;n=每个条件7-16只小鼠。(图17b)在2个月和17个月从trem2+/+和trem2–/–小鼠分离的血浆中的神经丝轻链(nf-l)水平(双因素anova,fdr<0.05,相互作用年龄-基因型p值<0.05)。(图17c)随着对照与5周cpz处理显著改变的脂质的热图比较。n=每个条件3只小鼠;双因素anova,fdr<0.05。(图17d)随着基因型和/或在trem2+/+、trem2+/–和trem2–/–小鼠前脑中的12周cpz处理而显著改变的脂质的热图。双因素anova,fdr<0.05;列代表来自个别小鼠的数据,n=每个条件3-7只小鼠。(图17e)来自提取的具有对照饮食、5周或12周cpz饮食的trem2+/+、trem2+/–和trem2–/–小鼠前脑的胆固醇酯(ce)种类的浓度。数据代表均值±sem,并且呈现为log10标度。双因素anova,fdr<0.05;针对来自12周cpz饮食的trem2–/–的指示脂质种类显示的基因型-处理相互作用,如通过星号表示。*p<0.05,**p<0.01,***p<0.001。针对每个ce种类从左到右显示对应于以下条件的数据:+/+对照;+/+5周cpz;+/+12周cpz;+/-对照;+/-5周cpz;+/-12周cpz;-/-对照;-/-5周cpz;和-/-12周cpz。(图17f)在对照饮食或5周或12周的cpz之后的trem2+/+和trem2–/–小鼠的海马中的app阳性点、app阳性区域和app强度的定量。图18a-18m.trem2缺乏引起胆固醇酯在分离的小胶质细胞中积累。(图18a)随着在从对照、5周或12周双环己酮草酰二腙(cpz)处理后的trem2+/+、trem2+/–和trem2–/–小鼠脑分离的小胶质细胞中的处理和/或基因型而显著改变的热图。双因素anova,fdr<0.05;列代表来自个别小鼠的数据,n=每个条件6只小鼠。(图18b)在从对照、5周或12周cpz处理后的trem2+/+、trem2+/–和trem2–/–小鼠分离的脑脊液(csf)中检测到的脂质的热图比较。列代表来自个别小鼠的数据,n=每个条件5-6只小鼠。如图18a-18b所示,在慢性脱髓鞘后的某些脂质组学改变存在于trem2敲除的分离的小胶质细胞中(图18a),但在csf中不存在(图18b)。(图18c)在从对照、5周或12周cpz处理后的trem2+/+、trem2+/–和trem2–/–小鼠分离的星形胶质细胞中检测到的脂质的热图比较。列代表来自个别小鼠的数据,n=每个条件5-6只小鼠。在从具有12周双环己酮草酰二腙饮食的trem2-/-脑分离的小胶质细胞相比于具有对照饮食或5周双环己酮草酰二腙的trem2+/+、trem2+/-和trem2-/-小胶质细胞以及具有12周双环己酮草酰二腙的trem2+/+和trem2+/-小胶质细胞中检测到(图18d)胆固醇酯水平升高。通常,在从具有对照饮食或双环己酮草酰二腙饮食的trem2+/+、trem2+/-和trem2-/-脑分离的富含星形胶质细胞的细胞群(图18e)或csf(图18f)中检测到胆固醇酯的脂质水平没有变化。通过lc/ms将脂质定量。*p<0.05,**p<0.01,***p<0.001;双因素anova,tukey检验;***:与+/+对照比较;+++:在具有12周cpz的基因型之间的比较。(图18d-18f)针对每个固醇种类从左到右显示对应于以下条件的数据:+/+对照;+/+5周cpz;+/+12周cpz;+/-对照;+/-5周cpz;+/-12周cpz;-/-对照;-/-5周cpz;和-/-12周cpz。(图18g-18m)来自具有对照饮食、5周或12周cpz饮食的trem2+/+、trem2+/–和trem2–/–小鼠脑的分选的小胶质细胞、分选的星形胶质细胞和csf的脂质种类的浓度:(图18g)小胶质细胞bmp、(图18h)星形胶质细胞bmp、(图18i)csf固醇、(图18j)csf硫苷脂、(图18k)csfbmp、(图18l)csf己糖神经酰胺和(图18m)csf神经酰胺。数据代表均值±sem,并且呈现为log10标度。双因素anova;针对来自12周cpz饮食的trem2–/–的指示脂质种类显示的基因型-处理相互作用,如通过星号表示;****p<0.0001。针对每个种类从左到右显示对应于以下条件的数据:+/+对照;+/+5周cpz;+/+12周cpz;+/-对照;+/-5周cpz;+/-12周cpz;-/-对照;-/-5周cpz;和-/-12周cpz。图19a-19k.髓磷脂硫苷脂结合trem2并促进下游信号传导。(图19a)用脂质体刺激表达trem2/dap12的稳定的hek293细胞中的磷酸化syk(psyk)倍数变化,所述脂质体由30%的指示测试脂质和70%的磷脂酰胆碱(pc)组成,将所述倍数变化归一化为缓冲液对照(虚线),并与trem2激动剂抗体和同种型对照进行比较。来自≥2个平均技术重复的n≥2个实验重复;sm:鞘磷脂,pe:磷脂酰乙醇胺,ps:磷脂酰丝氨酸,pi:磷脂酰肌醇,galcer:半乳糖神经酰胺。*p<0.05,**p<0.01,***p<0.001;双因素anova,sidak检验。对于每个种类,trem2/dap12显示在左侧,dap12显示在右侧。(图19b)来自用指示测试脂质刺激后的2-4个供体的人巨噬细胞中的psyk倍数变化的脂质体滴定曲线,将其归一化为缓冲液对照,并与trem2激动剂抗体和同种型对照进行比较。(图19c)来自4-5个供体的人巨噬细胞中的脂质体刺激,所述刺激仅用脂质体(刺激)或用具有3μm重组trem2-或trem1-细胞外结构域(ecd)蛋白的脂质体,将其归一化为缓冲液对照(虚线)。*p<0.05;双因素anova,tukey检验。对于每个种类,从左到右显示以下条件:刺激;trem2-ecd;和trem1-ecd。(图19d-19e)渐增浓度的野生型(深色阴影)和突变体(浅色阴影)r47hhtrem2蛋白对(图19d)30%硫苷脂/70%pc或(图19e)30%ps/70%pc100nm脂质体的表面等离子体共振结合反应。(图19f)在具有5ng/mlm-csf的trem2+/+和trem2–/–bmdm中的媒介物或phrodo-髓磷脂(5μg/ml)吞噬作用的强度。数据代表来自3个平均技术重复的3个生物学重复±sem;*p<0.05,比较trem2+/+和trem2–/–曲线下面积,双尾t检验。(图19g)在具有50ng/mlm-csf的trem2+/+和trem2–/–bmdm中的媒介物或phrodo-髓磷脂(5μg/ml)吞噬作用的强度。数据代表来自3个平均技术重复的3个生物学重复±sem。(图19d-19e)硫苷脂脂质体对于(图19h)htrem2相对于(图19i)htrem2r47h突变蛋白以及(图19j-19k)磷脂酰丝氨酸(ps)脂质体对于(图19j)htrem2相对于(图19k)htrem2r47h突变蛋白的(图19h-19k)表面等离子体共振动力学分析。ka:结合速率常数,kd:解离速率常数,kd:解离常数;s:秒,m:摩尔。图20a-20c.trem2kobmdm在髓磷脂处理时显示出固醇积累。图20a描绘了相比于wtbmdm在用髓磷脂(25ug/ml)处理的trem2kobmdm中的中性脂质积累增加,如尼罗红染色所示(左)。使细胞成像,并将尼罗红定量为总斑点面积(右)。数据代表3个平均技术重复的5个生物学重复±sem;*p<0.05;在具有髓磷脂的trem2+/+和具有髓磷脂的trem2–/–之间比较的单尾t检验。图20b显示在acat抑制剂的存在下在给予髓磷脂的wt和trem2kobmdm中都没有积累胆固醇酯,表明胆固醇酯积累是acat依赖性的。胆固醇显示为对照,并且在具有髓磷脂处理和acat抑制的trem2kobmdm中胆固醇略有升高(图20c)。(图20b)对于每个ce种类,从左到右显示以下条件:+/+;-/-;+/+髓磷脂;-/-髓磷脂;+/+髓磷脂/k604;-/-髓磷脂/k604。(图20c)从左到右的条代表:+/+;-/-;+/+髓磷脂;-/-髓磷脂;+/+髓磷脂/k604;-/-髓磷脂/k604。图21a-21b.在体外通过acat1抑制剂和lxr激动剂挽救了trem2缺乏相关的胆固醇酯积累。(图21a-21b)来自培养的trem2+/+和trem2–/–bmdm(图21b)的胆固醇酯(ce)、游离胆固醇、三酰基甘油(tg)、二酰基甘油(dg)和己糖神经酰胺(hexcer)以及来自用媒介物、髓磷脂、或髓磷脂与acat1抑制剂k604(500nm)或lxr激动剂gw(10μm)处理48h的培养的ipsc来源的小胶质细胞(img)的固醇的定量。通过针对每种脂质拟合以下anova模型,确定了实验组之间的差异丰度:log10(丰度)~处理+基因型+激发:基因型+批次。每个绘图显示了每组的批次调整平均值及其95%置信区间(n=每组3个生物学重复)。将基因型之间的显著基线差异(主效应)指示为#p<0.05、##p<0.01和###p<0.001。通过对比较髓磷脂/髓磷脂+抑制剂组(n=每个条件3个生物学重复)的log10转换的丰度进行配对t检验,鉴定在每个基因型中的显著药物处理效应,并将其指示为*p<0.05和**p<0.01。(图21a)对于每个种类,从左到右显示以下条件:媒介物;髓磷脂;和髓磷脂+k604。(图21b)对于每个种类,从左到右显示以下条件:媒介物;髓磷脂;髓磷脂+k604;和髓磷脂+gw。图22a-22g.trem2缺乏在体外引起acat1依赖性胆固醇酯积累。(图22a)用ldl或氧化ldl(oxldl)刺激表达trem2/dap12的稳定的hek293细胞中的磷酸化syk(psyk)倍数变化,将所述倍数变化归一化为缓冲液对照(虚线),并与trem2激动剂抗体和同种型对照进行比较。来自≥2个平均技术重复的≥2个实验重复;***通过双因素anova、sidak检验,p<0.001。对于每个条件,trem2/dap12显示在左侧,dap12显示在右侧。(图22b)来自oxldl刺激后的2-4个供体的人巨噬细胞中的psyk倍数变化的脂质体滴定曲线,将其归一化为缓冲液对照(虚线),并与trem2激动剂抗体和同种型对照进行比较。(图22c)来自4-5个供体的人巨噬细胞中的oxldl刺激,所述刺激仅用oxldl(刺激)或用oxldl连同3μm或9μm的重组trem2-或trem1-细胞外结构域(ecd)蛋白,将其归一化为缓冲液对照(虚线)。对于每个条件,从左到右显示如下:刺激;trem2-ecd;和trem1-ecd。(图22d)在用oxldl刺激的trem2+/+(左)或trem2-/-(右)bmdm细胞中的磷酸化syk(psyk)倍数变化,将其归一化为缓冲液对照(虚线),并与trem2激动剂抗体和同种型对照进行比较。(图22e)在媒介物或25ug/mloxldl处理的trem2+/+和trem2–/–bmdm中的尼罗红染色的总斑点面积的定量。数据代表来自3个平均技术重复的7个生物学重复±sem;*p<0.05;在具有oxldl的trem2+/+和具有oxldl的trem2–/–之间比较的双尾t检验。(图22f)在用媒介物或50ng/mloxldl经200分钟延时处理的培养的trem2+/+和trem2–/–bmdm中的每个细胞的平均荧光强度。数据代表来自3个平均技术重复的3个生物学重复±sem。(图22g)用媒介物、oxldl或oxldl连同acat1抑制剂k604(500nm)处理48h的培养的trem2+/+和trem2–/–bmdm的胆固醇酯(ce)、游离胆固醇、三酰基甘油(tg)和己糖神经酰胺(hexcer)的定量。通过针对每种脂质拟合以下anova模型,确定了实验组之间的差异丰度:log10(丰度)~处理+基因型+激发:基因型+批次。每个绘图显示了每组的批次调整平均值及其95%置信区间(n=每组3个生物学重复)。将基因型之间的显著基线差异(主效应)指示为#p<0.05、##p<0.01和###p<0.001。通过对比较oxldl/oxldl+抑制剂组(n=每个条件3个生物学重复)的log10转换的丰度进行配对t检验,鉴定在每个基因型中的显著药物处理效应,并将其指示为*p<0.05和**p<0.01。对于每个种类,从左到右显示以下条件:媒介物;oxldl;和oxldl+k604。图23a-23d.trem2kobmdm在髓磷脂处理时显示出非律平染色剂积累,并且抗trem2抗体减少了人ipsc来源的小胶质细胞中的非律平染色剂。图23a描绘了相比于wtbmdm在用髓磷脂处理的trem2kobmdm中的内吞溶酶体内游离胆固醇积累增加,如通过非律平染色所示。图23b以总斑点面积显示了非律平荧光的定量。数据显示为三个技术重复的平均值和标准偏差。图23c显示,与rsv对照相比,当用trem2抗体处理时,ipsc小胶质细胞具有减少的非律平染色剂。作为阳性对照,将细胞用3ug/ml的npc1抑制剂u18666a处理。内吞溶酶体游离胆固醇被非律平染色的代表性图像。图23d显示了非律平荧光的定量。数据显示为1-3个技术重复的平均值和标准偏差。图24.apoeko前脑在存在或不存在慢性脱髓鞘的情况下显示出胆固醇酯(ce)的积累。与正常饮食相比,在经受4周双环己酮草酰二腙饮食的野生型前脑中发生ce积累。与正常饮食相比,在使用双环己酮草酰二腙的apoe敲除小鼠中的ce积累加剧。用双环己酮草酰二腙处理在野生型和apoe基因敲除小鼠两者中都增加了酰基磷脂酰丝氨酸(acylps)的丰度。*p<0.05,***p<0.001;双因素anova,dunnett事后检验,对多重比较进行了校正。通过液相色谱-质谱(lcms)将脂质定量。动物为6个月大,n=每组8只动物(雄性3只,雌性5只)。图25.apoeko前脑在存在或不存在慢性脱髓鞘的情况下显示出多个胆固醇酯(ce)种类的积累。与正常饮食相比,在经受4周双环己酮草酰二腙饮食的野生型前脑中发生ce种类积累。与正常饮食相比,在使用双环己酮草酰二腙的apoe敲除小鼠中的ce种类积累加剧。*p<0.05,***p<0.001;双因素anova,dunnett事后检验,对多重比较进行了校正。通过lcms将脂质定量。动物为6个月大,n=每组8只动物(雄性3只,雌性5只)。图26a-26c.从慢性脱髓鞘后的apoeko小鼠分离的小胶质细胞、星形胶质细胞和神经元中的胆固醇酯(ce)水平升高。相对于野生型(wt)脑,从apoeko小鼠分离的小胶质细胞(图26a)中的大多数ce种类水平更高,并且与对照饮食相比,在两个组中的12周双环己酮草酰二腙饮食都使得水平升高。与具有对照饮食的apoeko小鼠以及双环己酮草酰二腙或对照饮食中的wt小鼠相比,具有12周双环己酮草酰二腙饮食的apoeko小鼠的星形胶质细胞(图26b)显示出ce积累加剧。与具有任一饮食的wt小鼠相比,包括ce(20:4)和ce(22:6)在内的ce的某些种类在从具有任一饮食的apoeko小鼠分选的神经元(图26c)中增加。通过lcms将脂质定量。动物为6个月大,n=每组6只动物(雄性3只,雌性3只)。图27a-27h.apoe缺乏引起胆固醇酯在脑、分选的小胶质细胞和星形胶质细胞以及csf中积累。(图27a)随着在apoe+/+和apoe–/–小鼠前脑中的基因型和/或12周cpz处理而改变的前50种脂质的热图,其按照p值(单因素anova)排列。(图27b)来自具有对照饮食或12周cpz饮食的apoe+/+和apoe–/–小鼠前脑提取物的游离胆固醇、胆固醇酯(ce)、bmp和三酰基甘油酯种类的浓度。(图27c)随着在apoe+/+和apoe–/–分选的小胶质细胞中的基因型和/或12周cpz处理而改变的前50种脂质的热图,其按照p值(单因素anova)排列。(图27d)来自具有对照饮食或12周cpz饮食的apoe+/+和apoe–/–分选的小胶质细胞的游离胆固醇、ce、己糖神经酰胺、神经酰胺、硫苷脂和神经节苷脂种类的浓度。(图27e)随着在apoe+/+和apoe–/–分选的星形胶质细胞中的基因型和/或12周cpz处理而改变的前50种脂质的热图,其按照p值(单因素anova)排列。(图27f)来自具有对照饮食或12周cpz饮食的apoe+/+和apoe–/–分选的星形胶质细胞的游离胆固醇、ce、己糖神经酰胺、神经酰胺、硫苷脂和神经节苷脂种类的浓度。(图27g)随着apoe+/+和apoe–/–csf的基因型和/或12周cpz处理而改变的前50种脂质的热图,其按照p值(单因素anova)排列。(图27h)来自具有对照饮食或12周cpz饮食的apoe+/+和apoe–/–csf的ce、硫苷脂、神经节苷脂和磷脂酸种类的浓度。对于图27b、27d、27f和27h,数据代表均值±sem(n=6),并且呈现为log10标度。双因素anova,fdr<0.05;基因型效应由主题标签指示,基因型-处理相互作用由星号指示。*p<0.05,#p<0.05,##p<0.01,###p<0.001,####p<0.0001。对于每个种类,从左到右显示以下条件:apoe+/+对照;apoe+/+12周cpz;apoe-/-对照;apoe-/-12周cpz。图28a-28b.来源于5xfad小鼠脑的小胶质细胞和星形胶质细胞中的胆固醇酯(ce)的丰度增加。相对于野生型(wt)小鼠,从5xfad小鼠中分离的小胶质细胞(图28a)和星形胶质细胞(图28b)中的ce水平更高。动物为14个月大。n=每组4只动物。图29a-29i.lps刺激和髓磷脂处理后,在小鼠trem2kobmdm中的炎性细胞因子产生增加。将wt和trem2kobmdm以100,000个细胞/孔在50ng/mlmcsf中进行平板接种,随后用媒介物或25ug/ml的纯化小鼠髓磷脂处理48h。在髓磷脂处理的最后16h,细胞未经lps刺激(0)或用10ng/mllps刺激。收集细胞培养基,并通过定量免疫测定(evetechnologies)测量(图29a)g-csf、(图29b)infy、(图29c)il-12(p40)、(图29d)il-12(p70)、(图29e)lix(cxcl5)、(图29f)mcp-1(ccl2)、(图29g)mig(cxcl9)、(图29h)il-1a和(图29i)il-1b的水平。数据代表均值±sem,n=2个技术重复。图30a-30b.在人ipsc来源的trem2ko小胶质细胞中的il-1β细胞因子反应因抗trem2抗体而增强并且il-1βmrna反应被减弱。(图30a)将wt和trem2koipsc来源的小胶质细胞用lps/atp(分别为1ug/ml和5mm)处理4小时,以刺激nlrp3炎症小体激活,然后收集细胞培养基,并通过定量免疫测定(evetechnologies)测量il-1β的水平。**p<0.01;双因素anova,tukey事后检验,对多重比较进行了校正。数据代表均值±sem,n=4个生物学重复。在每个分组中,显示以下条件:对照显示在左侧,lps+atp显示在中间,并且lps+atp+胱天蛋白酶1抑制剂vx-765(invivogen)显示在右侧。(图30b)将ipsc小胶质细胞用25ug/ml的髓磷脂处理24小时,然后用对照抗体(抗rsv)或抗trem2抗体处理48小时。通过qpcr测量il-1βmrna水平,并将其归一化为gapdh。n=2个生物学重复。图31a-31l.与trem2wtimg相比,trem2ko人ipsc来源的小胶质细胞(img)在基线和用髓磷脂处理后显示出脂质代谢基因的差异调节。与trem2wtimg相比,trem2koimg在基线时(媒介物处理)以及在25ug/ml的纯化髓磷脂处理24h后具有更高的abca1(图31a)、abca7(图31b)、abcg1(图31c)和ldlr(图31k)mrna水平。与trem2wtimg相比,trem2koimg具有更低的apoc1(图31d)、apoe(图31e)、ch25h(图31f)、fabp3(图31g)、fabp5(图31h)、lpl(图31i)、olr1(图31j)和lipa(图31l)mrna水平。n=4个生物学重复。数据显示为均值和s.e.m。图32a-32b.用25ug/ml的纯化髓磷脂处理48h增加了trem2ko和trem2wt人ipsc来源的小胶质细胞(img)两者中的分泌的apoe(图32a)和apoc1(图32b)蛋白。与trem2wtimg相比,在用媒介物和髓磷脂处理的条件下,在trem2koimg中的分泌的apoe(图32a)和apoc1(图32b)水平降低。n=3个技术重复。数据显示为中位值和四分位距。对于每个基因型分组,“媒介物”显示在左侧,并且“髓磷脂”显示在右侧。具体实施方式如本文所述,已经确定trem2的功能水平降低导致脂质代谢失调。当在表达trem2的细胞中相当程度的失调是被脂质激发诱导时,可用激动剂抗trem2抗体加以改善。类似地,在通过用acat1抑制剂、载脂蛋白e(apoe)、rxr激动剂、lxr激动剂或它们的组合处理已经降低trem2活性的细胞中,脂质失调可得到改善(参见,实施例)。虽然已使用rxr和lxr激动剂和acat1抑制剂来改善脂质清除,但它们的作用机制以多种细胞类型为目标,并可能导致不良副作用。相反,trem2表达局限于髓系谱系的细胞(例如,小胶质细胞、树突细胞和巨噬细胞)。因此,可以使用激动剂抗trem2抗体作为更有针对性的方法来促进在多种情况下的脂质清除。例如,一系列广泛的疾病和疾患与髓系谱系细胞中脂质代谢失调有关,包括某些神经退行性疾病(例如阿尔茨海默病)、动脉粥样硬化、代谢综合征相关疾病和某些溶酶体贮积病(例如c型尼曼-皮克病(npc))。因此,如本文所述,可以使用激动剂抗trem2抗体来治疗患有这样的病症的哺乳动物中的脂质代谢失调。此外,还显示出trem2功能水平的降低是促炎性的(例如,导致促炎性细胞因子包括il-1β的上调,所述il-1β是炎症小体途径的细胞因子)。相反,用抗体激动trem2减弱了这种炎症(例如,减轻了炎症小体反应)。因此,也可以用激动剂抗trem2抗体治疗与炎症和炎症小体反应相关的多种疾病和疾患。trem2基因编码作为免疫球蛋白(ig)受体超家族成员的i型跨膜蛋白。trem2最初被克隆为编码trem1同源物的cdna(bouchon,a等人,jexpmed,2001.194(8):第1111-22页)。这种受体是约40kda的糖蛋白,其在n-去糖基化之后减小至26kda。trem2基因编码230个氨基酸长的蛋白质,所述蛋白质包括细胞外结构域、跨膜区和短胞质尾(参见,uniprotkbq9nzc2;ncbi参考序列:np_061838.1)。由外显子2编码的细胞外区域由单个vig-sf结构域组成,含有三个潜在的n-糖基化位点。假定的跨膜区含有带电荷的赖氨酸残基。trem2的胞质尾缺乏信号传导基序,其被认为是通过信号传导衔接分子dap12/tyrobp并通过dap10来传导信号。在破骨细胞、未成熟树突细胞和巨噬细胞的表面上发现trem2。在中枢神经系统中,trem2仅在小胶质细胞中表达。因此,本文公开的某些实施方案提供了治疗在有需要的哺乳动物(例如,人)中的脂质代谢失调和/或炎症的方法,所述方法包括向所述哺乳动物施用有效量的激动剂抗trem2抗体。在某些实施方案中,这样的方法可用于治疗脂质代谢失调。在某些实施方案中,这样的方法可用于治疗炎症(例如,与脂质代谢失调相关的炎症)。在某些实施方案中,这样的方法可用于治疗脂质代谢失调和炎症两者。在某些实施方案中,在哺乳动物中的表达trem2的细胞表现出脂质代谢失调。在某些实施方案中,细胞是小胶质细胞。在某些实施方案中,细胞是巨噬细胞。如本文所用,术语“脂质代谢失调”是指相比于对照在细胞/哺乳动物中的脂质代谢改变(例如,与健康对照哺乳动物或没有脂质代谢失调的对照动物相比,trem2活性降低,apoe活性降低或apoeε4等位基因)。例如,脂质代谢失调可包括脂质种类的一个或多个类别的水平改变(例如,通过增加形成或减少降解)或定位/存储改变。在某些实施方案中,脂质代谢失调包括脂质的一个或多个类别或种类相比于对照的积累增加(例如,细胞内或细胞外积累)。在某些实施方案中,脂质代谢失调包括一种或多种脂质的细胞内积累增加。在某些实施方案中,一种或多种脂质在小胶质细胞中以细胞内方式积累。在某些实施方案中,一种或多种脂质在巨噬细胞中以细胞内方式积累。在某些实施方案中,一种或多种脂质未在星形胶质细胞中以细胞内方式积累。在某些实施方案中,脂质代谢失调包括一种或多种脂质的细胞外积累增加。在某些实施方案中,一种或多种脂质选自由以下组成的组:胆固醇酯、氧化胆固醇酯、双(单酰基甘油)磷酸酯种类(bmp)、二酰基甘油酯、三酰基甘油酯、己糖神经酰胺、半乳糖神经酰胺、乳糖神经酰胺、硫苷脂、神经节苷脂、磷脂酰丝氨酸38:4、双(单酰基甘油)磷酸酯44:12、溶血磷脂酰胆碱16:0、血小板活化因子、硫酸胆固醇、溶血磷脂酰乙醇胺、鞘磷脂(例如,smd18:1/18:0)、磷脂酰甘油(例如pgd16:0/18:1)、磷脂酰乙醇胺(例如,pe38:6),及其组合。在某些实施方案中,一种或多种脂质选自由以下组成的组:胆固醇酯、氧化胆固醇酯、双(单酰基甘油)磷酸酯种类(bmp)、二酰基甘油酯、三酰基甘油酯、己糖神经酰胺、半乳糖神经酰胺、乳糖神经酰胺、硫苷脂、神经节苷脂、磷脂酰丝氨酸38:4、双(单酰基甘油)磷酸酯44:12、溶血磷脂酰胆碱16:0、血小板活化因子、硫酸胆固醇、溶血磷脂酰乙醇胺,及其组合。在某些实施方案中,一种或多种脂质包括本文所述例如在附图或实施例中的脂质。在某些实施方案中,一种或多种脂质包括胆固醇酯。在某些实施方案中,一种或多种脂质包括胆固醇酯的氧化代谢物(例如,ceoxoode、cehode、cehpode、ceoxohete或cehete)。在某些实施方案中,激动剂抗trem2抗体减少脂质积累(例如,细胞内或细胞外积累)。在某些实施方案中,激动剂抗trem2抗体减少胆固醇酯的积累。在某些实施方案中,脂质积累相比于对照减少至少约5%、至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约95%、96%、97%、98%或99%。可以通过使用本文所述或本领域已知的测定法评价样品(例如,包含一个或多个细胞的样品)来确立细胞中的脂质积累水平。在某些实施方案中,在哺乳动物中表达trem2的细胞表现出炎症或促炎反应,比如促炎细胞因子的上调。在某些实施方案中,炎症小体在表达trem2的细胞中被上调。在某些实施方案中,细胞是小胶质细胞。在某些实施方案中,细胞是巨噬细胞。在某些实施方案中,至少一种促炎细胞因子的表达在哺乳动物中(例如,在表达trem2的细胞,比如巨噬细胞或小胶质细胞中)被上调。在某些实施方案中,至少一种细胞因子选自由以下组成的组:g-csf、infy、il-12(p40)、il-12(p70)、lix(cxcl5)、mcp-1(ccl2)、mig(cxcl9)、il-1α、il-1β和il-18。在某些实施方案中,至少一种细胞因子(例如,il-1β或il-18)与炎症小体途径相关。在某些实施方案中,至少一种细胞因子是il-1β。在某些实施方案中,激动剂抗trem2抗体降低了哺乳动物中的促炎反应(例如,炎症小体反应)。例如,在某些实施方案中,至少一种促炎细胞因子的表达降低(例如,与对照相比,所述对照比如未给予激动剂抗trem2抗体的相应哺乳动物)。在某些实施方案中,至少一种细胞因子选自由以下组成的组:g-csf、infy、il-12(p40)、il-12(p70)、lix(cxcl5)、mcp-1(ccl2)、mig(cxcl9)、il-1α、il-1β和il-18。在某些实施方案中,至少一种细胞因子(例如,il-1β或il-18)与炎症小体途径相关。在某些实施方案中,至少一种细胞因子是il-1β。在某些实施方案中,至少一种细胞因子的表达相比于对照减少至少约5%、至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约95%、96%、97%、98%或99%。通过使用本文所述或本领域已知的测定法评价样品(例如,包含一个或多个细胞的样品)来确立在细胞/哺乳动物中的细胞因子表达水平。例如,所述测定法可以评价rna(例如,mrna)或蛋白质表达水平(例如,与对照相比)。本文所述的某些实施方案还提供了治疗在有需要的患者中的脂质代谢失调的方法,所述方法包括:1)从患者获得或已经获得生物样品;2)分析生物样品或已经分析样品以检测脂质代谢失调的存在,从而将患者诊断为患有脂质代谢失调;以及3)向诊断的患者施用有效量的激动剂抗trem2抗体。本文所述的某些实施方案还提供了用激动剂抗trem2抗体治疗患者的方法,所述方法包括:1)从患者获得或已经获得生物样品;2)分析生物样品或已经分析样品以检测脂质代谢失调的存在,从而将患者诊断为患有脂质代谢失调;以及3)向诊断的患者施用有效量的激动剂抗trem2抗体。trem2活性降低、apoe活性降低和apoe4表达在某些实施方案中,使用本文所述的方法治疗的哺乳动物具有或已经被确定具有正常的trem2活性(例如,与健康对照受试者相比)。在某些其他实施方案中,使用本文所述的方法治疗的哺乳动物具有或已经被确定具有trem2活性降低。如本文所用,术语“trem2活性降低”是指与对照细胞/哺乳动物(例如,来自健康受试者的相应细胞)相比具有降低的trem2功能的细胞或包含这种细胞的哺乳动物。在某些实施方案中,功能蛋白的水平降低可由于trem2的表达降低(例如,通过抑制转录、抑制rna成熟、抑制rna翻译、改变翻译后修饰、或增加rna或蛋白质降解)或trem2蛋白的细胞表面水平降低所致。在某些实施方案中,功能性trem2水平降低是由trem2基因(例如,r47h、r62h、h157y、q33x、t66m或y38c)的功能基因突变的丧失或部分丧失引起的。在某些实施方案中,功能性trem2水平降低是由trem2蛋白水平降低引起的。在某些实施方案中,功能性trem2水平降低是由去整合素和金属蛋白酶(adam)蛋白酶(例如,adam10和adam17)对受体的切割增加导致可溶性trem2(strem2)释放到细胞外环境中引起的。在某些实施方案中,trem2活性降低包括信号传导降低。可以通过使用本文所述或本领域已知的测定法评价样品(例如,包含一个或多个细胞的样品)来确立细胞/哺乳动物中trem2活性降低的存在。例如,所述测定法可评价rna或蛋白质表达水平、细胞表面trem2蛋白质水平或可以检查trem2活性(例如,信号传导)(例如,与对照相比)。在其他实施方案中,所述测定法可测量strem2水平(例如,与对照相比)。还可以使用trem2活性的其他功能性度量,比如与对照细胞相比的psyk活性或i类pi3激酶活性降低,来鉴定具有trem2活性降低的细胞或哺乳动物。在某些实施方案中,样品中的功能性trem2水平相比于对照降低至少约5%、至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约95%、96%、97%、98%或99%。在某些实施方案中,细胞/哺乳动物不表达功能性trem2。在某些实施方案中,哺乳动物具有改变的一种或多种另外的基因的表达,所述基因比如与溶酶体功能或脂质代谢相关的基因(例如,本文所述的基因)。apoe是主要的胆固醇载体,其支持脑中的脂质转运和损伤修复。在周围组织中,apoe主要由肝脏和巨噬细胞产生,并以同工型依赖性方式介导胆固醇代谢。人apoe基因以三个多态性等位基因(ε2、ε3和ε4)的形式存在,它们编码apoe2、apoe3和apoe4(参见,genomiccoordinates(grch38):19:44,905,748-44,909,394;uniprotkbp02649)。apoe由299个氨基酸组成,并具有约34kda的分子质量。三种apoe同工型之间的差异限于存在半胱氨酸或精氨酸的氨基酸112和158:apoe2(cys112,cys158)、apoe3(cys112,arg158)和apoe4(arg112,arg158)。在这两个位置的单个氨基酸差异影响apoe同工型的结构,并影响其结合脂质、受体和aβ的能力。在某些实施方案中,使用本文所述的方法治疗的哺乳动物具有或已经被确定具有正常的apoe活性(例如,与健康对照受试者相比)。在某些其他实施方案中,使用本文所述的方法治疗的哺乳动物具有或已经被确定具有apoe活性降低。如本文所用,术语“apoe活性降低”是指与对照细胞/哺乳动物(例如,来自健康受试者的相应细胞)相比具有降低apoe功能的细胞或包含这种细胞的哺乳动物。在某些实施方案中,功能蛋白水平降低可由于apoe表达降低(例如,通过抑制转录、抑制rna成熟、抑制rna翻译、改变翻译后修饰、或增加rna或蛋白质降解)所致。在某些实施方案中,功能性apoe水平降低是由apoe基因的功能基因突变的丧失或部分丧失或编码变体引起的。在某些实施方案中,功能性apoe水平降低是由apoe蛋白水平降低引起的。在某些实施方案中,功能性apoe水平降低是由apoe分泌减少引起的。在某些实施方案中,功能性apoe水平降低是由细胞内或细胞外apoe转运降低引起的。在某些实施方案中,功能性apoe水平降低是由细胞运输异常引起的,包括到质膜的再循环减少,从内吞溶酶体向高尔基复合体的逆行转运减少,沿生物合成途径的运输减少。在某些实施方案中,功能性apoe水平降低是由诸如脂质之类的apoe货物转运降低引起的。在某些实施方案中,功能性apoe水平降低是由细胞脂质的流出减少引起的。在某些实施方案中,功能性apoe水平降低是由抗氧化性能降低引起的。可以通过使用本文所述或本领域已知的测定法评价样品(例如,包含一个或多个细胞的样品)来确立细胞/哺乳动物中apoe活性降低的存在。例如,所述测定法可评价rna或蛋白质表达水平或可以检查apoe活性(例如,与对照相比)。在某些实施方案中,样品中的功能性apoe水平相比于对照降低至少约5%、至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约95%、96%、97%、98%或99%。在某些实施方案中,细胞/哺乳动物不表达功能性apoe。在某些实施方案中,使用本文所述的方法治疗的哺乳动物不具有或已经被确定不具有apoeε4等位基因。在某些其他实施方案中,使用本文所述的方法治疗的哺乳动物具有或已经被确定具有apoeε4等位基因。在某些实施方案中,哺乳动物对于apoeε4等位基因是杂合的。在某些实施方案中,哺乳动物对于apoeε4等位基因是纯合的。可以使用本文所述的测定法或使用本领域中已知的测定法检测样品(即,包含来自哺乳动物的一个或多个细胞的样品)中的apoeε4等位基因。在某些实施方案中,所述测定法是基因分型测定法,比如测序测定法。如本文所述,可以用激动剂抗trem2抗体治疗可能患有脂质代谢失调和/或炎症的表达apoe4的哺乳动物。因而,在某些实施方案中,可以使用本文所述的方法治疗具有apoeε4等位基因的哺乳动物。因此,本文公开的某些实施方案提供了治疗在有需要的哺乳动物中的脂质代谢失调的方法,所述方法包括向哺乳动物施用有效量的激动剂抗trem2抗体,其中所述哺乳动物具有或已经被确定具有trem2活性降低、apoe活性降低和/或apoeε4等位基因。在某些实施方案中,所述哺乳动物具有或已经被确定具有trem2活性降低。在某些实施方案中,所述哺乳动物具有或已经被确定具有apoe活性降低。在某些实施方案中,所述哺乳动物具有或已经被确定具有apoeε4等位基因。某些实施方案还提供了治疗在有需要的哺乳动物中的炎症的方法,所述方法包括向哺乳动物施用有效量的激动剂抗trem2抗体,其中所述哺乳动物具有或已经被确定具有trem2活性降低。本文公开的某些实施方案提供了治疗在有需要的患者中的脂质代谢失调的方法,所述方法包括:1)从患者获得或已经获得生物样品;2)检测或已经检测到样品中的trem2活性降低、apoe活性降低或apoeε4等位基因;3)在检测到trem2活性降低、apoe活性降低或apoeε4等位基因时将患者诊断为患有脂质代谢失调;以及4)向诊断的患者施用有效量的激动剂抗trem2抗体。在某些实施方案中,所述方法包括在检测到trem2活性降低时将患者诊断为患有脂质代谢失调。在某些实施方案中,所述方法包括在检测到apoe活性降低时将患者诊断为患有脂质代谢失调。在某些实施方案中,所述方法包括在检测到apoeε4等位基因时将患者诊断为患有脂质代谢失调。本文公开的某些实施方案提供了用激动剂抗trem2抗体治疗患者的方法,所述方法包括:1)从患者获得或已经获得生物样品;2)分析生物样品或已经分析样品以检测trem2活性降低、apoe活性降低或apoeε4等位基因,从而将患者诊断为患有脂质代谢失调;以及4)向诊断的患者施用有效量的激动剂抗trem2抗体。在某些实施方案中,所述方法包括分析生物样品或已经分析样品以检测trem2活性降低。在某些实施方案中,所述方法包括分析生物样品或已经分析样品以检测apoe活性降低。在某些实施方案中,所述方法包括分析生物样品或已经分析样品以检测apoeε4等位基因。表达的trem2细胞如本文所述,已经明确显示trem2活性降低在某些细胞类型(例如,小胶质细胞和巨噬细胞)中引起脂质代谢失调,但在某些其他细胞类型(例如,星形胶质细胞)中则不然(参见,实施例)。还已经显示功能性trem2的减少引起促炎反应的增强。因此,本文公开的某些实施方案提供了减少细胞中一种或多种脂质的细胞内积累的方法,所述方法包括使所述细胞与有效量的激动剂抗trem2抗体接触。某些实施方案还提供了降低细胞中至少一种促炎细胞因子的表达的方法,所述方法包括使所述细胞与有效量的激动剂抗trem2抗体接触。在某些实施方案中,细胞表达trem2。在某些实施方案中,细胞是小胶质细胞。在某些实施方案中,细胞是巨噬细胞。在某些实施方案中,一种或多种脂质选自由以下组成的组:胆固醇酯、氧化胆固醇酯、双(单酰基甘油)磷酸酯种类(bmp)、二酰基甘油酯、三酰基甘油酯、己糖神经酰胺、半乳糖神经酰胺、乳糖神经酰胺、硫苷脂、神经节苷脂、磷脂酰丝氨酸38:4、双(单酰基甘油)磷酸酯44:12、溶血磷脂酰胆碱16:0、血小板活化因子、硫酸胆固醇、溶血磷脂酰乙醇胺、鞘磷脂(例如,smd18:1/18:0)、pg(例如pgd16:0/18:1)、pe(例如,pe38:6),及其组合。在某些实施方案中,一种或多种脂质选自由以下组成的组:胆固醇酯、氧化胆固醇酯、bmp、二酰基甘油酯、三酰基甘油酯、己糖神经酰胺、半乳糖神经酰胺、乳糖神经酰胺、硫苷脂、神经节苷脂、磷脂酰丝氨酸38:4、双(单酰基甘油)磷酸酯44:12、溶血磷脂酰胆碱16:0、血小板活化因子、硫酸胆固醇、溶血磷脂酰乙醇胺,及其组合。在某些实施方案中,一种或多种脂质包括胆固醇酯。在某些实施方案中,一种或多种脂质包括本文所述的脂质。在某些实施方案中,脂质积累相比于对照减少至少约5%、至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约95%、96%、97%、98%或99%。在某些实施方案中,至少一种细胞因子选自由以下组成的组:g-csf、infy、il-12(p40)、il-12(p70)、lix(cxcl5)、mcp-1(ccl2)、mig(cxcl9)、il-1α、il-1β和il-18。在某些实施方案中,至少一种细胞因子(例如,il-1β或il-18)与炎症小体途径相关。在某些实施方案中,至少一种细胞因子是il-1β。在某些实施方案中,至少一种细胞因子的表达相比于对照(例如,未给予激动剂抗trem2抗体的相应对照细胞)降低至少约5%、至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约95%、96%、97%、98%或99%。在某些实施方案中,细胞具有或已经被确定具有trem2活性降低。在其他实施方案中,细胞具有正常的trem2活性。在某些实施方案中,细胞具有或已经被确定具有apoe活性降低(例如,细胞具有apoe丧失或功能突变的部分丧失或编码变体)。在其他实施方案中,细胞具有正常的apoe活性。在某些实施方案中,细胞表达或已经被确定表达apoe4。在某些其他实施方案中,细胞不表达或已经被确定不表达apoe4。在某些实施方案中,使细胞与本文所述的激动剂抗trem2抗体(例如本文所述的激动剂抗trem2抗体,比如mab17291或78.18)接触。在某些实施方案中,使细胞在体外、体内或离体地与激动剂抗trem2抗体接触。在某些实施方案中,使细胞在体外与激动剂抗trem2抗体接触。在某些实施方案中,使细胞在体内与激动剂抗trem2抗体接触。在某些实施方案中,使细胞离体地与激动剂抗trem2抗体接触。在某些实施方案中,细胞存在于哺乳动物中并且在体内与激动剂抗trem2抗体接触。在这样的实施方案中,可以通过施用所述抗体来使细胞接触。在某些实施方案中,所述施用为全身施用。在某些实施方案中,哺乳动物患有与细胞内脂质积累相关的炎症。在某些实施方案中,激动剂抗trem2抗体降低至少一种促炎细胞因子(例如本文所述的促炎细胞因子,比如g-csf、infy、il-12(p40)、il-12(p70)、lix(cxcl5)、mcp-1(ccl2)、mig(cxcl9)、il-1α、il-1β或il-18)的表达。在某些实施方案中,所述至少一种细胞因子是il-1β。在某些实施方案中,哺乳动物患有或易于发生本文所述的疾病或病症。某些疾病和病症的治疗如实施例中所述,巨噬细胞和小胶质细胞中的trem2功能丧失导致不能加工和代谢脂质(例如胆固醇、胆固醇酯(ce)、甘油三酯和鞘脂)。此外,已经显示这些脂质的积累导致促炎反应(例如,包括作为炎症小体途径的细胞因子的il-1β在内的促炎细胞因子的上调)。相反,用抗体激动trem2降低了脂质负担并减轻了炎症。因此,如本文所述,激动剂抗trem2抗体可用于校正巨噬细胞、小胶质细胞或表达trem2的其他细胞类型中的脂质失调和炎症反应,并治疗有关疾病和疾患。例如,小胶质细胞中脂质负担增加和相关炎症是包括阿尔茨海默病(ad)在内的多种神经退行性疾病的关键特征。已知ce在ad患者脑部和和ad小鼠模型中积累(astarita等人,(2011).plosone6,e24777;chan等人,(2012).jbiolchem287,2678-2688;morel等人,(2013).natcommun4,2250;shibuya等人,(2015).futuremedchem7,2451-2467),并且load连锁的trem2变体导致功能的部分丧失(ulland,t.k.和colonna,m.(2018).natrevneurol14,667-675)。因此,根据本文所述的结果,增强trem2功能在ad中可能是有益的,其部分原因是促进小胶质细胞中的脂质清除。类似地,激动剂抗trem2抗体也可用于减轻以这些病理为特征的其他神经退行性疾病中的脂质负担和炎症。这样的疾病包括但不限于纳苏-哈科拉病(nasu-hakoladisease,nhd)、路易体痴呆、帕金森病、视网膜变性(例如黄斑变性)、亨廷顿病、额颞叶变性(ftd)和肌萎缩性侧索硬化(als)。如实施例中所述,trem2还在调节溶酶体胆固醇中起作用,并且激动剂抗trem2抗体在具有trem2表达降低的细胞中显示出减少内吞溶酶体游离胆固醇积累。因此,激动性trem2可用于治疗某些与胆固醇积累相关的溶酶体贮积病,比如尼曼-皮克病(a、b或c型)。另外,已显示trem2在慢性髓磷脂吞噬时参与小胶质细胞基因表达的控制和胆固醇转运,并且不能正确执行该程序导致大脑中广泛的神经元损伤(参见,实施例)。这些结果表明,增强trem2活性可具有神经保护作用(例如,对于衰老),并且可刺激某些神经退行性疾病(比如多发性硬化和消融性白质脑病)中的髓鞘再生。trem2还表达在cns之外(例如,在脂肪组织、肝脏、骨骼肌和动脉中的动脉粥样硬化病变中)的巨噬细胞亚群上。可以利用trem2调节来改变这些组织中的脂质代谢和炎症反应,以治疗各种相关疾病。例如,代谢综合征,包括一系列病症,比如肥胖、2型糖尿病、动脉粥样硬化、酒精和非酒精性脂肪肝疾病以及酒精和非酒精性脂肪性肝炎,通常与各种组织(包括脂肪组织、肝脏和骨骼肌)中的低度慢性(即,未消除的)炎症相关。髓样细胞,例如单核细胞和巨噬细胞,是这些炎症反应的关键介质,最终可导致胰岛素抵抗、葡萄糖耐受不良和动脉粥样硬化。对这些组织中的炎症反应重要的是髓样细胞与脂肪细胞或其他含脂肪细胞(比如肝细胞)之间的相互作用,以及髓样细胞自身脂质失调的程度。因此,用trem2激动剂调节脂质代谢/炎症可用于治疗代谢综合征和代谢综合征相关病症。另外,类风湿关节炎(ra)是一种自身免疫性疾病,其引起关节的慢性炎症,并且也与脂质失调有关。这些脂质异常增加了发生各种心血管疾病的风险。正因为如此,用trem2激动剂调节脂质代谢/炎症可用于治疗ra。功能性trem2的减少还导致多种促炎性细胞因子(包括炎症小体途径相关细胞因子il-1β)上调。如实施例中所述,这种炎症小体反应被激动剂抗trem2抗体降低,证明了抗trem2抗体的抗炎作用及其在治疗与炎症相关的疾病和病症(例如,炎症小体相关疾病和疾患)中的效用。例如,施用抗trem2抗体可用于治疗诸如ra、痛风和某些肠病(例如炎性肠病(ibd))之类的疾病。因此,在某些实施方案中,本文公开的方法可用于治疗患有或倾向于产生阿尔茨海默病、nhd、路易体痴呆、帕金森病、视网膜变性(例如黄斑变性)、ftd、als或亨廷顿病的哺乳动物。本文公开的方法还可用于治疗肥胖症、2型糖尿病、酒精和非酒精性脂肪性肝炎、酒精和非酒精性脂肪肝疾病、动脉粥样硬化和与代谢综合征相关的其他疾病。在某些实施方案中,本文所述的方法不用于治疗非酒精性脂肪性肝炎。在某些实施方案中,本文所述的方法可用于治疗溶酶体贮积病,比如a、b或c型尼曼-皮克病。在某些其他实施方案中,本文所述的方法可用于治疗与脱髓鞘相关的疾病(例如,多发性硬化或消融性白质脑病)。本文公开的方法可用于治疗患有或易于发生炎症或与炎症相关的疾病或疾患,比如炎症小体相关疾病和疾患的哺乳动物。在某些实施方案中,本文所述的方法可用于治疗类风湿关节炎(ra)、痛风和某些肠病(例如炎性肠病(ibd))。本文公开的方法也可用于治疗衰老或与衰老相关的效应。在某些实施方案中,这种方法减轻了细胞衰老和/或改善了细胞功能/活力。在某些实施方案中,这种方法延长了细胞寿命。治疗在患有一种或多种这些病症的哺乳动物中的脂质失调和/或炎症可改变疾病的自然过程(例如,通过预防疾病的发生或复发,减轻症状,减弱疾病的任何直接或间接病理后果,降低疾病的进展速度,改善或减轻疾病状态,或缓解或改善预后)。如本文所用,术语“易于发生”是指具有增加的发生特定疾病或病症的风险(例如,由于遗传风险因素,比如表达apoe4同工型或trem2突变;由于生活方式的选择,比如吃高脂肪饮食;或由于遗传和生活方式因素的组合导致的病症,比如代谢综合征)的哺乳动物。在某些实施方案中,使用本文所述的方法治疗的哺乳动物患有nhd。在某些实施方案中,哺乳动物易于发生nhd。在某些实施方案中,使用本文所述的方法治疗的哺乳动物患有c型尼曼-皮克病。在某些实施方案中,哺乳动物易于发生c型尼曼-皮克病。在某些实施方案中,使用本文所述的方法治疗的哺乳动物患有阿尔茨海默病。在某些实施方案中,哺乳动物易于发生阿尔茨海默病。因而,本文公开的某些实施方案还提供了治疗在有需要的哺乳动物中的阿尔茨海默病的方法,所述方法包括向所述哺乳动物施用激动剂抗trem2抗体,其中所述哺乳动物患有或已经被确定患有脂质代谢失调。在某些实施方案中,哺乳动物具有或已经被确定具有在表达trem2的细胞(例如,小胶质细胞)中的脂质代谢失调。在某些实施方案中,表达trem2的细胞具有或已经被确定具有trem2活性降低。在某些实施方案中,脂质代谢失调包括本文所述的一种或多种脂质(例如,胆固醇酯)的细胞内积累增加。在某些实施方案中,哺乳动物患有与脂质代谢失调(例如,至少一种促炎细胞因子比如本文所述的细胞因子(例如,il-1β)被上调)相关的炎症。在某些实施方案中,使用本文所述的方法治疗的哺乳动物患有动脉粥样硬化。在某些实施方案中,哺乳动物易于发生动脉粥样硬化。因而,本文公开的某些实施方案还提供了治疗在有需要的哺乳动物中的动脉粥样硬化的方法,所述方法包括向所述哺乳动物施用有效量的本文所述的激动剂抗trem2抗体(例如,mab17291或78.18)。在某些实施方案中,所述哺乳动物患有或已经被确定患有脂质代谢失调。在某些实施方案中,脂质代谢失调包括本文所述的一种或多种脂质的积累(例如细胞内或细胞外积累)增加。在某些实施方案中,一种或多种脂质在巨噬细胞(例如具有或已经被确定具有trem2活性降低的巨噬细胞)中以细胞内方式积累。在某些实施方案中,哺乳动物患有与脂质代谢失调(例如,至少一种促炎细胞因子比如本文所述的细胞因子(例如,il-1β)被上调)相关的炎症。在某些实施方案中,所述方法进一步包括施用第二治疗剂(例如,本文所述的治疗剂)。在某些实施方案中,第二治疗剂是可用于治疗动脉粥样硬化的药剂。在某些实施方案中,第二治疗剂是本文所述的lxr激动剂或rxr激动剂或本文所述的acat1抑制剂。激动剂抗trem2抗体如本文所述,在某些实施方案中,向哺乳动物施用有效量的激动剂抗trem2抗体,以治疗脂质代谢失调或与脂质代谢失调相关的疾病或病症,比如阿尔茨海默病或动脉粥样硬化。在某些其他实施方案中,将有效量的激动剂抗trem2抗体施用于哺乳动物以治疗炎症或与炎症相关的疾病或病症。如本文所用,术语“trem2蛋白”是指在髓样细胞上表达的触发受体2蛋白,其由基因trem2编码。如本文所用,“trem2蛋白”是指任何脊椎动物的天然(即,野生型)trem2蛋白,所述脊椎动物例如但不限于人、非人灵长类动物(例如,食蟹猴)、啮齿动物(例如,小鼠、大鼠)和其他哺乳动物。在一些实施方案中,trem2蛋白是人trem2蛋白,其具有在uniprotkb登录号q9nzc2中鉴定的序列。如本文所用,术语“trem2”还包括蛋白质变体和重组trem2或其片段。如本文所用,术语“抗trem2抗体”是指与trem2蛋白(例如,人trem2)特异性地结合的抗体。如本文所用,术语“激动剂抗trem2抗体”是指可以结合并激活trem2或增加trem2的至少一种生物活性的抗体。某些抗trem2抗体(例如,激动剂抗体)及其片段是本领域已知的。例如,抗trem2抗体包括但不限于mab17291(克隆编号237920,r&dsystems)和78.18(目录号mca4772;bio-rad)。针对trem2的抗体也已有描述,例如见于专利/公开号wo2016/023019、wo2017/062672、wo2017/058866、wo2018/195506、wo2019/118513和wo2019/028292。在某些实施方案中,激动剂抗trem2抗体或其片段是mab17291或78.18。在一个实施方案中,激动剂抗trem2抗体或其片段与trem2特异性地结合并增强其活性。在某些实施方案中,激动剂抗trem2抗体是全长抗体(例如,igg1或igg4抗体)。在某些实施方案中,激动剂抗trem2抗体的片段用于本文公开的方法中,并且仅包含抗原结合部分(例如,fab、f(ab')2或scfv片段)。在某些实施方案中,将激动剂抗trem2抗体或其片段加以修饰,以影响功能性,例如,消除残余的效应子功能(reddy等人,2000,j.lmmunol.164:1925-1933)。能消除效应子的突变包括“lala”突变(l234a/l235a突变,根据eu编号方案编号)。在某些实施方案中,激动剂抗trem2抗体是一种单克隆抗体或其片段。在某些实施方案中,激动剂抗trem2抗体是与trem2特异性地结合的分离的重组单克隆抗体或其片段。在某些实施方案中,激动剂抗trem2抗体或其片段是一种人抗体或其片段。在某些实施方案中,抗体是全人的。在某些实施方案中,抗体或抗原结合片段是双特异性的,其包括针对trem2的第一结合特异性和针对第二靶表位的第二结合特异性。第二靶表位可以是trem2上或不同蛋白质上的另一表位。如本文所用,术语“fc受体”是指具有针对抗体的fc区的结合特异性的在免疫细胞上发现的表面受体蛋白,所述免疫细胞包括b淋巴细胞、自然杀伤细胞、巨噬细胞、嗜碱性粒细胞、嗜中性粒细胞和肥大细胞。术语“fc受体”包括但不限于fcy受体(例如fcyri(cd64)、fcyriia(cd32)、fcyriib(cd32)、fcyriiia(cd16a)和fcyriiib(cd16b))、fca受体(例如fcari或cd89)和fcs受体(例如,fcsri和fcsrii(cd23))。如本文所用,术语“抗体”是指通过其可变区与抗原特异性地结合的具有免疫球蛋白折叠的蛋白质。该术语涵盖完整的多克隆抗体、完整的单克隆抗体、单链抗体、多特异性抗体(比如双特异性抗体)、单特异性抗体、单价抗体、嵌合抗体、人源化抗体和人抗体。如本文使用的术语“抗体”还包括保留结合特异性的抗体片段,包括但不限于fab、f(ab’)2、fv、scfv和二价scfv。抗体可包含被分类为κ或λ的轻链。抗体可包含被分类为γ、μ、α、δ或ε的重链,它们进而分别定义了免疫球蛋白类型igg、igm、iga、igd和ige。示例性免疫球蛋白(抗体)结构单元包括四聚体。每个四聚体由两对完全相同的多肽链组成,每一对具有一条“轻”(约25kd)链和一条“重”链(约50-70kd)。每条链的n末端定义了主要负责抗原识别的具有约100个至110个或更多个氨基酸的可变区。术语可变轻链(vl)和可变重链(vh)分别指这些轻链和重链。术语“可变区”或“可变结构域”是指抗体重链或轻链中的结构域,其衍生自种系可变(v)基因、多样性(d)基因或连接(j)基因(而不是衍生自恒定(cμ和cδ)基因区段),并赋予抗体与抗原结合的特异性。通常,抗体可变区包含四个保守的“框架”区,其间散布有三个高变的“互补决定区”。术语“互补决定区”或“cdr”是指每条链中的三个高变区,其使轻链和重链可变区所建立的四个框架区中断。cdr主要负责抗体与抗原表位的结合。从n末端开始依次编号,每条链的cdr通常被称为cdr1、cdr2和cdr3,并且通常还通过特定cdr所在的链加以标识。因而,vhcdr3或cdr-h3位于其中发现它的抗体重链可变区中,而vlcdr1或cdr-l1是来自其中发现它的抗体轻链可变区的cdr1。不同轻链或重链的“框架区”或“fr”在一个物种内相对保守。抗体的框架区,即组成性轻链和重链的组合框架区,用于将cdr定位和排列在三维空间中。框架序列可以从包括种系抗体基因序列的公共dna数据库或公开参考文献获得。例如,可以在人和小鼠序列的“vbase2”种系可变基因序列数据库中找到人重链和轻链可变区基因的种系dna序列。可以使用本领域熟知的各种定义来确定cdr和框架区的氨基酸序列,所述定义见于例如kabat、chothia、国际免疫遗传学(immunogenetics)数据库(imgt)、abm和观察到的抗原接触部(“contact”)。在一些实施方案中,根据contact定义来确定cdr。参见,maccallum等人,j.mol.biol.,262:732-745(1996)。在一些实施方案中,通过结合kabat、chothia和/或contactcdr的定义来确定cdr。术语“抗原结合部分”和“抗原结合片段”在本文中可互换使用,并且是指保留经由其可变区与抗原(例如,trem2蛋白)特异性地结合的能力的抗体的一个或多个片段。抗原结合片段的实例包括但不限于,fab片段(由vl、vh、cl和ch1结构域组成的单价片段)、f(ab’)2片段(包含通过铰链区的二硫桥连接的两个fab片段的二价片段)、单链fv(scfv)、二硫键连接的fv(dsfv)、互补决定区(cdr)、vl(轻链可变区)和vh(重链可变区)。术语“表位”是指抗体的cdr与之特异性地结合的抗原区或区域,并且可以包括少许氨基酸或少许氨基酸的部分,例如,5个或6个、或更多个,例如20个或更多个氨基酸,或这些氨基酸的部分。例如,在靶标是蛋白质的情况下,表位可以由连续氨基酸(例如,线性表位)或蛋白质不同部分的氨基酸组成,这些部分通过蛋白质折叠而接近(例如,不连续或构象表位)。在一些实施方案中,表位在一个氨基酸处(例如,在丝氨酸或苏氨酸残基处)被磷酸化。如本文所用,如关于抗trem2抗体所用的短语“识别表位”是指抗体cdr与在该表位处的抗原(即,trem2蛋白)或包含该表位的抗原的一部分相互作用或特异性地结合。如本文所用,术语“多特异性抗体”是指包含两个或更多个不同的抗原结合部分的抗体或抗体的片段或部分,其中每个抗原结合部分包含识别不同抗原的不同可变区,所述抗体的片段或部分经由其可变区与两种或更多种不同的抗原结合。如本文所用,术语“双特异性抗体”是指包含两个不同的抗原结合部分的抗体或抗体的片段或部分,其中每个抗原结合部分包含识别不同抗原的不同可变区,所述抗体的片段或部分经由其可变区与两种不同的抗原结合。“单克隆抗体”是指由单个细胞克隆或单个细胞系产生并且由其一级氨基酸序列完全相同的抗体分子组成或基本上由其组成的抗体。“多克隆抗体”是指从异质抗体群获得的抗体,其中所述群中的不同抗体与抗原的不同表位结合。“嵌合抗体”是指这样的抗体分子,其中恒定区或其一部分被改变、替换或交换,使得抗原结合位点(即,可变区、cdr或其部分)与具有不同或改变的类别、效应子功能和/或物种的恒定区连接,或者,其中可变区或其一部分被具有不同或改变的抗原特异性的可变区(例如,来自不同物种的cdr和框架区)改变、替换或交换。在一些实施方案中,嵌合抗体是单克隆抗体,其包含来自一个来源或物种(例如,小鼠)的可变区和源自第二来源或物种(例如,人)的恒定区。产生嵌合抗体的方法在本领域中有描述。“人源化抗体”是含有cdr之外的衍生自非人免疫球蛋白的最小序列的衍生自非人来源(例如,鼠)的嵌合抗体。一般而言,人源化抗体将包含至少一个(例如,两个)抗原结合可变结构域,其中cdr区基本上对应于非人免疫球蛋白的那些cdr区,而框架区基本上对应于人免疫球蛋白序列的那些框架区。在一些情况下,人免疫球蛋白的某些框架区残基可以被非人物种的相应残基替换,以便例如改善特异性、亲和力和/或血清半衰期。人源化抗体还可包含免疫球蛋白恒定区(fc)(一般是人免疫球蛋白序列的恒定区)的至少一部分。抗体人源化的方法是本领域已知的。“人抗体”或“全人抗体”是具有典型地衍生自人种系基因的人重链和轻链序列的抗体。在一些实施方案中,抗体是通过人细胞、通过利用人抗体库的非人动物(例如,经基因工程改造以表达人抗体序列的转基因小鼠)或通过噬菌体展示平台产生的。术语“特异性地结合”或“与……特异性地结合”等表示结合分子(例如,抗体或其抗原结合片段)能够结合靶标(例如,诸如trem2的抗原),而基本上不识别和结合样品(比如生物样品)中存在的其他无关分子。在一些情况下,特异性结合可通过约10-6、10-7或10-8m或更小的平衡解离常数来表征(越小的kd表示越紧密结合)。用于确定两个分子是否特异地结合抗原的方法是本领域熟知的,并且包括例如平衡透析、表面等离子体共振(例如,biacoretm),等等。而且,与trem2中的一个结构域和一种或多种另外的抗原结合的多特异性抗体或与trem2的两个不同区域结合的双特异性抗体仍然被认为是如本文所用的“特异性结合”的抗体。术语“高亲和力”抗体是指如通过表面等离子体共振(例如biacoretm或溶液亲和elisa)测量的与trem2具有至少10-7m、10-8m、10-9m、10-10m或10-11m的结合亲和力(以kd表示)的那些mab。激动剂抗trem2抗体或其片段可以与诸如配体或治疗部分(“免疫缀合物”)的部分缀合,所述部分例如第二激动剂抗trem2抗体或针对另一抗原的抗体。如本文中使用的“分离的抗体”意指基本上不含具有不同抗原特异性的其他抗体(ab)的抗体(例如,特异性地结合trem2的分离的抗体或其片段基本上不含特异性地结合除trem2以外的抗原的ab)。如本文所用,术语“表面等离子体共振”指通过例如使用biacoretm系统(pharmaciabiosensorab,uppsala,swedenandpiscataway,n.j.)来检测生物传感器基质内的蛋白质浓度改变从而允许分析实时生物分子相互作用的光学现象。如本文所用,术语“kd”意指特定抗体-抗原相互作用的平衡解离常数。当应用于多肽时,术语“实质相似性”或“基本上相似”表示两个肽序列在最佳比对时,例如通过使用默认空位权重的程序gap或bestfit,至少共享80%序列同一性、90%序列同一性或至少95%、98%或99%序列同一性。不完全相同的残基位置可因保守氨基酸取代而不同。“保守氨基酸取代”是这样的取代,其中氨基酸残基被具有侧链(r基团)的具有相似化学性质(例如,电荷或疏水性)的另一个氨基酸残基取代。一般而言,保守氨基酸取代基本上不改变蛋白质的功能特性。在两个或更多个氨基酸序列因保守取代而彼此不同的情况下,可以向上调整相似性的百分比或程度,以校正所述取代的保守性质。进行这种调整的手段是本领域技术人员熟知的。参见,例如pearson(1994)methodsmol.biol.24:sot-ssi,将其通过引用并入本文。具有化学性质相似的侧链的氨基酸基团的实例包括:1)脂肪族侧链:甘氨酸、丙氨酸、缬氨酸、亮氨酸和异亮氨酸;2)脂肪族羟基侧链:丝氨酸和苏氨酸;3)含酰胺的侧链:天冬酰胺和谷氨酰胺;4)芳香族侧链:苯丙氨酸、酪氨酸和色氨酸;5)碱性侧链:赖氨酸、精氨酸和组氨酸;6)酸性侧链:天冬氨酸和谷氨酸,以及7)含硫侧链:半胱氨酸和甲硫氨酸。保守氨基酸取代基团包括:缬氨酸-亮氨酸-异亮氨酸、苯丙氨酸-酪氨酸、赖氨酸-精氨酸、丙氨酸-缬氨酸、谷氨酸-天冬氨酸以及天冬酰胺-谷氨酰胺。可替代地,保守替换是在pam250对数似然矩阵中具有正值的任何变化,所述矩阵公开于gonnet等人,(1992)science256:144345,通过引用将其并入本文。“中度保守”替换是在pam250对数似然矩阵中具有非负值的任何变化。通常使用序列分析软件来测量多肽的序列相似性。蛋白质分析软件使用分配给各种取代、缺失和其他修饰(包括保守氨基酸取代)的相似性量度来匹配相似序列。例如,gcg软件包含有诸如gap和bestfit的程序,其可与默认参数一同使用,以确定密切相关多肽(诸如来自不同生物物种的同源多肽)之间或者野生型蛋白和其突变蛋白之间的序列同源性或序列同一性。参见,例如gcg版本6.1。还可使用具有默认或推荐参数的fasta(在gcg版本6.1中的程序)来比较多肽序列。fasta(例如,fasta2和fasta3)提供了在查询序列和搜索序列之间的最佳重叠区的比对和序列同一性百分比(pearson(2000),上文)在将本文公开的序列与包含来自不同生物的大量序列的数据库进行比较时,另一种算法是使用默认参数的计算机程序blast,尤其是blastp或tblastn。参见,例如altschul等人,(1990)j.mol.biol.215:403-410和(1997)nucleicacidsres.25:3389-3402,将其各自通过引用并入本文。可以如本文公开使用的抗体和抗原结合片段与trem2特异性地结合。激动剂抗trem2抗体可以高亲和力或以低亲和力与trem2结合。它们可单独使用或用作辅助治疗与本领域已知的其他治疗部分或方式(即,至少一种另外的治疗剂)一起使用,用于治疗脂质代谢失调和或炎症。如体外或体内测定法确定的,某些激动剂抗trem2抗体能够与trem2结合并且增强其活性。可以使用本领域技术人员已知的任何标准方法,包括结合测定法或活性测定法,来测量抗体与trem2结合并且增强其活性的能力。对trem2特异的抗体可以不含另外的标记物或部分,或者可以含有n末端或c末端标记物或部分。在一个实施方案中,标记物可以是放射性核素或荧光染料。在某些实施方案中,这样的标记抗体可用于诊断测定法中。抗人trem2抗体的制备在转基因小鼠中生成人抗体的方法是本领域已知的。可以如本文公开使用任何这样的已知方法来制备与trem2特异性地结合的人抗体。可以使用包括以下任何一种的免疫原来生成针对trem2的抗体或其片段。例如,初级免疫原可以是全长trem2(参见,uniprotkbq9nzc2)或trem2的重组形式或修饰的人trem2片段或修饰的食蟹猴trem2片段。在某些实施方案中,可以在初级免疫原之后用次级免疫原或用trem2的免疫原性活性片段进行免疫。可替代地,可以使用标准生化技术产生trem2或其片段,将其修饰并用作免疫原。免疫原可具有生物活性并且/或者是trem2的免疫原性片段或编码其活性片段的dna。在某些实施方案中,免疫原可以是来自trem2的n末端或c末端的肽。在一个实施方案中,免疫原是trem2的特定结构域。在一些实施方案中,免疫原可以是在大肠杆菌或在任何其他真核或哺乳动物细胞比如中国仓鼠卵巢(cho)细胞中表达的重组trem2肽。可以将肽修饰为包括某些残基的添加或取代,以便给载体分子(比如klh)加标签或为了与之缀合。例如,可以在肽的n末端或c末端添加半胱氨酸,或可以添加接头序列来制备肽,以便与例如klh缀合而用于免疫。包含fc变体的激动剂抗trem2抗体激动剂抗trem2抗体可包含包括一个或多个突变的fc结构域,所述突变例如在酸性ph下相比于中性ph增强或减弱抗体与fcrn受体的结合。例如,激动剂抗trem2抗体可包含在fc结构域的ch2或ch3区中的突变,其中所述突变在酸性环境中(例如,在ph范围从约5.5至约6.0的内体中)增加了fc结构域与fcrn的亲和力。当施用于动物时,这样的突变可导致抗体的血清半衰期延长。激动剂抗trem2抗体或其片段的生物学特征一般而言,本文公开的有用抗体通过与trem2结合而起作用,并且包括激动剂抗trem2抗体及其例如以高亲和力结合trem2分子的抗原结合片段。例如,如通过表面等离子体共振测量的,可以如本文公开使用以小于约50nm的kd结合(例如,在25℃或在37℃)trem2的抗体和抗体的抗原结合片段。在某些实施方案中,如通过表面等离子体共振或基本上相似的测定法测量的,所述抗体或其抗原结合片段以小于约40nm、小于约30nm、小于约20nm、小于约10nm、小于约5nm、小于约2nm或小于约1nm的kd结合trem2。如通过表面等离子体共振测量的,本文公开的抗体或其抗原结合片段还可以小于约35nm的kd结合(在25℃或在37℃)食蟹猴(食蟹猕猴)trem2。在某些实施方案中,如通过表面等离子体共振或基本上相似的测定法测量的,所述抗体或其抗原结合片段以小于约30nm、小于约20nm、小于约15nm、小于约10nm或小于约5nm的kd结合食蟹猴trem2。本文所述的方法和用途还包括以大于约1.1分钟的解离半衰期(t1/2)(如通过在25℃或37℃的表面等离子体共振或基本上相似的测定法测量的)结合trem2的抗体及其抗原结合片段的用途。在某些实施方案中,如通过在25℃或37℃的表面等离子体共振(例如,mab-捕获或抗原-捕获形式)或基本上相似的测定法测量的,抗体或抗原结合片段以大于约5分钟、大于约10分钟、大于约30分钟、大于约50分钟、大于约60分钟、大于约70分钟、大于约80分钟、大于约90分钟、大于约100分钟、大于约200分钟、大于约300分钟、大于约400分钟、大于约500分钟、大于约600分钟、大于约700分钟、大于约800分钟、大于约900分钟、大于约1000分钟或大于约1200分钟的t1/2结合trem2。在一些实施方案中,抗体可与trem2的特定结构域或所述结构域的片段结合。在一些实施方案中,如本文公开使用的抗体可以结合多于一个结构域(交叉反应性抗体)。在某些实施方案中,如本文公开使用的抗体可以是双特异性抗体。双特异性抗体可结合在一个结构域中的一个表位,也可结合在trem2的不同结构域中的第二表位。在某些实施方案中,双特异性抗体可结合同一结构域中的两个不同的表位。在一个实施方案中,提供了与trem2结合的分离的全人单克隆抗体或其抗原结合片段的用途。物种选择性和物种交叉反应性根据某些实施方案,激动剂抗trem2抗体可与人trem2结合,但不与来自其他物种的trem2结合。可替代地,激动剂抗trem2抗体可与人trem2和来自一个或多个非人物种的trem2结合。例如,激动剂抗trem2抗体可与人trem2结合,并且视情况而定,可与小鼠、大鼠、豚鼠、仓鼠、沙鼠、猪、猫、狗、兔、山羊、绵羊、牛、马、骆驼、食蟹猴、狨猴、恒河猴或黑猩猩trem2中的一者或多者结合或不结合。在某些实施方案中,激动剂抗trem2抗体可以相同的亲和力或以不同的亲和力与人和食蟹猴trem2结合,但不与大鼠和小鼠trem2结合。另外的治疗剂在某些实施方案中,本文所述的方法进一步包括施用一种或多种另外的治疗剂(例如,第二治疗剂)。可与激动剂抗trem2抗体同时或依次施用一种或多种另外的治疗剂。在某些实施方案中,可与激动剂抗trem2抗体同时施用一种或多种另外的治疗剂。在某些实施方案中,施用包含激动剂抗trem2抗体的药物组合物和一种或多种另外的治疗剂。在某些实施方案中,依次施用激动剂抗trem2抗体和一种或多种另外的治疗剂。在某些实施方案中,在施用一种或多种另外的治疗剂之前施用激动剂抗trem2抗体。在某些实施方案中,在施用激动剂抗trem2抗体之前施用一种或多种另外的治疗剂。在某些实施方案中,另外的治疗剂是可用于治疗阿尔茨海默病或动脉粥样硬化的药剂。在某些实施方案中,另外的治疗剂是可用于治疗炎症的药剂。在某些实施方案中,另外的治疗剂是lxr激动剂。如本文所述,可以向哺乳动物施用有效量的lxr激动剂,以治疗脂质代谢失调或与这样的失调相关的疾病或病症。lxr是配体依赖性核受体转录因子超家族的一部分。胆固醇的氧化衍生物(氧化胆固醇)是lxr的天然配体,并且兼有激动和拮抗lxr激活的能力。lxrα(由nr1h3编码)在肝脏、巨噬细胞和其他高代谢组织中高表达,而lxrβ(nr1h2)被普遍表达。配体激活后,lxr与rxr形成异二聚体,并在脂质代谢和炎症信号传导的调节中发挥作用。术语“lxr激动剂”是指能够激活、增强、增加或以别的方式刺激靶标lxr的一种或多种功能的药剂。lxr激动剂可直接或间接诱导任何lxr活性,例如lxr介导的信号传导。如本文所用的lxr激动剂可与lxr结合,但不必需结合,并且可以与或可以不与lxr直接相互作用。lxr激动剂可以特异性地激动lxrα、lxrβ或这两者。除了激动lxr外,lxr激动剂可影响其他受体/途径。lxr激动剂包括天然氧化胆固醇、合成氧化胆固醇、合成非氧化胆固醇和天然非氧化胆固醇。示例性天然氧化胆固醇包括20(s)羟基胆固醇、22(r)羟基胆固醇、24(s)羟基胆固醇、25-羟基胆固醇、24(s),25-环氧胆固醇和27-羟基胆固醇。示例性合成氧化胆固醇包括n,n-二甲基-3β-羟基胆酰胺(dmhca)。示例性合成非氧化胆固醇包括n-(2,2,2-三氟乙基)-n-{4-[2,2,2-三氟-1-羟基-1-(三氟甲基)乙基]苯基}苯磺酰胺(to901317;tularik0901317)、[3-(3-(2-氯-三氟甲基苄基-2,2-二苯基乙基氨基)丙氧基)苯乙酸](gw3965)、n-甲基-n-[4-(2,2,2-三氟-1-羟基-1-三氟甲基-1-乙基)-苯基-1]-苯磺酰胺(to314407)、4,5-二氢-1-(3-(3-三氟甲基-7-丙基-苯并异噁唑-6-基氧基)丙基)-2,6-嘧啶二酮、3-氯-4-(3-(7-丙基-3-三氟甲基-6-(4,5)-异噁唑基)丙基硫基)-苯乙酸(f.sub.3-甲基aa)和乙酰基-罗汉松酸二聚体。示例性天然非氧化胆固醇包括桩蛋白(paxilline)、链甾醇和豆甾醇。其他有用的lxr激动剂公开于,例如,公开的美国专利申请第2006/0030612、2005/0131014、2005/0036992、2005/0080111、2003/0181420、2003/0086923、2003/0207898、2004/0110947、2004/0087632、2005/0009837、2004/0048920和2005/0123580号;美国专利第6,316,503、6,828,446、6,822,120和6,900,244号;wo2008036239;wo2001/41704;menkejg等人,endocrinology143:2548-58(2002);josephsb等人,proc.natl.acad.sci.usa99:7604-09(2002);fux等人,j.biol.chem.276:38378-87(2001);schultzjr等人,genesdev.14:2831-38(2000);sparrowcp等人,j.biol.chem.277:10021-27(2002);yangc等人,j.biol.chem.,manuscriptm603781200(jul.20,2006);bramlettks等人,j.pharmacol.exp.ther.307:291-96(2003);ondeykajg等人,j.antibiot(tokyo)58:559-65(2005)。在某些实施方案中,lxr激动剂是次胆酰胺(hypocholamide)、t0901317、gw3965、imb-808或n,n-二甲基-3β-羟基胆酰胺(dmhca)。在某些实施方案中,lxr激动剂是gw3965。在某些其他实施方案中,另外的治疗剂是rxr激动剂。如本文所述,还可以向哺乳动物施用有效量的rxr激动剂,以治疗脂质代谢失调或与这样的失调相关的疾病或病症。rxr是一种被9-顺式视黄酸和9-顺式13,14-二氢-视黄酸激活的核受体。有三种rxr形式:rxr-α、rxr-β和rxr-γ,其分别由rxra、rxrb和rxrg基因编码。rxr与亚家族1核受体异二聚体化,所述核受体包括car、fxr、lxr、ppar、pxr、rar、tr和vdr。与其他ii型核受体一样,在不存在配体的情况下,rxr异二聚体结合到与共抑制(corepressor)蛋白复合的激素反应元件上。激动剂配体与rxr结合导致共抑制因子的解离和共激活蛋白的募集,进而促进下游靶基因转录为mrna,最终产生蛋白质。术语“rxr激动剂”是指能够激活、增强、增加或以别的方式刺激靶标rxr的一种或多种功能(例如,增加rxr同二聚体和异二聚体的转录调控活性)的药剂。rxr激动剂可直接或间接诱导任何rxr活性,例如rxr介导的信号传导。如本文所用的rxr激动剂可与rxr结合,但不必需结合,并且可以与或可以不与rxr直接相互作用。rxr激动剂能够特异性地激动rxrα、rxrβ或rxrγ或它们的组合。除了激动rxr外,rxr激动剂可影响其他受体/途径。某些rxr激动剂以及合成这样的激动剂的方法是已知的。例如,rxr激动剂包括但不限于描述于下列文献的那些:boehm等人,j.med.chem.38:3146(1994),boehm等人,j.med.chem.37:2930(1994),antras等人,j.biol.chem.266:1157-61(1991),salazar-olivo等人,biochem.biophys.res.commun.204:10257-263(1994),safanova,mol.cell.endocrin.104:201(1994),m.l.dawson和w.h.okamura,chemistryandbiologyofsyntheticretinoids,第3、8、14和16章,crcpress,inc.,florida(1990);m.l.dawson和p.d.hobbs,theretinoids,biology,chemistryandmedicine,m.b.sporn等人编辑(第2版),ravenpress,newyork,n.y.,第5-178页(1994);liu等人,tetrahedron,40:1931(1984);cancerres.,43:5268(1983);eur.j.med.chem.15:9(1980);allegretto等人,j.bio.chem.,270:23906(1995);bissonette等人,mol.cell.bio.,15:5576(1995);beard等人,j.med.chem.,38:2820(1995),koch等人,j.med.chem.,39:3229(1996);u.s.4,326,055;u.s.4,578,498;u.s.5,399,586;u.s.5,466,861;u.s.5,721,103;u.s.5,780,676;u.s.5,801,253;u.s.5,830,959;u.s.6,083,977;u.s.6,131,050;u.s.20160324874;us20180185342;us20180263939;us20180318241;wo93/11755;wo93/21146;wo94/15902;w094/23068;wo95/04036;wo96/20913;wo20100105728;wo2013056232;和wo2013090616。在某些实施方案中,rxr激动剂是cd3254、二十二碳六烯酸、氟贝沙罗汀(fluorobexarotene)、贝沙罗汀(lgd1069)、irx4204、hx630、pa024、异维a酸、视黄酸、sr11237、lg101506、lgd100268或lgd100324。在某些实施方案中,rxr激动剂是贝沙罗汀。在某些其他实施方案中,另外的治疗剂是acat1抑制剂。如本文所述,还可以向哺乳动物施用有效量的acat1抑制剂,以治疗脂质代谢失调或与这样的失调相关的疾病或病症。acat1基因编码线粒体乙酰辅酶a乙酰转移酶,一种短链长特异性硫解酶(uniprotkbp24752)。如本文所用,“acat1抑制剂”包括能够直接或间接抑制acat1的表达和/或功能的任何化合物或治疗(例如,抑制转录、rna成熟、rna翻译、翻译后修饰或酶活性)。如本文所用的acat1抑制剂可与acat1结合,但不必需结合,并且可以与或可以不与所述酶直接相互作用。在某些实施方案中,所述抑制剂可检测地抑制acat1的表达水平或生物活性,正如使用本文所述或本领域已知的测定法测量的。在某些实施方案中,所述抑制剂抑制acat1的表达水平或生物活性的至少约5%、至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%或至少约90%。抑制剂可以是天然或合成来源的。例如,它可以是核酸、多肽、蛋白质、肽或有机化合物。在一个实施方案中,抑制剂是sirna、shrna、小分子或抗体。在某些实施方案中,抑制剂是能够抑制acat1的转录或相应信使rna的翻译的反义核酸(例如,sirna或shrna)。本领域技术人员能够使用可商购的软件和acat1的基因序列来设计反义核酸。在某些实施方案中,抑制剂是多肽,例如针对acat1的抗体或其片段或衍生物,比如fab片段、cdr区或单链抗体。术语“小分子”包括分子量小于约1000amu的有机分子。在一实施方案中,小分子可具有小于约800amu的分子量。在另一个实施方案中,小分子可具有小于约500amu的分子量。某些acat1抑制剂是本领域已知的。例如,在某些实施方案中,acat1抑制剂是如us2004/0038987、us20140044757、us20170292128或wo2015/038585中描述的acat1抑制剂。在某些实施方案中,acat1抑制剂选自由以下组成的组:阿伐麦布(ci-1011)、帕替麦布、产紫青霉菌素(purpactin)、三白脂素a(manassantina)、二苯基哒嗪衍生物、粉红粘帚霉素a(glisoprenina)、cp113,818、k604、白僵菌交酯i、白僵菌交酯iii、u18666a、tmp-153、ym750、geri-bp002-a、sandozsah58-035、vulm1457、洛伐他汀、ci976、cl-283、546、ci-999、e5324、ym17e、fr182980、atr-101(pd132301或pd132301-2)、f-1394、hl-004、f-12511(依鲁麦布)、肉桂酸衍生物、肉桂衍生物、dup128、rp-73163、吡啶并吡咯烯c、fo-1289、as-183、spc-15549、fo-6979、angekica、人参、紫花前胡素、吲哚二萜生物碱c(terpendolec)、白僵菌素、spylidone、pentacecilides、cl-283、546、白桦脂酸、紫草素衍生物、番茄皂苷a苷元(esculeogenina)、wu-v-23、吡啶并吡咯烯衍生物a、b和d、粉红粘帚霉素(glisoprenin)b-d、三白草醇b、吲哚倍半萜(sespendole)、焦碳酸二乙酯、白僵菌内酯(beauveriolide)类似物、acaterin、dl-美利胺、pd138142-15、cl277、082、eab-309、恩镰孢菌素(enniatin)抗生素、表-旋孢腔菌醌a(epi-cochlioquinonea)、fce-27677、fr186485、fr190809、nte-122、厚朴新酚、人参二醇、原人参二醇、聚乙炔、sah57-118、as-186、bw-447a、447c88、t-2591、tei-6522、tei-6620、xp767、xr920、geri-bp001、戈米辛n(gomisinn)、gypsetin、长蠕孢醇、ts-962、a922500(cas959122-11-3)、n-[3-(4-羟基苯基)-1-氧-2-丙烯基]-l-苯丙氨酸甲酯(cas615264-52-3)、3,4-二羟基氢化肉桂酸(l-天冬氨酸二苄酯)酰胺(cas615264-62-5)、ci-976、fr14523(藤泽制药株式会社,fujisawapharmaceuticalco.ltd.)、f1394(富士瑞必欧株式会社,fujirebioinc.)、异色酚酮(isochromophilone)、苦丁茶皂苷(kudingoside)、lateritin、柚皮素及其组合。在某些实施方案中,acat1抑制剂是cp-113,818、ci-1011或k-604。在某些实施方案中,acat1抑制剂是k-604。在某些实施方案中,另外的治疗剂是在此描述的药剂。给药可将治疗剂(例如,激动剂抗trem2抗体或另外的治疗剂)配制成药物组合物,并且以适合于所选给药途径(即,口服或肠胃外,通过静脉内、肌内、局部或皮下途径)的多种形式施用于哺乳动物宿主(比如人患者)。因而,治疗剂可与药学上可接受的媒介物(比如惰性稀释剂或可同化的食用载体)组合全身施用,例如口服施用(例如,添加到饮用水中)。它们可封装在硬壳或软壳明胶胶囊中,可压制成片剂,或可直接与患者饮食中的食物掺混。对于口服治疗性给药,治疗剂可与一种或多种赋形剂组合,并且以可吸收片剂、含片、糖锭剂、胶囊、酏剂、混悬液、糖浆、糯米纸囊剂(wafer)等形式使用。这样的组合物和制剂通常含有至少0.1%的药剂。组合物和制剂的百分比当然可以变化,并且可以合宜地在给定单位剂型的重量的约2%到约60%之间。在这样的治疗有用的组合物中药剂的量是使得将获得有效剂量水平的量。片剂、糖锭剂、丸剂、胶囊等还可含有以下物质:可以加入粘合剂,比如黄蓍胶、阿拉伯胶、玉米淀粉或明胶;赋形剂,比如磷酸二钙;崩解剂,比如玉米淀粉、马铃薯淀粉、海藻酸等;润滑剂,比如硬脂酸镁;和甜味剂,比如蔗糖、果糖、乳糖或阿斯巴甜,或调味剂,比如薄荷、冬青油或樱桃调味剂。当单位剂型是胶囊时,除以上类型的物质之外,它还可以含有液体载体,比如植物油或聚乙二醇。各种其他物质可作为包衣存在,或以别的方式改变固体单位剂型的物理形式。例如,片剂、丸剂或胶囊可以用明胶、蜡、虫胶或糖等包衣。糖浆或酏剂可以含有治疗剂、蔗糖或果糖(作为甜味剂)、对羟基苯甲酸甲酯和对羟基苯甲酸丙酯(作为防腐剂)、染料和调味剂(比如,樱桃或橘子调味剂)。当然,用于制备任何单位剂型的任何物质应该是药学上可接受的,并且在所采用的量下基本上无毒。另外,可将治疗剂掺入缓释制剂和装置中。治疗剂还可以通过输注或注射经静脉内或腹膜内施用。可在水中制备治疗剂或其盐的溶液,任选地与无毒的表面活性剂混合。也可以在甘油、液体聚乙二醇、三醋精及其混合物中以及在油中制备分散液。在普通的储存和使用条件下,这些制剂含有防止微生物生长的防腐剂。适合用于注射或输注的药物剂型可包括包含活性成分的无菌水溶液或分散液或无菌粉末,所述无菌粉末适于临时制备无菌可注射或可输注的任选地包封在脂质体中的溶液或分散液。在所有情况下,在制造和储存条件下,最终剂型是无菌、流动且稳定的。液体载体或媒介物可以是溶剂或液体分散介质,其包括例如水、乙醇、多元醇(例如甘油、丙二醇、液体聚乙二醇等)、植物油或无毒甘油酯及其适合的混合物。例如,通过形成脂质体,通过维持在分散体情况下所需的粒径或者通过使用表面活性剂,可以维持适当的流动性。通过各种抗细菌剂和抗真菌剂例如对羟基苯甲酸、三氯叔丁醇、苯酚、抗坏血酸、硫柳汞等,可以带来微生物作用的防止。在许多情况下,可包括等渗剂,例如糖、缓冲剂或氯化钠。可以通过在组合物中使用吸收延迟剂(例如单硬脂酸铝和明胶)来实现可注射组合物的延长吸收。通过将治疗剂以需要的量在必要时与以上列举的各种其他成分一起掺入适当的溶剂中,随后进行过滤灭菌,从而制备无菌注射溶液。可以通过真空干燥和冷冻干燥技术制备用于准备无菌注射液的无菌粉末,产生具有具有活性成分加上在预先无菌过滤的溶液中存在的任何其他期望的成分的粉末。对于局部给药,可以纯的形式应用治疗剂,即,当它们是液体时。然而,通常期望将它们与皮肤病学上可接受的载体(其可以是固体或液体)组合以组合物或制剂的形式施用于皮肤。有用的固体载剂包括精细分散的固体,比如滑石、粘土、微晶纤维素、二氧化硅、氧化铝等。有用的液体载体包括水、醇或二醇或水-醇/二醇共混物,其中治疗剂可任选地借助于无毒表面活性剂以有效水平溶解或分散。可以加入佐剂(比如芳香剂和另外的抗微生物剂),以优化用于给定用途的性质。所得的液体组合物可以通过吸收垫加以施用,其可用于浸渍绷带和其他敷料,或将其使用泵式或气溶胶喷雾器喷到患处。也可以与液体载体一起使用增稠剂(比如合成聚合物、脂肪酸、脂肪酸盐和酯、脂肪醇、改性纤维素或改性矿物材料),以形成可涂抹的糊剂、凝胶、软膏、肥皂等,用于直接向使用者的皮肤施用。可以用于将治疗剂递送到皮肤的有用的皮肤病学组合物的实例是本领域已知的;例如,参见jacquet等人(美国专利第4,608,392号)、geria(美国专利第4,992,478号)、smith等人(美国专利第4,559,157号)和wortzman(美国专利第4,820,508号)。治疗剂的有用剂量可以通过在动物模型中比较它们的体外活性和体内活性来确定。用于将小鼠和其他动物中的有效剂量外推至人的方法是本领域已知的;例如,参见美国专利第4,938,949号。用于治疗所需的治疗剂或其活性盐或衍生物的量不仅会因所选择的特定盐,而且还会因给药途径、被治疗病症的性质以及患者的年龄和状况而不同,并且最终将由主治医师或临床医师判定。可以合宜地将治疗剂配制成单位剂型。在一个实施方案中,可以使用包含配制在这种单位剂型中的治疗剂的组合物。期望的剂量合宜地以单剂量存在,或为以适当间隔施用的分开剂量,例如每天两个、三个、四个或更多个亚剂量。亚剂量自身可进一步例如被分成多次离散的松散间隔给药;比如从吹入器进行多次吸入或向眼中施用多个液滴。在某些实施方案中,将激动剂抗trem2抗体施用于哺乳动物。在某些实施方案中,进一步向哺乳动物施用另外的治疗剂(例如,rxr激动剂、lxr激动剂、acat1抑制剂或其他可用于治疗脂质失调/炎症的药剂)。当将两种或更多种这些药剂联合施用时,它们可以同时或依次施用。在某些实施方案中,两种或更多种药剂是依次施用的。在某些实施方案中,两种或更多种药剂是同时施用的。在某些实施方案中,施用包含联合的两种或更多种药剂的药物组合物。例如,在一个实施方案中,提供了用于治疗脂质代谢失调和/或炎症的包含激动剂抗trem2抗体、至少一种其他治疗剂和药学上可接受的稀释剂或载体的组合物。某些实施方案还提供了一种包括激动剂抗trem2抗体、包装材料和说明书的试剂盒,所述说明书用于将激动剂抗trem2抗体施用于动物以治疗脂质代谢失调和/或炎症。在某些实施方案中,试剂盒进一步包括至少一种其他治疗剂。分离富集的cns细胞群的方法本文提供了从脑组织中分离cns细胞类型的富集群体的方法(例如,星形胶质细胞或小胶质细胞的富集群体)。因而,某些实施方案提供了从组织样品中分选cns细胞群的方法,所述方法包括:(a)使组织样品与抗cd45一级抗体、抗cd11b一级抗体和抗星形胶质细胞表面抗原2(acsa-2)一级抗体接触,其中每种一级抗体被独特标记,以提供标记的组织样品;和(b)通过流式细胞术分选标记的组织样品中的细胞,其中所述方法提供了星形胶质细胞和小胶质细胞的不同细胞群。如本文所用,术语“不同的细胞群”是指在物理上分开的细胞群,其富含特定的cns细胞类型(例如,神经元或星形细胞)。某些实施方案还提供了包含使用本文所述方法分离的分选的不同细胞群(例如,分选的小胶质细胞群或分选的星形胶质细胞群)的组合物。在某些实施方案中,基于以下标志物谱对小胶质细胞群进行分选:cd45低/cd11b+/acsa-2-。在某些实施方案中,基于以下标志物谱对星形胶质细胞群进行分选:cd45-/cd11b-/acsa-2+。某些实施方案提供了包含两个在物理上分开的细胞群的cns细胞的集合,其中第一细胞群包括cd45低/cd11b+/acsa-2-细胞的富集群体并且第二细胞群包括cd45-/cd11b-/acsa-2+细胞的富集群体。如本文所述,可使用抗cd45一级抗体和抗cd11b抗体的组合从其他cns细胞类型中分离小胶质细胞的富集群体。cd45,也称为白细胞共同抗原(lca)和蛋白酪氨酸磷酸酶c型受体(ptprc),是一种以不同水平由除了红细胞和血小板之外的大多数造血细胞表达的细胞表面抗原。cd45在小胶质细胞中以低水平表达,其不被星形胶质细胞表达,并且在某些非小胶质、非星形细胞(比如巨噬细胞)中以高水平表达。因此,可使用抗cd45一级抗体来标记表达cd45细胞表面标志物的细胞(cd45+),并且可使用流式细胞术来分离以低水平表达cd45的标记细胞(例如,cd45低小胶质细胞)。基于截止参考值,可以鉴定cd45低细胞并且将其从cd45高细胞分离。例如,参考值可以是在对照细胞或对照细胞群(比如已知的小胶质细胞)中或在已知的cd45高细胞中的cd45表达量。在一些实施方案中,例如,当参考值是从多个样品获得时,参考值是值的范围。此外,参考值可以呈现为单个值(例如,测量的丰度值、平均值或中值)或具有或不具有标准偏差或标准误差的值的范围。cd11b是整合素家族成员,其与cd18配对而形成cr3异二聚体。cd11b在多种细胞类型(包括巨噬细胞和小胶质细胞)上表达,但星形胶质细胞不表达。因此,可使用抗cd11b一级抗体来标记表达cd11b细胞表面标志物的细胞,并且可使用流式细胞术来分离标记的细胞(例如,cd11b+小胶质细胞)。抗acsa-2抗体识别由星形胶质细胞表达的糖基化表面分子。相反,cns中的非星形细胞比如神经元、少突神经胶质细胞、ng2+细胞、小胶质细胞、内皮细胞、白细胞或红细胞不表达该表面分子(kantzer等人,2017,glia,65:990-1004)。因此,可使用抗acsa-2一级抗体来标记表达acsa-2细胞表面标志物的细胞,并且可使用流式细胞术来分离标记的细胞(例如,acsa-2+星形细胞)。在某些实施方案中,使一级抗体包含在组合物中,并且使组织样品与组合物(例如,包含抗acsa-2抗体、抗cd11b抗体和抗cd45抗体的组合物)接触。在某些实施方案中,将每种一级抗体用适合于通过流式细胞术分选的标记物(例如,荧光标记物)进行独特标记(即,组合物中的每种抗体包含不同的标记物)。在某些实施方案中,组合物进一步包含活力染料,其可用于通过流式细胞术来区分活细胞和非活细胞(例如,可固定活力染料bv510)。在某些其他实施方案中,活力染料未包含在组合物中,并且使组织样品与活力染料接触,同时或依次与组合物接触。在某些实施方案中,存在于组织样品中的细胞在与活力染料和/或组合物接触之前被解离。在某些实施方案中,使组织样品在适合于抗体与它的相应标志物结合以及标记细胞的条件下与组合物接触。在某些实施方案中,在通过流式细胞术分选之前,标记的组织样品包含标记的acsa-2+细胞、标记的cd45+细胞和标记的cd11b+细胞。在某些实施方案中,将细胞进一步用存活力染料标记。在某些实施方案中,通过流式细胞术将存在于组织样品中的细胞分选为非活细胞群和活细胞群(例如,用活力染料)。在某些实施方案中,通过流式细胞术将存在于组织样品中的细胞分选为cd45+细胞群和cd45-细胞群。在某些实施方案中,通过流式细胞术将cd45+细胞群分选为cd45低细胞群和cd45高细胞群。在某些实施方案中,通过流式细胞术将存在于组织样品中的细胞分选为cd11b+细胞群和cd11b-细胞群。在某些实施方案中,通过流式细胞术将存在于组织样品中的细胞分选为acsa-2+细胞群和acsa-2-细胞群。可以通过使用任何门控组合的流式细胞术分选标记的细胞,产生分离的cd45低/cd11b+/acsa-2-小胶质细胞群和分离的cd45-/cd11b-/acsa-2+星形细胞群。例如,在某些实施方案中,通过流式细胞术将存在于组织样品中的细胞分选为非活细胞群和活细胞群(例如,用活力染料)。在某些实施方案中,通过流式细胞术将活细胞群分选为cd11b+细胞群和cd11b-细胞群。在某些实施方案中,将cd11b+细胞群进一步分选为cd45+细胞群和cd45-细胞群。在某些实施方案中,通过流式细胞术将cd11b+/cd45+细胞群分选为cd11b+/cd45低细胞群和cd11b+/cd45高细胞群。在某些实施方案中,通过流式细胞术将cd11b-细胞群分选为acsa-2+细胞群和acsa-2-细胞群。这样的分选产生cd45低/cd11b+/acsa-2-小胶质细胞群和cd45-/cd11b-/acsa-2+星形细胞群。在某些实施方案中,富集的星形细胞的分选群体(例如,活的、cd45-、cd11b-、acsa-2+细胞)包括至少约25%、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或更少的非星形细胞。在某些实施方案中,富集的星形细胞的分选群体不包含非星形细胞。在某些实施方案中,富集的小胶质细胞的分选群体(例如,活的、cd45低、cd11b+、acsa-2-细胞)包括至少约25%、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或更少的非小胶质细胞。在某些实施方案中,富集的小胶质细胞的分选群体不包含非小胶质细胞。在某些实施方案中,分析了一个或多个富集的细胞群的代谢种类(例如,脂质种类)或核酸种类的定量。在某些实施方案中,分析了富集的星形细胞群的代谢种类或核酸种类的定量。在某些实施方案中,分析了富集的小胶质细胞群的代谢种类或核酸种类的定量。在某些实施方案中,分析了富集的星形细胞和小胶质细胞群的代谢种类或核酸种类的定量。在某些实施方案中,分析了一个或多个富集的细胞群的代谢种类的定量。在某些实施方案中,分析了一个或多个富集的细胞群的多于一个(例如,2个、3个、4个、5个、10个、25个、50个或更多个)代谢种类的定量。在某些实施方案中,分析了一个或多个富集的细胞群的核酸种类的定量。在某些实施方案中,分析了一个或多个富集的细胞群的多于一个(例如,2个、3个、4个、5个、10个、25个、50个或更多个)核酸种类的定量。在某些实施方案中,分析了一个或多个富集的细胞群的代谢种类和核酸种类的定量。在某些实施方案中,分析了一个或多个富集的细胞群的多于一个代谢种类和多于一个核酸种类的定量。如本文所用,术语代谢种类包括大分子,比如脂质种类。例如,在某些实施方案中,代谢种类是脂质种类,比如本文所述的脂质种类(例如胆固醇酯种类)。在某些实施方案中,将代谢种类的组合(比如本文所述的脂质的组合)定量。可以使用本领域已知的方法将代谢种类定量。例如,可以使用液相色谱质谱(lcms)测定法将代谢种类定量(参见例如,实施例)。核酸,可以是例如,rna或dna,比如基因组dna、从基因组dna转录的rna或从rna生成的cdna。在某些实施方案中,核酸种类是rna。在某些实施方案中,核酸种类是dna。在某些实施方案中,核酸种类是基因组dna。核酸种类的定量方法是本领域中已知的。例如,这样的方法包括但不限于聚合酶链反应(pcr),包括定量pcr(qpcr)和实时定量反转录pcr(qrt-pcr);rnaseq;northern印迹分析,表达微阵列分析;下一代测序(ngs);和荧光原位杂交(fish)。在某些实施方案中,使用本文所述的测定法将核酸种类定量。在某些实施方案中,分析了一个或多个富集的细胞群的施用治疗剂的定量。在某些实施方案中,分析了富集的星形细胞群的施用治疗剂的定量。在某些实施方案中,分析了富集的小胶质细胞群的施用治疗剂的定量。在某些实施方案中,分析了富集的星形细胞和小胶质细胞群的施用治疗剂的定量。将治疗剂定量的方法是本领域中已知的,并在本文中进行了描述。某些技术如本文所用,短语“生理样品”意指获自受试者的生物样品,其含有蛋白质、脂质和/或核酸。因而,可以在核酸、脂质或蛋白质水平上评价样品。在某些实施方案中,生理样品包括组织、脑脊液(csf)、尿液、血液、血清或血浆。在某些实施方案中,样品包括组织(例如,包括小胶质细胞)。在某些实施方案中,样品包括csf。在某些实施方案中,样品包括血液/血浆。可以使用本领域技术人员已知的方法获得生物样品。可以从脊椎动物特别是哺乳动物获得生物样品。可以检测样品的dna、rna或蛋白质的变异(例如,突变、表达或定位)。核酸,可以是例如,基因组dna、从基因组dna转录的rna或从rna生成的cdna。核酸或蛋白质可以源自脊椎动物,例如哺乳动物。核酸或蛋白质被说成是“源自”特定来源,条件是它直接获自该来源,或条件是它是在该来源中发现的核酸的副本。在某些实施方案中,可以从生物样品中分离基因组dna,并在检测测定法中进行分析。在某些实施方案中,从生物样品中分离mrna,并在检测测定法中进行分析。在某些实施方案中,可以将从生物样品中分离的mrna反转录而产生cdna。可以通过本领域技术人员已知的某些方法检测核酸和氨基酸序列的变异。类似地,可以使用本领域已知的方法检测核酸表达(例如,mrna表达)。这样的方法包括,但不限于,聚合酶链反应(pcr),包括定量pcr(qpcr)和实时定量反转录pcr(qrt-pcr);northern印迹分析,表达微阵列分析;下一代测序(ngs);荧光原位杂交(fish);dna测序;引物延伸测定法,包括等位基因特异性核苷酸掺入测定法和等位基因特异性引物延伸测定法(例如,等位基因特异性pcr、等位基因特异性连接链反应(lcr)和缺口-lcr);等位基因特异性寡核苷酸杂交测定法(例如,寡核苷酸连接测定法);裂解保护测定法,其中利用免受裂解剂影响的保护作用来检测核酸双链体中的错配碱基;muts蛋白结合的分析;电泳分析,其比较变体和野生型核酸分子的迁移率;变性梯度凝胶电泳(dgge,如见于,例如myers等人(1985)nature313:495);错配碱基对的rna酶裂解的分析;异源双链dna的化学或酶促裂解的分析;质谱分析法(例如,maldi-tof);遗传位分析(gba);5'核酸酶测定法(例如,);和采用分子信标的测定法。在某些实施方案中,还可以检测蛋白质表达。用于检测和测量蛋白质表达的测定法是本领域已知的,包括例如蛋白质印迹分析、免疫荧光、免疫组织化学(例如,组织阵列的免疫组织化学)等。在某些实施方案中,使用本领域已知或本文所述的测定法评价巨噬细胞。在某些实施方案中,使用本领域已知或本文所述的测定法评价ipsc。在某些实施方案中,使用本领域已知或本文所述的测定法评价小胶质细胞。在某些实施方案中,使用本领域已知或本文所述的测定法评价从ipsc分化的小胶质细胞。某些定义术语“对照”或“对照样品”是指适合于所采用的检测技术的任何样品。对照样品可含有所采用的检测技术的产品或要测试的材料。此外,对照可以是阳性或阴性对照。术语“基因”广泛地用于指代与生物学功能相关的核酸的任何区段。基因包括编码序列和/或其表达所需的调控序列。例如,基因是指表达mrna、功能性rna或特定蛋白质的核酸片段,包括其调控序列。基因还包括,例如,形成其他蛋白质的识别序列的非表达dna区段。基因可以从多种来源获得,包括从感兴趣的来源进行克隆或从已知或预测的序列信息进行合成,并且可包括设计成具有期望参数的序列。另外,“基因”或“重组基因”是指包含开放阅读框并且包括至少一个外显子和(任选地)内含子序列的核酸分子。术语“内含子”是指存在于给定基因中的不被翻译成蛋白质并且通常见于外显子之间的dna序列。“突变基因”或“突变”或“功能性突变”是指基因的等位基因形式,相对于不具有突变基因的受试者,其能够改变具有突变基因的受试者的表型。分子的“变体”是与天然分子的序列基本上相似的序列。对于核苷酸序列,变体包括由于遗传密码的简并性而编码天然蛋白质的完全相同的氨基酸序列的那些序列。可以通过使用熟知的分子生物学技术,例如通过聚合酶链反应(pcr)和杂交技术来鉴定诸如此类的天然存在的等位基因变体。变体核苷酸序列还包括合成衍生的核苷酸序列,比如通过利用编码天然蛋白的定点诱变而生成的核苷酸序列,以及编码具有氨基酸取代的多肽的核苷酸序列。通常,本文公开的核苷酸序列变体将在至少一个实施方案中与天然(内源)核苷酸序列具有40%、50%、60%,至70%,例如,71%、72%、73%、74%、75%、76%、77%、78%,至79%,通常至少80%,例如81%-84%,至少85%,例如,86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%,至98%的序列同一性。如本文所用,就核酸而言,术语“特异性地杂交”或“特异性地检测”是指核酸分子与样品核酸的至少大约六个连续核苷酸杂交的能力。术语“蛋白质”、“肽”和“多肽”在本文中可互换使用。“天然存在”、“天然”或“野生型”用于描述可以在自然界发现的不同于人工产生的目标。例如,可以从自然界的来源分离并且尚未在实验室中被有意修饰的存在于生物(包括病毒)中的核苷酸序列是天然存在的。此外,“野生型”是指在自然界中发现的没有任何已知突变的正常基因或生物。以下术语用于描述两个或更多个核酸、多核苷酸或多肽之间的序列关系:(a)“参考序列”,(b)“比较窗口”,(c)“序列同一性”,(d)“序列同一性百分比”和(e)“基本同一性”。(a)如本文所用,“参考序列”是用作序列比较的基础的定义的序列。参考序列可以是指定序列的子集或整体;例如,其为全长cdna或基因序列的区段,或完全cdna或基因序列。(b)如本文所用,“比较窗口”是指多核苷酸序列的连续的指定的区段,其中与参考序列(其不包含添加或缺失)相比,在比较窗口中的多核苷酸序列可包含添加或缺失(即,空位),用于两个序列的最佳比对。通常,比较窗口的长度为至少20个连续核苷酸,并且任选地可以为30个、40个、50个、100个核苷酸或更长。本领域技术人员应当理解,为了避免由于多核苷酸序列中包含空位而导致与参考序列的高度相似性,通常引入空位罚分并将其从匹配数中减去。用于比较的序列比对方法是本领域熟知的。因而,可以使用数学算法来完成任意两个序列之间的同一性百分比的确定。可以利用这些数学算法的计算机实现进行序列比较,以确定序列同一性。这样的实现包括但不限于:在pc/基因程序中的clustal(可从加利福尼亚州山景城的intelligenetics公司获得);align程序(2.0版)以及在威斯康星遗传学软件包版本8(可从美国威斯康星州麦迪逊市575sciencedrive的遗传学计算机组(gcg)获得)中的gap、bestfit、blast、fasta和tfasta。可以使用默认参数执行使用这些程序的比对。可通过美国国家生物技术信息中心公开获得执行blast分析的软件(参见在ncbi.nlm.nih.gov的万维网)。这种算法涉及首先通过鉴定查询序列中具有长度w的短字而识别高评分序列对(hsp),这些短字当与数据库序列中具有相同长度的字比对时匹配或满足某个正值阈值评分t。t被称为相邻字评分阈。这些初始相邻字命中用作开始检索以找到含有它们的更长hsp的种子。然后,沿着每个序列的两个方向延伸字命中,直到累积比对评分可以增加。对于核苷酸序列,使用参数m(一对匹配残基的奖励分;总是>0)和n(错配残基的罚分;总是<0)计算累积评分。对于氨基酸序列,使用评分矩阵来计算累积评分。当累积比对评分从其最大获得值以数量x降低时,当由于一个或多个负评分残基比对的积累引起累积评分为0或低于0时,或当达到任一序列末端时,在每个方向上的字命中的延伸就停止。除计算序列一致性百分比之外,blast算法还进行两个序列之间相似性的统计分析。由blast算法提供的相似性的一个量度是最小总和概率(p(n)),它提供了由此将偶然发生在两个核苷酸序列或氨基酸序列之间的匹配的概率指示。例如,如果在测试核酸序列与参考核酸序列的比较中的最小总和概率小于约0.1、小于约0.01或甚至小于约0.001,则认为测试核酸序列与参考序列相似。为了获得用于比较目的的带空位的比对,可以利用带空位的blast(在blast2.0中)。可替代地,可以使用psi-blast(在blast2.0中)来执行迭代搜索,以检测分子之间的远距离关系。在使用blast、带空位的blast、psi-blast时,可以使用对应程序的默认参数(例如,对于核苷酸序列为blastn,对于蛋白质为blastx)。blastn程序(对于核苷酸序列)使用字长(w)11、期望值(e)10、截止值100、m=5、n=-4、以及两条链的比较作为默认值。对于氨基酸序列,blastp程序使用字长(w)3、期望值(e)10、以及blosum62评分矩阵作为默认值。参见在ncbi.n1m.nih.gov的万维网。也可以通过目视检查手动地进行比对。使用具有其默认参数的blastn程序(版本1.4.7或更高版本)或任何等效程序,可以将确定序列同一性百分比的核苷酸序列与本文公开的启动子序列进行比较。关于“等效程序”,是指这样的任何序列比较程序,当与由blast程序生成的相应比对进行比较时,所述序列比较程序对于所讨论的任何两个序列生成具有完全相同的核苷酸或氨基酸残基匹配的比对和完全相同的序列同一性百分比。(c)如本文所用,在两个核酸或多肽序列的背景下,“序列同一性”或“同一性”指的是当在指定比较窗口上比对最大对应性时在两个序列中的相同残基的指定百分比,如通过序列比较算法或目视检查测量的。当使用序列同一性百分比提及蛋白质时,将认识到的是,不完全相同的残基位置通常会因保守氨基酸取代而不完全相同,其中氨基酸残基被取代为具有相似化学特性(例如,电荷或疏水性)的其他氨基酸残基,并且因此分子的功能特性未改变。当序列在保守取代方面不同时,可以向上调整序列同一性百分比,以校正所述取代的保守性质。因这样的保守取代而不同的序列被称为具有“序列相似性”或“相似性”。进行这种调整的手段是本领域技术人员熟知的。通常,这涉及将保守取代评分为部分错配而不是完全错配,从而增加序列同一性百分比。因而,例如,在完全相同的氨基酸被给予评分1并且非保守取代被给予评分零的情况下,则保守取代被给予的评分在零和1之间。例如,如在程序pc/gene(加利福尼亚州山景城的intelligenetics公司)中实现的,计算出保守取代的评分。(d)如本文所用,“序列同一性百分比”意指通过在比较窗口上比较两个最优比对序列所确定的值,其中在所述比较窗口中的多核苷酸序列部分可以包含相比于参考序列(不包含添加或缺失)的添加或缺失(即,空位),用于这两个序列的最优比对。通过确定在两个序列中出现完全相同的核酸碱基或氨基酸残基的位置的数目而产生匹配位置数,用该匹配位置数除以比较窗口中位置的总数,将结果乘以100而产生序列同一性百分比,从而计算出所述百分比。(e)(i)术语多核苷酸序列的“基本同一性”意指使用以标准参数描述的比对程序之一,与参考序列相比,多核苷酸包含具有至少70%、71%、72%、73%、74%、75%、76%、77%、78%或79%;至少80%、81%、82%、83%、84%、85%、86%、87%、88%或89%;至少90%、91%、92%、93%或94%;或甚至至少95%、96%、97%、98%或99%序列同一性的序列。本领域技术人员将认识到,可以通过考虑密码子简并性、氨基酸相似性、阅读框定位等来适当地调节这些值,以确定由两个核苷酸序列编码的蛋白质的相应同一性。为了这些目的,氨基酸序列的基本同一性通常意指至少70%,或至少80%、90%,或甚至至少95%的序列同一性。基本上相同的核苷酸序列另一个指示是两个分子是否在严格条件下彼此杂交(见下文)。通常,严格条件被选择为比特定序列在限定的离子强度和ph下的热熔点(tm)低约5℃。然而,严格条件包括约1℃至约20℃范围内的温度,这取决于期望的严格程度,如本文另外限定的。在严格条件下彼此不杂交的核酸仍然是基本相同的,条件是它们所编码的多肽基本上相同。例如,当使用遗传密码所允许的最大密码子简并性产生核酸的拷贝时,可以发生这种情况。两个核酸序列基本上相同的一个指示在于,此时第一核酸编码的多肽与第二核酸编码的多肽具有免疫交叉反应。(e)(ii)在肽的背景下,术语“基本同一性”指示的是,在指定的比较窗口上,所述肽包含与参考序列具有至少70%、71%、72%、73%、74%、75%、76%、77%、78%或79%;至少80%、81%、82%、83%、84%、85%、86%、87%、88%或89%;或至少90%、91%、92%、93%或94%;或甚至至少95%、96%、97%、98%或99%序列同一性的序列。两个肽序列基本上相同的指示是,一个肽与针对第二个肽的抗体具有免疫反应性。因而,例如,在两个肽仅因保守取代而不同的情况下,一个肽与第二个肽是基本上相同的。为了序列比较,通常将一个序列用作与测试序列进行比较的参考序列。当使用序列比较算法时,将测试序列和参考序列输入计算机中,必要时指定亚序列坐标,并指定序列算法程序参数。然后,基于指定的程序参数,序列比较算法计算出测试序列相对于参考序列的序列同一性百分比。术语“rna转录物”是指由rna聚合酶催化的dna序列转录所产生的产物。当rna转录物是dna序列的完美互补拷贝时,其被称为初级转录物,或者它可以是源自初级转录物的转录后加工的rna序列,并且被称为成熟rna。“信使rna”(mrna)是指没有内含子且可被细胞翻译成蛋白质的rna。“cdna”是指与mrna互补并衍生自mrna的单链或双链dna。如本文所用,“治疗”(“treatment”)(及其语法变化,比如“治疗”(“treat”)或“治疗”(“treating”))是指改变被治疗个体的自然病程的临床干预,并且所述治疗可用于预防或在临床病理过程中进行。期望的治疗效果包括但不限于预防疾病的发生或复发、症状减轻、疾病的任何直接或间接病理结果的削减、降低疾病进展速度、改善或减轻疾病状态以及缓解或改善预后。短语“有效量”意指本文所述化合物的量,其(i)治疗或预防特定疾病、病症或疾患,(ii)减弱、改善或消除特定疾病、病症或疾患的一种或多种症状,或(iii)预防或延迟本文所述的特定疾病、病症或疾患的一种或多种症状的发作。本文公开的物质/分子的“治疗有效量”可以根据诸如个体的疾病状态、年龄、性别和体重等因素以及所述物质/分子在个体中引出期望反应的能力而变化。治疗有效量包括其中所述物质/分子的的治疗有益效果超过它的任何毒性或有害作用的量。“预防有效量”是指在剂量和时间段方面有效实现期望的预防结果所需的量。通常(但不一定),由于预防剂量是在疾病之前或早期的受试者中使用,因此预防有效量将小于治疗有效量。术语“哺乳动物”是指任何哺乳动物物种,比如人、小鼠、大鼠、狗、猫、仓鼠、豚鼠、兔子、家畜等。术语“从患者获得样品”、“从患者获得”和类似的措词用于表示直接从患者获得样品,以及通过中间个体间接地从患者获得样品(例如,从快递员获得样品,而快递员从护士获得样品,而护士从患者获得样品)。在细胞组合物的背景下,术语“富集群体”表示该群体含有一定量的指定细胞类型,所述细胞类型相对于在所述细胞来源的组织中的发现具有实质上更大的比例。相对于天然组织,指定类型的细胞可以富集至少10%、25%、50%、75%、100%、150%、200%、500%或1000%。可替代地,细胞群可以含有至少20%、50%、70%、80%、90%或95%的指定细胞类型。某些实施方案下面包括本文所述的某些实施方案。实施方案1.一种治疗在有需要的哺乳动物中的脂质代谢失调的方法,所述方法包括向所述哺乳动物施用有效量的激动剂,即,抗髓样细胞上表达的触发受体2(trem2)抗体。实施方案2.如实施方案1所述的方法,其中在哺乳动物中的表达trem2的细胞表现出脂质代谢失调。实施方案3.如实施方案2所述的方法,其中所述细胞是小胶质细胞或巨噬细胞。实施方案4.如实施方案1-3中任一项所述的方法,其中所述哺乳动物具有或已经被确定具有trem2活性降低。实施方案5.如实施方案4所述的方法,其中所述trem2活性降低是由trem2蛋白水平降低引起的。实施方案6.如实施方案4所述的方法,其中所述trem2活性降低是由细胞表面蛋白水平降低引起的。实施方案7.如实施方案4所述的方法,其中所述trem2活性降低是由trem2丧失或功能突变的部分丧失引起的。实施方案8.如实施方案1-7中任一项所述的方法,其中所述哺乳动物具有或已经被确定具有载脂蛋白e(apoe)活性降低。实施方案9.如实施方案8所述的方法,其中所述哺乳动物具有或已经被确定具有apoe功能丧失或功能突变的部分丧失或编码变体。实施方案10.如实施方案1-7中任一项所述的方法,其中所述哺乳动物具有或已经被确定具有apoeε4等位基因。实施方案11.如实施方案1-7中任一项所述的方法,其中所述哺乳动物不具有或已经被确定不具有apoeε4等位基因。实施方案12.如实施方案1-11中任一项所述的方法,其中所述脂质代谢失调包括一种或多种脂质的积累增加。实施方案13.如实施方案12所述的方法,其中所述一种或多种脂质的积累增加是细胞内的。实施方案14.如实施方案13所述的方法,其中所述一种或多种脂质在小胶质细胞或巨噬细胞中以细胞内方式积累。实施方案15.如实施方案12所述的方法,其中所述一种或多种脂质的积累增加是细胞外的。实施方案16.如实施方案12-15中任一项所述的方法,其中所述一种或多种脂质选自由以下组成的组:胆固醇酯、氧化胆固醇酯、双(单酰基甘油)磷酸酯种类(bmp)、二酰基甘油酯、三酰基甘油酯、己糖神经酰胺、半乳糖神经酰胺、乳糖神经酰胺、硫苷脂、神经节苷脂、磷脂酰丝氨酸38:4、双(单酰基甘油)磷酸酯44:12、溶血磷脂酰胆碱16:0、血小板活化因子、硫酸胆固醇、溶血磷脂酰乙醇胺,及其组合。实施方案17.如实施方案16所述的方法,其中所述一种或多种脂质包括胆固醇酯。实施方案18.如实施方案1-17中任一项所述的方法,其中所述哺乳动物患有与脂质代谢失调相关的炎症。实施方案19.如实施方案1-18中任一项所述的方法,其中所述哺乳动物患有或易于发生阿尔茨海默病、纳苏-哈科拉病(nhd)、路易体痴呆、帕金森病、视网膜变性(例如黄斑变性)、亨廷顿病、额颞叶变性(ftd)、肌萎缩性侧索硬化(als)、a型尼曼-皮克病、b型尼曼-皮克病、c型尼曼-皮克病、肥胖症、2型糖尿病、酒精或非酒精性脂肪性肝炎、酒精或非酒精性脂肪肝疾病、多发性硬化、消融性白质脑病、类风湿关节炎(ra)或动脉粥样硬化。实施方案20.如实施方案1-18中任一项所述的方法,其中所述哺乳动物患有或易于发生阿尔茨海默病、纳苏-哈科拉病(nhd)、路易体痴呆、帕金森病、视网膜变性、亨廷顿病、额颞叶变性(ftd)、肌萎缩性侧索硬化(als)、a型尼曼-皮克病、b型尼曼-皮克病、c型尼曼-皮克病、多发性硬化或消融性白质脑病。实施方案21.如实施方案1-18中任一项所述的方法,其中所述哺乳动物患有或易于发生肥胖症、2型糖尿病、酒精或非酒精性脂肪性肝炎、酒精或非酒精性脂肪肝疾病、类风湿关节炎(ra)或动脉粥样硬化。实施方案22.如实施方案19所述的方法,其中所述哺乳动物患有或易于发生阿尔茨海默病。实施方案23.如实施方案19所述的方法,其中所述哺乳动物患有或易于发生nhd。实施方案24.如实施方案19所述的方法,其中所述哺乳动物患有或易于发生动脉粥样硬化。实施方案25.如实施方案19所述的方法,其中所述哺乳动物患有或易于发生c型尼曼-皮克病。实施方案26.如实施方案1-25中任一项所述的方法,其中所述激动剂抗trem2抗体是mab17291或78.18。实施方案27.如实施方案1-26中任一项所述的方法,其中所述激动剂抗trem2抗体减少脂质积累。实施方案28.如实施方案27所述的方法,其中所述激动剂抗trem2抗体减少胆固醇酯的积累。实施方案29.如实施方案27或者28所述的方法,其中所述激动剂抗trem2抗体减少细胞内脂质积累。实施方案30.如实施方案27或28所述的方法,其中所述激动剂抗trem2抗体减少细胞外脂质积累。实施方案31.如实施方案1-30中任一项所述的方法,其中所述施用降低至少一种促炎细胞因子的表达。实施方案32.如实施方案31所述的方法,其中所述至少一种细胞因子选自由以下组成的组:g-csf、infy、il-12(p40)、il-12(p70)、lix(cxcl5)、mcp-1(ccl2)、mig(cxcl9)、il-1α、il-1β和il-18。实施方案33.如实施方案32所述的方法,其中所述至少一种细胞因子是il-1β。实施方案34.如实施方案1-33中任一项所述的方法,其进一步包括施用第二治疗剂。实施方案35.如实施方案34所述的方法,其中所述第二治疗剂选自由以下组成的组:rxr激动剂、lxr激动剂和乙酰辅酶a乙酰转移酶1(acat1)抑制剂。实施方案36.如实施方案35所述的方法,其中所述第二治疗剂是rxr激动剂。实施方案37.如实施方案36所述的方法,其中所述rxr激动剂是贝沙罗汀。实施方案38.如实施方案35所述的方法,其中所述第二治疗剂是lxr激动剂。实施方案39.如实施方案38所述的方法,其中所述lxr激动剂是gw3965。实施方案40.如实施方案35所述的方法,其中所述第二治疗剂是乙酰辅酶a乙酰转移酶1(acat1)抑制剂。实施方案41.如实施方案40所述的方法,其中所述acat1抑制剂是cp-113,818、ci-1011或k-604。实施方案42.如实施方案41所述的方法,其中所述acat1抑制剂是k-604。实施方案43.如实施方案34所述的方法,其中所述第二治疗剂是用于治疗阿尔茨海默病或动脉粥样硬化的药剂。实施方案44.一种治疗在有需要的患者中的脂质代谢失调的方法,所述方法包括:1)从患者获得或已经获得生物样品;2)检测或已经检测到样品中的trem2活性降低、apoe活性降低或apoeε4等位基因;3)在检测到trem2活性降低、apoe活性降低或apoeε4等位基因时将患者诊断为患有脂质代谢失调;以及4)向诊断的患者施用有效量的激动剂抗trem2抗体。实施方案45.一种用激动剂抗trem2抗体治疗患者的方法,所述方法包括:1)从患者获得或已经获得生物样品;2)分析生物样品或已经分析样品以检测trem2活性降低、apoe活性降低或apoeε4等位基因的存在,从而将患者诊断为患有脂质代谢失调;以及3)向诊断的患者施用有效量的激动剂抗trem2抗体。实施方案46.一种用于治疗哺乳动物中的脂质代谢失调的激动剂抗trem2抗体。实施方案47.用于如实施方案46中所述用途的抗体,其中所述哺乳动物具有或已经被确定具有trem2活性降低。实施方案48.用于如实施方案46或47中所述用途的抗体,其中所述哺乳动物具有或已经被确定具有apoe活性降低。实施方案49.用于如实施方案46或47中所述用途的抗体,其中所述哺乳动物具有或已经被确定具有apoe丧失或功能突变的部分丧失或编码变体。实施方案50.用于如实施方案46或47中所述用途的抗体,其中所述哺乳动物具有或已经被确定具有apoeε4等位基因。实施方案51.用于如实施方案46或47中所述用途的抗体,其中所述哺乳动物不具有或已经被确定不具有apoeε4等位基因。实施方案52.一种激动剂抗trem2抗体用于制备治疗哺乳动物中的脂质代谢失调的药剂的用途。实施方案53.如实施方案52所述的用途,其中所述哺乳动物具有或已经被确定具有trem2活性降低。实施方案54.如实施方案52或53所述的用途,其中所述哺乳动物具有或已经被确定具有apoe活性降低。实施方案55.如实施方案52或53所述的用途,其中所述哺乳动物具有或已经被确定具有apoe丧失或功能突变的部分丧失或编码变体。实施方案56.如实施方案52或53所述的用途,其中所述哺乳动物具有或已经被确定具有apoeε4等位基因。实施方案57.如实施方案52或者53所述的用途,其中所述哺乳动物不具有或已经被确定不具有apoeε4等位基因。实施方案58.一种减少细胞中一种或多种脂质的细胞内积累的方法,所述方法包括使所述细胞与有效量的激动剂抗trem2抗体接触。实施方案59.如实施方案58所述的方法,其中所述细胞是小胶质细胞。实施方案60.如实施方案58所述的方法,其中所述细胞是巨噬细胞。实施方案61.如实施方案58-60中任一项所述的方法,其中所述一种或多种脂质选自由以下组成的组:胆固醇酯、氧化胆固醇酯、bmp、二酰基甘油酯、三酰基甘油酯、己糖神经酰胺、半乳糖神经酰胺、乳糖神经酰胺、硫苷脂、神经节苷脂、磷脂酰丝氨酸38:4、双(单酰基甘油)磷酸酯44:12、溶血磷脂酰胆碱16:0、血小板活化因子、硫酸胆固醇、溶血磷脂酰乙醇胺,及其组合。实施方案62.如实施方案61所述的方法,其中所述一种或多种脂质包括胆固醇酯。实施方案63.如实施方案58-62中任一项所述的方法,其中所述细胞具有或已经被确定具有trem2活性降低。实施方案64.如实施方案58-63中任一项所述的方法,其中所述细胞具有或已经被确定具有apoe活性降低。实施方案65.如实施方案58-63中任一项所述的方法,其中所述细胞具有或已经被确定具有apoe丧失或功能突变的部分丧失或编码变体。实施方案66.如实施方案58-63中任一项所述的方法,其中所述细胞表达或已经被确定表达apoe4。实施方案67.如实施方案58-63中任一项所述的方法,其中所述细胞不表达或已经被确定不表达apoe4。实施方案68.如实施方案58-67中任一项所述的方法,其中所述激动剂抗trem2抗体是mab17291或78.18。实施方案69.如实施方案58-68中任一项所述的方法,其中所述细胞在体外、体内或离体地与激动剂抗trem2抗体接触。实施方案70.如实施方案58-68中任一项所述的方法,其中所述细胞存在于哺乳动物中。实施方案71.如实施方案58-68中任一项所述的方法,其中所述细胞存在于哺乳动物中并且在体内与激动剂抗trem2抗体接触。实施方案72.如实施方案70或71所述的方法,其中所述哺乳动物患有与细胞内脂质积累相关的炎症。实施方案73.如实施方案72所述的方法,其中所述激动剂抗trem2抗体降低至少一种促炎细胞因子的表达。实施方案74.如实施方案73所述的方法,其中所述至少一种细胞因子选自由以下组成的组:g-csf、infy、il-12(p40)、il-12(p70)、lix(cxcl5)、mcp-1(ccl2)、mig(cxcl9)、il-1α、il-1β和il-18。实施方案75.如实施方案74所述的方法,其中所述至少一种细胞因子是il-1β。实施方案76.如实施方案70-75中任一项所述的方法,其中所述哺乳动物患有或易于发生阿尔茨海默病、nhd、路易体痴呆、帕金森病、视网膜变性(例如黄斑变性)、亨廷顿病、ftd、als、a型尼曼-皮克病、b型尼曼-皮克病、c型尼曼-皮克病、肥胖症、2型糖尿病、酒精或非酒精性脂肪性肝炎、酒精或非酒精性脂肪肝疾病、多发性硬化、消融性白质脑病、ra或动脉粥样硬化。实施方案77.如实施方案76所述的方法,其中所述哺乳动物患有或易于发生nhd。实施方案78.如实施方案76所述的方法,其中所述哺乳动物患有或易于发生动脉粥样硬化。实施方案79.如实施方案76所述的方法,其中所述哺乳动物患有或易于发生c型尼曼-皮克病。实施方案80.如实施方案58-79中任一项所述的方法,其进一步包括使所述细胞与第二治疗剂接触。实施方案81.如实施方案80所述的方法,其中所述第二治疗剂是rxr激动剂。实施方案82.如实施方案81所述的方法,其中所述rxr激动剂是贝沙罗汀。实施方案83.如实施方案80所述的方法,其中所述第二治疗剂是lxr激动剂。实施方案84.如实施方案83所述的方法,其中所述lxr激动剂是gw3965。实施方案85.如实施方案80所述的方法,其中所述第二治疗剂是acat1抑制剂。实施方案86.如实施方案85所述的方法,其中所述acat1抑制剂是cp-113,818、ci-1011或k-604。实施方案87.如实施方案86所述的方法,其中所述acat1抑制剂是k-604。实施方案88.一种用于减少细胞中一种或多种脂质的细胞内积累的激动剂抗trem2抗体。实施方案89.一种激动剂抗trem2抗体用于制备减少细胞中一种或多种脂质的细胞内积累的药剂的用途。实施方案90.一种治疗在有需要的哺乳动物中的阿尔茨海默病的方法,所述方法包括向所述哺乳动物施用激动剂抗trem2抗体,其中所述哺乳动物患有或已经被确定患有脂质代谢失调。实施方案91.如实施方案90所述的方法,其中所述哺乳动物具有或已经被确定具有在表达trem2的细胞中的脂质代谢失调。实施方案92.一种治疗在有需要的哺乳动物中的阿尔茨海默病的方法,所述方法包括向所述哺乳动物施用激动剂抗trem2抗体,其中所述哺乳动物具有或已经被确定具有在表达trem2的细胞中的脂质代谢失调。实施方案93.如实施方案91-92中任一项所述的方法,其中所述表达trem2的细胞是小胶质细胞。实施方案94.如实施方案91-93中任一项所述的方法,其中所述表达trem2的细胞具有或已经被确定具有trem2活性降低。实施方案95.如实施方案90-94中任一项所述的方法,其中所述脂质代谢失调包括一种或多种脂质的细胞内积累增加。实施方案96.如实施方案95所述的方法,其中所述一种或多种脂质选自由以下组成的组:胆固醇酯、氧化胆固醇酯、bmp、二酰基甘油酯、三酰基甘油酯、己糖神经酰胺、半乳糖神经酰胺、乳糖神经酰胺、硫苷脂、神经节苷脂、磷脂酰丝氨酸38:4、双(单酰基甘油)磷酸酯44:12、溶血磷脂酰胆碱16:0、血小板活化因子、硫酸胆固醇、溶血磷脂酰乙醇胺,及其组合。实施方案97.如实施方案96所述的方法,其中所述一种或多种脂质包括胆固醇酯。实施方案98.如实施方案90-97中任一项所述的方法,其中所述哺乳动物患有与脂质代谢失调相关的炎症。实施方案99.如实施方案98所述的方法,其中所述施用降低至少一种促炎细胞因子的表达。实施方案100.如实施方案99所述的方法,其中所述至少一种细胞因子选自由以下组成的组:g-csf、infy、il-12(p40)、il-12(p70)、lix(cxcl5)、mcp-1(ccl2)、mig(cxcl9)、il-1α、il-1β和il-18。实施方案101.如实施方案100所述的方法,其中所述至少一种细胞因子是il-1β。实施方案102.如实施方案90-101中任一项所述的方法,其中所述激动剂抗trem2抗体是mab17291或78.18。实施方案103.如实施方案90-102中任一项所述的方法,其进一步包括向哺乳动物施用第二治疗剂。实施方案104.如实施方案103所述的方法,其中所述第二治疗剂是rxr激动剂。实施方案105.如实施方案104所述的方法,其中所述rxr激动剂是贝沙罗汀。实施方案106.如实施方案103所述的方法,其中所述第二治疗剂是lxr激动剂。实施方案107.如实施方案106所述的方法,其中所述lxr激动剂是gw3965。实施方案108.如实施方案103所述的方法,其中所述第二治疗剂是acat1抑制剂。实施方案109.如实施方案108所述的方法,其中所述acat1抑制剂是cp-113,818、ci-1011或k-604。实施方案110.如实施方案109所述的方法,其中所述acat1抑制剂是k-604。实施方案111.一种用于治疗哺乳动物中的阿尔茨海默病的激动剂抗trem2抗体,其中所述哺乳动物患有或已经被确定患有脂质代谢失调。实施方案112.一种用于治疗哺乳动物中的阿尔茨海默病的激动剂抗trem2抗体,其中所述哺乳动物具有或已经被确定具有在表达trem2的细胞中的脂质代谢失调。实施方案113.一种激动剂抗trem2抗体用于制备治疗哺乳动物中的阿尔茨海默病的药剂的用途,其中所述哺乳动物患有或已经被确定患有脂质代谢失调。实施方案114.一种激动剂抗trem2抗体用于制备治疗哺乳动物中的阿尔茨海默病的药剂的用途,其中所述哺乳动物具有或已经被确定具有在表达trem2的细胞中的脂质代谢失调。实施方案115.一种治疗在有需要的哺乳动物中的动脉粥样硬化的方法,所述方法包括向所述哺乳动物施用有效量的激动剂抗trem2抗体。实施方案116.如实施方案115所述的方法,其中所述哺乳动物患有或已经被确定患有脂质代谢失调。实施方案117.如实施方案115-116中任一项所述的方法,其中所述脂质代谢失调包括一种或多种脂质的积累增加。实施方案118.如实施方案117所述的方法,其中所述一种或多种脂质的积累增加是细胞内的。实施方案119.如实施方案117所述的方法,其中所述一种或多种脂质在巨噬细胞中以细胞内方式积累。实施方案120.如实施方案119所述的方法,其中所述巨噬细胞具有或已经被确定具有trem2活性降低。实施方案121.如实施方案117所述的方法,其中所述一种或多种脂质的积累增加是细胞外的。实施方案122.如实施方案117-121中任一项所述的方法,其中所述一种或多种脂质选自由以下组成的组:胆固醇酯、氧化胆固醇酯、bmp、二酰基甘油酯、三酰基甘油酯、己糖神经酰胺、半乳糖神经酰胺、乳糖神经酰胺、硫苷脂、神经节苷脂、磷脂酰丝氨酸38:4、双(单酰基甘油)磷酸酯44:12、溶血磷脂酰胆碱16:0、血小板活化因子、硫酸胆固醇、溶血磷脂酰乙醇胺,及其组合。实施方案123.如实施方案122所述的方法,其中所述一种或多种脂质包括胆固醇酯。实施方案124.如实施方案116-123中任一项所述的方法,其中所述哺乳动物患有与脂质代谢失调相关的炎症。实施方案125.如实施方案124所述的方法,其中所述施用降低至少一种促炎细胞因子的表达。实施方案126.如实施方案125所述的方法,其中所述至少一种细胞因子选自由以下组成的组:g-csf、infy、il-12(p40)、il-12(p70)、lix(cxcl5)、mcp-1(ccl2)、mig(cxcl9)、il-1α、il-1β和il-18。实施方案127.如实施方案126所述的方法,其中所述至少一种细胞因子是il-1β。实施方案128.如实施方案115-127中任一项所述的方法,其中所述激动剂抗trem2抗体是mab17291或78.18。实施方案129.如实施方案115-128中任一项所述的方法,其进一步包括施用第二治疗剂。实施方案130.如实施方案129所述的方法,其中所述第二治疗剂是用于治疗动脉粥样硬化的药剂。实施方案131.如实施方案129所述的方法,其中所述第二治疗剂是rxr激动剂、lxr激动剂或acat1抑制剂。实施方案132.一种用于治疗哺乳动物中的动脉粥样硬化的激动剂抗trem2抗体。实施方案133.一种激动剂抗trem2抗体用于制备治疗哺乳动物中的动脉粥样硬化的药剂的用途。实施方案134.一种治疗在有需要的哺乳动物中的炎症的方法,所述方法包括向所述哺乳动物施用有效量的激动剂抗trem2抗体。实施方案135.如实施方案134所述的方法,其中所述施用降低至少一种促炎细胞因子的表达。实施方案136.如实施方案135所述的方法,其中所述至少一种细胞因子与炎症小体反应相关。实施方案137.如实施方案135或136所述的方法,其中所述至少一种细胞因子选自由以下组成的组:g-csf、infy、il-12(p40)、il-12(p70)、lix(cxcl5)、mcp-1(ccl2)、mig(cxcl9)、il-1α、il-1β和il-18。实施方案138.如实施方案137所述的方法,其中所述至少一种细胞因子是il-1β。实施方案139.如实施方案134-138中任一项所述的方法,其中所述哺乳动物患有或易于发生炎症小体相关疾病或疾患。实施方案140.如实施方案134-138中任一项所述的方法,其中所述哺乳动物患有或易于发生类风湿关节炎、痛风或炎性肠病(ibd)。实施方案141.如实施方案134-138中任一项所述的方法,其中所述炎症与脂质代谢失调相关。实施方案142.如实施方案141所述的方法,其中施用所述激动剂抗trem2抗体减少脂质积累。实施方案143.如实施方案141或142所述的方法,其中所述哺乳动物患有或易于发生阿尔茨海默病、纳苏-哈科拉病(nhd)、路易体痴呆、帕金森病、视网膜变性(例如黄斑变性)、亨廷顿病、a型尼曼-皮克病、b型尼曼-皮克病、c型尼曼-皮克病、肥胖症、2型糖尿病、酒精或非酒精性脂肪性肝炎、酒精或非酒精性脂肪肝疾病、多发性硬化、消融性白质脑病或动脉粥样硬化。实施方案144.如实施方案141或142所述的方法,其中所述哺乳动物患有或易于发生阿尔茨海默病、纳苏-哈科拉病(nhd)、路易体痴呆、帕金森病、视网膜变性、亨廷顿病、a型尼曼-皮克病、b型尼曼-皮克病、c型尼曼-皮克病、多发性硬化或消融性白质脑病。实施方案145.如实施方案141或142所述的方法,其中所述哺乳动物患有或易于发生肥胖症、2型糖尿病、酒精或非酒精性脂肪性肝炎、酒精或非酒精性脂肪肝疾病或动脉粥样硬化。实施方案146.如实施方案134-145中任一项所述的方法,其中所述激动剂抗trem2抗体是mab17291或78.18。实施方案147.如实施方案134-146中任一项所述的方法,其进一步包括施用第二治疗剂。实施方案148.如实施方案147所述的方法,其中所述第二治疗剂是rxr激动剂、lxr激动剂或acat1抑制剂。实施方案149.一种用于治疗哺乳动物中的炎症的激动剂抗trem2抗体。实施方案150.一种激动剂抗trem2抗体用于制备治疗哺乳动物中的炎症的药剂的用途。实施方案151.如实施方案149所述的抗体或如实施方案150所述的用途,其中所述炎症与脂质代谢失调相关。实施方案152.一种从组织样品中分选cns细胞群的方法,所述方法包括:(a)使组织样品与抗cd45一级抗体、抗cd11b一级抗体和抗星形胶质细胞表面抗原2(acsa-2)一级抗体接触,其中每种一级抗体被独特标记,以提供标记的组织样品;和(b)通过流式细胞术分选标记的组织样品中的细胞,其中所述方法提供了星形胶质细胞和小胶质细胞的不同细胞群。实施方案153.如权利要求152所述的方法,其中所述抗cd45一级抗体、所述抗cd11b一级抗体和所述抗acsa-2一级抗体存在于组合物中。实施方案154.一种从组织样品中分选cns细胞群的方法,所述方法包括:(a)使组织样品与一种组合物接触,所述组合物包含:抗cd45一级抗体、抗cd11b一级抗体和抗星形胶质细胞表面抗原2(acsa-2)一级抗体,其中每种一级抗体被独特标记,以提供标记的组织样品;并且(b)通过流式细胞术分选标记的组织样品中的细胞,其中所述方法提供了星形胶质细胞和小胶质细胞的不同细胞群。实施方案155.如实施方案153或154所述的方法,其中所述组合物进一步包含活力染料。实施方案156.如实施方案152-154中任一项所述的方法,进一步包括使组织样品与活力染料接触。实施方案157.如实施方案152-156中任一项所述的方法,其提供了包含少于约20%的非小胶质细胞的不同的小胶质细胞群。实施方案158.如实施方案152-156中任一项所述的方法,其提供了包含少于约20%的非星形细胞的不同的星形胶质细胞群。实施方案159.如实施方案152-158中任一项所述的方法,其中基于以下标志物谱对小胶质细胞群进行分选:cd45低/cd11b+/acsa-2-。实施方案160.如实施方案152-159中任一项所述的方法,其中基于以下标志物谱对星形胶质细胞群进行分选:cd45-/cd11b-/acsa-2+。实施方案161.如实施方案152-160中任一项所述的方法,其中分析了不同细胞群的代谢种类或核酸种类的定量。实施方案162.如实施方案161所述的方法,其中所述代谢种类是脂质种类。实施方案163.如实施方案161所述的方法,其中所述核酸种类选自rna、dna和基因组dna。实施方案164.如实施方案152-160中任一项所述的方法,其中分析了不同细胞群的施用治疗剂的定量。实施方案165.一种包含通过如实施方案152-160中任一项所述的方法分离的不同细胞群的组合物。实施方案166.如实施方案165所述的组合物,其中所述不同细胞群是小胶质细胞群。实施方案167.如实施方案165所述的组合物,其中所述不同细胞群是星形细胞群。实施方案168.一种包含两个在物理上分开的细胞群的cns细胞的集合,其中第一细胞群包括cd45低/cd11b+/acsa-2-细胞的富集群体并且第二细胞群包括cd45-/cd11b-/acsa-2+细胞的富集群体。以下实施例旨在是非限制性的。实施例1:在具有慢性脱髓鞘的trem2敲除小鼠中的脂质代谢相关基因的表达减弱本实施例描述了小鼠小胶质细胞基因表达分析。双环己酮草酰二腙饮食诱导小鼠脱髓鞘trem2-/-小鼠购自美国杰克逊实验室(jacksonlaboratory)(品系号:027197)并且与c57bl/6j小鼠回交,产生trem2+/-小鼠。使trem2+/-小鼠进一步互交,产生用于本研究的三种基因型(trem2+/+、trem2+/-和trem2-/-)的同窝仔。使用大约9-11个月龄的小鼠。将每种基因型的小鼠分为两组(6-11只/组),采用正常饮食(envigotd.160766)或双环己酮草酰二腙饮食(0.2%双环己酮草酰二腙,envigotd.160765)治疗范例,持续5周或12周。每周记录每只动物的体重,以便监测双环己酮草酰二腙的作用。来自小鼠脑的小胶质细胞、星形胶质细胞和其他细胞的荧光激活细胞分选(facs)为了制备用于分选cns细胞的单细胞悬液,给小鼠灌注pbs,将脑解剖,并使用成人脑解离试剂盒(miltenyibiotec130-107-677)根据制造商的方案加工成单细胞悬液。将细胞用fc封闭,并用排除死细胞的可固定活力染料bv510(bdbiosciences564406)、cd11b-bv421(bdbiosciences562605)、cd45-apc(bdbiosciences559864)和acsa-2-pe(miltenyibiotec130-102-365)进行染色,进行流式细胞术分析。将细胞用hibernatea(brainbitsllc)洗涤两次,并通过100μm过滤器过滤,然后在带有100μm喷嘴的facsariaiii(bdbiosciences)上分选cd11b+小胶质细胞和acsa-2+星形胶质细胞。处理分选的细胞用于下游分析,包括rnaseq、scrnaseq或脂质组学。小胶质细胞基因表达的facs-rnaseq分析将活细胞被分选成cd11b+小胶质细胞(100,000-120,000个细胞)与所有其他未染色细胞(100,000-200,000个细胞),直接收集在rlt-plus缓冲液(qiagen)中,所述缓冲液具有1:100的β-巯基乙醇。使用rneasyplusmicro试剂盒(qiagen,74034)提取rna,并将其重悬在14μl无核酸酶的水中。在2100生物分析仪(agilent)上使用rna6000pico芯片(agilent5067-1513)评估rna的数量和质量。按照制造商定义的“低输入”方案,使用用于illumina的quantseq3'mrna-seqlibraryprepkitfwd(lexogen)处理rna。使用用于illumina的nebnextlibraryquantkit(neb,e7630s)将条形码化的样品定量。将所有样品以等摩尔比合并到一个测序文库中,在带有高灵敏度dna芯片的生物分析仪(agilent,5067-4626)上将所述文库定量。在ucsf先进技术中心(ucsfcenterforadvancedtechnology)的illuminahiseq4000泳道中产生50bp的单端读段。将读段与小鼠基因组版本grcm38_p6比对。用--sjdboverhang=50变元来构建star索引(dobin,a等人,bioinformatics,2013.29(1):第15-21页;版本2.5.3a)。通过--sjdbgtffile变元提供了来自gencode基因模型(发行版m17)的剪接连接。用以下参数生成star比对:--outfiltertypebysjout、--quantmodetranscriptomesam、--outfilterintronmotifsremovenoncanonicalunannotated、--outsamstrandfieldintronmotif、--outsamattributesnhhiasnmmdxs和--outsamunmappedwithin。用以下参数获得比对:--readfilescommandzcat--outfiltertypebysjout--outfiltermultimapnmax20--alignsjoverhangmin8--alignsjdboverhangmin1--outfiltermismatchnmax999--outfiltermismatchnoverlmax0.6--alignintronmin20--alignintronmax1000000--alignmatesgapmax1000000--quantmodegenecounts--outsamunmappedwithin--outsamattributesnhhiasnmmdxs–outsamstrandfieldintronmotif–outsamtypebamsortedbycoordinate–outbamcompression6。使用来自subread包(liao,y等人,nucleicacidsres,2013.41(10):e108;版本1.6.2)的featurecounts获得基因水平计数使用ensembl(版本91)经由使用r(版本3.4.3)的biomartr包(durinck,s等人,natprotoc,2009.4(8):第1184-91页;版本2.34.2)将基因符号和entrez基因标识符作图。为了鉴定差异表达的基因,使用limmabioconductor包来拟合线性模型(liu,r等人,nucleicacidsres,2015.43:p.e97)。在统计分析中仅包括如通过edger's"filterbyexpr”函数确定的具有足够大的计数的基因。用“calcnormfactors”函数计算每个样品的tmm缩放因子(robinson,md等人,genomebiol,2010.11(3):第r25页)。我们用来自limmabioconductor包的“voom”函数估计了log2转换计数和导出的观察水平权重的均值-方差关系(liu,r等人,nucleicacidsres,2015.43:p.e97)。将线性模型用“lmfit”和“ebayes”函数拟合。使用ggplot2r包(wickham,h等人,ggplot2:elegantgraphicsfordataanalysis,2016)绘制结果。使用来自limmar包的“camera”算法进行竞争性基因集测试(wu,d等人,nucleicacidsres,2012.40(17):p.e133)。单细胞rnaseq文库的制备和分析如上文所述将来自(2)对照饮食trem2+/+半脑和(2)trem2+/+、(2)trem2+/-和(2)trem2-/-12周双环己酮草酰二腙处理的半脑的解离细胞处理并染色。将从每个半脑和(2)每个条件的半脑分选的30,000个活的cd11b+/cd45lo小胶质细胞合并到pbs+0.5%bsa中,生成4个总测序组。将小胶质细胞计数并以70μl稀释至500,000个细胞/ml,经证实活力>70%。使用在stanford功能基因组学设施的具有铬控制器(10xgenomics)的具有v2化学(10xgenomics,产品编号120267)的铬单细胞3'文库试剂盒进行单细胞文库的条形码化和制备。使用ucsf先进技术中心的novaseqs4(测序仪)将scrnaseq文库测序。生成了四个单细胞数据集。使用dropletutils(lun,atl等人,biorxiv,2018.doi:10.1101/234872)、scater(mccarthydj等人,bioinformatics,2017.33(8):第1179-1186页)和scran(lun,atl等人,genomebiology,2016.17:第75页)bioconductor(v3.8)的组合进行所有质量控制、过滤和下游分析。每个实验均通过以下方式独立进行质量控制和过滤:(i)使用“emptydrops”函数鉴定仅含环境rna(fdr<0.01)的液滴,并将其除去;(ii)使用“isoutlier”函数鉴定具有低读取计数、低基因计数或高线粒体负荷的细胞,并将其除去。然后将来自每个实验的剩余细胞合并到通用细胞图集中,以进行下游分析。使用“computesumfactors”函数解释每个细胞的测序深度的差异,并使用“归一化”函数计算每个基因的归一化对数计数。最初的pca和随后的tsne分析进一步从每个样品鉴定出一组细胞,所述细胞唯一的真正区别特征是高线粒体负荷。这组细胞被认为是技术伪像,并且因此被除去,以形成最终的高质量细胞图集。首先通过使用“buildsnngraph”函数(使用k=6)构建共享的最近邻图,然后使用louvian方法进行社区检测,从而鉴定所述图集中的十个小胶质细胞簇。最大的簇含有595个细胞(knn_07),并且最小的簇含有147个细胞(knn_10)。首先通过鉴定整个图集中属于每个簇的细胞比例(图2a,左),随后通过鉴定属于每个簇的每个样品的细胞比例(图2a,右),从而表征多个簇。在以下两种情况下对每个簇进行了标记基因和基因集富集分析:通用-针对整个数据集检验了每个簇;或受限-仅针对彼此检验了三个有趣的细胞簇(knn_05、knn_05和knn_10)。通过使用“pairwisewilcox”函数的wilcoxon检验鉴定了每个簇的标记基因,并使用0.001的fdr阈值将其过滤。通过取给定簇内相对于其余每个簇的基因的log2倍变化的平均值(如通过“pairwisettests”函数计算的),报告了每个基因的倍数变化。表1:小胶质细胞簇knn5、8和10中改变的基因.基因方向簇fdrlog2fccd14上调knn_56.34e-041.448cd74上调knn_51.33e-041.736tmem176a上调knn_55.07e-051.081ptprc上调knn_51.65e-060.720bcl2a1a上调knn_57.06e-100.777spp1上调knn_56.67e-041.552axl上调knn_52.57e-070.804ctsh上调knn_51.97e-050.691lpl上调knn_53.78e-061.204nfkbiz上调knn_55.19e-040.703tmsb4x上调knn_87.43e-050.466sh3bgrl3上调knn_85.86e-050.615serf2上调knn_84.98e-040.453atp5j2上调knn_87.54e-060.507rpl35上调knn_81.85e-040.399ppia上调knn_83.04e-040.294rpl6上调knn_81.52e-050.312rpl23a上调knn_83.07e-040.366rpl36al上调knn_82.59e-040.396rpl38上调knn_89.22e-040.310btg1下调knn_85.81e-23-1.783ler5下调knn_81.35e-26-1.927jun下调knn_81.11e-25-2.494dusp1下调knn_81.93e-29-2.539rhob下调knn_81.26e-30-1.911zfp36下调knn_85.64e-27-2.166malat1下调knn_81.03e-29-4.234jund下调knn_81.10e-30-2.471btg2下调knn_81.21e-30-2.584junb下调knn_81.10e-30-2.954ltc4s上调knn_102.59e-101.069p2ry12上调knn_105.05e-101.123sgk1上调knn_107.33e-041.278serpine2上调knn_103.06e-080.886arl4c上调knn_102.55e-090.852pmp22上调knn_101.02e-090.891gpr34上调knn_107.32e-090.819fcrls上调knn_108.48e-060.713sft2d1上调knn_102.03e-070.727tmem86a上调knn_109.81e-070.767arpc1b下调knn_101.08e-05-0.456pfn1下调knn_103.42e-07-0.491sh3bgrl3下调knn_102.73e-06-0.653spp1下调knn_104.47e-06-1.792fth1下调knn_101.03e-09-0.644tmem176b下调knn_105.97e-06-1.246tmsb4x下调knn_104.39e-17-0.628tmsb10下调knn_102.64e-13-1.569trem2下调knn_105.54e-09-1.322cd52下调knn_101.40e-13-1.643如图1a-c、图2a-b和表1中所示,在急性和慢性脱髓鞘(分别进行5周和12周双环己酮草酰二腙处理)后,涉及脂质代谢的基因在trem2+/+和trem2+/-鼠小胶质细胞中上调,但是在具有慢性和急性脱髓鞘的trem2-/-鼠小胶质细胞中表现出上调降低。在具有对照饮食的小鼠中的大量分离的trem2+/+、trem2+/-和trem2-/-鼠小胶质细胞之间的基因型差异很小(图1a)。数以百计的基因在具有慢性脱髓鞘的大量trem2+/+和trem2+/-鼠小胶质细胞中上调,但是很少的基因在trem2-/-小胶质细胞中上调(图1b)。在大量trem2+/+和trem2+/-小胶质细胞中上调但在trem2-/-小胶质细胞中未上调的这些基因中有许多涉及脂质代谢(图1c)。图1c显示了在具有对照饮食(左插图)相对于5周或12周双环己酮草酰二腙处理(右插图,分别在顶部或底部)的trem2+/+、trem2+/-和trem2-/-大量小胶质细胞中的与脂质代谢相关的单个基因的基因表达的log2倍变化。图2a和2b鉴定了来自单独分离的trem2+/+对照饮食小胶质细胞(trem2+/+ctrl)相比于来自具有慢性脱髓鞘的trem2+/+、trem2+/-和trem2-/-小鼠的分离的小胶质细胞(trem2+/+cpz、trem2+/-cpz、trem2-/-cpz)的单细胞rna测序数据的小胶质细胞簇。簇knn8鉴定了其基因随着双环己酮草酰二腙处理被上调或下调而不论基因型的小胶质细胞群。簇knn_5鉴定了其基因在trem2+/+cpz和trem2+/-cpz小鼠中随着慢性脱髓鞘而上调但在对照或trem2-/-cpz小鼠中未上调的小胶质细胞群。簇knn_10鉴定了其基因在trem2-/-cpz小鼠中上调但在trem2+/+cpz、trem2+/-cpz或对照小鼠中未上调的小胶质细胞群。表1列出了在簇knn5、8和10中鉴定的基因、对数倍数变化和变化方向以及错误发现率(fdr)。实施例2.慢性脱髓鞘后在trem2敲除的前脑和分离的小胶质细胞中胆固醇酯和髓磷脂脂质的丰度增加本实施例描述了小鼠前脑以及分离的小胶质细胞和星形胶质细胞群的脂质组学。前脑脂质提取在pbs灌注之后,将小鼠矢状半脑在液氮中快速冷冻,并使用leicacm1950低温恒温器交替地以100μm(脂质组学)或20μm(组织学)宽度在-20℃下沿冠状面制作冷冻切片。将来自含有胼胝体的匹配的前脑区域的两个100μm切片放入1.5mllobind管(eppendorf)中,所述管中装有3mm不锈钢珠(qiagen)和200μl含内标的lc-ms级甲醇。使用tissuelyser(qiagen)2x在试管中进行裂解:1分钟,25hz,在4℃。取出20μl的样品,使用二辛可宁酸(bca)测定法(美国伊利诺伊州罗克福德的皮尔斯(pierce))进行蛋白质浓度测量。将裂解液以18,000xg在4℃旋转20分钟。将上清液转移到玻璃lc-ms小瓶(waters)中。facs脂质提取根据上述facs方案将解离细胞染色,不同之处在于所有染色缓冲液均含有pbs+1%不含脂肪酸的bsa(sigma)。将400μl含内标的lc-ms级甲醇添加到2mllo-bind管(eppendorf)中。在分选之后,用去离子水(milli-q)将总体积调整至800μl。将样品以2500rpm在室温涡旋5分钟。加入800μl甲基叔丁醚(mtbe),并将样品以2500rpm在室温涡旋5分钟,然后以21000xg在4℃旋转10分钟。将600μlmtbe上清液转移至玻璃lc-ms小瓶中,并在氮气下干燥。将样品重悬于100μllc-ms级甲醇中。脂质的质谱分析通过将液相色谱法(美国马里兰州哥伦比亚的shimadzuscientificinstrument的shimadzunexerax2系统)与电喷雾质谱法(美国马萨诸塞州弗雷明汉的sciex的qtrap6500+)偶联来进行脂质分析。对于每次分析,使用0.25ml/min的流速在55℃将5μl样品注入到behc181.7μm,2.1×100mm柱(美国马萨诸塞州米尔福德的waterscorporation)上。对于正电离模式,流动相a的组成为60:40的乙腈/水(v/v)和10mm甲酸铵+0.1%甲酸;流动相b的组成为90:10的异丙醇/乙腈(v/v)和10mm甲酸铵+0.1%甲酸。对于负电离模式,流动相a的组成为60:40的乙腈/水(v/v)和10mm乙酸铵;流动相b的组成为90:10的异丙醇/乙腈(v/v)和10mm乙酸铵。梯度按如下编程:从45%b到99%b0.0–8.0分钟,在99%b8.0-9.0分钟,到45%b到9.0-9.1分钟,在45%b9.1-10.0分钟。应用以下设置以正离子或负离子模式进行电喷雾电离:气帘气为30;碰撞气设定为中等;5500(正模式)或4500(负模式)的离子喷雾电压;温度为250℃(正模式)或600℃(负模式);离子源气1为50;离子源气2为60。使用analyst1.6.3(sciex)以多反应监测模式(mrm)进行数据采集,具有以下参数:在表2(正模式)或表3(负模式)中报告的每个种类的停留时间(毫秒)和碰撞能量(ce);去簇电压(dp)为80;入口电压(ep)为10(正模式)或-10(负模式);并且碰撞池出口电压(cxp)为12.5(正模式)或-12.5(负模式)。使用表2和表3中报告的非内源性内标混合物将脂质定量。基于脂质的保留时间和市售参考标准品(美国阿拉巴马州伯明翰的avantipolarlipids)的mrm特性鉴定脂质。使用multiquant3.02(sciex)进行定量。将代谢物归一化为总蛋白量或细胞数。表2:用于正模式的脂质组学测定法的lc-ms采集参数表3:用于负模式的脂质组学测定法的lc-ms采集参数glccer和galcer的质谱分析通过将液相色谱法(美国马里兰州哥伦比亚的shimadzuscientificinstrument的shimadzunexerax2系统)与电喷雾质谱法(美国马萨诸塞州弗雷明汉的sciex的qtrap6500+)偶联来进行葡萄糖神经酰胺(glccer)、半乳糖神经酰胺(galcer)、葡萄糖鞘氨醇和半乳糖鞘氨醇分析。对于每次分析,使用0.45ml/min的流速在45℃将10μl样品注入到halohilic2.0μm,3.0×150mm柱(advancedmaterialstechnology)上。流动相a的组成为92.5/5/2.5acn/ipa/h2o与5mm甲酸铵和0.5%甲酸。流动相b的组成为92.5/5/2.5h2o/ipa/acn与5mm甲酸铵和0.5%甲酸。梯度按如下编程:在100%b0.0–3.1分钟,在95%b3.2分钟,在85%b5.7分钟,在85%b保持到7.1分钟,在7.25分钟处降到0%b并保持到8.75分钟,在10.65分钟处恢复到100%并保持到11分钟。应用以下设置以正离子模式进行电喷雾电离:气帘气为25;碰撞气设定为中等;离子喷雾电压为5500;温度为350℃;离子源气1为55;离子源气2为60。使用analyst1.6(sciex)以多反应监测模式(mrm)进行数据采集,具有以下参数:在表4中报告的每个种类的停留时间(毫秒)和碰撞能量(ce);去簇电压(dp)为45;入口电压(ep)为10;碰撞池出口电压(cxp)为12.5。使用表4中报告的内标混合物将脂质定量。葡萄糖神经酰胺和半乳糖神经酰胺的鉴定基于它们的保留时间和市售参考标准品(美国阿拉巴马州伯明翰的avantipolarlipids)的mrm特性来进行。使用multiquant3.02(sciex)进行定量。将代谢物归一化为细胞数。表4:用于glccer和galcer测定法的lc-ms采集参数图3a-f和图4a-p突出显示在来自具有慢性脱髓鞘的trem2-/-小鼠的前脑和分离的小胶质细胞中胆固醇酯和富含髓磷脂的脂质的升高,但在星形胶质细胞中未升高。在图3中,在具有对照饮食和双环己酮草酰二腙饮食的trem2+/+、trem2+/-和trem2-/-小鼠中,前脑总胆固醇水平没有变化(图3a)。相比于具有对照饮食或5周双环己酮草酰二腙的trem2+/+、trem2+/-和trem2-/-小鼠以及具有12周双环己酮草酰二腙的trem2+/+和trem2+/-,在具有12周双环己酮草酰二腙饮食的trem2-/-小鼠前脑中的胆固醇酯(图3b)、氧化胆固醇酯(图3c)、bmp(图3d)和三酰基甘油酯(图3e)水平升高。相比于具有对照饮食或5周双环己酮草酰二腙的trem2+/+、trem2+/-和trem2-/-小鼠以及具有12周双环己酮草酰二腙的trem2+/+和trem2+/-,在具有12周双环己酮草酰二腙饮食的trem2-/-小鼠前脑中的gm3d38:1和gm3d40:1(图3f)水平升高。在图4中,相比于具有对照饮食或5周双环己酮草酰二腙的trem2+/+、trem2+/-和trem2-/-小胶质细胞以及具有12周双环己酮草酰二腙的trem2+/+和trem2+/-小胶质细胞,从具有12周双环己酮草酰二腙饮食的trem2-/-脑分离的小胶质细胞显示出升高的胆固醇酯(图4a)、bmp(图4b)、己糖神经酰胺(图4c)和半乳糖神经酰胺(图4d)水平。在从具有对照饮食或双环己酮草酰二腙饮食的trem2+/+、trem2+/-和trem2-/-脑分离的富含星形胶质细胞的细胞群中检测到胆固醇酯(图4e)、bmp(图4f)、己糖神经酰胺(图4g)和半乳糖神经酰胺(图4h)的脂质水平没有变化。实施例3.从trem2ko小鼠培养的bmdm和ipsc小胶质细胞中的体外脂质存储增加本实施例描述了通过免疫细胞化学和质谱分析在体外培养并且用氧化低密度脂蛋白(oxldl)或髓磷脂处理的trem2kobmdm中观察到的脂质存储表型。小鼠bmdm的收获和培养将小鼠股骨和胫骨解剖,并用70%乙醇短暂灭菌。用hbss将骨洗涤两次,然后用研钵和研杵将其在10mlhbss中砸开。通过70μm细胞过滤器将细胞悬液过滤,以300xg旋转5分钟,弃去上清液。在室温将细胞沉淀在ack裂解缓冲液(thermofishera1049201)中重悬4分钟。添加10mlrpmi-1640(thermofisher)+10%hyclonefbs(gehealthcare)+青霉素-链霉素(thermofisher),以终止ack裂解,然后以300xg旋转5分钟,弃去上清液。将细胞重悬于具有50ng/ml鼠m-csf(lifetechnologies,pmc2044)的rpmi培养基中,计数并稀释至1x106个细胞/ml,然后在非组织培养处理的培养皿上进行平板接种。接种后三天,添加新鲜的鼠m-csf(50ng/ml)。接种后五天,吸出细胞培养基,用pbs洗涤细胞一次。将细胞重悬于rpmi/fbs/pen-strep中,并用细胞刮刀收获。将细胞以300xg旋转5分钟,弃去上清液,并将细胞稀释至1x106个细胞/ml,用于在组织培养处理的平板上直接培养,或冷冻于rpmi/fbs/pen-strep+10%dmso中供以后使用。ipsc小胶质细胞方法人ipsc来源的小胶质细胞的生成方法概要:按照制造商的说明,使用市售试剂盒(stemcelltechnologies目录号05310),从野生型和敲除的ips细胞(按照以下方案生成敲除系)生成造血祖细胞。在造血干细胞分化的第12天,细胞的hsc标志物cd34、cd43和cd45为阳性,此时将漂浮的和粘附的细胞转移到含有原代人星形胶质细胞的6孔板中。将重新平板接种的细胞与星形胶质细胞在培养基c中共培养14-21天,所述培养基c改编自pandya,h等人,natneurosci,2017.20(5):第753-759页(imdm、10%hyclonefbs、penstrep、20ng/mlil3、20ng/mlgm-csf、20ng/mlm-csf),在此期间逐渐去除祖细胞,并且漂浮细胞主要(>80%)为成熟小胶质细胞。将成熟的小胶质细胞转移到稳态培养条件下保持3-7天,所述稳态培养条件改编自muffat,j等人,natmed,2016.(11):第1358-1367页(mgdm培养基),然后进行测定。稳定敲除系的生成基于crispr的方法与基于rnp的方案一起使用,所述方案的试剂来自idt(alt-r系统:https://www.idtdna.com/pages/products/crispr-genome-editing/alt-r-crispr-cas9-system),并且使用lonza目录号v4xp-3032经由核转染引入neb(cas9目录号m0646m)。髓磷脂纯化使用在safaiyan,s等人,natneurosci,2016.19(8):第995-8页中描述的方法从野生型c57bl/6小鼠脑(jackson实验室)纯化髓磷脂。纯化后,将髓磷脂重悬于pbs中,并使用dc蛋白质测定试剂盒2(biorad,5000112)调节至1mg/ml的蛋白质浓度。在添加有5ng/ml小鼠m-csf的组织培养处理的96孔板(cellcarrier,perkinelmer)中,以每孔100,000个细胞的密度在rpmi/10%fbs/pen-strep中进行bmdm的平板接种。根据公开的方案(us2004/0038987a1)制备acat抑制剂k604。用于尼罗红染色、非律平染色或脂质组学的体外脂质存储测定在包含20ng/mlmcsf的其对应的全血清培养基中,在pdl包被的96孔板上进行ipsc小胶质细胞(30,000/孔)或bmdm(100,000/孔)(wt或trem2ko)的平板接种。在37℃下保持24小时之后,将纯化的髓磷脂(如上所述从小鼠脑分离,5μg/ml(2小时摄取)或25μg/ml或50μg/ml(48-72小时摄取)终浓度)或oxldl(thermofisherl34357,50μg/ml终浓度)掺入到孔中。对于用oxldl进行的实验,在第一次添加后24小时,第二次添加相同量的oxldl,掺入到孔中。在使用acat抑制剂的实验中,将500nmacat抑制剂k604或媒介物对照与第一个脂质剂量一起掺入。在37℃进行脂质处理2小时(图9)或48小时至72小时之后,收集细胞或将其成像。对于髓磷脂洗脱实验,在24小时孵育期之后去除髓磷脂,并在随后的24-48小时孵育中用含抗体的培养基代替。对于lc-ms,根据以下方案提取细胞。对于尼罗红成像,去除上清液,并将细胞在含有1μm尼罗红(thermofishern1142)和1滴/ml的nucblue(thermofisherr37605)的活细胞成像缓冲液(lifetechnologies,a14291dj)中在37℃孵育30分钟。在孵育之后,除去染色溶液并将细胞在4%多聚甲醛中固定。然后在operaphoenix高内涵共聚焦成像仪上使用568和dapi照明设置将细胞成像。对于非律平染色,去除上清液,使用4%多聚甲醛将细胞固定。用胆固醇检测洗涤缓冲液(abcamab133116)洗涤细胞三次,每次5分钟。将非律平iii以1:100稀释在胆固醇检测测定缓冲液(abcamab133116)中,并且添加至细胞维持30分钟。将细胞用洗涤缓冲液洗涤两次以上,并使用dapi照明设置进行成像。使用与仪器一起提供的harmony软件上的斑点发现算法,分析脂质和非律平斑点。图5a-b描绘了相比于wtbmdm在用oxldl(50μg/ml)处理48小时的trem2kobmdm中的脂质积累增加,如尼罗红染色所示(图5a)。以63x分辨率将细胞成像,并使用harmony软件上的斑点发现算法将尼罗红定量为总斑点面积(图5b)。图9显示了在来自野生型小鼠的骨髓分化巨噬细胞中的胆固醇和胆固醇酯(ce)水平,所述野生型小鼠予以5μg/ml髓磷脂给药2小时,然后在摄取髓磷脂之后立即(t0)进行提取,或者随后洗脱髓磷脂并且进行2小时(t2)或4小时(t4)的驱除。在髓磷脂摄取过程中加入acat抑制剂,并通过洗脱4小时维持(t4+acat抑制剂)。图11a-c显示在acat抑制剂的存在下在给予髓磷脂的wt和trem2koipsc小胶质细胞都没有积累胆固醇酯,表明胆固醇酯积累是acat依赖性的。胆固醇显示为对照,并且不受acat抑制的影响。体外样品的脂质提取方案然后将如上所述用oxldl或髓磷脂处理的细胞在保持在冰上的同时用pbs洗涤。将70μl的含内标的9:1甲醇:水溶液加到96孔板的细胞中。在振荡器上在4℃和1200rpm将板搅拌20分钟,然后以300xg旋转离心5分钟。将50μl上清液转移至lc-ms小瓶中,并保持在-80℃,直到在仪器上运行时为止。关于质谱分析方案,参考实施例2。在图6a-e中,对用oxldl处理48小时的wt和trem2kobmdm进行质谱分析,以表征在细胞内积累的脂质种类。oxldl处理增加了在wt和trem2kobmdm两者中的脂质丰度,但胆固醇酯(图6a)、神经节苷脂(图6b)、三酰基甘油酯(图6c)和己糖神经酰胺(图6d)的增加在trem2kobmdm中加剧。在图7a-g中,对用髓磷脂处理48小时的wt和trem2kobmdm进行质谱分析,以表征在细胞内积累的脂质种类。当用髓磷脂处理时,相比于wtbmdm,trem2kobmdm显示出更多的胆固醇酯(图7a)、氧化胆固醇酯(图7b)、二酰基甘油酯(图7c)、三酰基甘油酯(图7d)、己糖神经酰胺(图7e)、半乳糖神经酰胺(图7f)和神经节苷脂(图7g)积累。在图8a-h中,对用髓磷脂(25ug/ml)处理72小时的wt和trem2koipsc小胶质细胞进行质谱分析,以表征在细胞内积累的脂质种类。trem2koipsc显示更多的胆固醇(图8a)、磷脂酰丝氨酸38:4(图8b)、双(单酰基甘油)磷酸酯44:12(图8c)、溶血磷脂酰胆碱16:0(图8d)、血小板活化因子(图8e)、硫酸胆固醇(图8f)和溶血磷脂酰乙醇胺(图8g)积累。图23a和23b表明,在用髓磷脂(25ug/ml)处理并且用非律平对游离胆固醇进行染色后,trem2kobmdm在内吞溶酶体系统中比trem2wtbmdm积累更多的游离胆固醇。图23c和23d显示,与对照抗体(抗rsv)相比,抗trem2抗体降低了人ipsc来源的小胶质细胞中的游离胆固醇水平。图23c显示了在各种条件下用非律平对游离胆固醇的染色,而图23d显示了非律平小点的定量。实施例4.用trem2抗体或外源性apoe改善ipsc小胶质细胞中的脂质积累生成ipsc并使用与实施例3相似的方法收获/培养bmdm。将来自上述实施例3的用于体外脂质存储测定和尼罗红染色或脂质组学的方案修改如下:在37℃脂质处理24小时后,将trem2抗体或rsv对照掺入孔中至终浓度为100nm。在细胞的收集或成像之前,将细胞在37℃再孵育48小时。在用apoe3进行的实验中,将细胞用髓磷脂(25μg/ml)处理24小时,然后将培养基更换为含10μg/mlapoe3的培养基。在24小时之后,收集细胞用于分析。根据上述方案进行脂质组学或尼罗红染色。图10显示,当用髓磷脂喂食(24小时)时,trem2kobmdm比wtbmdm积累更多的脂质,如尼罗红染色的总斑点面积定量的。通过添加外源性人apoe3改善了这种积累,其已显示出介导脂质流出(pmid:9541497,pmid:10693931,pmid:15485881)。图12a-12c显示,trem2抗体可减少人ipsc来源的wt小胶质细胞中的髓磷脂诱导的脂质积累的量。这在尼罗红染色上和在lc-ms上的三酰基甘油酯水平测量上都得到证明。图12d展示了在24小时髓磷脂处理之后用几种不同的抗trem2抗体处理72小时的如通过质谱法检测的在ipsc小胶质细胞的细胞裂解物中的三酰基甘油酯(tag)脂质种类的水平。抗trem2抗体a和b与trem2的茎区域结合,而抗trem2抗体c、d和e与trem2的igv区结合。图12e展示了如通过质谱法检测的在ipsc小胶质细胞的细胞裂解物中的tag脂质种类的水平,所述ipsc小胶质细胞经历了用抗trem2抗体进行的髓磷脂洗脱实验。将图12d和12e中生成的lc/ms数归一化为髓磷脂+每个单独的脂质种类的同种型对照。通过髓磷脂处理诱导了ipsc小胶质细胞中的脂质积累,这通过中性脂质染色(尼罗红)的增加并且通过用于检测细胞裂解物中的特定脂质种类的lc/ms反映出来。图12a-12e中展示的数据共同表明,用多种抗trem2抗体处理在髓磷脂激发后的ipsc小胶质细胞减少了脂质种类的积累,如通过lc/ms测量的tag脂质种类水平的降低指示的。在24小时至72小时的不同时间点范围观察到由于抗体处理导致的脂质水平降低。为了消除脂质水平降低是由于脂质摄取阻断而引起的可能性,进行了髓磷脂洗脱实验,其中在加入抗trem2抗体之前去除了髓磷脂。图12e展示的是,相对于同种型对照,抗trem2抗体也降低了ipsc小胶质细胞中的脂质水平,其中在抗体处理之前进行了髓磷脂洗脱。实施例5.acat1抑制剂、贝沙罗汀和gw3965对trem2ko细胞中的髓磷脂或oxldl存储的影响在包含20ng/mlmcsf的其对应的全血清培养基中,在pdl包被的96孔板上进行ipsc小胶质细胞(30,000/孔)或bmdm(100,000/孔)(wt或trem2ko)的平板接种。在37℃下保持24小时之后,将纯化的髓磷脂(如上所述从小鼠脑分离,5μg/ml(2小时摄取)或25μg/ml或50μg/ml(48-72小时摄取)终浓度)或oxldl(thermofisherl34357,50μg/ml终浓度)掺入到孔中。对于用oxldl进行的实验,在第一次添加后24小时,第二次添加相同量的oxldl,掺入到孔中。在使用acat抑制剂的实验中,将500nmacat抑制剂k604或媒介物对照与第一个脂质剂量一起掺入。在使用贝沙罗汀的实验中,将10um贝沙罗汀或媒介物对照与纯化的髓磷脂一起掺入。在使用gw3965的实验中,将10umgw3965或媒介物对照与纯化的髓磷脂一起掺入。在37℃进行脂质处理2小时(图9)或48小时至72小时之后,收集细胞或将其成像。图13a显示当用髓磷脂碎片(25ug/ml)处理48h时,trem2kobmdm比wtbmdm积累更多的中性脂质,如通过尼罗红染色定量的。用贝沙罗汀(10um)共同处理减少了这种积累。图13b显示人ipsc来源的trem2ko小胶质细胞积累了各种胆固醇酯(ce)种类,并且通过用acat抑制剂k604(500nm)和lxr激动剂gw3965(10μm)共同处理减少了这种积累。实施例6.涉及脂质代谢和溶酶体的基因的表达改变在具有慢性脱髓鞘的trem2敲除小鼠中的功能本实施例描述了小鼠小胶质细胞基因表达分析。具体而言,这些分析证明:1)trem2缺乏阻止了慢性脱髓鞘过程中的dam转化;2)trem2缺乏阻断了向损伤相关小胶质细胞状态的年龄依赖性转化;和3)trem2–/–小胶质细胞展现出在脱髓鞘后向损伤相关小胶质细胞状态的转变减弱,如单细胞rnaseq所示。通常,使用与实施例1中所述相似的方法,其中单细胞rnaseq簇和进行的表达分析如下指示。单细胞rnaseq簇和表达分析在log2归一化的基因表达矩阵上进行pca,并且保留前二十一个主成分。在pc空间中的数据上构建了共享的最近邻图(xu,c.和su,z.(2015).bioinformatics31,1974-1980.),随后使用louvain方法(blondel等人,(2008).journalofstatisticalmechanics:theoryandexperiment2008)进行社区检测,以将细胞指定给八个簇之一。通过彻底地执行如scran包中实现的成对wilcoxon检验来鉴定每个簇的标记基因。简言之,分别针对其他七个簇中的每一个测试了簇内每个基因的表达水平。为了提供针对每个簇的基因的差异表达状态的最终p值,使用simes方法将七个生成的p值合并(simes,r.j.(1986).biometrika73,751-754),然后调整这些p值,以便使用benjamini–hochberg方法针对多重检验进行校正(benjamini,y.,andhochberg,y.(1995).journaloftheroyalstatisticalsociety57,289-300)。将每个比较的效应大小计算为“重叠比例”,即,在源簇中随机选择的单元比查询簇中的随机单元具有更高的基因x表达的概率。将所有成对比较上的重叠比例(wilcoxon效应大小)取平均值,以提供簇内基因的最终效应大小。最后,通过鉴定具有fdr<0.05的基因来提取每个簇的标记基因,并且将小于0.4或大于0.6的重叠比例取平均值。trem2缺乏阻止了慢性脱髓鞘过程中的dam转化为了表征急性和慢性脱髓鞘对小胶质细胞中的trem2依赖性基因表达的影响,用0.2%cpz饮食饲喂trem2+/+、trem2+/–和trem2–/–小鼠5周或12周。通过facs从半脑分离出cd11b+小胶质细胞,并使用rnaseq进行转录组分析。绝大多数cd11b+细胞是cd45低。实际上,在不存在cpz的情况下,对于所有三种基因型,cd45高细胞的比例占小于0.2%的总活细胞,而在cpz饮食存在的情况下,这个比例小于0.5%,表明在这个模型中巨噬细胞的轻微浸润。主成分分析(pca)表明,cpz处理诱导了来自trem2+/+和trem2+/–动物的小胶质细胞样品中的转录变化,而cpz激发的trem2–/–小胶质细胞与未处理动物的小胶质细胞聚类在一起。差异基因表达分析未揭示在正常饮食条件下的显著的基因型依赖性差异(参见,实施例1,图1a-b,绝对log2倍变化>0.5,fdr<0.2)。相反,对cpz的作用应用相同的阈值鉴定了数百种显著上调或下调的基因,其中cpz的作用在5周后发生变化,甚至在12周之后发生更强的作用(参见,实施例1,图1a-1b)。在5周和12周cpz饮食相对于对照饮食之间的基因型方面的比较证实,这些基因表达变化几乎完全局限于来自trem2+/+和trem2+/–动物的小胶质细胞,而来自trem2–/–小鼠的小胶质细胞在很大程度上未能对髓磷脂激发作出反应。使用来自反应组学(reactome)数据库的基因集分析(fabregat等人,(2018).nucleicacidsres46,d649-d655),检测到涉及溶酶体和吞噬体功能、ad、氧化磷酸化和胆固醇代谢的基因的显著trem2依赖性上调。例如,如图14a-14b中所示,在急性和慢性脱髓鞘(分别进行5周和12周双环己酮草酰二腙处理)后,涉及溶酶体功能和脂质代谢的基因在trem2+/+和trem2+/-鼠小胶质细胞中上调,但是在具有慢性和急性脱髓鞘的trem2-/-鼠小胶质细胞中表现出上调降低。图14a显示了在具有对照饮食(左插图)与5周或12周双环己酮草酰二腙处理(右插图,分别在顶部或底部)的trem2+/+、trem2+/-和trem2-/-大量小胶质细胞中的与溶酶体功能相关的单个基因的基因表达的log2倍变化。图14b显示了在具有对照饮食(左插图)与5周或12周双环己酮草酰二腙处理(右插图,分别在顶部或底部)的trem2+/+、trem2+/-和trem2-/-大量小胶质细胞中的与脂质代谢相关的单个基因的基因表达的log2倍变化。例如,溶酶体降解途径的关键基因,比如ctse和ctsl,在trem2+/+和trem2+/–小胶质细胞中在慢性脱髓鞘后上调2倍(fdr<0.05),但在trem2–/–小胶质细胞中保持不变(图14a,相互作用p值≤0.05)。几个trem2基因看起来控制了胆固醇转运和代谢的多个方面,除了apoe外,包括ch25h、lipa、nceh1、npc2和soat1。基因集富集还显示,先前描述的dam基因(keren-shaul,等人,(2017).cell169,1276-1290e1217)在来自trem2+/+和trem2+/–动物的小胶质细胞中在两个时间点都响应于cpz处理而显著上调(图14c)。这种dam样反应在来自trem2–/–动物的样品中减弱(图14c和15c),表明慢性cpz脱髓鞘诱导了小胶质细胞表达变化,所述变化反映了在5xfad和sod1小胶质细胞中观察到的那些变化(keren-shaul,等人,(2017).cell169,1276-1290e1217)。将小胶质细胞从稳态到dam的转变描述为两步过程:到中间状态的trem2独立型转变(dam阶段1),然后为第二次trem2依赖性变化(dam阶段2)(keren-shaul等人,(2017)cell169,1276-1290e1217)。与以前的模型一致,稳态基因p2ry12和tmem119响应于cpz在trem2+/+和trem2+/–中显著下调(fdr<0.01),但在trem2–/–小胶质细胞中则不然(图14d,基因型-饮食相互作用p值<0.05)。在cpz处理后,相比于trem2+/+和trem2+/–小胶质细胞,还观察到阶段1dam基因比如apoe(相互作用p值<0.001)、fth1(相互作用p值<0.005)和tyrobp(相互作用p值<0.1)在trem2–/–中的诱导降低(图14e)。例如,通过对trem2+/+和trem2+/–动物进行cpz处理12周之后,apoe的表达上调超过8倍,但这种反应在trem2–/–动物中减弱,类似于对于阶段2dam基因比如axl(相互作用p值<0.05)、cd9(相互作用p值<0.001)或csf1(相互作用p值<0.1)所观察到的(图14f)。总之,这些数据证实trem2是髓磷脂碎片吞噬清除的调节剂,并且指向内吞溶酶体加工和脂质代谢中的作用,其清楚地暗示胆固醇转运和代谢。另外,这些数据表明cpz慢性脱髓鞘引出了损伤相关小胶质细胞状态,这种状态未在trem2–/–小胶质细胞中启动。trem2缺乏阻断了到损伤相关小胶质细胞状态的年龄依赖性转化基因表达研究表明,衰老的小胶质细胞获得dam转录状态,这表明小胶质细胞可以对年龄诱导的实质损伤作出反应(keren-shaul,等人,(2017).cell169,1276-1290e1217)。为了测试衰老的trem2–/–小胶质细胞相对于野生型小胶质细胞是否在转变为损伤相关小胶质细胞状态方面的能力较弱,对来自年轻(2个月大)和衰老(15-17个月大)的野生型和trem2–/–小鼠的分选的小胶质细胞进行基因表达分析。基于多种稳态基因的下调以及dam1和dam2基因的上调,证实了从衰老的野生型脑中分离的小胶质细胞表现出损伤相关小胶质细胞特征(图15b和15c)。这种反应在trem2–/–小胶质细胞中在很大程度上减弱,如在cpz处理的trem2–/–小胶质细胞中观察到的。dam2基因集比dam1基因集受到的影响更深,例如相对于衰老的trem2–/–小胶质细胞,在衰老的野生型小胶质细胞中的lpl和spp1更显著地上调(图15b和15c)。这与5xfad小胶质细胞中表现出的dam2谱的trem2依赖性一致(keren-shaul,等人,(2017).cell169,1276-1290e1217)。然而,相对于对照小胶质细胞,胆固醇代谢相关基因模块在衰老的trem2–/–小胶质细胞中受到的影响不如在cpz处理的trem2–/–小胶质细胞中那样深刻(图15b和15c)。总之,这些数据表明,在源自cpz激发的trem2–/–小鼠的小胶质细胞中观察到的适应不良功能同样存在于来自衰老的trem2–/–小鼠的小胶质细胞中,不过后者的基因表达与cpz激发相比,其改变较不深刻。trem2–/–小胶质细胞在脱髓鞘后表现出向损伤相关小胶质细胞状态的转变减弱,如通过单细胞rnaseq所示。设计以下实验来确定是否:1)在大量rnaseq谱中观察到的基于群体的cpz诱导的转录变化对所有小胶质细胞通用;或2)异源转录反应发生在单细胞水平。为了解决这个问题,对分离自trem2+/+对照脑的cd11b+/cd45低小胶质细胞进行了scrnaseq,将其与来具有慢性脱髓鞘的trem2+/+、trem2+/–、和trem2–/–小鼠的小胶质细胞进行比较。这些实验产生了关于3,023个单个细胞的数据。为了鉴定在这些数据中的小胶质细胞的在转录上不同的亚群,使用共享的最近邻方法在单细胞表达谱上进行无监督的基于图的聚类(xu,c.和su,z.(2015).bioinformatics31,1974-1980)。这鉴定了小胶质细胞的八个亚群,每个亚群占2%到19%的所有被分析细胞。跨组的簇成员资格的定量鉴定了两个簇(4和8),所述两个簇在trem2+/+对照中基本上不存在(<3%),但是表现出强的处理特异性和基因型特异性扩展和折叠。仅在具有trem2(约1%的trem2+/+对照;16%-19%的trem2+/+cpz和trem2+/–cpz;约1.5%的trem2–/–cpz)的至少一个功能拷贝的暴露于慢性脱髓鞘的小胶质细胞中观察到在簇4中细胞的表达谱。在簇8中的小胶质细胞的表达谱在trem2+/+对照中也基本上不存在(<2.3%),其相对丰度在trem2+/+cpz和trem2+/–cpz小鼠中轻度增加(约10%),并且在trem2–/–cpz小鼠中最丰富(约20%)。为了进一步表征每个簇中的表达谱,进行了标记基因分析,以鉴定给定簇中相对于fdr<0.05的其余七个簇表现出簇特异性过表达和低表达的基因。每个簇中前15个上调和下调的基因的相对表达证实这些簇在转录上是不同的,不过很少发现在簇之间的表达为排他性的基因。与来自大量小胶质细胞数据的发现一致,在trem2+/+cpz和trem2+/–cpz富集的簇4中的最前面的上调标记基因包括溶酶体基因,比如ctsb、ctsd和ctsz,以及涉及脂质代谢的基因,比如apoe和lpl(图16a)。在簇4中下调的标记基因包括小胶质细胞稳态基因,比如p2ry12和tmem119,表明在这个簇中的小胶质细胞处于更活跃的状态(图16a和16b)。在簇8中最前面的上调标记基因类似于在簇4中上调的那些,但其上调的程度较小(图16a和16c)。因此,在簇8中的上调标记基因类似地包括溶酶体相关基因和脂质代谢相关基因,比如ctsb、ctsd和apoe(图16a)。这一数据强调,trem2–/–cpz小胶质细胞并非完全能够上调溶酶体相关基因和脂质代谢相关基因的转录,从而在脱髓鞘存在的情况下能够正确转化为活跃状态。然而,并非在trem2+/+和trem2+/–小鼠的脑中的所有小胶质细胞都随着慢性脱髓鞘而改变基因表达。相反,大约20%的总的小胶质细胞群上调了上述基因。与来自大量小胶质细胞数据的发现一致,在trem2+/+和trem2+/–cpz小胶质细胞簇4中发现的转录程序主要也由先前已经在dam2表达中表征的上调的标记基因组成(keren-shaul,等人,(2017).cell169,1276-1290e1217),所述上调的标记基因包括lgals3、cd63、spp1、cst7、cd68、capg和fth1(图16a)。为了表征簇4和8与dam阶段1和2基因相关的程度,每个dam状态使用一组先前报告的标记基因,以便对每个单元提供聚合dam评分。然后将这些评分按照簇取平均值,以总结每个簇与给定dam状态相似的程度。簇4显示出dam2基因表达的最高富集,其次为簇8,表明trem2+/+cpz和trem2+/–cpz小胶质细胞表现出响应于慢性脱髓鞘的dam2样转变,所述转变在trem2-/–cpz小胶质细胞中大大减弱。另外,trem2依赖性dam1基因在trem2+/+cpz、trem2+/–cpz和trem2–/–cpz小胶质细胞中上调,而trem2+/+cpz和trem2+/–cpz小胶质细胞相比于trem2–/–cpz小胶质细胞表现出更高的dam1基因表达。因而,在慢性脱髓鞘后,trem2–/–小胶质细胞亚群表现出某些dam基因的表达减弱。这些数据证明,trem2–/–cpz小胶质细胞并非完全能够上调溶酶体、脂质代谢和dam基因的转录,正如在具有trem2的至少一个功能拷贝的小胶质细胞中一样,从而能够在慢性脱髓鞘过程中正确转化为活跃状态。实施例7.trem2缺乏引起慢性脱髓鞘过程中的神经元损伤本实施例描述了trem2缺乏对慢性脱髓鞘过程中神经元损伤的影响。双环己酮草酰二腙饮食在小鼠中诱导脱髓鞘将与实施例1中所述相似的方法用于脱髓鞘方案。试剂一级抗体:1:100兔抗β-app(lifetechnologies,512700);1:1000小鼠抗smi-32(millipore559844)。二级抗体:山羊抗小鼠555、山羊抗小鼠647、山羊抗兔555和山羊抗兔647(invitrogen)。免疫荧光在pbs灌注之后,将小鼠矢状半脑在液氮中快速冷冻,并使用leicacm1950低温恒温器交替地以100μm(脂质组学)或20μm(组织学)宽度在-20℃下沿冠状面制作冷冻切片。针对每个半脑,收集代表头侧至尾侧脑区的10个连续组织学载玻片组,并在-80℃下冷冻。染色前,将载玻片在室温解冻直至干燥,然后用4%多聚甲醛(electronmicroscopysciences15710)固定10分钟。将载玻片用pbs洗涤两次,每次5分钟,然后在室温用pbs+0.3%tritonx-100+5%正常山羊血清(vectorlabss-1000)封闭1小时。将一级抗体稀释在封闭缓冲液中,添加至载玻片,在40℃过夜。将载玻片在pbs中洗涤3x15分钟,并用以1:1000稀释在封闭缓冲液中的二级抗体在室温孵育2小时。将载玻片在pbs中洗涤3x15分钟,在室温干燥,并用fluoromountg(southernbiotech0100-01)封片。在具有20倍物镜的zeissaxioscan自动幻灯片成像仪和zeisscellobserversd中捕获免疫染色的脑切片的图像,然后修剪,聚焦于海马区。神经丝光检测将小鼠血液收集到带有毛细管(sarstedt201278100)的edta管(sarstedt201341102)中,在40℃以15,000xg旋转7分钟,然后将血浆顶层转移到1.5ml的管中并在-80℃保存。将冰冻的血浆样品在冰上融化并稀释10倍,然后根据制造商的方案使用simoanf-light优势试剂盒(quanterix103186)在sr-x(quanterix)上运行。与所有其他组相比,在5周或12周的cpz之后,在trem2–/–小鼠的海马和胼胝体中鉴定出营养不良的app阳性点的积累(图17f)。app点是细胞核的大小,但它们未与dapi共定位。相反,这些点被smi32+非磷酸化神经丝染色包围或与之连续,提示营养不良性神经突。以半自动化方式或手动方式将app阳性营养不良性神经突点定量,显示出取决于量化参数(点数、强度或面积)的强大的基因型效应以及在基因型和cpz处理5周和/或12处理之间的相互作用(图17f)。为了证实慢性脱髓鞘在不存在trem2的情况下引起神经元损伤,还测量了血浆中的神经丝轻链(nf-l)水平。与app染色一致,在慢性脱髓鞘后,在对照或cpztrem2+/+和trem2+/–血浆中的nf-l水平没有变化,但它们在trem2–/–血浆中升高(图17a)。与具有cpz处理的trem2–/–cns中观察到的神经元损伤增加一致,衰老的trem2–/–小鼠在它们的血浆中显示出nf-l水平升高(图17b;双因素anova,fdr<0.05,相互作用年龄-基因型p<0.05)。这些数据支持trem2发挥神经保护作用的观点。实施例8.在具有慢性脱髓鞘的trem2敲除小鼠中的脂质组学改变本实施例描述了来自具有慢性脱髓鞘的trem2敲除小鼠的前脑和分离的小胶质细胞、星形胶质细胞和csf的脂质组学。双环己酮草酰二腙饮食在小鼠中诱导脱髓鞘将与实施例1中所述相似的方法用于脱髓鞘方案。csf分离对于csf分离,使用2.5%阿佛丁(avertin)/叔戊醇麻醉小鼠。镇静后,在动物头骨的后部做一个矢状切口,露出小脑延髓池,用一根连接在玻璃毛细管上的针来穿刺小脑延髓池,收集csf。将csf转移到0.5ml的lo-bind管(eppendorf)中,在4℃下以12,000rpm旋转10分钟。将2μl的上清液转移到玻璃lcms小瓶中,并在分析lcms之前加入50μl含内标的甲醇。来自小鼠脑的小胶质细胞、星形胶质细胞和其他细胞的facs将与实施例1中所述相似的方法用于脑解离和facs方案。facs脂质提取和质谱分析使用与实施例2中所述相似的方法进行前脑、小胶质细胞、星形胶质细胞和csf的脂质提取和质谱法。trem2缺乏引起胆固醇酯在脑中积累如实施例6中所述,在慢性脱髓鞘后,野生型中的涉及脂质代谢的基因表达被强烈诱导,但在trem2–/–小胶质细胞中则不然(图14b和16a),所述基因包括六种蛋白质编码基因,所述蛋白质直接涉及胆固醇代谢、介导细胞外转运(apoe)、溶酶体中胆固醇酯的水解(lipa)、非酯化胆固醇从溶酶体排出(npc2)、胆固醇酯在脂滴中的合成和存储(soat1)、胆固醇酯在脂滴中的水解(nceh1)和25-羟基化(ch25h)(参见,例如图14b和16a)。因此,为了测试在cpz激发之后在trem2–/–小胶质细胞中的细胞内和细胞外胆固醇转运是否有缺陷,对来自含有胼胝体的冠状前脑切片的脂质提取物进行了lcms分析。在对照条件下未发现对照trem2+/+、trem2+/–和trem2–/–脑的脂质组学特征的差异(图17d)。急性脱髓鞘(cpz5周)后,检测到最小变化,其中在所有三种基因型中的胆固醇酯(ce)和氧化形式的ce(oxce)水平均升高(图17c)。随着慢性脱髓鞘(12周cpz),ce和oxce脂质种类显著升高(图17d-17e;双因素anova,fdr<0.05,相互作用p<0.01,持续12周cpz;还参见,实施例2,图3a-3c)。进一步的比较显示,与trem2+/+和trem2+/–12周cpz脑相比,具有慢性脱髓鞘的trem2缺陷型脑显著积累了包含多不饱和脂肪酸的ce种类,所述多不饱和脂肪酸比如ce22:6(二十二碳六烯酸,dha)以及在较小程度的ce20:4(花生四烯酸)(图17e;相互作用p<0.0001,双因素anova)。ce22:6在具有慢性脱髓鞘的trem2–/–脑中显示出最显著的增加,相比于trem2–/–对照脑上升38倍,并且相比于trem2+/+12周cpz脑上升2.5倍(图17e)。同样,以前报道过的仅在动脉粥样硬化病变中的oxce种类(choi等人,(2017).biochimbiophysactamolcellbiollipids1862,393-397;hutchins等人(2011).jlipidres52,2070-2083),在具有慢性脱髓鞘的trem2–/–脑中相比于trem2+/+对照脑显著上调,不过发现它们的水平比ce低得多(参见,实施例2,图3c)。尽管有显著的ce积累,但在脑中的胆固醇水平保持不变,这与胆固醇以比ce更大的量存在的事实一致(参见,实施例2,图3a)(martin等人(2014).emborep15,1036-1052)。神经节苷脂gm3在具有慢性脱髓鞘的trem2–/–脑中的水平也上升(参见,实施例2,图3f),这让人联想到见于c型尼曼-皮克病(一种溶酶体贮积病)中的内吞溶酶体缺陷(bissig,c.和gruenberg,j.(2013).coldspringharbperspectbiol5,a016816;zervas等人(2001).jneuropatholexpneurol60,49-64)。在cpz处理后,在trem2–/–脑中的其他中性脂质(比如tg)相对于对照也升高(参见,实施例2,图3e)。总体而言,这些数据表明,慢性脱髓鞘引起了胆固醇代谢的深刻改变,以及trem2缺陷型脑中特定脂质的改变。trem2缺乏引起分离自cpz处理小鼠的小胶质细胞中的胆固醇酯积累。为了研究ce积累主要是在细胞内还是在细胞外,开发了基于facs的脂质组学方法,用于以细胞类型特异性方式测量脂质种类。还收集和分析了csf,以评估cns中脂质的循环水平。从前脑的整个组织分析中观察到,与未处理的基因型对照相比,慢性脱髓鞘升高了trem2+/+、trem2+/–和trem2–/–小胶质细胞中某些脂质种类的水平。相比于暴露于慢性脱髓鞘的trem2+/+和trem2+/–小胶质细胞,trem2–/–小胶质细胞在慢性脱髓鞘后表现出某些脂质种类的丰度急剧增加,不过在没有cpz处理的对照小胶质细胞中没有显著的基因型依赖性效应(图18a;双因素anova,fdr<0.05)。引人注目的是,慢性脱髓鞘后脂质组学特征的变化对于小胶质细胞是独特的,因为富含星形胶质细胞的群体或csf没有显示任何显著的基因型特异性或cpz处理特异性改变(图18b和18c;双因素anova,fdr<0.05)。相比于具有对照饮食或5周双环己酮草酰二腙的trem2+/+、trem2+/-和trem2-/-小胶质细胞以及具有12周双环己酮草酰二腙的trem2+/+和trem2+/-小胶质细胞,在从具有12周双环己酮草酰二腙饮食的trem2-/-脑分离的小胶质细胞中检测到(图18d)胆固醇酯水平升高。通常,在从具有对照饮食或双环己酮草酰二腙饮食的trem2+/+、trem2+/-和trem2-/-脑分离的富含星形胶质细胞的细胞群(图18e)或csf(图18f)中检测到胆固醇酯的脂质水平没有变化。在慢性脱髓鞘后在trem2–/–小胶质细胞相对于星形胶质细胞中特异性地增加的脂质包括在前脑中鉴定的某些相同种类,比如ce18:1、ce20:4和ce22:6(图18d和18e;对于12周cpz,相互作用p<0.01,双因素anova),相比于对照,其在12周cpz处理后的trem2–/–小胶质细胞中升高8倍至43倍。进一步证实髓磷脂碎片在脱髓鞘后在trem2–/–小胶质细胞中积累,富含髓磷脂的脂质或其代谢产物以及神经节苷脂gm3在慢性脱髓鞘后独特地富集在trem2–/–小胶质细胞中,但在星形胶质细胞中没有变化(参见,实施例2,图4)。该数据表明,髓磷脂脂质能够被trem2–/–小胶质细胞吞噬,但随后未能随着时间的过去在小胶质细胞内适当地代谢和积累。另外,相比于对照,某些种类的bmp(像bmp36:2)在12周cpz处理后在trem2–/–小胶质细胞中升高(图18g和18h),可能表明溶酶体应激或功能障碍(bissig,c.和gruenberg,j.(2013).coldspringharbperspectbiol5,a016816;miranda等人,(2018).natcommun9,291)。相比于具有或没有cpz处理的trem2+/+、trem2+/–或trem2–/–csf,来自具有慢性脱髓鞘的trem2–/–小鼠的csf的lcms分析没有显示出任何显著的脂质组学差异(图18i-18m),表明在大量前脑组织中观察到的脂质积累并不反映细胞外积累,尽管不排除间隙液中的变化。这些数据表明,trem2缺陷型小胶质细胞能够在脱髓鞘过程中吞噬髓磷脂碎片,但不能适当地代谢或介导髓磷脂脂质的流出。实施例9.髓磷脂硫苷脂结合trem2并促进下游信号传导本实施例描述了使用体外系统更精确地描绘trem2–/–小胶质细胞中脂质积累增加的潜在机制。具体而言,表征了与trem2结合并通过trem2发出信号进而可以调节髓磷脂的吞噬清除的特异性髓磷脂脂质。脂质体制备将70摩尔%的dopc(1,2-油酰基-sn-甘油基-3-磷酸胆碱,avantipolarlipids)和30摩尔%的一种测试脂质合并在玻璃瓶中的氯仿中,并在n2气流下干燥1-2h,或直到完全干燥。测试脂质包括硫苷脂(avanti)、pops(avanti)、sm(avanti)、pi(avanti)、galcer(avanti)、pe(echelonbiosciences)和游离胆固醇(echelonbiosciences)。将脂质混合物重悬在hbss(1-2mg/ml最终脂质浓度)中,并涡旋2-3分钟。随后,将脂质悬浮液进行浴超声处理10分钟。表面等离子体共振实验,使用构造有一个100nm孔径的膜的avanti小型挤出机将脂质体挤出10次,以形成小的单层囊泡。trem2/dap12和dap12hek293稳定细胞系用表达野生型人trem2和dap12以及仅表达dap12的pbudce4.1哺乳动物表达载体(thermofisher)转染hek293细胞。选择稳定表达的克隆,并通过流式细胞术用apc缀合的大鼠抗人/小鼠trem2单克隆抗体(r&dmab17291)来评价细胞表面trem2表达。选择最高的野生型trem2表达克隆进行扩增。通过蛋白质印迹分析稳定表达dap12的克隆。psykalphalisa使用商业alphalisa测定法(perkinelmer)测量trem2依赖性psyk信号传导的活化。hek293细胞:实验前两天,将稳定地过表达trem2和dap12的hek293细胞以40,000个细胞/孔在96孔聚d-赖氨酸包被的板上进行平板接种。将分化的人巨噬细胞和bmdm以100,000个细胞/孔在组织培养处理的96孔板上进行平板接种。用hbss洗涤细胞一次,然后每孔添加50μl脂质体混合物。对于竞争实验,将htrem2-ecd或trem1-his(novoproteinscientific)与脂质体在室温孵育1小时,然后添加至细胞。将5μg/ml人特异性小鼠抗trem2(abnova)或15μg/ml小鼠特异性绵羊抗trem2(r&dsystems)添加到每个实验中作为阳性对照,其中并列同种型对照为5μg/ml小鼠igg3(r&dsystems)和15μg/ml多克隆绵羊igg(r&dsystems)。然后将细胞板转移到37℃培养箱中保持5分钟。弃去脂质体溶液和40ul裂解缓冲液(cellsignalingtechnologies,cst)。将裂解液在4℃孵育30分钟,然后在-80℃冷冻或立即进行alpha-lisa分析。使用perkinelmerpsykalphalisa试剂盒的标准方案测定裂解液。将10μl的裂解物/孔转移至白色不透明的384孔optiplate(perkinelmer)。每孔加入5μl的受体混合物(含有受体珠的工作溶液),然后将板用箔封纸密封并在室温孵育1小时。在减光条件下,将5μl供体混合物(含有供体珠的工作溶液)添加到每个孔中。再次将板密封并在室温孵育1小时。在perkinelmerenvision读板仪上使用alphalisa设置进行读板。加his标签的htrem2和htrem2r47hecd的重组表达和纯化将trem2的胞外结构域(残基19-172)亚克隆到prk载体中,其具有来自小鼠igκ链v-iii的分泌信号、在n末端区的氨基酸1-20和在c末端区的6x-his标签。根据制造商的说明,使用expi293tm表达系统试剂盒转染expi293ftm细胞,转染96小时后收获培养基上清液。向收获的培养基中补充1m咪唑(ph8.0),使其终浓度为10mm,过滤,然后上样到用上样缓冲液(20mmtrisph8.0、150mmnacl和10mm咪唑)平衡的hispurtmni-nta树脂上。用补充了50和100mm咪唑的上样缓冲液洗涤非特异性结合的蛋白质,并用20mmtrisph8.0、150mmnacl和200mm咪唑洗脱trem2胞外结构域。合并洗脱的蛋白质,并使用1xpbs作为运行缓冲液在hiloadsuperdex7516/600柱上进行尺寸排阻色谱。将洗脱级分通过sdspage进行分析,并进一步通过分析型尺寸排阻色谱法和完整蛋白质质量测定进行表征。使用表面等离子体共振(spr)的脂质结合分析使用seriesssensor芯片l1和biacoret200仪器(gehealthcare)在25℃进行结合分析。在包被脂质之前,用40μm的3-[(3胆酰胺丙基)二甲铵基]-1-丙磺酸盐(chaps)和40um的β-辛基葡糖苷以30μl/min的流速通过1分钟注入将传感器表面洗涤。通过30秒注入30%的乙醇洗去传感器表面上的残留洗涤剂。将1mg/ml硫苷脂/dopc或ps/dopc单层小囊泡以5μl/min经第二流通池注入15分钟。将第一流通池用dopc包被并用作参考表面。用两个短脉冲(15s)的10mmnaoh以30μl/min洗去松散结合的囊泡,随后注入0.1mg/ml牛血清白蛋白3分钟以封闭包被不良的表面。将重组htrem2-ecd或htrem2-r74h-ecd蛋白在pbs(0、0.19、0.56、1.7、5和15μm)中稀释,以30μl/min经两个流通池注入60秒,并且另外监测解离2分钟。在每次测量之间,通过注入10mmnaoh使脂质表面再生。通过使用biacoretmt200评价软件v3.1将平衡下的反应相对于浓度进行拟合而获得稳态亲和力。髓磷脂纯化和吞噬使用先前描述的方法从野生型c57bl/6小鼠脑(jackson实验室)纯化髓磷脂(safaiyan,等人,(2016).natneurosci19,995-998)。纯化后,将髓磷脂重悬于pbs中,并使用dc蛋白质测定试剂盒2(biorad,5000112)调节至1mg/ml的蛋白质浓度。按照制造商的建议,使用phrodoredmicroscale标记试剂盒(thermofisher,p35363)标记纯化的髓磷脂级分。在添加有5ng/ml小鼠m-csf的组织培养处理的96孔板(cellcarrier,perkinelmer)中,以每孔100,000个细胞的密度在rpmi/10%fbs/pen-strep中进行bmdm的平板接种。作为阴性对照,将10μm细胞松弛素d在髓磷脂前1小时添加至细胞,并在整个摄取测定法中予以保留。将细胞用cellmask深红血浆膜染色剂(1:5000,thermofisherc10046)和nucbluelivereadyprobes试剂(2滴/1ml,thermofisherr37605)在细胞培养基中在37℃预染色10分钟。将phrodo-髓磷脂在细胞培养基中稀释至5ug/ml,浴超声处理1分钟,然后添加至细胞保持2-4小时,并在operaphenixhcs系统(perkinelmer)上以15-30分钟的间隔进行实时成像(5%co2,37℃)。通过核和细胞膜染色鉴定单个细胞,然后使用harmonyhcasoftware(perkinelmer)将每孔每个细胞的phrodo摄取强度定量。结果在hek293细胞中存在或不存在人dap12的情况下,人trem2过表达。监测下游磷酸化syk(psyk)水平,以表征与ps相比在髓磷脂中发现的假定的trem2脂质配体的受体活化,其中ps在死细胞表面富集。并非所有含髓磷脂候选配体的脂质体都增加了trem2/dap12hek293细胞中的psyk水平。虽然pi和硫苷脂显著增加了psyk水平,但测试的其他脂质均未显示出高于dap12表达细胞或基线缓冲液刺激对照的显著psyk活化(图19a)。在具有trem2/dap12的内源性表达的系统中进一步表征脂质体诱导的trem2信号传导,使人外周血单核细胞分化为巨噬细胞。对于硫苷脂和ps的psyk水平,人巨噬细胞表现出脂质体剂量依赖性增加,但对于pi或galcer则不然(图19b)。随着添加重组trem2而不是trem1蛋白,响应于含硫苷脂的脂质体而增加的psyk降低至基线水平,从而证实了trem2的结合和信号传导的特异性(图19c)。某些trem2load变体,包括r47h在内,被认为降低了trem2与脂质配体的亲和力(kober等人(2016).elife5;ulland,t.k.和colonna,m.(2018).natrevneurol14,667-675;wang等人,(2015).cell160,1061-1071)。因此,通过表面等离子体共振(spr)测量来表征硫苷脂和ps对重组人野生型trem2(htrem2)和突变r47h(htrem2r47h)蛋白的细胞外结构域(ecd)的结合亲和力和动力学。将30%硫苷脂/70%pc和30%ps/70%pc脂质体包被到传感器芯片上,并使渐增浓度的htrem2ecd蛋白流过芯片,以评估与100%pc脂质体基线对照相比的结合特性。在最高分析物浓度下,htrem2对硫苷脂和ps脂质体表现出相似的的结合亲和力和反应,对应地,kd=6.8μm,反应单位(ru)=704,以及kd=5.6μm,ru=631(图19d和19e)。相比之下,htrem2r47h对硫苷脂和ps脂质体显示出降低的亲合力和较低的结合反应(即,ru),对应地,kd=20μm,ru=191,以及kd=14μm,ru=267,表明了配体特异性(图19d和19e)。较低的结合反应是由于较快的相互作用解离速率所致,这导致突变体trem2在脂质表面上的较短停留。在硫苷脂的情况下,对r47h变体观察到的亲和力和反应值降低的原因是,解离速率增快了5倍(硫苷脂)和2.4倍(ps),结合速率相对地相似(图19h-19k)。这个结果证明,硫苷脂结合trem2并通过后者发信号,并且r47hload变体在其与该脂质的相互作用方面显著受损。其他富含髓磷脂的脂质显得未结合trem2并通过后者发信号,其包括胆固醇、sm、pe、galcer和pi。证明trem2与硫苷脂脂质配体结合的这些研究表明,trem2缺陷型小胶质细胞可能在髓磷脂结合方面受损。为了评价急性trem2依赖性髓磷脂摄取,用phrodo缀合的髓磷脂处理trem2+/+和trem2–/–bmdm。在低浓度的m-csf(5ng/ml,已知驱动巨噬细胞分化和存活的因子)时,相比于trem2+/+,在trem2–/–bmdm中的phrodo髓磷脂吞噬降低(图19f)。然而,在高浓度的m-csf(50ng/ml)时,两种基因型的phrodo-髓磷脂吞噬变得更具可比性(图19g)。这些数据表明,高水平的m-csf可提供在trem2–/–bmdm的中的吞噬途径的代偿性上调,并且揭示在trem2缺陷型细胞中的吞噬缺陷可能是上下文相关的。实施例10.从trem2ko小鼠培养的bmdm和ipsc来源的小胶质细胞中的体外脂质存储增加本实施例描述了通过免疫细胞化学和质谱分析在体外培养并且用髓磷脂处理的trem2kobmdm中观察到的脂质存储表型。类似地评价了在ipsc来源的小胶质细胞中的脂质存储表型。使用与实施例3和9中所述相似的方法进行分析。考虑到ce是一种优先地在胞质脂滴中积累的中性脂质,将trem2+/+和trem2–/–bmdm用25μg/ml髓磷脂处理48小时,然后用尼罗红染色,通过荧光显微镜检查评估中性脂质存储。将细胞成像,并使用harmony软件上的斑点发现算法将尼罗红定量为总斑点面积。为了将髓磷脂的吞噬摄取的基因型特异性差异最小化,这些实验是在存在高m-csf(50μg/ml)的情况下进行的。图20a描绘了相比于wtbmdm在用髓磷脂处理的trem2kobmdm中的中性脂质积累增加,如尼罗红染色所示。随后的脂质组学分析揭示了在不存在髓磷脂处理情况下的最小基因型特异性脂质改变,但在具有髓磷脂处理的trem2–/–bmdm的脂质组中具有深刻变化,包括显著的ce种类ce18:2、ce20:4和ce22:5的基因型特异性积累(图21a;双因素anova,p<0.01;还参见,图20b)。游离胆固醇和不同种类的三酰基甘油(tg)、二酰基甘油(dg)和髓磷脂来源的糖鞘脂种类(hexcer)也在trem2–/–bmdm中积累(图20c和21a)。在全局上,这些脂质变化高度让人联想到在慢性cpz诱导的脱髓鞘之后在体内trem2–/–小胶质细胞中观察到的那些变化(参见,实施例8,图18a、18d;和实施例2,图4a-4p)。acat1将内质网中的游离胆固醇转化为ce。为了确定acat1在观察到的通过髓磷脂激发诱导的trem2–/–细胞中的脂质积累中的作用,将trem2+/+和trem2–/–bmdm用髓磷脂慢性处理48小时,并用acat1抑制剂(500nmk604)共同给药(ikenoya等人,(2007).atherosclerosis191,290-297)。图20b和21a显示,在acat抑制剂的存在下,大部分胆固醇酯在给予髓磷脂的wt和trem2kobmdm中都没有积累,表明胆固醇酯积累是acat依赖性的,并且髓磷脂衍生的胆固醇确实以酯化形式存储在脂滴中。通过k604没有挽救髓磷脂处理的trem2缺陷型bmdm中其他脂质的积累(图21a),这表明acat1抑制对ce的特异性。胆固醇显示为对照,并且在具有髓磷脂和acat抑制的trem2kobmdm中略有升高(图20c和21a)。用氧化ldl(oxldl)处理trem2+/+和trem2–/–bmdm,以确定在trem2–/–bmdm中的ce积累是否对髓磷脂吞噬是特异的,或者,其他的生理相关摄取机制是否会引起相似作用。首先,使用ldl作为对照,测试oxldl是否可结合并刺激trem2。使用在存在或不存在人dap12的情况下稳定地过表达人trem2的hek293细胞系,确定oxldl刺激趋向于升高psyk水平(图22a)。人巨噬细胞中的脂质体滴定显示,在oxldl刺激之后psyk水平呈剂量依赖性升高(图22b)。通过将oxldl用9μm的高浓度重组htrem2ecd预孵育,这种升高被减弱,但在较低浓度时,比如在脂质体/htrem2竞争实验中使用的那些浓度(3μm)则不然(图22c;还参见,实施例9,图19c)。这通过这样的事实得到证实,即,在用oxldl急性刺激之后,trem2–/–bmdm与trem2+/+bmdm具有相似的psyk水平(图22d)。在用50μg/mloxldl慢性处理时,当与trem2+/+bmdm相比时,trem2–/–bmdm表现出处理后中性脂质积累加剧,如通过尼罗红染色的总斑点面积增加所示(图22e;还参见,实施例3,图5a)。这种增加并不是由于trem2–/–bmdm对oxldl摄取增加所致,如与trem2+/+细胞相当的dii标记的oxldl内化所示(图22f)。通过lcms观察到,某些ce和tg种类显示出在用oxldl慢性处理的trem2–/–bmdm中增加加剧(图22g)。相比之下,hexcer、胆固醇和dg没有显示出显著的oxldl依赖性脂质组学变化(图22g)。k604在trem2–/–bmdm中在oxldl暴露后降低了特定种类的ce比如ce20:5和ce22:6的水平,虽然远不如在髓磷脂摄取实验中所见(图22g;学生t检验,p<0.05),其中没有升高胆固醇水平或改变其他脂质家族的水平。这些结果表明,在oxldl范式中,与髓磷脂范式相反,acat1只负责一部分ce在trem2缺陷型bmdm中的积累,这表明ce池在脂滴以外的细胞器(可能是溶酶体)中积累。如对于鼠bmdm所示,img能够吸收phrodo-髓磷脂,而trem2koimg在孵育4小时后相对于野生型img显示出髓磷脂摄取减少22%(n=4个技术重复)。尽管髓磷脂吞噬减少,但ce特别是ce20:4和ce22:6种类以及游离胆固醇存在着基因型特异性增加(图21b;双因素anova,对应地,对于ce和游离胆固醇,p<0.05和p<0.01)。正如在鼠bmdm的情况下,通过用acat1抑制剂k604共同处理消除了ce增加,但未消除游离胆固醇增加(图21b;学生t检验,p<0.05)。为了进一步描绘在trem2–/–img细胞中ce增加的潜在分子机制,用lxr激动剂gw3695处理来自两种基因型的img,所述激动剂增强了包括abca1/abcg1在内的胆固醇流出机制的表达。该化合物挽救了在髓磷脂处理的trem2+/+和trem2–/–img中测量的所有ce种类的积累(图21b;学生t检验,对应地,对于trem2+/+和trem2–/–img,p<0.01和p<0.05)。这些数据表明,trem2缺乏引起胆固醇流出缺陷,从而导致人img中ce的acat1抑制剂敏感池的积累。实施例11.在apoeko脑、分选的apoeko小胶质细胞、星形胶质细胞和神经元以及apoekocsf中的胆固醇酯积累.本实施例描述了来自具有慢性脱髓鞘的apoe敲除小鼠的前脑组织以及csf和分离的小胶质细胞、星形胶质细胞和神经元的脂质组学。进行这些实验是为了比较trem2相对于apoeko小鼠的表型,因为trem2ko小胶质细胞表达apoe的水平低得多。双环己酮草酰二腙饮食在小鼠中诱导脱髓鞘将与实施例1中所述相似的方法用于具有双环己酮草酰二腙的脱髓鞘方案。来自小鼠脑的小胶质细胞、星形胶质细胞和神经元的facs通常,将与实施例1中所述相似的方法用于脑解离和facs方案。为了分选神经元、星形胶质细胞和小胶质细胞群,使用了对每种细胞类型特异的独特标记抗体,以及用于排除死细胞的可固定活力染料bv510。facs脂质提取和质谱分析使用与实施例2中所述相似的方法进行小胶质细胞、星形胶质细胞和神经元的脂质提取和质谱法。图24显示了在存在或不存在通过4周的双环己酮草酰二腙饮食诱导的脱髓鞘的情况下在apoeko前脑中的总胆固醇酯(ce)积累。在不存在脱髓鞘的情况下,ce在ko前脑中积累,并且这种积累因双环己酮草酰二腙饮食而加剧。类似地,缺乏apoe和/或12周cpz处理通常引起脑ce水平显著升高(图27a)。图25显示了在存在或不存在脱髓鞘的情况下(4周cpz饮食与正常饮食相比)在apoeko中的ce的不同分子种类的积累。类似地,12周cpz处理导致ce18:1、20:4和22:6种类水平显著上升(图27b;来自双因素anova的主效应,fdr<0.05,p<0.001),并且apoe缺乏显著加剧了ce18:1和ce20:4的处理效应(基因型-治疗相互作用p<0.05)。相对于具有对照饮食的野生型前脑,在apoe–/–前脑中的ce18:1和ce22:6水平升高2.7倍和4倍。使用cpz饮食时,与野生型前脑相比,ce18:1、ce20:4和ce22:6的倍数变化分别为6.6、1.4和6.7。另外,两种bmp种类(bmp40:4和44:12)的水平在apoe–/–中更高,与溶酶体缺陷一致(图27b;p<0.05)。图26a显示,相比于从apoewt脑分离的小胶质细胞以及相比于从具有对照饮食的apoeko脑分离的小胶质细胞,诸如ce18:1、ce20:4和ce22:6的特定ce种类在从具有12周双环己酮草酰二腙饮食的apoeko脑分离的小胶质细胞中积累(还参见,图27c-27d)。图26b显示,在不存在脱髓鞘的情况下,诸如ce18:1和ce22:6的特定ce种类在从apoeko脑分离的星形胶质细胞中积累(还参见,图27e-27f)。相比于从具有12周双环己酮草酰二腙饮食的apoewt脑分离的星形胶质细胞以及相比于从具有对照饮食的apoeko脑分离的星形胶质细胞,这些ce种类更显著地在具有12周双环己酮草酰二腙饮食的apoeko星形胶质细胞中积累。图26c显示,在不存在脱髓鞘的情况下,诸如ce20:4和ce22:6的特定ce种类在从apoeko脑分离的神经元中积累。这些神经元ce种类不受双环己酮草酰二腙饮食的影响。在前脑或分选的神经胶质细胞中未发现游离胆固醇的变化(图27b和27d)。另外,与在trem2–/–csf中不同,ce在apoe–/–csf中升高,表明这些固醇在突变体脑中的普遍增加(图27g和27h)。这些数据表明,由apoe缺乏所致的胆固醇转运受损引起胆固醇的存储形式即,ce,在cns中特别是在神经胶质细胞中大量积累,其在csf中也可检出。在apoe下调的情况下trem2ko小胶质细胞表现出相似的ce储存的事实表明,这种生化表型可能源自胆固醇转运缺陷。实施例12.在从5xfad脑分离的小胶质细胞和星形胶质细胞中的胆固醇酯积累.本实施例描述了从5xfad脑分离的小胶质细胞和星形胶质细胞的脂质组学。来自小鼠脑的小胶质细胞和星形胶质细胞的facs将与实施例1中所述相似的方法用于脑解离和facs方案。facs脂质提取和质谱分析使用与实施例2中所述相似的方法进行小胶质细胞和星形胶质细胞的脂质提取和质谱法。图28a显示相对于源自wt小鼠的脑的小胶质细胞,源自5xfad小鼠的脑的小胶质细胞中的胆固醇酯(ce)的水平升高。与wt小鼠相比,诸如ce18:1、ce20:4和ce22:6的特定ce种类在源自5xfad小鼠的小胶质细胞中水平更高。图28b显示相对于源自wt小鼠的脑的星形胶质细胞,源自5xfad小鼠的脑的星形胶质细胞中的胆固醇酯(ce)的水平升高。虽然大多数ce种类在5xfad星形胶质细胞中上调,但程度比5xfad小胶质细胞中更小。动物为14个月大。n=每组4只动物。实施例13.在从trem2ko小鼠培养的bmdm中以及在人ipsc来源的trem2ko小胶质细胞中增强的体外炎症反应以及抗trem2抗体在髓磷脂处理的人ipsc来源的trem2ko小胶质细胞中的抗炎作用.使用与实施例3相似的方法收获/培养trem2wt和trem2kobmdm。将bmdm用媒介物或纯化的小鼠髓磷脂处理,随后用脂多糖(lps)刺激,以表征在trem2基因型、脂质积累和炎性细胞因子分泌之间的关系。以每孔100,000个细胞进行细胞的平板接种,并在24小时后用媒介物或25ug/ml髓磷脂处理48小时。在髓磷脂处理的最后16h,将0或10ng/ml的lps掺入孔中。收集细胞培养基,以3000×g旋转除去碎片,并在-80℃冷冻。通过evetechnologies的定量免疫测定法测量细胞因子水平。将trem2wt和ko人ipsc来源的小胶质细胞(img)以30,000个细胞/孔在聚d-赖氨酸包被的96孔板上进行平板接种,并通过在完全定义的无血清中枢神经系统细胞培养基中孵育而在稳态培养条件下培养。在添加lps之前将细胞用50μmcasp-1抑制剂((invivogen,#vx-765)处理1h。将培养基更换为含1μg/mllps(invivogen)的培养基。3小时后,用5mmatp掺入细胞持续另外的1小时。然后收获50μl培养基,快速冷冻,并通过定量免疫测定法(evetechnologies公司)测定il-1β蛋白水平。将img也用25ug/ml髓磷脂处理24小时,然后用100nm的对照抗体(抗rsv)或抗trem2抗体处理48小时。通过qpcr测量il-1βmrna水平,并将其归一化为gapdh。n=2个生物学重复。图29a-29i显示在lps刺激(10ng/ml)和髓磷脂处理后的trem2ko鼠bmdm中的炎性细胞因子产生增加。相对于trem2wtbmdm,通过定量免疫测定法(evetechnologies)测量到以下细胞因子在trem2ko中增加:(图29a)g-csf、(图29b)infy、(图29c)il-12(p40)、(图29d)il-12(p70)、(图29e)lix(cxcl5)、(图29f)mcp-1(ccl2)、(图29g)mig(cxcl9)、(图29h)il-1a和(图29i)il-1b。数据代表均值±sem,n=2个技术重复。图30a-30b显示了在人ipsc来源的trem2ko小胶质细胞中的il-1β细胞因子反应因抗trem2抗体而增强,并且il-1βmrna反应被降低。图30a显示,trem2koipsc来源的小胶质细胞在用lps和atp处理小胶质细胞之后具有增强的炎症小体反应和il-1β细胞因子分泌。图30b显示,在用髓磷脂处理小胶质细胞之后,抗trem2抗体降低了il-1βmrna水平。实施例14.髓磷脂处理的trem2ko人ipsc来源的小胶质细胞(img)中脂质代谢基因和蛋白质分泌的差异调节本实施例描述了用媒介物或髓磷脂处理的wt和trem2ko人ipsc来源的小胶质细胞(img)中的基因表达和蛋白质分泌分析。ipsc小胶质细胞方法使用与实施例3相似的方法生成trem2wt和trem2ko人img。基因表达分析将trem2wt和trem2ko人ipsc来源的小胶质细胞(img)以每孔30,000个细胞在聚d-赖氨酸包被的96孔板上进行平板接种。将细胞用媒介物或25ug/ml的纯化髓磷脂处理24小时,然后裂解,收集rna。通过qpcr测量选择的脂质代谢基因的mrna水平,并归一化为gapdh。如图31所示,abca1(图31a)和abcg1(图31c)mrna水平响应于trem2wt和trem2koimg中的髓磷脂而升高,并且在媒介物和髓磷脂处理的条件下,与trem2wtimg相比,在trem2koimg中的mrna水平更高。abca7(图31b)和ldlr(图31k)mrna响应于髓磷脂而降低,但是与trem2wtimg相比,trem2ko中的mrna更高。在媒介物和髓磷脂处理的条件下,与trem2wtimg相比,在trem2ko中的apoc1(图31d)、apoe(图31e)、ch25h(图31f)、fabp3(图31g)、fabp5(图31h)、lpl(图31i)、olr1(图31j)和lipa(图31l)mrna水平较低。蛋白质分泌分析将trem2wt和trem2ko人ipsc来源的小胶质细胞(img)以每孔30,000个细胞在聚d-赖氨酸包被的96孔板上进行平板接种。将细胞用媒介物或25ug/ml的纯化髓磷脂处理48h,随后收集上清液用于msd分析。将细胞裂解,进行bca测定法,以确定蛋白质浓度,并将msd数据归一化为这些裂解物浓度。图32显示,髓磷脂在trem2ko和trem2wtimg中都使分泌的apoe(图32a)和apoc1(图32b)蛋白增加,但在trem2ko细胞中的apoe和apoc1水平在两种条件下均较低。这些数据进一步表明,缺乏trem2引起apoe功能降低,这与在trem2缺陷型小胶质细胞中观察到的脂质积累一致。另外,降低的apoc1水平表明,除apoe以外的其他载脂蛋白的功能降低有助于trem2缺陷型小胶质细胞的脂质表型。将所有出版物、专利和专利文件通过引用并入本文,正如通过引用单独并入一样。已参考各种具体和优选的实施方案和技术描述了本公开。然而,应当理解的是,在保持在本发明的精神和范围内的同时,可以作出许多变化和修改。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1