猪链球菌、副猪嗜血杆菌和猪支气管败血波氏杆菌三重荧光PCR检测的引物、探针及方法与流程
本发明属于核酸检测领域,具体涉及猪链球菌、副猪嗜血杆菌和猪支气管败血波氏杆菌三重荧光pcr检测的引物、探针及方法。
背景技术:
呼吸道疾病一直是困扰我国养猪业的一大难题,其中猪链球菌、副猪嗜血杆菌、猪支气管败血波氏杆菌是目前猪群呼吸道疫病中主要的病原菌,且这三种病菌还往往是混合感染。混合感染会增加病原对机体的损伤,提高猪呼吸道疾病综合征的发病率和死亡率。
猪链球菌引起的猪链球菌病是一种急性人畜共患传染病。它会引起败血症、关节炎、脑膜炎和心内膜炎,从而导致巨大的经济损失。猪链球菌有荚膜,为革兰氏阳性菌,常单独出现或成对出现,偶尔出现短链,猪链球菌在血平板培养后有明显的α或β溶血环。猪链球菌根据其荚膜多糖抗原性的差异分为35个血清型,其中2型(ss2)流行最广,致病力最强,是疫情监控和病原鉴定的首要检测对象。
副猪嗜血杆菌是猪上呼吸道中的共生革兰氏阴性细菌病原体。它是格拉瑟氏病的病原体,一种以多关节炎,纤维蛋白性多浆膜炎和脑膜炎为特征的全身性疾病。副猪嗜血杆菌是仔猪高死亡率的主要致病因素,已经成为危害养猪业发展的关键细菌性传染病。除一部分分离菌株无法鉴定其血清型外,副猪嗜血杆菌血清型已被鉴定出有十五种,血清型不同,毒力也具有很大差异。从世界范围来看4、5、13型较为流行,国内以4型和5型较为流行。副猪嗜血杆菌常与猪的几种重要病原体并发感染,目前已发现其可以与猪流感病毒、猪呼吸与繁殖障碍综合征病毒以及圆环病毒引起混合感染。
猪支气管败血波氏杆菌可引起猪发生非进行性萎缩性鼻炎和支气管炎,也是猪呼吸道综合征的重要致病因子之一。近年来随着中国集约化养猪业的发展及猪的引种、调动频繁,由猪支气管败血波氏杆菌引起的非进行性萎缩性鼻炎、猪呼吸道综合征等疾病也随之扩散蔓延,造成较大经济损失。猪支气管败血波氏杆菌和其它多种病原体,如多杀性巴氏杆菌、猪链球菌、副猪嗜血杆菌、绿脓杆菌、猪繁殖与呼吸综合征病毒、猪流感病毒、圆环病毒等有协同致病作用,这样的协同作用可提高呼吸道疾病的发病率并增加疾病的严重程度,造成严重损失。
猪链球菌病、副猪嗜血杆菌病、猪支气管败血波氏杆菌病这几种疫病的临床症状相似,混合感染和继发感染更是给诊断带来困难。目前,对它们的检测方法多采用细菌分离鉴定、补体结合实验、间接血凝实验、elisa和免疫组化等检测方法,存在灵敏度和准确度较低,耗时较长等问题。pcr方法也可用于上述3种病原体的检测,但是鉴于现有的pcr检测方法多为单荧光检测,无法实现单管内同时检测猪链球菌病、副猪嗜血杆菌病和猪支气管败血波氏杆菌,增加了检测及监测的工作量和成本。
技术实现要素:
为解决上述问题,本发明提供猪链球菌、副猪嗜血杆菌和猪支气管败血波氏杆菌三重荧光pcr检测的引物、探针及方法,该检测方法灵敏度高,特异性强,具有较好重复性。
为了实现上述目的,本发明采用的技术方案为:
猪链球菌、副猪嗜血杆菌和猪支气管败血波氏杆菌三重荧光pcr检测的引物和探针,其特征在于:引物的核苷酸序列为:
猪链球菌上游引物suis-gdhqf:5’-gtcatggactcgtgaagaagtag-3’(seqidno:1);
猪链球菌下游引物suis-gdhqr:5’-gtagtctgtaccaaggtcgtattt-3’(seqidno:2);
副猪嗜血杆菌上游引物hpsqf:5’-gcgtagtatcgggagatgaaag-3’(seqidno:3);
副猪嗜血杆菌下游引物hpsqr:5’-tagagatcgtcggcttggtagg-3’(seqidno:4);
猪支气管败血波氏杆菌上游引物bbqf:5’-ggcttcttcaaaccgggcagct-3’(seqidno:5);
猪支气管败血波氏杆菌下游引物bbqr:5’-gtcgcaaacctgccgtaatccag-3’(seqidno:6);
探针的核苷酸序列为:
猪链球菌特异探针suis-gdhqp:5’-x1-ttggctgtgttgaagatgttggcc-y1-3’(seqidno:7);
副猪嗜血杆菌特异探针hpsqp:5’-x2-accgcaaggccagttgccataagat-y2-3’(seqidno:8);
猪支气管败血波氏杆菌的特异探针bbqp:5’-x3-ccgcccatctgtaacatcggactt-y3-3’(seqidno:9)。
进一步的,探针序列5’端标记的荧光基团x1、x2和x3分别为fam、hex、cy5、joe、rox中的一种,且x1、x2、x3互不相同,探针序列3’端标记的淬灭基团y1、y2和y3分别为bhq1、bhq2、bhq3、tamra中的一种。
进一步的,猪链球菌特异探针suis-gdhqp:5’-fam-ttggctgtgttgaagatgttggcc-bhq2-3’;
副猪嗜血杆菌特异探针hpsqp:5’-hex-accgcaaggccagttgccataagat-bhq1-3’;
猪支气管败血波氏杆菌特异探针bbqp:5’-cy5-ccgcccatctgtaacatcggactt-bhq2-3’。
本发明还提供猪链球菌、副猪嗜血杆菌和猪支气管败血波氏杆菌三重荧光pcr检测的方法,其特征在于:具体步骤为:
步骤一、计算猪链球菌、副猪嗜血杆菌和猪支气管败血波氏杆菌标准样品的基因组dna拷贝数,将猪链球菌、副猪嗜血杆菌和猪支气管败血波氏杆菌标准样品分别稀释成106、105、104、103、102数量级拷贝数;
步骤二、以步骤一得到的不同浓度的猪链球菌、副猪嗜血杆菌和猪支气管败血波氏杆菌基因组不同浓度的标准样品和提取的待测样品为模板,分别用权利要求1所述的引物suis-gdhqf、suis-gdhqr、hpsqf、hpsqr、bbqf和bbqr,及权利要求1或权利要求2所述的探针suis-gdhqp、hpsqp和bbqp进行荧光定量pcr扩增反应;
步骤三、根据荧光定量pcr扩增cq值和反应荧光信号变化及强度,对待测样品中的猪链球菌、副猪嗜血杆菌和猪支气管败血波氏杆菌中的目标基因进行定性和定量分析。
进一步的,步骤一和步骤二中,荧光定量pcr扩增反应体系包括:2×premixextaq(probeqpcr)10μl,引物suis-gdhqf、suis-gdhqr、hpsqf、hpsqr、bbqr和bbqf的终浓度分别为0.3μm,探针suis-gdhqp、hpsqp和bbqp的终浓度分别为0.15μm,dna模板2μl,双蒸水补足扩增反应体系至20μl。
进一步的,步骤一和步骤二中,荧光定量pcr扩增程序为:95℃预变性3min,95℃变性10s,56℃退火30s,循环40次。
进一步的,步骤三中,结果分析包括定性分析和定量分析,分析的具体过程为:
1)定性分析:出现探针suis-gdhqp5’端标记的荧光基团x1的荧光扩增曲线且cq值<35时,说明猪链球菌阳性,出现探针hpsqp5’端标记的荧光基团x2的荧光扩增曲线且cq值<35时,说明副猪嗜血杆菌阳性,出现探针bbqp5’端标记的荧光基团x3的荧光扩增曲线且cq值<35时,说明猪支气管败血波氏杆菌阳性;未出现荧光扩增曲线时,表明样品中不含有猪链球菌、副猪嗜血杆菌和猪支气管败血波氏杆菌,为阴性;
2)定量分析:根据稀释的不同浓度的标准品的pcr扩增反应标准曲线,将待测样品的猪链球菌、副猪嗜血杆菌或猪支气管败血波氏杆菌的检测cq值带入标准曲线公式,计算样品中含有的猪链球菌、副猪嗜血杆菌或猪支气管败血波氏杆菌的基因拷贝数。
进一步的,步骤二中的荧光定量pcr扩增反应还在5通道或5通道以上荧光定量pcr仪上进行检测。
本发明的有益效果为:
1、本发明的猪链球菌、副猪嗜血杆菌和猪支气管败血波氏杆菌三重荧光pcr检测的引物、探针及方法,引物和探针分别根据猪链球菌的gdh基因、副猪嗜血杆菌的16srrna基因和猪支气管败血波氏杆菌的fla基因设计并且合成,建立的猪链球菌、副猪嗜血杆菌和猪支气管败血波氏杆菌三重荧光pcr检测的引物、探针及方法可以对上述3种细菌同时进行定性及定量的检测,相比现有的检测技术,减少了检测时间及检测成本;
2、本发明的检测方法灵敏度高,能够特异性的识别猪链球菌、副猪嗜血杆菌和猪支气管败血波氏杆菌,对其他杂菌无反应,具有良好的特异性及重复性;
3、检测时间短、准确度高、可靠性强,检测周期短,能在1.5小时内完成,能实现实时监测,具有很高的可行性与应用前景。
附图说明
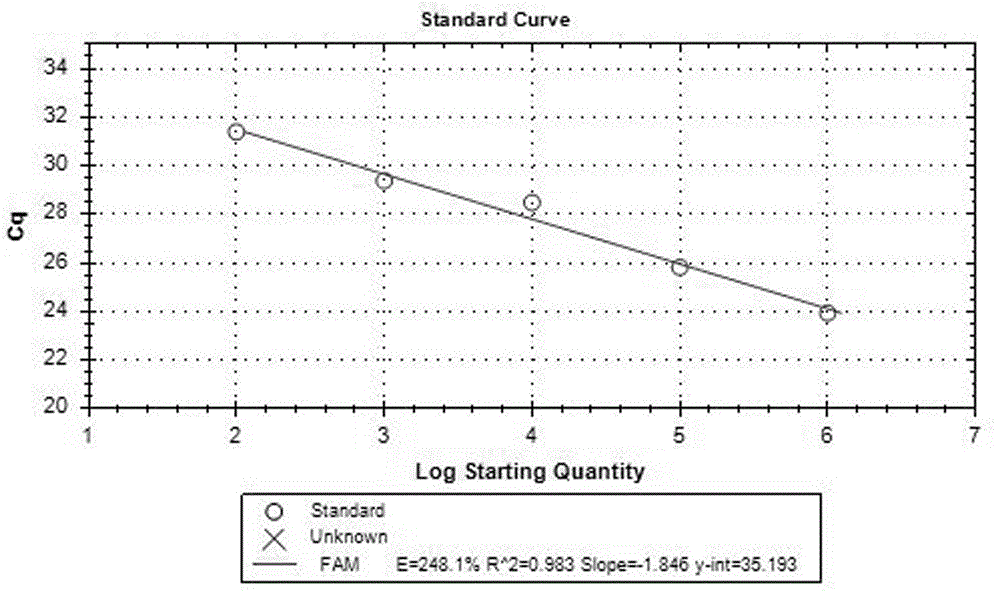
图1为猪链球菌标准曲线图;
图2为副猪嗜血杆菌标准曲线图;
图3为猪支气管败血波氏杆菌标准曲线图;
图4为猪链球菌、副猪嗜血杆菌、猪支气管败血波氏杆菌三重荧光pcr结果;
图5为猪链球菌模板分别为10ng、1ng、0.1ng、0.01ng、0.001ng时的灵敏度扩增曲线图;
图6为副猪嗜血杆菌模板分别为10ng、1ng、0.1ng、0.01ng、0.001ng时的灵敏度扩增曲线图;
图7为猪支气管败血波氏杆菌模板分别为10ng、1ng、0.1ng、0.01ng、0.001ng时的灵敏度扩增曲线图。
具体实施方式
为了本领域的技术人员能够更好地理解本发明所提供的技术方案,下面结合具体实施例进行阐述。
猪链球菌、副猪嗜血杆菌和猪支气管败血波氏杆菌三重荧光pcr检测的引物和探针基于猪链球菌的gdh基因序列、副猪嗜血杆菌的16srrna基因序列和猪支气管败血波氏杆菌的fla基因序列作为检测序列设计。
猪链球菌、副猪嗜血杆菌和猪支气管败血波氏杆菌三重荧光pcr检测的方法中,还包括制备标准品、建立标准曲线的步骤:
(1)制备标准品:
猪链球菌基因组-标准品制备:初始浓度为30ng/μl,猪链球菌基因组大小为2.176mb,copy数=(6.02×1023)×(30ng/μl×10-9)/(2.176×106×660)=1.25×107copies/μl;
副猪嗜血杆菌基因组-标准品制备:初始浓度为30ng/μl,副猪嗜血杆菌基因组大小为2.248mb,copy数=(6.02×1023)×(30ng/μl×10-9)/(2.248×106×660)=1.23×107copies/μl;
猪支气管败血波氏杆菌基因组-标准品制备:初始浓度为60ng/μl,猪支气管败血波氏杆菌基因组大小为5.199mb,copy数=(6.02×1023)×(60ng/μl×10-9)/(5.199×106×660)=1.05×107copies/μl;
(2)建立标准曲线:
将猪链球菌、副猪嗜血杆菌、猪支气管败血波氏杆菌基因组dna分别从1.25×107copies/μl、1.23×107copies/μl和1.05×107copies/μl按10×逐级稀释5个梯度,即106、105、104、103、102数量级拷贝数。以5个梯度标准品为模板,再分别进行荧光定量pcr,以基因组标准品浓度的对数值为x轴,cq值为y轴,绘制标准曲线;
在建立标准曲线后,还以提取的dna为模板进行荧光定量检测,用得到的cq值及荧光信号的变化,实现对猪链球菌、副猪嗜血杆菌、猪支气管败血波氏杆菌的定性检测,再根据cq值和建立的标准曲线,得出待测样品中所含猪链球菌、副猪嗜血杆菌、猪支气管败血波氏杆菌的拷贝数,实现定量检测。
本发明中所用实验材料包括:猪链球菌、副猪嗜血杆菌、猪支气管败血波氏杆菌、金黄色葡萄球菌、大肠杆菌、血链球菌、无乳链球菌、戈登链球菌、猪胸膜肺炎放线杆菌、枯草芽孢杆菌、铜绿假单胞菌、猪多杀性巴氏杆菌。
实施例1
猪链球菌、副猪嗜血杆菌和猪支气管败血波氏杆菌靶基因的选择和引物设计,猪链球菌(suis)、副猪嗜血杆菌(hps)、猪支气管败血波氏杆菌(bb)分别以gdh基因、16srrna基因及fla基因为特异性靶基因引物的核苷酸序列,表1为设计的引物及探针的核苷酸序列。
表1引物及探针的核苷酸序列:
之后以设计的引物及探针为基础进行猪链球菌、副猪嗜血杆菌和猪支气管败血波氏杆菌三重荧光pcr检测:
步骤一、标准样品的制备:
猪链球菌基因组-标准品制备:初始浓度为30ng/μl,猪链球菌基因组大小为2.176mb,copy数=(6.02×1023)×(30ng/μl×10-9)/(2.176×106×660)=1.25×107copies/μl;
副猪嗜血杆菌基因组-标准品制备:初始浓度为30ng/μl,副猪嗜血杆菌基因组大小为2.248mb,copy数=(6.02×1023)×(30ng/μl×10-9)/(2.248×106×660)=1.23×107copies/μl;
猪支气管败血波氏杆菌基因组-标准品制备:初始浓度为30ng/μl,猪支气管败血波氏杆菌基因组大小为5.199mb,copy数=(6.02×1023)×(60ng/μl×10-9)/(5.199×106×660)=1.05×107copies/μl;
将猪链球菌、副猪嗜血杆菌、猪支气管败血波氏杆菌基因组dna分别从1.25×107copies/μl、1.23×107copies/μl和1.05×107copies/μl按10×逐级稀释5个梯度,即106、105、104、103、102数量级拷贝数。
步骤二、不同浓度的标准样品和提取的待测样品的荧光定量pcr扩增反应:
选用20μl的实时荧光pcr扩增体系,表2为荧光pcr扩增体系:
表2pcr反应扩增体系
荧光定量pcr扩增程序为:95℃预变性3min,95℃变性10s,56℃退火30s,循环40次。
①以步骤一得到的5个梯度标准品为模板,以上述的荧光pcr扩增体系及荧光定量pcr扩增程序为基础进行实时荧光定量pcr检测,以基因组标准品浓度的对数值为x轴,cq值为y轴,生成标准曲线,同时对待检样本进行精确定量。
建立的相对应的定量标准曲线,如图1、图2和图3所示,线性回归方程分别为:
猪链球菌,荧光信号为fam,标准曲线为:y=-1.846x+35.193,r2=0.983;
副猪嗜血杆菌,荧光信号为hex,标准曲线为:y=-2.503x+31.274,r2=0.999;
猪支气管败血波氏杆菌,荧光信号为cy5,标准曲线为:y=-2.775x+37.195,r2=0.995。
②提取待测样品,猪链球菌、副猪嗜血杆菌、猪支气管败血波氏杆菌样品提取采用细菌dna提取试剂盒提取,提取的基因组dna经紫外分光光度计测定其纯度和浓度。测定od260/od280值均为1.8~1.9左右,浓度在10ng/μl以上,dna纯度较高,浓度适中,符合pcr扩增要求。
以提取到的猪链球菌、副猪嗜血杆菌、猪支气管败血波氏杆菌样品的总dna为模板,在表2的反应体系内,使用上述荧光定量pcr扩增体系和条件进行荧光定量pcr。
步骤三、结果分析:
设立猪链球菌、副猪嗜血杆菌、猪支气管败血波氏杆菌阳性对照、阴性对照及空白对照,试验结束后打开分析软件,分析实验结果,根据探针荧光信号及扩增曲线cq值来判定待测样品是否为猪链球菌、副猪嗜血杆菌、猪支气管败血波氏杆菌。图4为猪链球菌、副猪嗜血杆菌、猪支气管败血波氏杆菌三重荧光pcr结果,猪链球菌、副猪嗜血杆菌、猪支气管败血波氏杆菌都有扩增曲线时,且满足cq值<35说明待测样品包括猪链球菌、副猪嗜血杆菌、猪支气管败血波氏杆菌,具体的,当出现探针suis-gdhqp5’端标记的荧光基团x1的荧光扩增曲线且cq值<35时,说明猪链球菌阳性,出现探针hpsqp5’端标记的荧光基团x2的荧光扩增曲线且cq值<35时,说明副猪嗜血杆菌阳性,出现探针bbqp5’端标记的荧光基团x3的荧光扩增曲线且cq值<35时,说明猪支气管败血波氏杆菌阳性;未出现荧光扩增曲线时,表明样品中不含有猪链球菌、副猪嗜血杆菌和猪支气管败血波氏杆菌,为阴性。定量测量则根据cq值和上述猪链球菌、副猪嗜血杆菌、猪支气管败血波氏杆菌的标准曲线分别计算猪链球菌、副猪嗜血杆菌、猪支气管败血波氏杆菌的拷贝数。
实施例2
其他对照细菌样本dna提取同样采用细菌dna提取试剂盒提取,提取的基因组dna经紫外分光光度计测定其纯度和浓度。测定od260/od280值均为1.8~1.9左右,浓度在10ng/μl以上,dna纯度较高,浓度适中,符合pcr扩增要求。进一步的对本发明的猪链球菌、副猪嗜血杆菌和猪支气管败血波氏杆菌三重荧光pcr检测的引物、探针及方法进行特异性验证:利用本发明设计的引物和探针,分别以猪链球菌、副猪嗜血杆菌、猪支气管败血波氏杆菌、金黄色葡萄球菌、大肠杆菌、血链球菌、无乳链球菌、戈登链球菌、猪胸膜肺炎放线杆菌、枯草芽孢杆菌、铜绿假单胞菌、猪多杀性巴氏杆菌的总基因组dna为模板,以表2中的荧光pcr扩增体系及荧光定量pcr扩增程序,进行实时荧光pcr检测,验证其引物和探针的特异性。表3为荧光pcr检测的特异性验证试验结果:
表3荧光pcr检测的特异性验证试验结果
实施例3
对本发明的猪链球菌、副猪嗜血杆菌和猪支气管败血波氏杆菌三重荧光pcr检测的引物、探针及方法进行灵敏度验证:将猪链球菌、副猪嗜血杆菌、猪支气管败血波氏杆菌的基因组dna分别定量到5ng/μl,按10×梯度稀释,每个梯度均取2.0μl为模板量,(即:10ng、1ng、0.1ng、0.01ng、0.001ng、0.0001ng、0.00001ng),以表2中的荧光pcr扩增体系及荧光定量pcr扩增程序,进行实时荧光定量pcr检测,利用本发明设计的引物和探针,进行实时荧光定量pcr检测,评估本发明的检测限。图5为猪链球菌模板分别为10ng、1ng、0.1ng、0.01ng、0.001ng时的灵敏扩增曲线图,其最低检出限为0.01ng;图6为副猪嗜血杆菌模板分别为10ng、1ng、0.1ng、0.01ng、0.001ng时的灵敏度扩增曲线图,其最低检出限为0.01ng;图7为猪支气管败血波氏杆菌模板分别为10ng、1ng、0.1ng、0.01ng、0.001ng时的灵敏度扩增曲线图,其最低检出限为0.01ng。由此结果可看出,猪链球菌、副猪嗜血杆菌和猪支气管败血波氏杆菌灵敏度均为0.01ng,结果表明本方法定量检测限为0.01ng,本发明所提供的方法具有很高的灵敏度,相对于普通pcr灵敏度更高。
实施例4
使用本发明的猪链球菌、副猪嗜血杆菌和猪支气管败血波氏杆菌三重荧光pcr检测的引物、探针及方法对20份临床可疑样本进行检测:样本类型包括洛阳等不同地区的病料和血清。20份临床可疑样本的来源及编号,同时使用病毒分离方法和测序进行检测。表4为20份临床可疑样本检测结果,结果显示本发明所建立的方法与病毒分离后测序结果验证完全一致,本方法准确、可靠。
表420份临床可疑样本检测结果
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
sequencelisting
<110>洛阳师范学院
<120>猪链球菌、副猪嗜血杆菌和猪支气管败血波氏杆菌三重荧光pcr检测的引物
、探针及方法
<130>1
<160>9
<170>patentinversion3.3
<210>1
<211>23
<212>dna
<213>人工序列
<400>1
gtcatggactcgtgaagaagtag23
<210>2
<211>24
<212>dna
<213>人工序列
<400>2
gtagtctgtaccaaggtcgtattt24
<210>3
<211>22
<212>dna
<213>人工序列
<400>3
gcgtagtatcgggagatgaaag22
<210>4
<211>22
<212>dna
<213>人工序列
<400>4
tagagatcgtcggcttggtagg22
<210>5
<211>22
<212>dna
<213>人工序列
<400>5
ggcttcttcaaaccgggcagct22
<210>6
<211>23
<212>dna
<213>人工序列
<400>6
gtcgcaaacctgccgtaatccag23
<210>7
<211>24
<212>dna
<213>人工序列
<400>7
ttggctgtgttgaagatgttggcc24
<210>8
<211>25
<212>dna
<213>人工序列
<400>8
accgcaaggccagttgccataagat25
<210>9
<211>24
<212>dna
<213>人工序列
<400>9
ccgcccatctgtaacatcggactt24
- 还没有人留言评论。精彩留言会获得点赞!