一种筛选莱茵衣藻周期调控缺陷突变体的方法与流程
本发明属于微生物技术领域,具体涉及一种筛选莱茵衣藻周期调控缺陷突变体的方法。
背景技术:
莱茵衣藻是一种单细胞真核藻类,特点在于生长迅速,世代周期短,细胞周期调控方式简单,易于培养,能用tap液体培养基吹气培养,也能在平板上生长单克隆等优点而被选为模式生物,广泛用来研究光合作用,脂质代谢,纤毛运动,细胞分裂等过程。前人的研究也已经证明了衣藻的重要研究价值就是其简单的突变体获取方式,如1930年moiwus就已经能成功分离衣藻细胞的突变体。现如今更是可以通过电转的方法来高效快速获取大量突变体,并以此为基础来从中筛选感兴趣性状的突变体。
衣藻细胞周期调控涉及到衣藻纤毛去组装、释放中心体、形成纺锤体,以及后续的细胞分裂等的调控,每一个环节的缺陷都会造成周期的紊乱,从而影响其增殖。因此,在衣藻体系中,其纤毛周期与其细胞周期又是相互偶联的,因此为了探索纤毛周期的异样,可以以衣藻细胞周期异常的为突破口来对其进行深入性的研究。
多种其他种系的细胞作为研究细胞周期调控的报道很多,但是以衣藻作为实验材料来研究细胞周期调控缺陷,其自身具有很多优势:1.衣藻在光照或者黑暗条件下均可生长,既可以异养又可以自养;2.衣藻属于单倍体,突变体的制备和筛选相对而言比较容易,可用各种筛选基因(如,aphviii基因、arg7基因、nit1基因、ble基因等等);3.衣藻的细胞周期与纤毛周期相偶联,对于研究纤毛的研究者更加有实际意义;4..衣藻基因组测序已全部完成并且不断更新,“phytozomev12.1:home”有衣藻基因组序列信息,方便突变体筛选后续的序列比对(https://phytozome.jgi.doe.gov/pz/portal.html)。
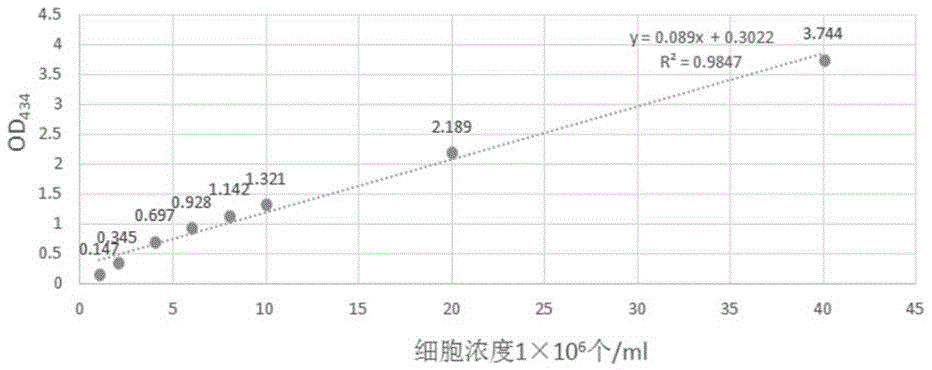
根据之前所报道的衣藻细胞浓度可以通过吸光值od434间接反映,发明人建立了本发明中衣藻细胞od434标准曲线。本发明通过发明人所建立的随机插入突变体文库,而后经过初筛根据单克隆直径大小,复筛再利用酶标仪od434检测细胞浓度,从而计算24h与48h的吸光值比值,从而参照野生型复制比,筛选和鉴定衣藻细胞周期调控缺陷的突变体的方法。该方法操作简便,效率较高,能够快速且稳定的获得细胞周期调控缺陷的突变体,为后续的实验打下了基础。
技术实现要素:
本发明的目的在于提供一种稳定高效筛选和鉴定衣藻细胞周期调控缺陷突变体的方法。该方法可实现高效获得大量具有稳定遗传特性的衣藻突变体藻株,也验证了酶标仪可以通过测量两个时间点的衣藻细胞浓度,能够快捷的筛选和鉴定出细胞周期调控缺陷的衣藻,同时具备操作方法简便、易于推广应用、耗费时间短等优点。
为了实现上述发明目的,本发明采用以下技术方案:
一种筛选莱茵衣藻周期调控缺陷突变体的方法,包括以下步骤:
步骤1,配制tap液体培养基、tap固体培养基、含巴龙霉素的tap固体培养基,备用;
步骤2,将莱茵衣藻21gr接种于tap液体培养基中,在22.5-23.5℃、8000lx光强下连续光照并通气培养,经过转接与继续培养、处理后,即可进行转化;
步骤3,采用电击法向衣藻细胞中插入筛选基因片段aphviii,造成随机位点突变,涂布于含巴龙霉素的tap固体培养基平板,经过7-10天光周期培养,得到突变体文库单克隆藻;
步骤4,挑取直径异常的单克隆藻落转移至tap固体培养基平板,进行培养;
步骤5,挑取步骤4培养的藻24孔板进行培养后,再利用酶标仪od434检测24h与48h两个时间点的藻液吸光值,计算吸光值比值,记为复制比,以未进行突变的野生型的复制比为标准,筛选获得在同样的时间段内复制比明显低于或高于野生型的,即得到目标周期调控缺陷突变体。
进一步地,所述tap液体培养基的组成为:25ml/l的tap盐溶液、0.375ml/l的磷酸盐溶液、1ml/l的hutner微量元素溶液、1ml/l的乙酸、2.42g/l的tris;
其中:tap盐溶液的组成为:nh4cl15g/l、mgso4•7h2o4g/l、cacl2•2h2o2g/l;磷酸盐溶液的组成为:k2hpo4288g/l、kh2po4144g/l;hutner微量元素溶液的组成为:edta二钠盐50g/l、znso4•7h2o22g/l、h3bo311.4g/l、mncl2•4h2o5.06g/l、cocl•6h2o1.61g/l、cuso4•5h2o1.57g/l、(nh4)6mo7o24•4h2o1.1g/l、feso4•7h2o4.99g/l,用koh或者hcl调节ph至7.0;
所述tap固体培养基是向tap液体培养基中加入15g/l琼脂粉后灭菌倒平板制成;
所述含巴龙霉素的tap固体培养基(即tap+paro平板)是向tap液体培养基中加入15g/l琼脂粉后灭菌,冷却至55°c后添加终浓度为10μg/ml巴龙霉素倒平板制成。
进一步地,电击法是使用电击仪btxecm830,设置参数为500v、4ms、6波段,间隔时长100ms,进行电击。
进一步地,所述筛选基因片段aphviii是从大小为6.6kb的pjmg-aphviii质粒中,经过内切酶ecori酶切,回收获得的大小为2.2kb的抗巴龙霉素片段。
进一步地,步骤2中具体是将野生型莱茵衣藻21gr接种于tap液体培养基中,在22.5-23.5℃、8000lx光强下连续光照并通气培养3-4天,转接过程是使得藻液初始浓度为1×106个/ml,在上述下条件下吹气培养20h,终浓度达5×106个/ml进行转化。
进一步地,步骤3中培养是在22.5-23.5℃,按白天14h、夜晚10h的光周期,8000lx光强下倒置培养7-10天。
进一步地,步骤4中培养是在22.5-23.5℃,按白天14h、夜晚10h的光周期,8000lx光强条件下倒置培养3-5天。
进一步地,步骤5中培养是在tap液体培养基中,22.5-23.5℃,按白天14h、夜晚10h的光周期,8000lx光强条件下摇床培养。
有益效果:本发明利用方波电击法随机插入抗性基因获得大量稳定遗传的突变体,再用酶标仪检测细胞数量变化的速度,以此来筛选和鉴定衣藻细胞周期调控缺陷的突变体。方波电击法可以高效获得大量随机插入的转化子,可挑选出大量的细胞周期调控缺陷的突变体衣藻以供后续试验进行研究,通过实验验证了酶标仪测量衣藻细胞数量的可行性,酶标仪测量精确快捷,操作方法简单,耗时短等。
方波电击法能够进行莱茵衣藻高效建库,获得大量随机插入的转化子,酶标仪可准确快捷的测量衣藻细胞数量,可获得大量的细胞周期调控缺陷的突变体衣藻以供后续研究,操作方法简短,易于推广应用,具有良好的使用前景。
本发明所采用的方波电击法建库,酶标仪测定细胞数量未曾报道用于莱茵衣藻(chlamydomonasreinhardtii)的细胞周期调控缺陷的筛选与鉴定。
本发明能够方便、高效,可筛选获得大量衣藻细胞周期调控缺陷的突变体,为后续的进一步研究打下基础。
附图说明
图1是莱茵衣藻细胞浓度od434的标准曲线。
具体实施方式
本发明的筛选与鉴定的方法如下:莱茵衣藻21gr接种于tap液体培养基吹气瓶中,23±0.5℃,8000lx光强下连续光照并通气培养,经过转接与继续培养、处理后,采取电击法将筛选基因片段aphviii随机插入衣藻细胞基因组中,弱光低速恢复过夜后,涂布于tap+paro平板,经过7-10天光周期培养,获得随机插入的突变体文库,初筛根据突变体单克隆直径大小(挑选特别小的,与特别大的),复筛将上述疑似突变体培养至24孔板后,再利用酶标仪od434检测两个时间点的细胞浓度,从而计算24h与48h的吸光值比值(复制比),从而参照野生型复制比筛选和鉴定衣藻细胞周期调控缺陷的突变体。
由图1的标准曲线可知,衣藻细胞在1×106个/ml-4×107个/ml时,其线性效果好,因此在进行复制比计算时(24h,48h的od434),在此范围内进行读数与计算。
所述的衣藻即实验藻种为:莱茵衣藻,即chlamydomonasreinhardtii,野生型为21gr(cc1690),该实验品系可以从衣藻实验室馈赠或从美国衣藻资源中心(chlamydomonasresourcecenter)购买。
所述的tap液体培养基为:25ml/l的tap盐溶液(nh4cl15g/l,mgso4•7h2o4g/l,cacl2•2h2o2g/l),0.375ml/l的磷酸盐溶液(k2hpo4288g/l,kh2po4144g/l),1ml/l的hutner微量元素溶液(edta二钠盐50g/l,znso4•7h2o22g/l,h3bo311.4g/l,mncl2•4h2o5.06g/l,cocl•6h2o1.61g/l,cuso4•5h2o1.57g/l,(nh4)6mo7o24•4h2o1.1g/l,feso4•7h2o4.99g/l,用koh或者hcl调节ph至7.0),1ml/l的乙酸,2.42g/l的tris,121℃高压蒸汽灭菌20min,冷却备用;tap普通平板或者tap+paro平板(添加巴龙霉素,即paromomycin)为:上述液体tap培养基成分基础上,添加15g/l的琼脂粉,121℃高压蒸汽灭菌20min,倒平板备用,或者冷却至约55℃后再添加巴龙霉素(终浓度为10μg/ml)倒平板备用。
所述的电击转化方法是使用电击仪btxecm830,设置参数为500v、4ms、6波段,间隔时长100ms,进行电击。筛选基因片段aphviii是从pjmg-aphviii质粒(6.6kb大小)中,经过内切酶ecori酶切,回收获得的抗巴龙霉素片段(aphviii片段,2.2kb大小)。
所述培养条件为:电转培养初期野生型21gr接种于吹气瓶中,温度23±0.5℃,连续光照,8000lx光强下条件下吹气培养3-4天,转接过程是使得藻液初始浓度为1×106个/ml,在上述下条件下吹气培养20h,终浓度达5×106个/ml左右进行转化,转化后涂布的tap+paro筛选平板是在23±0.5℃、光周期(白天14h/夜晚10h)、8000lx光强下倒置培养7-10天,获得突变体文库单克隆藻。初筛的藻转涂于tap平板,在23±0.5℃、光周期(白天14h/夜晚10h)、8000lx光强条件下倒置培养3-5天,复筛是挑取适量藻置于24孔板的1.5ml液体tap中,温度23±0.5℃、光周期(白天14h/夜晚10h)、8000lx光强条件下摇床培养。
所述的酶标仪检测莱茵衣藻细胞浓度变化的方法是适量挑取初筛后的藻置于24孔板中的1.5ml液体tap培养基中进行摇床培养,野生型作对照,分别在培养24h与48h后观察藻液的颜色记录,并用酶标仪在波长434(od434)的条件下测量每个时间点每个孔藻液的吸光值,获取上述两个时间点吸光值的比值(我们称之为复制比),以野生型的复制比为标准,筛选获得在同样的时间段内其复制比明显低于或高于野生型的,即是要筛选的目标周期调控缺陷突变体。
以下实施例进一步说明本发明的内容,但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。实施例中未注明具体条件的实验方法及未说明配方的试剂均为按照本领域常规条件。
实施例1
a.配制tap液体培养基和含paro抗性的tap固体培养基平板,备用;b.挑取莱茵衣藻21gr于tap液体培养基中,在温度23±0.5℃、连续光照、8000lx光强的条件下进行吹气培养3-4天,培养衣藻细胞至浓度1-2×107个/ml,然后转接至另一tap液体培养基中,使得初始浓度为1×106个/ml,连续光照培养20h左右,终浓度一般可达5×106个/ml,即可进行转化;c.采用方波电击法(btxecm830,设置参数为500v、4ms、6波段,间隔时长100ms),向衣藻细胞中插入带有抗巴龙霉素的aphviii基因,造成随机位点突变,涂布于含有10μg/mltap+paro平板上,温度23±0.5℃、光周期(白天14h/夜晚10h)、8000lx光强下倒置培养7-10天;d.挑取直径异常小或者异常大的单克隆藻落转移至普通tap平板上,倒置培养3-5天;e.初筛后的突变体在平板上恢复生长后,挑取适量藻置于24孔板的tap液体培养基中进行摇床培养,野生型21gr为对照,分别在培养24h与48h后观察藻液的颜色记录,并用酶标仪在波长434(od434)的条件下测量每个时间点每个孔藻液的吸光值,获取上述两个时间点吸光值的比值(本发明称之为复制比),以野生型的复制比为标准,筛选获得在同样的时间段内其复制比明显低于或高于野生型的,即是要筛选的目标周期调控缺陷突变体。后续可进一步研究其突变基因及调控机制。
- 还没有人留言评论。精彩留言会获得点赞!