抑制人PCSK9基因表达的siRNA及其应用的制作方法
本发明属于生物医药领域,具体涉及一种抑制人蛋白转化酶枯草溶菌素9(pcsk9)基因表达的sirna及其在制备治疗pcsk9介导的相关疾病如高血脂症、动脉粥样硬化、心脑血管疾病、肥胖、糖尿病、肾病等病症药物中的应用。
背景技术:
高胆固醇血症可分为家族性和非家族性,临床表现为高血浆低密度脂蛋白胆固醇水平(lowdensitylipoproteincholesterol,ldl-c),是心血管类疾病发生的重要因素。目前临床上广泛应用的降血脂药物以他汀类为主,但相当一部分患者会对其产生耐受(eckel(2010)jclinendocrinolmetab95:2015-22),接受他汀类药物治疗后无法使ldl-c水平降低至期望值(toutouzasetal.(2010)expertopinpharmacother11:1659-72),因此研制新型降脂药物具有重要的临床应用价值。pcsk9是由肝脏合成与分泌的蛋白酶,在胆固醇代谢中具有重要作用,可影响肝脏低密度脂蛋白受体(lowdensitylipoproteinrecepter,ldlr)水平(fitzgeraldetal.(2014)thelancet383:60-68)。pcsk9分泌进入血液循环后可与肝细胞表面ldl-r的表皮生长因子样结构域特异性结合,介导其进入肝细胞到达溶酶体,使ldl-r在溶酶体中降解,从而导致肝细胞表面ldl-r减少,进而降低肝脏结合和清除ldl-c的能力,最终导致血液中ldl-c水平升高(zhangetal.(2008)procnatlacadsciusa105:13045-50)。因此,可通过抑制pcsk9治疗高胆固醇血症(norataetal.(2014)annurevpharmacoltoxicol54:273-93)。此外,pcsk9表达升高与肥胖及2型糖尿病密切相关(levensonetal.(2017)pediatrdiabetes18:755-60;yangetal.(2016)diabetesmetabresrev32:193-9),也与肾病综合症及蛋白尿等慢性肾病(pavlakouetal.(2017)inturolnephrol49:1015-24),因此,抑制pcsk9表达可成为预防和治疗这些相关性疾病的重要途径。
rna干扰(rnainterference,rnai)技术于1998年由fire等(fireetal.(1998)nature391:806-11)首次发现,随后迅速获得广泛应用。研究表明,在不同生物中均存在rna干扰现象(wilsonetal.(2013)annurevbiophys42:217-39)。rna干扰中引起基因沉默的双链rna为sirna,一般由一段长约21-23个核苷酸的双链rna组成,其序列中包括与靶mrna配对的正义链和反义链,从而诱发宿主细胞针对这些mrna的降解反应(singhetal.(2018)artifcellsnanomedbiotechnol46:274-83)。虽然sirna能特异性抑制靶基因表达,但细胞内的sirna很容易降解,难以实现稳定的基因沉默。慢病毒载体在细胞内感染效率高,免疫原型低,既能干扰分裂期的细胞又能感染非分裂期的细胞,且其介导的rnai能在各种动物细胞内长期稳定地表达sirna,抑制靶基因表达,因此具有高效、稳定、特异性强、适用范围广的特点。
目前已有多种rnai药物处于研发阶段或已获批上市,并显示出很好的治疗效果。例如,2018年8月10日,美国食品和药物管理局(fda)批准了第一个sirna药物onpattro(patisiran),用于治疗多发性神经病变的遗传性转甲状腺素蛋白淀粉样变性(hattr)(settenetal.(2019)natrevdrugdiscov18:421-46)。alnylam公司的aln-pc可抑制pcsk9的转录,且已进入i期临床试验(dellabadiaetal.(2016)pharmacolther164:183-94)。因此,利用rnai抑制特定疾病靶基因表达已成为一种有效的疾病治疗途径。
技术实现要素:
本发明的第一个目的在于提供一种有效抑制人pcsk9基因表达的sirna。
本发明的第二个目的在于提供一种由上述sirna序列构建而成的重组病毒表达载体。
本发明的第三个目的在于提供上述sirna、sirna修饰物及重组病毒在制备高血脂症、动脉粥样硬化、心脑血管疾病、糖尿病等与pcsk9相关病症药物中的应用。
为实现上述第一个目的,本发明的技术方案如下:采用生物信息学方法从genebank获取人、金黄地鼠及猴的pcsk9mrna序列(refseqid编号依次为nm_174936.3、xm_013114871.1和nm_001112660.1),用dnaman(v6)软件寻找mrna保守区序列。采用rnastructure分析软件对pcsk9mrna序列的二级结构进行预测,依据sirna设计原则,综合分析其gc含量、mrna作用位点的二级结构、sirna对碱基偏爱性的要求等。在sirna在线设计软件dsir设计基础上,进一步寻找合适的sirna靶序列,初步筛选出3对sirna序列。再用ncbigenebank提供的blast软件,选择转录本参考序列数据库(transcriptreferencesequences),对上述sirna序列进行同源分析,排除sirna非特异性抑制pcsk9以外其它基因的可能。
初步筛选出的3对sirna由上海吉玛制药技术有限公司合成,再通过体外细胞实验筛选出能有效抑制pcsk9基因表达的sirna即si1318,所述sirna序列为:
正义链:5’-gggacgaugccugccucuadtdt-3’(seqidno:3)
反义链:5’-uagaggcaggcaucgucccdtdt-3’(seqidno:4)
所述的抑制pcsk9基因表达的sirna序列3’端垂悬有dtdt。
为实现上述第二个目的,本发明采取的技术方案是:根据筛选的si1318序列,设计对应的带有环状结构的shdna序列(seqidno:7和seqidno:8),shdna序列框架中的loop结构选用ttcaagaga,shdna的转录终止序列采用tttttt结构。正义链模板的5’端添加了gatcc,反义链模板的5’端添加了aattc,分别与bamhi和ecori酶切后形成的粘端互补。
所述dna分子序列为:
正义链:
5’gatccgggacgatgcctgcctctattcaagagatagaggcaggcatcgtcccttttttg3’(seqidno:7)
反义链:
5’aattcaaaaaagggacgatgcctgcctctatctcttgaatagaggcaggcatcgtcccg3’(seqidno:8)
在此基础上,将上述序列插入慢病毒表达载体plvx-shrna2(clontech产品)的bamhi和ecori酶切位点从而构建出重组慢病毒表达载体,该重组表达载体含有人u6启动子。
将上所述重组慢病毒表达载体和病毒包装系统共转染病毒包装细胞。所述病毒包装系统包含有pspax2和pmd2.g质粒,所述病毒包装细胞为293t细胞。
为实现上述第三个目的,本发明采取的技术方案是:
通过转染人肝癌细胞hepg2和人正常肝细胞lo2体外实验证明,所述sirna可显著抑制人肝细胞pcsk9表达,上调肝细胞ldlr蛋白水平,并增强肝细胞摄取ldl-c的功能。同时,高胆固醇血症模型小鼠体内实验证明,根据基于所述sirna序列构建成的pcsk9shrna重组慢病毒,尾静脉给药后可显著降低高脂血症小鼠血浆ldl-c及tc的水平。
所述sirna、及其重组慢病毒在制备治疗高血脂症、动脉粥样硬化、心脑血管疾病、糖尿病等与pcsk9相关病症的药物中的应用。
本发明抑制pcsk9基因表达的sirna可以通过人工合成的方法制备。
本发明所述的抑制pcsk9基因表达的重组病毒表达载体为慢病毒表达载体或腺相关病毒表达载体。
有益效果:本发明提供了一种特异性抑制pcsk9基因表达的sirna,该sirna或根据其序列构建成的相应的重组病毒如慢病毒给药后可显著特异性抑制人肝脏细胞pcsk9的表达与分泌,上调肝细胞ldlr蛋白水平,并增强肝细胞摄取ldl-c的功能,体内实验进一步证明其显著降低高脂血症小鼠血浆ldl-c及tc的水平。所述sirna或其重组病毒可用于制备预防和/或治疗高血脂症、动脉粥样硬化、心脑血管疾病、糖尿病等与pcsk9相关病症的药物。
附图说明
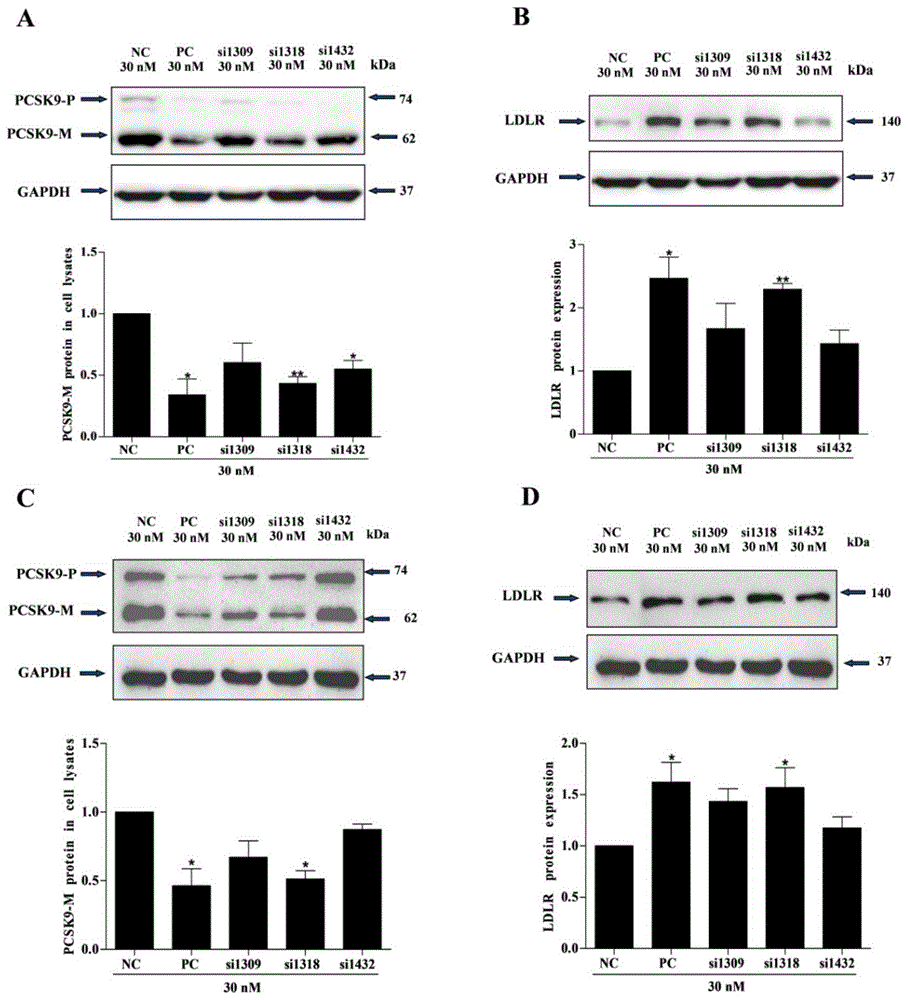
图1是westernblot检测30nmsi1309、si1318及si1432转染人肝癌细胞hepg2(图1a-b)及人正常肝细胞lo2(图1c-d)后抑制pcsk9表达及上调ldlr水平示意图;
图2是流式细胞术检测si1318(30nm)转染人肝癌细胞hepg2及人正常肝细胞lo2后上调细胞表面ldlr结果示意图;
图3是免疫荧光检测si1318(30nm)转染人肝癌细胞hepg2(图3a)及人正常肝细胞lo2(图3b)后抑制pcsk9对ldlr的降解结果示意图;
图4是si1318(30nm)转染人肝癌细胞hepg2(图4a)及人正常肝细胞lo2(图4b)后增强其dii-ldl摄取功能结果示意图;
图5是慢病毒shrna重组表达质粒示意图;
图6是westernblot检测慢病毒sh1318感染人肝癌细胞hepg2(图6a-b)及人正常肝细胞lo2(图6c-d)后显著沉默pcsk9基因表达并增加ldlr蛋白水平示意图;
图7是流式细胞术检测慢病毒lv-sh1318感染人肝癌细胞hepg2及人正常肝细胞lo2后增加细胞表面ldlr蛋白水平;
图8是免疫荧光检测慢病毒lv-sh1318感染人肝癌细胞hepg2(图8a)及人正常肝细胞lo2(图8b)后抑制pcsk9对ldlr的降解示意;
图9是慢病毒lv-sh1318感染人肝癌细胞hepg2(图9a)及人正常肝细胞lo2(图9b)后增强其dii-ldl摄取功能结果示意;
图10是高胆固醇血症模型小鼠尾静脉注射慢病毒lv-sh1318给药后显著降低血清总胆固醇和低密度脂蛋白胆固醇(图10a-b)结果示意;
图11是高胆固醇血症模型小鼠尾静脉注射慢病毒lv-sh1318给药后显著抑制小鼠肝脏pcsk9表达(图11a)并增加ldlr蛋白水平(图11b)结果示意。
具体实施方式
下面结合具体实施例进一步说明本发明。以下实施例中所用材料、试剂、仪器设备等,如无特殊说明,均可从商业途径获得,所有方法均为本领域中公知的常规方法。
实施例1靶向人pcsk9的sirna设计与合成
采用生物信息学方法从genebank获取人、金黄地鼠及猴的pcsk9mrna序列(refseqid编号依次为nm_174936.3、xm_013114871.1和nm_001112660.1),用dnaman(v6)软件寻找mrna的保守区序列。采用rnastructure分析软件对pcskmrna序列的二级结构进行预测,依据sirna设计原则,综合分析其gc含量、mrna作用位点的二级结构、sirna对碱基偏爱性的要求等。在sirna在线设计软件dsir设计基础上,进一步寻找合适的sirna靶序列,初步筛选出3对sirna序列。再用ncbigenebank提供的blast软件,选择转录本参考序列数据库(transcriptreferencesequences),对上述sirna序列进行同源分析,排除sirna非特异性抑制pcsk9以外其它基因的可能性。本发明设计的3对sirna序列分别为(由上海吉玛制药技术有限公司合成):
si1309:
正义链:5’-gcaacuuccgggacgaugcdtdt-3’(seqidno:1)
反义链:5’-gcaucgucccggaaguugcdtdt-3’(seqidno:2)
si1318:
正义链:5’-gggacgaugccugccucuadtdt-3’(seqidno:3)
反义链:5’-uagaggcaggcaucgucccdtdt-3’(seqidno:4)
si1432:
正义链:5’-gcuguguggaccucuuugcdtdt-3’(seqidno:5)
反义链:5’-gcaaagagguccacacagcdtdt-3’(seqidno:6)
实施例2westernblot检测靶向人pcsk9的sirna转染hepg2及lo2细胞对pcsk9及ldlr表达的影响
将hepg2及lo2细胞(均购自中国医学科学院基础医学研究所基础医学细胞中心)调按1×105个/孔接种于12孔板,1ml/孔,37℃培养12h后吸尽培养基,更换为500μl无血清、青霉素和链霉素的mem培养基。设置pcsk9sirna药物inclisiran的sirna序列为阳性对照(pc),另设空白对照组(nc)。用无血清opti-mem培养基分别稀释sirna(阴性对照nc、阳性对照pc、si1309、si1318、si1432)和脂质体lipofectaminetm3000(invitrogen公司),室温孵育5min后,再将sirna与脂质体混合,室温孵育15min后,逐滴加入孔板,每孔终体积600μl,sirna的作用浓度均为30nm,培养箱孵育4h后,每孔更换为600μl含10%胎牛血清、青霉素(100u/ml)和链霉素(100μg/ml)的mem培养基继续培养。转染48h后,更换为无血清opti-mem培养基培养。转染时间达到72h后,收集培养板中的细胞,分别取每孔转染细胞和培养基上清提取蛋白,westernblot检测pcsk9基因沉默效果。具体过程如下:取处理好的蛋白样品进行sds-page电泳,分离胶浓度为10%,4℃,100v恒压转印120min,将蛋白转印到pvdf膜(millipore公司产品);转印结束,将膜置于5%tbst(含有5%脱脂牛奶和0.1%吐温20的tbs)中室温封闭1h;用5%tbst按1∶2500稀释anti-pcsk9抗体(abcam公司,货号ab181142)和anti-ldlreceptor抗体(abcam公司,货号ab52818),4℃孵育过夜,tbst洗涤3遍,每次10min;用1%pbst(含有1%bsa和0.1%吐温20的pbs)按1∶3000稀释goatanti-rabbitigg二抗(福麦斯生物技术有限公司,货号fms-rb01),室温孵育1h,tbst洗涤3遍,每次10min;ecl显色,以各组目的蛋白条带灰度值计算沉默效率。结果(图1)显示,与阴性对照相比,si1309、si1318和si1432组pcsk9基因表达均有降低,但si1318下调pcsk9表达最为明显,且上调ldlr也最显著,因此,si1318即为筛选出的沉默pcsk9效率最高的sirna。
实施例3流式细胞术检测转染人pcsk9sirna对hepg2及lo2细胞表面ldlr表达的影响
按实施例2所述方法转染hepg2及lo2细胞,转染48h后,每孔更换为无血清opti-mem培养基培养。通过流式细胞仪检测ldlr水平。具体过程如下:用胰酶消化细胞并用pbs清洗,离心收集细胞。用80%甲醇固定5min,离心弃上清,加入封闭液(含有10%山羊血清、0.3m甘氨酸的pbs缓冲液)重悬沉淀,室温静置30min。离心弃上清,用含1%bsa的pbs按1﹕100稀释的anti-ldlrreceptor抗体(abcam公司,货号ab52818)重悬沉淀,室温静置60min;离心弃上清,用含1%bsa的pbs按1﹕300稀释的alexa
实施例4免疫荧光检测人pcsk9sirna体外沉默pcsk9及提升ldlr水平
将hepg2和lo2细胞调按1×105个/孔接种于共聚焦培养皿(nest公司,货号801002),1ml/孔,37℃培养12h后吸尽培养基,更换为900μl无血清、青霉素和链霉素的mem培养基。设置pcsk9sirna药物inclisiran的sirna序列为阳性对照(pc),另设空白对照组(nc)。用无血清opti-mem培养基分别稀释sirna(阴性对照nc、阳性对照pc、si1318)和脂质体lipofectaminetm3000(invitrogen公司产品),室温孵育5min后,再将sirna与脂质体混合,室温孵育15min后,逐滴加入孔板,每孔终体积1ml,sirna的作用浓度均为30nm。培养箱孵育4h后,hepg2及lo2细胞各孔分别更换为1ml含10%胎牛血清、青霉素(100u/ml)和链霉素(100μg/ml)的mem和dmem培养基继续培养。转染时间达到48h后,每孔更换为无血清opti-mem培养基培养。
转染时间达到72h后,通过免疫荧光检测pcsk9基因的沉默效果及ldlr提升水平。具体过程如下:弃上清,用pbs清洗残余培养基。每孔加入100μl4%多聚甲醛,室温固定30min。固定结束后,弃上清用pbs洗3次,每孔加入100μl0.2%的tritonx-100,对细胞进行通透20min。通透结束后,弃上清,用pbs洗3次,每孔加入100μl封闭液(含有2%bsa的pbs)室温封闭1h。封闭结束后,用一抗稀释液(1%bsa的pbs)分别按1∶100及1∶250稀释anti-pcsk9antibody抗体(abcam公司,货号ab181142)和anti-ldlrreceptor抗体(abcam公司,货号ab52818),4℃孵育过夜,pbs洗涤3遍,每次5min;用1%pbs(含有1%bsa的pbs)按1∶400稀释alexa
实施例5转染人pcsk9sirna增强肝细胞摄取dii-ldl的活性
将hepg2及lo2细胞调按1×104个/孔接种于96孔板,100μl/孔,37℃培养12h后吸尽培养基,更换为90μl无血清、青霉素和链霉素的mem培养基。设置pcsk9sirna药物inclisiran的sirna序列为阳性对照(pc),另设空白对照组(nc)。用无血清opti-mem培养基分别稀释sirna(阴性对照nc、阳性对照pc和si1318)和脂质体lipofectaminetm3000(invitrogen公司),室温孵育5min后,再将sirna与脂质体混合,室温孵育15min后,逐滴加入孔板,每孔终体积100μl,sirna的作用浓度均为30nm。37℃孵育4h后,hepg2与lo2细胞每孔分别更换为100μl含10%胎牛血清、青霉素(100u/ml)和链霉素(100μg/ml)的mem和dmem培养基继续培养。转染时间达到48h后,每孔更换为无血清opti-mem培养基培养。转染时间达到72h后,向各孔中加入终浓度为20μg/ml的dii-ldl试剂(广州奕元生物科技公司),37℃继续避光孵育4h后,吸取各孔培养基,用pbs清洗细胞两次后再加入100μlpbs,以不加dii-ldl试剂的细胞做为空白对照,采用varioskanflash全波长荧光酶标仪,以520nm为激发光波长、580nm为发射光波长,检测相对荧光单位值(relativefluorescenceunits,rfu),并进行数据统计,结果(图4)表明,靶向人pcsk9的si1318可以显著增强hepg2及lo2细胞摄取dii-ldl的功能。
实施例6靶向人pcsk9的shrna慢病毒载体构建
根据实施例2所筛选的si1318序列,设计与si1318对应的带有环状结构的dna序列(即对应sirna的shdna,其两条互补链中间由一个不能互补的5-8bp的单链连接,shrna由对应的dna序列转录形成,转录后的rna单链通过碱基互补及形成茎环结构,中间不互补的地方形成环,以此形成shrna)。
shrna模板序列:
正义链:
5’gatccgggacgatgcctgcctctattcaagagatagaggcaggcatcgtcccttttttg3’(seqidno:7)
反义链:
5’aattcaaaaaagggacgatgcctgcctctatctcttgaatagaggcaggcatcgtcccg3’(seqidno:8)
其中正向序列从5’至3’依次为bamhi酶切位点+靶序列+茎环结构+靶序列+rnapolyiii聚合酶转录终止位点+ecori酶切位点。
本发明所用的sirna重组慢病毒由本实验室构建,重组慢病毒图谱见图5。主要构建步骤如下:用bamhi和ecori双酶切慢病毒表达载体plvx-shrna2,电泳回收载体大片段。将上述shrna模板序列与载体大片段连接,得到重组穿梭质粒,测序正确后抽提阳性克隆质粒,用于制备慢病毒包装质粒。
实施例7靶向人pcsk9shrna慢病毒包装、浓缩及滴度测定
接种3×106个293t细胞于10cm培养皿,细胞密度为50-70%为宜。37℃培养24h后进行转染,即将12μgpcsk9shrna重组慢病毒质粒、9μgpspax和3μgpmd2.g辅助包装质粒混匀,按pei:包装质粒的质量比3:1加入转染试剂pei(1mg/ml),静置20min后将转染混合物加入到含有常规培养基的培养皿中,37℃培养,分别收集培养48h和72h的病毒上清,与5×peg8000以4:1比例混合,冰浴12h。4℃4000g离心30min,可见白色沉淀即为病毒颗粒,弃上清,加入适量pbs重悬,分装后保存于-70℃。
取一支分装保存的病毒采用荧光法测定滴度,测定前一天,将测定滴度所需的293t细胞铺板,96孔板,每孔加1×104个细胞,体积为100μl。根据病毒的预期滴度,准备7~10个无菌的eppendorf管,每管加入90μl无血清培养基。取10μl待测定病毒原液加入到第一个管中,混匀后再取10μl加入到第二个管中,继续相同操作进行梯度稀释。病毒稀释完成后,吸去各孔细胞培养基,加入含有稀释后病毒的细胞培养基,放入培养箱培养,24h后加入完全培养基100μl,3天后观察荧光表达情况,荧光细胞数随稀释倍数的增加而减少,根据各孔荧光细胞数确定计量孔,病毒滴度(tu/ml)=计量孔荧光细胞数×稀释倍数。
实施例8westernblot检测靶向人pcsk9的shrna转染hepg2及lo2细胞后对pcsk9表达及ldlr水平的影响
将人肝癌hepg2及lo2细胞调按1×105个/孔接种于12孔板,1ml/孔,37℃培养12h后,加入2×106单位(tu)的慢病毒shrna(lv-sh1318、阴性对照lv-shnc和阳性对照lv-shpc)进行感染,24h后hepg2及lo2细胞各孔培养基分别更换为1ml含10%胎牛血清、青霉素(100u/ml)和链霉素(100μg/ml)的mem和dmem继续培养。感染48h后,每孔培养基更换为无血清opti-mem培养。感染时间达到72h后,通过westernblot检测pcsk9基因的沉默效果。具体过程如下:收集培养板中的细胞,分别取每孔转染细胞和培养基上清提取蛋白。取处理好的蛋白样品进行10%sds-page电泳分离,并于4℃,100v恒压电转印120min,将蛋白转印到pvdf膜(millipore公司)。转印结束,将膜置于5%tbst(含有5%脱脂牛奶和0.1%吐温20的tbs)中室温封闭1h。用5%tbst按1∶2500稀释anti-pcsk9抗体(abcam公司,货号ab181142)和anti-ldlrreceptor抗体(abcam公司,货号ab52818),4℃过夜,tbst洗涤3遍,每次10min。用1%pbst(含有1%bsa和0.1%吐温20的pbs)按1∶3000稀释goatanti-rabbitigg二抗(福麦斯生物技术有限公司,货号fms-rb01),室温孵育1h,tbst洗涤3遍,每次10min。ecl显色,以各组目的蛋白条带灰度值计算沉默效率。结果表明,lv-sh1318可显著沉默hepg2及lo2细胞中pcsk9表达并提高ldlr蛋白水平(图6)。
实施例9流式细胞术检测靶向人pcsk9的shrna转染hepg2及lo2细胞后对细胞表面ldlr水平的影响
按实施例8将人肝癌hepg2及lo2细胞感染慢病毒shrna,慢病毒感染48h后,每孔更换为无血清opti-mem培养基培养。感染时间达到72h后,通过流式细胞仪检测ldlr提升水平。具体过程如下:用胰酶消化细胞并用pbs清洗,离心收集细胞;用80%甲醇固定5min,离心弃上清,沉淀加入封闭液(含有10%山羊血清、0.3m甘氨酸的pbs缓冲液)重悬,室温静置30min,离心弃上清,沉淀加入用含1%bsa的pbs按1﹕100稀释的anti-ldlrreceptor抗体(abcam公司,货号ab52818)重悬,室温静置60min。离心弃上清,沉淀加入用含1%bsa的pbs按1﹕300稀释的alexa
实施例10免疫荧光检测靶向人pcsk9的shrna转染hepg2及lo2细胞后对pcsk9表达及及ldlr水平的影响
按实施例8将人肝癌hepg2及lo2细胞转染慢病毒shrna,转染时间达到72h后,通过免疫荧光检测pcsk9基因的沉默效果及ldlr提升水平。具体过程如下:弃细胞培养液上清,pbs清洗后,每孔加入100μl4%多聚甲醛,室温固定30min。固定结束后,弃上清,pbs洗3次,每孔加入100μl0.2%的tritonx-100,对细胞进行通透20min。通透结束后,弃上清,pbs洗3次,每孔加入100μl封闭液(含有2%bsa的pbs)室温封闭1h。封闭结束后,用一抗稀释液(1%bsa的pbs)分别按1∶100及1∶250稀释anti-pcsk9antibody抗体(abcam公司,货号ab181142)和anti-ldlrreceptor抗体(abcam公司,货号ab52818),4℃孵育过夜,pbs洗涤3遍,每次5min。用含1%bsa的pbs按1∶400稀释alexa
实施例11靶向人pcsk9shrna增强肝细胞摄取dii-ldl的活性
将人肝癌hepg2及lo2细胞调按1×104个/孔接种于96孔板,100μl/孔,37℃培养12h后,加入2×105单位(tu)的慢病毒shrna(lv-sh1318、阴性对照lv-shnc和阳性对照lv-shpc)进行感染,24h后hepg2及lo2细胞各孔分别更换为100μl含10%胎牛血清、青霉素(100u/ml)和链霉素(100μg/ml)的mem和dmem培养基继续培养。慢病毒感染48h后,每孔更换为无血清opti-mem培养基培养。转染时间达到72h后,采用标记di-ldl法检测hepg2及lo2细胞表面的ldlr水平。具体过程如下:向各孔中加入终浓度为20μg/ml的dii-ldl试剂(广州奕元生物科技公司),37℃继续培养4h后,吸取各孔培养基,用pbs清洗细胞两次后再加入100μlpbs,以不加dii-ldl试剂的细胞做为空白对照。采用varioskanflash全波长荧光酶标仪,以520nm为激发光波长、580nm为发射光波长,检测细胞荧光值。结果(图9)显示,lv-sh1318可显著增强肝细胞摄取dii-ldl的功能。
实施例12靶向人pcsk9shrna的体内生物学活性评价
按文献(genetherapy,1999,6(7):1258-1266)所述方法造模,5s内尾静脉注射人pcsk9表达质粒ptt5-hpcsk9(50μg于2ml生理盐水中),使人pcsk9在c57bl/6小鼠体内过表达,建立pcsk9过表达引起的高胆固醇血症小鼠模型。具体地,30只c57/bl6小鼠随机分为5组,每组6只,其中模型组在小鼠尾静脉以流体动力注射法注射50μgptt5-hpcsk9(于2ml生理盐水中),阴性对照组(lv-shnc)、阳性对照组(lv-shpc)和实验组(lv-sh1318)每只注射50μgptt5-pcsk9和5×107tu慢病毒混合物2ml,空白对照组注射2ml生理盐水。各组均为单次给药。各组小鼠予以普通饮食,自由饮水,给药1周后处死动物,收集血液及肝脏等组织标本。采用试剂盒(南京建成生物产品)检测小鼠血清总胆固醇、低密度脂蛋白胆固醇水平,并进行统计分析。结果如图10所示,与阴性对照组相比,经lv-sh1318干预后小鼠血清总胆固醇(tc)和低密度脂蛋白胆固醇(ldl-c)水平明显下降。
此外,取小鼠肝脏组织,研磨破碎提取肝脏细胞蛋白,利用抗人pcsk9和抗小鼠ldlr抗体(均为abcam公司产品)进行westernblot,检测肝细胞pcsk9和ldlr蛋白水平。结果表明,lv-sh1318可显著降低小鼠肝脏中人pcsk9基因表达并提升ldlr的表达水平(图11)。
序列表
<110>中国药科大学
<120>抑制人pcsk9基因表达的sirna及其应用
<160>8
<170>siposequencelisting1.0
<210>1
<211>19
<212>rna
<213>人工序列(artificialsequence)
<400>1
gcaacuuccgggacgaugc19
<210>2
<211>19
<212>rna
<213>人工序列(artificialsequence)
<400>2
gcaucgucccggaaguugc19
<210>3
<211>19
<212>rna
<213>人工序列(artificialsequence)
<400>3
gggacgaugccugccucua19
<210>4
<211>19
<212>rna
<213>人工序列(artificialsequence)
<400>4
uagaggcaggcaucguccc19
<210>5
<211>19
<212>rna
<213>人工序列(artificialsequence)
<400>5
gcuguguggaccucuuugc19
<210>6
<211>19
<212>rna
<213>人工序列(artificialsequence)
<400>6
gcaaagagguccacacagc19
<210>7
<211>59
<212>dna
<213>人工序列(artificialsequence)
<400>7
gatccgggacgatgcctgcctctattcaagagatagaggcaggcatcgtcccttttttg59
<210>8
<211>59
<212>dna
<213>人工序列(artificialsequence)
<400>8
aattcaaaaaagggacgatgcctgcctctatctcttgaatagaggcaggcatcgtcccg59
- 还没有人留言评论。精彩留言会获得点赞!
- 大豆低温诱导人工合成启动子SP5及应用的制造方法与工艺
- 一种棒状杆菌组成型表达载体启动子、含有该启动子及gnd基因的表达载体的制造方法与工艺
- 一种棒状杆菌组成型表达载体启动子、含有该启动子及lrp基因的表达载体的制造方法与工艺
- 一种二值卷积神经网络处理器及其使用方法与流程
- 检测NUP214‑ABL1基因相对表达量的试剂盒和方法与流程
- 环介导的级联放大策略用于高灵敏检测DNA甲基转移酶活性的制造方法与工艺
- 一种基于高压静电场来促进作物优质高效安全生产的嫁接方法与流程
- 一种酶性DNA机器用于miRNA检测的方法与流程
- 转基因玉米MON87403品系特异性实时荧光PCR检测引物、探针、方法和试剂盒与流程
- 葡萄早熟基因VvWRKY13在调控植物中乙烯生物合成中的应用的制造方法与工艺