基于杂交链式反应的荧光DNA传感器及E542K基因检测方法与流程
本发明涉及化学与生物传感技术领域,特别是涉及基于杂交链式反应的荧光dna传感器及e542k基因检测方法。
背景技术:
循环肿瘤dna是一类重要的肿瘤标志物,能够实时反映肿瘤的动态变化,因此在多种肿瘤的早期诊断、实时监控、预后评估等方面体现出重要的临床价值。pik3ca基因是一种重要的循环肿瘤dna,可以编码蛋白质,调控细胞增殖、分化等一系列细胞活动,其中,e542k基因是野生型pik3ca基因热点突变区域的一种突变型基因,在乳腺癌、结肠癌和肺癌中均有该基因的突变,可作为肿瘤标志物用于临床上的辅助诊断。
循环肿瘤dna的检测方法主要有数字pcr、beaming及ngs等,但是这些方法具有操作复杂、价格昂贵、耗时耗力、实验条件苛刻等缺点。近年来,随着检测技术的不断提高,循环肿瘤dna的检测出现了电化学检测、表面增强拉曼散射检测等方法,但这些方法都存在检测信号不稳定的问题,使得这些方法在实际应用中受到制约。
技术实现要素:
基于此,为了克服上述问题,提供一种基于杂交链式反应的荧光dna传感器及e542k基因检测方法,其中,e542k基因既是靶标分子又是所述引发链,能够激活杂交链式反应,提高检测的灵敏度与选择性,并利用反应前后荧光强度的变化实现e542k基因的定量检测。
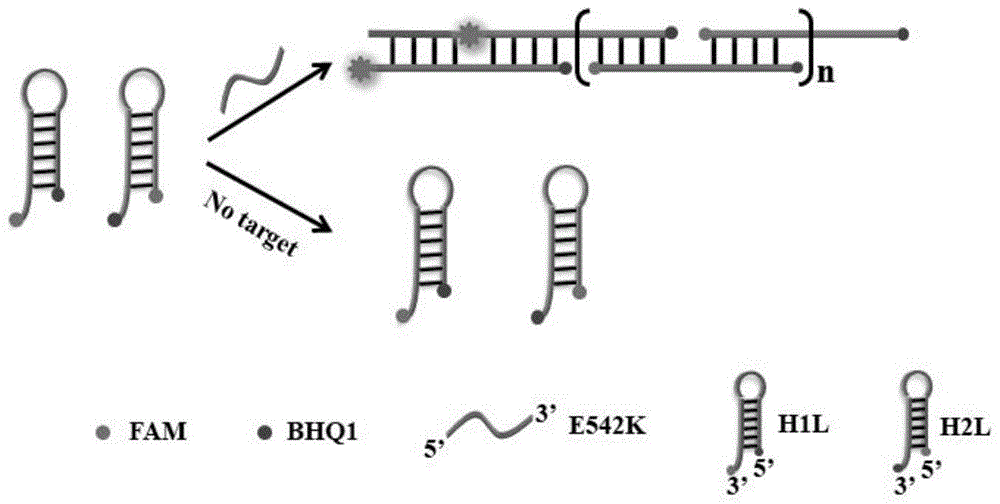
一种基于杂交链式反应的荧光dna传感器,包括引发链、第一发夹探针及第二发夹探针,所述第一发夹探针的两端分别标记有荧光基团及相应的荧光猝灭基团,所述第二发夹探针的两端分别标记有荧光基团及相应的荧光猝灭基团,所述引发链为e542k基因,所述引发链可与所述第一发夹探针结合,打开所述第一发夹探针的发夹结构,使所述第一发夹探针与所述第二发夹探针结合,激活杂交链式反应,形成长双链dna,使所述长双链dna荧光增强,从而定量检测所述e542k基因。
进一步地,所述荧光基团为6-羧基荧光素(fam),所述荧光猝灭基团为黑洞猝灭基团(bhq1)。
进一步地,所述第一发夹探针包括特异性识别e542k基因的碱基序列,所述第一发夹探针的碱基序列为5’-bhq1-aaaatcactaagcaggcaaagtcctgcttagtgattttagagag-fam-3’。
进一步地,所述第二发夹探针包括与所述第一发夹探针互补的碱基序列,所述第二发夹探针的碱基序列为5’-fam-actttgcctgcttagtgattttctctctaaaatcactaagcagg-bhq1-3’。
一种所述的基于杂交链式反应的荧光dna传感器的e542k基因检测方法,包括以下步骤:
s1、e542k基因、第一发夹探针与第二发夹探针首次开盖使用前先离心,分别将其溶于二次水中配成100μm的母液,再用缓冲液稀释成e542k基因溶液、第一发夹探针溶液和第二发夹探针溶液,4℃保存待用;
s2、将第一发夹探针溶液与第二发夹探针溶液分别加热并冷却至室温备用;
s3、将所述步骤s2中加热后的第一发夹探针溶液、第二发夹探针溶液与不同浓度的e542k基因溶液在缓冲液中混合反应,得到反应液,检测荧光信号强度。
进一步地,所述缓冲液为spsc缓冲液,ph为7.4。
进一步地,在所述步骤s2中,加热反应温度为85℃~95℃,加热反应时间为5分钟~15分钟。
进一步地,在所述步骤s3中,所述e542k基因溶液的浓度为10nm~1000nm,所述第一发夹探针溶液的浓度为1nm~1000nm,所述第二发夹探针溶液的浓度为1nm~1000nm。
进一步地,在所述步骤s3中,混合反应温度为25℃~45℃,混合反应时间为3小时~7小时。
本发明所提供的基于杂交链式反应的荧光dna传感器中,e542k基因既是靶标分子又是杂交链式反应的引发链。当e542k基因不存在时,第一发夹探针与第二发夹探针都是发夹结构,标记在两端的荧光基团与荧光猝灭基团相互靠近,发生荧光共振能量转移,荧光猝灭。当e542k基因存在时,e542k基因能够与第一发夹探针特异性结合,打开第一发夹探针的发夹结构,使得第一发夹探针产生构象变化,从而第一发夹探针与第二发夹探针结合,激活杂交链式反应,形成长双链dna,从而荧光强度增加,进而实现了e542k基因的定量检测,提高了e542k基因检测的灵敏度与选择性,具有简单、快速、高效的优势。
而且,本发明所提供的基于杂交链式反应的荧光dna传感器的e542k基因检测方法具有操作简便、信号稳定、显著降低检测成本的优势,使得该检测方法具有很广阔的应用前景。
附图说明
图1为本发明基于杂交链式反应的荧光dna传感器的e542k基因检测方法的原理示意图;
图2为本发明实施例1中基于杂交链式反应的荧光dna传感器的琼脂糖凝胶电泳图;
图3为本发明实施例2中基于杂交链式反应的荧光dna传感器处于不同条件下的荧光光谱图;
图4为本发明实施例3中基于杂交链式反应的荧光dna传感器对不同浓度的e542k基因检测的荧光光谱图;
图5为本发明实施例3中基于杂交链式反应的荧光dna传感器中e542k基因的浓度与相对荧光强度的关系图;
图6为本发明实施例4中基于杂交链式反应的荧光dna传感器对e542k基因检测的选择性分析。
具体实施方式
以下将对本发明提供的基于杂交链式反应的荧光dna传感器及e542k基因检测方法作进一步说明。
本发明所提供的基于杂交链式反应的荧光dna传感器,包括引发链、第一发夹探针及第二发夹探针,所述第一发夹探针的两端分别标记有荧光基团及相应的荧光猝灭基团,所述第二发夹探针的两端分别标记有荧光基团及相应的荧光猝灭基团,所述引发链为e542k基因,所述引发链可与所述第一发夹探针结合,打开所述第一发夹探针的发夹结构,使所述第一发夹探针与所述第二发夹探针结合,激活杂交链式反应,形成长双链dna,使所述长双链dna荧光增强,从而定量检测所述e542k基因。
具体的,所述荧光dna传感器利用e542k基因作为引发链,能够与所述第一发夹探针特异性结合,使得所述第一发夹探针产生构象变化,打开发夹结构,与所述第二发夹探针杂交组装,激活杂交链式反应,形成长双链dna,从而放大反应检测信号,提高了检测的选择性与灵敏度,有利于实际样品中的e542k基因检测,进而有助于肿瘤的动态监控。因此,所述荧光dna传感器具有简单、快速、高效的优势,应用前景广阔。
发夹探针包括修饰有荧光基团与猝灭基团的第一发夹探针(h1l)、修饰有荧光基团与猝灭基团的第二发夹探针(h2l)及未标记荧光基团与猝灭基团的第一发夹探针(h1)、未标记荧光基团与猝灭基团的第二发夹探针(h2)。所述杂交链式反应激活,所述第一发夹探针h1l与所述第二发夹探针h2l链末端修饰的荧光基团与荧光猝灭基团之间能够发生荧光共振能量转移,使得双链dna两端的荧光增强,分子内部间的荧光猝灭,从而能够利用荧光信号强度变化实现e542k基因的定量检测。
进一步地,考虑到荧光信号强度,所述荧光基团选择6-羧基荧光素(fam),所述荧光猝灭基团为黑洞猝灭基团(bhq1)。所述荧光基团以及相应的所述荧光猝灭基团没有具体的限制,两个基团之间能够实现荧光共振能量转移即可,从而有效地实现荧光猝灭及荧光激发。
进一步地,考虑到靶标的特异性识别,所述第一发夹探针包括特异性识别e542k基因的碱基序列,所述第一发夹探针的碱基序列为5’-bhq1-aaaatcactaagcaggcaaagtcctgcttagtgattttagagag-fam-3’。为了提高第一发夹探针的稳定性,所述第一发夹探针还包括稳定发夹结构的碱基序列,使得所述第一发夹探针能够稳定存在于溶液中。
进一步地,所述第二发夹探针包括与所述第一发夹探针互补的碱基序列,所述第二发夹探针的碱基序列为5’-fam-actttgcctgcttagtgattttctctctaaaatcactaagcagg-bhq1-3’,能够与所述第一发夹探针杂交组装,从而激活杂交链式反应,形成长双链dna,并根据荧光共振能量转移原理,产生荧光信号强度变化。其中,所述第二发夹探针还包括稳定发夹结构的碱基序列,能够提高所述第二发夹探针的稳定性。
本发明还提供了所述的基于杂交链式反应的荧光dna传感器的e542k基因检测方法,包括以下步骤:
s1、e542k基因、第一发夹探针与第二发夹探针首次开盖使用前先离心,分别将其溶于二次水中配成100μm的母液,再用缓冲液稀释成e542k基因溶液、第一发夹探针溶液和第二发夹探针溶液,4℃保存待用;
s2、将第一发夹探针溶液与第二发夹探针溶液分别加热并冷却至室温备用;
s3、将所述步骤s2中加热后的第一发夹探针溶液、第二发夹探针溶液与不同浓度的e542k基因溶液在缓冲液中混合反应,得到反应液,检测荧光信号强度。
具体的,考虑到核酸易受到核酸酶作用而降解,以及杂交链式反应扩增效率,所述缓冲液为spsc缓冲液,所述spsc缓冲液的ph为7.4,使所述e542k基因、所述第一发夹探针与所述第二发夹探针能够保持较稳定的发夹结构,从而实现杂交链式反应。
在所述步骤s2中,为了使核酸充分形成发夹结构,核酸探针需要经过高温过程,即加热反应温度为85℃~95℃,加热反应时间为5分钟~15分钟,使得dna变性,从而形成二聚体的dna解链形成单链,在缓慢退火降温的复性过程中,核酸探针能够充分形成稳定的发夹结构,有利于后续的杂交链式反应。优选的,反应温度为90℃,反应时间为10分钟。
在所述步骤s3中,为了提高杂交链式反应的扩增效率,所述e542k基因溶液的浓度为10nm~1000nm,所述第一发夹探针溶液为1nm~1000nm,所述第二发夹探针溶液为1nm~1000nm。优选的,所述第一发夹探针溶液为50nm,所述第二发夹探针溶液为50nm。
当反应温度过高时,dna双链之间的氢键不稳定,导致dna解链,降低扩增效率。当反应时间过短,则核酸探针之间的反应不完全。因此,考虑到反应温度以及反应时间对杂交链式反应的影响,所述混合反应温度为25℃~45℃之间,优选为37℃,所述混合反应时间为3小时~7小时,优选为5小时。
本发明所提供的基于杂交链式反应的荧光dna传感器的e542k基因检测方法中,e542k基因既是目标分析物,又是杂交链式反应的引发链,具有操作简便、显著降低检测成本、缩短检测时间的优势,而且无需辅助酶,就能够实现荧光信号放大,从而提高实际样品中e542k基因检测的选择性与灵敏度。
以下,将通过具体实施例对所述基于杂交链式反应的荧光dna传感器及e542k基因检测方法做进一步的说明。
如图1所示,基于杂交链式反应的荧光dna传感器的e542k基因检测方法的原理示意图。
实施例中,各dna序列如下:
表1本实验所用的dna序列
实施例1
e542k基因、第一发夹探针与第二发夹探针首次开盖使用前先10000rpm离心,4℃离心30秒,分别将其溶于二次水中配成100μm的母液,再用spsc缓冲液稀释,4℃保存待用;将第一发夹探针溶液10μm与第二发夹探针溶液10μm分别加热到90℃,反应10分钟,并冷却至室温备用。
其中,在图2条带1中,离心管中加入1μme542k基因于ph为7.4的spsc缓冲液中,37℃反应5小时。
在图2条带2中,离心管中加入1μm无标记的第一发夹探针溶液h1于ph为7.4的spsc缓冲液中,37℃反应5小时。
在图2条带3中,离心管中加入1μm无标记的第二发夹探针溶液h2于ph为7.4的spsc缓冲液中,37℃反应5小时。
在图2条带4中,离心管中加入1μm无标记第一发夹探针溶液h1与1μm无标记第二发夹探针溶液h2于ph为7.4的spsc缓冲液中,37℃反应5小时。
在图2条带5中,离心管中加入0.1μme542k基因、1μm无标记第一发夹探针溶液h1与1μm无标记第二发夹探针溶液h2于ph为7.4的spsc缓冲液中,37℃反应5小时。
在图2条带6中,离心管中加入0.4μme542k基因、1μm无标记第一发夹探针溶液h1与1μm无标记第二发夹探针溶液h2于ph为7.4的spsc缓冲液中,37℃反应5小时。
在图2条带7中,离心管中加入0.8μme542k基因、1μm无标记第一发夹探针溶液h1与1μm无标记第二发夹探针溶液h2于ph为7.4的spsc缓冲液中,37℃反应5小时。
在图2条带8中,离心管中加入1μme542k基因、1μm无标记第一发夹探针溶液h1与1μm无标记第二发夹探针溶液h2于ph为7.4的spsc缓冲液中,37℃反应5小时。
在图2条带m中,100bp分子量的dnamarker。
通过图2的琼脂糖凝胶电泳图,可以得出,所述e542k基因不存在时,所述无标记第一发夹探针h1与所述无标记第二发夹探针h2保持稳定的发夹结构,保持闭合状态,未发生杂交链式反应,两个无标记发夹探针稳定地存在于溶液中。所述e542k基因存在时,两个无标记发夹探针杂交组装,激活杂交链式反应,聚合形成了大分子dna双链。
实施例2
e542k基因、第一发夹探针与第二发夹探针首次开盖使用前先10000rpm离心,4℃离心30秒,分别将其溶于二次水中配成100μm的母液,再用spsc缓冲液稀释,4℃保存待用;将0.5μm第一发夹探针溶液与0.5μm第二发夹探针溶液分别加热到90℃,反应10分钟,并冷却至室温备用。
其中,在图3(a)中,离心管中加入100nme542k基因在ph为7.4的spsc缓冲液中,37℃反应5小时,得到反应液,检测荧光信号强度。
在图3(b)中,离心管中加入50nm第一发夹探针溶液h1l在ph为7.4的spsc缓冲液中,37℃反应5小时,得到反应液,检测荧光信号强度。
在图3(c)中,离心管中加入50nm第二发夹探针溶液h2l在ph为7.4的spsc缓冲液中,37℃反应5小时,得到反应液,检测荧光信号强度。
在图3(d)中,离心管中加入50nm第一发夹探针溶液h1l与50nm第二发夹探针溶液h2l在ph为7.4的spsc缓冲液中,37℃反应5小时,得到反应液,检测荧光信号强度。
在图3(e)中,离心管中加入100nme542k基因,50nm第一发夹探针溶液h1l与50nm第二发夹探针溶液h2l在ph为7.4的spsc缓冲液中,37℃反应5小时,得到反应液,检测荧光信号强度。
在图3(f)中,离心管中加入500nme542k基因,50nm第一发夹探针溶液h1l与50nm第二发夹探针溶液h2l在ph为7.4的spsc缓冲液中,37℃反应5小时,得到反应液,检测荧光信号强度。
通过图3的荧光光谱图,可以得出,当e542k基因分子不存在时,所述第一发夹探针h1l与所述第二发夹探针h2l保持稳定的发夹结构,发生荧光共振能量转移,荧光猝灭,因此,反应液仅有较弱的荧光信号强度。然而,当e542k基因分子存在时,随着所述e542k基因浓度的增加,荧光信号强度显著增强。
实施例3
e542k基因、第一发夹探针与第二发夹探针首次开盖使用前先10000rpm离心,4℃离心30秒,分别将其溶于二次水中配成100μm的母液,再用spsc缓冲液稀释,4℃保存待用;将0.5μm第一发夹探针溶液与0.5μm第二发夹探针溶液分别加热到90℃,反应10分钟,并冷却至室温备用。
在图4(a)中,离心管中加入50nm第一发夹探针溶液h1l与50nm第二发夹探针溶液h2l在ph为7.4的spsc缓冲液中,37℃反应5小时,得到反应液,检测荧光信号强度。
在图4(b)中,离心管中加入5nme542k基因、50nm第一发夹探针溶液h1l与50nm第二发夹探针溶液h2l在ph为7.4的spsc缓冲液中,37℃反应5小时,得到反应液,检测荧光信号强度。
在图4(c)中,离心管中加入10nme542k基因、50nm第一发夹探针溶液h1l与50nm第二发夹探针溶液h2l在ph为7.4的spsc缓冲液中,37℃反应5小时,得到反应液,检测荧光信号强度。
在图4(d)中,离心管中加入15nme542k基因、50nm第一发夹探针溶液h1l与50nm第二发夹探针溶液h2l在ph为7.4的spsc缓冲液中,37℃反应5小时,得到反应液,检测荧光信号强度。
在图4(e)中,离心管中加入20nme542k基因、50nm第一发夹探针溶液h1l与50nm第二发夹探针溶液h2l在ph为7.4的spsc缓冲液中,37℃反应5小时,得到反应液,检测荧光信号强度。
在图4(f)中,离心管中加入30nme542k基因、50nm第一发夹探针溶液h1l与50nm第二发夹探针溶液h2l在ph为7.4的spsc缓冲液中,37℃反应5小时,得到反应液,检测荧光信号强度。
在图4(g)中,离心管中加入40nme542k基因、50nm第一发夹探针溶液h1l与50nm第二发夹探针溶液h2l在ph为7.4的spsc缓冲液中,37℃反应5小时,得到反应液,检测荧光信号强度。
在图4(h)中,离心管中加入60nme542k基因、50nm第一发夹探针溶液h1l与50nm第二发夹探针溶液h2l在ph为7.4的spsc缓冲液中,37℃反应5小时,得到反应液,检测荧光信号强度。
在图4(i)中,离心管中加入80nme542k基因、50nm第一发夹探针溶液h1l与50nm第二发夹探针溶液h2l在ph为7.4的spsc缓冲液中,37℃反应5小时,得到反应液,检测荧光信号强度。
在图4(j)中,离心管中加入100nme542k基因、50nm第一发夹探针溶液h1l与50nm第二发夹探针溶液h2l在ph为7.4的spsc缓冲液中,37℃反应5小时,得到反应液,检测荧光信号强度。
在图4(k)中,离心管中加入200nme542k基因、50nm第一发夹探针溶液h1l与50nm第二发夹探针溶液h2l在ph为7.4的spsc缓冲液中,37℃反应5小时,得到反应液,检测荧光信号强度。
在图4(l)中,离心管中加入400nme542k基因、50nm第一发夹探针溶液h1l与50nm第二发夹探针溶液h2l在ph为7.4的spsc缓冲液中,37℃反应5小时,得到反应液,检测荧光信号强度。
通过图4的荧光光谱图,可以得出,随着所述e542k基因浓度的增加,荧光信号强度显著增强。
在本实施例中,从图5可以得出,在5nm~100nm浓度范围内,e542k基因的浓度与相对荧光强度变化呈现良好的线性关系,线性相关系数为r2=0.99052,检出限为2nm,其中f和f0分别为e542k基因存在与不存在时的荧光强度,因此,所述基于杂交链式反应的荧光dna传感器具有较高的灵敏度。
实施例4
e542k基因、第一发夹探针与第二发夹探针首次开盖使用前先10000rpm离心,4℃离心30秒,分别将其溶于二次水中配成100μm的母液,再用spsc缓冲液稀释,4℃保存待用;将0.5μm第一发夹探针溶液与0.5μm第二发夹探针溶液分别加热到90℃,反应10分钟,并冷却至室温备用。
在图6(a)中,离心管中加入50nm第一发夹探针溶液h1l与50nm第二发夹探针溶液h2l在ph为7.4的spsc缓冲液中,37℃反应5小时,得到反应液,检测荧光信号强度。
在图6(b)中,离心管中加入100nme542k基因、50nm第一发夹探针溶液h1l与50nm第二发夹探针溶液h2l在ph为7.4的spsc缓冲液中,37℃反应5小时,得到反应液,检测荧光信号强度。
在图6(c)中,离心管中加入100nm单碱基错配dna(1mtdna)、50nm第一发夹探针溶液h1l与50nm第二发夹探针溶液h2l在ph为7.4的spsc缓冲液中,37℃反应5小时,得到反应液,检测荧光信号强度。
在图6(d)中,离心管中加入100nm双碱基错配dna(2mtdna)、50nm第一发夹探针溶液h1l与50nm第二发夹探针溶液h2l在ph为7.4的spsc缓冲液中,37℃反应5小时,得到反应液,检测荧光信号强度。
在图6(e)中,离心管中加入100nm四碱基错配dna(4mtdna)、50nm第一发夹探针溶液h1l与50nm第二发夹探针溶液h2l在ph为7.4的spsc缓冲液中,37℃反应5小时,得到反应液,检测荧光信号强度。
在图6(f)中,离心管中加入100nm完全错配dna(ncdna)、50nm第一发夹探针溶液h1l与50nm第二发夹探针溶液h2l在ph为7.4的spsc缓冲液中,37℃反应5小时,得到反应液,检测荧光信号强度。
从图6可知,e542k基因能够引发杂交链式反应,从而具有较强的荧光信号强度,而单碱基错配dna、双碱基错配dna、四碱基错配dna和完全错配dna及背景仅有较弱的荧光信号强度,因此,所述基于杂交链式反应的荧光dna传感器对e542k基因具有较高的选择性,能够区分单碱基错配序列。
实施例5
为了评估该荧光dna传感器在实样检测中的分析应用能力,测定了不同浓度的e542k基因在稀释的人血清样本中的回收率。实验结果如表2所示,所述基于杂交链式反应的荧光dna传感器对e542k基因的加标回收率在95.52%到104.80%之间,满足实验要求,因而该荧光dna传感器能够在复杂生物样品中定量检测e542k基因,具有临床应用前景。
表2血清中e542k基因的检测
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!